浙教版科学八下第2章微粒的模型与符号综合复习(二)(含答案)
文档属性
| 名称 | 浙教版科学八下第2章微粒的模型与符号综合复习(二)(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-06-13 10:42:46 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
浙教版科学八下第2章微粒的模型与符号(一)(含答案)
一、选择题
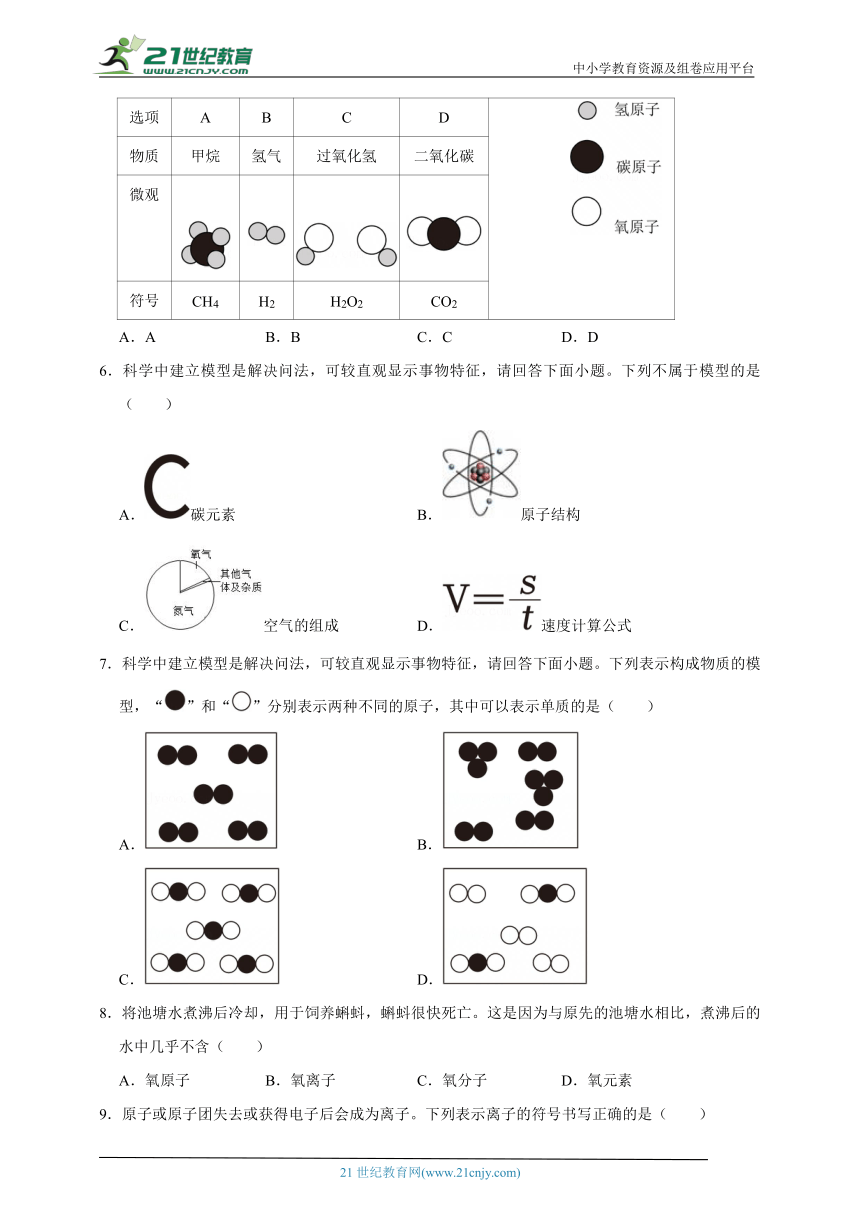
1.下列图示微粒中属于化合物的是( )
A.A B.B C.C D.D
2.钨酸钠(Na2WO4)是一种白色粉末,可作为添加剂用于航空器涂层或航天材料的制造,提升耐高温与防腐性能。钨酸钠中钠元素的化合价是+1价,氧元素的化合价为﹣2价,则钨酸钠中钨元素的化合价为( )
A.+2 B.+4 C.+6 D.+8
3.如图是砹元素的信息,下列有关砹的说法不正确的是( )
A.元素符号是At B.原子质量是210克
C.质子数是85 D.元素名称是砹
4.C﹣14除了可以在考古中测定年代,还可以检测幽门螺杆菌。碳﹣14是碳﹣12的一种同位素,下列关于同位素的说法不正确的是( )
A.碳﹣14的核电荷数是6
B.碳﹣14和碳﹣12的主要区别是中子数不同
C.碳﹣14和碳﹣12在元素周期表中位于相同的位置
D.碳﹣14和碳﹣12的化学性质不同,所以碳﹣14能测年代而碳﹣12不能
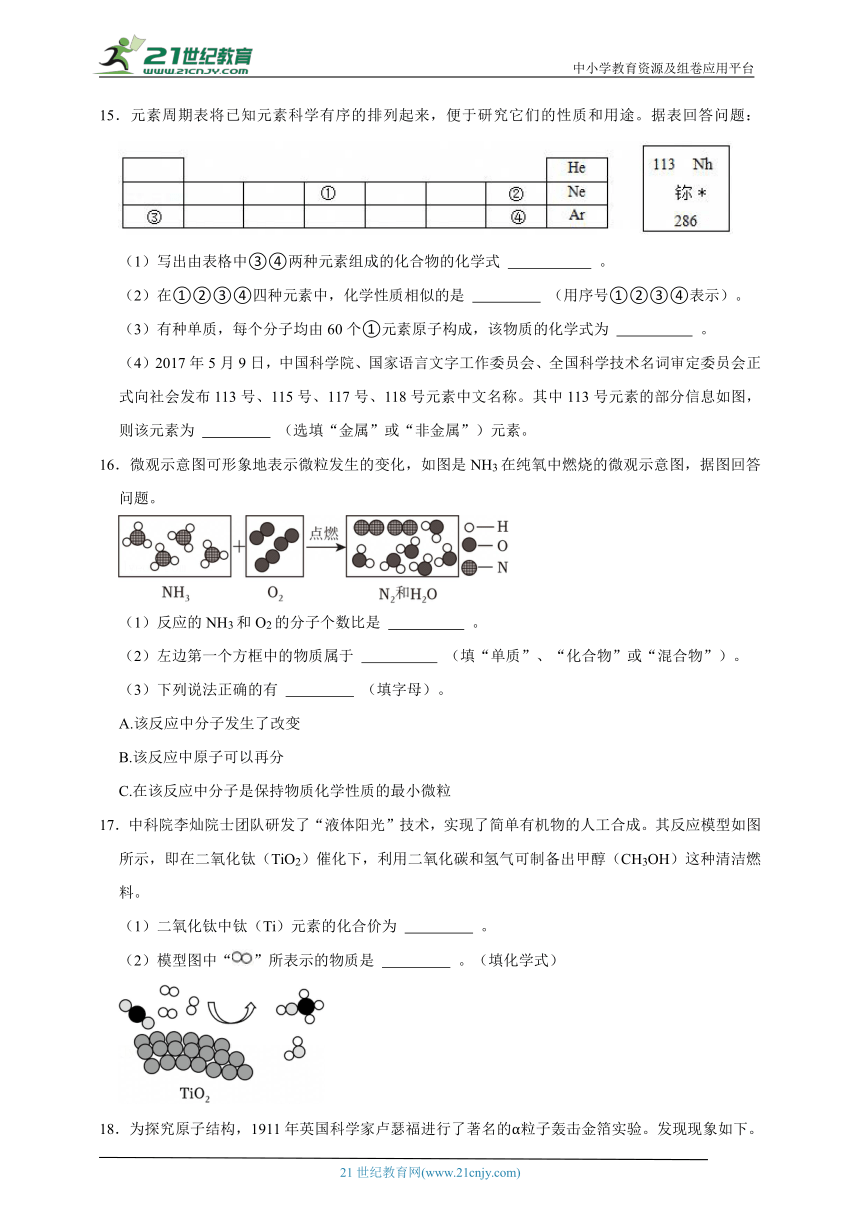
5.对物质进行“宏观“微观﹣符号”表征以及建立三者联系,能帮助我们更好地认识物质的本质,也是化学学科独特的思维方式。如图为小实整理的水的思维导图,请完成下面小题。
下列常见物质中,“宏观﹣微观﹣符号”三者之间的联系没有一一对应的是( )
选项 A B C D
物质 甲烷 氢气 过氧化氢 二氧化碳
微观
符号 CH4 H2 H2O2 CO2
A.A B.B C.C D.D
6.科学中建立模型是解决问法,可较直观显示事物特征,请回答下面小题。下列不属于模型的是( )
A.碳元素 B.原子结构
C.空气的组成 D.速度计算公式
7.科学中建立模型是解决问法,可较直观显示事物特征,请回答下面小题。下列表示构成物质的模型,“”和“”分别表示两种不同的原子,其中可以表示单质的是( )
A. B.
C. D.
8.将池塘水煮沸后冷却,用于饲养蝌蚪,蝌蚪很快死亡。这是因为与原先的池塘水相比,煮沸后的水中几乎不含( )
A.氧原子 B.氧离子 C.氧分子 D.氧元素
9.原子或原子团失去或获得电子后会成为离子。下列表示离子的符号书写正确的是( )
A.钙离子:CA2+ B.镁离子:Mg2+
C.铝离子:Cl﹣ D.硫酸根离子:SO4
10.学习小组制作了如图所示的分子模型,这个模型最可能用来表示( )
A.CH4 B.NH3 C.H2O D.CO2
11.如图是测定相对原子质量的示意图,推断A原子的相对原子质量约为( )
A.7 B.7g C.19 D.19g
12.歼﹣20是我国自主研发的一款高态势感知、高机动性的隐形战斗机,其中隐身材料的合成原料之一为间苯二胺(C6H8N2)。间苯二胺的分子结构稳定,能够通过化学反应加工成坚固耐用的隐身涂层。下列说法正确的是( )
A.间苯二胺中含一个氮气分子
B.间苯二胺由16个原子构成
C.间苯二胺由碳、氢、氮元素组成
D.间苯二胺属于单质
二、填空题
13.用化学符号或符号的意义填空。
(1)2个三氧化硫分子 。
(2)3个硝酸根离子 。
(3)正三价的铁元素: 。
(4)氧化钠 。
(5):2表示 。
14.下列常见物质:①氧气;②二氧化碳;③铁;④汞(水银);⑤水;⑥氯化钠.
其中由原子直接构成的有 ,由分子构成的有 ,由离子构成的有 (填序号).
15.元素周期表将已知元素科学有序的排列起来,便于研究它们的性质和用途。据表回答问题:
(1)写出由表格中③④两种元素组成的化合物的化学式 。
(2)在①②③④四种元素中,化学性质相似的是 (用序号①②③④表示)。
(3)有种单质,每个分子均由60个①元素原子构成,该物质的化学式为 。
(4)2017年5月9日,中国科学院、国家语言文字工作委员会、全国科学技术名词审定委员会正式向社会发布113号、115号、117号、118号元素中文名称。其中113号元素的部分信息如图,则该元素为 (选填“金属”或“非金属”)元素。
16.微观示意图可形象地表示微粒发生的变化,如图是NH3在纯氧中燃烧的微观示意图,据图回答问题。
(1)反应的NH3和O2的分子个数比是 。
(2)左边第一个方框中的物质属于 (填“单质”、“化合物”或“混合物”)。
(3)下列说法正确的有 (填字母)。
A.该反应中分子发生了改变
B.该反应中原子可以再分
C.在该反应中分子是保持物质化学性质的最小微粒
17.中科院李灿院士团队研发了“液体阳光”技术,实现了简单有机物的人工合成。其反应模型如图所示,即在二氧化钛(TiO2)催化下,利用二氧化碳和氢气可制备出甲醇(CH3OH)这种清洁燃料。
(1)二氧化钛中钛(Ti)元素的化合价为 。
(2)模型图中“”所表示的物质是 。(填化学式)
18.为探究原子结构,1911年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。发现现象如下。
现象1:大多数a粒子能穿透金箔而不改变原来运动方向。
现象2:少部分a粒子改变原来的运动方向。
现象3:极少数α粒子被弹了回来。
(1)结合实验现象,判断图中α粒子运动轨迹绘制有误的是 (填字母)。
(2)根据卢瑟福实验所产生的现象,不能获得的结论是 。
A.原子核体积很小 B.原子核带正电 C.原子核质量较大 D.核外电子带负电
(3)1919年,卢瑟福用加速了的高能α粒子轰击氮原子核,发现了一种新粒子,这种粒子带一个单位的正电荷,其质量与氢原子相近,这种粒子的名称为 。
19.甲、乙、丙是三种物体所含元素质量分数比的示意图。
(1)写出Mg的元素名称 。
(2)试推测,属于海水中所含各元素质量分数的是 图。
(3)三幅图中氧元素含量均为最高,是因为氧很容易与其他元素形成氧化物。请写出地壳中含量最高的金属元素对应氧化物的化学式 。
20.2024年10月,中国科学院化学研究所李永舫院士等团队研发出光电转化率高的钙钛矿﹣有机叠层太阳能电池。
(1)钙钛矿的主要成分是CaTiO3其中钛元素的化合价为 。
(2)图为简易的元素周期表,则钛元素大概位于 (填“A”或“B”)区域。
(3)钛﹣46,钛﹣47,钛﹣48是三种不同的原子,在元素周期表中 。
A、只有钛﹣46占位置 B、占三个不同的位置 C、同占一个位置
三、实验探究题
21.温州某校的项目研究小组开展建构分子模型来解释物质变化的活动,以下是某小组实践过程:
任务一:制作水分子模型
资料:水的化学式H2O,氢原子直径0.53×10﹣10m,氧原子直径0.74×10﹣10m。
材料:①直径2cm白色圆球若干
②直径2cm黑色圆球若干
③直径2.8cm白色圆球若干
④直径2.8cm黑色圆球若干
⑤直径8cm白色圆球若干
⑥直径8cm黑色圆球若干
评价等第 优秀 合格 不合格
评价指标 能区分原子种类、并符合原子实际比例 能区分原子种类、不符合原子实际比例 不能区分原子种类且不符合原子实际比例
(1)为使其制作的水分子模型达到优秀,其选材为 。
A.①② B.④⑤ C.②⑥ D.①④
任务二:利用建构的模型解释水电解的微观过程
(2)该小组同学结合资料建构水分子的模型,并用模型去解释水电解的微观过程,请在方框内画出水电解的中间过程。
(3)上述变化过程属于 (选填“物理变化”或“化学变化”),请从微观角度解释上述变化过程: 。
四、解答题
22.调味料味精的成分是谷氨酸钠(C5H8NO4Na)和少量食盐(NaCl),由生物发为白色晶体,易溶于水。谷氨酸钠在120℃以下稳定,超过150℃时部分分解为焦谷氨酸钠(C5H7NO3Na),导致鲜味降低。
(1)谷氨酸钠分子中碳、氢的原子个数比为 。
(2)谷氨酸钠与焦谷氨酸钠在鲜味上有所不同,其微观本质原因是 。
(3)钠摄入超标会引发高血压等疾病。食盐中Na的含量约为39%,有人说“每克味精比吃5克食盐更易诱发高血压”。你是否认同该说法,请计算说明。
23.碘是一种人体必需的微量元素。由于中国大部分地区都缺碘,进而引发地方性的碘缺乏病。我国要求向食盐中添加碘酸钾(KIO3),美国、加拿大等国家则向食盐中添加碘化钾(KI)。
(1)无论添加碘酸钾还是碘化钾,这两种加碘食盐都能起到补碘的作用。这里的“碘”指的是 。
A.碘单质 B.碘原子 C.碘离子 D.碘元素
(2)KIO3中Ⅰ的化合价为 。
(3)我国规定每千克加碘食盐中碘酸钾的含量为60mg,按照此标准,一包400g的加碘食盐中碘的质量为多少mg?请写出计算过程(结果保留一位小数)。
24.科学家对相对原子质量的认识经历了漫长的时间。
材料一:19世纪初,有科学家认为:氢是母体,其他元素的相对原子质量理论上都是氢的整数倍。
材料二:1886年,英国科学家克鲁克斯大胆假设:同一元素的原子,可以有不同的相对原子质量。科学家测定出的元素相对原子质量是其不同原子相对原子质量的平均值。
材料三:1961年8月,国际上采用碳﹣12原子的作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和。
(1)下列元素的相对原子质量不支持材料一的是 。
A.O﹣16 B.C1﹣35.5 C.Ag﹣108
(2)在克鲁克斯假设中,同种元素的原子,相对原子质量却不同,是因为原子结构中的某种微粒数不同,该微粒的名称是 。
(3)现发现氖的三种同位素原子相对原子质量分别为20、21、22,它们在自然界中分布如图。请结合材料三,列出氖元素的相对原子质量的计算式: 。
(4)结合以上材料及所学知识,判断下列说法正确的是 。
A.19世纪初,以氢为母体的相对原子质量标准是错误的,它对科学的发展没有价值
B.只要方法正确、仪器精确,实验结果就不会存在误差
C.若干年后,科学家有可能更改现在国际上采用的相对原子质量的标准
D.元素周期表中很多元素的相对原子质量都不是整数,可推测很多元素有多种同位素原子
参考答案
一.选择题(共12小题)
1.B; 2.C; 3.B; 4.D; 5.C; 6.A; 7.A; 8.C; 9.B; 10.A; 11.C; 12.C;
二.填空题(共8小题)
13.2SO3 ; 3 ; ; Na2O ; 1个碳酸根离子带两个单位负电荷 ; 14.③④ ; ①②⑤ ; ⑥ ; 15.NaCl ; ②④ ; C60 ; 金属 ; 16.4:3 ; 化合物 ; AC ; 17.+4 ; H2 ; 18.c ; D ; 质子 ; 19.镁 ; 乙 ; Al2O3 ; 20.+4 ; A ; C ;
三.实验探究题(共1小题)
21.D ; 化学变化 ; 分子分解为原子,原子重新结合为新的分子 ;
四.解答题(共3小题)
22.5:8 ; 阴离子不同 ; 23.D ; +5 ; 24.B ; 中子数 ; 21×a%+22×b%+20×c% ; CD
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
浙教版科学八下第2章微粒的模型与符号(一)(含答案)
一、选择题
1.下列图示微粒中属于化合物的是( )
A.A B.B C.C D.D
2.钨酸钠(Na2WO4)是一种白色粉末,可作为添加剂用于航空器涂层或航天材料的制造,提升耐高温与防腐性能。钨酸钠中钠元素的化合价是+1价,氧元素的化合价为﹣2价,则钨酸钠中钨元素的化合价为( )
A.+2 B.+4 C.+6 D.+8
3.如图是砹元素的信息,下列有关砹的说法不正确的是( )
A.元素符号是At B.原子质量是210克
C.质子数是85 D.元素名称是砹
4.C﹣14除了可以在考古中测定年代,还可以检测幽门螺杆菌。碳﹣14是碳﹣12的一种同位素,下列关于同位素的说法不正确的是( )
A.碳﹣14的核电荷数是6
B.碳﹣14和碳﹣12的主要区别是中子数不同
C.碳﹣14和碳﹣12在元素周期表中位于相同的位置
D.碳﹣14和碳﹣12的化学性质不同,所以碳﹣14能测年代而碳﹣12不能
5.对物质进行“宏观“微观﹣符号”表征以及建立三者联系,能帮助我们更好地认识物质的本质,也是化学学科独特的思维方式。如图为小实整理的水的思维导图,请完成下面小题。
下列常见物质中,“宏观﹣微观﹣符号”三者之间的联系没有一一对应的是( )
选项 A B C D
物质 甲烷 氢气 过氧化氢 二氧化碳
微观
符号 CH4 H2 H2O2 CO2
A.A B.B C.C D.D
6.科学中建立模型是解决问法,可较直观显示事物特征,请回答下面小题。下列不属于模型的是( )
A.碳元素 B.原子结构
C.空气的组成 D.速度计算公式
7.科学中建立模型是解决问法,可较直观显示事物特征,请回答下面小题。下列表示构成物质的模型,“”和“”分别表示两种不同的原子,其中可以表示单质的是( )
A. B.
C. D.
8.将池塘水煮沸后冷却,用于饲养蝌蚪,蝌蚪很快死亡。这是因为与原先的池塘水相比,煮沸后的水中几乎不含( )
A.氧原子 B.氧离子 C.氧分子 D.氧元素
9.原子或原子团失去或获得电子后会成为离子。下列表示离子的符号书写正确的是( )
A.钙离子:CA2+ B.镁离子:Mg2+
C.铝离子:Cl﹣ D.硫酸根离子:SO4
10.学习小组制作了如图所示的分子模型,这个模型最可能用来表示( )
A.CH4 B.NH3 C.H2O D.CO2
11.如图是测定相对原子质量的示意图,推断A原子的相对原子质量约为( )
A.7 B.7g C.19 D.19g
12.歼﹣20是我国自主研发的一款高态势感知、高机动性的隐形战斗机,其中隐身材料的合成原料之一为间苯二胺(C6H8N2)。间苯二胺的分子结构稳定,能够通过化学反应加工成坚固耐用的隐身涂层。下列说法正确的是( )
A.间苯二胺中含一个氮气分子
B.间苯二胺由16个原子构成
C.间苯二胺由碳、氢、氮元素组成
D.间苯二胺属于单质
二、填空题
13.用化学符号或符号的意义填空。
(1)2个三氧化硫分子 。
(2)3个硝酸根离子 。
(3)正三价的铁元素: 。
(4)氧化钠 。
(5):2表示 。
14.下列常见物质:①氧气;②二氧化碳;③铁;④汞(水银);⑤水;⑥氯化钠.
其中由原子直接构成的有 ,由分子构成的有 ,由离子构成的有 (填序号).
15.元素周期表将已知元素科学有序的排列起来,便于研究它们的性质和用途。据表回答问题:
(1)写出由表格中③④两种元素组成的化合物的化学式 。
(2)在①②③④四种元素中,化学性质相似的是 (用序号①②③④表示)。
(3)有种单质,每个分子均由60个①元素原子构成,该物质的化学式为 。
(4)2017年5月9日,中国科学院、国家语言文字工作委员会、全国科学技术名词审定委员会正式向社会发布113号、115号、117号、118号元素中文名称。其中113号元素的部分信息如图,则该元素为 (选填“金属”或“非金属”)元素。
16.微观示意图可形象地表示微粒发生的变化,如图是NH3在纯氧中燃烧的微观示意图,据图回答问题。
(1)反应的NH3和O2的分子个数比是 。
(2)左边第一个方框中的物质属于 (填“单质”、“化合物”或“混合物”)。
(3)下列说法正确的有 (填字母)。
A.该反应中分子发生了改变
B.该反应中原子可以再分
C.在该反应中分子是保持物质化学性质的最小微粒
17.中科院李灿院士团队研发了“液体阳光”技术,实现了简单有机物的人工合成。其反应模型如图所示,即在二氧化钛(TiO2)催化下,利用二氧化碳和氢气可制备出甲醇(CH3OH)这种清洁燃料。
(1)二氧化钛中钛(Ti)元素的化合价为 。
(2)模型图中“”所表示的物质是 。(填化学式)
18.为探究原子结构,1911年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。发现现象如下。
现象1:大多数a粒子能穿透金箔而不改变原来运动方向。
现象2:少部分a粒子改变原来的运动方向。
现象3:极少数α粒子被弹了回来。
(1)结合实验现象,判断图中α粒子运动轨迹绘制有误的是 (填字母)。
(2)根据卢瑟福实验所产生的现象,不能获得的结论是 。
A.原子核体积很小 B.原子核带正电 C.原子核质量较大 D.核外电子带负电
(3)1919年,卢瑟福用加速了的高能α粒子轰击氮原子核,发现了一种新粒子,这种粒子带一个单位的正电荷,其质量与氢原子相近,这种粒子的名称为 。
19.甲、乙、丙是三种物体所含元素质量分数比的示意图。
(1)写出Mg的元素名称 。
(2)试推测,属于海水中所含各元素质量分数的是 图。
(3)三幅图中氧元素含量均为最高,是因为氧很容易与其他元素形成氧化物。请写出地壳中含量最高的金属元素对应氧化物的化学式 。
20.2024年10月,中国科学院化学研究所李永舫院士等团队研发出光电转化率高的钙钛矿﹣有机叠层太阳能电池。
(1)钙钛矿的主要成分是CaTiO3其中钛元素的化合价为 。
(2)图为简易的元素周期表,则钛元素大概位于 (填“A”或“B”)区域。
(3)钛﹣46,钛﹣47,钛﹣48是三种不同的原子,在元素周期表中 。
A、只有钛﹣46占位置 B、占三个不同的位置 C、同占一个位置
三、实验探究题
21.温州某校的项目研究小组开展建构分子模型来解释物质变化的活动,以下是某小组实践过程:
任务一:制作水分子模型
资料:水的化学式H2O,氢原子直径0.53×10﹣10m,氧原子直径0.74×10﹣10m。
材料:①直径2cm白色圆球若干
②直径2cm黑色圆球若干
③直径2.8cm白色圆球若干
④直径2.8cm黑色圆球若干
⑤直径8cm白色圆球若干
⑥直径8cm黑色圆球若干
评价等第 优秀 合格 不合格
评价指标 能区分原子种类、并符合原子实际比例 能区分原子种类、不符合原子实际比例 不能区分原子种类且不符合原子实际比例
(1)为使其制作的水分子模型达到优秀,其选材为 。
A.①② B.④⑤ C.②⑥ D.①④
任务二:利用建构的模型解释水电解的微观过程
(2)该小组同学结合资料建构水分子的模型,并用模型去解释水电解的微观过程,请在方框内画出水电解的中间过程。
(3)上述变化过程属于 (选填“物理变化”或“化学变化”),请从微观角度解释上述变化过程: 。
四、解答题
22.调味料味精的成分是谷氨酸钠(C5H8NO4Na)和少量食盐(NaCl),由生物发为白色晶体,易溶于水。谷氨酸钠在120℃以下稳定,超过150℃时部分分解为焦谷氨酸钠(C5H7NO3Na),导致鲜味降低。
(1)谷氨酸钠分子中碳、氢的原子个数比为 。
(2)谷氨酸钠与焦谷氨酸钠在鲜味上有所不同,其微观本质原因是 。
(3)钠摄入超标会引发高血压等疾病。食盐中Na的含量约为39%,有人说“每克味精比吃5克食盐更易诱发高血压”。你是否认同该说法,请计算说明。
23.碘是一种人体必需的微量元素。由于中国大部分地区都缺碘,进而引发地方性的碘缺乏病。我国要求向食盐中添加碘酸钾(KIO3),美国、加拿大等国家则向食盐中添加碘化钾(KI)。
(1)无论添加碘酸钾还是碘化钾,这两种加碘食盐都能起到补碘的作用。这里的“碘”指的是 。
A.碘单质 B.碘原子 C.碘离子 D.碘元素
(2)KIO3中Ⅰ的化合价为 。
(3)我国规定每千克加碘食盐中碘酸钾的含量为60mg,按照此标准,一包400g的加碘食盐中碘的质量为多少mg?请写出计算过程(结果保留一位小数)。
24.科学家对相对原子质量的认识经历了漫长的时间。
材料一:19世纪初,有科学家认为:氢是母体,其他元素的相对原子质量理论上都是氢的整数倍。
材料二:1886年,英国科学家克鲁克斯大胆假设:同一元素的原子,可以有不同的相对原子质量。科学家测定出的元素相对原子质量是其不同原子相对原子质量的平均值。
材料三:1961年8月,国际上采用碳﹣12原子的作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和。
(1)下列元素的相对原子质量不支持材料一的是 。
A.O﹣16 B.C1﹣35.5 C.Ag﹣108
(2)在克鲁克斯假设中,同种元素的原子,相对原子质量却不同,是因为原子结构中的某种微粒数不同,该微粒的名称是 。
(3)现发现氖的三种同位素原子相对原子质量分别为20、21、22,它们在自然界中分布如图。请结合材料三,列出氖元素的相对原子质量的计算式: 。
(4)结合以上材料及所学知识,判断下列说法正确的是 。
A.19世纪初,以氢为母体的相对原子质量标准是错误的,它对科学的发展没有价值
B.只要方法正确、仪器精确,实验结果就不会存在误差
C.若干年后,科学家有可能更改现在国际上采用的相对原子质量的标准
D.元素周期表中很多元素的相对原子质量都不是整数,可推测很多元素有多种同位素原子
参考答案
一.选择题(共12小题)
1.B; 2.C; 3.B; 4.D; 5.C; 6.A; 7.A; 8.C; 9.B; 10.A; 11.C; 12.C;
二.填空题(共8小题)
13.2SO3 ; 3 ; ; Na2O ; 1个碳酸根离子带两个单位负电荷 ; 14.③④ ; ①②⑤ ; ⑥ ; 15.NaCl ; ②④ ; C60 ; 金属 ; 16.4:3 ; 化合物 ; AC ; 17.+4 ; H2 ; 18.c ; D ; 质子 ; 19.镁 ; 乙 ; Al2O3 ; 20.+4 ; A ; C ;
三.实验探究题(共1小题)
21.D ; 化学变化 ; 分子分解为原子,原子重新结合为新的分子 ;
四.解答题(共3小题)
22.5:8 ; 阴离子不同 ; 23.D ; +5 ; 24.B ; 中子数 ; 21×a%+22×b%+20×c% ; CD
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
