河北省邯郸市2023-2024学年高一下学期6月期末考试化学试卷(含答案)
文档属性
| 名称 | 河北省邯郸市2023-2024学年高一下学期6月期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 933.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-12 22:59:20 | ||
图片预览



文档简介
河北省邯郸市2023-2024学年高一下学期期末质量检测化学试题
一、单选题
1.从科技前沿到人类的日常生活,化学无处不在。下列说法正确的是
A.新型LED管束模块是由GaAs、GaP等半导体制成的,它们都属于金属材料
B.水泥、陶瓷、有机玻璃(聚甲基丙烯酸甲酯)都属于传统无机非金属材料
C.制造5G芯片的氮化铝晶圆、制造飞机机翼的氮化硅陶瓷、碳纤维都属于新型无机非金属材料
D.我国科学家从嫦娥五号带回的月壤样品中,首次发现了天然玻璃纤维,该纤维中的主要氧化物属于分子晶体
2.下列有关试剂保存及实验操作不符合规范的是
A.浓硝酸、新制氯水保存在棕色细口瓶中
B.配制硫酸亚铁溶液时将蒸馏水煮沸并迅速冷却后使用
C.蒸馏时,忘记加沸石,应熄灭酒精灯后立即补加
D.盛有KMnO4与乙醇的试剂瓶不能同橱存放
3.设为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,92g和混合气体中原子数为6
B.常温下,100g46%乙醇溶液中含有键的数目为
C.1molFe与水蒸气在高温下充分反应,转移的电子数为3
D.标准状况下,11.2L和22.4L在光照下充分反应后分子数小于1.5
4.下列有关电极反应式或离子方程式正确的是
A.等物质的量的、和HCl溶液混合:
B.利用覆铜板制作印刷电路板:
C.铅酸蓄电池放电时的负极反应:
D.明矾溶液与过量氨水混合:
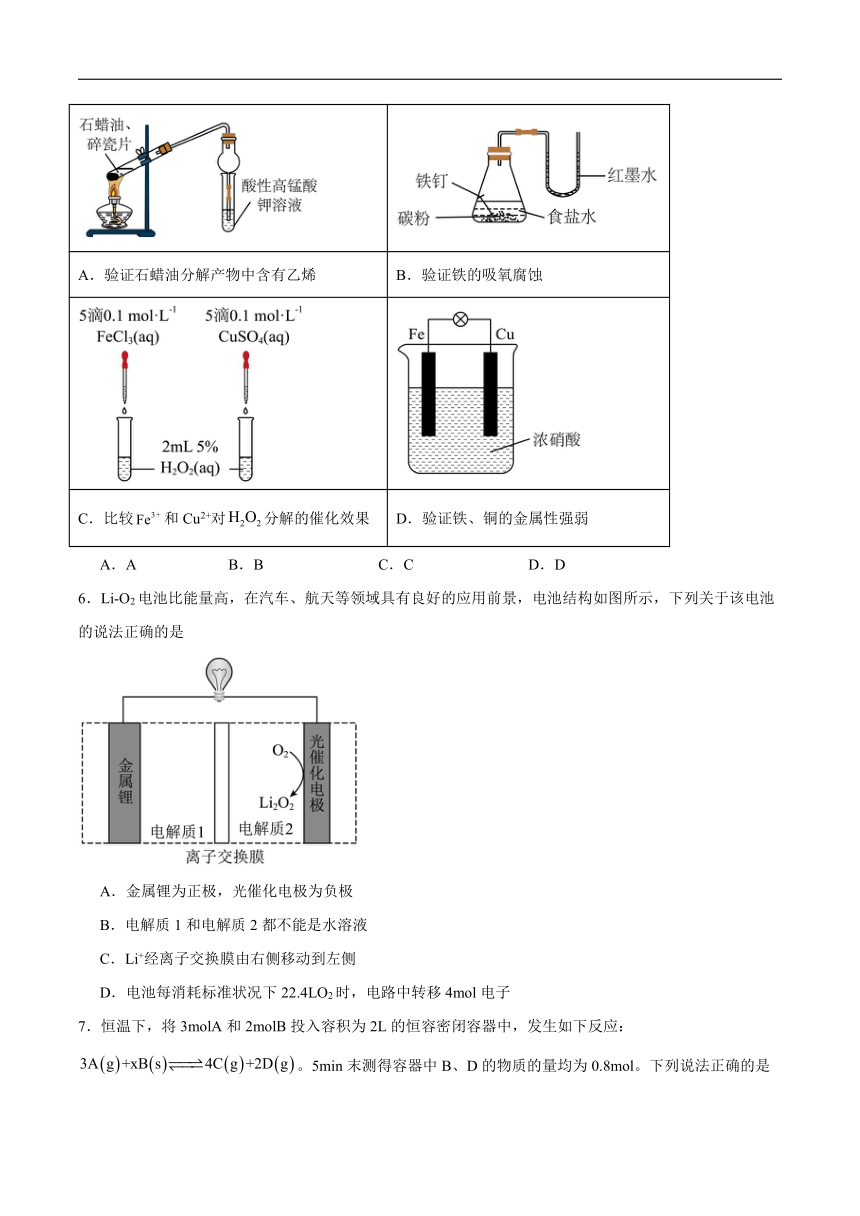
5.利用下列装置和试剂进行实验,设计合理并能达到实验目的的是
A.验证石蜡油分解产物中含有乙烯 B.验证铁的吸氧腐蚀
C.比较和Cu2+对分解的催化效果 D.验证铁、铜的金属性强弱
A.A B.B C.C D.D
6.Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景,电池结构如图所示,下列关于该电池的说法正确的是
A.金属锂为正极,光催化电极为负极
B.电解质1和电解质2都不能是水溶液
C.Li+经离子交换膜由右侧移动到左侧
D.电池每消耗标准状况下22.4LO2时,电路中转移4mol电子
7.恒温下,将3molA和2molB投入容积为2L的恒容密闭容器中,发生如下反应:。5min末测得容器中B、D的物质的量均为0.8mol。下列说法正确的是
A.
B.0~5min内,用A表示的平均反应速率为
C.其他条件不变,增加B的量可加快反应速率
D.5min末,容器内气体的压强是起始压强的1.4倍
8.实验室制备柠檬酸铁铵的流程为:。下列实验装置或操作不能达到实验目的的是
A.流程①可用装置甲
B.用装置乙制取
C.用装置丙可观察喷泉实验和制取氨水
D.已知流程②为“浓缩为糊状、干燥”,其中“浓缩为糊状”流程可用装置丁,“干燥”用低温干燥
9.已知:。部分键能数据如表所示。下列说法正确的是
化学键 C=O
键能/() 808 436 464
A.1mol和1mol充分反应生成和吸收41.2kJ的热量
B.CO中的键能为
C.该反应为吸热反应,吸热反应必须加热才能进行
D.
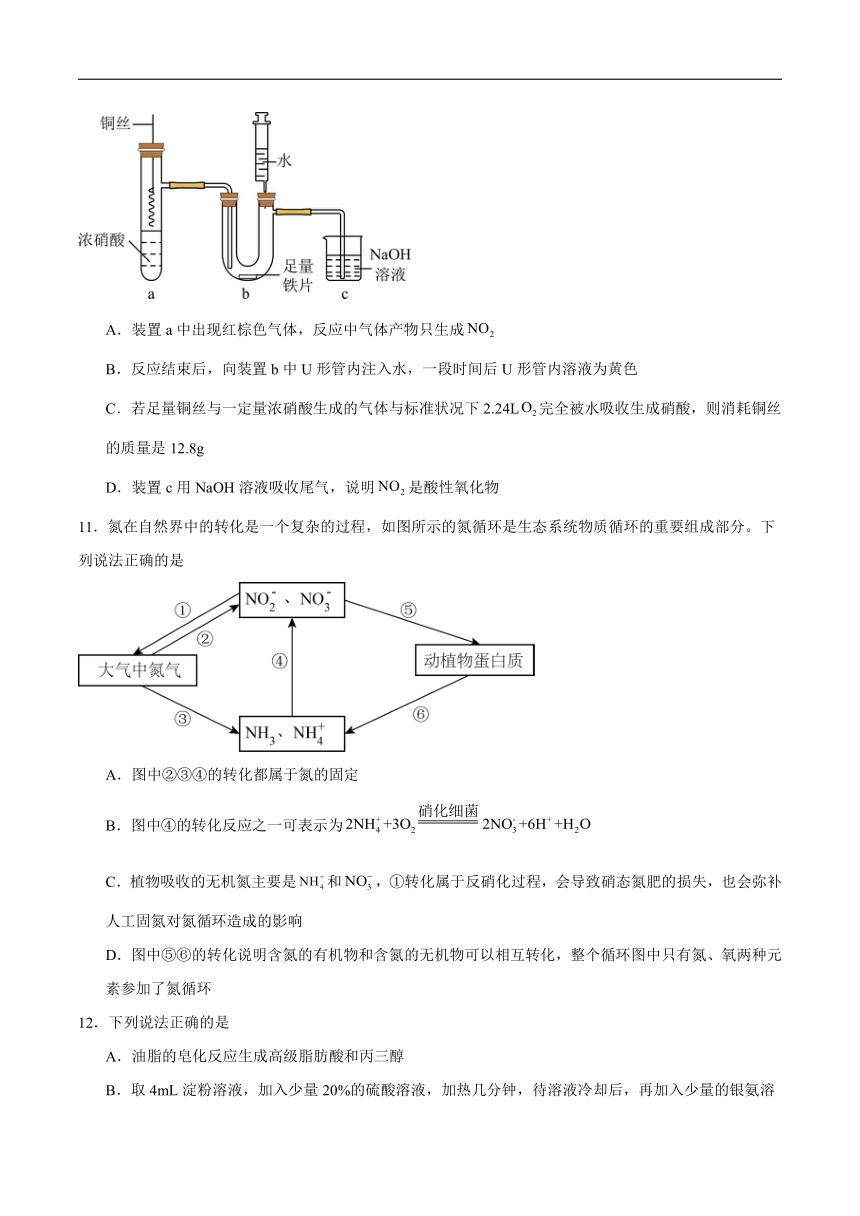
10.将足量铜丝插入一定量浓硝酸中进行如图所示的实验,下列说法正确的是
A.装置a中出现红棕色气体,反应中气体产物只生成
B.反应结束后,向装置b中U形管内注入水,一段时间后U形管内溶液为黄色
C.若足量铜丝与一定量浓硝酸生成的气体与标准状况下2.24L完全被水吸收生成硝酸,则消耗铜丝的质量是12.8g
D.装置c用NaOH溶液吸收尾气,说明是酸性氧化物
11.氮在自然界中的转化是一个复杂的过程,如图所示的氮循环是生态系统物质循环的重要组成部分。下列说法正确的是
A.图中②③④的转化都属于氮的固定
B.图中④的转化反应之一可表示为
C.植物吸收的无机氮主要是和,①转化属于反硝化过程,会导致硝态氮肥的损失,也会弥补人工固氮对氮循环造成的影响
D.图中⑤⑥的转化说明含氮的有机物和含氮的无机物可以相互转化,整个循环图中只有氮、氧两种元素参加了氮循环
12.下列说法正确的是
A.油脂的皂化反应生成高级脂肪酸和丙三醇
B.取4mL淀粉溶液,加入少量20%的硫酸溶液,加热几分钟,待溶液冷却后,再加入少量的银氨溶液,水浴加热,有光亮的银镜生成
C.氨基酸为高分子化合物,种类较多,分子中都含有和
D.硬脂酸甘油酯的结构简式为
13.下列实验操作及现象与实验结论均正确的是
选项 实验操作及现象 实验结论
A 向溶液中滴入酸性溶液,溶液紫色褪去 具有还原性
B 将酸化的溶液滴入溶液中,溶液变黄 的氧化性大于
C 取适量浓硝酸于试管中,将灼热的木炭插入试管,产生红棕色气体 浓硝酸与木炭反应产生
D 向某盐溶液中加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体 该盐溶液中一定含有
A.A B.B C.C D.D
14.关于有机物的说法正确的是
A.分子式为
B.该有机物可以发生取代反应、加成反应和酯化反应
C.该有机物能被催化氧化生成醛
D.1mol该有机物与足量NaOH溶液反应消耗2molNaOH
二、解答题
15.某学习小组根据氨气的性质设计如下实验(夹持装置省略),用于测定铜元素的相对原子质量(近似值)和制备。
已知:①E中化学反应方程式为。②的化学性质与相似,具有还原性。
(1)A中的固体可为 (填化学式)。
(2)氨气还原炽热氧化铜的化学方程式为 。
(3)干燥管D中盛放的药品可为_______(填标号)。
A.五氧化二磷 B.无水 C.碱石灰 D.氯化钠
(4)实验前将石英玻璃管(带两端开关和)(设为装置C)称重,记为g。将氧化铜装入C中,再次将装置C称重,记为g。按上图连接好装置,关闭打开进行实验,通入,充分反应直至C恒重,记为g。根据实验记录,计算铜元素的相对原子质量= (用含有、、的式子表示)。
(5)的电子式是 。
(6)仪器b的名称为 ,仪器a的作用是 。
(7)采用上述装置制备时产率较低,可能的原因是 。
16.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳的排放,有助于实现碳中和。其反应可表示为
(1)已知反应过程的能量变化如下图所示:
由图可知 ,代表正反应的活化能,的大小对该反应的反应热 (填“有”或“无”)影响。
(2)恒温条件下,向容积为5L的恒容容器中充入1mol和2mol,发生上述反应。
①下列事实不能说明体系达到平衡状态的是 (填标号)。
A.容器内的压强不再变化
B.
C.容器内气体的密度不再变化
D.CO2和H2的物质的量浓度比值不再变化
②若3min末测得CH3OH的体积分数为25%,则用H2表示0~3min内该反应的平均反应速率为 ,CO2的转化率为 。
(3)某科研小组用电化学方法实现二氧化碳加氢制甲醇,工作原理如下图所示。
①通入H2的一极为 (填“正极”或“负极”),通入CO2的一极的电极反应式为 。
②电极材料采用“多孔”碳棒,“多孔”的优点是 。
17.钛被誉为“21世纪金属”,工业上常用钛铁矿[主要成分为钛酸亚铁(),含有少量、CaO、等杂质]为原料制备金属钛,同时获得铁基颜料铁黄(FeOOH)的工艺流程如图所示:
已知:①酸浸时转化为和,在热水中转化为沉淀。②FeOOH难溶于水。回答下列问题:
(1)滤渣Ⅰ中除过量铁粉外,主要成分还有 (填化学式)。
(2)“还原”过程中发生反应的离子方程式为 ,可用 (填化学式)试剂检验是否“还原”完全。
(3)高温下转化为的同时生成一种还原性气体,化学反应方程式为 。
(4)“沉降、氧化”时发生反应的离子方程式为 。
(5)FeOOH可以表示为,则 ,“氧化”时,用浓溶液代替空气,能缩短氧化时间,但缺点是 。
(6)经“过滤、洗涤、干燥”一系列操作可得铁黄产品,“洗涤”的具体操作为 。
18.已知0.5mol某种烃A在空气中完全燃烧,生成44g和18g,H是有香味的油状液体。有关物质转化关系如图所示:
回答下列问题:
(1)A的结构式是 ,A的全氟代物能发生加聚反应,所得聚合物可用作不粘锅的涂层,该聚合物的结构简式是 。
(2)A→B的反应类型是 ,E中所含的官能团是 (填名称)。
(3)D+F→H的化学方程式是 。
(4)为除去H中的D和F应选择试剂的名称为 。
(5)I为H的同分异构体,已知I能与溶液反应,则I可能的结构简式有 种,其中烃基只有一种一氯代物的结构简式为 。
参考答案
1.C
2.C
3.A
4.B
5.B
6.B
7.D
8.B
9.B
10.C
11.C
12.D
13.D
14.B
15.(1)氧化钙或者氢氧化钠
(2)
(3)AB
(4)
(5)
(6) 恒压滴液漏斗 防止倒吸
(7)具有还原性,NaClO具有强氧化性,NaClO会将生成的氧化使产率较低
16.(1) -49kJ/mol 无
(2) BC 0.1mol/(L min) 50%
(3) 负极 CO2+6H++6e-=CH3OH+H2O 提高气体在电极表面的吸附量,使其与溶液充分接触,提高反应速率
17.(1)和
(2) KSCN溶液
(3)
(4)
(5) 1:1 会被还原为氮氧化物,污染空气
(6)沿玻璃棒向漏斗中加入蒸馏水至浸没沉淀,待水自然流出,重复操作次
18.(1)
(2) 加成反应 碳碳双键、醛基
(3)
(4)饱和碳酸钠溶液
(5) 4
一、单选题
1.从科技前沿到人类的日常生活,化学无处不在。下列说法正确的是
A.新型LED管束模块是由GaAs、GaP等半导体制成的,它们都属于金属材料
B.水泥、陶瓷、有机玻璃(聚甲基丙烯酸甲酯)都属于传统无机非金属材料
C.制造5G芯片的氮化铝晶圆、制造飞机机翼的氮化硅陶瓷、碳纤维都属于新型无机非金属材料
D.我国科学家从嫦娥五号带回的月壤样品中,首次发现了天然玻璃纤维,该纤维中的主要氧化物属于分子晶体
2.下列有关试剂保存及实验操作不符合规范的是
A.浓硝酸、新制氯水保存在棕色细口瓶中
B.配制硫酸亚铁溶液时将蒸馏水煮沸并迅速冷却后使用
C.蒸馏时,忘记加沸石,应熄灭酒精灯后立即补加
D.盛有KMnO4与乙醇的试剂瓶不能同橱存放
3.设为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,92g和混合气体中原子数为6
B.常温下,100g46%乙醇溶液中含有键的数目为
C.1molFe与水蒸气在高温下充分反应,转移的电子数为3
D.标准状况下,11.2L和22.4L在光照下充分反应后分子数小于1.5
4.下列有关电极反应式或离子方程式正确的是
A.等物质的量的、和HCl溶液混合:
B.利用覆铜板制作印刷电路板:
C.铅酸蓄电池放电时的负极反应:
D.明矾溶液与过量氨水混合:
5.利用下列装置和试剂进行实验,设计合理并能达到实验目的的是
A.验证石蜡油分解产物中含有乙烯 B.验证铁的吸氧腐蚀
C.比较和Cu2+对分解的催化效果 D.验证铁、铜的金属性强弱
A.A B.B C.C D.D
6.Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景,电池结构如图所示,下列关于该电池的说法正确的是
A.金属锂为正极,光催化电极为负极
B.电解质1和电解质2都不能是水溶液
C.Li+经离子交换膜由右侧移动到左侧
D.电池每消耗标准状况下22.4LO2时,电路中转移4mol电子
7.恒温下,将3molA和2molB投入容积为2L的恒容密闭容器中,发生如下反应:。5min末测得容器中B、D的物质的量均为0.8mol。下列说法正确的是
A.
B.0~5min内,用A表示的平均反应速率为
C.其他条件不变,增加B的量可加快反应速率
D.5min末,容器内气体的压强是起始压强的1.4倍
8.实验室制备柠檬酸铁铵的流程为:。下列实验装置或操作不能达到实验目的的是
A.流程①可用装置甲
B.用装置乙制取
C.用装置丙可观察喷泉实验和制取氨水
D.已知流程②为“浓缩为糊状、干燥”,其中“浓缩为糊状”流程可用装置丁,“干燥”用低温干燥
9.已知:。部分键能数据如表所示。下列说法正确的是
化学键 C=O
键能/() 808 436 464
A.1mol和1mol充分反应生成和吸收41.2kJ的热量
B.CO中的键能为
C.该反应为吸热反应,吸热反应必须加热才能进行
D.
10.将足量铜丝插入一定量浓硝酸中进行如图所示的实验,下列说法正确的是
A.装置a中出现红棕色气体,反应中气体产物只生成
B.反应结束后,向装置b中U形管内注入水,一段时间后U形管内溶液为黄色
C.若足量铜丝与一定量浓硝酸生成的气体与标准状况下2.24L完全被水吸收生成硝酸,则消耗铜丝的质量是12.8g
D.装置c用NaOH溶液吸收尾气,说明是酸性氧化物
11.氮在自然界中的转化是一个复杂的过程,如图所示的氮循环是生态系统物质循环的重要组成部分。下列说法正确的是
A.图中②③④的转化都属于氮的固定
B.图中④的转化反应之一可表示为
C.植物吸收的无机氮主要是和,①转化属于反硝化过程,会导致硝态氮肥的损失,也会弥补人工固氮对氮循环造成的影响
D.图中⑤⑥的转化说明含氮的有机物和含氮的无机物可以相互转化,整个循环图中只有氮、氧两种元素参加了氮循环
12.下列说法正确的是
A.油脂的皂化反应生成高级脂肪酸和丙三醇
B.取4mL淀粉溶液,加入少量20%的硫酸溶液,加热几分钟,待溶液冷却后,再加入少量的银氨溶液,水浴加热,有光亮的银镜生成
C.氨基酸为高分子化合物,种类较多,分子中都含有和
D.硬脂酸甘油酯的结构简式为
13.下列实验操作及现象与实验结论均正确的是
选项 实验操作及现象 实验结论
A 向溶液中滴入酸性溶液,溶液紫色褪去 具有还原性
B 将酸化的溶液滴入溶液中,溶液变黄 的氧化性大于
C 取适量浓硝酸于试管中,将灼热的木炭插入试管,产生红棕色气体 浓硝酸与木炭反应产生
D 向某盐溶液中加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体 该盐溶液中一定含有
A.A B.B C.C D.D
14.关于有机物的说法正确的是
A.分子式为
B.该有机物可以发生取代反应、加成反应和酯化反应
C.该有机物能被催化氧化生成醛
D.1mol该有机物与足量NaOH溶液反应消耗2molNaOH
二、解答题
15.某学习小组根据氨气的性质设计如下实验(夹持装置省略),用于测定铜元素的相对原子质量(近似值)和制备。
已知:①E中化学反应方程式为。②的化学性质与相似,具有还原性。
(1)A中的固体可为 (填化学式)。
(2)氨气还原炽热氧化铜的化学方程式为 。
(3)干燥管D中盛放的药品可为_______(填标号)。
A.五氧化二磷 B.无水 C.碱石灰 D.氯化钠
(4)实验前将石英玻璃管(带两端开关和)(设为装置C)称重,记为g。将氧化铜装入C中,再次将装置C称重,记为g。按上图连接好装置,关闭打开进行实验,通入,充分反应直至C恒重,记为g。根据实验记录,计算铜元素的相对原子质量= (用含有、、的式子表示)。
(5)的电子式是 。
(6)仪器b的名称为 ,仪器a的作用是 。
(7)采用上述装置制备时产率较低,可能的原因是 。
16.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳的排放,有助于实现碳中和。其反应可表示为
(1)已知反应过程的能量变化如下图所示:
由图可知 ,代表正反应的活化能,的大小对该反应的反应热 (填“有”或“无”)影响。
(2)恒温条件下,向容积为5L的恒容容器中充入1mol和2mol,发生上述反应。
①下列事实不能说明体系达到平衡状态的是 (填标号)。
A.容器内的压强不再变化
B.
C.容器内气体的密度不再变化
D.CO2和H2的物质的量浓度比值不再变化
②若3min末测得CH3OH的体积分数为25%,则用H2表示0~3min内该反应的平均反应速率为 ,CO2的转化率为 。
(3)某科研小组用电化学方法实现二氧化碳加氢制甲醇,工作原理如下图所示。
①通入H2的一极为 (填“正极”或“负极”),通入CO2的一极的电极反应式为 。
②电极材料采用“多孔”碳棒,“多孔”的优点是 。
17.钛被誉为“21世纪金属”,工业上常用钛铁矿[主要成分为钛酸亚铁(),含有少量、CaO、等杂质]为原料制备金属钛,同时获得铁基颜料铁黄(FeOOH)的工艺流程如图所示:
已知:①酸浸时转化为和,在热水中转化为沉淀。②FeOOH难溶于水。回答下列问题:
(1)滤渣Ⅰ中除过量铁粉外,主要成分还有 (填化学式)。
(2)“还原”过程中发生反应的离子方程式为 ,可用 (填化学式)试剂检验是否“还原”完全。
(3)高温下转化为的同时生成一种还原性气体,化学反应方程式为 。
(4)“沉降、氧化”时发生反应的离子方程式为 。
(5)FeOOH可以表示为,则 ,“氧化”时,用浓溶液代替空气,能缩短氧化时间,但缺点是 。
(6)经“过滤、洗涤、干燥”一系列操作可得铁黄产品,“洗涤”的具体操作为 。
18.已知0.5mol某种烃A在空气中完全燃烧,生成44g和18g,H是有香味的油状液体。有关物质转化关系如图所示:
回答下列问题:
(1)A的结构式是 ,A的全氟代物能发生加聚反应,所得聚合物可用作不粘锅的涂层,该聚合物的结构简式是 。
(2)A→B的反应类型是 ,E中所含的官能团是 (填名称)。
(3)D+F→H的化学方程式是 。
(4)为除去H中的D和F应选择试剂的名称为 。
(5)I为H的同分异构体,已知I能与溶液反应,则I可能的结构简式有 种,其中烃基只有一种一氯代物的结构简式为 。
参考答案
1.C
2.C
3.A
4.B
5.B
6.B
7.D
8.B
9.B
10.C
11.C
12.D
13.D
14.B
15.(1)氧化钙或者氢氧化钠
(2)
(3)AB
(4)
(5)
(6) 恒压滴液漏斗 防止倒吸
(7)具有还原性,NaClO具有强氧化性,NaClO会将生成的氧化使产率较低
16.(1) -49kJ/mol 无
(2) BC 0.1mol/(L min) 50%
(3) 负极 CO2+6H++6e-=CH3OH+H2O 提高气体在电极表面的吸附量,使其与溶液充分接触,提高反应速率
17.(1)和
(2) KSCN溶液
(3)
(4)
(5) 1:1 会被还原为氮氧化物,污染空气
(6)沿玻璃棒向漏斗中加入蒸馏水至浸没沉淀,待水自然流出,重复操作次
18.(1)
(2) 加成反应 碳碳双键、醛基
(3)
(4)饱和碳酸钠溶液
(5) 4
同课章节目录
