人教版高中化学必修二 课件1.2 元素周期律(共20张PPT)
文档属性
| 名称 | 人教版高中化学必修二 课件1.2 元素周期律(共20张PPT) | 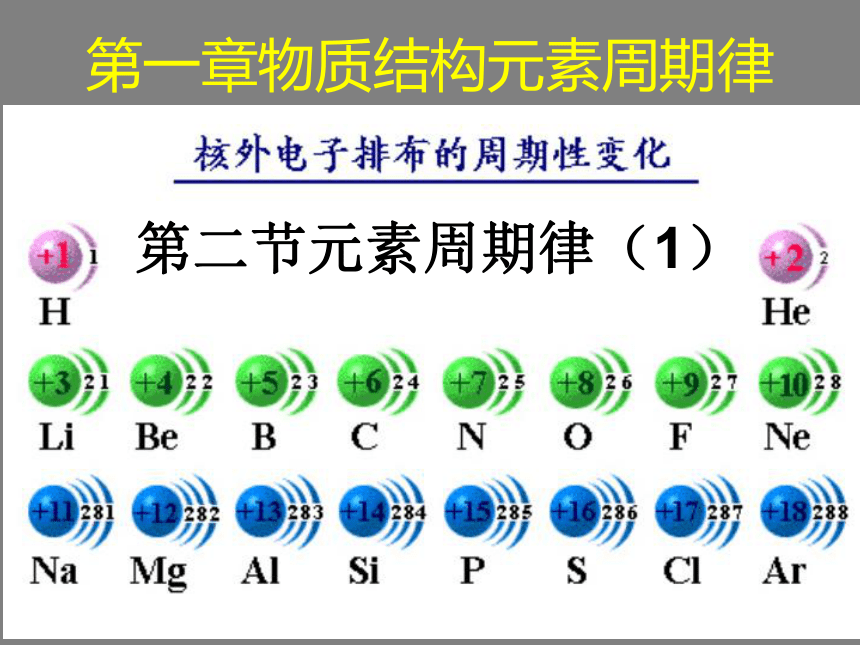 | |
| 格式 | zip | ||
| 文件大小 | 545.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-21 21:21:00 | ||
图片预览







文档简介
课件20张PPT。第二节元素周期律(1)第一章物质结构元素周期律学习目标:
1、理解解核外电子是分层排布的,不同电子层中的电子具有不同的能量。
2、掌握核外电子排布的初步规律,并能据此规律画出常见原子的结构示意图。
重点:
核外电子的排布规律, 画常见原子的结构示意图。
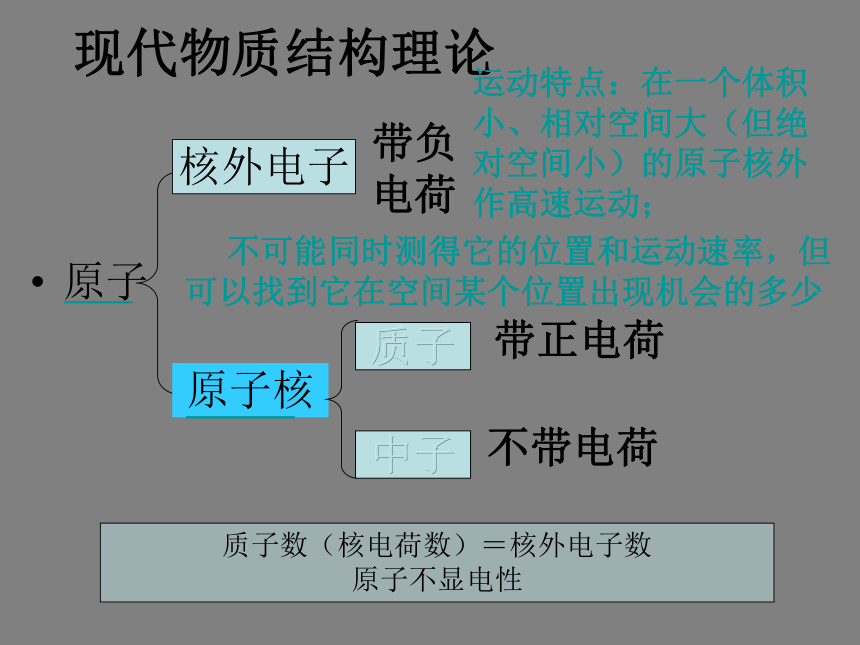
难点:核外电子的分层排布。提问:1、元素的性质由什么决定? 原子原子核核外电子质子 相对质量为1中子 相对质量为1 相对质量为1/1836 原子核几乎集中了原子所有的质量,但体积却很小… 电子的质量很小,体积也很小;电子所占据的运动空间相对于原子核的体积却很大(绝对空间也很小);电子在核 外做高速运动。2、原子的组成怎样? 为了探索原子内部结构,科学家们进行了无数的实验。他们用原子模型来表示原子,并通过实验来不断的修正模型。原子结构模型的演变1803年汤姆原子模型1911年玻尔原子模型1913年 1904年卢瑟福原子模型道尔顿原子模型电子云模型1927-1935年现代物质结构理论原子原子核质子中子带负电荷带正电荷不带电荷质子数(核电荷数)=核外电子数
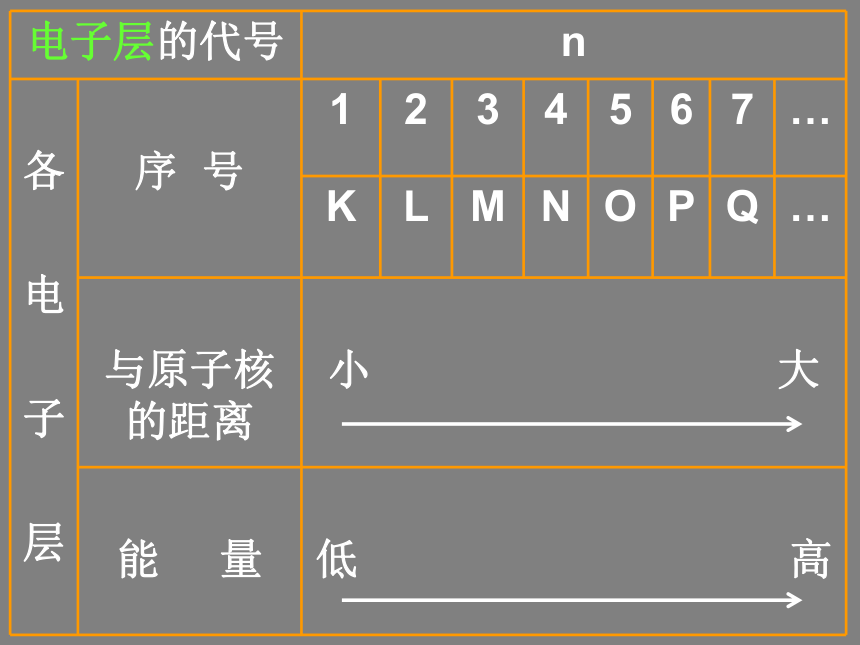
原子不显电性核外电子运动特点:在一个体积小、相对空间大(但绝对空间小)的原子核外作高速运动; 不可能同时测得它的位置和运动速率,但可以找到它在空间某个位置出现机会的多少一、原子核外电子的排布 1、电子在原子核外相对大实际小的空间不停地做高速运动(速度接近光速)。 2、所有的电子都具有一定的能量,在多电子原子里,各电子所具有的能量不尽相同,有的电子的能量还相差较大。 3、能量低的电子在离核较近的区域运动,能量较高的电子在离核较远的区域运动。 4、我们把不同的电子运动区域简化为不连续的壳层,称之为“电子层”。电子层???各电子层的序号、能量如下表:(1)在多电子原子里,电子在原子核外是分层运动的,又叫核外电子的分层排布。(2)在多电子原子里,原子核外有一个或多个电子层,能量低的电子在离核近的、能量低的电子层中运动,能量高的电子在离核较远的、能量较高的电子层中运动。 5、核外电子的排布规律(分析表1-2)(1)核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(能量最低原理)。(2)各电子层最多能容纳的电子数为 2n2 (3)最外层电子数不能超过 8(当K层为最外层时不能超过 2 )。 (4)次外层电子数不能超过 18 ,倒数第三层电子数不能超过 32 。注意:
a、以上四条规律是相互联系的,不能孤立地理解。
b、最外电子层中排满 8 个电子(He为2个电子)时,为相对稳定结构,其它为不稳定结构(在一定条件下要转变为稳定结构)
c、画原子结构示意图要遵循上述规律。原子结构用原子结构示意图表示作业:
1、画出下列元素的原子结构示意图:
Sr、Ra、Se、Sb、Pb、Xe2、预习并填写完成 P.13~15 的各个表格练习一下:
画出原子序数为7、15、35、55、84的元素的原子结构示意图,并指出它们在周期表中的位置。
近代科学原子论(1803年)一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)“化学的新时代是从原子论开始的”
——恩格斯原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。英国物理学家汤姆生
(J.J.Thomson ,1856~1940)α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937)玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。
丹麦物理学家玻尔
(N.Bohr,1885~1962)电子云模型 (现代物质结构学说)现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。
电子云密度大的地方,表明电子在核外单位体积内出现的机会多,反之,出现的机会少。
如:氢原子的电子云电子云现代物质结构学说
1、理解解核外电子是分层排布的,不同电子层中的电子具有不同的能量。
2、掌握核外电子排布的初步规律,并能据此规律画出常见原子的结构示意图。
重点:
核外电子的排布规律, 画常见原子的结构示意图。
难点:核外电子的分层排布。提问:1、元素的性质由什么决定? 原子原子核核外电子质子 相对质量为1中子 相对质量为1 相对质量为1/1836 原子核几乎集中了原子所有的质量,但体积却很小… 电子的质量很小,体积也很小;电子所占据的运动空间相对于原子核的体积却很大(绝对空间也很小);电子在核 外做高速运动。2、原子的组成怎样? 为了探索原子内部结构,科学家们进行了无数的实验。他们用原子模型来表示原子,并通过实验来不断的修正模型。原子结构模型的演变1803年汤姆原子模型1911年玻尔原子模型1913年 1904年卢瑟福原子模型道尔顿原子模型电子云模型1927-1935年现代物质结构理论原子原子核质子中子带负电荷带正电荷不带电荷质子数(核电荷数)=核外电子数
原子不显电性核外电子运动特点:在一个体积小、相对空间大(但绝对空间小)的原子核外作高速运动; 不可能同时测得它的位置和运动速率,但可以找到它在空间某个位置出现机会的多少一、原子核外电子的排布 1、电子在原子核外相对大实际小的空间不停地做高速运动(速度接近光速)。 2、所有的电子都具有一定的能量,在多电子原子里,各电子所具有的能量不尽相同,有的电子的能量还相差较大。 3、能量低的电子在离核较近的区域运动,能量较高的电子在离核较远的区域运动。 4、我们把不同的电子运动区域简化为不连续的壳层,称之为“电子层”。电子层???各电子层的序号、能量如下表:(1)在多电子原子里,电子在原子核外是分层运动的,又叫核外电子的分层排布。(2)在多电子原子里,原子核外有一个或多个电子层,能量低的电子在离核近的、能量低的电子层中运动,能量高的电子在离核较远的、能量较高的电子层中运动。 5、核外电子的排布规律(分析表1-2)(1)核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(能量最低原理)。(2)各电子层最多能容纳的电子数为 2n2 (3)最外层电子数不能超过 8(当K层为最外层时不能超过 2 )。 (4)次外层电子数不能超过 18 ,倒数第三层电子数不能超过 32 。注意:
a、以上四条规律是相互联系的,不能孤立地理解。
b、最外电子层中排满 8 个电子(He为2个电子)时,为相对稳定结构,其它为不稳定结构(在一定条件下要转变为稳定结构)
c、画原子结构示意图要遵循上述规律。原子结构用原子结构示意图表示作业:
1、画出下列元素的原子结构示意图:
Sr、Ra、Se、Sb、Pb、Xe2、预习并填写完成 P.13~15 的各个表格练习一下:
画出原子序数为7、15、35、55、84的元素的原子结构示意图,并指出它们在周期表中的位置。
近代科学原子论(1803年)一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)“化学的新时代是从原子论开始的”
——恩格斯原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。英国物理学家汤姆生
(J.J.Thomson ,1856~1940)α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937)玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。
丹麦物理学家玻尔
(N.Bohr,1885~1962)电子云模型 (现代物质结构学说)现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。
电子云密度大的地方,表明电子在核外单位体积内出现的机会多,反之,出现的机会少。
如:氢原子的电子云电子云现代物质结构学说
