人教版高中化学必修二 课件2.2 化学能与电能 复习(共46张PPT)
文档属性
| 名称 | 人教版高中化学必修二 课件2.2 化学能与电能 复习(共46张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 613.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-21 21:26:23 | ||
图片预览









文档简介
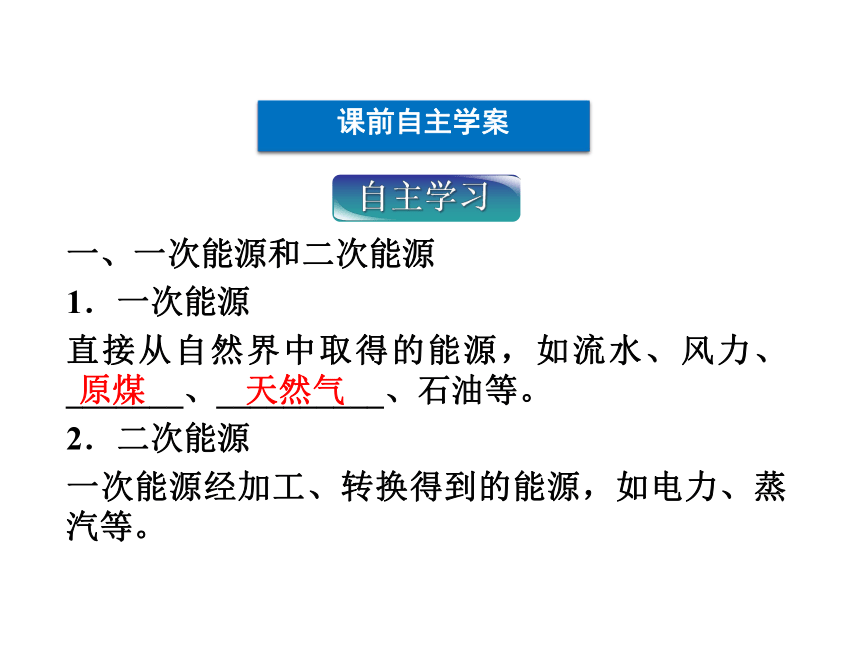
课件46张PPT。第二节 化学能与电能课前自主学案一、一次能源和二次能源
1.一次能源
直接从自然界中取得的能源,如流水、风力、_______、__________、石油等。
2.二次能源
一次能源经加工、转换得到的能源,如电力、蒸汽等。原煤天然气二、化学能转化为电能
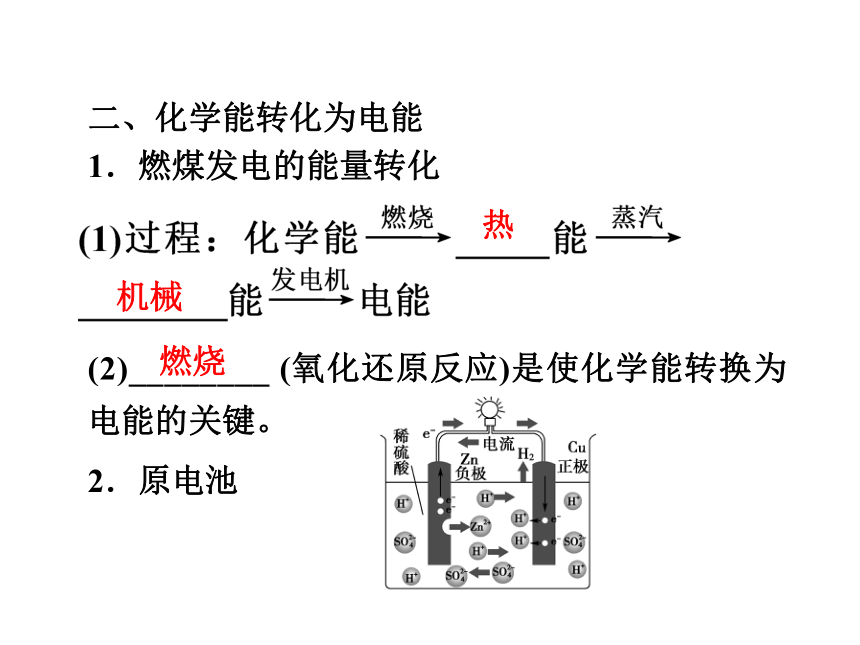
1.燃煤发电的能量转化
(2)________ (氧化还原反应)是使化学能转换为电能的关键。
2.原电池
热机械燃烧(1)原电池概念:将________能转变为_____能的装置。
(2)铜锌原电池工作原理化学电氧化还原总电池反应:_________________________。
(3)反应本质:原电池反应的本质是
____________________。
(4)构成原电池的条件
理论上,自发的_____________反应均可设计成原电池。Zn+2H+===Zn2++H2↑氧化还原反应氧化还原电解质思考感悟
原电池是如何构成闭合回路的?(请从电子流向和离子移动方向分析)
【提示】 在外电路,电子从负极流出经导线流向正极,在电解质溶液中,阳离子向正极移动,阴离子向负极移动。三、发展中的化学电源
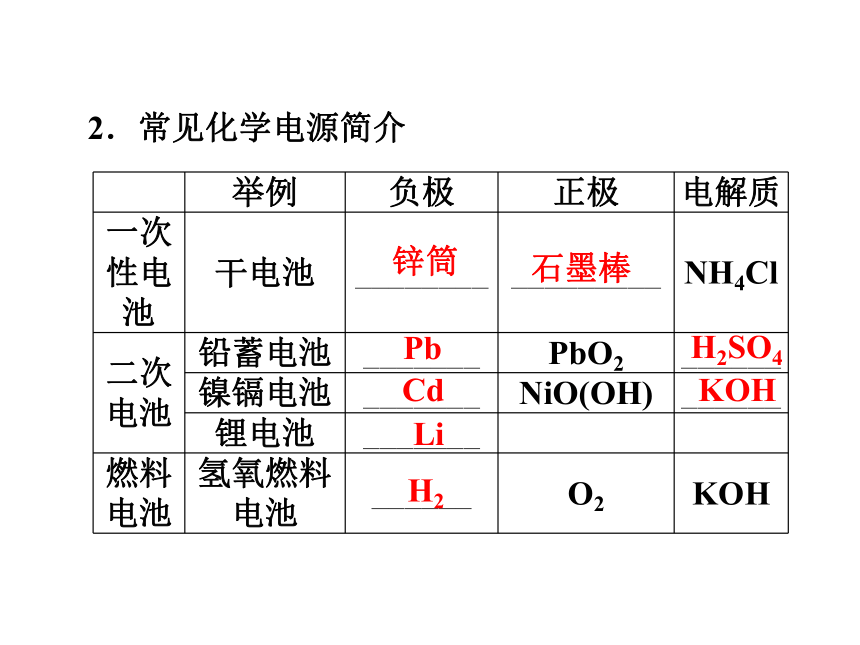
1.分类
(1)____________ :放电之后不能充电。
(2)二次电池(又称充电电池):放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。
化学能 电能
(3)____________ :燃料和氧气分别在两个电极上反应将化学能转化为电能。一次性电池燃料电池2.常见化学电源简介锌筒石墨棒PbH2SO4CdKOHLiH21.关于原电池的叙述中正确的是( )
A.构成原电池的必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.原电池工作时总是负极溶解,正极上有物质生成
D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原
答案:B2.(2011年株洲高一检测)原电池的电极反应不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( )
A.由Al、Cu、稀硫酸组成原电池,其负极反应式:Al-3e-===Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式:Al-3e-+4OH-===AlO+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式:Cu-2e-===Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式:Cu-2e-===Cu2+解析:选C。本题考查原电池中的电极反应。A项,铝比铜活泼,且可与稀硫酸反应,所以铝作负极,正确;B项,Mg和Al在NaOH溶液中,只有Al与其反应,故Al为负极,正确;C项,Fe比Cu活泼,故Fe先于Cu与Fe3+反应而作负极,故错;D项,Al虽比Cu活泼,但由于其遇浓硝酸钝化,故Cu作负极,正确。3.下列事实不能说明Al的金属活泼性比Cu强的是( )
A.常温下将铝投入CuSO4溶液中
B.常温下将铝和铜用导线连接一起放入到稀盐酸溶液中
C.常温下将铝和铜不用导线连接一起放入到稀盐酸溶液中
D.常温下将铝和铜用导线连接一起放入到氢氧化钠溶液中
解析:选D。在氢氧化钠溶液中能反应生成气体的金属,其活泼性不一定强,如Mg和Al。课堂互动讲练特别提醒:在判断原电池正、负极时,不要只根据金属活泼性的相对强弱,有时还和电解质溶液有关,如Mg?Al和NaOH溶液构成的原电池中,由于Mg不与NaOH溶液反应,虽金属性Mg>Al,但在该条件下却是Al作负极。因此要根据具体情况来判断正、负极。 (2011年孝感高一检测)如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,在卡片上,描述合理的是( )
No:28 Date:2011.7.28
实验后的记录:
①Zn为正极,Cu为负极。
②H+向负极移动。③电子流动方向,从Zn经外电路流向Cu。
④Cu极上有H2产生。
⑤若有1 mol电子流过导线,则产生H2为0.5 mol。
⑥正极的电极反应式为:Zn-2e-===Zn2+。
A.①②③
B.③④⑤
C.④⑤⑥
D.②③④【答案】 B变式训练1 如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为稀硫酸
B.b为负极,是铁片,烧杯中
的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中
的溶液为稀硫酸
D.b为正极,是碳棒,烧杯中
的溶液为硫酸铜溶液解析:选C。由题给信息“电流表指针发生偏转”,可确定该装置构成了原电池。又因“a极有大量气泡生成”,可知:a为正极(碳棒),则b为负极(铁片),即可确定烧杯中的溶液是稀硫酸。1.比较金属的活动性强弱
(1)原理:一般原电池中活动性较强的金属作负极,活动性较弱的金属作正极。
(2)应用:A、B两种金属用导线连接后插入稀H2SO4中,若A极溶解,B极上冒气泡,则活动性:A>B。2.加快化学反应的进行
(1)原理:在原电池中,氧化反应和还原反应分别在两极进行,溶液中的粒子运动时相互间的干扰小,使化学反应加快。
(2)应用:实验室中用Zn和稀H2SO4制取H2时,通常滴入几滴CuSO4溶液。原因是Zn与置换出的Cu构成原电池,加快了反应的进行。3.原电池的设计
以Zn+H2SO4===ZnSO4+H2↑为例说明
(1)电极反应
①依据:负极反应为:还原剂-ne-===氧化产物
正极反应为:氧化剂+ne-===还原产物
②实例:负极反应为:Zn-2e-===Zn2+
正极反应为:2H++2e-===H2↑(2)电极材料及电解质
①负极:Zn
②正极:Cu或C(比Zn的活泼性差的金属或导电的非金属)
③电解质:稀H2SO4
(3)装置图特别提醒:在设计原电池时,若给出的是离子反应方程式,如:Fe+Cu2+===Cu+Fe2+,此时电解质不确定为具体的物质,只要是可溶性铜盐即可,如CuCl2、CuSO4等。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:_____________________________________
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图,标出正、负极,并写出电极反应式。
?正极反应________________________________________________________________________;
负极反应________________________________________________________________________。【解析】 首先分析Fe3+与Cu的反应中的氧化剂、还原剂,然后依据原电池原理,再设计成原电池。依据反应:2Fe3++Cu===2Fe2++Cu2+,Cu失电子,应为原电池的负极,正极材料选用比铜不活泼的碳棒或铂丝均可,电解质溶液选用FeCl3溶液。【答案】 (1)2Fe3++Cu===2Fe2++Cu2+
(2)装置图
2Fe3++2e-===2Fe2+
Cu-2e-===Cu2+
【误区警示】 学生在画原电池装置图时易出现以下几种错误:
(1)未用虚线画出烧杯中所盛放电解质溶液。
(2)未用导线将两电极连接起来。
(3)未指明:①正、负极及其材料;②电解质溶液。变式训练2 (2011年黄石高一检测)如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细。下表所列M、N、P物质中,可以组合成该装置的是( )解析:选C。M棒变粗,N棒变细,说明N棒是负极,相对M棒金属活泼性更强。M棒变粗说明M棒上有金属析出。1.电极反应式的书写
(1)根据原电池的装置书写
①负极
若负极材料本身被氧化,其电极反应式有两种情况:一种是负极金属失电子后生成的金属阳离子不与电解质溶液的成分反应,此时的电极反应可表示为M-ne-===Mn+。若负极材料本身不反应, 如燃料电池,在书写负极反应式时,要将燃料失电子的反应及其产物与电解质溶液中的反应叠加在一起书写,如H2-O2(KOH溶液)电池的负极反应为H2+2OH--2e-===2H2O。
②正极
首先判断在正极发生反应的物质。当负极材料与电解质溶液能发生自发的化学反应时,在正极上发生电极反应的物质是电解质溶液中的某种微粒;当负极材料与电解质溶液不能发生自发的化学反应时,在正极上发生反应的物质是溶解在电解质溶液中的O2。然后再根据具体情况写出正极反应式,在书写时也要考虑正极反应产物是否与电解质溶液反应的问题,若反应也要书写叠加后的反应式。
(2)根据原电池反应书写电极反应式
①找出发生氧化反应和还原反应的物质,确定正、负极产物。②利用电荷守恒分别写出电极反应式。
③验证:两电极反应式相加所得式子和原化学方程式相同,则书写正确。
2.原电池反应式的书写
将两电极反应式相加即得原电池反应式,要使两电极反应式得失电子数相等。 锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。某种锂电池的总反应式为Li+MnO2===LiMnO2,下列说法正确的是( )
A.Li是正极,电极反应为Li-e-===Li+
B.Li是负极,电极反应为Li-e-===Li+
C.MnO2是负极,电极反应为MnO2+e-===MnO
D.Li是负极,电极反应为Li-2e-===Li2+【思路点拨】 解答此题要注意以下两点:
(1)根据化合价判断正、负极;
(2)根据电极材料写电极反应方程式。【答案】 B
【规律方法】 电极方程式判断方法
(1)首先判断反应类型是否正确,即负极应该失电子发生氧化反应,正极应该得电子发生还原反应;
(2)确认电极得失电子后的产物是否与电解质溶液发生反应,若能反应,则应写与电解质溶液反应后的方程式。
变式训练3 (2011年北京东城区高一检测)
燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )
A.a极是负极,该电极上发生氧化反应
B.b极反应是O2+4OH--4e-===2H2O
C.总反应方程式为2H2+O2===2H2O
D.氢氧燃料电池是一种
具有应用前景的绿色电源解析:选B。a极通H2为负极,电极反应为2H2+4OH--4e-===4H2O发生氧化反应;b极通O2为正极,电极反应为O2+2H2O+4e-===4OH-,B项不正确;正负极电极反应式相加得总反应式为2H2+O2===2H2O;氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应用前景的绿色电源。探究整合应用实验目的:利用所学知识,设计电池装置。
实验用品:电极、镁条、铜片、铁片等。
电解质:果汁(橙汁、苹果汁、柠檬汁等)。
其他:导线、金属夹、发光二极管、500 mL烧杯。
实验方案:①Cu-Mg原电池、电解质溶液为橙汁;
②Cu-Fe原电池,电解质溶液为苹果汁;
③Fe-Mg原电池,电解质溶液为柠檬汁。实验操作:用导线分别将三种方案中的金属片连接到金属夹上,分别将金属片两两插入到盛有果汁的三个500 mL的烧杯中,
用发光二极管两端分别接触三种
方案中金属活动性不同的金属夹。
观察现象,连接方式如图所示。
实验现象:三种方案中发光二极管均发光。
实验结论:原电池把化学能转变为电能。回答问题:
(1)连接装置时活泼金属接二极管的________极上,较不活泼金属接二极管的________极上。
(2)在方案①、②中铜作电极情况_______________________________________。
(3)在方案①、③中镁作电极情况_______________________________________。
(4)在方案②、③中铁作电极情况_______________________________________。(5)在方案③中负极反应为______________,正极反应为________,总反应方程式为______________________。
【解析】 在原电池中较活泼金属作负极(连接二极管的负极),较不活泼金属作正极(连接二极管的正极)。因金属活泼性:Mg>Fe>Cu,故方案①、②中Cu均作正极,①、③中Mg均作负极,方案②中铁作负极,方案③中铁作正极。在方案③中负极反应为Mg-2e-===Mg2+,正极反应为2H++2e-===H2↑,总电池方程式为Mg+2H+===Mg2++H2↑。【答案】 (1)负 正
(2)Cu均作正极
(3)镁均作负极
(4)方案②中铁作负极,方案③中铁作正极
(5)Mg-2e-===Mg2+ 2H++2e-===H2↑
Mg+2H+===Mg2++H2↑知能优化训练本部分内容讲解结束点此进入课件目录按ESC键退出全屏播放谢谢使用
1.一次能源
直接从自然界中取得的能源,如流水、风力、_______、__________、石油等。
2.二次能源
一次能源经加工、转换得到的能源,如电力、蒸汽等。原煤天然气二、化学能转化为电能
1.燃煤发电的能量转化
(2)________ (氧化还原反应)是使化学能转换为电能的关键。
2.原电池
热机械燃烧(1)原电池概念:将________能转变为_____能的装置。
(2)铜锌原电池工作原理化学电氧化还原总电池反应:_________________________。
(3)反应本质:原电池反应的本质是
____________________。
(4)构成原电池的条件
理论上,自发的_____________反应均可设计成原电池。Zn+2H+===Zn2++H2↑氧化还原反应氧化还原电解质思考感悟
原电池是如何构成闭合回路的?(请从电子流向和离子移动方向分析)
【提示】 在外电路,电子从负极流出经导线流向正极,在电解质溶液中,阳离子向正极移动,阴离子向负极移动。三、发展中的化学电源
1.分类
(1)____________ :放电之后不能充电。
(2)二次电池(又称充电电池):放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。
化学能 电能
(3)____________ :燃料和氧气分别在两个电极上反应将化学能转化为电能。一次性电池燃料电池2.常见化学电源简介锌筒石墨棒PbH2SO4CdKOHLiH21.关于原电池的叙述中正确的是( )
A.构成原电池的必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.原电池工作时总是负极溶解,正极上有物质生成
D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原
答案:B2.(2011年株洲高一检测)原电池的电极反应不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( )
A.由Al、Cu、稀硫酸组成原电池,其负极反应式:Al-3e-===Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式:Al-3e-+4OH-===AlO+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式:Cu-2e-===Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式:Cu-2e-===Cu2+解析:选C。本题考查原电池中的电极反应。A项,铝比铜活泼,且可与稀硫酸反应,所以铝作负极,正确;B项,Mg和Al在NaOH溶液中,只有Al与其反应,故Al为负极,正确;C项,Fe比Cu活泼,故Fe先于Cu与Fe3+反应而作负极,故错;D项,Al虽比Cu活泼,但由于其遇浓硝酸钝化,故Cu作负极,正确。3.下列事实不能说明Al的金属活泼性比Cu强的是( )
A.常温下将铝投入CuSO4溶液中
B.常温下将铝和铜用导线连接一起放入到稀盐酸溶液中
C.常温下将铝和铜不用导线连接一起放入到稀盐酸溶液中
D.常温下将铝和铜用导线连接一起放入到氢氧化钠溶液中
解析:选D。在氢氧化钠溶液中能反应生成气体的金属,其活泼性不一定强,如Mg和Al。课堂互动讲练特别提醒:在判断原电池正、负极时,不要只根据金属活泼性的相对强弱,有时还和电解质溶液有关,如Mg?Al和NaOH溶液构成的原电池中,由于Mg不与NaOH溶液反应,虽金属性Mg>Al,但在该条件下却是Al作负极。因此要根据具体情况来判断正、负极。 (2011年孝感高一检测)如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,在卡片上,描述合理的是( )
No:28 Date:2011.7.28
实验后的记录:
①Zn为正极,Cu为负极。
②H+向负极移动。③电子流动方向,从Zn经外电路流向Cu。
④Cu极上有H2产生。
⑤若有1 mol电子流过导线,则产生H2为0.5 mol。
⑥正极的电极反应式为:Zn-2e-===Zn2+。
A.①②③
B.③④⑤
C.④⑤⑥
D.②③④【答案】 B变式训练1 如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为稀硫酸
B.b为负极,是铁片,烧杯中
的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中
的溶液为稀硫酸
D.b为正极,是碳棒,烧杯中
的溶液为硫酸铜溶液解析:选C。由题给信息“电流表指针发生偏转”,可确定该装置构成了原电池。又因“a极有大量气泡生成”,可知:a为正极(碳棒),则b为负极(铁片),即可确定烧杯中的溶液是稀硫酸。1.比较金属的活动性强弱
(1)原理:一般原电池中活动性较强的金属作负极,活动性较弱的金属作正极。
(2)应用:A、B两种金属用导线连接后插入稀H2SO4中,若A极溶解,B极上冒气泡,则活动性:A>B。2.加快化学反应的进行
(1)原理:在原电池中,氧化反应和还原反应分别在两极进行,溶液中的粒子运动时相互间的干扰小,使化学反应加快。
(2)应用:实验室中用Zn和稀H2SO4制取H2时,通常滴入几滴CuSO4溶液。原因是Zn与置换出的Cu构成原电池,加快了反应的进行。3.原电池的设计
以Zn+H2SO4===ZnSO4+H2↑为例说明
(1)电极反应
①依据:负极反应为:还原剂-ne-===氧化产物
正极反应为:氧化剂+ne-===还原产物
②实例:负极反应为:Zn-2e-===Zn2+
正极反应为:2H++2e-===H2↑(2)电极材料及电解质
①负极:Zn
②正极:Cu或C(比Zn的活泼性差的金属或导电的非金属)
③电解质:稀H2SO4
(3)装置图特别提醒:在设计原电池时,若给出的是离子反应方程式,如:Fe+Cu2+===Cu+Fe2+,此时电解质不确定为具体的物质,只要是可溶性铜盐即可,如CuCl2、CuSO4等。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:_____________________________________
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图,标出正、负极,并写出电极反应式。
?正极反应________________________________________________________________________;
负极反应________________________________________________________________________。【解析】 首先分析Fe3+与Cu的反应中的氧化剂、还原剂,然后依据原电池原理,再设计成原电池。依据反应:2Fe3++Cu===2Fe2++Cu2+,Cu失电子,应为原电池的负极,正极材料选用比铜不活泼的碳棒或铂丝均可,电解质溶液选用FeCl3溶液。【答案】 (1)2Fe3++Cu===2Fe2++Cu2+
(2)装置图
2Fe3++2e-===2Fe2+
Cu-2e-===Cu2+
【误区警示】 学生在画原电池装置图时易出现以下几种错误:
(1)未用虚线画出烧杯中所盛放电解质溶液。
(2)未用导线将两电极连接起来。
(3)未指明:①正、负极及其材料;②电解质溶液。变式训练2 (2011年黄石高一检测)如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细。下表所列M、N、P物质中,可以组合成该装置的是( )解析:选C。M棒变粗,N棒变细,说明N棒是负极,相对M棒金属活泼性更强。M棒变粗说明M棒上有金属析出。1.电极反应式的书写
(1)根据原电池的装置书写
①负极
若负极材料本身被氧化,其电极反应式有两种情况:一种是负极金属失电子后生成的金属阳离子不与电解质溶液的成分反应,此时的电极反应可表示为M-ne-===Mn+。若负极材料本身不反应, 如燃料电池,在书写负极反应式时,要将燃料失电子的反应及其产物与电解质溶液中的反应叠加在一起书写,如H2-O2(KOH溶液)电池的负极反应为H2+2OH--2e-===2H2O。
②正极
首先判断在正极发生反应的物质。当负极材料与电解质溶液能发生自发的化学反应时,在正极上发生电极反应的物质是电解质溶液中的某种微粒;当负极材料与电解质溶液不能发生自发的化学反应时,在正极上发生反应的物质是溶解在电解质溶液中的O2。然后再根据具体情况写出正极反应式,在书写时也要考虑正极反应产物是否与电解质溶液反应的问题,若反应也要书写叠加后的反应式。
(2)根据原电池反应书写电极反应式
①找出发生氧化反应和还原反应的物质,确定正、负极产物。②利用电荷守恒分别写出电极反应式。
③验证:两电极反应式相加所得式子和原化学方程式相同,则书写正确。
2.原电池反应式的书写
将两电极反应式相加即得原电池反应式,要使两电极反应式得失电子数相等。 锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。某种锂电池的总反应式为Li+MnO2===LiMnO2,下列说法正确的是( )
A.Li是正极,电极反应为Li-e-===Li+
B.Li是负极,电极反应为Li-e-===Li+
C.MnO2是负极,电极反应为MnO2+e-===MnO
D.Li是负极,电极反应为Li-2e-===Li2+【思路点拨】 解答此题要注意以下两点:
(1)根据化合价判断正、负极;
(2)根据电极材料写电极反应方程式。【答案】 B
【规律方法】 电极方程式判断方法
(1)首先判断反应类型是否正确,即负极应该失电子发生氧化反应,正极应该得电子发生还原反应;
(2)确认电极得失电子后的产物是否与电解质溶液发生反应,若能反应,则应写与电解质溶液反应后的方程式。
变式训练3 (2011年北京东城区高一检测)
燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )
A.a极是负极,该电极上发生氧化反应
B.b极反应是O2+4OH--4e-===2H2O
C.总反应方程式为2H2+O2===2H2O
D.氢氧燃料电池是一种
具有应用前景的绿色电源解析:选B。a极通H2为负极,电极反应为2H2+4OH--4e-===4H2O发生氧化反应;b极通O2为正极,电极反应为O2+2H2O+4e-===4OH-,B项不正确;正负极电极反应式相加得总反应式为2H2+O2===2H2O;氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应用前景的绿色电源。探究整合应用实验目的:利用所学知识,设计电池装置。
实验用品:电极、镁条、铜片、铁片等。
电解质:果汁(橙汁、苹果汁、柠檬汁等)。
其他:导线、金属夹、发光二极管、500 mL烧杯。
实验方案:①Cu-Mg原电池、电解质溶液为橙汁;
②Cu-Fe原电池,电解质溶液为苹果汁;
③Fe-Mg原电池,电解质溶液为柠檬汁。实验操作:用导线分别将三种方案中的金属片连接到金属夹上,分别将金属片两两插入到盛有果汁的三个500 mL的烧杯中,
用发光二极管两端分别接触三种
方案中金属活动性不同的金属夹。
观察现象,连接方式如图所示。
实验现象:三种方案中发光二极管均发光。
实验结论:原电池把化学能转变为电能。回答问题:
(1)连接装置时活泼金属接二极管的________极上,较不活泼金属接二极管的________极上。
(2)在方案①、②中铜作电极情况_______________________________________。
(3)在方案①、③中镁作电极情况_______________________________________。
(4)在方案②、③中铁作电极情况_______________________________________。(5)在方案③中负极反应为______________,正极反应为________,总反应方程式为______________________。
【解析】 在原电池中较活泼金属作负极(连接二极管的负极),较不活泼金属作正极(连接二极管的正极)。因金属活泼性:Mg>Fe>Cu,故方案①、②中Cu均作正极,①、③中Mg均作负极,方案②中铁作负极,方案③中铁作正极。在方案③中负极反应为Mg-2e-===Mg2+,正极反应为2H++2e-===H2↑,总电池方程式为Mg+2H+===Mg2++H2↑。【答案】 (1)负 正
(2)Cu均作正极
(3)镁均作负极
(4)方案②中铁作负极,方案③中铁作正极
(5)Mg-2e-===Mg2+ 2H++2e-===H2↑
Mg+2H+===Mg2++H2↑知能优化训练本部分内容讲解结束点此进入课件目录按ESC键退出全屏播放谢谢使用
