人教版 A版(2019) 高中化学选择性必修一 第二章 化学反应速率与化学平衡第二节 化学平衡 第2课时 化学平衡常数 教学设计1
文档属性
| 名称 | 人教版 A版(2019) 高中化学选择性必修一 第二章 化学反应速率与化学平衡第二节 化学平衡 第2课时 化学平衡常数 教学设计1 |

|
|
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-13 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第二节 化学平衡
第2课时 化学平衡常数
教学目标
1.知道化学平衡常数的含义。
2.能书写平衡常数表达式,能进行化学平衡常数、转化率的简单计算。
3.通过化学平衡常数对化学平衡进行“定量”计算和判断化学反应进行的方向。
评价目标
1.通过化学平衡常数的学习,检验学生对数据处理的能力及归纳能力。
2.通过课堂评价反馈的训练,检测学生对化学平衡常数及计算的掌握情况。
重点、难点
重点:化学平衡常数。
难点:化学平衡常数的相关计算。
教法、学法
小组讨论。
课时安排
1课时。
教学准备
学案、多媒体课件。
一、新课导入
【设疑】核对课前复习答案,思考对于可逆反应,达到平衡时有哪些标志 你还能从哪些方面定量地描述反应进行的程度 可以通过哪些量判断化学反应平衡与否呢
二、新课讲授
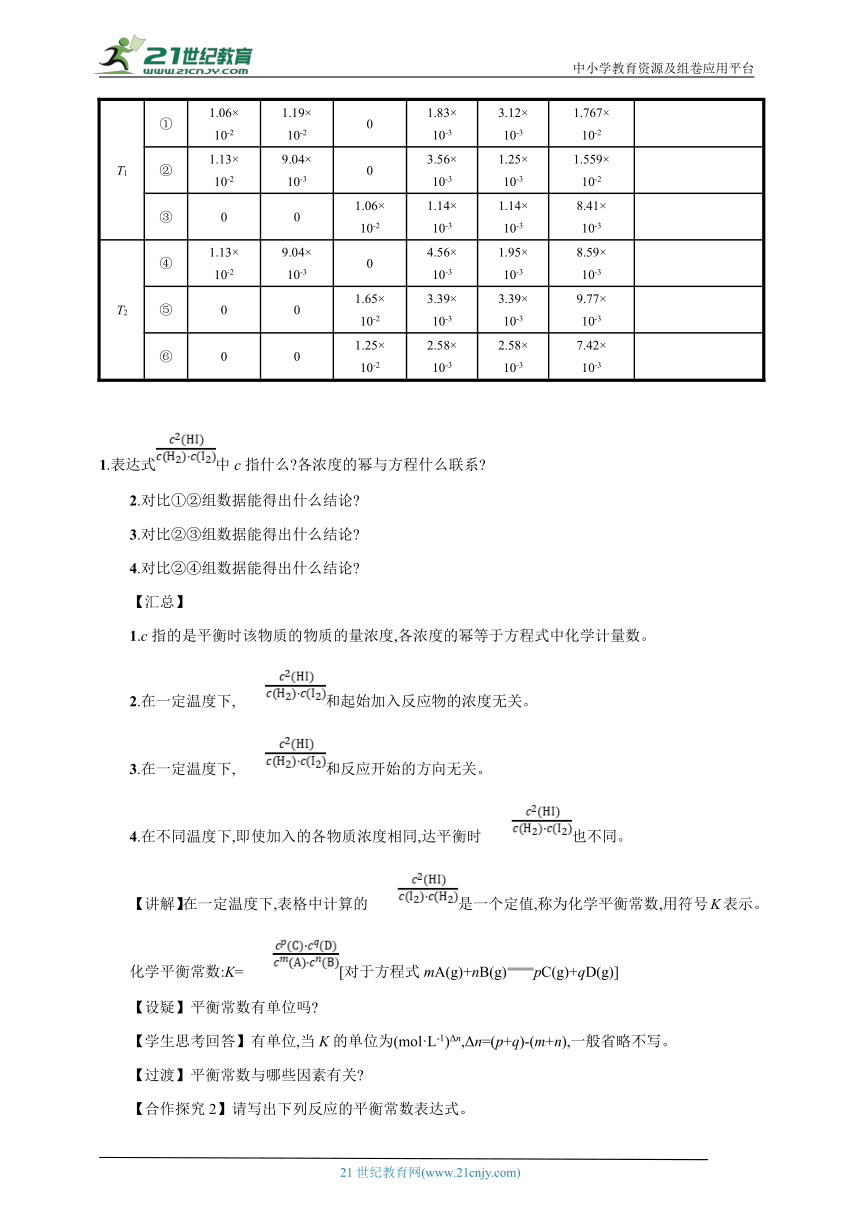
【合作探究1】已知:在T1(698.6 ℃)和T2(798.6 ℃)时,对反应H2(g)+I2(g)2HI(g)有如下数据,请计算完成填空:
【学生思考、交流】
温度T 序号
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI)
T1 ① 1.06×10-2 1.19×10-2 0 1.83×10-3 3.12×10-3 1.767×10-2
② 1.13×10-2 9.04×10-3 0 3.56×10-3 1.25×10-3 1.559×10-2
③ 0 0 1.06×10-2 1.14×10-3 1.14×10-3 8.41×10-3
T2 ④ 1.13×10-2 9.04×10-3 0 4.56×10-3 1.95×10-3 8.59×10-3
⑤ 0 0 1.65×10-2 3.39×10-3 3.39×10-3 9.77×10-3
⑥ 0 0 1.25×10-2 2.58×10-3 2.58×10-3 7.42×10-3
1.表达式中c指什么 各浓度的幂与方程什么联系
2.对比①②组数据能得出什么结论
3.对比②③组数据能得出什么结论
4.对比②④组数据能得出什么结论
【汇总】
1.c指的是平衡时该物质的物质的量浓度,各浓度的幂等于方程式中化学计量数。
2.在一定温度下,和起始加入反应物的浓度无关。
3.在一定温度下,和反应开始的方向无关。
4.在不同温度下,即使加入的各物质浓度相同,达平衡时也不同。
【讲解】在一定温度下,表格中计算的是一个定值,称为化学平衡常数,用符号K表示。
化学平衡常数:K=[对于方程式mA(g)+nB(g)pC(g)+qD(g)]
【设疑】平衡常数有单位吗
【学生思考回答】有单位,当K的单位为(mol·L-1)Δn,Δn=(p+q)-(m+n),一般省略不写。
【过渡】平衡常数与哪些因素有关
【合作探究2】请写出下列反应的平衡常数表达式。
①N2(g)+H2(g)NH3(g) ②N2(g)+3H2(g)2NH3(g)
③2NH3(g)N2(g)+3H2(g) ④FeO(s)+CO(g)Fe(s)+CO2(g)
⑤AgCl(s)Ag+(aq)+Cl-(aq) ⑥N(aq)+H2O(l)NH3·H2O(aq)+H+(aq)
【学生思考、交流】
1.对比①②的方程式与K的表达式,你能发现什么规律
2.对比②③的方程式与K的表达式,你能发现什么规律
3.书写④⑤⑥的K的表达式时应注意什么问题
【汇总】
① ②
③ ④ ⑤c(Ag+)·c(Cl-)
⑥
1.当化学计量数变为原来2倍时,平衡常数变为原来的平方。
2.正、逆反应的平衡常数互为倒数。
3.固体和纯液体的浓度不列入平衡常数表达式。
【归纳总结】
1.纯液体和固体的浓度是常数,不列入平衡常数表达式中。
2.当计量数变为原来的a倍时,K变为原来的a次方。
3.正、逆反应的K互为倒数。
【过渡】平衡常数有什么意义和应用呢
【合作探究3】根据你已有知识判断下列三个反应的进行程度(填“完全反应”“反应不完全”或“几乎不反应”)。
化学反应 反应程度 K(某温度)
1 mol氢气与1 mol氯气反应生成氯化氢 9.7×1012
氯化氢分解生成1 mol氢气与1 mol氯气 1.03×10-13
1 mol氢气与1 mol I2(g)反应生成碘化氢 43
思考:反应程度与K之间有什么联系
【归纳总结】
平衡常数可以定量的衡量化学反应进行的程度:
(1)K值越大,表示反应进行的程度越大,反应物的转化率也越大。
(2)一般当K>105时,该反应进行得基本完全。
【合作探究4】例题1:在某温度下,将含有H2和I2各0.10 mol 的气态混合物充入容积为10 L的密闭容器中,充分反应并达到平衡后,测得c(H2)=0.008 0 mol·L-1。
(1)计算该反应的平衡常数。
(2)在上述温度下,若起始时向该容器中通入H2和I2(g)各0.20 mol,试求达到化学平衡时各物质的浓度。
拓展:(2)中,反应一段时间后,测得c(H2)=0.018 0 mol·L-1,c(I2)=0.018 0 mol·L-1,c(HI)=0.004 0 mol·L-1,试判断此时反应是否平衡。若不平衡,反应在向哪个方向进行 说出你的判断理由。
【学生活动】尝试解决例1(1)(2)。
【讲解】
解:(1)依题意可知,平衡时c(H2)=0.008 0 mol·L-1,消耗c(H2)=0.002 0 mol·L-1,生成c(HI)=0.004 0 mol·L-1
H2(g) + I2(g) 2HI(g)
0.010 0.010 0
0.002 0 0.002 0 0.004 0
0.008 0 0.008 0 0.004 0
K==0.25
(2)依题意可知,起始时c(H2)=0.020 mol·L-1,c(I2)=0.020 mol·L-1。
设:H2的变化浓度为x mol·L-1。则:
H2(g) + I2(g) 2HI(g)
0.020 0.020 0
x x 2x
0.020-x 0.020-x 2x
K只随温度发生变化,因此:
K==0.25
解得:x=0.004 0
平衡时:c(H2)=c(I2)=0.016 mol·L-1,c(HI)=0.080 mol·L-1
拓展:
解:Q==0.049 4因为任何反应都是趋向于平衡的,现在Q【归纳总结】
1.浓度商
(1)概念:对于一般的可逆反应,如mA(g)+nB(g)pC(g)+qD(g),在任意时刻的称为浓度商,常用Q表示。
(2)使用范围:任意时刻的可逆反应(固体或液体纯物质一般不列入浓度商)。
(3)表示方法:Q=
2.平衡常数应用——判断反应进行的方向
(1)当Q=K时,反应处于平衡状态;
(2)当Q(3)当Q>K时,反应向逆反应方向进行。
3.关于平衡常数的计算
化学平衡的计算模式可采取“三段式”的方式,依题意,列出化学方程式,并计算。“三段式法”是有效解答化学平衡计算题的“万能钥匙”。
(1)计算步骤:
书写—写出有关反应的化学方程式。
|
标示—标示出各物质的起始量、转化量、平衡量。
|
计算—根据已知条件列式计算,注意单位统一。
(2)具体方法:
可按下列模式进行计算:如mA(g)+nB(g)pC(g)+qD(g),令A、B的起始物质的量浓度分别为a mol·L-1、b mol·L-1,达到平衡后消耗A的物质的量浓度为mx mol·L-1。
mA(g)+nB(g)pC(g)+qD(g)
起始/(mol·L-1) a b 0 0
变化/(mol·L-1) mx nx px qx
平衡/(mol·L-1) a-mx b-nx px qx
K=
【学生活动】尝试解答课本例题2,师生共同订正。
1.电石(主要成分为CaC2)是重要的基本化工原料。已知2 000 ℃时,电石的生产原理如下:
①CaO(s)+C(s)Ca(g)+CO(g) ΔH1=a kJ·mol-1,平衡常数为K1
②Ca(g)+2C(s)CaC2(s) ΔH2=b kJ·mol-1,平衡常数为K2
下列说法不正确的是( )
A.反应①K1=c(Ca)·c(CO)
B.反应Ca(g)+C(s)CaC(s)的平衡常数K=
C.2 000 ℃时,增大压强,K1减小,K2增大
D.反应2CaO(s)+CaC2(s)3Ca(g)+2CO(g) ΔH=(2a-b)kJ·mol-1
答案 C
解析 由CaO(s)+C(s)Ca(g)+CO(g)可知,K1=c(Ca)·c(CO),A正确;反应Ca(g)+2C(s)CaC2(s)与Ca(g)+C(s)CaC2(s)的化学计量数为倍数关系,则K为指数关系,则反应Ca(g)+C(s)CaC2(s)的平衡常数K=,B正确;K只与温度有关,则2 000 ℃时增大压强,K1、K2均不变,C错误;由①CaO(s)+C(s)Ca(g)+CO(g),②Ca(g)+2C(s)CaC2(s),结合盖斯定律可知①×2-②得2CaO(s)+CaC2(s)3Ca(g)+2CO(g),其ΔH=(2a-b)kJ·mol-1,D正确。
2.向300 mL恒容密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表。下列说法不正确的是( )
温度/℃ 25 80 230
平衡常数 5×104 2
A.上述反应为放热反应
B.在25 ℃时,反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数K为2×10-5
C.在80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正D.在80 ℃达到平衡时,继续充入一定量的Ni(CO)4气体,再次平衡后,CO的体积分数增大,平衡常数减小
答案 D
解析 A对,由图表数据分析,平衡常数随温度升高而减小,说明升高温度,平衡逆向进行,逆向是吸热反应,正向是放热反应。B对,25 ℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为反应Ni(s)+4CO(g)Ni(CO)4(g)平衡常数的倒数,为×10-4=2×10-5。C对,在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,Qc==8>2,故反应向逆反应方向进行,故v正3.在一定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ 700 800 830 1 000 1 200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 (填“吸热”或“放热”)反应。
答案 (1) (2)吸热
解析 (1)化学平衡常数为平衡时生成物浓度幂之积与反应物浓度幂之积的比值,即K=。(2)由表格中的数据可知,温度升高,平衡常数增大,则该反应为吸热反应。
体会化学平衡常数在生产、生活中的重要意义,通过练习掌握“三段式法”解题思路,并应用平衡常数解决生产中的简单计算。
化学平衡常数是定量解决化学平衡问题的重要依据。本节课给学生提供生产中的数据进行计算,让学生对化学平衡常数有感性认识。通过计算相同温度下不同投料量和不同温度下的平衡常数,进行对比,归纳平衡常数的特点,使学生从计算中得到结论,通过学习的成就感激发学生的学习动力。在课堂教学中在教学方法上要充分调动学生通过数据来获取结论,可采用讲授与讨论相结合的方法进行,在该过程中要注意对学生的启发和引导。
第二节 化学平衡
第2课时 化学平衡常数
1.浓度商:Q=
2.平衡常数:K= K>105,反应进行完全;K<10-5,反应很难进行。
3.平衡常数的应用——判断反应进行的方向
Q=K,处于平衡状态;
QQ>K,向逆反应方向进行。
4.关于平衡常数的计算——三段式法
mA(g)+nB(g)pC(g)+qD(g)
起始/(mol·L-1) a b 0 0
变化/(mol·L-1) mx nx px qx
平衡/(mol·L-1) a-mx b-nx px qx
K=
1.5 mL 0.1 mol·L-1 KI溶液与1 mL 0.1 mol·L-1 FeCl3溶液发生反应:2Fe3+(aq)+2I-(aq)2Fe2+(aq)+I2(aq),达到平衡。下列说法不正确的是( )
A.加入苯,振荡,平衡正向移动
B.经苯2次萃取分离后,在水溶液中加入KSCN,溶液呈血红色,表明该化学反应存在限度
C.加入FeSO4固体,平衡逆向移动
D.该反应的平衡常数K=
答案 D
解析 苯萃取溶液中的I2,使溶液中I2浓度减小,平衡向右移动,A项正确;经苯2次萃取后,加入KSCN,溶液呈血红色,说明反应不能进行彻底,B项正确;加入FeSO4固体,使Fe2+浓度增大,平衡逆向移动,C项正确。
2.一定温度下,在2 L的恒容密闭容器中发生反应A(g)+2B(g)3C(g)。反应过程中的部分数据如下表所示:
t/min n/mol
n(A) n(B) n(C)
0 2.0 2.4 0
5 0.9
10 1.6
15 1.6
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为0.09 mol·L-1·min-1
B.该反应在10 min后才达到平衡
C.平衡状态时,c(C)=0.6 mol·L-1
D.物质B的平衡转化率为20%
答案 C
解析 v(C)==0.09 mol·L-1·min-1,同一反应中反应速率之比等于计量数之比,3v(A)=v(C),所以v(A)=0.03 mol·L-1·min-1,A项错误;15 min时,n(B)=1.6 mol,消耗了2.4 mol-1.6 mol=0.8 mol,根据方程式可知这段时间内消耗A的物质的量为0.4 mol,所以15 min时,n(A)=1.6 mol,与10 min时A的物质的量相同,说明10~15 min这段时间内平衡没有移动,但无法确定是10 min时达到平衡,还是10 min前已经达到平衡,B项错误;根据B选项分析可知平衡时消耗的B为0.8 mol,根据方程式可知生成C的物质的量为1.2 mol,浓度为c(C)==0.6 mol·L-1,C项正确;物质B的平衡转化率为×100%≈33.3%,D项错误;故答案为C。
3.已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。起始反应物为N2和H2,物质的量之比为1∶3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中NH3的物质的量分数如下表:
压强 温度
400 ℃ 450 ℃ 500 ℃ 600 ℃
20 MPa时的压强 0.387 0.274 0.189 0.088
30 MPa时的压强 0.478 0.359 0.260 0.129
下列说法正确的是( )
A.体系中NH3的物质的量分数越大,则正反应速率越大
B.反应达到平衡时,N2和H2的转化率之比均为1
C.反应达到平衡时,放出的热量均为92.4 kJ
D.600 ℃、30 MPa下反应达到平衡时,生成NH3的物质的量最多
答案 B
解析 正反应速率与反应物的浓度有关,且反应物浓度越大正反应速率越大,而NH3是产物,故A错误;N2和H2的起始物质的量之比为1∶3,反应消耗的物质的量之比也是1∶3,故反应达到平衡时N2和H2的转化率相同,故B正确;当1 mol N2参与反应时放出的热量为92.4 kJ,而题目中没有确定参与反应的反应物的量,故C错误;由表格可知600 ℃、30 MPa下反应达到平衡时,NH3的物质的量分数相对于500 ℃、30 MPa时小,故D错误。
4.某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)3Z(g)平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1∶1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
答案 D
解析 运用三段式求算m。设转化的X的物质的量为n。
X(g)+mY(g)3Z(g)
起始/mol 1 2 0
转化/mol n mn 3n
平衡/mol (1-n) (2-mn) 3n
根据:(1-n)∶(2-mn)∶3n=30%∶60%∶10%
求得:n=0.1,m=2。
由m=2知,A项正确;由第二次平衡时,X、Y、Z的体积分数不变可知两次平衡所处温度相同,则B项正确;由m和n的数值及起始量可计算出X、Y二者的平衡转化率都为10%,C项正确;第二次平衡时,c(Z)==0.2 mol·L-1,D项错误。
5.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)COS(g)+H2(g) K=0.1
反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7 mol
D.CO的平衡转化率为80%
答案 C
解析 升高温度,H2S浓度增加,说明平衡向左移动,则正反应为放热反应,A项错误;通入CO,在恒容密闭容器中相当于增大反应物浓度,故正反应速率瞬间增大,然后又逐渐减小,B项错误;设反应前H2S的物质的量为x mol,则根据方程式得:K==0.1,解之得x=7,故C项正确;α(CO)=×100%=20%,D项错误。
6.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g)2ClNO(g) K2 ΔH2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min 时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 (填“>”“<”或“=”)α1,平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是 。
答案 (1)
(2)2.5×10-2 75% > 不变 升高温度
解析 (1)反应可用(Ⅰ)×2-(Ⅱ)得到,所以其平衡常数K=。(2)10 min内生成ClNO的物质的量为7.5×10-3 mol·L-1·min-1×10 min×2 L=0.15 mol,则需要参加反应的NO为0.15 mol,消耗Cl2的物质的量为0.075 mol,所以平衡后n(Cl2)=0.1 mol-0.075 mol=0.025 mol,NO的转化率α1=×100%=75%;由于反应是个气体体积减小的反应,因此反应(Ⅱ)在恒压条件下进行可看作由恒容条件下的平衡通过增大压强来实现,增大压强时反应(Ⅱ)的平衡向右移动,NO的转化率增大,所以α2>α1;平衡常数只受温度影响,温度不变,平衡常数不变;因该反应的正反应方向为放热反应,故升高温度,平衡向左移动,放热反应的平衡常数将减小。
7.由γ-羟基丁酸生成γ-丁内酯的反应如下:
在298 K下,γ-羟基丁酸水溶液的初始浓度为0.180 mol·L-1,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
t/min 21 50 80 100 120 160 220 ∞
c/(mol·L-1) 0.024 0.050 0.071 0.081 0.090 0.104 0.116 0.132
(1)该反应在50~80 min内的平均反应速率为 mol·L-1·min-1。
(2)120 min时γ-羟基丁酸的转化率为 。
(3)298 K时该反应的平衡常数K= 。
(4)为提高γ-羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是 。
答案 (1)0.000 7 (2)0.5(50%) (3) (4)将γ-丁内酯移走
解析 (1)v==0.000 7 mol/(L·min)。(2)在120 min时反应产生的γ-丁内酯的物质的量浓度0.090 mol·L-1,则反应消耗的γ-羟基丁酸的浓度为0.090 mol·L-1,由于反应开始时γ-羟基丁酸的浓度0.180 mol·L-1,所以γ-羟基丁酸的转化率为×100%=×100%=50%。(3)298 K的摄氏温度为25 ℃,水为液态,则此时该反应的平衡常数K=。(4)为提高γ-羟基丁酸的平衡转化率,使化学平衡正向移动,除适当控制反应温度外,还可采取的措施是及时分离出γ-丁内酯。
8.近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1= %,反应平衡常数K= 。
(2)在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2 α1,该反应的ΔH 0(填“>”“<”或“=”)。
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是 (填标号)。
A.H2S B.CO2 C.COS D.N2
答案 (1)2.5 2.8×10-3 (2)> > (3)B
解析 (1)考查转化率和平衡常数,依据“三段式”解决。
设H2S转化了x mol
H2S(g)+CO2(g)COS(g)+H2O(g)
起始/mol 0.4 0.1
转化/mol x x x x
平衡/mol (0.4-x) (0.1-x) x x
由题意可知,平衡后水的物质的量分数为0.02,
即=0.02,x=0.01,
则α1(H2S)=×100%=2.5%。
平衡常数K==
=2.8×10-3。
(2)升高温度,平衡后水的物质的量分数增大,即平衡正向移动,则H2S的转化率增大。升高温度,平衡向吸热反应方向移动,则正反应为吸热反应,ΔH>0。
(3)增大反应物中一种物质的百分含量,其自身的转化率降低,而另外一种反应物的转化率增大,因此选B。加入COS时,平衡逆向移动,H2S的转化率减小;加入N2,平衡不移动,H2S的转化率不变。
教学分析
教学设计
评价反馈
课堂小结
布置作业
教学反思
板书设计
历年高考题荟萃
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
第二节 化学平衡
第2课时 化学平衡常数
教学目标
1.知道化学平衡常数的含义。
2.能书写平衡常数表达式,能进行化学平衡常数、转化率的简单计算。
3.通过化学平衡常数对化学平衡进行“定量”计算和判断化学反应进行的方向。
评价目标
1.通过化学平衡常数的学习,检验学生对数据处理的能力及归纳能力。
2.通过课堂评价反馈的训练,检测学生对化学平衡常数及计算的掌握情况。
重点、难点
重点:化学平衡常数。
难点:化学平衡常数的相关计算。
教法、学法
小组讨论。
课时安排
1课时。
教学准备
学案、多媒体课件。
一、新课导入
【设疑】核对课前复习答案,思考对于可逆反应,达到平衡时有哪些标志 你还能从哪些方面定量地描述反应进行的程度 可以通过哪些量判断化学反应平衡与否呢
二、新课讲授
【合作探究1】已知:在T1(698.6 ℃)和T2(798.6 ℃)时,对反应H2(g)+I2(g)2HI(g)有如下数据,请计算完成填空:
【学生思考、交流】
温度T 序号
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI)
T1 ① 1.06×10-2 1.19×10-2 0 1.83×10-3 3.12×10-3 1.767×10-2
② 1.13×10-2 9.04×10-3 0 3.56×10-3 1.25×10-3 1.559×10-2
③ 0 0 1.06×10-2 1.14×10-3 1.14×10-3 8.41×10-3
T2 ④ 1.13×10-2 9.04×10-3 0 4.56×10-3 1.95×10-3 8.59×10-3
⑤ 0 0 1.65×10-2 3.39×10-3 3.39×10-3 9.77×10-3
⑥ 0 0 1.25×10-2 2.58×10-3 2.58×10-3 7.42×10-3
1.表达式中c指什么 各浓度的幂与方程什么联系
2.对比①②组数据能得出什么结论
3.对比②③组数据能得出什么结论
4.对比②④组数据能得出什么结论
【汇总】
1.c指的是平衡时该物质的物质的量浓度,各浓度的幂等于方程式中化学计量数。
2.在一定温度下,和起始加入反应物的浓度无关。
3.在一定温度下,和反应开始的方向无关。
4.在不同温度下,即使加入的各物质浓度相同,达平衡时也不同。
【讲解】在一定温度下,表格中计算的是一个定值,称为化学平衡常数,用符号K表示。
化学平衡常数:K=[对于方程式mA(g)+nB(g)pC(g)+qD(g)]
【设疑】平衡常数有单位吗
【学生思考回答】有单位,当K的单位为(mol·L-1)Δn,Δn=(p+q)-(m+n),一般省略不写。
【过渡】平衡常数与哪些因素有关
【合作探究2】请写出下列反应的平衡常数表达式。
①N2(g)+H2(g)NH3(g) ②N2(g)+3H2(g)2NH3(g)
③2NH3(g)N2(g)+3H2(g) ④FeO(s)+CO(g)Fe(s)+CO2(g)
⑤AgCl(s)Ag+(aq)+Cl-(aq) ⑥N(aq)+H2O(l)NH3·H2O(aq)+H+(aq)
【学生思考、交流】
1.对比①②的方程式与K的表达式,你能发现什么规律
2.对比②③的方程式与K的表达式,你能发现什么规律
3.书写④⑤⑥的K的表达式时应注意什么问题
【汇总】
① ②
③ ④ ⑤c(Ag+)·c(Cl-)
⑥
1.当化学计量数变为原来2倍时,平衡常数变为原来的平方。
2.正、逆反应的平衡常数互为倒数。
3.固体和纯液体的浓度不列入平衡常数表达式。
【归纳总结】
1.纯液体和固体的浓度是常数,不列入平衡常数表达式中。
2.当计量数变为原来的a倍时,K变为原来的a次方。
3.正、逆反应的K互为倒数。
【过渡】平衡常数有什么意义和应用呢
【合作探究3】根据你已有知识判断下列三个反应的进行程度(填“完全反应”“反应不完全”或“几乎不反应”)。
化学反应 反应程度 K(某温度)
1 mol氢气与1 mol氯气反应生成氯化氢 9.7×1012
氯化氢分解生成1 mol氢气与1 mol氯气 1.03×10-13
1 mol氢气与1 mol I2(g)反应生成碘化氢 43
思考:反应程度与K之间有什么联系
【归纳总结】
平衡常数可以定量的衡量化学反应进行的程度:
(1)K值越大,表示反应进行的程度越大,反应物的转化率也越大。
(2)一般当K>105时,该反应进行得基本完全。
【合作探究4】例题1:在某温度下,将含有H2和I2各0.10 mol 的气态混合物充入容积为10 L的密闭容器中,充分反应并达到平衡后,测得c(H2)=0.008 0 mol·L-1。
(1)计算该反应的平衡常数。
(2)在上述温度下,若起始时向该容器中通入H2和I2(g)各0.20 mol,试求达到化学平衡时各物质的浓度。
拓展:(2)中,反应一段时间后,测得c(H2)=0.018 0 mol·L-1,c(I2)=0.018 0 mol·L-1,c(HI)=0.004 0 mol·L-1,试判断此时反应是否平衡。若不平衡,反应在向哪个方向进行 说出你的判断理由。
【学生活动】尝试解决例1(1)(2)。
【讲解】
解:(1)依题意可知,平衡时c(H2)=0.008 0 mol·L-1,消耗c(H2)=0.002 0 mol·L-1,生成c(HI)=0.004 0 mol·L-1
H2(g) + I2(g) 2HI(g)
0.010 0.010 0
0.002 0 0.002 0 0.004 0
0.008 0 0.008 0 0.004 0
K==0.25
(2)依题意可知,起始时c(H2)=0.020 mol·L-1,c(I2)=0.020 mol·L-1。
设:H2的变化浓度为x mol·L-1。则:
H2(g) + I2(g) 2HI(g)
0.020 0.020 0
x x 2x
0.020-x 0.020-x 2x
K只随温度发生变化,因此:
K==0.25
解得:x=0.004 0
平衡时:c(H2)=c(I2)=0.016 mol·L-1,c(HI)=0.080 mol·L-1
拓展:
解:Q==0.049 4
1.浓度商
(1)概念:对于一般的可逆反应,如mA(g)+nB(g)pC(g)+qD(g),在任意时刻的称为浓度商,常用Q表示。
(2)使用范围:任意时刻的可逆反应(固体或液体纯物质一般不列入浓度商)。
(3)表示方法:Q=
2.平衡常数应用——判断反应进行的方向
(1)当Q=K时,反应处于平衡状态;
(2)当Q
3.关于平衡常数的计算
化学平衡的计算模式可采取“三段式”的方式,依题意,列出化学方程式,并计算。“三段式法”是有效解答化学平衡计算题的“万能钥匙”。
(1)计算步骤:
书写—写出有关反应的化学方程式。
|
标示—标示出各物质的起始量、转化量、平衡量。
|
计算—根据已知条件列式计算,注意单位统一。
(2)具体方法:
可按下列模式进行计算:如mA(g)+nB(g)pC(g)+qD(g),令A、B的起始物质的量浓度分别为a mol·L-1、b mol·L-1,达到平衡后消耗A的物质的量浓度为mx mol·L-1。
mA(g)+nB(g)pC(g)+qD(g)
起始/(mol·L-1) a b 0 0
变化/(mol·L-1) mx nx px qx
平衡/(mol·L-1) a-mx b-nx px qx
K=
【学生活动】尝试解答课本例题2,师生共同订正。
1.电石(主要成分为CaC2)是重要的基本化工原料。已知2 000 ℃时,电石的生产原理如下:
①CaO(s)+C(s)Ca(g)+CO(g) ΔH1=a kJ·mol-1,平衡常数为K1
②Ca(g)+2C(s)CaC2(s) ΔH2=b kJ·mol-1,平衡常数为K2
下列说法不正确的是( )
A.反应①K1=c(Ca)·c(CO)
B.反应Ca(g)+C(s)CaC(s)的平衡常数K=
C.2 000 ℃时,增大压强,K1减小,K2增大
D.反应2CaO(s)+CaC2(s)3Ca(g)+2CO(g) ΔH=(2a-b)kJ·mol-1
答案 C
解析 由CaO(s)+C(s)Ca(g)+CO(g)可知,K1=c(Ca)·c(CO),A正确;反应Ca(g)+2C(s)CaC2(s)与Ca(g)+C(s)CaC2(s)的化学计量数为倍数关系,则K为指数关系,则反应Ca(g)+C(s)CaC2(s)的平衡常数K=,B正确;K只与温度有关,则2 000 ℃时增大压强,K1、K2均不变,C错误;由①CaO(s)+C(s)Ca(g)+CO(g),②Ca(g)+2C(s)CaC2(s),结合盖斯定律可知①×2-②得2CaO(s)+CaC2(s)3Ca(g)+2CO(g),其ΔH=(2a-b)kJ·mol-1,D正确。
2.向300 mL恒容密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表。下列说法不正确的是( )
温度/℃ 25 80 230
平衡常数 5×104 2
A.上述反应为放热反应
B.在25 ℃时,反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数K为2×10-5
C.在80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正
答案 D
解析 A对,由图表数据分析,平衡常数随温度升高而减小,说明升高温度,平衡逆向进行,逆向是吸热反应,正向是放热反应。B对,25 ℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为反应Ni(s)+4CO(g)Ni(CO)4(g)平衡常数的倒数,为×10-4=2×10-5。C对,在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,Qc==8>2,故反应向逆反应方向进行,故v正
CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ 700 800 830 1 000 1 200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 (填“吸热”或“放热”)反应。
答案 (1) (2)吸热
解析 (1)化学平衡常数为平衡时生成物浓度幂之积与反应物浓度幂之积的比值,即K=。(2)由表格中的数据可知,温度升高,平衡常数增大,则该反应为吸热反应。
体会化学平衡常数在生产、生活中的重要意义,通过练习掌握“三段式法”解题思路,并应用平衡常数解决生产中的简单计算。
化学平衡常数是定量解决化学平衡问题的重要依据。本节课给学生提供生产中的数据进行计算,让学生对化学平衡常数有感性认识。通过计算相同温度下不同投料量和不同温度下的平衡常数,进行对比,归纳平衡常数的特点,使学生从计算中得到结论,通过学习的成就感激发学生的学习动力。在课堂教学中在教学方法上要充分调动学生通过数据来获取结论,可采用讲授与讨论相结合的方法进行,在该过程中要注意对学生的启发和引导。
第二节 化学平衡
第2课时 化学平衡常数
1.浓度商:Q=
2.平衡常数:K= K>105,反应进行完全;K<10-5,反应很难进行。
3.平衡常数的应用——判断反应进行的方向
Q=K,处于平衡状态;
Q
4.关于平衡常数的计算——三段式法
mA(g)+nB(g)pC(g)+qD(g)
起始/(mol·L-1) a b 0 0
变化/(mol·L-1) mx nx px qx
平衡/(mol·L-1) a-mx b-nx px qx
K=
1.5 mL 0.1 mol·L-1 KI溶液与1 mL 0.1 mol·L-1 FeCl3溶液发生反应:2Fe3+(aq)+2I-(aq)2Fe2+(aq)+I2(aq),达到平衡。下列说法不正确的是( )
A.加入苯,振荡,平衡正向移动
B.经苯2次萃取分离后,在水溶液中加入KSCN,溶液呈血红色,表明该化学反应存在限度
C.加入FeSO4固体,平衡逆向移动
D.该反应的平衡常数K=
答案 D
解析 苯萃取溶液中的I2,使溶液中I2浓度减小,平衡向右移动,A项正确;经苯2次萃取后,加入KSCN,溶液呈血红色,说明反应不能进行彻底,B项正确;加入FeSO4固体,使Fe2+浓度增大,平衡逆向移动,C项正确。
2.一定温度下,在2 L的恒容密闭容器中发生反应A(g)+2B(g)3C(g)。反应过程中的部分数据如下表所示:
t/min n/mol
n(A) n(B) n(C)
0 2.0 2.4 0
5 0.9
10 1.6
15 1.6
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为0.09 mol·L-1·min-1
B.该反应在10 min后才达到平衡
C.平衡状态时,c(C)=0.6 mol·L-1
D.物质B的平衡转化率为20%
答案 C
解析 v(C)==0.09 mol·L-1·min-1,同一反应中反应速率之比等于计量数之比,3v(A)=v(C),所以v(A)=0.03 mol·L-1·min-1,A项错误;15 min时,n(B)=1.6 mol,消耗了2.4 mol-1.6 mol=0.8 mol,根据方程式可知这段时间内消耗A的物质的量为0.4 mol,所以15 min时,n(A)=1.6 mol,与10 min时A的物质的量相同,说明10~15 min这段时间内平衡没有移动,但无法确定是10 min时达到平衡,还是10 min前已经达到平衡,B项错误;根据B选项分析可知平衡时消耗的B为0.8 mol,根据方程式可知生成C的物质的量为1.2 mol,浓度为c(C)==0.6 mol·L-1,C项正确;物质B的平衡转化率为×100%≈33.3%,D项错误;故答案为C。
3.已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。起始反应物为N2和H2,物质的量之比为1∶3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中NH3的物质的量分数如下表:
压强 温度
400 ℃ 450 ℃ 500 ℃ 600 ℃
20 MPa时的压强 0.387 0.274 0.189 0.088
30 MPa时的压强 0.478 0.359 0.260 0.129
下列说法正确的是( )
A.体系中NH3的物质的量分数越大,则正反应速率越大
B.反应达到平衡时,N2和H2的转化率之比均为1
C.反应达到平衡时,放出的热量均为92.4 kJ
D.600 ℃、30 MPa下反应达到平衡时,生成NH3的物质的量最多
答案 B
解析 正反应速率与反应物的浓度有关,且反应物浓度越大正反应速率越大,而NH3是产物,故A错误;N2和H2的起始物质的量之比为1∶3,反应消耗的物质的量之比也是1∶3,故反应达到平衡时N2和H2的转化率相同,故B正确;当1 mol N2参与反应时放出的热量为92.4 kJ,而题目中没有确定参与反应的反应物的量,故C错误;由表格可知600 ℃、30 MPa下反应达到平衡时,NH3的物质的量分数相对于500 ℃、30 MPa时小,故D错误。
4.某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)3Z(g)平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1∶1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
答案 D
解析 运用三段式求算m。设转化的X的物质的量为n。
X(g)+mY(g)3Z(g)
起始/mol 1 2 0
转化/mol n mn 3n
平衡/mol (1-n) (2-mn) 3n
根据:(1-n)∶(2-mn)∶3n=30%∶60%∶10%
求得:n=0.1,m=2。
由m=2知,A项正确;由第二次平衡时,X、Y、Z的体积分数不变可知两次平衡所处温度相同,则B项正确;由m和n的数值及起始量可计算出X、Y二者的平衡转化率都为10%,C项正确;第二次平衡时,c(Z)==0.2 mol·L-1,D项错误。
5.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)COS(g)+H2(g) K=0.1
反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7 mol
D.CO的平衡转化率为80%
答案 C
解析 升高温度,H2S浓度增加,说明平衡向左移动,则正反应为放热反应,A项错误;通入CO,在恒容密闭容器中相当于增大反应物浓度,故正反应速率瞬间增大,然后又逐渐减小,B项错误;设反应前H2S的物质的量为x mol,则根据方程式得:K==0.1,解之得x=7,故C项正确;α(CO)=×100%=20%,D项错误。
6.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g)2ClNO(g) K2 ΔH2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min 时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 (填“>”“<”或“=”)α1,平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是 。
答案 (1)
(2)2.5×10-2 75% > 不变 升高温度
解析 (1)反应可用(Ⅰ)×2-(Ⅱ)得到,所以其平衡常数K=。(2)10 min内生成ClNO的物质的量为7.5×10-3 mol·L-1·min-1×10 min×2 L=0.15 mol,则需要参加反应的NO为0.15 mol,消耗Cl2的物质的量为0.075 mol,所以平衡后n(Cl2)=0.1 mol-0.075 mol=0.025 mol,NO的转化率α1=×100%=75%;由于反应是个气体体积减小的反应,因此反应(Ⅱ)在恒压条件下进行可看作由恒容条件下的平衡通过增大压强来实现,增大压强时反应(Ⅱ)的平衡向右移动,NO的转化率增大,所以α2>α1;平衡常数只受温度影响,温度不变,平衡常数不变;因该反应的正反应方向为放热反应,故升高温度,平衡向左移动,放热反应的平衡常数将减小。
7.由γ-羟基丁酸生成γ-丁内酯的反应如下:
在298 K下,γ-羟基丁酸水溶液的初始浓度为0.180 mol·L-1,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
t/min 21 50 80 100 120 160 220 ∞
c/(mol·L-1) 0.024 0.050 0.071 0.081 0.090 0.104 0.116 0.132
(1)该反应在50~80 min内的平均反应速率为 mol·L-1·min-1。
(2)120 min时γ-羟基丁酸的转化率为 。
(3)298 K时该反应的平衡常数K= 。
(4)为提高γ-羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是 。
答案 (1)0.000 7 (2)0.5(50%) (3) (4)将γ-丁内酯移走
解析 (1)v==0.000 7 mol/(L·min)。(2)在120 min时反应产生的γ-丁内酯的物质的量浓度0.090 mol·L-1,则反应消耗的γ-羟基丁酸的浓度为0.090 mol·L-1,由于反应开始时γ-羟基丁酸的浓度0.180 mol·L-1,所以γ-羟基丁酸的转化率为×100%=×100%=50%。(3)298 K的摄氏温度为25 ℃,水为液态,则此时该反应的平衡常数K=。(4)为提高γ-羟基丁酸的平衡转化率,使化学平衡正向移动,除适当控制反应温度外,还可采取的措施是及时分离出γ-丁内酯。
8.近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1= %,反应平衡常数K= 。
(2)在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2 α1,该反应的ΔH 0(填“>”“<”或“=”)。
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是 (填标号)。
A.H2S B.CO2 C.COS D.N2
答案 (1)2.5 2.8×10-3 (2)> > (3)B
解析 (1)考查转化率和平衡常数,依据“三段式”解决。
设H2S转化了x mol
H2S(g)+CO2(g)COS(g)+H2O(g)
起始/mol 0.4 0.1
转化/mol x x x x
平衡/mol (0.4-x) (0.1-x) x x
由题意可知,平衡后水的物质的量分数为0.02,
即=0.02,x=0.01,
则α1(H2S)=×100%=2.5%。
平衡常数K==
=2.8×10-3。
(2)升高温度,平衡后水的物质的量分数增大,即平衡正向移动,则H2S的转化率增大。升高温度,平衡向吸热反应方向移动,则正反应为吸热反应,ΔH>0。
(3)增大反应物中一种物质的百分含量,其自身的转化率降低,而另外一种反应物的转化率增大,因此选B。加入COS时,平衡逆向移动,H2S的转化率减小;加入N2,平衡不移动,H2S的转化率不变。
教学分析
教学设计
评价反馈
课堂小结
布置作业
教学反思
板书设计
历年高考题荟萃
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
