人教版高中化学选修四 课件2.3 化学平衡(共23张PPT)
文档属性
| 名称 | 人教版高中化学选修四 课件2.3 化学平衡(共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-21 21:55:00 | ||
图片预览






文档简介
课件23张PPT。高中化学精品课件 ? 选修 4第二章 化学反应速率和化学平衡第三节 化学平衡第 5 课时 化学平衡图像、等效平衡化学平衡图像等效平衡本节知识目录学习目标定位 1.认识化学反应速率、化学平衡典型图像,学会化学平衡图像题的分析解答方法。
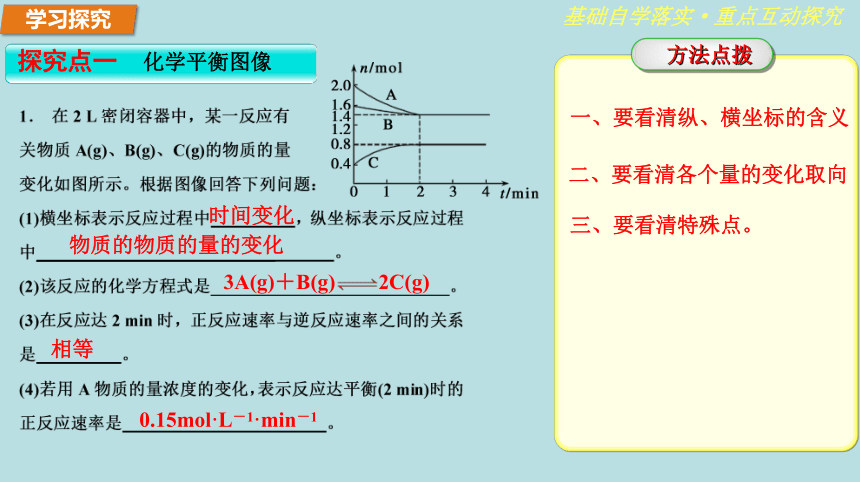
2.知道等效平衡的含义,学会等效平衡的分析判断方法。学习重难点:等效平衡的分析判断方法。知识回顾温故追本溯源·推陈方可知新② 压强:增大压强,平衡向气体分子数缩小的方向移动① 浓度:增大反应物(或减小生成物)的浓度,平衡向正反应方向移动;③ 温度:升高温度,平衡向吸热的反应方向移动。外界因素对化学平衡的影响:正反应 减小 增大 正反应 增大 减小 增大 逆反应 减小 增大 减小 知识回顾温故追本溯源·推陈方可知新AⅢCDA.673 K B.273 K C.373 K D.1 073 K学习探究基础自学落实·重点互动探究物质的物质的量的变化 3A(g)+B(g)??2C(g) 时间变化 相等 0.15mol·L-1·min-1一、要看清纵、横坐标的含义 二、要看清各个量的变化取向 三、要看清特殊点。 学习探究基础自学落实·重点互动探究减小 逆向 < 增大 正向 吸热 T1T1减小 逆向 放热 p1>p2减小 逆向 < ●●先拐先平,
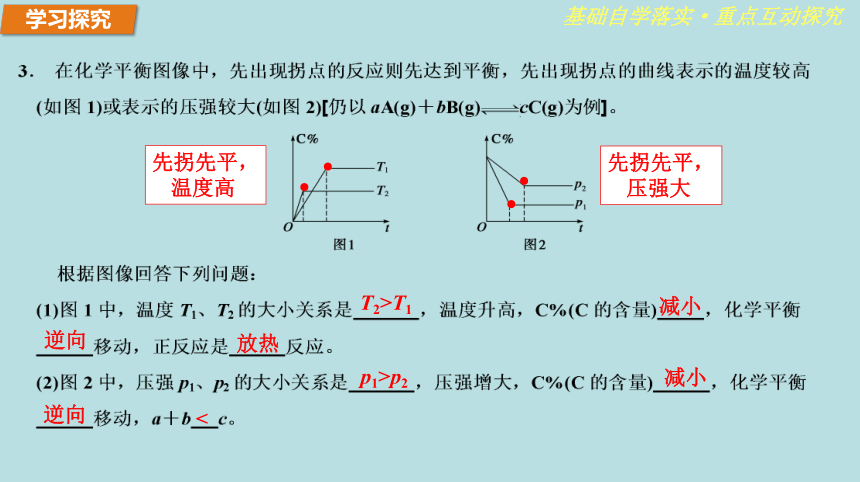
温度高 ●●先拐先平,
压强大 学习探究归纳总结基础自学落实·重点互动探究可逆反应mA(g)+nB(g)??pC(g)+qD(g),在转化率-时间曲线中,先出现拐点的曲线先达到平衡,这表示反应的温度高或压强大。化学平衡图像题的分析解答方法(1)无论是反应速率图像还是平衡图像,都要清楚纵、横坐标的含义,都要与化学原理相联系,特别是与平衡移动原理相联系。三看化学平衡移动的方向。(3)四要素分析法:图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系。(2)三步分析法:一看反应速率是增大还是减小;二看v正、v逆的相对大小;看曲线的终点。看曲线的起点;看曲线的变化趋势;看曲线的转折点;(4)先拐先平:(5)定一议二:学习探究基础自学落实·重点互动探究A 随着温度的升高,化学平衡应向吸热反应方向移动,即向逆反应方向移动。向逆反应方向移动,生成物C的体积分数减小 增大体系的压强,正反应和逆反应的速率都增大 加入催化剂,不能使平衡移动 同温下,加压平衡右移,A的转化率增加。同压下,升温平衡左移,A的转化率减小。学习探究基础自学落实·重点互动探究 化学平衡的建立与反应途径无关,从正反应开始或逆反应开始都可以建立平衡。在一定条件(恒温恒容或恒温恒压)下,对同一可逆反应,只有起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的百分含量(质量分数、体积分数、物质的量分数等)相同,这样的平衡称为等效平衡。(化学平衡与建立的途径无关)如:2SO2(g)+O2 (g) 2SO3(g)等效学习探究基础自学落实·重点互动探究1 mol 3 mol 0 mol1 mol 3 mol 0 mol1 mol 3 mol 0 mol2 mol 6mol 0 mol结论1:恒温、恒容:反应物投料量相当,则平衡等效。(恒温、恒容,化为原值)N2(g)+3H2(g) ??2NH3(g)加压平衡移动不等效①②③ 学习探究基础自学落实·重点互动探究1 mol 3 mol 0 mol1 mol 3 mol 0 mol1 mol 3 mol 0 mol2 mol 6mol 0 molN2(g)+3H2(g) ??2NH3(g)①②③④ 2 mol N2 6 mol H21 mol N2 3 mol H21 mol N2 3 mol H2等 效结论2:恒温、恒压:相同反应物投料比相等,则平衡等效。(恒温、恒压,化为原比)学习探究基础自学落实·重点互动探究CO(g)+H2O(g)?CO2(g)+H2(g)
2 mol 2 mol 0 mol 0 mol
4 mol 4 mol 0mol 0 mol
6 mol 6 mol 0 mol 0 mol
2mol 3 mol 0 mol 1 mol加压平衡等效平衡不移动①②③ 结论3:恒温恒容,对前后气体体积不变的可逆反应:相同反应物的投料比相等,则为等效平衡。学习探究归纳总结基础自学落实·重点互动探究(2)恒温恒容条件下,对于反应前后气体分子数不同的可逆反应,要求极值等量。等效平衡解题方法解答等效平衡问题时,先看条件(恒温恒容或恒温恒压),再看方程式反应前后气体分子数(相同或不同),按“一边倒”转换比较。(1)恒温恒容条件下,对于反应前后气体分子数不变的可逆反应,要求极值等比。(3)恒温恒压条件下,不管反应前后气体分子数是否改变,都只要求极值等比。学习探究基础自学落实·重点互动探究ABDE DEABCCDE该反应为前后气体分子数不同的可逆反应化为原比(填字母序号)化为原值学习探究基础自学落实·重点互动探究2.恒温恒容,反应前后气体分子数不同,量相同,等效平衡;恒温恒容,反应
前后气体分子数相同,成比例,等效平衡;恒温恒压,任何气体可逆反应,成
比例,等效平衡。1.化学平衡图像题的分析思路:看图像,想规律,作判断。解题技巧:先拐先平,定一议二。自我检测检测学习效果·体验成功快乐C 升温,v正、v逆都增大,且v逆> v正加压,v正、v逆都增大,且v正v逆而图像所示v正、v逆都减小
12345自我检测检测学习效果·体验成功快乐C 图Ⅰ:t0时温度升高,平衡向左移动,此时逆反应速率大于正反应速率图Ⅱ:该反应是反应前后气体物质的量不变的反应,增大压强和使用催化剂,可同等程度地加快正、逆反应速率,平衡不移动。图Ⅲ:如是使用催化剂的话,甲、乙两条件下的CO转化率应相等,若是温度对平衡的影响,乙高于甲,那么从甲升温到乙,平衡向左移动,CO的转化率下降12345自我检测检测学习效果·体验成功快乐从图像可以看出,t2时刻X、Y两物质的物质的量相等,而不是反应速率相等,故C不正确;t3时,反应达到平衡状态,所以正反应速率等于逆反应速率,故D不正确;反应开始时Y物质为10 mol,X物质为2 mol,达到平衡时Y减少了7 mol,X增多了3 mol,因此反应方程式应该是7Y(g) ??3X(g ),故A不正确。 B 12345自我检测检测学习效果·体验成功快乐 C 由图示可知,随着温度的升高,生成物的含量增加,即升高温度,平衡右移,所以该反应一定为吸热反应;压强越大,生成物的含量减小,说明化学方程式中,气体生成物的系数之和大于气体反应物的系数之和。12345自我检测检测学习效果·体验成功快乐1234(2)在恒温、恒压下,若投放3 mol A和3 mol B,则所占有的体积为(1)中的3倍。由于A、B的投放比例与(1)相同,故平衡时与(1)等效,故C的物质的量为3a mol。(1)由反应A(g)+B(g)??C(g)知,反应达平衡后,若有a mol C生成,则必有a mol A消耗,此时A剩余的物质的量为(1-a) mol3a1-a5本讲内容结束
请完成课时作业
2.知道等效平衡的含义,学会等效平衡的分析判断方法。学习重难点:等效平衡的分析判断方法。知识回顾温故追本溯源·推陈方可知新② 压强:增大压强,平衡向气体分子数缩小的方向移动① 浓度:增大反应物(或减小生成物)的浓度,平衡向正反应方向移动;③ 温度:升高温度,平衡向吸热的反应方向移动。外界因素对化学平衡的影响:正反应 减小 增大 正反应 增大 减小 增大 逆反应 减小 增大 减小 知识回顾温故追本溯源·推陈方可知新AⅢCDA.673 K B.273 K C.373 K D.1 073 K学习探究基础自学落实·重点互动探究物质的物质的量的变化 3A(g)+B(g)??2C(g) 时间变化 相等 0.15mol·L-1·min-1一、要看清纵、横坐标的含义 二、要看清各个量的变化取向 三、要看清特殊点。 学习探究基础自学落实·重点互动探究减小 逆向 < 增大 正向 吸热 T1
温度高 ●●先拐先平,
压强大 学习探究归纳总结基础自学落实·重点互动探究可逆反应mA(g)+nB(g)??pC(g)+qD(g),在转化率-时间曲线中,先出现拐点的曲线先达到平衡,这表示反应的温度高或压强大。化学平衡图像题的分析解答方法(1)无论是反应速率图像还是平衡图像,都要清楚纵、横坐标的含义,都要与化学原理相联系,特别是与平衡移动原理相联系。三看化学平衡移动的方向。(3)四要素分析法:图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系。(2)三步分析法:一看反应速率是增大还是减小;二看v正、v逆的相对大小;看曲线的终点。看曲线的起点;看曲线的变化趋势;看曲线的转折点;(4)先拐先平:(5)定一议二:学习探究基础自学落实·重点互动探究A 随着温度的升高,化学平衡应向吸热反应方向移动,即向逆反应方向移动。向逆反应方向移动,生成物C的体积分数减小 增大体系的压强,正反应和逆反应的速率都增大 加入催化剂,不能使平衡移动 同温下,加压平衡右移,A的转化率增加。同压下,升温平衡左移,A的转化率减小。学习探究基础自学落实·重点互动探究 化学平衡的建立与反应途径无关,从正反应开始或逆反应开始都可以建立平衡。在一定条件(恒温恒容或恒温恒压)下,对同一可逆反应,只有起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的百分含量(质量分数、体积分数、物质的量分数等)相同,这样的平衡称为等效平衡。(化学平衡与建立的途径无关)如:2SO2(g)+O2 (g) 2SO3(g)等效学习探究基础自学落实·重点互动探究1 mol 3 mol 0 mol1 mol 3 mol 0 mol1 mol 3 mol 0 mol2 mol 6mol 0 mol结论1:恒温、恒容:反应物投料量相当,则平衡等效。(恒温、恒容,化为原值)N2(g)+3H2(g) ??2NH3(g)加压平衡移动不等效①②③ 学习探究基础自学落实·重点互动探究1 mol 3 mol 0 mol1 mol 3 mol 0 mol1 mol 3 mol 0 mol2 mol 6mol 0 molN2(g)+3H2(g) ??2NH3(g)①②③④ 2 mol N2 6 mol H21 mol N2 3 mol H21 mol N2 3 mol H2等 效结论2:恒温、恒压:相同反应物投料比相等,则平衡等效。(恒温、恒压,化为原比)学习探究基础自学落实·重点互动探究CO(g)+H2O(g)?CO2(g)+H2(g)
2 mol 2 mol 0 mol 0 mol
4 mol 4 mol 0mol 0 mol
6 mol 6 mol 0 mol 0 mol
2mol 3 mol 0 mol 1 mol加压平衡等效平衡不移动①②③ 结论3:恒温恒容,对前后气体体积不变的可逆反应:相同反应物的投料比相等,则为等效平衡。学习探究归纳总结基础自学落实·重点互动探究(2)恒温恒容条件下,对于反应前后气体分子数不同的可逆反应,要求极值等量。等效平衡解题方法解答等效平衡问题时,先看条件(恒温恒容或恒温恒压),再看方程式反应前后气体分子数(相同或不同),按“一边倒”转换比较。(1)恒温恒容条件下,对于反应前后气体分子数不变的可逆反应,要求极值等比。(3)恒温恒压条件下,不管反应前后气体分子数是否改变,都只要求极值等比。学习探究基础自学落实·重点互动探究ABDE DEABCCDE该反应为前后气体分子数不同的可逆反应化为原比(填字母序号)化为原值学习探究基础自学落实·重点互动探究2.恒温恒容,反应前后气体分子数不同,量相同,等效平衡;恒温恒容,反应
前后气体分子数相同,成比例,等效平衡;恒温恒压,任何气体可逆反应,成
比例,等效平衡。1.化学平衡图像题的分析思路:看图像,想规律,作判断。解题技巧:先拐先平,定一议二。自我检测检测学习效果·体验成功快乐C 升温,v正、v逆都增大,且v逆> v正加压,v正、v逆都增大,且v正
12345自我检测检测学习效果·体验成功快乐C 图Ⅰ:t0时温度升高,平衡向左移动,此时逆反应速率大于正反应速率图Ⅱ:该反应是反应前后气体物质的量不变的反应,增大压强和使用催化剂,可同等程度地加快正、逆反应速率,平衡不移动。图Ⅲ:如是使用催化剂的话,甲、乙两条件下的CO转化率应相等,若是温度对平衡的影响,乙高于甲,那么从甲升温到乙,平衡向左移动,CO的转化率下降12345自我检测检测学习效果·体验成功快乐从图像可以看出,t2时刻X、Y两物质的物质的量相等,而不是反应速率相等,故C不正确;t3时,反应达到平衡状态,所以正反应速率等于逆反应速率,故D不正确;反应开始时Y物质为10 mol,X物质为2 mol,达到平衡时Y减少了7 mol,X增多了3 mol,因此反应方程式应该是7Y(g) ??3X(g ),故A不正确。 B 12345自我检测检测学习效果·体验成功快乐 C 由图示可知,随着温度的升高,生成物的含量增加,即升高温度,平衡右移,所以该反应一定为吸热反应;压强越大,生成物的含量减小,说明化学方程式中,气体生成物的系数之和大于气体反应物的系数之和。12345自我检测检测学习效果·体验成功快乐1234(2)在恒温、恒压下,若投放3 mol A和3 mol B,则所占有的体积为(1)中的3倍。由于A、B的投放比例与(1)相同,故平衡时与(1)等效,故C的物质的量为3a mol。(1)由反应A(g)+B(g)??C(g)知,反应达平衡后,若有a mol C生成,则必有a mol A消耗,此时A剩余的物质的量为(1-a) mol3a1-a5本讲内容结束
请完成课时作业
