人教版高中化学选修四 课件3.1 弱电解质的电离(共40张PPT)
文档属性
| 名称 | 人教版高中化学选修四 课件3.1 弱电解质的电离(共40张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 583.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-21 00:00:00 | ||
图片预览









文档简介
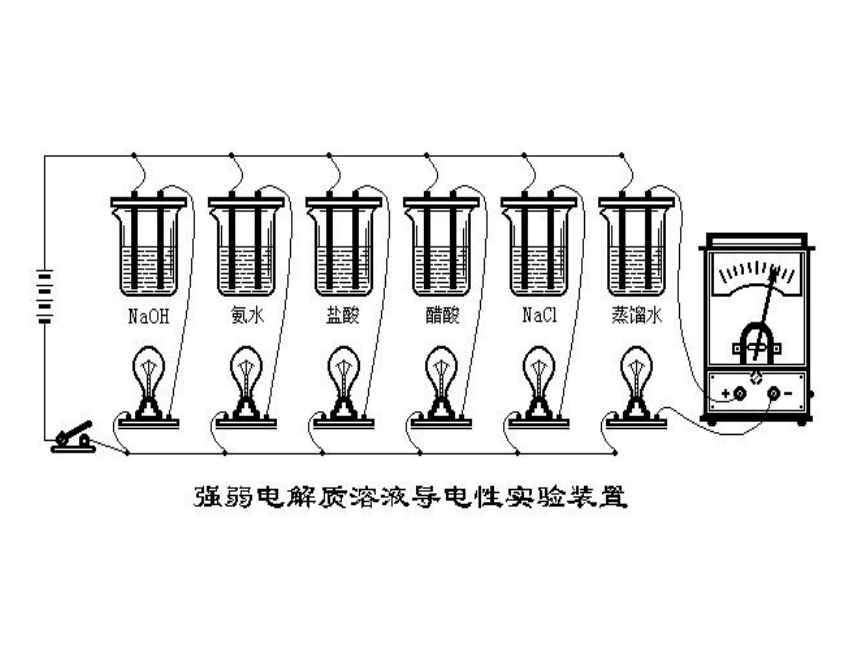
课件40张PPT。弱电解质的电离 一、强、弱电解质与结构的关系1、电解质与非电解质在水溶液或熔融状态下能够导电的化合物酸、碱、盐、金属氧化物、少数有机物、水溶于水和熔融时能导电(被电解)离子化合物、部分共价化合物(含强极性键)H2SO4,NaOH,NaCl,Na2O,CH3COOH,H2O等在水溶液中和熔融状态下都不能导电的化合物非金属氧化物、大多数有机物、NH3溶于水或熔融时均不能导电(无变化)共价化合物SO3、CH4、C2H5OH、NH3课堂练习1、下列说法正确的是( )
A.氯水能导电,所以氯气是电解质
B.固体磷酸是电解质,所以磷酸在融化状态下和水溶液中都能导电
C.胆矾虽不能导电,但它属于电解质
D.NH3溶于水能导电,所以它是电解质
E.碳酸钙不溶于水,所以它是非电解质C注意:
①对象:电解质、非电解质均为化合物;单质、混合物既不是电解质也不是非电解质
②条件:a.电解质:在水溶液中或熔融状态能导电,只要具备一个条件即可;b.非电解质:在水溶液中或熔融状态均不能导电,同时具备两个条件。
③电离:在水溶液或熔融状态是,化合物自身电离出自由移动的离子而导电时,才是电解质
④导电能力:电解质溶液的导电能力由自由移动的离子浓度与离子所带电荷决定课堂练习2、下列各物质的反应中,溶液的导电能力比反应前明显增强的是( )
A.向亚硫酸钠溶液中通入适量氯气
B.向硝酸银溶液中通入少量HCl
C.向氢氧化钠溶液中通入少量Cl2
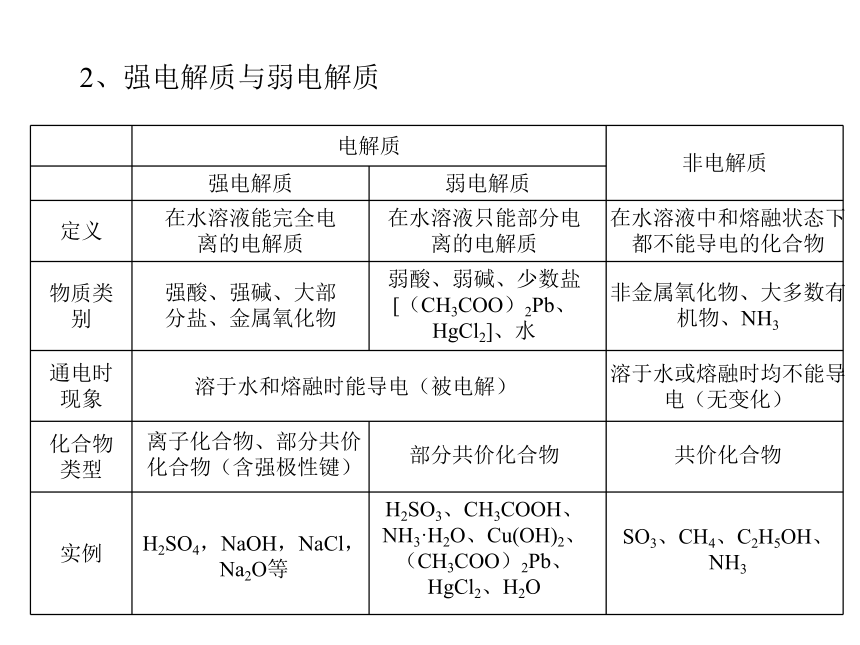
D.向NaOH溶液中加入醋酸A3、电解质水溶液一定能够导电,非电解质水溶液一定不能导电。2、强电解质与弱电解质在水溶液能完全电离的电解质强酸、强碱、大部分盐、金属氧化物溶于水和熔融时能导电(被电解)离子化合物、部分共价化合物(含强极性键)H2SO4,NaOH,NaCl,Na2O等在水溶液只能部分电离的电解质弱酸、弱碱、少数盐[(CH3COO)2Pb、HgCl2]、水部分共价化合物H2SO3、CH3COOH、NH3·H2O、Cu(OH)2、(CH3COO)2Pb、HgCl2、H2O在水溶液中和熔融状态下都不能导电的化合物非金属氧化物、大多数有机物、NH3SO3、CH4、C2H5OH、NH3溶于水或熔融时均不能导电(无变化)共价化合物1、下列物质:
(1)能导电的是_______
(2)属于强电解质的是________,
(3)属于弱电解质的是_______,
(4)属于非电解质的是_______.课堂练习2、下列关于电解质与结构关系的叙述正确的是( )
A.离子化合物一定是强电解质
B.极性共价化合物一定是强电解质
C.绝大多数离子化合物和某些具有极性键的共价化合物是强电解质,某些具有极性键的共价化合物是弱电解质
D. BaSO4难溶于水, BaSO4是弱电解质
E.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强a.c.ed.h.i.l.oj.k.mf.gCa.铜丝;b.金刚石;c.石墨;d.NaCl;e.盐酸;f.蔗糖 g.CO2;h.Na2O;i.硫酸;j.醋酸 ;k.碳酸;l.碳酸氢铵;m.氢氧化铝;n.氯气 ;o. BaSO4 注意:
①电解质的强弱与化学键没有必然联系。一般,强电解质含有离子键或强极性键。[强电解质可能为离子化合物,也可能为共价化合物;离子化合物,含强极性化学键化合物(HF)可能为弱电解质,共价化合物可能为强电解质]
②电解质的强弱与溶解度无关。[某些难溶或微溶于水的盐,虽然溶解度小,但溶于水的部分确实完全电离]
③电解质的强弱与导电能力无关。
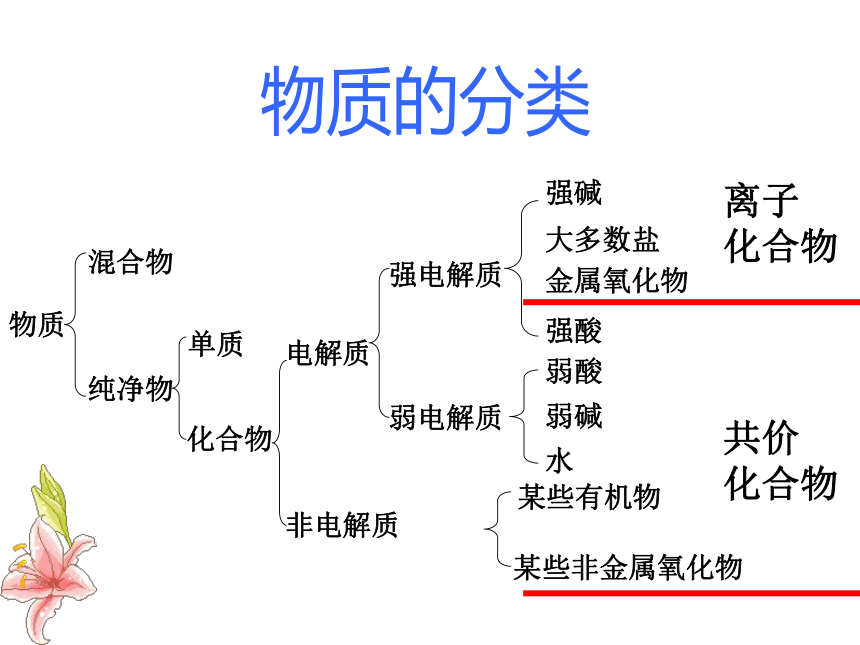
④导电能力:电解质溶液的导电能力由自由移动的离子浓度与离子所带电荷决定物质混合物纯净物单质化合物电解质非电解质强电解质弱电解质强碱大多数盐金属氧化物强酸弱酸弱碱水某些有机物某些非金属氧化物离子
化合物共价
化合物物质的分类3、电离方程式的书写:完全电离“===”,部分电离“ ”(1)熔融:只有离子化合物能够电离,共价化合物不能电离(2)水溶液中①.强电解质,完全电离,以“====”连接,一步电离NaOH====Na+ + OH-H2SO4====2H+ + SO42-②.弱电解质,部分(微弱)电离,以“ ”连接CH3COOH CH3COO-+H+H3PO4 H+ +H2PO4-A.多元弱酸,分步电离(以第一步为主)H2PO4- H+ +HPO42-HPO42- H+ +PO43-NH3 · H2O NH4+ + OH-NH3 · H2O中含有哪些微粒?3、电离方程式的书写Fe(OH)3 Fe3+ +3OH-B.多元弱碱,一步到位(3)酸式盐的电离①.强酸酸式盐A.熔融B.水溶液中②.弱酸酸式盐NaHSO4====Na+ + H+ + SO42-NaHCO3====Na+ + HCO3-HCO3- H+ +CO32-只断离子键断离子键、共价键C.两性物质:Al(OH)3AlO2-+H++H2O Al(OH)3 Al3+ +3OH-1、完成下列电解质的电离方程式:
(1)、KNO3 (2)、CH3COOH
(3)、Ba(OH)2 (4)、NH3·H2O
(5)、NaHCO3 (6)、CaCO3课堂练习2、判断下列电离方程式是否正确?(1)c酸相同,体积相同
有0.1 mol/L的盐酸、醋酸、硫酸各50ml,试比较:
①三种酸中氢离子浓度由大到小的顺序是 。
②三种酸与足量的锌反应,开始时产生H2的速率是
。
③三种酸与足量的锌反应产生H2的体积是 _______。
④三种酸分别与0.1 mol/L的NaOH溶液中和反应,消耗 NaOH体积由大到小的顺序是 。
⑤三种酸的pH值由大到小的顺序是 。硫酸>盐酸>醋酸硫酸>盐酸>醋酸硫酸>盐酸= 醋酸硫酸>盐酸= 醋酸醋酸>盐酸>硫酸4、强弱电解质的比较(2) c(H+)相同(pH相同)、体积相同
请比较c(H+)相同(pH相同)、体积相同盐酸、醋酸、硫酸:盐酸 = 醋酸 = 硫酸盐酸 = 硫酸 > 醋酸 盐酸 = 醋酸 = 硫酸醋酸 > 盐酸 > 硫酸醋酸 > 盐酸 = 硫酸醋酸 > 盐酸 = 硫酸4、强弱电解质的比较醋酸 > 盐酸 = 硫酸弱电解质的电离平衡 临川二中 刘肃林HCl === Cl-+H+HCl+H2O === Cl-+H3O+看图谈区别?CH3COOH +H2O CH3COO-+ H3O+CH3COOH CH3COO-+H+ 可逆反应在一定条件下进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生改变,反应达到化学平衡状态。知识回顾 : 一、化学平衡
1、化学平衡的概念
知识回顾 :一、化学平衡
2、V-t图和c-t图
逆:可逆反应
等:正反应速率和逆反应速率相等
动:动态平衡
定:反应物和生成物的浓度保持恒定
变:外界条件改变,原有平衡状态被破坏,一段时间后会达到新的平衡状态知识回顾 :一、化学平衡
3、化学平衡的特点
化学平衡移动原理(勒夏特列原理):
改变影响化学平衡的一个因素,平衡将向能减弱这种改变的方向移动。知识回顾 :二、化学平衡移动
一、弱电解质的电离平衡
1、电离平衡的概念 在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态。以CH3COOH为例CH3COOH CH3COO-+H+一、弱电解质的电离平衡
2、 V-t图和c-t图一、弱电解质的电离平衡
3、电离平衡的特点平衡移动规律—勒沙特列原理1、弱电解质电离过程的特点:
(1)、弱电解质的电离属于可逆过程
(2)、电离方向是微粒数增多的过程
(3)、电离方向是吸热过程一、弱电解质的电离平衡移动(1)温度:
升高温度,平衡向右移动,电离度α增大 2、影响电离平衡的因素(2)浓度:浓度越小,α越大
①增大弱电解质浓度,平衡向右移动,电离度α减小;
②稀释:平衡向右移动,电离度α增大;右移增大增大减少左移增大减少增大右移减少增大减少左移减少增大增大右移增大增大增大右移减少增大减小增大减小减小增大CH3COOH CH3COO-+H+加水c(H+)一定减少吗?如何理解加和稀释时平衡均向右移动,是否有区别?烧杯中含有2mL的纯醋酸,逐滴加入蒸馏水,在下图中绘出溶液的导电性和加入水的体积关系曲线。导电性V(H2O)H+浓度思考题 :1、一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如下图所示,下列说法正确的是( )
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<bBC课堂练习2、利用下图装做下面的实验:在烧杯里盛半杯乙溶液,然后用滴定管向容器里滴入甲溶液。随着甲的滴入,电灯渐渐变暗。滴到一定量时,电灯熄灭。继续滴入甲溶液,电灯又会逐渐亮起来。下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )
A.NH3·H2O、H2O B.CH3COOH、NH3·H2O
C.AlCl3 、NaOH、 D.H2SO4、Ba(OH)2D课堂练习知识回顾 :三、化学反应程度的表示
1、化学平衡常数 K(1)、表达式:(2)、意义:K值越大,可逆反应进行的程度越大。(3)、影响因素:内因:反应物的本性
外因:温度三、弱电解质电离程度的表示:1、电离平衡常数K①一元弱酸:HA H++A-,平衡时②一元弱碱:MOH M++OH-,平衡时(1)、K表达式:③对于多元弱酸:H3PO4 H+ +H2PO4-H2PO4- H+ +HPO42-HPO42- H+ +PO43-你知道第二步电离难的原因吗?K1>>K2>>K3…… (一般要相差105) ,多元弱酸的酸性由第一步电离决定(分步进行,一步定位)一级电离出的H+抑制了一级、二级的电离(1).已知下面三个数据: 7.2×10-4、 4.6×10-4、 4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:(2)、K值意义①.利用K值大小,估算弱电解质电离的趋势。K值越大,电离程度越大,酸性、碱性越强。如:相同条件下:
H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClONaCN+HNO2===HCN+NaNO2
NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF由此可判断下列叙述不正确的是( )
A.K(HF)= 7.2×10-4 ;
B.K(HNO2)=4.9×10-10
C.根据其中两个反应即可得出三种酸的强弱顺序为:
HF>HNO2>HCN
D.K(HCN)A.Na2CO3+H2S===NaHCO3+NaHS
B.Na2S+H2O+CO2===NaHS+NaHCO3
C.2NaHCO3+H2S===Na2S+2H2O+2CO2
D.NaHS+H2O+CO2===NaHCO3+H2S(2)、K值意义①.利用K值大小,估算弱电解质电离的趋势。K值越大,电离程度越大,酸性、碱性越强。如:相同条件下:
H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO(2)、K值意义②.比较多元弱酸溶液中的离子浓度关系。
c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)>c(OH-)(3)、影响因素①.内因:由物质的本性决定的,在同一温度下,不同弱电解质的电离常数不同。
②.外因:同一弱电解质的电离平衡常数只受温度影响,温度升高,K值增大。注意:K值大小只能说明弱电解质分子电离程度大,不能说明离子浓度和导电能力大小。试比较碳酸、氢硫酸中各微粒的大小?(4)、计算已知25 ℃时,Ka(CH3COOH)=1.75 ×10-5。
(1)向0.1mol/L醋酸溶液中加入一定量1mol/L盐酸时,上式中的数值是否发生变化?为什么?
(2)若醋酸的起始浓度为0.010mol/L,求平衡时c(H+) ?
(3)若醋酸的起始浓度为0.00010mol/L,求平衡时c(H+) ?
(4) 25 ℃时,Ka(HF)=7.2×10-4,起始浓度为10-4mol/L ,求平衡时c(H+) 4.18 ×10-4mol/L不变,电离常数只受温度影响,温度一定下是一个常数注意:K值大小只能说明弱电解质分子电离程度大,不能说明离子浓度和导电能力大小。2.68 ×10-4mol/L4.18 ×10-5mol/Lα =4.18 %α =41.8%弱电解质浓度越大,电离度越小(4)、计算已知25 ℃时,Ka(CH3COOH)=1.75 ×10-5。
(5)向1L 0.01mol/L醋酸溶液中加入1molCH3COONa,求平衡时溶液中的c(H+) ?结果: 1.75 ×10-7mol/L与(2)对比, c(H+)明显减小,可以看出CH3COO-对CH3COOH的电离有抑制作用,但是由CH3COOH电离出CH3COO-和H+的一定相等,且都为1.75 ×10-7mol/L2、弱电解质的电离度 α(1)、α的表达式:二、弱电解质电离程度的表示:一元弱酸:HA H++A-一元弱碱:MOH M++OH-(2)、意义
弱电解质的电离程度的相对大小2、弱电解质的电离度 α二、弱电解质电离程度的表示:(3)、影响因素:
内因:与弱电解质的本性有关 外因:
①升高温度, α增大; ②溶液浓度越小, α增大; ③同离子效应、离子反应效应右移增大增大减少左移增大减少增大右移减少增大减少左移减少增大增大右移增大增大增大右移减少增大增大不变减小不变增大不变减小减小不变不变增大CH3COOH CH3COO-+H+
A.氯水能导电,所以氯气是电解质
B.固体磷酸是电解质,所以磷酸在融化状态下和水溶液中都能导电
C.胆矾虽不能导电,但它属于电解质
D.NH3溶于水能导电,所以它是电解质
E.碳酸钙不溶于水,所以它是非电解质C注意:
①对象:电解质、非电解质均为化合物;单质、混合物既不是电解质也不是非电解质
②条件:a.电解质:在水溶液中或熔融状态能导电,只要具备一个条件即可;b.非电解质:在水溶液中或熔融状态均不能导电,同时具备两个条件。
③电离:在水溶液或熔融状态是,化合物自身电离出自由移动的离子而导电时,才是电解质
④导电能力:电解质溶液的导电能力由自由移动的离子浓度与离子所带电荷决定课堂练习2、下列各物质的反应中,溶液的导电能力比反应前明显增强的是( )
A.向亚硫酸钠溶液中通入适量氯气
B.向硝酸银溶液中通入少量HCl
C.向氢氧化钠溶液中通入少量Cl2
D.向NaOH溶液中加入醋酸A3、电解质水溶液一定能够导电,非电解质水溶液一定不能导电。2、强电解质与弱电解质在水溶液能完全电离的电解质强酸、强碱、大部分盐、金属氧化物溶于水和熔融时能导电(被电解)离子化合物、部分共价化合物(含强极性键)H2SO4,NaOH,NaCl,Na2O等在水溶液只能部分电离的电解质弱酸、弱碱、少数盐[(CH3COO)2Pb、HgCl2]、水部分共价化合物H2SO3、CH3COOH、NH3·H2O、Cu(OH)2、(CH3COO)2Pb、HgCl2、H2O在水溶液中和熔融状态下都不能导电的化合物非金属氧化物、大多数有机物、NH3SO3、CH4、C2H5OH、NH3溶于水或熔融时均不能导电(无变化)共价化合物1、下列物质:
(1)能导电的是_______
(2)属于强电解质的是________,
(3)属于弱电解质的是_______,
(4)属于非电解质的是_______.课堂练习2、下列关于电解质与结构关系的叙述正确的是( )
A.离子化合物一定是强电解质
B.极性共价化合物一定是强电解质
C.绝大多数离子化合物和某些具有极性键的共价化合物是强电解质,某些具有极性键的共价化合物是弱电解质
D. BaSO4难溶于水, BaSO4是弱电解质
E.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强a.c.ed.h.i.l.oj.k.mf.gCa.铜丝;b.金刚石;c.石墨;d.NaCl;e.盐酸;f.蔗糖 g.CO2;h.Na2O;i.硫酸;j.醋酸 ;k.碳酸;l.碳酸氢铵;m.氢氧化铝;n.氯气 ;o. BaSO4 注意:
①电解质的强弱与化学键没有必然联系。一般,强电解质含有离子键或强极性键。[强电解质可能为离子化合物,也可能为共价化合物;离子化合物,含强极性化学键化合物(HF)可能为弱电解质,共价化合物可能为强电解质]
②电解质的强弱与溶解度无关。[某些难溶或微溶于水的盐,虽然溶解度小,但溶于水的部分确实完全电离]
③电解质的强弱与导电能力无关。
④导电能力:电解质溶液的导电能力由自由移动的离子浓度与离子所带电荷决定物质混合物纯净物单质化合物电解质非电解质强电解质弱电解质强碱大多数盐金属氧化物强酸弱酸弱碱水某些有机物某些非金属氧化物离子
化合物共价
化合物物质的分类3、电离方程式的书写:完全电离“===”,部分电离“ ”(1)熔融:只有离子化合物能够电离,共价化合物不能电离(2)水溶液中①.强电解质,完全电离,以“====”连接,一步电离NaOH====Na+ + OH-H2SO4====2H+ + SO42-②.弱电解质,部分(微弱)电离,以“ ”连接CH3COOH CH3COO-+H+H3PO4 H+ +H2PO4-A.多元弱酸,分步电离(以第一步为主)H2PO4- H+ +HPO42-HPO42- H+ +PO43-NH3 · H2O NH4+ + OH-NH3 · H2O中含有哪些微粒?3、电离方程式的书写Fe(OH)3 Fe3+ +3OH-B.多元弱碱,一步到位(3)酸式盐的电离①.强酸酸式盐A.熔融B.水溶液中②.弱酸酸式盐NaHSO4====Na+ + H+ + SO42-NaHCO3====Na+ + HCO3-HCO3- H+ +CO32-只断离子键断离子键、共价键C.两性物质:Al(OH)3AlO2-+H++H2O Al(OH)3 Al3+ +3OH-1、完成下列电解质的电离方程式:
(1)、KNO3 (2)、CH3COOH
(3)、Ba(OH)2 (4)、NH3·H2O
(5)、NaHCO3 (6)、CaCO3课堂练习2、判断下列电离方程式是否正确?(1)c酸相同,体积相同
有0.1 mol/L的盐酸、醋酸、硫酸各50ml,试比较:
①三种酸中氢离子浓度由大到小的顺序是 。
②三种酸与足量的锌反应,开始时产生H2的速率是
。
③三种酸与足量的锌反应产生H2的体积是 _______。
④三种酸分别与0.1 mol/L的NaOH溶液中和反应,消耗 NaOH体积由大到小的顺序是 。
⑤三种酸的pH值由大到小的顺序是 。硫酸>盐酸>醋酸硫酸>盐酸>醋酸硫酸>盐酸= 醋酸硫酸>盐酸= 醋酸醋酸>盐酸>硫酸4、强弱电解质的比较(2) c(H+)相同(pH相同)、体积相同
请比较c(H+)相同(pH相同)、体积相同盐酸、醋酸、硫酸:盐酸 = 醋酸 = 硫酸盐酸 = 硫酸 > 醋酸 盐酸 = 醋酸 = 硫酸醋酸 > 盐酸 > 硫酸醋酸 > 盐酸 = 硫酸醋酸 > 盐酸 = 硫酸4、强弱电解质的比较醋酸 > 盐酸 = 硫酸弱电解质的电离平衡 临川二中 刘肃林HCl === Cl-+H+HCl+H2O === Cl-+H3O+看图谈区别?CH3COOH +H2O CH3COO-+ H3O+CH3COOH CH3COO-+H+ 可逆反应在一定条件下进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生改变,反应达到化学平衡状态。知识回顾 : 一、化学平衡
1、化学平衡的概念
知识回顾 :一、化学平衡
2、V-t图和c-t图
逆:可逆反应
等:正反应速率和逆反应速率相等
动:动态平衡
定:反应物和生成物的浓度保持恒定
变:外界条件改变,原有平衡状态被破坏,一段时间后会达到新的平衡状态知识回顾 :一、化学平衡
3、化学平衡的特点
化学平衡移动原理(勒夏特列原理):
改变影响化学平衡的一个因素,平衡将向能减弱这种改变的方向移动。知识回顾 :二、化学平衡移动
一、弱电解质的电离平衡
1、电离平衡的概念 在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态。以CH3COOH为例CH3COOH CH3COO-+H+一、弱电解质的电离平衡
2、 V-t图和c-t图一、弱电解质的电离平衡
3、电离平衡的特点平衡移动规律—勒沙特列原理1、弱电解质电离过程的特点:
(1)、弱电解质的电离属于可逆过程
(2)、电离方向是微粒数增多的过程
(3)、电离方向是吸热过程一、弱电解质的电离平衡移动(1)温度:
升高温度,平衡向右移动,电离度α增大 2、影响电离平衡的因素(2)浓度:浓度越小,α越大
①增大弱电解质浓度,平衡向右移动,电离度α减小;
②稀释:平衡向右移动,电离度α增大;右移增大增大减少左移增大减少增大右移减少增大减少左移减少增大增大右移增大增大增大右移减少增大减小增大减小减小增大CH3COOH CH3COO-+H+加水c(H+)一定减少吗?如何理解加和稀释时平衡均向右移动,是否有区别?烧杯中含有2mL的纯醋酸,逐滴加入蒸馏水,在下图中绘出溶液的导电性和加入水的体积关系曲线。导电性V(H2O)H+浓度思考题 :1、一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如下图所示,下列说法正确的是( )
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<bBC课堂练习2、利用下图装做下面的实验:在烧杯里盛半杯乙溶液,然后用滴定管向容器里滴入甲溶液。随着甲的滴入,电灯渐渐变暗。滴到一定量时,电灯熄灭。继续滴入甲溶液,电灯又会逐渐亮起来。下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )
A.NH3·H2O、H2O B.CH3COOH、NH3·H2O
C.AlCl3 、NaOH、 D.H2SO4、Ba(OH)2D课堂练习知识回顾 :三、化学反应程度的表示
1、化学平衡常数 K(1)、表达式:(2)、意义:K值越大,可逆反应进行的程度越大。(3)、影响因素:内因:反应物的本性
外因:温度三、弱电解质电离程度的表示:1、电离平衡常数K①一元弱酸:HA H++A-,平衡时②一元弱碱:MOH M++OH-,平衡时(1)、K表达式:③对于多元弱酸:H3PO4 H+ +H2PO4-H2PO4- H+ +HPO42-HPO42- H+ +PO43-你知道第二步电离难的原因吗?K1>>K2>>K3…… (一般要相差105) ,多元弱酸的酸性由第一步电离决定(分步进行,一步定位)一级电离出的H+抑制了一级、二级的电离(1).已知下面三个数据: 7.2×10-4、 4.6×10-4、 4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:(2)、K值意义①.利用K值大小,估算弱电解质电离的趋势。K值越大,电离程度越大,酸性、碱性越强。如:相同条件下:
H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClONaCN+HNO2===HCN+NaNO2
NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF由此可判断下列叙述不正确的是( )
A.K(HF)= 7.2×10-4 ;
B.K(HNO2)=4.9×10-10
C.根据其中两个反应即可得出三种酸的强弱顺序为:
HF>HNO2>HCN
D.K(HCN)
B.Na2S+H2O+CO2===NaHS+NaHCO3
C.2NaHCO3+H2S===Na2S+2H2O+2CO2
D.NaHS+H2O+CO2===NaHCO3+H2S(2)、K值意义①.利用K值大小,估算弱电解质电离的趋势。K值越大,电离程度越大,酸性、碱性越强。如:相同条件下:
H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO(2)、K值意义②.比较多元弱酸溶液中的离子浓度关系。
c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)>c(OH-)(3)、影响因素①.内因:由物质的本性决定的,在同一温度下,不同弱电解质的电离常数不同。
②.外因:同一弱电解质的电离平衡常数只受温度影响,温度升高,K值增大。注意:K值大小只能说明弱电解质分子电离程度大,不能说明离子浓度和导电能力大小。试比较碳酸、氢硫酸中各微粒的大小?(4)、计算已知25 ℃时,Ka(CH3COOH)=1.75 ×10-5。
(1)向0.1mol/L醋酸溶液中加入一定量1mol/L盐酸时,上式中的数值是否发生变化?为什么?
(2)若醋酸的起始浓度为0.010mol/L,求平衡时c(H+) ?
(3)若醋酸的起始浓度为0.00010mol/L,求平衡时c(H+) ?
(4) 25 ℃时,Ka(HF)=7.2×10-4,起始浓度为10-4mol/L ,求平衡时c(H+) 4.18 ×10-4mol/L不变,电离常数只受温度影响,温度一定下是一个常数注意:K值大小只能说明弱电解质分子电离程度大,不能说明离子浓度和导电能力大小。2.68 ×10-4mol/L4.18 ×10-5mol/Lα =4.18 %α =41.8%弱电解质浓度越大,电离度越小(4)、计算已知25 ℃时,Ka(CH3COOH)=1.75 ×10-5。
(5)向1L 0.01mol/L醋酸溶液中加入1molCH3COONa,求平衡时溶液中的c(H+) ?结果: 1.75 ×10-7mol/L与(2)对比, c(H+)明显减小,可以看出CH3COO-对CH3COOH的电离有抑制作用,但是由CH3COOH电离出CH3COO-和H+的一定相等,且都为1.75 ×10-7mol/L2、弱电解质的电离度 α(1)、α的表达式:二、弱电解质电离程度的表示:一元弱酸:HA H++A-一元弱碱:MOH M++OH-(2)、意义
弱电解质的电离程度的相对大小2、弱电解质的电离度 α二、弱电解质电离程度的表示:(3)、影响因素:
内因:与弱电解质的本性有关 外因:
①升高温度, α增大; ②溶液浓度越小, α增大; ③同离子效应、离子反应效应右移增大增大减少左移增大减少增大右移减少增大减少左移减少增大增大右移增大增大增大右移减少增大增大不变减小不变增大不变减小减小不变不变增大CH3COOH CH3COO-+H+
