浙江省绍兴市2023-2024学年高二下学期6月期末调研测试化学试卷(含答案)
文档属性
| 名称 | 浙江省绍兴市2023-2024学年高二下学期6月期末调研测试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-13 16:49:35 | ||
图片预览


文档简介
浙江省绍兴市2023-2024学年高二下学期期末调测化学试题
一、单选题
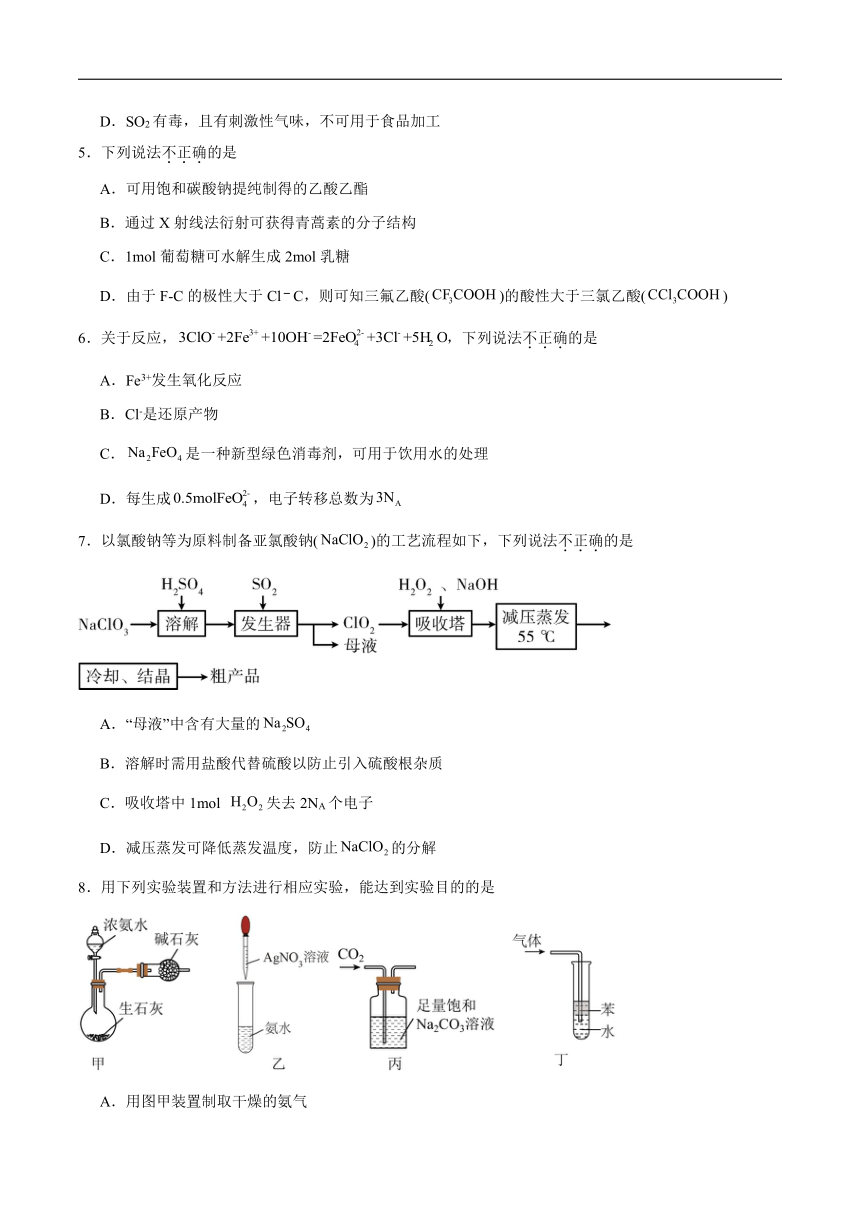
1.“高山流水觅知音”。下列中国古乐器中,主要由硅酸盐材料制成的是
A.九霄环佩木古琴 B.裴李岗文化骨笛 C.商朝后期陶埙 D.曾侯乙青铜编钟
A.A B.B C.C D.D
2.下列说法不正确的是
A.“天舟六号”为中国空间站送去推进剂Xe气,Xe元素位于周期表的p区
B.火星全球影像彩图显示了火星表土颜色,表土中赤铁矿主要成分为Fe2O3
C.创造了可控核聚变运行纪录的“人造太阳”,其原料中的与互为同位素
D.“深地一号”为进军万米深度提供核心装备,制造钻头用的金刚石为金属晶体
3.下列表达正确的是
A.硬脂酸的分子式:
B.用电子式表示HCl的形成过程:
C.H2的共价键电子云轮廓图:
D.NH3分子的球棍模型:
4.物质的性质决定用途,下列两者对应关系正确的是
A.氨极易溶于水,液氨可用作制冷剂
B.次氯酸具有强氧化性,可用于棉、麻和纸张的漂白剂
C.碳的非金属性强于硅,可用焦炭和石英砂制取粗硅
D.SO2有毒,且有刺激性气味,不可用于食品加工
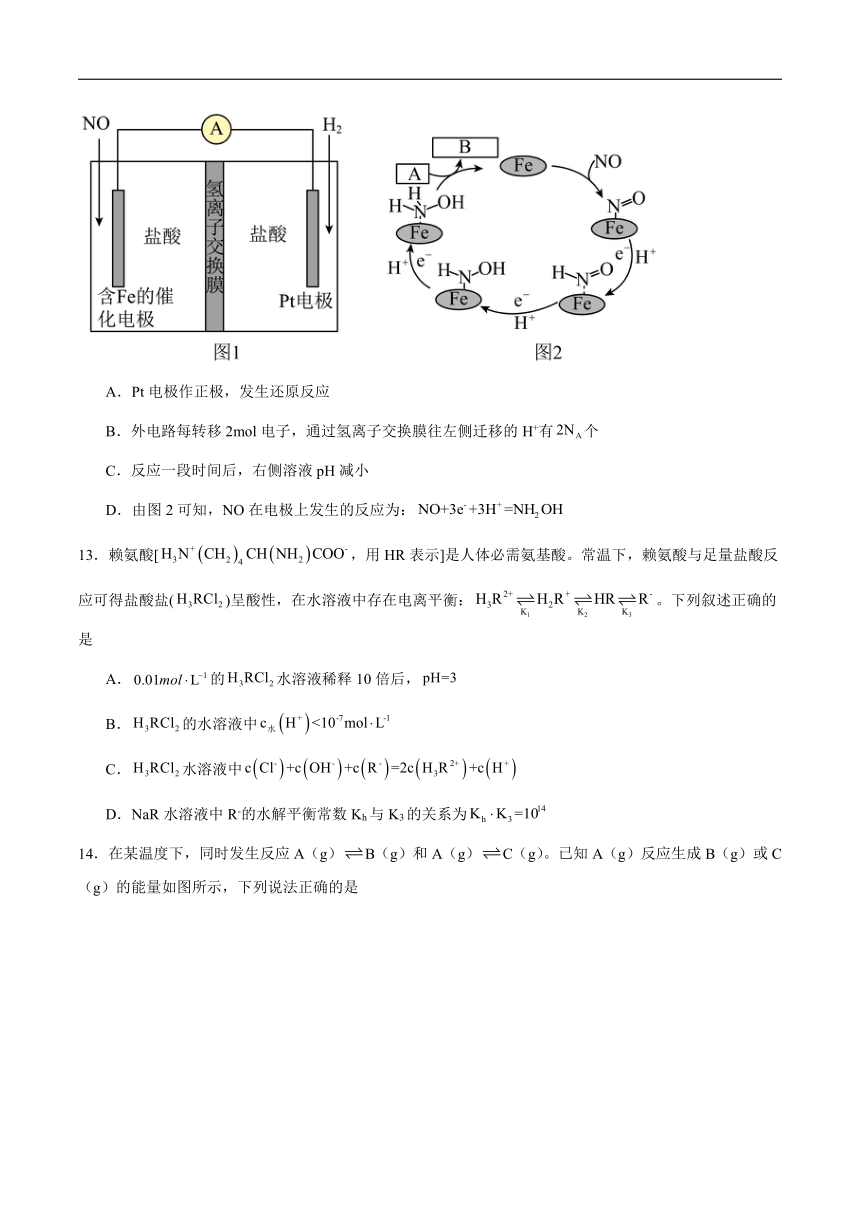
5.下列说法不正确的是
A.可用饱和碳酸钠提纯制得的乙酸乙酯
B.通过X射线法衍射可获得青蒿素的分子结构
C.1mol葡萄糖可水解生成2mol乳糖
D.由于F-C的极性大于ClC,则可知三氟乙酸()的酸性大于三氯乙酸()
6.关于反应,,下列说法不正确的是
A.Fe3+发生氧化反应
B.Cl-是还原产物
C.是一种新型绿色消毒剂,可用于饮用水的处理
D.每生成,电子转移总数为
7.以氯酸钠等为原料制备亚氯酸钠()的工艺流程如下,下列说法不正确的是
A.“母液”中含有大量的
B.溶解时需用盐酸代替硫酸以防止引入硫酸根杂质
C.吸收塔中1mol 失去2NA个电子
D.减压蒸发可降低蒸发温度,防止的分解
8.用下列实验装置和方法进行相应实验,能达到实验目的的是
A.用图甲装置制取干燥的氨气
B.用图乙装置配制银氨溶液
C.用图丙装置除去CO2中含有的少量HCl
D.用图丁装置吸收NH3,并防止倒吸
9.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明溶液中:Fe3+、SCN-、Al3+、Br-
B.加入Al粉能放出H2的溶液中:、Zn2+、Na+、Cl-
C.的氨水溶液中:、K+、Cl-、
D.溶解少量SO2气体的水溶液:H+、、S2-、
10.下列化学用语表达不正确的是
A.酰胺在碱性条件下的水解:
B.用足量碳酸钠溶液吸收尾气NO2:
C.常温常压下,1.6g甲烷完全燃烧生成CO2和液态水放出89.3kJ热量,其热化学方程式为:
D.氯气溶于水:
11.一种亲电试剂的结构如图,其中W、X、Y、Z均为同周期短周期元素,且元素的原子序数逐渐增大,X元素的p轨道中有3个电子,阳离子中所有原子共平面。下列说法不正确的是
A.中W为sp3杂化
B.第一电离能:
C.最简单氢化物的沸点:
D.1molW的最高价含氧酸最多能与3molNaOH反应
12.工业上主要采用如图1所示的方法制备盐酸羟胺(),一种常见的显像剂,性质类似。电池装置中含Fe的催化电极的电极反应机理如图2所示。下列说法正确的是
A.Pt电极作正极,发生还原反应
B.外电路每转移2mol电子,通过氢离子交换膜往左侧迁移的H+有个
C.反应一段时间后,右侧溶液pH减小
D.由图2可知,NO在电极上发生的反应为:
13.赖氨酸[,用HR表示]是人体必需氨基酸。常温下,赖氨酸与足量盐酸反应可得盐酸盐()呈酸性,在水溶液中存在电离平衡:。下列叙述正确的是
A.的水溶液稀释10倍后,
B.的水溶液中
C.水溶液中
D.NaR水溶液中R-的水解平衡常数Kh与K3的关系为
14.在某温度下,同时发生反应A(g)B(g)和A(g)C(g)。已知A(g)反应生成B(g)或C(g)的能量如图所示,下列说法正确的是
A.B(g)比C(g)稳定
B.在该温度下,反应刚开始时,产物以B为主;反应足够长时间,产物以C为主
C.反应A(g)B(g)的活化能为(E3—E1)
D.反应A(g)C(g)的ΔH<0且ΔS=0
15.已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;p(Ni)=-lgc(Ni2+),p(B)=-lgc(S2-)或-lgc(CO)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
A.常温下NiCO3的溶解度大于NiS的溶解度
B.向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C.对于曲线Ⅰ,在b点加热,b点向c点移动
D.P为3.5且对应的阴离子是CO
16.化学是以实验为基础的学科。下列实验方案设计能达到探究目的的是
选项 探究目的 实验方案
A 比较和结合H+的能力大小 室温下,用pH计分别测定等物质的量浓度的溶液和NaClO溶液的pH
B 麦芽糖可水解产生葡萄糖 向麦芽糖溶液中加入少量稀硫酸,加热,冷却后滴加NaOH溶液至碱性,再加入银氨溶液,水浴加热,观察是否产生银镜
C 比较和的相对大小 向NaCl、Nal的混合溶液中滴入少量稀溶液,观察是否有黄色沉淀生成
D 比较Cl和Si两种元素非金属性的强弱 向硅酸钠溶液中滴加盐酸,观察是否有沉淀生成
A.A B.B C.C D.D
二、解答题
17.依据物质结构的相关知识,回答下列问题。
Ⅰ.氧族元素在生产生活中有十分重要的应用。
(1)根据下图所示H2SO4和HClO4分子结构,判断沸点:H2SO4 HClO4 (填“>”、“<”或“=”),请说明理由 。
(2)Se是元素周期表中第34号元素,其基态原子的价电子排布式为 ;根据价层电子对互斥理论,可以推知的空间构型为 。
Ⅱ.铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示。
(3)与铁紧邻且等距离的铁微粒数目为 ;该氧化物的化学式为 。
18.以废铜渣(主要成分为Cu、CuO、和少量铁的氧化物)为原料可制备以下含铜的物质(部分产物已省略)。请回答:
已知:I.
Ⅱ.步骤⑤中的反应只有一种元素化合价发生变化
(1)步骤①中加入的作用除了将氧化为,还有 。
(2)写出步骤⑤的离子反应方程式 。
(3)下列说法正确的是___________。
A.固体X的成分是
B.上述步骤①④⑤都涉及氧化还原反应
C.溶液B通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得到较纯净的硫酸四氨合铜
D.步骤④中,部分SO2的氧化产物为
(4)写出溶液C中除H+外的其他阳离子 ,设计实验验证除H+外的无色阳离子 。
19.将CO2转化成可利用的化学能源的“负碳”技术是减少碳排放的重要途径。
方法I:二氧化碳催化加氢制甲醇。该反应一般认为通过如下步骤来实现:
①
②
(1)总反应的ΔH= 。
(2)反应①的平衡常数为K1,反应②的平衡常数为K2,则总反应的平衡常数为K= (用含K1、K2的式子表示)。
(3)下列关于二氧化碳加氢制甲醇的说法不正确的是___________。
A.图1中能正确反映总反应平衡常数K随温度变化关系的曲线为a
B.体系中的CO2平衡转化率(a)与温度和压强的关系如图2所示,则压强最大的为
C.反应达平衡后,在恒温恒容条件下充入一定量的N2,体系压强增大,反应速率加快
D.选择合适的催化剂能提高CO2的平衡转化率
方法II:CO2电解法制甲醇。利用电解原理,可将CO2转化为,其装置如图所示:
(4)电极上电极反应方程式: 。
方法III:CH4超干重整CO2得到的CO经偶联反应可制得 (草酸)。
(5)在水溶液中、和物质的量分数pH关系如图所示,则c点(1、3两条线的交点)溶液pH= 。
20.碘化锡()是一种非极性分子,主要用于制造有机锡配合物。某小组利用单质锡和碘制备碘化锡,其主要实验流程如下(反应装置见下图,夹持仪器略去);
已知:
①无水碘化锡为橙红色立方晶体,受潮易水解,熔点145.7℃,沸点364.5℃。
②碘化锡在丙酮和热的石油醚中溶解度较大,在冷的石油醚中溶解度小。
③石油醚的沸点为60~90℃,碘单质的升华温度为45~77℃。
请回答:
(1)反应装置中仪器A的名称是 。
(2)下列说法不正确的是___________。
A.将锡片剪成细小碎片、碘磨细的原因是增大接触面积、提高反应速率
B.步骤II可以不转移反应液,直接在原反应装置(圆底烧瓶)中进行后续操作
C.步骤II,圆底烧瓶中还附着四碘化锡晶体,可用热的石油醚洗涤内壁,一起转移到小烧杯中
D.步骤IV采用蒸发结晶比冷却结晶更好
(3)产品可以进乙步采用重结晶法提纯。请从下列选项中选择最佳选项并进行排序: 。
取碘化锡样品放入烧杯中→___________→___________→___________
a.加入适量的热水 b.加入适量的热的石油醚 c.用冷水浴冷却结晶
d.趁热过滤 e.加入适量的冷的石油醚
(4)实验结果得到碘化锡产品25.08g,此次实验的实际产率为 (保留一位小数)。
(5)经测定,查阅文献发现,用乙酸代替石油醚作反应溶剂能得到更高的产率,但需将锡粒处理为极碎的锡箔,若仍然用锡粒,反应引发后很容易停止。产生这种现象的原因是 。
21.肉桂硫胺(M)是抗击新型冠状病毒的潜在用药,其合成路线如下:
已知:I.
Ⅱ.
(1)A中官能团的名称为 。
(2)下列说法正确的是___________。
A.M的分子式为
B.反应A→B的条件是NaOH水溶液,加热
C.反应E→F中苯的作用是溶剂
D.F中最多有18个原子共平面
(3)G→H的反应方程式为 。
(4)写出2种符合下列条件的E的同分异构体。
a.具有两个取代基的芳香族化合物。
b.能水解,水解产物遇到溶液显紫色
c.核磁共振氢谱显示苯环上有4种化学环境的氢
(5)乙酰苯胺结构为()。参照上述合成路线和下面的信息,设计一条由苯和乙酸为起始原料制备乙酰苯胺的合成路线 。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
已知:
参考答案
1.C
2.D
3.D
4.B
5.C
6.D
7.B
8.A
9.C
10.D
11.D
12.B
13.B
14.B
15.C
16.A
17.(1) > H2SO4和HClO4都是分子晶体,H2SO4分子间氢键比HClO4多,分子间作用力较大,沸点高于HClO4
(2) 4s24p4 正四面体
(3) 12 FeO
18.(1)将Cu氧化为Cu2+
(2)
(3)BD
(4) 、Cu2+ 取少量溶液C于试管中,向溶液中加入足量的氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则证明溶液中有。
19.(1)-58kJ mol-1
(2)K1 K2
(3)CD
(4)
(5)2.7
20.(1)球形冷凝管
(2)BD
(3)bdc
(4)80.0%
(5)SnI4为非极性分子,乙酸为极性分子,故SnI4在该溶剂中溶解度较小,生成的SnI4包裹在锡粒表面,阻碍了后续反应的进行
21.(1)溴原子或者碳溴键
(2)BCD
(3)
(4)
(5)
一、单选题
1.“高山流水觅知音”。下列中国古乐器中,主要由硅酸盐材料制成的是
A.九霄环佩木古琴 B.裴李岗文化骨笛 C.商朝后期陶埙 D.曾侯乙青铜编钟
A.A B.B C.C D.D
2.下列说法不正确的是
A.“天舟六号”为中国空间站送去推进剂Xe气,Xe元素位于周期表的p区
B.火星全球影像彩图显示了火星表土颜色,表土中赤铁矿主要成分为Fe2O3
C.创造了可控核聚变运行纪录的“人造太阳”,其原料中的与互为同位素
D.“深地一号”为进军万米深度提供核心装备,制造钻头用的金刚石为金属晶体
3.下列表达正确的是
A.硬脂酸的分子式:
B.用电子式表示HCl的形成过程:
C.H2的共价键电子云轮廓图:
D.NH3分子的球棍模型:
4.物质的性质决定用途,下列两者对应关系正确的是
A.氨极易溶于水,液氨可用作制冷剂
B.次氯酸具有强氧化性,可用于棉、麻和纸张的漂白剂
C.碳的非金属性强于硅,可用焦炭和石英砂制取粗硅
D.SO2有毒,且有刺激性气味,不可用于食品加工
5.下列说法不正确的是
A.可用饱和碳酸钠提纯制得的乙酸乙酯
B.通过X射线法衍射可获得青蒿素的分子结构
C.1mol葡萄糖可水解生成2mol乳糖
D.由于F-C的极性大于ClC,则可知三氟乙酸()的酸性大于三氯乙酸()
6.关于反应,,下列说法不正确的是
A.Fe3+发生氧化反应
B.Cl-是还原产物
C.是一种新型绿色消毒剂,可用于饮用水的处理
D.每生成,电子转移总数为
7.以氯酸钠等为原料制备亚氯酸钠()的工艺流程如下,下列说法不正确的是
A.“母液”中含有大量的
B.溶解时需用盐酸代替硫酸以防止引入硫酸根杂质
C.吸收塔中1mol 失去2NA个电子
D.减压蒸发可降低蒸发温度,防止的分解
8.用下列实验装置和方法进行相应实验,能达到实验目的的是
A.用图甲装置制取干燥的氨气
B.用图乙装置配制银氨溶液
C.用图丙装置除去CO2中含有的少量HCl
D.用图丁装置吸收NH3,并防止倒吸
9.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明溶液中:Fe3+、SCN-、Al3+、Br-
B.加入Al粉能放出H2的溶液中:、Zn2+、Na+、Cl-
C.的氨水溶液中:、K+、Cl-、
D.溶解少量SO2气体的水溶液:H+、、S2-、
10.下列化学用语表达不正确的是
A.酰胺在碱性条件下的水解:
B.用足量碳酸钠溶液吸收尾气NO2:
C.常温常压下,1.6g甲烷完全燃烧生成CO2和液态水放出89.3kJ热量,其热化学方程式为:
D.氯气溶于水:
11.一种亲电试剂的结构如图,其中W、X、Y、Z均为同周期短周期元素,且元素的原子序数逐渐增大,X元素的p轨道中有3个电子,阳离子中所有原子共平面。下列说法不正确的是
A.中W为sp3杂化
B.第一电离能:
C.最简单氢化物的沸点:
D.1molW的最高价含氧酸最多能与3molNaOH反应
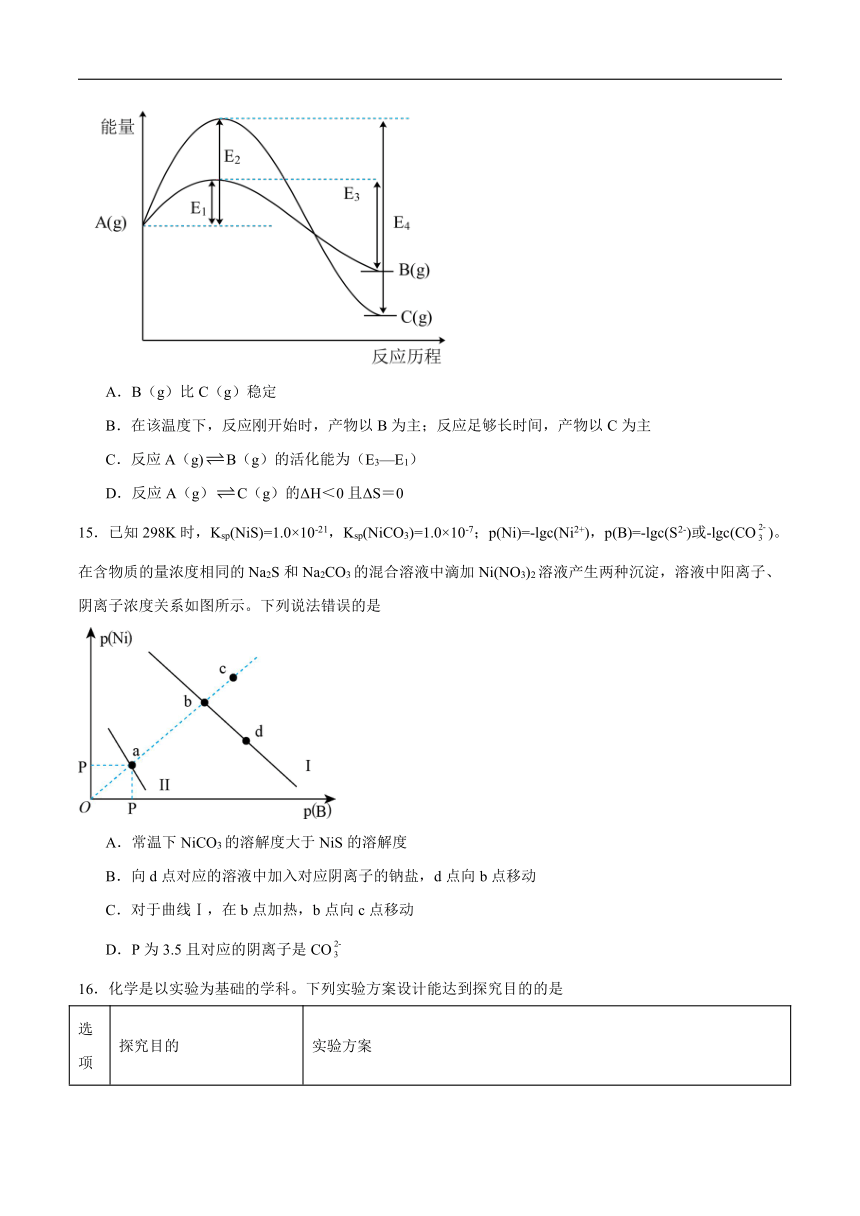
12.工业上主要采用如图1所示的方法制备盐酸羟胺(),一种常见的显像剂,性质类似。电池装置中含Fe的催化电极的电极反应机理如图2所示。下列说法正确的是
A.Pt电极作正极,发生还原反应
B.外电路每转移2mol电子,通过氢离子交换膜往左侧迁移的H+有个
C.反应一段时间后,右侧溶液pH减小
D.由图2可知,NO在电极上发生的反应为:
13.赖氨酸[,用HR表示]是人体必需氨基酸。常温下,赖氨酸与足量盐酸反应可得盐酸盐()呈酸性,在水溶液中存在电离平衡:。下列叙述正确的是
A.的水溶液稀释10倍后,
B.的水溶液中
C.水溶液中
D.NaR水溶液中R-的水解平衡常数Kh与K3的关系为
14.在某温度下,同时发生反应A(g)B(g)和A(g)C(g)。已知A(g)反应生成B(g)或C(g)的能量如图所示,下列说法正确的是
A.B(g)比C(g)稳定
B.在该温度下,反应刚开始时,产物以B为主;反应足够长时间,产物以C为主
C.反应A(g)B(g)的活化能为(E3—E1)
D.反应A(g)C(g)的ΔH<0且ΔS=0
15.已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;p(Ni)=-lgc(Ni2+),p(B)=-lgc(S2-)或-lgc(CO)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
A.常温下NiCO3的溶解度大于NiS的溶解度
B.向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C.对于曲线Ⅰ,在b点加热,b点向c点移动
D.P为3.5且对应的阴离子是CO
16.化学是以实验为基础的学科。下列实验方案设计能达到探究目的的是
选项 探究目的 实验方案
A 比较和结合H+的能力大小 室温下,用pH计分别测定等物质的量浓度的溶液和NaClO溶液的pH
B 麦芽糖可水解产生葡萄糖 向麦芽糖溶液中加入少量稀硫酸,加热,冷却后滴加NaOH溶液至碱性,再加入银氨溶液,水浴加热,观察是否产生银镜
C 比较和的相对大小 向NaCl、Nal的混合溶液中滴入少量稀溶液,观察是否有黄色沉淀生成
D 比较Cl和Si两种元素非金属性的强弱 向硅酸钠溶液中滴加盐酸,观察是否有沉淀生成
A.A B.B C.C D.D
二、解答题
17.依据物质结构的相关知识,回答下列问题。
Ⅰ.氧族元素在生产生活中有十分重要的应用。
(1)根据下图所示H2SO4和HClO4分子结构,判断沸点:H2SO4 HClO4 (填“>”、“<”或“=”),请说明理由 。
(2)Se是元素周期表中第34号元素,其基态原子的价电子排布式为 ;根据价层电子对互斥理论,可以推知的空间构型为 。
Ⅱ.铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示。
(3)与铁紧邻且等距离的铁微粒数目为 ;该氧化物的化学式为 。
18.以废铜渣(主要成分为Cu、CuO、和少量铁的氧化物)为原料可制备以下含铜的物质(部分产物已省略)。请回答:
已知:I.
Ⅱ.步骤⑤中的反应只有一种元素化合价发生变化
(1)步骤①中加入的作用除了将氧化为,还有 。
(2)写出步骤⑤的离子反应方程式 。
(3)下列说法正确的是___________。
A.固体X的成分是
B.上述步骤①④⑤都涉及氧化还原反应
C.溶液B通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得到较纯净的硫酸四氨合铜
D.步骤④中,部分SO2的氧化产物为
(4)写出溶液C中除H+外的其他阳离子 ,设计实验验证除H+外的无色阳离子 。
19.将CO2转化成可利用的化学能源的“负碳”技术是减少碳排放的重要途径。
方法I:二氧化碳催化加氢制甲醇。该反应一般认为通过如下步骤来实现:
①
②
(1)总反应的ΔH= 。
(2)反应①的平衡常数为K1,反应②的平衡常数为K2,则总反应的平衡常数为K= (用含K1、K2的式子表示)。
(3)下列关于二氧化碳加氢制甲醇的说法不正确的是___________。
A.图1中能正确反映总反应平衡常数K随温度变化关系的曲线为a
B.体系中的CO2平衡转化率(a)与温度和压强的关系如图2所示,则压强最大的为
C.反应达平衡后,在恒温恒容条件下充入一定量的N2,体系压强增大,反应速率加快
D.选择合适的催化剂能提高CO2的平衡转化率
方法II:CO2电解法制甲醇。利用电解原理,可将CO2转化为,其装置如图所示:
(4)电极上电极反应方程式: 。
方法III:CH4超干重整CO2得到的CO经偶联反应可制得 (草酸)。
(5)在水溶液中、和物质的量分数pH关系如图所示,则c点(1、3两条线的交点)溶液pH= 。
20.碘化锡()是一种非极性分子,主要用于制造有机锡配合物。某小组利用单质锡和碘制备碘化锡,其主要实验流程如下(反应装置见下图,夹持仪器略去);
已知:
①无水碘化锡为橙红色立方晶体,受潮易水解,熔点145.7℃,沸点364.5℃。
②碘化锡在丙酮和热的石油醚中溶解度较大,在冷的石油醚中溶解度小。
③石油醚的沸点为60~90℃,碘单质的升华温度为45~77℃。
请回答:
(1)反应装置中仪器A的名称是 。
(2)下列说法不正确的是___________。
A.将锡片剪成细小碎片、碘磨细的原因是增大接触面积、提高反应速率
B.步骤II可以不转移反应液,直接在原反应装置(圆底烧瓶)中进行后续操作
C.步骤II,圆底烧瓶中还附着四碘化锡晶体,可用热的石油醚洗涤内壁,一起转移到小烧杯中
D.步骤IV采用蒸发结晶比冷却结晶更好
(3)产品可以进乙步采用重结晶法提纯。请从下列选项中选择最佳选项并进行排序: 。
取碘化锡样品放入烧杯中→___________→___________→___________
a.加入适量的热水 b.加入适量的热的石油醚 c.用冷水浴冷却结晶
d.趁热过滤 e.加入适量的冷的石油醚
(4)实验结果得到碘化锡产品25.08g,此次实验的实际产率为 (保留一位小数)。
(5)经测定,查阅文献发现,用乙酸代替石油醚作反应溶剂能得到更高的产率,但需将锡粒处理为极碎的锡箔,若仍然用锡粒,反应引发后很容易停止。产生这种现象的原因是 。
21.肉桂硫胺(M)是抗击新型冠状病毒的潜在用药,其合成路线如下:
已知:I.
Ⅱ.
(1)A中官能团的名称为 。
(2)下列说法正确的是___________。
A.M的分子式为
B.反应A→B的条件是NaOH水溶液,加热
C.反应E→F中苯的作用是溶剂
D.F中最多有18个原子共平面
(3)G→H的反应方程式为 。
(4)写出2种符合下列条件的E的同分异构体。
a.具有两个取代基的芳香族化合物。
b.能水解,水解产物遇到溶液显紫色
c.核磁共振氢谱显示苯环上有4种化学环境的氢
(5)乙酰苯胺结构为()。参照上述合成路线和下面的信息,设计一条由苯和乙酸为起始原料制备乙酰苯胺的合成路线 。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
已知:
参考答案
1.C
2.D
3.D
4.B
5.C
6.D
7.B
8.A
9.C
10.D
11.D
12.B
13.B
14.B
15.C
16.A
17.(1) > H2SO4和HClO4都是分子晶体,H2SO4分子间氢键比HClO4多,分子间作用力较大,沸点高于HClO4
(2) 4s24p4 正四面体
(3) 12 FeO
18.(1)将Cu氧化为Cu2+
(2)
(3)BD
(4) 、Cu2+ 取少量溶液C于试管中,向溶液中加入足量的氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则证明溶液中有。
19.(1)-58kJ mol-1
(2)K1 K2
(3)CD
(4)
(5)2.7
20.(1)球形冷凝管
(2)BD
(3)bdc
(4)80.0%
(5)SnI4为非极性分子,乙酸为极性分子,故SnI4在该溶剂中溶解度较小,生成的SnI4包裹在锡粒表面,阻碍了后续反应的进行
21.(1)溴原子或者碳溴键
(2)BCD
(3)
(4)
(5)
同课章节目录
