2026届高考化学一轮复习 第1章 化学实验基础 第2节 物质的检验、分离与提纯 课件(70张PPT)
文档属性
| 名称 | 2026届高考化学一轮复习 第1章 化学实验基础 第2节 物质的检验、分离与提纯 课件(70张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-15 10:15:27 | ||
图片预览









文档简介
(共70张PPT)
第2节 物质的检验、分离与提纯
第1章
课标要求
1.初步学会物质的检验、分离、提纯和溶液配制等化学实验基础知识和基本技能。
2.学习进行物质分离、检验和制备等不同类型化学实验的核心思路与基本方法。
3.能根据物质性质的差异选择物质分离的实验方法;能根据物质的特征反应和干扰因素选取适当的检验试剂。
备考指导
1.本节在高考试题中的考查形式有:(1)将物质的特征性质与实验现象相结合,考查物质的检验;(2)以制备物质的实验为载体,结合物质的物理性质进行物质分离的考查,结合物质的化学性质进行物质提纯的考查。题型有选择题和综合实验题,试题以中等难度及中等难度偏上为主。
2.对检验、分离、提纯等知识的复习,重点掌握常见的分离、提纯混合物的方法,掌握常见离子、特殊物质的检验方法,对物质的检验、分离与提纯的方法形成答题模板。
内容索引
01
02
03
第一环节 必备知识落实
第二环节 关键能力形成
第三环节 核心素养提升
第一环节 必备知识落实
知识点1
物质的检验
知识筛查
1.常见阳离子的检验
名师点拨(1)阳离子的检验除了一些特殊的方法(如焰色试验、KSCN溶液显色反应)外,一般用NaOH溶液即可鉴别;(2)在没有特殊要求时,如果有多种检验方法,应该选择教材中给定的方法,如检验Fe3+用KSCN溶液。
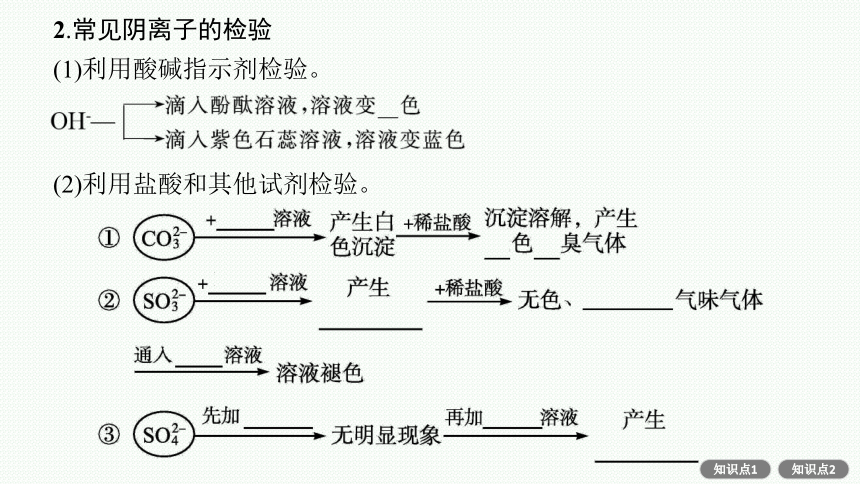
2.常见阴离子的检验
(1)利用酸碱指示剂检验。
(2)利用盐酸和其他试剂检验。
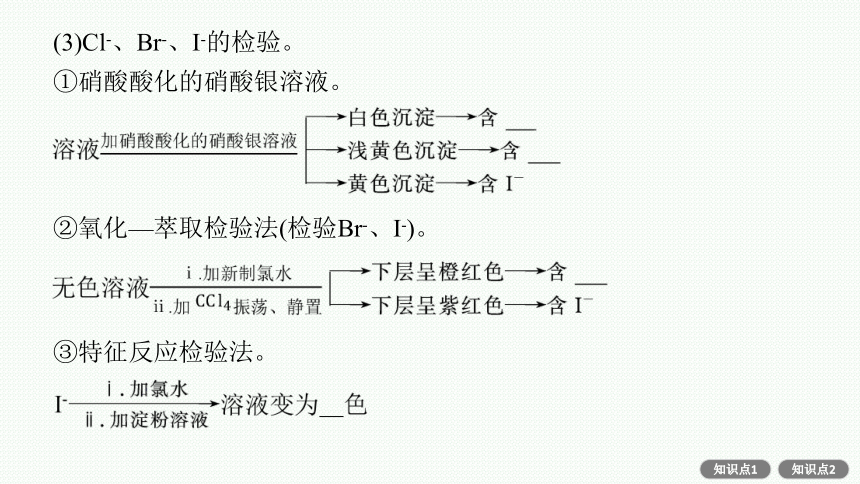
(3)Cl-、Br-、I-的检验。
①硝酸酸化的硝酸银溶液。
②氧化—萃取检验法(检验Br-、I-)。
③特征反应检验法。
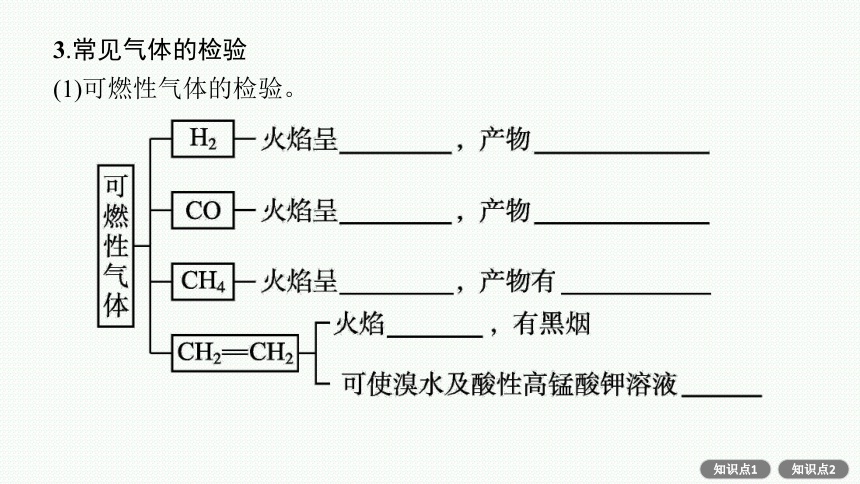
3.常见气体的检验
(1)可燃性气体的检验。
(2)酸性气体的检验。
(3)碱性气体的检验(NH3)。
(4)强氧化性气体的检验。
名师点拨(1)检验气体时,要防止气体之间的互相干扰,如Cl2、SO2均能使品红溶液褪色。(2)中学阶段只学过一种碱性气体,使湿润的红色石蕊试纸变蓝的气体一般是NH3。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)能使品红溶液褪色的气体一定是SO2。( )
(2)使湿润的碘化钾淀粉试纸变蓝的气体一定是Cl2。( )
(3)加盐酸有无色、无臭气体生成,通入澄清石灰水产生白色沉淀,该溶液中一定含有 。( )
×
×
×
×
√
2.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )。
B
知识点2
物质的分离与提纯
知识筛查
1.物质分离、提纯的区别
(1)物质的分离:将混合物的各组分分离出来,获得几种纯净物的过程。
(2)物质的提纯:将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂。
2.物质分离、提纯的常用物理方法
3.物质分离、提纯的常用化学方法
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)过滤时,为加快过滤速度,应用玻璃棒不断搅拌漏斗中液体。( )
(2)从溶液中获取NaCl晶体,用蒸发结晶的方法,其操作应使混合物中的水分完全蒸干后,再停止加热。( )
(3)根据食用油和汽油的密度不同,可选用分液的方法分离。( )
(4)用乙醇萃取出溴水中的溴,再用蒸馏的方法分离溴与乙醇。( )
(5)蒸馏时温度计的水银球应插入液体中。( )
(6)在蒸馏过程中,若发现忘加沸石,应停止加热立即补加。( )
(7)利用加热的方法分离NH4Cl和I2的固体混合物。( )
(8)蒸馏中,冷却水应从冷凝管的下口通入,上口流出。( )
×
×
×
×
×
×
×
√
2.请选用适当的分离方法,按要求分离下列混合物。
A.过滤 B.蒸发 C.盐析 D.蒸馏 E.升华 F.分液 G.重结晶
① 从海水中获得粗食盐
② 除去氯化钠溶液中的泥沙
③ 分离固体氯化钠和单质碘
④ 用自来水制取蒸馏水
⑤ 油脂发生皂化反应后产物的分离
⑥ 四氯化碳和水的分离
⑦ 除去硝酸钾溶液中混有的少量氯化钠
B
A
E
D
C
F
G
3.下列实验所选择的装置或仪器都正确的是( )。
A
解析:植物油和氯化钠溶液不互溶,可用分液法分离,A项正确。除去氯化钠晶体中混有的氯化铵晶体应用加热分解法,而不能用蒸馏法,B项错误。分离CCl4中的Br2应用蒸馏法,不能用过滤法,C项错误。NaOH溶液可以同时吸收CO2和HCl,D项错误。
第二环节 关键能力形成
能力点1
选用合适的方法对物质进行检验的能力
整合建构
1.物质检验的一般思路和程序
如固态物质的检验程序:
2.离子检验实验操作的答题模板
例如:检验某溶液中含有Fe2+而不含Fe3+的方法是取适量溶液放入洁净的试管中,滴加几滴KSCN溶液,无明显现象,再向溶液中滴加几滴H2O2溶液(或新制氯水),溶液变为红色,说明溶液中含有Fe2+而不含Fe3+。
问题引领
(1)解答离子检验问题时,需要注意什么问题
(2)解答物质检验类题目时,常见的突破口有哪些
点拨(1)解答离子检验问题时,需要关注如下“九字诀”。
(2)解答物质检验类题目时,常见的突破口有如下几个方面。
①溶于水显碱性的气体:NH3。
②在空气中由无色变为红棕色的气体:NO。
③在一定条件下能漂白有色物质的淡黄色固体:Na2O2。
④遇SCN-显红色,遇OH-生成红褐色沉淀的离子:Fe3+。
⑤遇Ag+产生不溶于稀硝酸的沉淀,若沉淀为白色则含有Cl-;若沉淀为浅黄色则含有Br-;若沉淀为黄色则含有I-。
⑥可溶于NaOH溶液的白色沉淀:Al(OH)3;可溶于NaOH溶液的金属氧化物:Al2O3。
⑦能与NaOH溶液作用产生H2的金属是Al。
⑧能与盐酸反应产生有刺激性气味的气体,且该气体通入品红溶液后,溶液褪色,加热又复原的离子:
训练突破
1.根据实验操作和现象所得出的结论正确的是( )。
A
选项 操作 现象 结论
A 向某浓溶液中加入铜片和浓硫酸并加热 产生红棕色有刺激性气味的气体 原溶液中一定有N
B 向某溶液中滴入氯水,再滴加KSCN溶液 溶液显红色 原溶液中一定有Fe2+
C 向某无色溶液中加入硝酸钡溶液 产生白色沉淀,沉淀难溶于稀硝酸 原溶液中一定有S
D 向品红溶液中通入气体 溶液褪色 该气体一定是SO2
2.某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”)。
(1)将少量混合物放入水中得到无色溶液和白色沉淀。
(2)取溶液进行焰色试验,火焰呈黄色。
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
(4)通过上述实验仍无法确定的物质是 。
答案:(1)无 CuSO4 溶液无色,而CuSO4溶液为蓝色
(2)Na2SO4 无 焰色试验中钠元素的焰色呈黄色
(3)MgCO3 Ba(NO3)2、AgNO3 MgCO3沉淀溶于盐酸,有气体放出;(2)中已确定有Na2SO4,如有Ba(NO3)2,生成的BaSO4沉淀难溶于盐酸;如有AgNO3,生成的Ag2SO4沉淀在盐酸中不消失,会转化为AgCl白色沉淀
(4)Al2(SO4)3
能力点2
选用合适的方法分离或提纯物质的能力
整合建构
1.物质分离与提纯应遵循的原则及注意事项
2.混合物分离与提纯的物理方法的选择
(1)“固+固”混合物的分离(提纯)。
(2)“固+液”混合物的分离(提纯)。
(3)“液+液”混合物的分离(提纯)。
3.化学方法除杂的一般思路
问题引领
(1)解答物质分离提纯类题目的一般步骤是什么
(2)常见物质分离操作中的注意事项是什么
点拨(1)解答物质分离提纯类题目的一般步骤如下。
第一步:确定被提纯物质与除杂对象。
对比两者物理性质、化学性质的差异,利用差异性(如溶解度差异、密度差异、熔点或沸点差异、与某些物质反应的差异性等),选择合适的分离原理或除杂试剂;除杂试剂除去杂质的同时,不消耗被提纯物质,不引入新的杂质。
第二步:选择合适的分离或除杂装置。
根据分离原理选择合适的分离装置(过滤、分液、蒸馏等);根据除杂试剂的状态及反应条件,选择合适的装置,液体试剂一般用洗气瓶,固体试剂一般用球形干燥管或U形管。
第三步:综合分析,筛选答案。
综合分析物质分离是否完全,被提纯物质中的杂质是否被除去。
(2)常见物质分离操作中的注意事项。
①过滤中的“3要求”:一贴二低三靠。
②蒸发中的“2注意”:玻璃棒搅拌和不能蒸干。
③萃取分液中的“4步操作”:加萃取剂→振荡放气→静置分层→分液。
④蒸馏中的“3注意”:温度计水银球的位置,冷却水的进出方向,加沸石防暴沸。
训练突破
1.下列操作能达到相应实验目的的是( )。
A
解析:A选项,酚羟基遇Fe3+发生显色反应。B选项,“84”消毒液的有效成分是次氯酸钠,是一种强碱弱酸盐,水解使溶液显碱性,但水解产物中的次氯酸具有漂白性,对pH试纸有漂白作用,可以应用pH计测量。C选项,溴水与苯酚生成的三溴苯酚也可溶于苯中,一般加入氢氧化钠溶液再进行分液。D选项,正确顺序为依次加入乙醇、浓硫酸、乙酸、碎瓷片,再加热。
2.实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示,下列分析错误的是( )。
A.操作Ⅰ是溶解,操作Ⅱ是蒸发浓缩
B.若从分离出固体的滤液中获得NaCl晶体,可再降温结晶
C.操作Ⅲ是降温结晶→过滤→洗涤→干燥,使硝酸钾晶体从溶液中分离岀来
D.除去KNO3中少量NaCl的原理是两者的溶解度受温度影响不同
B
解析:试样先用适量水溶解,再进行蒸发浓缩,得到较高温度下的饱和溶液,A项正确。由于NaCl的溶解度随温度降低变化不大,故从其溶液中获得晶体一般采用蒸发结晶的方法,B项错误。操作Ⅲ是降温结晶析出KNO3,经过滤、洗涤、干燥可得KNO3晶体,C项正确。KNO3的溶解度随温度的升高而显著增大,NaCl的溶解度随温度的升高增大不明显,D项正确。
第三环节 核心素养提升
【高考真题剖析】
【例题】 (2020全国Ⅱ改编)苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
(3)纯度测定:称取0.122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25.00 mL溶液,用0.010 00 mol·L-1的KOH标准溶液滴定,三次滴定平均消耗21.50 mL的KOH标准溶液。
回答下列问题。
(1)根据上述实验试剂的用量,三颈烧瓶的最适宜规格为 (填字母)。
A.100 mL B.250 mL
C.500 mL D.1 000 mL
(2)在反应装置中应选用 (填“直形”或“球形”)冷凝管,当回流液不再出现油珠即可判断反应已完成,其判断理由是 。
(3)加入适量饱和亚硫酸氢钠溶液的目的是 ;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理 。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是 。
(6)本实验制备的苯甲酸的纯度为 ;据此估算本实验中苯甲酸的产率最接近于 (填字母)。
A.70% B.60%
C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中 的方法提纯。
【核心素养考查点剖析】本题主要以物质的制备为载体,考查制备方案的设计,涉及物质的分离提纯、仪器的使用、产率计算等,考查了实验综合能力 ,渗透了 “科学探究与创新意识”的学科素养。题目的难度较大。
【答案及评分细则】(1)B(写成小写字母不得分)
(2)球形(出现错别字不得分) 无油珠说明难溶于水的甲苯已经被完全氧化(其他合理叙述同样得分,物质名称出现错别字不得分)
(3)除去过量的高锰酸钾,避免在用盐酸酸化时,产生氯气(其他合理叙述同样得分,物质名称出现错别字不得分)
2 +5H2C2O4+6H+══2Mn2++10CO2↑+8H2O(方程式不配平不得分,化学式写错不得分,书写不规范如漏掉气体符号的扣1分)
(4)MnO2(化学式写错不得分,用汉字“二氧化锰” 描述也得分)
(5)苯甲酸升华而损失(其他合理叙述同样得分,物质名称出现错别字不得分)
(6)86.0%(0.86或者86%均得分) C
(7)重结晶(其他答案不得分,出现错别字不得分)
解析:(1)反应物总体积略大于100 mL,根据三颈烧瓶的使用原则,适合选择250 mL的三颈烧瓶。
(2)冷凝管在该实验中起冷凝回流作用,为增大蒸气与冷却水的接触面积,提高冷却效果,选用球形冷凝管。甲苯的沸点较低,且难溶于水,回流液中无油珠,则证明甲苯已经被氧化完全。
(3)NaHSO3具有还原性,可用于除去过量的KMnO4,避免在后续操作中加入的浓盐酸与KMnO4发生反应产生氯气。H2C2O4中C的化合价为+3价,酸性条件下被氧化为CO2, (Mn的化合价为+7价)被还原为Mn2+,利用得失电子守恒等配平方程式即可。
(4)由题目所给方程式可知,KMnO4氧化 时,被还原为MnO2,故“用少量热水洗涤滤渣”一步中滤渣的主要成分为MnO2。
(5)因苯甲酸易升华,若干燥时温度过高,会导致苯甲酸损失。
(6)纯度测定时,得到下列关系式:
(7)利用苯甲酸在热水、冷水中的溶解度差异,可采用在水中重结晶的方法提纯。
【典题训练】
1.(2022浙江卷改编)亚硝酸钠俗称“工业盐”,其外观、口感与食盐相似,人若误服会中毒。现将适量某样品(成分为亚硝酸钠或氯化钠)溶于水配成溶液,分别取少量该溶液放入试管中进行实验。下列方案设计、现象和结论都正确的是( )。
选项 方案设计 现象和结论
A 先加入少量KClO3溶液,再加AgNO3溶液和足量稀硝酸,振荡 若产生白色沉淀,则样品为亚硝酸钠
B 加到少量KMnO4溶液中,再加硫酸酸化,振荡 若溶液褪色,则样品为亚硝酸钠
C 先加到少量FeCl2溶液中,再加入稀盐酸酸化,振荡 若溶液变黄色,则样品为亚硝酸钠
D 先加入少量Na2SO3溶液,再加入BaCl2溶液和稀硝酸,振荡 若产生白色沉淀,则样品为亚硝酸钠
C
解析:氯离子可以与银离子结合生成白色沉淀,若出现白色沉淀,样品也可能为氯化钠,A项错误。若样品为亚硝酸钠,则亚硝酸根离子被酸性高锰酸钾溶液氧化,可以使溶液褪色。若样品为氯化钠,氯离子也能被酸性高锰酸钾溶液氧化,使溶液褪色,B项错误。若样品为氯化钠,溶液颜色无明显变化。若样品为亚硝酸钠,亚硝酸根在酸性环境下会将Fe2+氧化为Fe3+,使溶液变
2.(2024吉林卷)下列实验方法或试剂使用合理的是( )。
选项 实验目的 实验方法或试剂
A 检验NaBr溶液中是否含有Fe2+ K3[Fe(CN)6]溶液
B 测定KHS溶液中c(S2-) 用AgNO3溶液滴定
C 除去乙醇中少量的水 加入金属Na,过滤
D 测定KClO溶液的pH 使用pH试纸
A
解析:Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀,A项正确;KHS溶液中存在平衡HS- H++S2-,加入AgNO3溶液后,Ag+消耗溶液中的S2-,导致HS-的电离平衡正向移动,继续电离出S2-,因此无法准确测定KHS溶液中的S2-的浓度, B项错误;金属钠既与水反应,又与乙醇反应,若要除去乙醇中的水,可加入CaO后蒸馏,C项错误;KClO溶液具有强氧化性,可漂白pH试纸,pH试纸不能测量KClO溶液的pH,故D项错误。
3.(2023全国甲)钴配合物[Co(NH3)6]Cl3溶于热水,在冷水中微溶,可通过如下反应制备:
2CoCl2+2NH4Cl+10NH3+H2O2 2[Co(NH3)6]Cl3+2H2O
具体步骤如下:
Ⅰ.称取2.0 g NH4Cl,用5 mL水溶解。
Ⅱ.分批加入3.0 g CoCl2·6H2O后,将溶液温度降至10 ℃以下,加入1 g活性炭、7 mL浓氨水,搅拌下逐滴加入10 mL 6%的双氧水。
Ⅲ.加热至55~60 ℃反应20 min。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的25 mL沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入4 mL浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)步骤Ⅰ中使用的部分仪器如下。
仪器a的名称是 。加快NH4Cl溶解的操作有 。
(2)步骤Ⅱ中,将温度降至10 ℃以下以避免 、 ;可选用 降低溶液温度。
(3)指出下列过滤操作中不规范之处: 。
(4)步骤Ⅳ中,趁热过滤,除掉的不溶物主要为 。
(5)步骤Ⅴ中加入浓盐酸的目的是 。
答案:(1)锥形瓶 加热、搅拌(振摇)
(2)氨逸出 过氧化氢分解 冰水浴(冷水浴)
(3)漏斗末端顶尖未紧靠烧杯内壁;玻璃棒下端未贴近滤纸
(4)活性炭
(5)(利用同离子效应)增大氯离子浓度,抑制[Co(NH3)6]Cl3的溶解,利于[Co(NH3)6]Cl3晶体的析出,提高产率
解析:(1)步骤Ⅰ中,仪器a是锥形瓶;该步骤中加快氯化铵溶解的操作有:用玻璃棒搅拌和用酒精灯加热,都会促进固体的溶解。
(2)步骤Ⅱ中,依据实验制备的化学方程式知,反应物有氨水和过氧化氢溶液。温度太高,氨水易挥发、过氧化氢易分解。反应需要将温度降至10 ℃以下,可选用冰水浴(或冷水浴)来降低溶液温度。
(3)过滤操作中,需要“一贴二低三靠”,故本题中错误操作有:漏斗末端顶尖未紧靠烧杯内壁;玻璃棒下端未贴近滤纸。
(4)因为步骤Ⅱ中加入1 g活性炭,活性炭不参与反应,也不溶于水。第Ⅲ步反应完全,因[Co(NH3)6]Cl3微溶于冷水,冷却、过滤的滤渣是[Co(NH3)6]Cl3和活性炭。[Co(NH3)6]Cl3易溶于热水,将粗产品溶于热水,趁热过滤,除去活性炭。
(5)步骤Ⅴ中,加入浓盐酸的目的是增大c(Cl-),抑制[Co(NH3)6]Cl3的溶解,利于[Co(NH3)6]Cl3晶体的析出,提高产率。
【新情境模拟训练】
(2024山东卷)我国科学家在青蒿素研究方面为人类健康作出了巨大贡献。在青蒿素研究实验中,下列描述错误的是( )。
A.通过萃取法可获得含青蒿素的提取液
B.通过X射线衍射可测定青蒿素晶体结构
C.通过核磁共振谱可推测青蒿素相对分子质量
D.通过红外光谱可推测青蒿素分子中的官能团
解析:青蒿素为有机化合物,可以用萃取方法提取青蒿素,A项正确;X射线衍射实验可以测定键角和键长,从而确定晶体的结构,也是测定晶体结构的最有效的方法,B项正确;核磁共振谱通常用来测定成键情况,C项错误;红外光谱用来测定分子所含的化学键和官能团,D项正确。
C
第2节 物质的检验、分离与提纯
第1章
课标要求
1.初步学会物质的检验、分离、提纯和溶液配制等化学实验基础知识和基本技能。
2.学习进行物质分离、检验和制备等不同类型化学实验的核心思路与基本方法。
3.能根据物质性质的差异选择物质分离的实验方法;能根据物质的特征反应和干扰因素选取适当的检验试剂。
备考指导
1.本节在高考试题中的考查形式有:(1)将物质的特征性质与实验现象相结合,考查物质的检验;(2)以制备物质的实验为载体,结合物质的物理性质进行物质分离的考查,结合物质的化学性质进行物质提纯的考查。题型有选择题和综合实验题,试题以中等难度及中等难度偏上为主。
2.对检验、分离、提纯等知识的复习,重点掌握常见的分离、提纯混合物的方法,掌握常见离子、特殊物质的检验方法,对物质的检验、分离与提纯的方法形成答题模板。
内容索引
01
02
03
第一环节 必备知识落实
第二环节 关键能力形成
第三环节 核心素养提升
第一环节 必备知识落实
知识点1
物质的检验
知识筛查
1.常见阳离子的检验
名师点拨(1)阳离子的检验除了一些特殊的方法(如焰色试验、KSCN溶液显色反应)外,一般用NaOH溶液即可鉴别;(2)在没有特殊要求时,如果有多种检验方法,应该选择教材中给定的方法,如检验Fe3+用KSCN溶液。
2.常见阴离子的检验
(1)利用酸碱指示剂检验。
(2)利用盐酸和其他试剂检验。
(3)Cl-、Br-、I-的检验。
①硝酸酸化的硝酸银溶液。
②氧化—萃取检验法(检验Br-、I-)。
③特征反应检验法。
3.常见气体的检验
(1)可燃性气体的检验。
(2)酸性气体的检验。
(3)碱性气体的检验(NH3)。
(4)强氧化性气体的检验。
名师点拨(1)检验气体时,要防止气体之间的互相干扰,如Cl2、SO2均能使品红溶液褪色。(2)中学阶段只学过一种碱性气体,使湿润的红色石蕊试纸变蓝的气体一般是NH3。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)能使品红溶液褪色的气体一定是SO2。( )
(2)使湿润的碘化钾淀粉试纸变蓝的气体一定是Cl2。( )
(3)加盐酸有无色、无臭气体生成,通入澄清石灰水产生白色沉淀,该溶液中一定含有 。( )
×
×
×
×
√
2.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )。
B
知识点2
物质的分离与提纯
知识筛查
1.物质分离、提纯的区别
(1)物质的分离:将混合物的各组分分离出来,获得几种纯净物的过程。
(2)物质的提纯:将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂。
2.物质分离、提纯的常用物理方法
3.物质分离、提纯的常用化学方法
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)过滤时,为加快过滤速度,应用玻璃棒不断搅拌漏斗中液体。( )
(2)从溶液中获取NaCl晶体,用蒸发结晶的方法,其操作应使混合物中的水分完全蒸干后,再停止加热。( )
(3)根据食用油和汽油的密度不同,可选用分液的方法分离。( )
(4)用乙醇萃取出溴水中的溴,再用蒸馏的方法分离溴与乙醇。( )
(5)蒸馏时温度计的水银球应插入液体中。( )
(6)在蒸馏过程中,若发现忘加沸石,应停止加热立即补加。( )
(7)利用加热的方法分离NH4Cl和I2的固体混合物。( )
(8)蒸馏中,冷却水应从冷凝管的下口通入,上口流出。( )
×
×
×
×
×
×
×
√
2.请选用适当的分离方法,按要求分离下列混合物。
A.过滤 B.蒸发 C.盐析 D.蒸馏 E.升华 F.分液 G.重结晶
① 从海水中获得粗食盐
② 除去氯化钠溶液中的泥沙
③ 分离固体氯化钠和单质碘
④ 用自来水制取蒸馏水
⑤ 油脂发生皂化反应后产物的分离
⑥ 四氯化碳和水的分离
⑦ 除去硝酸钾溶液中混有的少量氯化钠
B
A
E
D
C
F
G
3.下列实验所选择的装置或仪器都正确的是( )。
A
解析:植物油和氯化钠溶液不互溶,可用分液法分离,A项正确。除去氯化钠晶体中混有的氯化铵晶体应用加热分解法,而不能用蒸馏法,B项错误。分离CCl4中的Br2应用蒸馏法,不能用过滤法,C项错误。NaOH溶液可以同时吸收CO2和HCl,D项错误。
第二环节 关键能力形成
能力点1
选用合适的方法对物质进行检验的能力
整合建构
1.物质检验的一般思路和程序
如固态物质的检验程序:
2.离子检验实验操作的答题模板
例如:检验某溶液中含有Fe2+而不含Fe3+的方法是取适量溶液放入洁净的试管中,滴加几滴KSCN溶液,无明显现象,再向溶液中滴加几滴H2O2溶液(或新制氯水),溶液变为红色,说明溶液中含有Fe2+而不含Fe3+。
问题引领
(1)解答离子检验问题时,需要注意什么问题
(2)解答物质检验类题目时,常见的突破口有哪些
点拨(1)解答离子检验问题时,需要关注如下“九字诀”。
(2)解答物质检验类题目时,常见的突破口有如下几个方面。
①溶于水显碱性的气体:NH3。
②在空气中由无色变为红棕色的气体:NO。
③在一定条件下能漂白有色物质的淡黄色固体:Na2O2。
④遇SCN-显红色,遇OH-生成红褐色沉淀的离子:Fe3+。
⑤遇Ag+产生不溶于稀硝酸的沉淀,若沉淀为白色则含有Cl-;若沉淀为浅黄色则含有Br-;若沉淀为黄色则含有I-。
⑥可溶于NaOH溶液的白色沉淀:Al(OH)3;可溶于NaOH溶液的金属氧化物:Al2O3。
⑦能与NaOH溶液作用产生H2的金属是Al。
⑧能与盐酸反应产生有刺激性气味的气体,且该气体通入品红溶液后,溶液褪色,加热又复原的离子:
训练突破
1.根据实验操作和现象所得出的结论正确的是( )。
A
选项 操作 现象 结论
A 向某浓溶液中加入铜片和浓硫酸并加热 产生红棕色有刺激性气味的气体 原溶液中一定有N
B 向某溶液中滴入氯水,再滴加KSCN溶液 溶液显红色 原溶液中一定有Fe2+
C 向某无色溶液中加入硝酸钡溶液 产生白色沉淀,沉淀难溶于稀硝酸 原溶液中一定有S
D 向品红溶液中通入气体 溶液褪色 该气体一定是SO2
2.某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”)。
(1)将少量混合物放入水中得到无色溶液和白色沉淀。
(2)取溶液进行焰色试验,火焰呈黄色。
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
(4)通过上述实验仍无法确定的物质是 。
答案:(1)无 CuSO4 溶液无色,而CuSO4溶液为蓝色
(2)Na2SO4 无 焰色试验中钠元素的焰色呈黄色
(3)MgCO3 Ba(NO3)2、AgNO3 MgCO3沉淀溶于盐酸,有气体放出;(2)中已确定有Na2SO4,如有Ba(NO3)2,生成的BaSO4沉淀难溶于盐酸;如有AgNO3,生成的Ag2SO4沉淀在盐酸中不消失,会转化为AgCl白色沉淀
(4)Al2(SO4)3
能力点2
选用合适的方法分离或提纯物质的能力
整合建构
1.物质分离与提纯应遵循的原则及注意事项
2.混合物分离与提纯的物理方法的选择
(1)“固+固”混合物的分离(提纯)。
(2)“固+液”混合物的分离(提纯)。
(3)“液+液”混合物的分离(提纯)。
3.化学方法除杂的一般思路
问题引领
(1)解答物质分离提纯类题目的一般步骤是什么
(2)常见物质分离操作中的注意事项是什么
点拨(1)解答物质分离提纯类题目的一般步骤如下。
第一步:确定被提纯物质与除杂对象。
对比两者物理性质、化学性质的差异,利用差异性(如溶解度差异、密度差异、熔点或沸点差异、与某些物质反应的差异性等),选择合适的分离原理或除杂试剂;除杂试剂除去杂质的同时,不消耗被提纯物质,不引入新的杂质。
第二步:选择合适的分离或除杂装置。
根据分离原理选择合适的分离装置(过滤、分液、蒸馏等);根据除杂试剂的状态及反应条件,选择合适的装置,液体试剂一般用洗气瓶,固体试剂一般用球形干燥管或U形管。
第三步:综合分析,筛选答案。
综合分析物质分离是否完全,被提纯物质中的杂质是否被除去。
(2)常见物质分离操作中的注意事项。
①过滤中的“3要求”:一贴二低三靠。
②蒸发中的“2注意”:玻璃棒搅拌和不能蒸干。
③萃取分液中的“4步操作”:加萃取剂→振荡放气→静置分层→分液。
④蒸馏中的“3注意”:温度计水银球的位置,冷却水的进出方向,加沸石防暴沸。
训练突破
1.下列操作能达到相应实验目的的是( )。
A
解析:A选项,酚羟基遇Fe3+发生显色反应。B选项,“84”消毒液的有效成分是次氯酸钠,是一种强碱弱酸盐,水解使溶液显碱性,但水解产物中的次氯酸具有漂白性,对pH试纸有漂白作用,可以应用pH计测量。C选项,溴水与苯酚生成的三溴苯酚也可溶于苯中,一般加入氢氧化钠溶液再进行分液。D选项,正确顺序为依次加入乙醇、浓硫酸、乙酸、碎瓷片,再加热。
2.实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示,下列分析错误的是( )。
A.操作Ⅰ是溶解,操作Ⅱ是蒸发浓缩
B.若从分离出固体的滤液中获得NaCl晶体,可再降温结晶
C.操作Ⅲ是降温结晶→过滤→洗涤→干燥,使硝酸钾晶体从溶液中分离岀来
D.除去KNO3中少量NaCl的原理是两者的溶解度受温度影响不同
B
解析:试样先用适量水溶解,再进行蒸发浓缩,得到较高温度下的饱和溶液,A项正确。由于NaCl的溶解度随温度降低变化不大,故从其溶液中获得晶体一般采用蒸发结晶的方法,B项错误。操作Ⅲ是降温结晶析出KNO3,经过滤、洗涤、干燥可得KNO3晶体,C项正确。KNO3的溶解度随温度的升高而显著增大,NaCl的溶解度随温度的升高增大不明显,D项正确。
第三环节 核心素养提升
【高考真题剖析】
【例题】 (2020全国Ⅱ改编)苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
(3)纯度测定:称取0.122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25.00 mL溶液,用0.010 00 mol·L-1的KOH标准溶液滴定,三次滴定平均消耗21.50 mL的KOH标准溶液。
回答下列问题。
(1)根据上述实验试剂的用量,三颈烧瓶的最适宜规格为 (填字母)。
A.100 mL B.250 mL
C.500 mL D.1 000 mL
(2)在反应装置中应选用 (填“直形”或“球形”)冷凝管,当回流液不再出现油珠即可判断反应已完成,其判断理由是 。
(3)加入适量饱和亚硫酸氢钠溶液的目的是 ;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理 。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是 。
(6)本实验制备的苯甲酸的纯度为 ;据此估算本实验中苯甲酸的产率最接近于 (填字母)。
A.70% B.60%
C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中 的方法提纯。
【核心素养考查点剖析】本题主要以物质的制备为载体,考查制备方案的设计,涉及物质的分离提纯、仪器的使用、产率计算等,考查了实验综合能力 ,渗透了 “科学探究与创新意识”的学科素养。题目的难度较大。
【答案及评分细则】(1)B(写成小写字母不得分)
(2)球形(出现错别字不得分) 无油珠说明难溶于水的甲苯已经被完全氧化(其他合理叙述同样得分,物质名称出现错别字不得分)
(3)除去过量的高锰酸钾,避免在用盐酸酸化时,产生氯气(其他合理叙述同样得分,物质名称出现错别字不得分)
2 +5H2C2O4+6H+══2Mn2++10CO2↑+8H2O(方程式不配平不得分,化学式写错不得分,书写不规范如漏掉气体符号的扣1分)
(4)MnO2(化学式写错不得分,用汉字“二氧化锰” 描述也得分)
(5)苯甲酸升华而损失(其他合理叙述同样得分,物质名称出现错别字不得分)
(6)86.0%(0.86或者86%均得分) C
(7)重结晶(其他答案不得分,出现错别字不得分)
解析:(1)反应物总体积略大于100 mL,根据三颈烧瓶的使用原则,适合选择250 mL的三颈烧瓶。
(2)冷凝管在该实验中起冷凝回流作用,为增大蒸气与冷却水的接触面积,提高冷却效果,选用球形冷凝管。甲苯的沸点较低,且难溶于水,回流液中无油珠,则证明甲苯已经被氧化完全。
(3)NaHSO3具有还原性,可用于除去过量的KMnO4,避免在后续操作中加入的浓盐酸与KMnO4发生反应产生氯气。H2C2O4中C的化合价为+3价,酸性条件下被氧化为CO2, (Mn的化合价为+7价)被还原为Mn2+,利用得失电子守恒等配平方程式即可。
(4)由题目所给方程式可知,KMnO4氧化 时,被还原为MnO2,故“用少量热水洗涤滤渣”一步中滤渣的主要成分为MnO2。
(5)因苯甲酸易升华,若干燥时温度过高,会导致苯甲酸损失。
(6)纯度测定时,得到下列关系式:
(7)利用苯甲酸在热水、冷水中的溶解度差异,可采用在水中重结晶的方法提纯。
【典题训练】
1.(2022浙江卷改编)亚硝酸钠俗称“工业盐”,其外观、口感与食盐相似,人若误服会中毒。现将适量某样品(成分为亚硝酸钠或氯化钠)溶于水配成溶液,分别取少量该溶液放入试管中进行实验。下列方案设计、现象和结论都正确的是( )。
选项 方案设计 现象和结论
A 先加入少量KClO3溶液,再加AgNO3溶液和足量稀硝酸,振荡 若产生白色沉淀,则样品为亚硝酸钠
B 加到少量KMnO4溶液中,再加硫酸酸化,振荡 若溶液褪色,则样品为亚硝酸钠
C 先加到少量FeCl2溶液中,再加入稀盐酸酸化,振荡 若溶液变黄色,则样品为亚硝酸钠
D 先加入少量Na2SO3溶液,再加入BaCl2溶液和稀硝酸,振荡 若产生白色沉淀,则样品为亚硝酸钠
C
解析:氯离子可以与银离子结合生成白色沉淀,若出现白色沉淀,样品也可能为氯化钠,A项错误。若样品为亚硝酸钠,则亚硝酸根离子被酸性高锰酸钾溶液氧化,可以使溶液褪色。若样品为氯化钠,氯离子也能被酸性高锰酸钾溶液氧化,使溶液褪色,B项错误。若样品为氯化钠,溶液颜色无明显变化。若样品为亚硝酸钠,亚硝酸根在酸性环境下会将Fe2+氧化为Fe3+,使溶液变
2.(2024吉林卷)下列实验方法或试剂使用合理的是( )。
选项 实验目的 实验方法或试剂
A 检验NaBr溶液中是否含有Fe2+ K3[Fe(CN)6]溶液
B 测定KHS溶液中c(S2-) 用AgNO3溶液滴定
C 除去乙醇中少量的水 加入金属Na,过滤
D 测定KClO溶液的pH 使用pH试纸
A
解析:Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀,A项正确;KHS溶液中存在平衡HS- H++S2-,加入AgNO3溶液后,Ag+消耗溶液中的S2-,导致HS-的电离平衡正向移动,继续电离出S2-,因此无法准确测定KHS溶液中的S2-的浓度, B项错误;金属钠既与水反应,又与乙醇反应,若要除去乙醇中的水,可加入CaO后蒸馏,C项错误;KClO溶液具有强氧化性,可漂白pH试纸,pH试纸不能测量KClO溶液的pH,故D项错误。
3.(2023全国甲)钴配合物[Co(NH3)6]Cl3溶于热水,在冷水中微溶,可通过如下反应制备:
2CoCl2+2NH4Cl+10NH3+H2O2 2[Co(NH3)6]Cl3+2H2O
具体步骤如下:
Ⅰ.称取2.0 g NH4Cl,用5 mL水溶解。
Ⅱ.分批加入3.0 g CoCl2·6H2O后,将溶液温度降至10 ℃以下,加入1 g活性炭、7 mL浓氨水,搅拌下逐滴加入10 mL 6%的双氧水。
Ⅲ.加热至55~60 ℃反应20 min。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的25 mL沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入4 mL浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)步骤Ⅰ中使用的部分仪器如下。
仪器a的名称是 。加快NH4Cl溶解的操作有 。
(2)步骤Ⅱ中,将温度降至10 ℃以下以避免 、 ;可选用 降低溶液温度。
(3)指出下列过滤操作中不规范之处: 。
(4)步骤Ⅳ中,趁热过滤,除掉的不溶物主要为 。
(5)步骤Ⅴ中加入浓盐酸的目的是 。
答案:(1)锥形瓶 加热、搅拌(振摇)
(2)氨逸出 过氧化氢分解 冰水浴(冷水浴)
(3)漏斗末端顶尖未紧靠烧杯内壁;玻璃棒下端未贴近滤纸
(4)活性炭
(5)(利用同离子效应)增大氯离子浓度,抑制[Co(NH3)6]Cl3的溶解,利于[Co(NH3)6]Cl3晶体的析出,提高产率
解析:(1)步骤Ⅰ中,仪器a是锥形瓶;该步骤中加快氯化铵溶解的操作有:用玻璃棒搅拌和用酒精灯加热,都会促进固体的溶解。
(2)步骤Ⅱ中,依据实验制备的化学方程式知,反应物有氨水和过氧化氢溶液。温度太高,氨水易挥发、过氧化氢易分解。反应需要将温度降至10 ℃以下,可选用冰水浴(或冷水浴)来降低溶液温度。
(3)过滤操作中,需要“一贴二低三靠”,故本题中错误操作有:漏斗末端顶尖未紧靠烧杯内壁;玻璃棒下端未贴近滤纸。
(4)因为步骤Ⅱ中加入1 g活性炭,活性炭不参与反应,也不溶于水。第Ⅲ步反应完全,因[Co(NH3)6]Cl3微溶于冷水,冷却、过滤的滤渣是[Co(NH3)6]Cl3和活性炭。[Co(NH3)6]Cl3易溶于热水,将粗产品溶于热水,趁热过滤,除去活性炭。
(5)步骤Ⅴ中,加入浓盐酸的目的是增大c(Cl-),抑制[Co(NH3)6]Cl3的溶解,利于[Co(NH3)6]Cl3晶体的析出,提高产率。
【新情境模拟训练】
(2024山东卷)我国科学家在青蒿素研究方面为人类健康作出了巨大贡献。在青蒿素研究实验中,下列描述错误的是( )。
A.通过萃取法可获得含青蒿素的提取液
B.通过X射线衍射可测定青蒿素晶体结构
C.通过核磁共振谱可推测青蒿素相对分子质量
D.通过红外光谱可推测青蒿素分子中的官能团
解析:青蒿素为有机化合物,可以用萃取方法提取青蒿素,A项正确;X射线衍射实验可以测定键角和键长,从而确定晶体的结构,也是测定晶体结构的最有效的方法,B项正确;核磁共振谱通常用来测定成键情况,C项错误;红外光谱用来测定分子所含的化学键和官能团,D项正确。
C
同课章节目录
