2026届高考化学一轮复习 第2章 物质的量 第1节 物质的量 气体摩尔体积 课件(65张PPT)
文档属性
| 名称 | 2026届高考化学一轮复习 第2章 物质的量 第1节 物质的量 气体摩尔体积 课件(65张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-15 10:13:13 | ||
图片预览










文档简介
(共65张PPT)
第1节 物质的量 气体摩尔体积
第2章
课标要求
1.了解物质的量及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
2.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、气体摩尔体积之间的相互关系进行简单计算。
备考指导
1.本部分知识在高考中一般以选择题形式进行考查,主要考查内容有阿伏加德罗常数、气体摩尔体积等,同时又隐含对物质结构、氧化还原反应、弱电解质的电离、盐类水解等知识的考查。在第Ⅱ卷中主要在流程图题目、实验题目中设置以物质的量为中心的计算题,难度中等。
2.高考的备考中,要重点掌握以物质的量为中心的化学计量关系网络,理解阿伏加德罗定律及其推论的应用。在有关物质的量的计算过程中,通过分析、推理认识计算的方法,建立阿伏加德罗常数、气体摩尔体积等题目解答的模型。
内容索引
01
02
03
第一环节 必备知识落实
第二环节 关键能力形成
第三环节 核心素养提升
第一环节 必备知识落实
知识点1
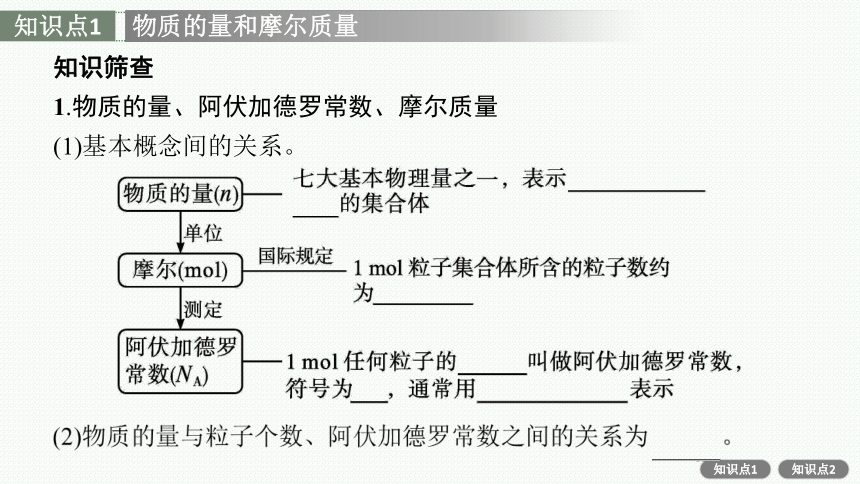
物质的量和摩尔质量
知识筛查
1.物质的量、阿伏加德罗常数、摩尔质量
(1)基本概念间的关系。
特别提醒(1)物质的量的描述对象是微观粒子,如电子、质子、中子、原子、分子、离子、原子团等,不能用于描述宏观物体。
(2)勿忽视摩尔的使用对象:使用摩尔作单位时,必须用化学式指明粒子的种类,如1 mol Fe、1 mol O2等。
2.摩尔质量
定义—单位物质的量的物质所具有的质量
↓
符号—M
↓
单位—g·mol-1
↓
特别提醒(1)摩尔质量(g·mol-1)、相对分子质量、1 mol该物质的质量(g)在数值上是相同的,但含义不同,具有不同的单位。如Fe的摩尔质量为56 g·mol-1,Fe的相对原子质量为56,1 mol Fe的质量为56 g。
(2)摩尔质量只有当以g·mol-1作单位时,在数值上才等于物质的相对原子(或分子)质量。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)摩尔是表示物质的量多少的基本物理量。( )
(2)物质的量就是1 mol物质的质量。( )
(3)0.012 kg 12C中含有约6.02×1023个碳原子。( )
(4)1 mol H2O中含有2 mol氢和1 mol氧。( )
(5)NaOH的摩尔质量为40 g。( )
(6)1 mol O2的质量与它的相对分子质量相等。( )
(7)1 mol OH-的质量为17 g·mol-1。( )
(8)2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍。( )
×
×
√
×
×
×
×
×
2.若氖原子的质量是a g,12C原子的质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是( )。
B
3.草酸(分子式为H2C2O4,沸点为150 ℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中。下列有关判断不正确的是( )。
A.H2C2O4的摩尔质量是90 g·mol-1
B.1 mol H2C2O4中约含有6.02×1023个分子
C.45 g H2C2O4中约含有1.204×1024个氧原子
D.1 mol H2C2O4在标准状况下的体积约为22.4 L
D
知识点2
气体摩尔体积 阿伏加德罗常数
知识筛查
1.影响物质体积的因素
2.气体摩尔体积
3.阿伏加德罗定律
可总结为:“三同”定“一同”,即同温、同压、同体积的气体,具有相同的 分子数。
知识巩固
1. 判断正误,正确的画“√”,错误的画“×”。
(1)标准状况下,80 g SO3中含3NA个氧原子,体积约为22.4 L。( )
(2)1 mol金刚石晶体中有4 mol碳碳键。( )
(3)在标准状况下,1 mol气体的体积约是22.4 L;在非标准状况下,1 mol气体的体积则一定不是22.4 L。( )
(4)在相同条件下,相同物质量的CO、N2的混合气体与O2的分子个数相同,原子个数也相同。( )
(5)在相同条件下,相同物质的量的C2H4和C3H6,所含分子个数相同,而相同质量时,它们所含的原子个数相同。( )
×
×
×
√
√
2.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )。
A.常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA
B.标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA
C.常温常压下,4.6 g乙醇中含有的极性共价键数目为0.8NA
D.在1 L 1.0 mol·L-1碳酸钠溶液中,阴离子总数大于NA
D
解析:常温常压下气体摩尔体积不等于22.4 L·mol-1,无法计算CO和CO2的物质的量,A项错误。标准状况下,7.1 g氯气的物质的量为0.1 mol,与足量的氢氧化钠溶液反应转移0.1 mol电子,即转移电子数为0.1NA,B项错误。4.6 g乙醇的物质的量n= =0.1 mol,而1个乙醇分子中含7个极性共价键,故0.1 mol乙醇中含极性共价键数目为0.7NA,C项错误。碳酸根离子水解生成碳酸氢根离子和氢氧根离子,1 L 1.0 mol·L-1碳酸钠溶液中含有的阴离子总数大于NA,D项正确。
3.取五个相同的气球,同温同压下,分别充入CO和以下四种混合气体,使气球的体积相等,如图所示。A、B、C、D四个气球内,与CO所含原子数一定相等的是( )。
C
解析:同温、同压下,气体体积相等则物质的量相等,而CO是双原子分子, C项中N2、O2都是双原子分子,与CO原子数相等。
第二环节 关键能力形成
能力点1
分析解决有关阿伏加德罗常数问题的能力
整合建构
问题引领
有关阿伏加德罗常数问题的常见考查角度有哪些
点拨有关阿伏加德罗常数问题的常见考查角度总结如下。
(1)通过结构考查粒子数。
命题 方向 举例(设NA代表阿伏加德罗常数的值) 判断 正误 注意事项
原子 结构 ①18 g H2O、D2O组成的物质中含有的质子数为10NA × ①注意特殊分子中的中子数;②注意官能团与离子的区别
②0.1 mol的11B中,含有0.6NA个中子 √ ③1 mol H37Cl中含有的质子数、中子数均为18NA × ④1 mol —OH与1 mol OH-所含电子数均为9NA × 命题 方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
化学 键数目 ①1 mol H2O2含有的化学键数目为3NA √ 白磷的分子结构为正四面体构型,1 mol P4(白磷)中含有的P—P的数目为6NA
②0.1 mol CCl4中含有的共价键数目为0.4NA √ ③1 mol P4(白磷)中含有的P—P的数目为4NA × ④1 mol CnH2n+2中化学键的数目为(3n+1)NA √ 命题 方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
特定 组成 ①28 g乙烯和环丁烷 (C4H8)的混合气体中含有的碳原子数为2NA √ ①看物质的最简式是否相同(如乙烯与环丁烷);
②看物质的相对分子质量是否相同(如N2、CO);
③看物质是否由同一种元素组成
(如O2、O3)
②常温常压下,92 g NO2和N2O4的混合气体中含有的原子数为6NA √ ③16 g O2和O3的混合气体中含有的氧原子数为NA √ ④1 mol Na2O2中含有的离子总数为3NA √ ⑤1 mol CO2和SO2的混合气体中含有的氧原子数为2NA √ (2)通过反应程度确定粒子数目。
命题方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
可逆 反应 ①2 mol NO2置于密闭容器中,最终生成的N2O4分子数为NA × ①注意隐含反应,如2NO2 N2O4;
②Cl2与H2O、N2与H2、SO2与O2、酯化反应等均是可逆反应,反应不能进行到底;
③盐的水解、弱电解质的电离是可逆的
②密闭容器中1 mol N2与3 mol H2充分反应,生成2 mol NH3 × ③密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA × ④1 L 0.1 mol·L-1 CH3COOH溶液中所含H+的数目为0.1NA × ⑤2 L 1 mol·L-1 FeCl3溶液中所含Fe3+的数目为2NA × 命题 方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
浓度 变化 ①常温下,含1 mol HNO3的浓硝酸与足量Cu反应,产生0.5 mol NO2 × ①浓盐酸与MnO2、浓硫酸与金属活动性顺序中氢后面的金属反应,酸不可能消耗完;
②浓硝酸与足量金属反应,先生成NO2,后生成NO;
③浓硫酸与金属活动性顺序中氢前面的金属反应,先生成SO2,后生成H2
②50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA × ③含2 mol H2SO4的浓硫酸与足量铜共热,产生1 mol SO2 × (3)电子转移数目判断。
命题方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
常规 反应 ①过氧化钠与水反应时,生成0.1 mol O2转移的电子数为0.4NA × 要注意特殊物质,如由过氧化钠、过氧化氢制取1 mol O2转移2 mol电子;铁与硫、碘、非氧化性酸反应,1 mol Fe转移2 mol电子;
1 mol Fe与足量的氯气、稀硝酸反应,转移3 mol电子
②铁与硫的反应中,1 mol Fe失去的电子数为3NA × ③标准状况下,6.72 L NO2溶于足量的水中,转移的电子数为0.3NA × ④1 mol Fe在1 mol Cl2中燃烧,转移的电子数为3NA × ⑤KIO3+6HI══KI+3H2O+3I2中,生成3 mol I2转移电子的总数为6NA × ⑥0.1 mol Cl2全部溶于水后转移电子的数目为0.2NA × (4)警惕两大设陷。
设陷 方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
气体 摩尔 体积 ①常温常压下,22.4 L氯气与足量的镁粉充分反应,转移的电子数为2NA × 常温常压,气体摩尔体积不能用22.4 L·mol-1计算;标准状况下为非气体的物质有水、乙醇、硫酸、三氧化硫、四氯化碳、苯、甲醇等
②锌与足量的稀硫酸反应生成22.4 L H2,转移电子数为2NA × ③标准状况下,2.24 L SO3中含有0.3NA个氧原子 × ④标准状况下,22.4 L CCl4中含有NA个分子 × ⑤在标准状况下,11.2 L H2和D2的混合气体中含质子数为NA √ 设陷 方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
溶液 浓度 ①在pH=13的NaOH溶液中OH-的数目约为0.1×6.02×1023 × 溶液的体积未知,溶质的物质的量无法计算,所含粒子数也无法计算
②0.1 mol·L-1 NaF溶液中所含F-的数目小于0.1NA × ③0.1 mol·L-1 CH3COOH溶液中c(H+)=0.1 mol·L-1 × 训练突破
1.(2024河北卷改编)超氧化钾(KO2)可用作潜水或航天装置的CO2吸收剂和供氧剂,反应为4KO2+2CO2══2K2CO3+3O2。NA为阿伏加德罗常数的值。下列说法正确的是( )。
A.44 g CO2中σ键的数目为2NA
B.1 mol KO2晶体中离子的数目为3NA
C.1 L 1 mol·L-1 K2CO3溶液中C的数目为NA
D.该反应中每转移1 mol电子生成O2的数目为1.5NA
A
解析:CO2的结构式为O═C═O,每个分子有两个σ键,44 g CO2的物质的量为1 mol,则分子中σ键的数目为2NA,A项正确;KO2由K+和形成,1 mol KO2晶体中离子的数目为2NA,B项错误;1 L 1 mol·L-1 K2CO3溶液含K2CO3的物质的量为1 mol,C为弱酸根离子,会发生水解,故溶液中C的数目小于NA,C项错误;KO2中O的化合价为-价,该反应为歧化反应,生成3 mol O2转移电子3 mol,则转移1 mol电子,生成O2的数目为NA,D项错误。
2.(2021河北卷)NA是阿伏加德罗常数的值,下列说法错误的是( )。
A.22.4 L(标准状况)氟气所含的质子数为18NA
B.1 mol碘蒸气和1 mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于2NA
C.电解饱和食盐水时,若阴阳两极产生气体的总质量为73 g,则转移电子数为NA
D.1 L 1 mol·L-1溴化铵水溶液中 与H+的总数大于NA
C
解析:F的原子序数为9,一个F2分子中含有的质子数为18,则标准状况下22.4 L F2含有的质子数为18NA,A项正确。I2与H2的反应为可逆反应,反应生成的HI分子数小于2NA,B项正确。电解饱和食盐水时,阴阳两极分别产生氢气和氯气,当两极产生气体的总质量为73 g时,即分别产生1 mol H2和 1 mol Cl2,转移电子数应该为2NA,C项错误。溴化铵溶液中 水解产生的H+等于水解过程中减少的 ,但是水自身还电离出H+,故 与H+的总数大于NA,D项正确。
能力点2
运用阿伏加德罗定律及其推论分析有关气体问题的能力
整合建构
(1)总结一口诀——“三同”(T、p、V) “一同”(N)→(n)。可概括为“三同”定“一同”,即在同温、同压、同体积的条件下,才有分子数相等这一结论,但所含原子数不一定相等。
(3)适用一范围——气体。阿伏加德罗定律及其推论适用于气体,既适用于单一气体,也适用于混合气体。
问题引领
如何利用阿伏加德罗定律及其推论解题
点拨阿伏加德罗定律及其推论解题模板。
第一步:找“相同”明“不同”。
(1)找出题干中有哪些相同的条件,再根据物质的量,结合物质的粒子结构,求出相应的粒子数;
(2)分析选项中的要求,明确需要求解哪些量。
第二步:用“规律”。
利用阿伏加德罗定律及其推论得出不同条件之间的关系,进行对比判断,从而顺利解题。
训练突破
1.同温同压下,相同体积的CO和CO2的下列比较中正确的是( )。
①所含的分子数目之比为1∶1 ②所含的氧原子数目之比为1∶2 ③所含的原子总数目之比为2∶3 ④两者的密度之比为7∶11 ⑤所含的电子数目之比为7∶11
A.①④ B.②③
C.④⑤ D.①②③④⑤
D
解析:同温同压下等体积的CO和CO2的物质的量相同,则分子数相等,即所含的分子数目之比为1∶1、所含的氧原子数目之比为1∶2、所含的原子总数目之比为2∶3,故①②③正确。④同温同压下,两者的密度之比等于摩尔质量之比,为7∶11,故正确。⑤同温同压下等体积的CO和CO2的物质的量相同,每个分子含有的电子数分别为14、22,则所含的电子数目之比为7∶11,故正确。
2.在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同。根据甲、乙的摩尔质量(M)的关系判断,下列说法中正确的是( )。
A.若M(甲)B.若M(甲)>M(乙),则气体摩尔体积:甲<乙
C.若M(甲)乙
D.若M(甲)>M(乙),则气体的体积:甲<乙
C
解析:根据题给信息,质量相等、温度和密度相同的甲、乙两种气体的体积相等,D项错误。等质量的气体,其摩尔质量与物质的量(或分子数)成反比,若M(甲)乙,A项错误。若M(甲)>M(乙),则物质的量甲<乙,又气体体积相等,故气体摩尔体积甲>乙,B项错误。同温、同体积、同质量的气体或混合气体,压强与摩尔质量成反比,C项正确。
能力点3
运用物质的量进行有关计算的能力
整合建构
问题引领
运用物质的量进行有关计算时,特别需要注意什么问题
点拨运用物质的量进行有关计算时,特别需要注意如下几个问题。
(1)“两个前提”:在应用Vm=22.4 L·mol-1时,一定要有“标准状况”和“气体状态”两个前提条件(混合气体也适用)。(2)“三个关系”:①直接构成物质的粒子与间接构成物质的粒子(原子、电子等)间的关系;②摩尔质量与相对分子质量间的关系;③强电解质、弱电解质与溶质粒子(分子或离子)数之间的关系。(3)“七个无关”:物质的量、质量、粒子数的多少均与温度、压强的高低无关;物质的量浓度的大小与所取该溶液的体积多少无关(但溶质粒子数的多少与溶液体积有关)。
训练突破
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )。
A.若1 mol FeCl3与水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA
B.将一定量的Cl2通入FeBr2溶液中,当有1 mol Br-转化为Br2时,转移的电子数为NA
C.44 g环氧乙烷中含有6NA个极性共价键
D.1 mol CaO2晶体中含离子总数为3NA
C
解析:氢氧化铁胶体粒子是由许多个Fe(OH)3“分子”聚集而成,因此1 mol FeCl3与水完全反应转化成氢氧化铁胶体后,其中胶体粒子的数目小于NA,A项错误。Fe2+的还原性强于Br-,通入氯气,先发生2Fe2++Cl2══2Fe3++ 2Cl-,再发生Cl2+2Br-══2Cl-+Br2,当Br-转化成Br2时,Fe2+全部转化成Fe3+,转移电子的数目大于NA,B项错误。环氧乙烷的键线式为 , 1 mol环氧乙烷中含有6 mol极性共价键,则44 g环氧乙烷的物质的量为1 mol,含有的极性共价键的数目为6NA,C项正确。CaO2由Ca2+和 构成,1 mol CaO2晶体中含离子总数为2NA,D项错误。
2.设NA为阿伏加德罗常数的值,下列说法错误的是( )。
A.12 g石墨烯和12 g金刚石均含有NA个碳原子
B.0 ℃、101 kPa下,0.1 mol乙炔和甲醛(HCHO)的混合物中含有C—H的数目为0.2NA
C.x mol R2(R的核内中子数为N,质量数为A)所含的核外电子数为x(A-N+2)NA
D.1.00 L 0.2 mol·L-1的稀硫酸与足量的金属钠反应,消耗金属钠的质量大于9.2 g
C
解析:石墨烯和金刚石都是碳元素组成的单质,12 g石墨烯和12 g金刚石都含有1 mol碳原子,A项正确。1个乙炔(H—C≡C—H)和1个甲醛(HCHO)分子中都含2个C—H,所以0.1 mol乙炔和甲醛(HCHO)的混合物中含有C—H的数目为0.2NA,B项正确。R的核内中子数为N,质量数为A,则R的质子数为A-N,R的核外电子数也为A-N,则x mol R2所含的核外电子数为2x(A-N)NA, C项错误。1.00 L 0.2 mol·L-1的稀硫酸中H+的物质的量为0.4 mol,能与0.4 mol Na(9.2 g)发生反应,但Na还能与溶液中的水反应,所以加入足量的金属钠时,消耗金属钠的质量大于9.2 g,D项正确。
第三环节 核心素养提升
【高考真题剖析】
【例1】 (2023全国甲)NA为阿伏加德罗常数的值。下列叙述正确的是
( )。
A.0.50 mol异丁烷分子中共价键的数目为6.5NA
B.标准状况下,2.24 L SO3中电子的数目为4.00NA
C.1.0 L pH=2的H2SO4溶液中H+的数目为0.02NA
D.1.0 L 1.0 mol·L-1的Na2CO3溶液中 的数目为1.0NA
A
【核心素养考查点剖析】本题是一个高考题的常规题,较好地考查了考生“宏观辨识与微观探析”素养,题目提供的均为宏观物质的宏观量,如本题的2.24 L(标准状况下)SO3、1.0 L pH=2的H2SO4溶液等,而题目要求考生分析的均为微观量,如本题的共价键数、电子数、H+数、C数。因此,顺利解答本题,要求考生在复习备考过程中,务必通过训练,学会并熟练掌握对物质进行宏观—微观—符号的三重表征。
解析:每个异丁烷(结构简式为 )分子中有13条共价键,故0.50 mol异丁烷分子中共价键的数目为6.5NA,A项正确;标准状况下,SO3是固体, B项错误;pH=2的H2SO4溶液中c(H+)=0.01 mol·L-1,1.0 L该溶液中H+的数目为0.01NA,C项错误;1.0 L 1.0 mol·L-1的Na2CO3溶液中,含溶质Na2CO3的物质的量是1 mol,由于 水解,实际存在的 的数目小于1.0NA,D项错误。
【学科思想方法】
化学计算中的常用方法——关系式法、守恒法
1.关系式法
(1)应用原理。
关系式法是表示两种或多种物质之间“物质的量”关系的一种简化式子。在多步反应中,它可以把始态的反应物与终态的生成物之间的“物质的量”关系表示出来,把多步计算简化成一步计算。正确书写关系式是用关系式法解化学计算题的前提。
(2)解题步骤。
第一步—写出各步反应的化学方程式
↓
第二步—根据化学方程式找出作为“中介”的物质,并确定最初反应物、中介物质、最终生成物之间量的关系
↓
第三步—确定最初反应物和最终生成物之间量的关系
↓
第四步—根据已知条件及关系式列出比例式计算求解
2.守恒法
(1)应用原理。
所谓“守恒”就是物质在发生“变化”或两物质在发生“相互作用”的过程中某些物理量的总量保持“不变”。在化学变化中有各种各样的守恒,如元素守恒、得失电子守恒、电荷守恒等。
(2)解题步骤。
第一步—明确题目要求解的量
↓
第二步—根据题目中要求解的量,分析反应过程中物质的变化,找出守恒类型及相关的量
↓
第三步—根据守恒原理,梳理出反应前后守恒的量,列式计算求解
【例2】 黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.100 0 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.020 00 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液25.00 mL。
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%的硫酸质量为 t。
【核心素养考查点剖析】本题主要考查了化学计算中的常用方法——关系式法。综合考查了考生的 “证据推理与模型认知”等化学核心素养。实际化工生产中往往涉及多步反应,但原料和产品中某种主要元素是相同的,据此可列出关系式。寻找关系式时,要特别注意原料中的主要元素是否全部转化为产物,中间反应是否有原料参与,不可盲目根据起始物和产物中的原子守恒直接得出关系式。
【答案及评分细则】(1)90.0%(写成0.9或0.90也得分)
(2)3.36×106(写成3 360 000也得分) 15
n(SO2)=1.5×105 mol,V(SO2)=3.36×106 L。
由SO2 ~ SO3 ~ H2SO4
1 mol 98 g
1.5×105 mol m(H2SO4)×98%
得m(H2SO4)=1.5×107 g=15 t。
【典题训练】
1.(2022全国甲)NA为阿伏加德罗常数的值,下列说法正确的是( )。
A.25 ℃、101 kPa下,28 L氢气中质子的数目为2.5NA
B.2.0 L 1.0 mol·L-1 AlCl3溶液中,Al3+的数目为2.0NA
C.0.20 mol苯甲酸完全燃烧,生成CO2的数目为1.4NA
D.电解熔融CuCl2,阴极增重6.4 g,外电路中通过电子的数目为0.10NA
C
2.(2023全国乙节选)硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。
在N2气氛中,FeSO4·7H2O的脱水热分解过程如图所示:
根据上述实验结果,可知x= ,y= 。
4
1
解析:FeSO4·7H2O的相对分子质量为278,当失重比为19.4%时,对应质量减少了54 g,对应的是3 mol水,因此x=4,同理,当失重比为38.8%时,质量减少108 g,失水共6 mol,因此y=1。
3.测定水中的溶解氧:将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定,将固氧后的水酸化,MnO(OH)2被I-还原为Mn2+,再用Na2S2O3溶液滴定生成的I2。现取100.00 mL水样经固氧、酸化后,用a mol·L-1 Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为 ;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为 mg·L-1。
答案:蓝色刚好褪去,且半分钟内不恢复 80ab
【新情境模拟训练】
设NA为阿伏加德罗常数的值,下列说法不正确的是( )。
A.10.1 g N(C2H5)3中所含的共价键数
目为2.1NA
B.在捕获过程中,二氧化碳分子中的共
价键不会完全断裂
C.1 mol Fe溶于过量稀硝酸,电子转移
数为2NA
D.一定温度下,1 L 0.5 mol·L-1 NH4NO3
溶液中含氮原子数为NA
C
捕获CO2生成甲酸的过程
解析:10.1 g N(C2H5)3的物质的量为n= =0.1 mol,1个N(C2H5)3含有共价键的数目为21,则10.1 g N(C2H5)3含有的共价键数目为2.1NA,A项正确。在捕获过程中,根据图中信息得出二氧化碳分子中的共价键没有完全断裂,B项正确。1 mol Fe溶于过量稀硝酸,生成Fe(NO3)3、NO和H2O,电子转移数为3NA,C项错误。溶液中硝酸铵的物质的量n=0.5 mol·L-1×1 L=0.5 mol,而1 mol硝酸铵中含2 mol 氮原子,故0.5 mol硝酸铵中含NA个氮原子,D项正确。
第1节 物质的量 气体摩尔体积
第2章
课标要求
1.了解物质的量及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
2.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、气体摩尔体积之间的相互关系进行简单计算。
备考指导
1.本部分知识在高考中一般以选择题形式进行考查,主要考查内容有阿伏加德罗常数、气体摩尔体积等,同时又隐含对物质结构、氧化还原反应、弱电解质的电离、盐类水解等知识的考查。在第Ⅱ卷中主要在流程图题目、实验题目中设置以物质的量为中心的计算题,难度中等。
2.高考的备考中,要重点掌握以物质的量为中心的化学计量关系网络,理解阿伏加德罗定律及其推论的应用。在有关物质的量的计算过程中,通过分析、推理认识计算的方法,建立阿伏加德罗常数、气体摩尔体积等题目解答的模型。
内容索引
01
02
03
第一环节 必备知识落实
第二环节 关键能力形成
第三环节 核心素养提升
第一环节 必备知识落实
知识点1
物质的量和摩尔质量
知识筛查
1.物质的量、阿伏加德罗常数、摩尔质量
(1)基本概念间的关系。
特别提醒(1)物质的量的描述对象是微观粒子,如电子、质子、中子、原子、分子、离子、原子团等,不能用于描述宏观物体。
(2)勿忽视摩尔的使用对象:使用摩尔作单位时,必须用化学式指明粒子的种类,如1 mol Fe、1 mol O2等。
2.摩尔质量
定义—单位物质的量的物质所具有的质量
↓
符号—M
↓
单位—g·mol-1
↓
特别提醒(1)摩尔质量(g·mol-1)、相对分子质量、1 mol该物质的质量(g)在数值上是相同的,但含义不同,具有不同的单位。如Fe的摩尔质量为56 g·mol-1,Fe的相对原子质量为56,1 mol Fe的质量为56 g。
(2)摩尔质量只有当以g·mol-1作单位时,在数值上才等于物质的相对原子(或分子)质量。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)摩尔是表示物质的量多少的基本物理量。( )
(2)物质的量就是1 mol物质的质量。( )
(3)0.012 kg 12C中含有约6.02×1023个碳原子。( )
(4)1 mol H2O中含有2 mol氢和1 mol氧。( )
(5)NaOH的摩尔质量为40 g。( )
(6)1 mol O2的质量与它的相对分子质量相等。( )
(7)1 mol OH-的质量为17 g·mol-1。( )
(8)2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍。( )
×
×
√
×
×
×
×
×
2.若氖原子的质量是a g,12C原子的质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是( )。
B
3.草酸(分子式为H2C2O4,沸点为150 ℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中。下列有关判断不正确的是( )。
A.H2C2O4的摩尔质量是90 g·mol-1
B.1 mol H2C2O4中约含有6.02×1023个分子
C.45 g H2C2O4中约含有1.204×1024个氧原子
D.1 mol H2C2O4在标准状况下的体积约为22.4 L
D
知识点2
气体摩尔体积 阿伏加德罗常数
知识筛查
1.影响物质体积的因素
2.气体摩尔体积
3.阿伏加德罗定律
可总结为:“三同”定“一同”,即同温、同压、同体积的气体,具有相同的 分子数。
知识巩固
1. 判断正误,正确的画“√”,错误的画“×”。
(1)标准状况下,80 g SO3中含3NA个氧原子,体积约为22.4 L。( )
(2)1 mol金刚石晶体中有4 mol碳碳键。( )
(3)在标准状况下,1 mol气体的体积约是22.4 L;在非标准状况下,1 mol气体的体积则一定不是22.4 L。( )
(4)在相同条件下,相同物质量的CO、N2的混合气体与O2的分子个数相同,原子个数也相同。( )
(5)在相同条件下,相同物质的量的C2H4和C3H6,所含分子个数相同,而相同质量时,它们所含的原子个数相同。( )
×
×
×
√
√
2.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )。
A.常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA
B.标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA
C.常温常压下,4.6 g乙醇中含有的极性共价键数目为0.8NA
D.在1 L 1.0 mol·L-1碳酸钠溶液中,阴离子总数大于NA
D
解析:常温常压下气体摩尔体积不等于22.4 L·mol-1,无法计算CO和CO2的物质的量,A项错误。标准状况下,7.1 g氯气的物质的量为0.1 mol,与足量的氢氧化钠溶液反应转移0.1 mol电子,即转移电子数为0.1NA,B项错误。4.6 g乙醇的物质的量n= =0.1 mol,而1个乙醇分子中含7个极性共价键,故0.1 mol乙醇中含极性共价键数目为0.7NA,C项错误。碳酸根离子水解生成碳酸氢根离子和氢氧根离子,1 L 1.0 mol·L-1碳酸钠溶液中含有的阴离子总数大于NA,D项正确。
3.取五个相同的气球,同温同压下,分别充入CO和以下四种混合气体,使气球的体积相等,如图所示。A、B、C、D四个气球内,与CO所含原子数一定相等的是( )。
C
解析:同温、同压下,气体体积相等则物质的量相等,而CO是双原子分子, C项中N2、O2都是双原子分子,与CO原子数相等。
第二环节 关键能力形成
能力点1
分析解决有关阿伏加德罗常数问题的能力
整合建构
问题引领
有关阿伏加德罗常数问题的常见考查角度有哪些
点拨有关阿伏加德罗常数问题的常见考查角度总结如下。
(1)通过结构考查粒子数。
命题 方向 举例(设NA代表阿伏加德罗常数的值) 判断 正误 注意事项
原子 结构 ①18 g H2O、D2O组成的物质中含有的质子数为10NA × ①注意特殊分子中的中子数;②注意官能团与离子的区别
②0.1 mol的11B中,含有0.6NA个中子 √ ③1 mol H37Cl中含有的质子数、中子数均为18NA × ④1 mol —OH与1 mol OH-所含电子数均为9NA × 命题 方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
化学 键数目 ①1 mol H2O2含有的化学键数目为3NA √ 白磷的分子结构为正四面体构型,1 mol P4(白磷)中含有的P—P的数目为6NA
②0.1 mol CCl4中含有的共价键数目为0.4NA √ ③1 mol P4(白磷)中含有的P—P的数目为4NA × ④1 mol CnH2n+2中化学键的数目为(3n+1)NA √ 命题 方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
特定 组成 ①28 g乙烯和环丁烷 (C4H8)的混合气体中含有的碳原子数为2NA √ ①看物质的最简式是否相同(如乙烯与环丁烷);
②看物质的相对分子质量是否相同(如N2、CO);
③看物质是否由同一种元素组成
(如O2、O3)
②常温常压下,92 g NO2和N2O4的混合气体中含有的原子数为6NA √ ③16 g O2和O3的混合气体中含有的氧原子数为NA √ ④1 mol Na2O2中含有的离子总数为3NA √ ⑤1 mol CO2和SO2的混合气体中含有的氧原子数为2NA √ (2)通过反应程度确定粒子数目。
命题方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
可逆 反应 ①2 mol NO2置于密闭容器中,最终生成的N2O4分子数为NA × ①注意隐含反应,如2NO2 N2O4;
②Cl2与H2O、N2与H2、SO2与O2、酯化反应等均是可逆反应,反应不能进行到底;
③盐的水解、弱电解质的电离是可逆的
②密闭容器中1 mol N2与3 mol H2充分反应,生成2 mol NH3 × ③密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA × ④1 L 0.1 mol·L-1 CH3COOH溶液中所含H+的数目为0.1NA × ⑤2 L 1 mol·L-1 FeCl3溶液中所含Fe3+的数目为2NA × 命题 方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
浓度 变化 ①常温下,含1 mol HNO3的浓硝酸与足量Cu反应,产生0.5 mol NO2 × ①浓盐酸与MnO2、浓硫酸与金属活动性顺序中氢后面的金属反应,酸不可能消耗完;
②浓硝酸与足量金属反应,先生成NO2,后生成NO;
③浓硫酸与金属活动性顺序中氢前面的金属反应,先生成SO2,后生成H2
②50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA × ③含2 mol H2SO4的浓硫酸与足量铜共热,产生1 mol SO2 × (3)电子转移数目判断。
命题方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
常规 反应 ①过氧化钠与水反应时,生成0.1 mol O2转移的电子数为0.4NA × 要注意特殊物质,如由过氧化钠、过氧化氢制取1 mol O2转移2 mol电子;铁与硫、碘、非氧化性酸反应,1 mol Fe转移2 mol电子;
1 mol Fe与足量的氯气、稀硝酸反应,转移3 mol电子
②铁与硫的反应中,1 mol Fe失去的电子数为3NA × ③标准状况下,6.72 L NO2溶于足量的水中,转移的电子数为0.3NA × ④1 mol Fe在1 mol Cl2中燃烧,转移的电子数为3NA × ⑤KIO3+6HI══KI+3H2O+3I2中,生成3 mol I2转移电子的总数为6NA × ⑥0.1 mol Cl2全部溶于水后转移电子的数目为0.2NA × (4)警惕两大设陷。
设陷 方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
气体 摩尔 体积 ①常温常压下,22.4 L氯气与足量的镁粉充分反应,转移的电子数为2NA × 常温常压,气体摩尔体积不能用22.4 L·mol-1计算;标准状况下为非气体的物质有水、乙醇、硫酸、三氧化硫、四氯化碳、苯、甲醇等
②锌与足量的稀硫酸反应生成22.4 L H2,转移电子数为2NA × ③标准状况下,2.24 L SO3中含有0.3NA个氧原子 × ④标准状况下,22.4 L CCl4中含有NA个分子 × ⑤在标准状况下,11.2 L H2和D2的混合气体中含质子数为NA √ 设陷 方向 举例(设NA代表阿伏加德罗常数的值) 判断正误 注意事项
溶液 浓度 ①在pH=13的NaOH溶液中OH-的数目约为0.1×6.02×1023 × 溶液的体积未知,溶质的物质的量无法计算,所含粒子数也无法计算
②0.1 mol·L-1 NaF溶液中所含F-的数目小于0.1NA × ③0.1 mol·L-1 CH3COOH溶液中c(H+)=0.1 mol·L-1 × 训练突破
1.(2024河北卷改编)超氧化钾(KO2)可用作潜水或航天装置的CO2吸收剂和供氧剂,反应为4KO2+2CO2══2K2CO3+3O2。NA为阿伏加德罗常数的值。下列说法正确的是( )。
A.44 g CO2中σ键的数目为2NA
B.1 mol KO2晶体中离子的数目为3NA
C.1 L 1 mol·L-1 K2CO3溶液中C的数目为NA
D.该反应中每转移1 mol电子生成O2的数目为1.5NA
A
解析:CO2的结构式为O═C═O,每个分子有两个σ键,44 g CO2的物质的量为1 mol,则分子中σ键的数目为2NA,A项正确;KO2由K+和形成,1 mol KO2晶体中离子的数目为2NA,B项错误;1 L 1 mol·L-1 K2CO3溶液含K2CO3的物质的量为1 mol,C为弱酸根离子,会发生水解,故溶液中C的数目小于NA,C项错误;KO2中O的化合价为-价,该反应为歧化反应,生成3 mol O2转移电子3 mol,则转移1 mol电子,生成O2的数目为NA,D项错误。
2.(2021河北卷)NA是阿伏加德罗常数的值,下列说法错误的是( )。
A.22.4 L(标准状况)氟气所含的质子数为18NA
B.1 mol碘蒸气和1 mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于2NA
C.电解饱和食盐水时,若阴阳两极产生气体的总质量为73 g,则转移电子数为NA
D.1 L 1 mol·L-1溴化铵水溶液中 与H+的总数大于NA
C
解析:F的原子序数为9,一个F2分子中含有的质子数为18,则标准状况下22.4 L F2含有的质子数为18NA,A项正确。I2与H2的反应为可逆反应,反应生成的HI分子数小于2NA,B项正确。电解饱和食盐水时,阴阳两极分别产生氢气和氯气,当两极产生气体的总质量为73 g时,即分别产生1 mol H2和 1 mol Cl2,转移电子数应该为2NA,C项错误。溴化铵溶液中 水解产生的H+等于水解过程中减少的 ,但是水自身还电离出H+,故 与H+的总数大于NA,D项正确。
能力点2
运用阿伏加德罗定律及其推论分析有关气体问题的能力
整合建构
(1)总结一口诀——“三同”(T、p、V) “一同”(N)→(n)。可概括为“三同”定“一同”,即在同温、同压、同体积的条件下,才有分子数相等这一结论,但所含原子数不一定相等。
(3)适用一范围——气体。阿伏加德罗定律及其推论适用于气体,既适用于单一气体,也适用于混合气体。
问题引领
如何利用阿伏加德罗定律及其推论解题
点拨阿伏加德罗定律及其推论解题模板。
第一步:找“相同”明“不同”。
(1)找出题干中有哪些相同的条件,再根据物质的量,结合物质的粒子结构,求出相应的粒子数;
(2)分析选项中的要求,明确需要求解哪些量。
第二步:用“规律”。
利用阿伏加德罗定律及其推论得出不同条件之间的关系,进行对比判断,从而顺利解题。
训练突破
1.同温同压下,相同体积的CO和CO2的下列比较中正确的是( )。
①所含的分子数目之比为1∶1 ②所含的氧原子数目之比为1∶2 ③所含的原子总数目之比为2∶3 ④两者的密度之比为7∶11 ⑤所含的电子数目之比为7∶11
A.①④ B.②③
C.④⑤ D.①②③④⑤
D
解析:同温同压下等体积的CO和CO2的物质的量相同,则分子数相等,即所含的分子数目之比为1∶1、所含的氧原子数目之比为1∶2、所含的原子总数目之比为2∶3,故①②③正确。④同温同压下,两者的密度之比等于摩尔质量之比,为7∶11,故正确。⑤同温同压下等体积的CO和CO2的物质的量相同,每个分子含有的电子数分别为14、22,则所含的电子数目之比为7∶11,故正确。
2.在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同。根据甲、乙的摩尔质量(M)的关系判断,下列说法中正确的是( )。
A.若M(甲)
C.若M(甲)
D.若M(甲)>M(乙),则气体的体积:甲<乙
C
解析:根据题给信息,质量相等、温度和密度相同的甲、乙两种气体的体积相等,D项错误。等质量的气体,其摩尔质量与物质的量(或分子数)成反比,若M(甲)
能力点3
运用物质的量进行有关计算的能力
整合建构
问题引领
运用物质的量进行有关计算时,特别需要注意什么问题
点拨运用物质的量进行有关计算时,特别需要注意如下几个问题。
(1)“两个前提”:在应用Vm=22.4 L·mol-1时,一定要有“标准状况”和“气体状态”两个前提条件(混合气体也适用)。(2)“三个关系”:①直接构成物质的粒子与间接构成物质的粒子(原子、电子等)间的关系;②摩尔质量与相对分子质量间的关系;③强电解质、弱电解质与溶质粒子(分子或离子)数之间的关系。(3)“七个无关”:物质的量、质量、粒子数的多少均与温度、压强的高低无关;物质的量浓度的大小与所取该溶液的体积多少无关(但溶质粒子数的多少与溶液体积有关)。
训练突破
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )。
A.若1 mol FeCl3与水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA
B.将一定量的Cl2通入FeBr2溶液中,当有1 mol Br-转化为Br2时,转移的电子数为NA
C.44 g环氧乙烷中含有6NA个极性共价键
D.1 mol CaO2晶体中含离子总数为3NA
C
解析:氢氧化铁胶体粒子是由许多个Fe(OH)3“分子”聚集而成,因此1 mol FeCl3与水完全反应转化成氢氧化铁胶体后,其中胶体粒子的数目小于NA,A项错误。Fe2+的还原性强于Br-,通入氯气,先发生2Fe2++Cl2══2Fe3++ 2Cl-,再发生Cl2+2Br-══2Cl-+Br2,当Br-转化成Br2时,Fe2+全部转化成Fe3+,转移电子的数目大于NA,B项错误。环氧乙烷的键线式为 , 1 mol环氧乙烷中含有6 mol极性共价键,则44 g环氧乙烷的物质的量为1 mol,含有的极性共价键的数目为6NA,C项正确。CaO2由Ca2+和 构成,1 mol CaO2晶体中含离子总数为2NA,D项错误。
2.设NA为阿伏加德罗常数的值,下列说法错误的是( )。
A.12 g石墨烯和12 g金刚石均含有NA个碳原子
B.0 ℃、101 kPa下,0.1 mol乙炔和甲醛(HCHO)的混合物中含有C—H的数目为0.2NA
C.x mol R2(R的核内中子数为N,质量数为A)所含的核外电子数为x(A-N+2)NA
D.1.00 L 0.2 mol·L-1的稀硫酸与足量的金属钠反应,消耗金属钠的质量大于9.2 g
C
解析:石墨烯和金刚石都是碳元素组成的单质,12 g石墨烯和12 g金刚石都含有1 mol碳原子,A项正确。1个乙炔(H—C≡C—H)和1个甲醛(HCHO)分子中都含2个C—H,所以0.1 mol乙炔和甲醛(HCHO)的混合物中含有C—H的数目为0.2NA,B项正确。R的核内中子数为N,质量数为A,则R的质子数为A-N,R的核外电子数也为A-N,则x mol R2所含的核外电子数为2x(A-N)NA, C项错误。1.00 L 0.2 mol·L-1的稀硫酸中H+的物质的量为0.4 mol,能与0.4 mol Na(9.2 g)发生反应,但Na还能与溶液中的水反应,所以加入足量的金属钠时,消耗金属钠的质量大于9.2 g,D项正确。
第三环节 核心素养提升
【高考真题剖析】
【例1】 (2023全国甲)NA为阿伏加德罗常数的值。下列叙述正确的是
( )。
A.0.50 mol异丁烷分子中共价键的数目为6.5NA
B.标准状况下,2.24 L SO3中电子的数目为4.00NA
C.1.0 L pH=2的H2SO4溶液中H+的数目为0.02NA
D.1.0 L 1.0 mol·L-1的Na2CO3溶液中 的数目为1.0NA
A
【核心素养考查点剖析】本题是一个高考题的常规题,较好地考查了考生“宏观辨识与微观探析”素养,题目提供的均为宏观物质的宏观量,如本题的2.24 L(标准状况下)SO3、1.0 L pH=2的H2SO4溶液等,而题目要求考生分析的均为微观量,如本题的共价键数、电子数、H+数、C数。因此,顺利解答本题,要求考生在复习备考过程中,务必通过训练,学会并熟练掌握对物质进行宏观—微观—符号的三重表征。
解析:每个异丁烷(结构简式为 )分子中有13条共价键,故0.50 mol异丁烷分子中共价键的数目为6.5NA,A项正确;标准状况下,SO3是固体, B项错误;pH=2的H2SO4溶液中c(H+)=0.01 mol·L-1,1.0 L该溶液中H+的数目为0.01NA,C项错误;1.0 L 1.0 mol·L-1的Na2CO3溶液中,含溶质Na2CO3的物质的量是1 mol,由于 水解,实际存在的 的数目小于1.0NA,D项错误。
【学科思想方法】
化学计算中的常用方法——关系式法、守恒法
1.关系式法
(1)应用原理。
关系式法是表示两种或多种物质之间“物质的量”关系的一种简化式子。在多步反应中,它可以把始态的反应物与终态的生成物之间的“物质的量”关系表示出来,把多步计算简化成一步计算。正确书写关系式是用关系式法解化学计算题的前提。
(2)解题步骤。
第一步—写出各步反应的化学方程式
↓
第二步—根据化学方程式找出作为“中介”的物质,并确定最初反应物、中介物质、最终生成物之间量的关系
↓
第三步—确定最初反应物和最终生成物之间量的关系
↓
第四步—根据已知条件及关系式列出比例式计算求解
2.守恒法
(1)应用原理。
所谓“守恒”就是物质在发生“变化”或两物质在发生“相互作用”的过程中某些物理量的总量保持“不变”。在化学变化中有各种各样的守恒,如元素守恒、得失电子守恒、电荷守恒等。
(2)解题步骤。
第一步—明确题目要求解的量
↓
第二步—根据题目中要求解的量,分析反应过程中物质的变化,找出守恒类型及相关的量
↓
第三步—根据守恒原理,梳理出反应前后守恒的量,列式计算求解
【例2】 黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.100 0 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.020 00 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液25.00 mL。
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%的硫酸质量为 t。
【核心素养考查点剖析】本题主要考查了化学计算中的常用方法——关系式法。综合考查了考生的 “证据推理与模型认知”等化学核心素养。实际化工生产中往往涉及多步反应,但原料和产品中某种主要元素是相同的,据此可列出关系式。寻找关系式时,要特别注意原料中的主要元素是否全部转化为产物,中间反应是否有原料参与,不可盲目根据起始物和产物中的原子守恒直接得出关系式。
【答案及评分细则】(1)90.0%(写成0.9或0.90也得分)
(2)3.36×106(写成3 360 000也得分) 15
n(SO2)=1.5×105 mol,V(SO2)=3.36×106 L。
由SO2 ~ SO3 ~ H2SO4
1 mol 98 g
1.5×105 mol m(H2SO4)×98%
得m(H2SO4)=1.5×107 g=15 t。
【典题训练】
1.(2022全国甲)NA为阿伏加德罗常数的值,下列说法正确的是( )。
A.25 ℃、101 kPa下,28 L氢气中质子的数目为2.5NA
B.2.0 L 1.0 mol·L-1 AlCl3溶液中,Al3+的数目为2.0NA
C.0.20 mol苯甲酸完全燃烧,生成CO2的数目为1.4NA
D.电解熔融CuCl2,阴极增重6.4 g,外电路中通过电子的数目为0.10NA
C
2.(2023全国乙节选)硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。
在N2气氛中,FeSO4·7H2O的脱水热分解过程如图所示:
根据上述实验结果,可知x= ,y= 。
4
1
解析:FeSO4·7H2O的相对分子质量为278,当失重比为19.4%时,对应质量减少了54 g,对应的是3 mol水,因此x=4,同理,当失重比为38.8%时,质量减少108 g,失水共6 mol,因此y=1。
3.测定水中的溶解氧:将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定,将固氧后的水酸化,MnO(OH)2被I-还原为Mn2+,再用Na2S2O3溶液滴定生成的I2。现取100.00 mL水样经固氧、酸化后,用a mol·L-1 Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为 ;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为 mg·L-1。
答案:蓝色刚好褪去,且半分钟内不恢复 80ab
【新情境模拟训练】
设NA为阿伏加德罗常数的值,下列说法不正确的是( )。
A.10.1 g N(C2H5)3中所含的共价键数
目为2.1NA
B.在捕获过程中,二氧化碳分子中的共
价键不会完全断裂
C.1 mol Fe溶于过量稀硝酸,电子转移
数为2NA
D.一定温度下,1 L 0.5 mol·L-1 NH4NO3
溶液中含氮原子数为NA
C
捕获CO2生成甲酸的过程
解析:10.1 g N(C2H5)3的物质的量为n= =0.1 mol,1个N(C2H5)3含有共价键的数目为21,则10.1 g N(C2H5)3含有的共价键数目为2.1NA,A项正确。在捕获过程中,根据图中信息得出二氧化碳分子中的共价键没有完全断裂,B项正确。1 mol Fe溶于过量稀硝酸,生成Fe(NO3)3、NO和H2O,电子转移数为3NA,C项错误。溶液中硝酸铵的物质的量n=0.5 mol·L-1×1 L=0.5 mol,而1 mol硝酸铵中含2 mol 氮原子,故0.5 mol硝酸铵中含NA个氮原子,D项正确。
同课章节目录
