2026届高考化学一轮复习 第2章 物质的量 第2节 物质的量浓度 课件(54张PPT)
文档属性
| 名称 | 2026届高考化学一轮复习 第2章 物质的量 第2节 物质的量浓度 课件(54张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-15 21:05:55 | ||
图片预览








文档简介
(共54张PPT)
第2节 物质的量浓度
第2章
课标要求
1.能运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
2.必做实验:配制一定物质的量浓度的溶液。
备考指导
1.本节内容重点考查:对物质的量浓度的理解及简单的计算; 配制一定物质的量浓度溶液的方法及相关误差分析。
2.复习备考时要能从问题和实际出发,设计配制一定物质的量浓度溶液的方案,进行实验探究;在探究中学会合作,能够正确分析实验过程中可能存在的误差。能根据溶质的物质的量浓度计算溶质的物质的量、与溶质相关的粒子数目等。
内容索引
01
02
03
第一环节 必备知识落实
第二环节 关键能力形成
第三环节 核心素养提升
04
实验探源
第一环节 必备知识落实
知识点1
物质的量浓度及相关计算
知识筛查
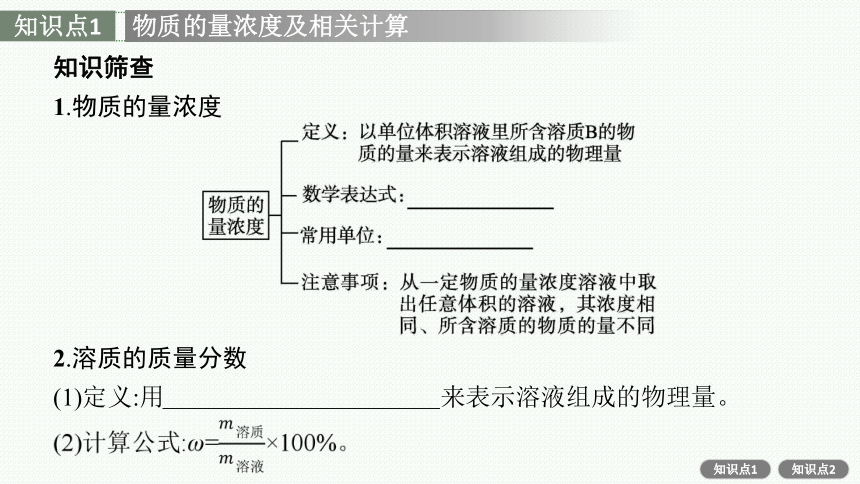
1.物质的量浓度
2.溶质的质量分数
(1)定义:用溶质质量与溶液质量之比来表示溶液组成的物理量。
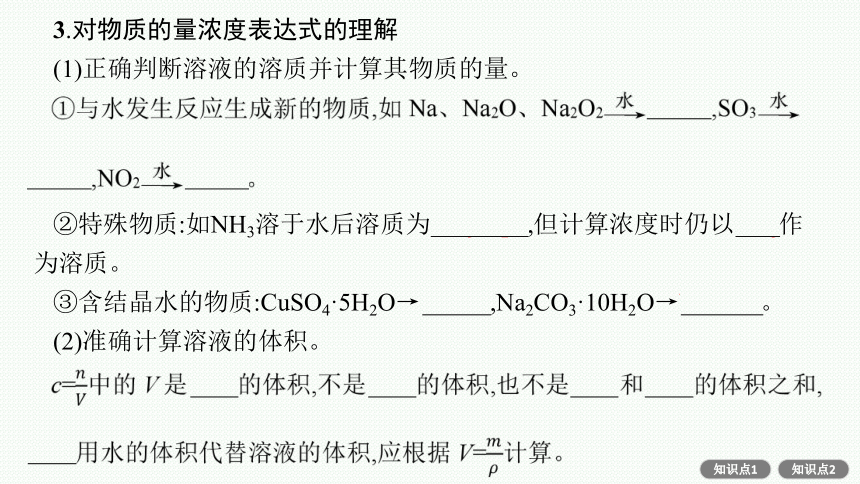
3.对物质的量浓度表达式的理解
(1)正确判断溶液的溶质并计算其物质的量。
②特殊物质:如NH3溶于水后溶质为NH3·H2O,但计算浓度时仍以NH3作为溶质。
③含结晶水的物质:CuSO4·5H2O→CuSO4,Na2CO3·10H2O→Na2CO3。
(2)准确计算溶液的体积。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中。( )
(2)标准状况下22.4 L HCl溶于1 L水,溶质的物质的量浓度为1 mol·L-1。( )
(3)32.2 g Na2SO4·10H2O溶于67.8 g水中,ω(Na2SO4)=32.2%。( )
(4)31 g Na2O溶于水,配成1 L溶液,c(Na2O)=0.5 mol·L-1。( )
(5)将10 mL 1 mol·L-1的H2SO4溶液稀释成0.1 mol·L-1的H2SO4溶液,可向该溶液中加入90 mL水。( )
(6)将1 mol·L-1的NaCl溶液和0.5 mol·L-1的BaCl2溶液等体积混合后,不考虑溶液体积变化,c(Cl-)=0.75 mol·L-1。( )
(7)1 L 0.5 mol·L-1 CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol·L-1。( )
×
×
×
×
×
×
×
2.(1)1.204×1024个氯化氢分子溶于水配成1 L溶液,则溶液中溶质的物质的量浓度为 。
(2)0.3 L 2 mol·L-1的硫酸铝溶液中 的物质的量为 ;因Al3+能发生水解,所以c(Al3+) (填“>”“<”或“=”)4 mol·L-1。
(3)2 mol·L-1 Mg(NO3)2溶液中含有0.4 mol ,则溶液的体积为
mL。
(4)2 L 2 mol·L-1的Na2SO4溶液中c(Na+) (填“>”“<”或“=”)1 L 2 mol·L-1的Na2SO4溶液中c(Na+)。
(5)10 g NaCl溶于40 g水形成的溶液,其溶质的质量分数为 ;从中取出5 g溶液,所含NaCl质量为 ,其溶质质量分数为 。
答案:(1)2 mol·L-1 (2)1.8 mol < (3)100 (4)= (5)20% 1 g 20%
知识点2
配制一定物质的量浓度的溶液
知识筛查
1.主要仪器
(1)为了与容量瓶的精度相匹配,称量固体时应使用分析天平。考虑到学校的实际情况,本实验可暂用托盘天平或普通电子天平代替。
(2)容量瓶。
①构造及用途。
②查漏操作。
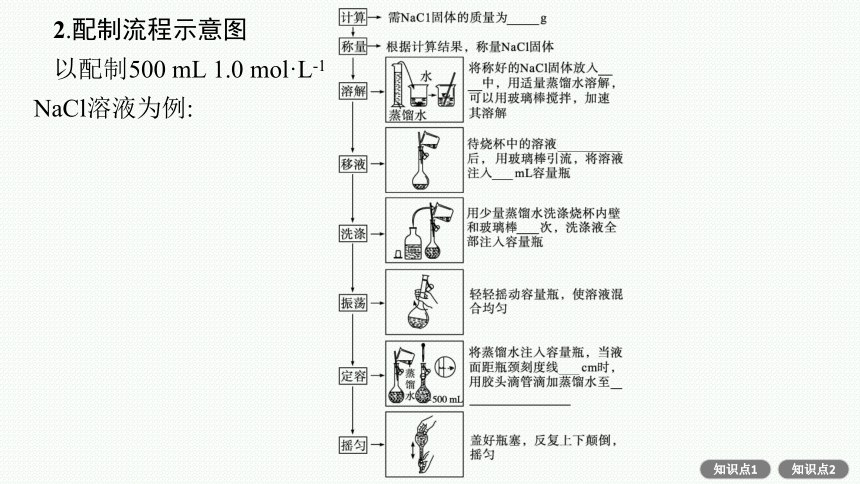
2.配制流程示意图
以配制500 mL 1.0 mol·L-1 NaCl溶液为例:
特别提醒(1)配制100 g 10%的NaCl溶液。用托盘天平称取10.0 g NaCl固体,放入烧杯中,再用100 mL量筒量取90.0 mL的水注入烧杯中,然后用玻璃棒搅拌使之溶解。
(2)用浓硫酸和蒸馏水配制体积比为1∶4的稀硫酸。用50 mL的量筒量取40.0 mL的蒸馏水注入100 mL的烧杯中,再用10 mL的量筒量取10.0 mL浓硫酸,然后沿烧杯内壁缓缓注入烧杯中,并用玻璃棒不停地搅拌。
知识巩固
1.实验室需要用到450 mL 1 mol·L-1的硫酸,现用密度为1.84 g·cm-3、溶质的质量分数为98%的浓硫酸来配制,下列有关说法正确的是(设NA为阿伏加德罗常数的值)( )。
A.浓硫酸中H2SO4的物质的量浓度为18.4 mol·L-1
B.配制溶液所需浓硫酸的体积为24 mL
C.配制溶液时所需的仪器只有容量瓶、烧杯、玻璃棒、量筒
D.配制溶液时,量取浓硫酸注入烧杯中,加水稀释,冷却后再转移到容量瓶中
A
解析:密度为1.84 g·cm-3、溶质的质量分数为98%的浓硫酸的物质的量浓
度c= =18.4 mol·L-1,A项正确。配制450 mL 1 mol·L-1的硫酸,应选择500 mL容量瓶,即实际配制500 mL溶液,依据稀释过程中溶质的物质的量不变得18.4 mol·L-1×V=500 mL×1 mol·L-1,解得V=27.2 mL,B项错误。用浓溶液配制一定物质的量浓度的溶液时,需要的仪器有量筒、胶头滴管、烧杯、玻璃棒、容量瓶,C项错误。稀释浓硫酸的正确操作为将浓硫酸沿着烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌,D项错误。
2.某同学按如图所示的步骤配制100 mL一定物质的量浓度的NaOH溶液,其中不正确的操作有( )。
A.②⑤
B.①②⑤⑦
C.①②④⑥
D.①④⑥⑦
C
解析:NaOH容易变质,且容易潮解,称量NaOH固体时应该在烧杯中快速称量,图示操作方法不合理,故①错误;量筒只能用于量取液体,不能在量筒中溶解固体或者稀释液体,溶解NaOH固体应该在烧杯中进行,故②错误;转移溶液时,玻璃棒应该放在容量瓶刻度线下方,图示操作不合理,故④错误;图示为仰视容量瓶刻度线定容,会导致加入的蒸馏水体积偏大,配制的溶液浓度偏小,故⑥错误。
第二环节 关键能力形成
能力点1
用不同的物理量描述溶液组成及解决相互转化的能力
整合建构
1.物质的量浓度与溶质的质量分数的相互求算
问题引领
(1)如何计算气体溶于水后形成的溶液中溶质的物质的量浓度
(2)溶液稀释、混合后浓度的计算有哪些规律方法
点拨(1)计算气体溶于水后形成的溶液中溶质的物质的量浓度的一般思路。
气体溶于水后,溶液的体积不是溶剂的体积,也不是气体体积与溶剂体积
之和,应根据V= 进行计算。
(2)溶液稀释、混合后浓度计算的方法。
①同种溶液混合后浓度计算的关键。
有关溶液稀释及混合的计算,应抓住稀释前后溶质的物质的量不变列方程式:c前·V前=c后·V后或c1V1+c2V2=c混·V混,混合后溶液的体积不等于混合前
两溶液的体积之和,而是要根据密度计算,即V混= 。
②溶质相同、质量分数不同的两溶液的混合规律。
溶质相同,质量分数分别为a%、b%的两溶液混合。
训练突破
在标准状况下,将a L A气体(相对分子质量为b)溶于0.1 L水中,所得溶液的密度为d g·cm-3,则此溶液中溶质的物质的量浓度(mol·L-1)为( )。
B
能力点2
一定物质的量浓度溶液的配制中误差分析的能力
整合建构
常见不当操作及造成的误差分析
问题引领
如何分析溶液配制过程中因操作不当引起的误差
点拨(1)溶液配制过程中的误差分析。
①分析方法。
②实例分析:配制一定物质的量浓度的NaOH溶液时,若向容量瓶中转移液体时有少量溅出,会造成溶质的量(即m)减少,故所配NaOH溶液的浓度偏小。
若溶液未冷却至室温就注入容量瓶中定容,会造成溶液的体积(即V)减小,故所配NaOH溶液的浓度偏大。
(2)读数不当引起误差的分析方法。
①仰视刻度线(图1),导致溶液体积偏大,结果偏小。
②俯视刻度线(图2),导致溶液体积偏小,结果偏大。
训练突破
1.下列说法正确的是( )。
A.现需480 mL 0.1 mol·L-1氯化钠溶液,则使用容量瓶配制溶液需要2.8 g氯化钠固体
B.配制1 mol·L-1 NaOH溶液100 mL,用托盘天平称量4 g NaOH固体放入100 mL容量瓶中溶解
C.制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并继续煮沸至液体呈红褐色
D.使用量筒量取一定体积的浓硫酸配制一定物质的量浓度的稀硫酸,将浓硫酸转移至烧杯后需用蒸馏水洗涤量筒,并将洗涤液一并转移至烧杯
C
解析:实验室没有480 mL的容量瓶,选择大于480 mL且相近规格的容量瓶,故应选择500 mL容量瓶,配制500 mL 0.1 mol·L-1氯化钠溶液需要氯化钠的质量为0.5 L×0.1 mol·L-1×58.5 g·mol-1=2.925 g,A项错误。氢氧化钠固体应该在烧杯中溶解,冷却至室温后再转移至容量瓶,B项错误。制备Fe(OH)3胶体时,向沸水中滴加FeCl3饱和溶液并继续煮沸至液体呈红褐色即得到氢氧化铁胶体,C项正确。量筒是量出式仪器,量取的液体倒出的量就是所读的量,不能洗涤,如果洗涤并将洗涤液一并转移至烧杯,实际量取浓硫酸的体积偏大,所配溶液的浓度偏大,D项错误。
2.若在配制溶液的过程中出现下列情况,对所配溶液的浓度有何影响 (填“偏大”“偏小”或“无影响”)
(1)配制NaOH溶液时,在天平的两个托盘上放两张质量相等的纸片,其他操作均正确。
(2)配制一定物质的量浓度的NaOH溶液,需称量溶质4.4 g,称量时物码放置颠倒。
(3)用量筒量取浓硫酸时,仰视读数。
(4)定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线。
(5)移液时未洗涤烧杯及玻璃棒。
答案:(1)偏小 (2)偏小 (3)偏大 (4)偏小 (5)偏小
第三环节 核心素养提升
【高考真题剖析】
【例题】 (高考组合题)下列实验过程错误的是 。
ABCD
解析:称取4.0 g NaOH固体放入烧杯中,加入少量蒸馏水溶解,冷却至室温后转移至250 mL容量瓶中,洗涤烧杯和玻璃棒并将洗涤液转移至容量瓶中,然后定容,A项错误。不能在容量瓶中直接溶解固体,B项错误。容量瓶洗净后不需要烘干,C项错误。稀释浓硫酸时应将浓硫酸慢慢加入水中(“酸入水”),并不断搅拌使产生的热量迅速扩散,以防液体溅出,D项错误。
【核心素养考查点剖析】本题从不同的角度考查了一定物质的量浓度溶液的配制过程、常见的基本操作,发现和提出有探究价值的化学问题,融合了“科学探究与创新意识”的学科素养,题目的难度中等。
【典题训练】
1.配制100 mL 0.1 mol·L-1Na2CO3溶液,下列操作正确的是( )。
A.称取1.06 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B.称取1.06 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D.定容后,塞好瓶塞,反复倒转,摇匀
D
2.实验室里需要用到480 mL 0.10 mol·L-1的硫酸铜溶液,下列实验用品及实验操作都正确的是( )。
D
解析:配制480 mL 0.10 mol·L-1的硫酸铜溶液,由于实验室没有480 mL的容量瓶,故需要选用500 mL的容量瓶,即实际配制的溶液是500 mL 0.10 mol·L-1的硫酸铜溶液,需要硫酸铜的物质的量为0.10 mol·L-1×0.5 L=0.05 mol,需要硫酸铜的质量为160 g·mol-1×0.05 mol=8.0 g,需要胆矾的质量为250 g·mol-1×0.05 mol=12.5 g。故D项正确。
3.硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)可用作定影剂、还原剂。利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下。
(1)溶液配制:称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在 中溶解,完全溶解后,全部转移至100 mL的 中,加蒸馏水至 。
答案:(1)烧杯 容量瓶 溶液的凹液面与刻度线相切
(2)蓝色褪去,且半分钟内不恢复 95.0
解析:(1)溶液配制应在烧杯中溶解,容量瓶中定容。(2)滴定过程中I2→I-,达到滴定终点时无I2,故溶液蓝色褪去,且半分钟内不恢复,即为终点。根据反应的离子方程式,可得到如下定量关系:
1 mol 248×6 g
0.009 50 mol·L-1×0.02 L m(Na2S2O3·5H2O)
m(Na2S2O3·5H2O)=0.282 72 g
【新情境模拟训练】
“84”消毒液能有效杀灭多种病毒。某同学购买了一瓶“84”消毒液,并查阅相关资料和消毒液包装说明得到如下信息:①含NaClO的质量分数为25%;②体积为1 000 mL;③密度为1.19 g·cm-3;④用水稀释后使用。请根据以上信息和相关知识回答下列问题。
(1)该“84”消毒液中NaClO的物质的量浓度为 mol·L-1。
(2)该同学取100 mL该“84”消毒液稀释至原体积的100倍后用于消毒,稀释后的溶液中c(Na+)= mol·L-1。
(3)一瓶该“84”消毒液能吸收空气中 L的CO2(标准状况)而变质。(已知:CO2+NaClO+H2O══NaHCO3+HClO)
(4)该同学参阅该“84”消毒液的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是 。
A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
答案:(1)4.0 (2)0.04 (3)89.6 (4)C
c(Na+)=c(NaClO)=0.04 mol·L-1。
(3)一瓶“84”消毒液含有n(NaClO)=1 L×4.0 mol·L-1=4.0 mol,
根据反应CO2+NaClO+H2O══NaHCO3+HClO,则需要CO2的物质的量为4.0 mol,即标准状况下V(CO2)=4.0 mol×22.4 L·mol-1=89.6 L。
(4)需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,题图中①②③④不需要,还需玻璃棒和胶头滴管,A项错误。配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,B项错误。由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏小,C项正确。应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol·L-1×74.5 g·mol-1=149 g,D项错误。
实验探源
【必备知识归纳】
配制一定物质的量浓度的溶液
1.所需仪器及配制步骤
特别提醒(1)选用容量瓶的原则——“大而近”,如需90 mL溶液,则选用100 mL容量瓶。
(2)选用容量瓶时,应指明其规格。
(3)向容量瓶中转移液体时,用玻璃棒引流,玻璃棒末端应在容量瓶刻度线以下。
2.配制溶液过程中要重点关注的四个数据
数据 要求或解释
试剂的质量 托盘天平只能精确到0.1 g,所以实验室中若用托盘天平称量试剂,记录数据时只能保留小数点后一位数字
容量瓶 的规格 (1)选择容量瓶的规格时应该与所配溶液体积相匹配,无合适规格容量瓶时,则选容积稍大一点的,如需用480 mL某溶液,则应该选择500 mL容量瓶配制溶液。
(2)回答问题时应指明所选容量瓶的规格,如回答“500 mL容量瓶”时,不能只回答“容量瓶”
洗涤烧杯和玻 璃棒2~3次 转移溶液后洗涤烧杯和玻璃棒2~3次,是为了确保溶质全部转移入容量瓶中,否则会导致所配溶液浓度偏低
液面离容量 瓶颈刻度线 下1~2 cm 定容时,当液面离容量瓶颈刻度线下1~2 cm时,应该改用胶头滴管滴加,否则容易导致液体体积超过刻度线,超过刻度线应重新配制
3.配制一定物质的量浓度溶液产生误差的原因
【易错细节筛查】
判断正误,正确的画“√”,错误的画“×”。
(1)配制0.1 L 0.4 mol·L-1 NaCl溶液,须用托盘天平称量2.34 g NaCl。( )
(2)配制稀硫酸时,先将浓硫酸加入烧杯中,后倒入蒸馏水。( )
(3)使用托盘天平称量试剂,都不能直接放在托盘中,应放两张相同的纸片。( )
(4)用100 mL量筒量取5.68 mL浓硫酸。( )
(5)配制90 mL 1 mol·L-1CuSO4溶液需要100 mL容量瓶。( )
(6)为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。( )
×
×
×
×
√
√
【实验能力形成】
1.(2023全国甲)实验室将粗盐提纯并配制0.100 0 mol·L-1的NaCl溶液。下列仪器中,本实验必须用到的有( )。
①天平 ②温度计 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯
A.①②④⑥ B.①④⑤⑥
C.②③⑦⑧ D.①⑤⑥⑧
D
解析:粗盐提纯过程中涉及的实验操作包括溶解、过滤、蒸发和结晶,题给仪器中所用到的有⑥⑧;由固体NaCl配制0.100 0 mol·L-1的NaCl溶液,题给仪器中所用到的有①⑤⑥。故D项正确。
2.实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸500 mL。根据这两种溶液的配制情况回答下列问题。
(1)如图所示的仪器中,配制溶液肯定不需要的是 (填字母),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)配制0.1 mol·L-1的NaOH溶液的操作步骤如下,正确的顺序是 。
①把称量好的NaOH固体放入小烧杯中,加适量的蒸馏水溶解
②把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液的凹液面与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中,并轻轻摇匀
⑤将容量瓶瓶塞塞紧,充分摇匀
(3)根据计算,用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液的浓度
(填“大于”“小于”或“等于”,下同)0.1 mol·L-1。若还未等溶液冷却至室温就定容,则所得溶液的浓度 0.1 mol·L-1。
答案:(1)AC 烧杯、玻璃棒、500 mL容量瓶
(2)①②④③⑤
(3)2.0 等于 大于
解析:实验室中配制450 mL 0.1 mol·L-1 NaOH溶液和500 mL 0.5 mol·L-1硫酸时,由于没有450 mL的容量瓶,应选择500 mL容量瓶。
(1)配制溶液过程中通常要用到托盘天平、容量瓶、烧杯、玻璃棒、胶头滴管、量筒等,题图所示的仪器中,配制溶液不需要的是平底烧瓶和分液漏斗;配制上述溶液还需用到的玻璃仪器是烧杯、玻璃棒、500 mL容量瓶。
(2)配制一定物质的量浓度的溶液的基本步骤:计算、称量或量取、溶解或稀释、转移、洗涤、定容、摇匀、装瓶、贴标签。配制0.1 mol·L-1 NaOH溶液的操作步骤是把称量好的NaOH固体放入小烧杯中,加适量的蒸馏水溶解。把所得溶液冷却至室温,再小心转入一定容积的容量瓶中。用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中,并轻轻摇匀。继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心地滴加蒸馏水至溶液的凹液面与刻度线相切。将容量瓶瓶塞塞紧,充分摇匀。所以正确的操作顺序是①②④③⑤。
(3)根据计算,500 mL 0.1 mol·L-1的NaOH溶液中溶质的物质的量为0.5 L ×0.1 mol·L-1=0.05 mol,质量为40 g·mol-1×0.05 mol=2 g,故用托盘天平称取NaOH的质量为2.0 g;配制一定物质的量浓度的溶液,进行误差分析时,根据c= ,分析实验操作对溶质的物质的量的影响以及对所配溶液体积的影响,进而确定对所配溶液浓度的影响。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,并不影响溶液的配制,所以所得溶液的浓度等于0.1 mol·L-1;若还未等溶液冷却至室温就定容,待温度降至室温时,溶液的凹液面会下降到刻度线以下,所得溶液的体积偏小,浓度大于0.1 mol·L-1。
第2节 物质的量浓度
第2章
课标要求
1.能运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
2.必做实验:配制一定物质的量浓度的溶液。
备考指导
1.本节内容重点考查:对物质的量浓度的理解及简单的计算; 配制一定物质的量浓度溶液的方法及相关误差分析。
2.复习备考时要能从问题和实际出发,设计配制一定物质的量浓度溶液的方案,进行实验探究;在探究中学会合作,能够正确分析实验过程中可能存在的误差。能根据溶质的物质的量浓度计算溶质的物质的量、与溶质相关的粒子数目等。
内容索引
01
02
03
第一环节 必备知识落实
第二环节 关键能力形成
第三环节 核心素养提升
04
实验探源
第一环节 必备知识落实
知识点1
物质的量浓度及相关计算
知识筛查
1.物质的量浓度
2.溶质的质量分数
(1)定义:用溶质质量与溶液质量之比来表示溶液组成的物理量。
3.对物质的量浓度表达式的理解
(1)正确判断溶液的溶质并计算其物质的量。
②特殊物质:如NH3溶于水后溶质为NH3·H2O,但计算浓度时仍以NH3作为溶质。
③含结晶水的物质:CuSO4·5H2O→CuSO4,Na2CO3·10H2O→Na2CO3。
(2)准确计算溶液的体积。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中。( )
(2)标准状况下22.4 L HCl溶于1 L水,溶质的物质的量浓度为1 mol·L-1。( )
(3)32.2 g Na2SO4·10H2O溶于67.8 g水中,ω(Na2SO4)=32.2%。( )
(4)31 g Na2O溶于水,配成1 L溶液,c(Na2O)=0.5 mol·L-1。( )
(5)将10 mL 1 mol·L-1的H2SO4溶液稀释成0.1 mol·L-1的H2SO4溶液,可向该溶液中加入90 mL水。( )
(6)将1 mol·L-1的NaCl溶液和0.5 mol·L-1的BaCl2溶液等体积混合后,不考虑溶液体积变化,c(Cl-)=0.75 mol·L-1。( )
(7)1 L 0.5 mol·L-1 CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol·L-1。( )
×
×
×
×
×
×
×
2.(1)1.204×1024个氯化氢分子溶于水配成1 L溶液,则溶液中溶质的物质的量浓度为 。
(2)0.3 L 2 mol·L-1的硫酸铝溶液中 的物质的量为 ;因Al3+能发生水解,所以c(Al3+) (填“>”“<”或“=”)4 mol·L-1。
(3)2 mol·L-1 Mg(NO3)2溶液中含有0.4 mol ,则溶液的体积为
mL。
(4)2 L 2 mol·L-1的Na2SO4溶液中c(Na+) (填“>”“<”或“=”)1 L 2 mol·L-1的Na2SO4溶液中c(Na+)。
(5)10 g NaCl溶于40 g水形成的溶液,其溶质的质量分数为 ;从中取出5 g溶液,所含NaCl质量为 ,其溶质质量分数为 。
答案:(1)2 mol·L-1 (2)1.8 mol < (3)100 (4)= (5)20% 1 g 20%
知识点2
配制一定物质的量浓度的溶液
知识筛查
1.主要仪器
(1)为了与容量瓶的精度相匹配,称量固体时应使用分析天平。考虑到学校的实际情况,本实验可暂用托盘天平或普通电子天平代替。
(2)容量瓶。
①构造及用途。
②查漏操作。
2.配制流程示意图
以配制500 mL 1.0 mol·L-1 NaCl溶液为例:
特别提醒(1)配制100 g 10%的NaCl溶液。用托盘天平称取10.0 g NaCl固体,放入烧杯中,再用100 mL量筒量取90.0 mL的水注入烧杯中,然后用玻璃棒搅拌使之溶解。
(2)用浓硫酸和蒸馏水配制体积比为1∶4的稀硫酸。用50 mL的量筒量取40.0 mL的蒸馏水注入100 mL的烧杯中,再用10 mL的量筒量取10.0 mL浓硫酸,然后沿烧杯内壁缓缓注入烧杯中,并用玻璃棒不停地搅拌。
知识巩固
1.实验室需要用到450 mL 1 mol·L-1的硫酸,现用密度为1.84 g·cm-3、溶质的质量分数为98%的浓硫酸来配制,下列有关说法正确的是(设NA为阿伏加德罗常数的值)( )。
A.浓硫酸中H2SO4的物质的量浓度为18.4 mol·L-1
B.配制溶液所需浓硫酸的体积为24 mL
C.配制溶液时所需的仪器只有容量瓶、烧杯、玻璃棒、量筒
D.配制溶液时,量取浓硫酸注入烧杯中,加水稀释,冷却后再转移到容量瓶中
A
解析:密度为1.84 g·cm-3、溶质的质量分数为98%的浓硫酸的物质的量浓
度c= =18.4 mol·L-1,A项正确。配制450 mL 1 mol·L-1的硫酸,应选择500 mL容量瓶,即实际配制500 mL溶液,依据稀释过程中溶质的物质的量不变得18.4 mol·L-1×V=500 mL×1 mol·L-1,解得V=27.2 mL,B项错误。用浓溶液配制一定物质的量浓度的溶液时,需要的仪器有量筒、胶头滴管、烧杯、玻璃棒、容量瓶,C项错误。稀释浓硫酸的正确操作为将浓硫酸沿着烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌,D项错误。
2.某同学按如图所示的步骤配制100 mL一定物质的量浓度的NaOH溶液,其中不正确的操作有( )。
A.②⑤
B.①②⑤⑦
C.①②④⑥
D.①④⑥⑦
C
解析:NaOH容易变质,且容易潮解,称量NaOH固体时应该在烧杯中快速称量,图示操作方法不合理,故①错误;量筒只能用于量取液体,不能在量筒中溶解固体或者稀释液体,溶解NaOH固体应该在烧杯中进行,故②错误;转移溶液时,玻璃棒应该放在容量瓶刻度线下方,图示操作不合理,故④错误;图示为仰视容量瓶刻度线定容,会导致加入的蒸馏水体积偏大,配制的溶液浓度偏小,故⑥错误。
第二环节 关键能力形成
能力点1
用不同的物理量描述溶液组成及解决相互转化的能力
整合建构
1.物质的量浓度与溶质的质量分数的相互求算
问题引领
(1)如何计算气体溶于水后形成的溶液中溶质的物质的量浓度
(2)溶液稀释、混合后浓度的计算有哪些规律方法
点拨(1)计算气体溶于水后形成的溶液中溶质的物质的量浓度的一般思路。
气体溶于水后,溶液的体积不是溶剂的体积,也不是气体体积与溶剂体积
之和,应根据V= 进行计算。
(2)溶液稀释、混合后浓度计算的方法。
①同种溶液混合后浓度计算的关键。
有关溶液稀释及混合的计算,应抓住稀释前后溶质的物质的量不变列方程式:c前·V前=c后·V后或c1V1+c2V2=c混·V混,混合后溶液的体积不等于混合前
两溶液的体积之和,而是要根据密度计算,即V混= 。
②溶质相同、质量分数不同的两溶液的混合规律。
溶质相同,质量分数分别为a%、b%的两溶液混合。
训练突破
在标准状况下,将a L A气体(相对分子质量为b)溶于0.1 L水中,所得溶液的密度为d g·cm-3,则此溶液中溶质的物质的量浓度(mol·L-1)为( )。
B
能力点2
一定物质的量浓度溶液的配制中误差分析的能力
整合建构
常见不当操作及造成的误差分析
问题引领
如何分析溶液配制过程中因操作不当引起的误差
点拨(1)溶液配制过程中的误差分析。
①分析方法。
②实例分析:配制一定物质的量浓度的NaOH溶液时,若向容量瓶中转移液体时有少量溅出,会造成溶质的量(即m)减少,故所配NaOH溶液的浓度偏小。
若溶液未冷却至室温就注入容量瓶中定容,会造成溶液的体积(即V)减小,故所配NaOH溶液的浓度偏大。
(2)读数不当引起误差的分析方法。
①仰视刻度线(图1),导致溶液体积偏大,结果偏小。
②俯视刻度线(图2),导致溶液体积偏小,结果偏大。
训练突破
1.下列说法正确的是( )。
A.现需480 mL 0.1 mol·L-1氯化钠溶液,则使用容量瓶配制溶液需要2.8 g氯化钠固体
B.配制1 mol·L-1 NaOH溶液100 mL,用托盘天平称量4 g NaOH固体放入100 mL容量瓶中溶解
C.制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并继续煮沸至液体呈红褐色
D.使用量筒量取一定体积的浓硫酸配制一定物质的量浓度的稀硫酸,将浓硫酸转移至烧杯后需用蒸馏水洗涤量筒,并将洗涤液一并转移至烧杯
C
解析:实验室没有480 mL的容量瓶,选择大于480 mL且相近规格的容量瓶,故应选择500 mL容量瓶,配制500 mL 0.1 mol·L-1氯化钠溶液需要氯化钠的质量为0.5 L×0.1 mol·L-1×58.5 g·mol-1=2.925 g,A项错误。氢氧化钠固体应该在烧杯中溶解,冷却至室温后再转移至容量瓶,B项错误。制备Fe(OH)3胶体时,向沸水中滴加FeCl3饱和溶液并继续煮沸至液体呈红褐色即得到氢氧化铁胶体,C项正确。量筒是量出式仪器,量取的液体倒出的量就是所读的量,不能洗涤,如果洗涤并将洗涤液一并转移至烧杯,实际量取浓硫酸的体积偏大,所配溶液的浓度偏大,D项错误。
2.若在配制溶液的过程中出现下列情况,对所配溶液的浓度有何影响 (填“偏大”“偏小”或“无影响”)
(1)配制NaOH溶液时,在天平的两个托盘上放两张质量相等的纸片,其他操作均正确。
(2)配制一定物质的量浓度的NaOH溶液,需称量溶质4.4 g,称量时物码放置颠倒。
(3)用量筒量取浓硫酸时,仰视读数。
(4)定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线。
(5)移液时未洗涤烧杯及玻璃棒。
答案:(1)偏小 (2)偏小 (3)偏大 (4)偏小 (5)偏小
第三环节 核心素养提升
【高考真题剖析】
【例题】 (高考组合题)下列实验过程错误的是 。
ABCD
解析:称取4.0 g NaOH固体放入烧杯中,加入少量蒸馏水溶解,冷却至室温后转移至250 mL容量瓶中,洗涤烧杯和玻璃棒并将洗涤液转移至容量瓶中,然后定容,A项错误。不能在容量瓶中直接溶解固体,B项错误。容量瓶洗净后不需要烘干,C项错误。稀释浓硫酸时应将浓硫酸慢慢加入水中(“酸入水”),并不断搅拌使产生的热量迅速扩散,以防液体溅出,D项错误。
【核心素养考查点剖析】本题从不同的角度考查了一定物质的量浓度溶液的配制过程、常见的基本操作,发现和提出有探究价值的化学问题,融合了“科学探究与创新意识”的学科素养,题目的难度中等。
【典题训练】
1.配制100 mL 0.1 mol·L-1Na2CO3溶液,下列操作正确的是( )。
A.称取1.06 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B.称取1.06 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D.定容后,塞好瓶塞,反复倒转,摇匀
D
2.实验室里需要用到480 mL 0.10 mol·L-1的硫酸铜溶液,下列实验用品及实验操作都正确的是( )。
D
解析:配制480 mL 0.10 mol·L-1的硫酸铜溶液,由于实验室没有480 mL的容量瓶,故需要选用500 mL的容量瓶,即实际配制的溶液是500 mL 0.10 mol·L-1的硫酸铜溶液,需要硫酸铜的物质的量为0.10 mol·L-1×0.5 L=0.05 mol,需要硫酸铜的质量为160 g·mol-1×0.05 mol=8.0 g,需要胆矾的质量为250 g·mol-1×0.05 mol=12.5 g。故D项正确。
3.硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)可用作定影剂、还原剂。利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下。
(1)溶液配制:称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在 中溶解,完全溶解后,全部转移至100 mL的 中,加蒸馏水至 。
答案:(1)烧杯 容量瓶 溶液的凹液面与刻度线相切
(2)蓝色褪去,且半分钟内不恢复 95.0
解析:(1)溶液配制应在烧杯中溶解,容量瓶中定容。(2)滴定过程中I2→I-,达到滴定终点时无I2,故溶液蓝色褪去,且半分钟内不恢复,即为终点。根据反应的离子方程式,可得到如下定量关系:
1 mol 248×6 g
0.009 50 mol·L-1×0.02 L m(Na2S2O3·5H2O)
m(Na2S2O3·5H2O)=0.282 72 g
【新情境模拟训练】
“84”消毒液能有效杀灭多种病毒。某同学购买了一瓶“84”消毒液,并查阅相关资料和消毒液包装说明得到如下信息:①含NaClO的质量分数为25%;②体积为1 000 mL;③密度为1.19 g·cm-3;④用水稀释后使用。请根据以上信息和相关知识回答下列问题。
(1)该“84”消毒液中NaClO的物质的量浓度为 mol·L-1。
(2)该同学取100 mL该“84”消毒液稀释至原体积的100倍后用于消毒,稀释后的溶液中c(Na+)= mol·L-1。
(3)一瓶该“84”消毒液能吸收空气中 L的CO2(标准状况)而变质。(已知:CO2+NaClO+H2O══NaHCO3+HClO)
(4)该同学参阅该“84”消毒液的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是 。
A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
答案:(1)4.0 (2)0.04 (3)89.6 (4)C
c(Na+)=c(NaClO)=0.04 mol·L-1。
(3)一瓶“84”消毒液含有n(NaClO)=1 L×4.0 mol·L-1=4.0 mol,
根据反应CO2+NaClO+H2O══NaHCO3+HClO,则需要CO2的物质的量为4.0 mol,即标准状况下V(CO2)=4.0 mol×22.4 L·mol-1=89.6 L。
(4)需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,题图中①②③④不需要,还需玻璃棒和胶头滴管,A项错误。配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,B项错误。由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏小,C项正确。应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol·L-1×74.5 g·mol-1=149 g,D项错误。
实验探源
【必备知识归纳】
配制一定物质的量浓度的溶液
1.所需仪器及配制步骤
特别提醒(1)选用容量瓶的原则——“大而近”,如需90 mL溶液,则选用100 mL容量瓶。
(2)选用容量瓶时,应指明其规格。
(3)向容量瓶中转移液体时,用玻璃棒引流,玻璃棒末端应在容量瓶刻度线以下。
2.配制溶液过程中要重点关注的四个数据
数据 要求或解释
试剂的质量 托盘天平只能精确到0.1 g,所以实验室中若用托盘天平称量试剂,记录数据时只能保留小数点后一位数字
容量瓶 的规格 (1)选择容量瓶的规格时应该与所配溶液体积相匹配,无合适规格容量瓶时,则选容积稍大一点的,如需用480 mL某溶液,则应该选择500 mL容量瓶配制溶液。
(2)回答问题时应指明所选容量瓶的规格,如回答“500 mL容量瓶”时,不能只回答“容量瓶”
洗涤烧杯和玻 璃棒2~3次 转移溶液后洗涤烧杯和玻璃棒2~3次,是为了确保溶质全部转移入容量瓶中,否则会导致所配溶液浓度偏低
液面离容量 瓶颈刻度线 下1~2 cm 定容时,当液面离容量瓶颈刻度线下1~2 cm时,应该改用胶头滴管滴加,否则容易导致液体体积超过刻度线,超过刻度线应重新配制
3.配制一定物质的量浓度溶液产生误差的原因
【易错细节筛查】
判断正误,正确的画“√”,错误的画“×”。
(1)配制0.1 L 0.4 mol·L-1 NaCl溶液,须用托盘天平称量2.34 g NaCl。( )
(2)配制稀硫酸时,先将浓硫酸加入烧杯中,后倒入蒸馏水。( )
(3)使用托盘天平称量试剂,都不能直接放在托盘中,应放两张相同的纸片。( )
(4)用100 mL量筒量取5.68 mL浓硫酸。( )
(5)配制90 mL 1 mol·L-1CuSO4溶液需要100 mL容量瓶。( )
(6)为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。( )
×
×
×
×
√
√
【实验能力形成】
1.(2023全国甲)实验室将粗盐提纯并配制0.100 0 mol·L-1的NaCl溶液。下列仪器中,本实验必须用到的有( )。
①天平 ②温度计 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯
A.①②④⑥ B.①④⑤⑥
C.②③⑦⑧ D.①⑤⑥⑧
D
解析:粗盐提纯过程中涉及的实验操作包括溶解、过滤、蒸发和结晶,题给仪器中所用到的有⑥⑧;由固体NaCl配制0.100 0 mol·L-1的NaCl溶液,题给仪器中所用到的有①⑤⑥。故D项正确。
2.实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸500 mL。根据这两种溶液的配制情况回答下列问题。
(1)如图所示的仪器中,配制溶液肯定不需要的是 (填字母),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)配制0.1 mol·L-1的NaOH溶液的操作步骤如下,正确的顺序是 。
①把称量好的NaOH固体放入小烧杯中,加适量的蒸馏水溶解
②把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液的凹液面与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中,并轻轻摇匀
⑤将容量瓶瓶塞塞紧,充分摇匀
(3)根据计算,用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液的浓度
(填“大于”“小于”或“等于”,下同)0.1 mol·L-1。若还未等溶液冷却至室温就定容,则所得溶液的浓度 0.1 mol·L-1。
答案:(1)AC 烧杯、玻璃棒、500 mL容量瓶
(2)①②④③⑤
(3)2.0 等于 大于
解析:实验室中配制450 mL 0.1 mol·L-1 NaOH溶液和500 mL 0.5 mol·L-1硫酸时,由于没有450 mL的容量瓶,应选择500 mL容量瓶。
(1)配制溶液过程中通常要用到托盘天平、容量瓶、烧杯、玻璃棒、胶头滴管、量筒等,题图所示的仪器中,配制溶液不需要的是平底烧瓶和分液漏斗;配制上述溶液还需用到的玻璃仪器是烧杯、玻璃棒、500 mL容量瓶。
(2)配制一定物质的量浓度的溶液的基本步骤:计算、称量或量取、溶解或稀释、转移、洗涤、定容、摇匀、装瓶、贴标签。配制0.1 mol·L-1 NaOH溶液的操作步骤是把称量好的NaOH固体放入小烧杯中,加适量的蒸馏水溶解。把所得溶液冷却至室温,再小心转入一定容积的容量瓶中。用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中,并轻轻摇匀。继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心地滴加蒸馏水至溶液的凹液面与刻度线相切。将容量瓶瓶塞塞紧,充分摇匀。所以正确的操作顺序是①②④③⑤。
(3)根据计算,500 mL 0.1 mol·L-1的NaOH溶液中溶质的物质的量为0.5 L ×0.1 mol·L-1=0.05 mol,质量为40 g·mol-1×0.05 mol=2 g,故用托盘天平称取NaOH的质量为2.0 g;配制一定物质的量浓度的溶液,进行误差分析时,根据c= ,分析实验操作对溶质的物质的量的影响以及对所配溶液体积的影响,进而确定对所配溶液浓度的影响。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,并不影响溶液的配制,所以所得溶液的浓度等于0.1 mol·L-1;若还未等溶液冷却至室温就定容,待温度降至室温时,溶液的凹液面会下降到刻度线以下,所得溶液的体积偏小,浓度大于0.1 mol·L-1。
同课章节目录
