2026届高考化学一轮复习 第5章 非金属及其化合物 第4节 无机非金属材料 课件(37张PPT)
文档属性
| 名称 | 2026届高考化学一轮复习 第5章 非金属及其化合物 第4节 无机非金属材料 课件(37张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-15 21:17:29 | ||
图片预览










文档简介
(共37张PPT)
第4节 无机非金属材料
第5章
课标要求
1.结合真实情境中的应用实例或通过实验探究,了解硅及其重要化合物的主要性质,认识其在生产中的应用和对生态环境的影响。
2.结合实例认识硅及其化合物性质的多样性,了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在自然资源综合利用和环境保护中的重要价值。
备考指导
1.本部分主要考查Si、SiO2、Na2SiO3的性质和用途及SiO2的结构。由于许多高科技领域的新型无机非金属材料都与硅有关,往往以工业生产流程图为载体考查综合应用,题型以选择题、工业生产流程图题为主。
2.复习备考时,多关注以硅及其化合物知识为载体与基本理论和其他元素及化合物相联系的综合题。
内容索引
01
02
03
第一环节 必备知识落实
第二环节 关键能力形成
第三环节 核心素养提升
第一环节 必备知识落实
知识点1
硅单质及其重要化合物的性质和用途
知识筛查
1.硅及其化合物
硅元素在自然界中主要以硅酸盐和氧化物的形式存在。
(1)单质硅。
①硅单质的导电性介于导体和绝缘体之间,是应用最为广泛的半导体材料。
②硅与强碱溶液反应(特征反应):
Si+2NaOH+H2O══Na2SiO3+2H2↑。
(2)SiO2的性质。
①晶体类型:共价晶体。
②酸性氧化物:SiO2+2NaOH══Na2SiO3+H2O。
③与氢氟酸反应(特性)。
SiO2+4HF══SiF4↑+2H2O。
(3)硅酸。
①硅酸是难溶于水的弱酸。
②硅酸的制法:Na2SiO3+CO2+H2O══H2SiO3↓+Na2CO3。(SiO2难溶于水,不能直接与水反应制备硅酸)
特别提醒(1)玻璃中含有二氧化硅,因此氢氟酸可用于刻蚀玻璃,盛放氢氟酸不能用玻璃瓶而用塑料瓶。
(2)NaOH溶液可以用玻璃瓶盛放,但不能用带磨口玻璃塞的玻璃瓶。
2.硅的制备工艺流程
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)氢氟酸与SiO2反应,可用氢氟酸在玻璃器皿上刻蚀标记。( )
(2)可用带磨口玻璃塞的玻璃瓶保存NaOH溶液。( )
(3)硅胶可用作食品干燥剂。( )
(4)NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中。( )
(5)Si和SiO2都用于制造光导纤维。( )
(6)玻璃容器可长期盛放各种酸。( )
(7)浓硫酸可刻蚀石英制艺术品。( )
(8)晶体硅熔点高、硬度大,所以可用于制作半导体材料。( )
(9)高温下用焦炭还原SiO2制取粗硅。( )
√
×
√
√
×
×
×
×
√
2.下列叙述中正确的是( )。
A.CO2和SiO2都是酸性氧化物,所以两者的物理性质相似
B.因为CaCO3+SiO2 CaSiO3+CO2↑,所以硅酸的酸性比碳酸的酸性强
C.CO2和SiO2都能与碳反应,且都做氧化剂
D.SiO2既能与NaOH反应,又能与氢氟酸反应,所以SiO2属于两性氧化物
C
解析:CO2的熔、沸点低,可溶于水;SiO2的熔、沸点高,硬度大,难溶于水;两者都是酸性氧化物,和物理性质没有因果关系,A项错误。CaCO3和SiO2反应是因为生成的CO2为气体,脱离反应体系,不能说明H2CO3的酸性比H2SiO3的酸性弱,B项错误。SiO2与氢氟酸反应是SiO2的特殊性质,不能说明SiO2是两性氧化物,D项错误。
知识点2
硅酸盐及无机非金属材料
知识筛查
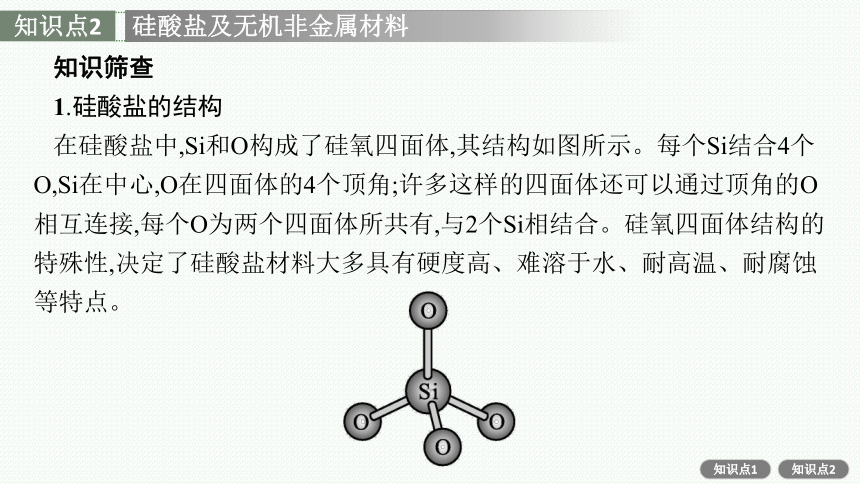
1.硅酸盐的结构
在硅酸盐中,Si和O构成了硅氧四面体,其结构如图所示。每个Si结合4个O,Si在中心,O在四面体的4个顶角;许多这样的四面体还可以通过顶角的O相互连接,每个O为两个四面体所共有,与2个Si相结合。硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高、难溶于水、耐高温、耐腐蚀等特点。
2.无机非金属材料
(1)传统的无机非金属材料多为硅酸盐材料,如水泥、玻璃、陶瓷等硅酸盐材料。
①常见硅酸盐材料比较。
硅酸钠的水溶液俗称水玻璃。
(2)新型无机非金属材料,如新型陶瓷、碳纳米材料等。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)石英砂可用于生产单晶硅。( )
(3)向Na2SiO3溶液中通入过量SO2:
(4)烧结黏土制陶瓷不涉及化学反应。( )
(5)合成纤维和光导纤维都是新型无机非金属材料。( )
(6)水玻璃可用于生产黏合剂和防火剂。( )
(7)氮化硅陶瓷是新型无机非金属材料。( )
√
×
×
×
×
√
√
2.下列有关说法中正确的是( )。
A.玻璃是人类最早使用的硅酸盐制品
B.制水泥的原料为纯碱、石灰石和石英砂
C.硅酸盐制品的性质稳定、熔点较高
D.沙子和黏土的主要成分均为硅酸盐
C
解析:陶瓷是人类最早使用的硅酸盐制品,A项错误。纯碱、石灰石和石英砂是制玻璃的原料,而制水泥的原料是黏土和石灰石,B项错误。硅酸盐制品性质稳定、熔点高,C项正确。沙子的主要成分是SiO2,黏土的主要成分是硅酸盐,D项错误。
第二环节 关键能力形成
能力点
从多角度掌握硅及其化合物特性的能力
整合建构
硅及其化合物的特性
问题引领
在设计制备高纯硅的实验题中,常遇到哪些知识点
点拨在设计制备高纯硅的实验题中,常遇到的知识点:
(1)高温下用碳还原二氧化硅制得粗硅:
(7)SiHCl3、SiCl4能与水发生反应:
SiHCl3+3H2O══H2SiO3↓+3HCl+H2↑
SiCl4+3H2O══H2SiO3↓+4HCl
(8)SiH4在空气中易自燃:SiH4+2O2══SiO2+2H2O
训练突破
1.SiO2是一种化工原料,可以制备一系列物质(如图所示)。下列说法错误的是( )。
A.高炉炼铁时,加入石灰石
将铁矿石中的脉石(主要成
分为SiO2)转化为易熔的炉渣
B.纯净的二氧化硅和单晶
硅都是信息产业的重要基础材料
C.用盐酸可除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.图中所含反应都不属于氧化还原反应
D
解析:CaCO3+SiO2 CaSiO3+CO2↑,CaSiO3的熔点低于SiO2的熔点,A项正确;光导纤维的成分是二氧化硅,半导体、芯片的成分是单晶硅,纯净的二氧化硅和单晶硅都是信息产业的重要基础材料,B项正确;碳酸钙溶于盐酸生成氯化钙、水和二氧化碳,二氧化硅与盐酸不反应,可以用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙,C项正确;二氧化硅与碳在高温下反应生成硅单质的反应是氧化还原反应,D项错误。
2.Si、SiO2广泛用于制造晶体管、光导纤维等。下列有关说法正确的是( )。
A.附着油污的晶体管可用碱液浸泡 B.光导纤维遇碱会影响光信号传输
C.工业上用SiO2热分解法冶炼硅 D.自然界中硅以游离态形式存在
B
解析:晶体管中的硅和二氧化硅可以与碱液反应,所以附着油污的晶体管不可用碱液浸泡,A项错误;SiO2用于制造光导纤维,SiO2也能与碱液反应,所以光导纤维遇碱会影响光信号传输,B项正确;工业上冶炼高纯硅有以下
第三环节 核心素养提升
【学科思想方法】
物质的转化与推断
无机物性质、类型不同,存在各种不同的转化关系,但也有许多不同类别物质存在相类似的转化关系,比较常见的有下面几种情况。
1.直接型连续转化关系
(1)X为O2。Na→Na2O→Na2O2
N2→NO→NO2或NH3→NO→NO2
S→SO2→SO3或H2S→SO2→SO3
C→CO→CO2或CH4→CO→CO2
醇→醛→羧酸
2.交叉型转化
3.三角型转化
【例题】 有如下转化关系(其他产物及反应所需条件均已略去)。
以下推断错误的是( )。
A.当X是盐酸时,F可能是稀硫酸
B.当X是氢氧化钠时,D是红棕色气体
C.当X不论是盐酸还是氢氧化钠时,F都可能是强酸
D.当X是氢氧化钠时,B与Cl2反应可能有白烟现象
B
【核心素养考查点剖析】本题主要考查了元素化合物的推断,考查了证据推理与模型认知的学科素养。该类题的解题思路一般是:迅速浏览→产生印象→找突破口→注意联系→全面分析(互推或逆推)→验证确认。解题关键是依物质的特性或转换特征来确定“突破口”,顺藤摸瓜,进而完成全部未知物的推断。
解析:若A为硫化钠,硫化钠与盐酸反应生成硫化氢,硫化氢与氯气反应生成硫单质,硫与氧气反应生成二氧化硫,二氧化硫与氧气反应生成三氧化硫,三氧化硫与水反应生成硫酸,A项正确。若A为氯化铵,氯化铵与NaOH反应生成氨,氨与氯气反应生成氯化铵和氮气,氮气与氧气在放电条件下反应生成一氧化氮(无色气体),一氧化氮与氧气反应生成红棕色二氧化氮,二氧化氮与水反应生成硝酸,B项错误。根据对A、B项的分析可知,当X不论是盐酸还是氢氧化钠时,F都可能是强酸,C项正确。根据对B项的分析,当X是氢氧化钠时,氨气与Cl2反应可生成氯化铵,有白烟现象,D项正确。
【典题训练】
1.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B与Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是( )。
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B与Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
D
解析:根据图中的转化关系可知,A与强酸或强碱反应均能生成气态氢化物,且单质C经过连续氧化后生成的E与H2O反应生成强酸,可推断A是(NH4)2S,当X是强酸时,A、B、C、D、E、F分别是:(NH4)2S、H2S、S、SO2、SO3、H2SO4;当X是强碱时,A、B、C、D、E、F分别是:(NH4)2S、NH3、N2、NO、NO2、HNO3。由上述分析可知,当X是强酸时,F是H2SO4,A项正确。当X是强碱时,F是HNO3,B项正确。无论B是H2S 还是NH3,B与Cl2的反应一定是氧化还原反应,C项正确。当X是强酸时,C是硫单质,在常温下呈固态,D项错误。
2.右图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
(1)写出B与足量硝酸钡溶液反应的离子方程式: 。
(2)写出E与A的氢化物反应生成A的化学方程式: 。
(3)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10
mol·L-1的NaOH溶液混合,反应后溶液的pH
(填“大于”“小于”或“等于”)7,理由用离
子方程式表示: 。
解析:根据题中转化关系和有关信息,可知A是S,B是SO2,C是SO3,D是H2SO4,E是H2SO3。
(1)SO2与足量硝酸钡溶液反应会被氧化成硫酸根,继而生成硫酸钡沉淀。
(2)H2SO3与H2S反应生成S,反应的化学方程式为H2SO3+2H2S══ 3S↓+3H2O。
(3)5 mL 0.10 mol·L-1的H2SO3溶液与10 mL 0.10 mol·L-1的NaOH溶液恰好完全反应得到Na2SO3溶液。Na2SO3为强碱弱酸盐,其水解使溶液呈碱性,溶液pH>7。
【新情境模拟训练】
(2023湖北卷)工业制备高纯硅的主要过程如下:
下列说法错误的是( )。
A.制备粗硅的反应方程式为SiO2+2C Si+2CO↑
B.1 mol Si含Si—Si的数目约为4×6.02×1023
C.原料气HCl和H2应充分去除水和氧气
D.生成SiHCl3的反应为熵减过程
B
解析:高温下C与SiO2反应生成Si和CO,A项正确;Si晶体中每个Si连接4个Si原子,每个Si形成共价键数目为4× =2,则1 mol Si含Si—Si键数目为2×6.02×1023,B项错误;SiHCl3能与水反应,H2与O2在高温下容易发生爆炸危险,故应除去HCl和H2中的水和氧气,C项正确;生成SiHCl3的反应为Si+3HCl SiHCl3+H2,该反应是气体分子数减小的反应,故该过程熵减,D项正确。
第4节 无机非金属材料
第5章
课标要求
1.结合真实情境中的应用实例或通过实验探究,了解硅及其重要化合物的主要性质,认识其在生产中的应用和对生态环境的影响。
2.结合实例认识硅及其化合物性质的多样性,了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在自然资源综合利用和环境保护中的重要价值。
备考指导
1.本部分主要考查Si、SiO2、Na2SiO3的性质和用途及SiO2的结构。由于许多高科技领域的新型无机非金属材料都与硅有关,往往以工业生产流程图为载体考查综合应用,题型以选择题、工业生产流程图题为主。
2.复习备考时,多关注以硅及其化合物知识为载体与基本理论和其他元素及化合物相联系的综合题。
内容索引
01
02
03
第一环节 必备知识落实
第二环节 关键能力形成
第三环节 核心素养提升
第一环节 必备知识落实
知识点1
硅单质及其重要化合物的性质和用途
知识筛查
1.硅及其化合物
硅元素在自然界中主要以硅酸盐和氧化物的形式存在。
(1)单质硅。
①硅单质的导电性介于导体和绝缘体之间,是应用最为广泛的半导体材料。
②硅与强碱溶液反应(特征反应):
Si+2NaOH+H2O══Na2SiO3+2H2↑。
(2)SiO2的性质。
①晶体类型:共价晶体。
②酸性氧化物:SiO2+2NaOH══Na2SiO3+H2O。
③与氢氟酸反应(特性)。
SiO2+4HF══SiF4↑+2H2O。
(3)硅酸。
①硅酸是难溶于水的弱酸。
②硅酸的制法:Na2SiO3+CO2+H2O══H2SiO3↓+Na2CO3。(SiO2难溶于水,不能直接与水反应制备硅酸)
特别提醒(1)玻璃中含有二氧化硅,因此氢氟酸可用于刻蚀玻璃,盛放氢氟酸不能用玻璃瓶而用塑料瓶。
(2)NaOH溶液可以用玻璃瓶盛放,但不能用带磨口玻璃塞的玻璃瓶。
2.硅的制备工艺流程
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)氢氟酸与SiO2反应,可用氢氟酸在玻璃器皿上刻蚀标记。( )
(2)可用带磨口玻璃塞的玻璃瓶保存NaOH溶液。( )
(3)硅胶可用作食品干燥剂。( )
(4)NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中。( )
(5)Si和SiO2都用于制造光导纤维。( )
(6)玻璃容器可长期盛放各种酸。( )
(7)浓硫酸可刻蚀石英制艺术品。( )
(8)晶体硅熔点高、硬度大,所以可用于制作半导体材料。( )
(9)高温下用焦炭还原SiO2制取粗硅。( )
√
×
√
√
×
×
×
×
√
2.下列叙述中正确的是( )。
A.CO2和SiO2都是酸性氧化物,所以两者的物理性质相似
B.因为CaCO3+SiO2 CaSiO3+CO2↑,所以硅酸的酸性比碳酸的酸性强
C.CO2和SiO2都能与碳反应,且都做氧化剂
D.SiO2既能与NaOH反应,又能与氢氟酸反应,所以SiO2属于两性氧化物
C
解析:CO2的熔、沸点低,可溶于水;SiO2的熔、沸点高,硬度大,难溶于水;两者都是酸性氧化物,和物理性质没有因果关系,A项错误。CaCO3和SiO2反应是因为生成的CO2为气体,脱离反应体系,不能说明H2CO3的酸性比H2SiO3的酸性弱,B项错误。SiO2与氢氟酸反应是SiO2的特殊性质,不能说明SiO2是两性氧化物,D项错误。
知识点2
硅酸盐及无机非金属材料
知识筛查
1.硅酸盐的结构
在硅酸盐中,Si和O构成了硅氧四面体,其结构如图所示。每个Si结合4个O,Si在中心,O在四面体的4个顶角;许多这样的四面体还可以通过顶角的O相互连接,每个O为两个四面体所共有,与2个Si相结合。硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高、难溶于水、耐高温、耐腐蚀等特点。
2.无机非金属材料
(1)传统的无机非金属材料多为硅酸盐材料,如水泥、玻璃、陶瓷等硅酸盐材料。
①常见硅酸盐材料比较。
硅酸钠的水溶液俗称水玻璃。
(2)新型无机非金属材料,如新型陶瓷、碳纳米材料等。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)石英砂可用于生产单晶硅。( )
(3)向Na2SiO3溶液中通入过量SO2:
(4)烧结黏土制陶瓷不涉及化学反应。( )
(5)合成纤维和光导纤维都是新型无机非金属材料。( )
(6)水玻璃可用于生产黏合剂和防火剂。( )
(7)氮化硅陶瓷是新型无机非金属材料。( )
√
×
×
×
×
√
√
2.下列有关说法中正确的是( )。
A.玻璃是人类最早使用的硅酸盐制品
B.制水泥的原料为纯碱、石灰石和石英砂
C.硅酸盐制品的性质稳定、熔点较高
D.沙子和黏土的主要成分均为硅酸盐
C
解析:陶瓷是人类最早使用的硅酸盐制品,A项错误。纯碱、石灰石和石英砂是制玻璃的原料,而制水泥的原料是黏土和石灰石,B项错误。硅酸盐制品性质稳定、熔点高,C项正确。沙子的主要成分是SiO2,黏土的主要成分是硅酸盐,D项错误。
第二环节 关键能力形成
能力点
从多角度掌握硅及其化合物特性的能力
整合建构
硅及其化合物的特性
问题引领
在设计制备高纯硅的实验题中,常遇到哪些知识点
点拨在设计制备高纯硅的实验题中,常遇到的知识点:
(1)高温下用碳还原二氧化硅制得粗硅:
(7)SiHCl3、SiCl4能与水发生反应:
SiHCl3+3H2O══H2SiO3↓+3HCl+H2↑
SiCl4+3H2O══H2SiO3↓+4HCl
(8)SiH4在空气中易自燃:SiH4+2O2══SiO2+2H2O
训练突破
1.SiO2是一种化工原料,可以制备一系列物质(如图所示)。下列说法错误的是( )。
A.高炉炼铁时,加入石灰石
将铁矿石中的脉石(主要成
分为SiO2)转化为易熔的炉渣
B.纯净的二氧化硅和单晶
硅都是信息产业的重要基础材料
C.用盐酸可除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.图中所含反应都不属于氧化还原反应
D
解析:CaCO3+SiO2 CaSiO3+CO2↑,CaSiO3的熔点低于SiO2的熔点,A项正确;光导纤维的成分是二氧化硅,半导体、芯片的成分是单晶硅,纯净的二氧化硅和单晶硅都是信息产业的重要基础材料,B项正确;碳酸钙溶于盐酸生成氯化钙、水和二氧化碳,二氧化硅与盐酸不反应,可以用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙,C项正确;二氧化硅与碳在高温下反应生成硅单质的反应是氧化还原反应,D项错误。
2.Si、SiO2广泛用于制造晶体管、光导纤维等。下列有关说法正确的是( )。
A.附着油污的晶体管可用碱液浸泡 B.光导纤维遇碱会影响光信号传输
C.工业上用SiO2热分解法冶炼硅 D.自然界中硅以游离态形式存在
B
解析:晶体管中的硅和二氧化硅可以与碱液反应,所以附着油污的晶体管不可用碱液浸泡,A项错误;SiO2用于制造光导纤维,SiO2也能与碱液反应,所以光导纤维遇碱会影响光信号传输,B项正确;工业上冶炼高纯硅有以下
第三环节 核心素养提升
【学科思想方法】
物质的转化与推断
无机物性质、类型不同,存在各种不同的转化关系,但也有许多不同类别物质存在相类似的转化关系,比较常见的有下面几种情况。
1.直接型连续转化关系
(1)X为O2。Na→Na2O→Na2O2
N2→NO→NO2或NH3→NO→NO2
S→SO2→SO3或H2S→SO2→SO3
C→CO→CO2或CH4→CO→CO2
醇→醛→羧酸
2.交叉型转化
3.三角型转化
【例题】 有如下转化关系(其他产物及反应所需条件均已略去)。
以下推断错误的是( )。
A.当X是盐酸时,F可能是稀硫酸
B.当X是氢氧化钠时,D是红棕色气体
C.当X不论是盐酸还是氢氧化钠时,F都可能是强酸
D.当X是氢氧化钠时,B与Cl2反应可能有白烟现象
B
【核心素养考查点剖析】本题主要考查了元素化合物的推断,考查了证据推理与模型认知的学科素养。该类题的解题思路一般是:迅速浏览→产生印象→找突破口→注意联系→全面分析(互推或逆推)→验证确认。解题关键是依物质的特性或转换特征来确定“突破口”,顺藤摸瓜,进而完成全部未知物的推断。
解析:若A为硫化钠,硫化钠与盐酸反应生成硫化氢,硫化氢与氯气反应生成硫单质,硫与氧气反应生成二氧化硫,二氧化硫与氧气反应生成三氧化硫,三氧化硫与水反应生成硫酸,A项正确。若A为氯化铵,氯化铵与NaOH反应生成氨,氨与氯气反应生成氯化铵和氮气,氮气与氧气在放电条件下反应生成一氧化氮(无色气体),一氧化氮与氧气反应生成红棕色二氧化氮,二氧化氮与水反应生成硝酸,B项错误。根据对A、B项的分析可知,当X不论是盐酸还是氢氧化钠时,F都可能是强酸,C项正确。根据对B项的分析,当X是氢氧化钠时,氨气与Cl2反应可生成氯化铵,有白烟现象,D项正确。
【典题训练】
1.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B与Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是( )。
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B与Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
D
解析:根据图中的转化关系可知,A与强酸或强碱反应均能生成气态氢化物,且单质C经过连续氧化后生成的E与H2O反应生成强酸,可推断A是(NH4)2S,当X是强酸时,A、B、C、D、E、F分别是:(NH4)2S、H2S、S、SO2、SO3、H2SO4;当X是强碱时,A、B、C、D、E、F分别是:(NH4)2S、NH3、N2、NO、NO2、HNO3。由上述分析可知,当X是强酸时,F是H2SO4,A项正确。当X是强碱时,F是HNO3,B项正确。无论B是H2S 还是NH3,B与Cl2的反应一定是氧化还原反应,C项正确。当X是强酸时,C是硫单质,在常温下呈固态,D项错误。
2.右图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
(1)写出B与足量硝酸钡溶液反应的离子方程式: 。
(2)写出E与A的氢化物反应生成A的化学方程式: 。
(3)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10
mol·L-1的NaOH溶液混合,反应后溶液的pH
(填“大于”“小于”或“等于”)7,理由用离
子方程式表示: 。
解析:根据题中转化关系和有关信息,可知A是S,B是SO2,C是SO3,D是H2SO4,E是H2SO3。
(1)SO2与足量硝酸钡溶液反应会被氧化成硫酸根,继而生成硫酸钡沉淀。
(2)H2SO3与H2S反应生成S,反应的化学方程式为H2SO3+2H2S══ 3S↓+3H2O。
(3)5 mL 0.10 mol·L-1的H2SO3溶液与10 mL 0.10 mol·L-1的NaOH溶液恰好完全反应得到Na2SO3溶液。Na2SO3为强碱弱酸盐,其水解使溶液呈碱性,溶液pH>7。
【新情境模拟训练】
(2023湖北卷)工业制备高纯硅的主要过程如下:
下列说法错误的是( )。
A.制备粗硅的反应方程式为SiO2+2C Si+2CO↑
B.1 mol Si含Si—Si的数目约为4×6.02×1023
C.原料气HCl和H2应充分去除水和氧气
D.生成SiHCl3的反应为熵减过程
B
解析:高温下C与SiO2反应生成Si和CO,A项正确;Si晶体中每个Si连接4个Si原子,每个Si形成共价键数目为4× =2,则1 mol Si含Si—Si键数目为2×6.02×1023,B项错误;SiHCl3能与水反应,H2与O2在高温下容易发生爆炸危险,故应除去HCl和H2中的水和氧气,C项正确;生成SiHCl3的反应为Si+3HCl SiHCl3+H2,该反应是气体分子数减小的反应,故该过程熵减,D项正确。
同课章节目录
