2026届高考化学一轮复习 第10章 水溶液中的离子反应与平衡 第1节 电离平衡 课件(48张PPT)
文档属性
| 名称 | 2026届高考化学一轮复习 第10章 水溶液中的离子反应与平衡 第1节 电离平衡 课件(48张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-15 21:25:47 | ||
图片预览








文档简介
(共48张PPT)
第1节 电离平衡
第10章
课标要求
1.能用化学用语正确表示电离平衡,能通过实验证明水溶液中存在的电离平衡,能举例说明电离平衡在生产、生活中的应用。
2.能从电离、离子反应、化学平衡的角度分析溶液的性质,如酸碱性、导电性等。
3.能进行溶液pH的简单计算,能正确测定溶液pH,能调控溶液的酸碱性。能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
4.能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题。
备考指导
1.本节主要考查内容有:(1)强、弱电解质的判断与比较;(2)外界条件对弱电解质电离平衡的影响;(3) 电离平衡以及溶液的导电性的变化等;(4)电离平衡常数的计算及应用。题型以选择题为主,难度适中。
2.弱电解质的电离平衡,复习时注意与溶液的酸碱性、盐类水解的知识结合理解。注意电离平衡常数与化学平衡常数的异同。
内容索引
01
02
03
第一环节 必备知识落实
第二环节 关键能力形成
第三环节 核心素养提升
第一环节 必备知识落实
知识点1
弱电解质的电离平衡
知识筛查
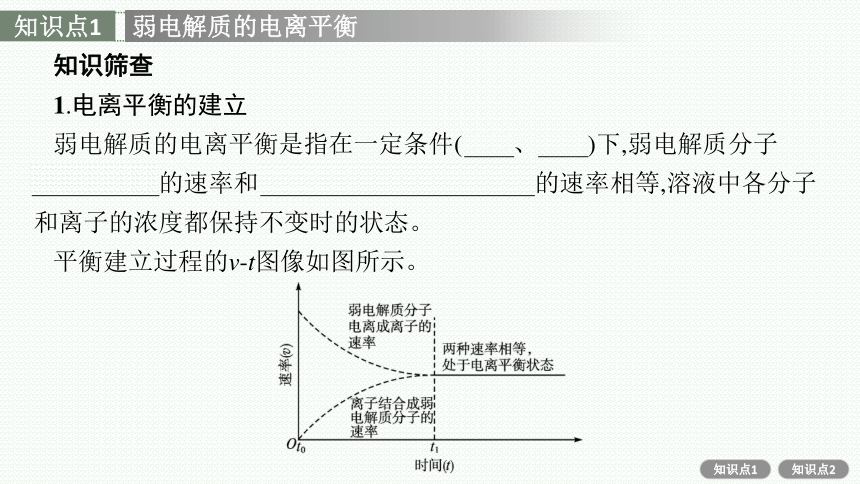
1.电离平衡的建立
弱电解质的电离平衡是指在一定条件(温度、浓度)下,弱电解质分子
电离成离子的速率和离子结合成弱电解质分子的速率相等,溶液中各分子和离子的浓度都保持不变时的状态。
平衡建立过程的v-t图像如图所示。
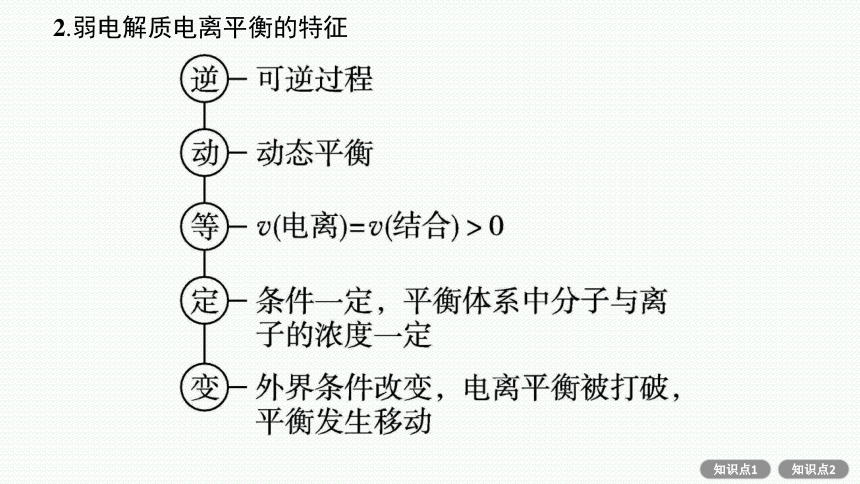
2.弱电解质电离平衡的特征
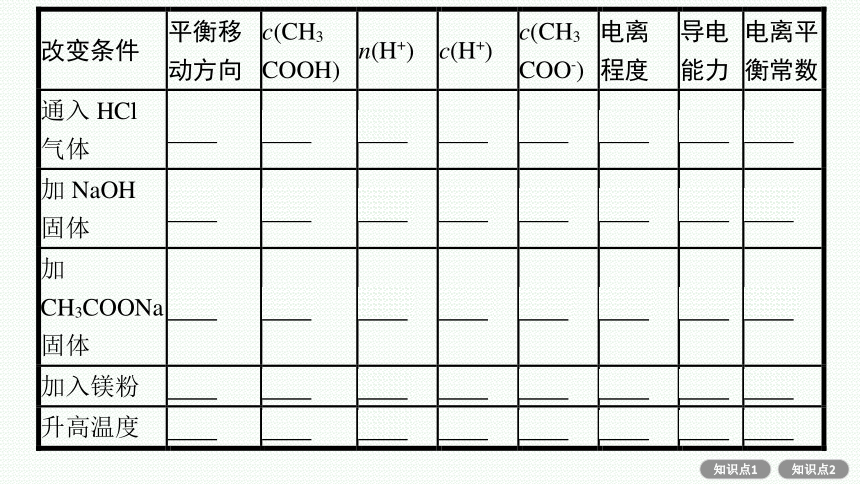
3.外界条件对电离平衡的影响
(1)内因:弱电解质本身的性质。
(2)外因:浓度、温度、加入试剂等。以0.1 mol·L-1 CH3COOH溶液为例,CH3COOH CH3COO-+H+(ΔH>0),用平衡移动原理分析电离平衡的移动。
特别提醒(1)稀醋酸加水稀释时,溶液中的各离子浓度并不是都减小,如c(OH-)是增大的。
(2)电离平衡右移,电解质分子的浓度不一定减小,电离程度也不一定增大,如稀醋酸中加入冰醋酸。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)强电解质的稀溶液中不存在溶质分子,弱电解质的稀溶液中存在溶质分子。( )
(2)NH3溶于水,当NH3·H2O电离出的c(OH-)=c( )时,表明NH3·H2O电离处于平衡状态。( )
(3)室温下,由0.1 mol·L-1一元碱BOH的pH=10可知,溶液中存在BOH══B++OH-。( )
(4)电离平衡向右移动,电解质分子的浓度一定减小,离子浓度一定增大。( )
√
×
×
×
(5)25 ℃时,向10 mL 0.1 mol·L-1醋酸中加水稀释,各离子浓度均减小。( )
(6)电离平衡向右移动,弱电解质的电离程度一定增大。( )
(7)强电解质溶液的导电能力一定比弱电解质溶液的导电能力强。( )
×
×
×
2.下列有关电离平衡的叙述正确的是( )。
A.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动
B.达到电离平衡时,由于分子和离子的浓度仍在不断发生变化,所以说电离平衡是动态平衡
C.电解质在溶液中达到电离平衡时,分子的浓度和离子的浓度相等
D.电解质达到电离平衡后,各种离子的浓度相等
A
解析:电离平衡是化学平衡的一种,达到平衡时,反应仍在进行,弱电解质分子电离成离子的速率和离子结合成分子的速率相等,各分子和离子的浓度不再变化,与分子和离子浓度是否相等没有关系,所以只有A项正确。
知识点2
弱电解质的电离平衡常数
知识筛查
1.电离常数表达式
2.特点
(1)电离平衡常数(也叫电离常数)只与温度有关,升高温度,K值增大。
3.意义
同一温度下,K越大→越易电离→酸(碱)性越强
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)电离平衡向右移动,电离常数一定增大。( )
(3)在相同的温度下,电离常数可以表示弱电解质的相对强弱。( )
(4)在相同的温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同。( )
×
×
√
×
√
√
2.相同温度下,三种酸的电离常数如表所示,下列判断正确的是( )。
A.三种酸的酸性强弱关系:HX>HY>HZ
B.反应HZ+Y-══HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液的pH最大
D.相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX的电离常数
B
解析:由表中三种酸的电离常数可知,三种酸的酸性强弱关系为HZ>HY>HX,A项不正确,B项正确。酸的电离程度越大,酸根离子的水解程度就越小,则相同浓度的钠盐溶液,酸根离子水解程度越大的溶液其碱性越强,所以NaZ溶液的pH最小,C项不正确。电离常数只与温度有关,与浓度无关,D项不正确。
第二环节 关键能力形成
能力点1
运用电离常数定量分析弱电解质电离问题的能力
整合建构
运用电离常数能解决的电解质的电离问题
(1)判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
(2)判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,碱性(或酸性)越弱。
(3)判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
(4)判断粒子浓度比值的变化。
弱电解质加水稀释时,能促进弱电解质的电离,溶液中离子和分子的浓度会发生相应的变化,但电离常数不变,考题中经常利用电离常数来判断溶液中粒子浓度比值的变化情况。
问题引领
利用电离平衡常数解决问题的一般思路是什么
点拨利用电离平衡常数解题的思维模型。
训练突破
1.已知:下表为25 ℃时某些弱酸的电离平衡常数。
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法不正确的是( )。
A.图中c(H+)∶c(R-)的值:A点>C
点(HR代表CH3COOH或HClO)
B.pH相同的四种溶液浓度关系:c(CH3COONa)>c(NaHCO3)>c(NaClO)>c(Na2CO3)
C.图中A点酸的总浓度小于B点酸的总浓度
D.浓度均为0.1 mol·L-1的CH3COONa和NaClO的
混合溶液中:c(OH-)=0.1 mol·L-1-c(ClO-)+c(H+)+
c(CH3COOH)
A
Ⅰ为CH3COOH,Ⅱ为HClO,两种酸开始时的pH相等,故较弱的酸浓度大,即HClO浓度大,故A点酸的总浓度小于B点酸的总浓度,C项正确。溶液中存在电荷守恒,即c(Na+)+c(H+)=c(ClO-)+c(CH3COO-)+c(OH-)=0.2 mol·L-1 +c(H+),由元素守恒c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1,结合两式可得c(OH-)=0.1 mol·L-1-c(ClO-)+c(H+)+c(CH3COOH),D项正确。
2.常温下,某酸HA的电离常数Ka=1×10-5。下列说法中正确的是( )。
B.常温下,0.1 mol·L-1 HA溶液中水电离出的c(H+)为10-13 mol·L-1
C.NaA溶液中加入盐酸至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-)
D.常温下,0.1 mol·L-1 NaA溶液的水解常数为10-9
D
能力点2
分析比较强、弱电解质性质的能力
整合建构
1.等物质的量浓度、相同体积的一元强酸溶液与一元弱酸溶液的比较
2.相同pH、相同体积的一元强酸溶液与一元弱酸溶液的比较
说明:一元强碱与一元弱碱的比较规律与上述类似。
3.用图像法理解一强一弱的稀释规律
(1)相同体积、相同浓度的盐酸、醋酸。
(2)相同体积、相同pH的盐酸、醋酸。
问题引领
从哪些角度能证明某种电解质属于弱电解质
点拨通过实验证明水溶液中存在的离子平衡的三个角度。
角度一 通过证明弱电解质不能完全电离。如测0.1 mol·L-1的CH3COOH溶液的pH>1。
角度二 通过改变条件,电离平衡发生移动,即存在电离平衡。如pH=1的CH3COOH溶液加水稀释至原体积的10倍后1角度三 通过弱电解质形成的盐类能水解,确定该电解质为弱电解质。如判断CH3COOH为弱酸可用下面两个现象:
(1)配制某浓度的醋酸钠溶液,向其中加入几滴酚酞溶液。现象:溶液变为浅红色。
(2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH。现象:溶液pH>7。
训练突破
1.现有室温下四种溶液,有关叙述不正确的是( )。
A.在③④溶液中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.将②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释至原体积的10倍,四种溶液的pH:①>②>④>③
D.将a L④与b L①溶液混合,若所得溶液显中性,则aD
解析:醋酸中加入醋酸钠晶体后,CH3COO-浓度增大,使CH3COOH的电离平衡向左移动,则c(H+)减小,pH增大,盐酸中加入醋酸钠,H+与CH3COO-结合生成弱电解质CH3COOH,使c(H+)减小,pH增大,A项正确。将②③两溶液等体积混合后,醋酸过量,溶液显酸性,B项正确。分别加水稀释至原体积的10倍,假设NH3·H2O的电离平衡不移动,那么①②溶液的pH均为10,但稀释氨水使平衡NH3·H2O +OH-右移,则①的pH>10,同理,醋酸稀释后pH<4,C项正确。a L④与b L①溶液混合后,若a=b,则氨水过量,溶液显碱性,所以溶液显中性时,氨水的体积应比盐酸的体积小,即a>b,D项错误。
2.pH=12的X、Y两种碱溶液各10 mL,分别稀释至1 000 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )。
A.若10B.X、Y两种碱的物质的量浓度一定相等
C.完全中和pH相同的X、Y两溶液时,消耗相同
浓度盐酸的体积:V(X)>V(Y)
D.稀释后,X溶液的碱性比Y溶液的碱性强
A
解析:若X为强碱,则10 mL pH=12的X溶液稀释至1 000 mL,pH应该为10,故若10第三环节 核心素养提升
【高考真题剖析】
【例题】 NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的
=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中Q点为反应终点。下列叙述错误的是( )。
A.混合溶液的导电能力与离子浓度和
种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.Q点的混合溶液pH=7
D.M点的混合溶液中,c(Na+)>c(K+)>c(OH-)
C
【核心素养考查点剖析】本题以“NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的 =3.9×10-6)溶液”为情景命制,旨在考查考生利用水溶液中的离子平衡的有关知识,解决实际问题的能力,较好地考查了考生的“变化观念与平衡思想”以及“宏观辨识与微观探析”等素养。
解析:随着NaOH溶液的加入,混合溶液中离子浓度和种类发生变化,因此混合溶液的导电能力与离子浓度和种类有关,A项正确;P点的混合溶液中能导电的离子主要为HA-和K+,Q点为反应终点,因此Q点的混合溶液中能导电的离子主要为A2-、K+、Na+,故Na+与A2-的导电能力之和大于HA-的,B项正确;Q点的混合溶液中含有的A2-能发生水解反应而使溶液呈碱性,C项错误;Q点为反应终点,因此Q点的混合溶液中c(Na+)=c(K+)>c(OH-),继续加入氢氧化钠溶液后,M点的混合溶液中c(Na+)>c(K+)>c(OH-),D项正确。
【典题训练】
1.(2022浙江卷)25 ℃时,苯酚(C6H5OH)的Ka=1.0×10-10,下列说法正确的是( )。
A.相同温度下,等pH的C6H5ONa和CH3COONa溶液中,c(C6H5O-)> c(CH3COO-)
B.将浓度均为0.10 mol·L-1的C6H5ONa和NaOH溶液加热,两种溶液的pH均变大
C.25 ℃时,C6H5OH溶液与NaOH溶液混合,测得pH=10.00,则此时溶液中c(C6H5O-)=c(C6H5OH)
D.25 ℃时,0.10 mol·L-1的C6H5OH溶液中加少量C6H5ONa固体,水的电离程度变小
C
解析:苯酚的酸性弱于醋酸,故C6H5O-的水解程度大于CH3COO-,故相同温度下pH相同的C6H5ONa溶液与CH3COONa溶液中,c(C6H5O-)的C6H5OH溶液中加入C6H5ONa,C6H5ONa电离出的C6H5O-会抑制C6H5OH的电离,导致溶液中H+浓度减小,从而使水的电离程度变大,D项错误。
2.(2019天津卷)某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )。
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度: N点>P点
D.相同体积M点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C
解析:根据两种酸的电离常数的值可知,酸性:HNO2>CH3COOH,pH相同的两种酸稀释相同倍数,pH变化大的是相对较强的酸,即曲线Ⅱ表示HNO2溶液的稀释,A项错误;pH越小酸性越强,对水电离的抑制程度越大,因此溶液中水的电离程度:N点3.常温下,HCOOH和CH3COOH的电离平衡常数分别为1.80×10-4和1.75×10-5。将pH=3、体积均为V0的两种酸溶液分别加水稀释至体积V,pH随lg 的变化如图所示。下列叙述正确的是( )。
A.溶液中水的电离程度:M>N>P>Q
B.M点的两种酸溶液分别与NaOH固体恰好
完全中和后,溶液中n(Na+)相同
D
D.同温下pH相同的NaOH溶液、
CH3COONa溶液、HCOONa溶液、NaHCO3
溶液的浓度:c(NaOH)解析:酸的电离平衡常数越大,酸的酸性越强,则甲酸酸性比乙酸强,pH相同的这两种酸稀释相同倍数,pH变化较大的酸酸性较强,根据图知Ⅰ表示甲酸、Ⅱ表示乙酸,酸抑制水电离,酸中c(H+)越大其抑制水电离程度越大,c(H+):M>N>P>Q,则水电离程度:M不变,故C项错误。
同温下pH相同的这几种溶液,碱性越强物质的水溶液浓度越小,这几种物质碱性:NaOH>NaHCO3>CH3COONa>HCOONa,则溶液浓度:
c(NaOH)【新情境模拟训练】
常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )。
A.C点时,溶液中由水电离的c(OH-)约为
1×10-10 mol·L-1
B.电离平衡常数:Ka(HA)C.D点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
D.向HB溶液中滴加NaOH溶液至pH=7时,
c(B-)>c(HB)
B
第1节 电离平衡
第10章
课标要求
1.能用化学用语正确表示电离平衡,能通过实验证明水溶液中存在的电离平衡,能举例说明电离平衡在生产、生活中的应用。
2.能从电离、离子反应、化学平衡的角度分析溶液的性质,如酸碱性、导电性等。
3.能进行溶液pH的简单计算,能正确测定溶液pH,能调控溶液的酸碱性。能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
4.能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题。
备考指导
1.本节主要考查内容有:(1)强、弱电解质的判断与比较;(2)外界条件对弱电解质电离平衡的影响;(3) 电离平衡以及溶液的导电性的变化等;(4)电离平衡常数的计算及应用。题型以选择题为主,难度适中。
2.弱电解质的电离平衡,复习时注意与溶液的酸碱性、盐类水解的知识结合理解。注意电离平衡常数与化学平衡常数的异同。
内容索引
01
02
03
第一环节 必备知识落实
第二环节 关键能力形成
第三环节 核心素养提升
第一环节 必备知识落实
知识点1
弱电解质的电离平衡
知识筛查
1.电离平衡的建立
弱电解质的电离平衡是指在一定条件(温度、浓度)下,弱电解质分子
电离成离子的速率和离子结合成弱电解质分子的速率相等,溶液中各分子和离子的浓度都保持不变时的状态。
平衡建立过程的v-t图像如图所示。
2.弱电解质电离平衡的特征
3.外界条件对电离平衡的影响
(1)内因:弱电解质本身的性质。
(2)外因:浓度、温度、加入试剂等。以0.1 mol·L-1 CH3COOH溶液为例,CH3COOH CH3COO-+H+(ΔH>0),用平衡移动原理分析电离平衡的移动。
特别提醒(1)稀醋酸加水稀释时,溶液中的各离子浓度并不是都减小,如c(OH-)是增大的。
(2)电离平衡右移,电解质分子的浓度不一定减小,电离程度也不一定增大,如稀醋酸中加入冰醋酸。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)强电解质的稀溶液中不存在溶质分子,弱电解质的稀溶液中存在溶质分子。( )
(2)NH3溶于水,当NH3·H2O电离出的c(OH-)=c( )时,表明NH3·H2O电离处于平衡状态。( )
(3)室温下,由0.1 mol·L-1一元碱BOH的pH=10可知,溶液中存在BOH══B++OH-。( )
(4)电离平衡向右移动,电解质分子的浓度一定减小,离子浓度一定增大。( )
√
×
×
×
(5)25 ℃时,向10 mL 0.1 mol·L-1醋酸中加水稀释,各离子浓度均减小。( )
(6)电离平衡向右移动,弱电解质的电离程度一定增大。( )
(7)强电解质溶液的导电能力一定比弱电解质溶液的导电能力强。( )
×
×
×
2.下列有关电离平衡的叙述正确的是( )。
A.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动
B.达到电离平衡时,由于分子和离子的浓度仍在不断发生变化,所以说电离平衡是动态平衡
C.电解质在溶液中达到电离平衡时,分子的浓度和离子的浓度相等
D.电解质达到电离平衡后,各种离子的浓度相等
A
解析:电离平衡是化学平衡的一种,达到平衡时,反应仍在进行,弱电解质分子电离成离子的速率和离子结合成分子的速率相等,各分子和离子的浓度不再变化,与分子和离子浓度是否相等没有关系,所以只有A项正确。
知识点2
弱电解质的电离平衡常数
知识筛查
1.电离常数表达式
2.特点
(1)电离平衡常数(也叫电离常数)只与温度有关,升高温度,K值增大。
3.意义
同一温度下,K越大→越易电离→酸(碱)性越强
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)电离平衡向右移动,电离常数一定增大。( )
(3)在相同的温度下,电离常数可以表示弱电解质的相对强弱。( )
(4)在相同的温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同。( )
×
×
√
×
√
√
2.相同温度下,三种酸的电离常数如表所示,下列判断正确的是( )。
A.三种酸的酸性强弱关系:HX>HY>HZ
B.反应HZ+Y-══HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液的pH最大
D.相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX的电离常数
B
解析:由表中三种酸的电离常数可知,三种酸的酸性强弱关系为HZ>HY>HX,A项不正确,B项正确。酸的电离程度越大,酸根离子的水解程度就越小,则相同浓度的钠盐溶液,酸根离子水解程度越大的溶液其碱性越强,所以NaZ溶液的pH最小,C项不正确。电离常数只与温度有关,与浓度无关,D项不正确。
第二环节 关键能力形成
能力点1
运用电离常数定量分析弱电解质电离问题的能力
整合建构
运用电离常数能解决的电解质的电离问题
(1)判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
(2)判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,碱性(或酸性)越弱。
(3)判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
(4)判断粒子浓度比值的变化。
弱电解质加水稀释时,能促进弱电解质的电离,溶液中离子和分子的浓度会发生相应的变化,但电离常数不变,考题中经常利用电离常数来判断溶液中粒子浓度比值的变化情况。
问题引领
利用电离平衡常数解决问题的一般思路是什么
点拨利用电离平衡常数解题的思维模型。
训练突破
1.已知:下表为25 ℃时某些弱酸的电离平衡常数。
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法不正确的是( )。
A.图中c(H+)∶c(R-)的值:A点>C
点(HR代表CH3COOH或HClO)
B.pH相同的四种溶液浓度关系:c(CH3COONa)>c(NaHCO3)>c(NaClO)>c(Na2CO3)
C.图中A点酸的总浓度小于B点酸的总浓度
D.浓度均为0.1 mol·L-1的CH3COONa和NaClO的
混合溶液中:c(OH-)=0.1 mol·L-1-c(ClO-)+c(H+)+
c(CH3COOH)
A
Ⅰ为CH3COOH,Ⅱ为HClO,两种酸开始时的pH相等,故较弱的酸浓度大,即HClO浓度大,故A点酸的总浓度小于B点酸的总浓度,C项正确。溶液中存在电荷守恒,即c(Na+)+c(H+)=c(ClO-)+c(CH3COO-)+c(OH-)=0.2 mol·L-1 +c(H+),由元素守恒c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1,结合两式可得c(OH-)=0.1 mol·L-1-c(ClO-)+c(H+)+c(CH3COOH),D项正确。
2.常温下,某酸HA的电离常数Ka=1×10-5。下列说法中正确的是( )。
B.常温下,0.1 mol·L-1 HA溶液中水电离出的c(H+)为10-13 mol·L-1
C.NaA溶液中加入盐酸至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-)
D.常温下,0.1 mol·L-1 NaA溶液的水解常数为10-9
D
能力点2
分析比较强、弱电解质性质的能力
整合建构
1.等物质的量浓度、相同体积的一元强酸溶液与一元弱酸溶液的比较
2.相同pH、相同体积的一元强酸溶液与一元弱酸溶液的比较
说明:一元强碱与一元弱碱的比较规律与上述类似。
3.用图像法理解一强一弱的稀释规律
(1)相同体积、相同浓度的盐酸、醋酸。
(2)相同体积、相同pH的盐酸、醋酸。
问题引领
从哪些角度能证明某种电解质属于弱电解质
点拨通过实验证明水溶液中存在的离子平衡的三个角度。
角度一 通过证明弱电解质不能完全电离。如测0.1 mol·L-1的CH3COOH溶液的pH>1。
角度二 通过改变条件,电离平衡发生移动,即存在电离平衡。如pH=1的CH3COOH溶液加水稀释至原体积的10倍后1
(1)配制某浓度的醋酸钠溶液,向其中加入几滴酚酞溶液。现象:溶液变为浅红色。
(2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH。现象:溶液pH>7。
训练突破
1.现有室温下四种溶液,有关叙述不正确的是( )。
A.在③④溶液中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.将②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释至原体积的10倍,四种溶液的pH:①>②>④>③
D.将a L④与b L①溶液混合,若所得溶液显中性,则a
解析:醋酸中加入醋酸钠晶体后,CH3COO-浓度增大,使CH3COOH的电离平衡向左移动,则c(H+)减小,pH增大,盐酸中加入醋酸钠,H+与CH3COO-结合生成弱电解质CH3COOH,使c(H+)减小,pH增大,A项正确。将②③两溶液等体积混合后,醋酸过量,溶液显酸性,B项正确。分别加水稀释至原体积的10倍,假设NH3·H2O的电离平衡不移动,那么①②溶液的pH均为10,但稀释氨水使平衡NH3·H2O +OH-右移,则①的pH>10,同理,醋酸稀释后pH<4,C项正确。a L④与b L①溶液混合后,若a=b,则氨水过量,溶液显碱性,所以溶液显中性时,氨水的体积应比盐酸的体积小,即a>b,D项错误。
2.pH=12的X、Y两种碱溶液各10 mL,分别稀释至1 000 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )。
A.若10
C.完全中和pH相同的X、Y两溶液时,消耗相同
浓度盐酸的体积:V(X)>V(Y)
D.稀释后,X溶液的碱性比Y溶液的碱性强
A
解析:若X为强碱,则10 mL pH=12的X溶液稀释至1 000 mL,pH应该为10,故若10
【高考真题剖析】
【例题】 NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的
=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中Q点为反应终点。下列叙述错误的是( )。
A.混合溶液的导电能力与离子浓度和
种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.Q点的混合溶液pH=7
D.M点的混合溶液中,c(Na+)>c(K+)>c(OH-)
C
【核心素养考查点剖析】本题以“NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的 =3.9×10-6)溶液”为情景命制,旨在考查考生利用水溶液中的离子平衡的有关知识,解决实际问题的能力,较好地考查了考生的“变化观念与平衡思想”以及“宏观辨识与微观探析”等素养。
解析:随着NaOH溶液的加入,混合溶液中离子浓度和种类发生变化,因此混合溶液的导电能力与离子浓度和种类有关,A项正确;P点的混合溶液中能导电的离子主要为HA-和K+,Q点为反应终点,因此Q点的混合溶液中能导电的离子主要为A2-、K+、Na+,故Na+与A2-的导电能力之和大于HA-的,B项正确;Q点的混合溶液中含有的A2-能发生水解反应而使溶液呈碱性,C项错误;Q点为反应终点,因此Q点的混合溶液中c(Na+)=c(K+)>c(OH-),继续加入氢氧化钠溶液后,M点的混合溶液中c(Na+)>c(K+)>c(OH-),D项正确。
【典题训练】
1.(2022浙江卷)25 ℃时,苯酚(C6H5OH)的Ka=1.0×10-10,下列说法正确的是( )。
A.相同温度下,等pH的C6H5ONa和CH3COONa溶液中,c(C6H5O-)> c(CH3COO-)
B.将浓度均为0.10 mol·L-1的C6H5ONa和NaOH溶液加热,两种溶液的pH均变大
C.25 ℃时,C6H5OH溶液与NaOH溶液混合,测得pH=10.00,则此时溶液中c(C6H5O-)=c(C6H5OH)
D.25 ℃时,0.10 mol·L-1的C6H5OH溶液中加少量C6H5ONa固体,水的电离程度变小
C
解析:苯酚的酸性弱于醋酸,故C6H5O-的水解程度大于CH3COO-,故相同温度下pH相同的C6H5ONa溶液与CH3COONa溶液中,c(C6H5O-)
2.(2019天津卷)某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )。
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度: N点>P点
D.相同体积M点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C
解析:根据两种酸的电离常数的值可知,酸性:HNO2>CH3COOH,pH相同的两种酸稀释相同倍数,pH变化大的是相对较强的酸,即曲线Ⅱ表示HNO2溶液的稀释,A项错误;pH越小酸性越强,对水电离的抑制程度越大,因此溶液中水的电离程度:N点
A.溶液中水的电离程度:M>N>P>Q
B.M点的两种酸溶液分别与NaOH固体恰好
完全中和后,溶液中n(Na+)相同
D
D.同温下pH相同的NaOH溶液、
CH3COONa溶液、HCOONa溶液、NaHCO3
溶液的浓度:c(NaOH)
同温下pH相同的这几种溶液,碱性越强物质的水溶液浓度越小,这几种物质碱性:NaOH>NaHCO3>CH3COONa>HCOONa,则溶液浓度:
c(NaOH)
常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )。
A.C点时,溶液中由水电离的c(OH-)约为
1×10-10 mol·L-1
B.电离平衡常数:Ka(HA)
D.向HB溶液中滴加NaOH溶液至pH=7时,
c(B-)>c(HB)
B
同课章节目录
