2026届高考化学一轮复习 第10章 水溶液中的离子反应与平衡 第4节 沉淀溶解平衡 课件(58张PPT)
文档属性
| 名称 | 2026届高考化学一轮复习 第10章 水溶液中的离子反应与平衡 第4节 沉淀溶解平衡 课件(58张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-15 21:29:05 | ||
图片预览









文档简介
(共58张PPT)
第4节 沉淀溶解平衡
第10章
课标要求
1.认识难溶电解质在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解与转化。
2.了解水溶液中的离子反应与平衡在物质检测、化学反应规律研究、物质转化中的应用。
3.能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题。
备考指导
1.本节的主要考查内容有:
(1)溶解平衡的建立和平衡的移动;
(2)结合图像,考查溶度积的应用及其影响因素;
(3)沉淀反应在生产、科研、环保中的应用。
题型以选择题、填空题为主,难度较大。
2.沉淀溶解平衡在复习备考时,应多关注沉淀平衡常数的计算以及沉淀的转化,注意化学平衡的思想在沉淀溶解平衡中的应用等。
内容索引
01
02
03
第一环节 必备知识落实
第二环节 关键能力形成
第三环节 核心素养提升
第一环节 必备知识落实
知识点1
沉淀溶解平衡及其应用
知识筛查
1.溶解平衡状态
(1)定义。
沉淀溶解平衡状态是指在一定温度下,当难溶强电解质溶于水形成饱和溶液时,难溶电解质的溶解速率和沉淀速率相等的状态。
例如,在一定温度下,当AgCl溶于水形成饱和溶液时,AgCl溶于水形成Ag+和Cl-的速率等于溶液中的Ag+与Cl-结合生成AgCl的速率的状态,属于溶解平衡状态。
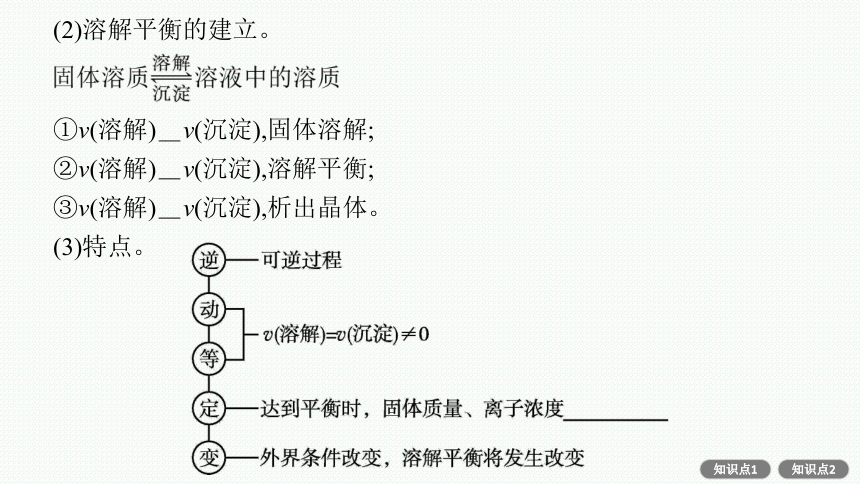
(2)溶解平衡的建立。
①v(溶解) > v(沉淀),固体溶解;
②v(溶解) = v(沉淀),溶解平衡;
③v(溶解) < v(沉淀),析出晶体。
(3)特点。
(4)沉淀溶解平衡的影响因素。
2.沉淀溶解平衡的应用
(1)沉淀的生成。
①调节pH法。
如除去CuCl2溶液中的杂质FeCl3,可以向溶液中加入CuO,调节溶液的pH,使Fe3+形成Fe(OH)3沉淀而除去。离子方程式为CuO+2H+══Cu2++H2O, Fe3++3H2O══Fe(OH)3↓+3H+。
②沉淀剂法。
如用Na2S沉淀Hg2+的离子方程式为Hg2++S2-══HgS↓。
(2)沉淀的溶解。
①酸溶解法。
如CaCO3溶于盐酸,离子方程式为CaCO3+2H+══Ca2++H2O+CO2↑。
Cu(OH)2溶于稀硫酸,离子方程式为Cu(OH)2+2H+══Cu2++2H2O。
②盐溶液溶解法。
如Mg(OH)2溶于NH4Cl溶液,离子方程式为
(3)沉淀的转化。
①实质:沉淀溶解平衡的移动。
②规律:一般说来,溶解度小的沉淀容易转化成溶解度更小的沉淀。两者的溶解度差别越大,转化越容易。
③应用。
a.锅炉除垢:将CaSO4转化为CaCO3,离子方程式为
b.矿物转化:CuSO4溶液遇PbS转化为CuS,离子方程式为Cu2++PbS══CuS+Pb2+。
特别提醒(1)沉淀溶解平衡移动过程是难溶电解质溶解和沉淀的相互转化过程,属于物理变化,但遵循勒夏特列原理。
(2)沉淀溶解达到平衡时,再加入该难溶电解质对平衡无影响。
(3)用沉淀法除杂不可能将杂质离子全部转化为沉淀除去。一般认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时,沉淀已经完全。
(4)对于化学式中阴、阳离子个数比不同的难溶物,不能直接根据Ksp的大小来确定其溶解能力的大小,需通过计算转化为溶解度。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀。( )
(2)常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变。( )
(3)25 ℃时,Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度。( )
(4)AgCl(s) Ag+(aq)+Cl-(aq)和AgCl══Ag++Cl-表示的意义相同。( )
√
√
√
×
(5)将0.1 mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L-1 CuSO4溶液,先有白色沉淀生成,后变为浅蓝色沉淀,说明Cu(OH)2的溶度积比Mg(OH)2的小。( )
(6)0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-)。( )
(7)向AgCl的悬浊液中加入NaI溶液时,出现黄色沉淀,说明Ksp(AgCl)(8)Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液。( )
√
×
×
√
(9)溶解度小的沉淀易向溶解度更小的沉淀转化,所以ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀。( )
(10)验证Fe(OH)3的溶解度小于Mg(OH)2的溶解度,可以将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色。( )
(11)AgCl沉淀易转化为AgI沉淀且Ksp(AgX)=c(Ag+)·c(X-),故Ksp(AgI)√
√
√
2.为研究沉淀的生成及转化,某小组进行如下实验。关于该实验的分析不正确的是( )。
A.①浊液中存在平衡:
AgSCN(s) Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液
中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
D
解析:根据信息,白色沉淀是AgSCN,存在沉淀溶解平衡:AgSCN(s) Ag+(aq)+SCN(aq),A项正确;取上层清液,加入Fe3+出现红色溶液,说明生成Fe(SCN)3,说明溶液中含有SCN-,B项正确;现象是产生黄色沉淀,说明有AgI生成,C项正确;可能是因为c(I-)·c(Ag+)>Ksp(AgI),所以生成AgI沉淀,D项不正确。
知识点2
溶度积及其应用
知识筛查
1.溶度积和离子积
以AmBn(s) mAn+(aq)+nBm-(aq)为例
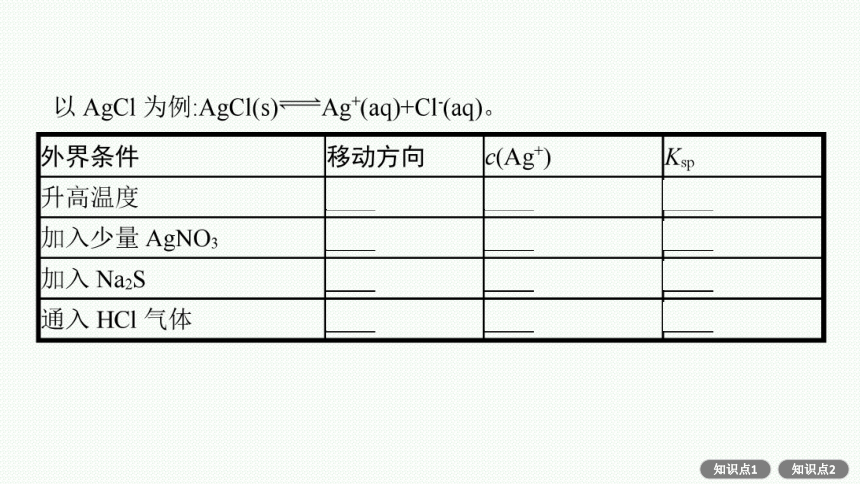
2.Ksp的影响因素
(1)内因:难溶物质本身的性质,这是决定因素。
(2)外因。
温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向溶解方向移动,Ksp增大。
名师点拨(1)浓度:加水稀释,平衡向溶解方向移动,但Ksp不变。(2)其他:向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解方向移动,但Ksp不变。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)已知:Ksp(Ag2CrO4)(2)10 mL 0.1 mol·L-1HCl溶液与10 mL 0.12 mol·L-1 AgNO3溶液混合,充分反应后,Cl-浓度等于0。( )
(3)常温下,向BaCO3的饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小。( )
(4)沉淀达到溶解平衡状态,溶液中各离子浓度一定相等。( )
×
×
×
×
2.已知:25 ℃时,Ksp[Cu(OH)2]=2.2×10-20。当溶液中各离子浓度幂的乘积大于溶度积时,产生沉淀,反之沉淀溶解。
(1)25 ℃时,某CuSO4溶液中c(Cu2+)=0.02 mol·L-1,若要生成Cu(OH)2沉淀,应调节溶液的pH,使之大于 。
(2)25 ℃时,要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降低至原来的千分之一),则应向溶液中加入NaOH溶液,使溶液的pH= 。
答案:(1)5 (2)6
第二环节 关键能力形成
能力点1
运用沉淀溶解平衡理论分析解决有关沉淀生成、溶解、转化问题的能力
整合建构
1.沉淀生成的两大应用
(1)分离离子:同一类型的难溶电解质,如AgCl、AgBr、AgI,溶度积小的物质先析出,溶度积大的物质后析出。
(2)控制溶液的pH来分离物质,如调节溶液的pH为3~4,可以除去CuSO4溶液中的铁离子。
2.沉淀溶解的四种常用方法
(1)盐溶解法:加入盐溶液,与沉淀溶解平衡体系中某种离子反应生成弱电解质,从而减小离子浓度使沉淀溶解,如Mg(OH)2溶于NH4Cl溶液。
(2)配位溶解法:加入适当的配合剂,与沉淀溶解平衡体系中的某种离子生成稳定的配合物,从而减小离子浓度使沉淀溶解,如AgCl溶于氨水。
(3)氧化还原法:通过发生氧化还原反应使平衡体系中的离子浓度降低,从而使沉淀溶解,如Ag2S溶于硝酸。
(4)沉淀转化溶解法:将难溶物转化为能用上述三种方法之一溶解的沉淀,再溶解。例如向BaSO4中加入饱和Na2CO3溶液使BaSO4转化为BaCO3,再将BaCO3溶于盐酸。
问题引领
无论是沉淀溶解,还是沉淀转化,本质的原因是什么
点拨无论是沉淀溶解,还是沉淀转化,本质的原因从定性的角度来说,就是外界条件对沉淀溶解平衡的影响;从定量的角度来分析,就是Q和Ksp的相对大小问题。
训练突破
1.下列化学原理的应用,可以用沉淀溶解平衡原理来解释的是( )。
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用后,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)溶洞的形成;④BaCO3不能作“钡餐”,而BaSO4可以;⑤泡沫灭火器灭火原理。
A.②③④ B.①②③
C.③④⑤ D.①②④⑤
A
解析:①碳酸钠是强碱弱酸盐,因为水解使其溶液呈碱性,加热促进水解,碱能促进油脂水解,所以热纯碱溶液洗涤油污的能力更强,应用了盐类水解原理,不符合题意;②钡离子有毒,所以可溶性的钡盐有毒,钡离子与硫酸根离子反应生成难溶于酸和水的硫酸钡,即易溶性的物质向难溶性的物质转化,所以可以用沉淀溶解平衡原理来解释;③石灰岩里难溶性的碳酸钙在水和二氧化碳的作用下转化为微溶性的碳酸氢钙,长时间反应,形成溶洞,可以用沉淀溶解平衡原理来解释;④碳酸钡能与盐酸反应生成氯化钡、二氧化碳和水,硫酸钡与盐酸不反应,所以碳酸钡不能作“钡餐”而硫酸钡可以,可以用沉淀溶解平衡原理来解释;⑤碳酸氢钠水解使其溶液呈碱性,硫酸铝水解使其溶液呈酸性,氢离子与氢氧根离子反应生成水,则碳酸氢钠和硫酸铝发生相互促进的水解反应,从而迅速产生二氧化碳,所以可以用盐类水解原理来解释泡沫灭火器灭火的原理,不符合题意。
2.资源综合利用既符合绿色化学理念,也是经济可持续发展的有效途径。一种难溶的废弃矿渣杂卤石,其主要成分可表示为K2SO4·MgSO4·2CaSO4·2H2O,已知它在水溶液中存在如下平衡:
为了充分利用钾资源,一种溶浸杂卤石制备K2SO4的工艺流程如图所示:
(1)操作①的名称是 。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解出杂卤石中K+的原因: 。
(3)除杂环节中,为除去Ca2+,可先加入 溶液,经搅拌等操作后,过滤,再向滤液中滴加稀硫酸,调节溶液pH至 (填“酸性”“中性”或“碱性”)。
(4)操作②的步骤包括(填操作过程): 、过滤、洗涤、干燥。
答案:(1)过滤
(2)Mg2+转化成Mg(OH)2沉淀, 与Ca2+结合转化为CaSO4沉淀,平衡右移,促使杂卤石溶解
(3)K2CO3 中性
(4)蒸发浓缩、冷却结晶
解析:(3)为除去Ca2+,可先加入K2CO3溶液,生成碳酸钙沉淀,过滤后再向滤液中滴加稀硫酸,调节溶液pH至中性,除去过量的碳酸钾。(4)为从溶液中得到溶质,需依次经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
能力点2
分析解答有关沉淀溶解平衡图像问题的能力
整合建构
沉淀溶解平衡图像题的解题策略
(1)沉淀溶解平衡曲线类似于溶解度曲线,曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液。
(2)从图像中找到数据,根据Ksp公式计算得出Ksp的值。
(3)比较溶液的Q与Ksp的大小,判断溶液中有无沉淀析出。
(4)涉及Q的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合溶液的体积。
问题引领
如何解读沉淀溶解平衡图像
点拨有关沉淀溶解平衡图像问题的思维模板。
明确图像中纵、横坐标的含义→理解图像中线上的点、线外点的含义→抓住Ksp的特点,结合题目选项或问题分析判断
一般来说,曲线上的点是该温度下达到沉淀溶解平衡的点,线上方或线下方的点的含义因纵、横坐标的含义以及参考线的不同而不同。对于纵、横坐标为离子浓度的图像,线上方的点为Q大于Ksp的点,线下方的点为Q小于Ksp的点;对于纵、横坐标为离子浓度负对数的图像,则正好相反。
训练突破
1.向废水中加入硫化物可以依次获得CuS、 ZnS纳米粒子。常温下,H2S的 ,溶液中平衡时相关离子浓度的关系如图,下列说法错误的是( )。
A.Ksp(CuS)的数量级约为10-37
B.A点对应的CuS溶液为不饱和溶液
C.向P点的溶液中加入少量Na2S固体,
溶液组成由P向M方向移动
D
解析:由图中数据可知,当c(Cu2+)=10-18 mol·L-1时,c(S2-)=10-18.3 mol·L-1,则Ksp(CuS)=c(Cu2+)·c(S2-)=10-36.3,数量级为10-37,故A项正确。
计算A点的离子浓度积为Q(CuS)=c(Cu2+)·c(S2-)=10-18.5×10-18.5=10-37向P点的溶液中加入少量Na2S固体,溶液中c(S2-)增大,则c(Cu2+)减小,故C项正确。
2.已知:25 ℃时Ksp(BaSO4)=1.0×10-10。该温度下,CaSO4悬浊液中,c(Ca2+)与c( )的关系如图所示,下列叙述正确的是( )。
A.向A点的溶液中加入等物质的量的固
体Na2SO4或Ca(NO3)2,析出的沉淀量不同
B.A、B、C、D四点对应的体系中,
D点体系最稳定
C.升高温度后,溶液可能会由A点转化为B点
D
第三环节 核心素养提升
【高考真题剖析】
【例题】 (2023全国乙改编)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。下列说法正确的是( )。
A.A点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
C
【核心素养考查点剖析】本题结合沉淀溶解平衡曲线,考查沉淀溶解平衡及Ksp的相关计算,较好考查了考生的“变化观念与平衡思想”以及“宏观辨识与微观探析”等素养。
【典题训练】
1.(2022山东卷)工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1 mol·L-1、1.0 mol·L-1 Na2CO3溶液,含SrSO4(s)的0.1 mol·L-1、1.0 mol·L-1 Na2SO4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/(mol·L-1)]随pH的变化关系如图所示。
下列说法错误的是( )。
D
B.a=-6.5
C.曲线④代表含SrCO3(s)的1.0 mol·L-1 Na2CO3溶液的变化曲线
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
解析:对于含SrSO4(s)的Na2SO4溶液,当溶液pH变化时,溶液中硫酸根离子浓度几乎不变,不会使SrSO4(s) Sr2+(aq)+ (aq)发生移动,即含硫酸锶固体的硫酸钠溶液中锶离子的浓度几乎不变,又因为pH相同时,溶液中硫酸根离子浓度增大,SrSO4的沉淀溶解平衡向沉淀方向移动,因此锶离子浓度减小,所以曲线①代表含硫酸锶固体的0.1 mol·L-1硫酸钠溶液的变化曲线,曲线②代表含硫酸锶固体的1.0 mol·L-1硫酸钠溶液的变化曲线;对于含SrCO3(s)的Na2CO3溶液,当溶液pH减小时,溶液中碳酸根离子浓度减小,SrCO3的沉淀溶解平衡向溶解的方向移动,锶离子浓度增大,又因为pH相同时,1.0 mol·L-1碳酸钠溶液中碳酸根离子浓度大于0.1 mol·L-1碳酸钠溶液中碳酸根离子的浓度,因此曲线③表示含碳酸锶固体的0.1 mol·L-1碳酸钠溶液的变化曲线,曲线④表示含碳酸锶固体的1.0 mol·L-1碳酸钠溶液的变化曲线。
变化曲线,则硫酸锶的溶度积Ksp(SrSO4)=10-5.5×0.1=10-6.5,温度不变,溶度积不变,则pH为7.7的含硫酸锶固体的1.0 mol·L-1硫酸钠溶液中,锶离子的浓度为 mol·L-1=10-6.5 mol·L-1,即a=-6.5,B项正确;由分析可知,曲线④表示含碳酸锶固体的1.0 mol·L-1碳酸钠溶液的变化曲线,C项正确;根据图像分析可知,对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH≥6.9时,溶液中Sr2+浓度减小,发生了SrSO4(s)到SrCO3(s)的转化,D项错误。
2.(2021全国甲)已知相同温度下,Ksp(BaSO4)下列说法正确的是( )。
A.曲线①代表BaCO3的沉淀溶解曲线
B.该温度下BaSO4的Ksp(BaSO4)值为
1.0×10-10
C.加适量BaCl2固体可使溶液由A点
变到B点
B
3.(2024全国甲)将0.10 mmol Ag2CrO4配制成1.0 mL悬浊液,向其中滴加0.10 mol·L-1的NaCl溶液。lg[cM/(mol·L-1)](M代表Ag+、Cl-或Cr)随加入NaCl溶液体积(V)的变化关系如图所示。
C
下列叙述正确的是( )。
A.交点a处:c(Na+)=2c(Cl-)
B.=10-2.21
C.V≤2.0 mL时,不变
D.y1=-7.82,y2=-lg 34
D
解析:由化学方程式Ag2CrO4+2NaCl 2AgCl+Na2CrO4得,①当V(NaCl)=2.0 mL时,为完全反应点,c(Cr)最大;②随着V(NaCl)增大,c(Cl-)增大,c(Ag+)减小。
在NaCl体积为2.0 mL前,AgCl和Ag2CrO4均满足溶度积常数Ksp,所以Ksp(AgCl)=10-4.57×10-5.18=10-9.75,Ksp(Ag2CrO4)=(10-5.18)2×10-1.6=10-11.96。
A项,a点为过量点,由化学方程式Ag2CrO4+2NaCl 2AgCl+Na2CrO4得, a点溶质为NaCl、Na2CrO4;由图像可知a点时,c(Cr)=c(Cl-),则c(Na2CrO4)=c(NaCl),所以a处:c(Na+)=3c(Cl-),错误。
B项,=102.21,错误。
C项,当V≤2.0 mL时,存在Ag2CrO4+2Cl- 2AgCl+Cr,得K=为定值,所以=K·c(Cl-),c(Cl-)不是定值,错误。
D项,当V(NaCl)=1.0 mL时,算出Ksp(AgCl)=c(Ag+)·c(Cl-)=10-9.75。当V(NaCl)=2.4 mL时,c(Cl-)=10-1.93 mol·L-1,所以y1=lg[]=lg[]=-7.82。c(Cr)= mol·L-1。y2=lg[c(Cr)]=lg[]=-lg 34,正确。
【新情境模拟训练】
常温时,向120 mL 0.005 mol·L-1 CaCl2溶液中逐滴加入0.1 mol·L-1 Na2CO3溶液,混合溶液的电导率随Na2CO3溶液体积的变化曲线如图所示。已知25 ℃时,Ksp(CaCO3) =3.36×10-9,忽略 水解。下列说法正确的是( )。
A.A点对应的溶液中Ca2+开始形成沉淀,溶液中c(Ca2+)=c( )
B.B点对应的溶液中Ca2+已完全沉淀,且存在关系:
c(Na+)+c(H+)=c(Cl-) +c(OH-)
C.在滴加Na2CO3溶液的过程中,
混合溶液的pH先减小后增大
D.题图可以说明CaCO3在溶液中存在过饱和现象
D
第4节 沉淀溶解平衡
第10章
课标要求
1.认识难溶电解质在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解与转化。
2.了解水溶液中的离子反应与平衡在物质检测、化学反应规律研究、物质转化中的应用。
3.能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题。
备考指导
1.本节的主要考查内容有:
(1)溶解平衡的建立和平衡的移动;
(2)结合图像,考查溶度积的应用及其影响因素;
(3)沉淀反应在生产、科研、环保中的应用。
题型以选择题、填空题为主,难度较大。
2.沉淀溶解平衡在复习备考时,应多关注沉淀平衡常数的计算以及沉淀的转化,注意化学平衡的思想在沉淀溶解平衡中的应用等。
内容索引
01
02
03
第一环节 必备知识落实
第二环节 关键能力形成
第三环节 核心素养提升
第一环节 必备知识落实
知识点1
沉淀溶解平衡及其应用
知识筛查
1.溶解平衡状态
(1)定义。
沉淀溶解平衡状态是指在一定温度下,当难溶强电解质溶于水形成饱和溶液时,难溶电解质的溶解速率和沉淀速率相等的状态。
例如,在一定温度下,当AgCl溶于水形成饱和溶液时,AgCl溶于水形成Ag+和Cl-的速率等于溶液中的Ag+与Cl-结合生成AgCl的速率的状态,属于溶解平衡状态。
(2)溶解平衡的建立。
①v(溶解) > v(沉淀),固体溶解;
②v(溶解) = v(沉淀),溶解平衡;
③v(溶解) < v(沉淀),析出晶体。
(3)特点。
(4)沉淀溶解平衡的影响因素。
2.沉淀溶解平衡的应用
(1)沉淀的生成。
①调节pH法。
如除去CuCl2溶液中的杂质FeCl3,可以向溶液中加入CuO,调节溶液的pH,使Fe3+形成Fe(OH)3沉淀而除去。离子方程式为CuO+2H+══Cu2++H2O, Fe3++3H2O══Fe(OH)3↓+3H+。
②沉淀剂法。
如用Na2S沉淀Hg2+的离子方程式为Hg2++S2-══HgS↓。
(2)沉淀的溶解。
①酸溶解法。
如CaCO3溶于盐酸,离子方程式为CaCO3+2H+══Ca2++H2O+CO2↑。
Cu(OH)2溶于稀硫酸,离子方程式为Cu(OH)2+2H+══Cu2++2H2O。
②盐溶液溶解法。
如Mg(OH)2溶于NH4Cl溶液,离子方程式为
(3)沉淀的转化。
①实质:沉淀溶解平衡的移动。
②规律:一般说来,溶解度小的沉淀容易转化成溶解度更小的沉淀。两者的溶解度差别越大,转化越容易。
③应用。
a.锅炉除垢:将CaSO4转化为CaCO3,离子方程式为
b.矿物转化:CuSO4溶液遇PbS转化为CuS,离子方程式为Cu2++PbS══CuS+Pb2+。
特别提醒(1)沉淀溶解平衡移动过程是难溶电解质溶解和沉淀的相互转化过程,属于物理变化,但遵循勒夏特列原理。
(2)沉淀溶解达到平衡时,再加入该难溶电解质对平衡无影响。
(3)用沉淀法除杂不可能将杂质离子全部转化为沉淀除去。一般认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时,沉淀已经完全。
(4)对于化学式中阴、阳离子个数比不同的难溶物,不能直接根据Ksp的大小来确定其溶解能力的大小,需通过计算转化为溶解度。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀。( )
(2)常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变。( )
(3)25 ℃时,Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度。( )
(4)AgCl(s) Ag+(aq)+Cl-(aq)和AgCl══Ag++Cl-表示的意义相同。( )
√
√
√
×
(5)将0.1 mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L-1 CuSO4溶液,先有白色沉淀生成,后变为浅蓝色沉淀,说明Cu(OH)2的溶度积比Mg(OH)2的小。( )
(6)0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-)。( )
(7)向AgCl的悬浊液中加入NaI溶液时,出现黄色沉淀,说明Ksp(AgCl)
√
×
×
√
(9)溶解度小的沉淀易向溶解度更小的沉淀转化,所以ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀。( )
(10)验证Fe(OH)3的溶解度小于Mg(OH)2的溶解度,可以将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色。( )
(11)AgCl沉淀易转化为AgI沉淀且Ksp(AgX)=c(Ag+)·c(X-),故Ksp(AgI)
√
√
2.为研究沉淀的生成及转化,某小组进行如下实验。关于该实验的分析不正确的是( )。
A.①浊液中存在平衡:
AgSCN(s) Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液
中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
D
解析:根据信息,白色沉淀是AgSCN,存在沉淀溶解平衡:AgSCN(s) Ag+(aq)+SCN(aq),A项正确;取上层清液,加入Fe3+出现红色溶液,说明生成Fe(SCN)3,说明溶液中含有SCN-,B项正确;现象是产生黄色沉淀,说明有AgI生成,C项正确;可能是因为c(I-)·c(Ag+)>Ksp(AgI),所以生成AgI沉淀,D项不正确。
知识点2
溶度积及其应用
知识筛查
1.溶度积和离子积
以AmBn(s) mAn+(aq)+nBm-(aq)为例
2.Ksp的影响因素
(1)内因:难溶物质本身的性质,这是决定因素。
(2)外因。
温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向溶解方向移动,Ksp增大。
名师点拨(1)浓度:加水稀释,平衡向溶解方向移动,但Ksp不变。(2)其他:向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解方向移动,但Ksp不变。
知识巩固
1.判断正误,正确的画“√”,错误的画“×”。
(1)已知:Ksp(Ag2CrO4)
(3)常温下,向BaCO3的饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小。( )
(4)沉淀达到溶解平衡状态,溶液中各离子浓度一定相等。( )
×
×
×
×
2.已知:25 ℃时,Ksp[Cu(OH)2]=2.2×10-20。当溶液中各离子浓度幂的乘积大于溶度积时,产生沉淀,反之沉淀溶解。
(1)25 ℃时,某CuSO4溶液中c(Cu2+)=0.02 mol·L-1,若要生成Cu(OH)2沉淀,应调节溶液的pH,使之大于 。
(2)25 ℃时,要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降低至原来的千分之一),则应向溶液中加入NaOH溶液,使溶液的pH= 。
答案:(1)5 (2)6
第二环节 关键能力形成
能力点1
运用沉淀溶解平衡理论分析解决有关沉淀生成、溶解、转化问题的能力
整合建构
1.沉淀生成的两大应用
(1)分离离子:同一类型的难溶电解质,如AgCl、AgBr、AgI,溶度积小的物质先析出,溶度积大的物质后析出。
(2)控制溶液的pH来分离物质,如调节溶液的pH为3~4,可以除去CuSO4溶液中的铁离子。
2.沉淀溶解的四种常用方法
(1)盐溶解法:加入盐溶液,与沉淀溶解平衡体系中某种离子反应生成弱电解质,从而减小离子浓度使沉淀溶解,如Mg(OH)2溶于NH4Cl溶液。
(2)配位溶解法:加入适当的配合剂,与沉淀溶解平衡体系中的某种离子生成稳定的配合物,从而减小离子浓度使沉淀溶解,如AgCl溶于氨水。
(3)氧化还原法:通过发生氧化还原反应使平衡体系中的离子浓度降低,从而使沉淀溶解,如Ag2S溶于硝酸。
(4)沉淀转化溶解法:将难溶物转化为能用上述三种方法之一溶解的沉淀,再溶解。例如向BaSO4中加入饱和Na2CO3溶液使BaSO4转化为BaCO3,再将BaCO3溶于盐酸。
问题引领
无论是沉淀溶解,还是沉淀转化,本质的原因是什么
点拨无论是沉淀溶解,还是沉淀转化,本质的原因从定性的角度来说,就是外界条件对沉淀溶解平衡的影响;从定量的角度来分析,就是Q和Ksp的相对大小问题。
训练突破
1.下列化学原理的应用,可以用沉淀溶解平衡原理来解释的是( )。
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用后,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)溶洞的形成;④BaCO3不能作“钡餐”,而BaSO4可以;⑤泡沫灭火器灭火原理。
A.②③④ B.①②③
C.③④⑤ D.①②④⑤
A
解析:①碳酸钠是强碱弱酸盐,因为水解使其溶液呈碱性,加热促进水解,碱能促进油脂水解,所以热纯碱溶液洗涤油污的能力更强,应用了盐类水解原理,不符合题意;②钡离子有毒,所以可溶性的钡盐有毒,钡离子与硫酸根离子反应生成难溶于酸和水的硫酸钡,即易溶性的物质向难溶性的物质转化,所以可以用沉淀溶解平衡原理来解释;③石灰岩里难溶性的碳酸钙在水和二氧化碳的作用下转化为微溶性的碳酸氢钙,长时间反应,形成溶洞,可以用沉淀溶解平衡原理来解释;④碳酸钡能与盐酸反应生成氯化钡、二氧化碳和水,硫酸钡与盐酸不反应,所以碳酸钡不能作“钡餐”而硫酸钡可以,可以用沉淀溶解平衡原理来解释;⑤碳酸氢钠水解使其溶液呈碱性,硫酸铝水解使其溶液呈酸性,氢离子与氢氧根离子反应生成水,则碳酸氢钠和硫酸铝发生相互促进的水解反应,从而迅速产生二氧化碳,所以可以用盐类水解原理来解释泡沫灭火器灭火的原理,不符合题意。
2.资源综合利用既符合绿色化学理念,也是经济可持续发展的有效途径。一种难溶的废弃矿渣杂卤石,其主要成分可表示为K2SO4·MgSO4·2CaSO4·2H2O,已知它在水溶液中存在如下平衡:
为了充分利用钾资源,一种溶浸杂卤石制备K2SO4的工艺流程如图所示:
(1)操作①的名称是 。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解出杂卤石中K+的原因: 。
(3)除杂环节中,为除去Ca2+,可先加入 溶液,经搅拌等操作后,过滤,再向滤液中滴加稀硫酸,调节溶液pH至 (填“酸性”“中性”或“碱性”)。
(4)操作②的步骤包括(填操作过程): 、过滤、洗涤、干燥。
答案:(1)过滤
(2)Mg2+转化成Mg(OH)2沉淀, 与Ca2+结合转化为CaSO4沉淀,平衡右移,促使杂卤石溶解
(3)K2CO3 中性
(4)蒸发浓缩、冷却结晶
解析:(3)为除去Ca2+,可先加入K2CO3溶液,生成碳酸钙沉淀,过滤后再向滤液中滴加稀硫酸,调节溶液pH至中性,除去过量的碳酸钾。(4)为从溶液中得到溶质,需依次经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
能力点2
分析解答有关沉淀溶解平衡图像问题的能力
整合建构
沉淀溶解平衡图像题的解题策略
(1)沉淀溶解平衡曲线类似于溶解度曲线,曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液。
(2)从图像中找到数据,根据Ksp公式计算得出Ksp的值。
(3)比较溶液的Q与Ksp的大小,判断溶液中有无沉淀析出。
(4)涉及Q的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合溶液的体积。
问题引领
如何解读沉淀溶解平衡图像
点拨有关沉淀溶解平衡图像问题的思维模板。
明确图像中纵、横坐标的含义→理解图像中线上的点、线外点的含义→抓住Ksp的特点,结合题目选项或问题分析判断
一般来说,曲线上的点是该温度下达到沉淀溶解平衡的点,线上方或线下方的点的含义因纵、横坐标的含义以及参考线的不同而不同。对于纵、横坐标为离子浓度的图像,线上方的点为Q大于Ksp的点,线下方的点为Q小于Ksp的点;对于纵、横坐标为离子浓度负对数的图像,则正好相反。
训练突破
1.向废水中加入硫化物可以依次获得CuS、 ZnS纳米粒子。常温下,H2S的 ,溶液中平衡时相关离子浓度的关系如图,下列说法错误的是( )。
A.Ksp(CuS)的数量级约为10-37
B.A点对应的CuS溶液为不饱和溶液
C.向P点的溶液中加入少量Na2S固体,
溶液组成由P向M方向移动
D
解析:由图中数据可知,当c(Cu2+)=10-18 mol·L-1时,c(S2-)=10-18.3 mol·L-1,则Ksp(CuS)=c(Cu2+)·c(S2-)=10-36.3,数量级为10-37,故A项正确。
计算A点的离子浓度积为Q(CuS)=c(Cu2+)·c(S2-)=10-18.5×10-18.5=10-37
2.已知:25 ℃时Ksp(BaSO4)=1.0×10-10。该温度下,CaSO4悬浊液中,c(Ca2+)与c( )的关系如图所示,下列叙述正确的是( )。
A.向A点的溶液中加入等物质的量的固
体Na2SO4或Ca(NO3)2,析出的沉淀量不同
B.A、B、C、D四点对应的体系中,
D点体系最稳定
C.升高温度后,溶液可能会由A点转化为B点
D
第三环节 核心素养提升
【高考真题剖析】
【例题】 (2023全国乙改编)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。下列说法正确的是( )。
A.A点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
C
【核心素养考查点剖析】本题结合沉淀溶解平衡曲线,考查沉淀溶解平衡及Ksp的相关计算,较好考查了考生的“变化观念与平衡思想”以及“宏观辨识与微观探析”等素养。
【典题训练】
1.(2022山东卷)工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1 mol·L-1、1.0 mol·L-1 Na2CO3溶液,含SrSO4(s)的0.1 mol·L-1、1.0 mol·L-1 Na2SO4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/(mol·L-1)]随pH的变化关系如图所示。
下列说法错误的是( )。
D
B.a=-6.5
C.曲线④代表含SrCO3(s)的1.0 mol·L-1 Na2CO3溶液的变化曲线
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
解析:对于含SrSO4(s)的Na2SO4溶液,当溶液pH变化时,溶液中硫酸根离子浓度几乎不变,不会使SrSO4(s) Sr2+(aq)+ (aq)发生移动,即含硫酸锶固体的硫酸钠溶液中锶离子的浓度几乎不变,又因为pH相同时,溶液中硫酸根离子浓度增大,SrSO4的沉淀溶解平衡向沉淀方向移动,因此锶离子浓度减小,所以曲线①代表含硫酸锶固体的0.1 mol·L-1硫酸钠溶液的变化曲线,曲线②代表含硫酸锶固体的1.0 mol·L-1硫酸钠溶液的变化曲线;对于含SrCO3(s)的Na2CO3溶液,当溶液pH减小时,溶液中碳酸根离子浓度减小,SrCO3的沉淀溶解平衡向溶解的方向移动,锶离子浓度增大,又因为pH相同时,1.0 mol·L-1碳酸钠溶液中碳酸根离子浓度大于0.1 mol·L-1碳酸钠溶液中碳酸根离子的浓度,因此曲线③表示含碳酸锶固体的0.1 mol·L-1碳酸钠溶液的变化曲线,曲线④表示含碳酸锶固体的1.0 mol·L-1碳酸钠溶液的变化曲线。
变化曲线,则硫酸锶的溶度积Ksp(SrSO4)=10-5.5×0.1=10-6.5,温度不变,溶度积不变,则pH为7.7的含硫酸锶固体的1.0 mol·L-1硫酸钠溶液中,锶离子的浓度为 mol·L-1=10-6.5 mol·L-1,即a=-6.5,B项正确;由分析可知,曲线④表示含碳酸锶固体的1.0 mol·L-1碳酸钠溶液的变化曲线,C项正确;根据图像分析可知,对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH≥6.9时,溶液中Sr2+浓度减小,发生了SrSO4(s)到SrCO3(s)的转化,D项错误。
2.(2021全国甲)已知相同温度下,Ksp(BaSO4)
A.曲线①代表BaCO3的沉淀溶解曲线
B.该温度下BaSO4的Ksp(BaSO4)值为
1.0×10-10
C.加适量BaCl2固体可使溶液由A点
变到B点
B
3.(2024全国甲)将0.10 mmol Ag2CrO4配制成1.0 mL悬浊液,向其中滴加0.10 mol·L-1的NaCl溶液。lg[cM/(mol·L-1)](M代表Ag+、Cl-或Cr)随加入NaCl溶液体积(V)的变化关系如图所示。
C
下列叙述正确的是( )。
A.交点a处:c(Na+)=2c(Cl-)
B.=10-2.21
C.V≤2.0 mL时,不变
D.y1=-7.82,y2=-lg 34
D
解析:由化学方程式Ag2CrO4+2NaCl 2AgCl+Na2CrO4得,①当V(NaCl)=2.0 mL时,为完全反应点,c(Cr)最大;②随着V(NaCl)增大,c(Cl-)增大,c(Ag+)减小。
在NaCl体积为2.0 mL前,AgCl和Ag2CrO4均满足溶度积常数Ksp,所以Ksp(AgCl)=10-4.57×10-5.18=10-9.75,Ksp(Ag2CrO4)=(10-5.18)2×10-1.6=10-11.96。
A项,a点为过量点,由化学方程式Ag2CrO4+2NaCl 2AgCl+Na2CrO4得, a点溶质为NaCl、Na2CrO4;由图像可知a点时,c(Cr)=c(Cl-),则c(Na2CrO4)=c(NaCl),所以a处:c(Na+)=3c(Cl-),错误。
B项,=102.21,错误。
C项,当V≤2.0 mL时,存在Ag2CrO4+2Cl- 2AgCl+Cr,得K=为定值,所以=K·c(Cl-),c(Cl-)不是定值,错误。
D项,当V(NaCl)=1.0 mL时,算出Ksp(AgCl)=c(Ag+)·c(Cl-)=10-9.75。当V(NaCl)=2.4 mL时,c(Cl-)=10-1.93 mol·L-1,所以y1=lg[]=lg[]=-7.82。c(Cr)= mol·L-1。y2=lg[c(Cr)]=lg[]=-lg 34,正确。
【新情境模拟训练】
常温时,向120 mL 0.005 mol·L-1 CaCl2溶液中逐滴加入0.1 mol·L-1 Na2CO3溶液,混合溶液的电导率随Na2CO3溶液体积的变化曲线如图所示。已知25 ℃时,Ksp(CaCO3) =3.36×10-9,忽略 水解。下列说法正确的是( )。
A.A点对应的溶液中Ca2+开始形成沉淀,溶液中c(Ca2+)=c( )
B.B点对应的溶液中Ca2+已完全沉淀,且存在关系:
c(Na+)+c(H+)=c(Cl-) +c(OH-)
C.在滴加Na2CO3溶液的过程中,
混合溶液的pH先减小后增大
D.题图可以说明CaCO3在溶液中存在过饱和现象
D
同课章节目录
