辽宁省沈阳市第二中学2024-2025学年高一下学期6月月考化学试卷(图片版,含答案)
文档属性
| 名称 | 辽宁省沈阳市第二中学2024-2025学年高一下学期6月月考化学试卷(图片版,含答案) |  | |
| 格式 | |||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-13 23:02:06 | ||
图片预览




文档简介
沈阳二中 2024——2025学年度下学期 6月月考
高一(2027届)化学试题
说明:1.测试时间:75 分钟 总分:100 分
2.客观题涂在答题纸上,主观题答在答题纸的相应位置上
可能用到的相对原子质量:H:1 C:12 Na:23
第Ⅰ卷 (45分)
一、选择题(本题包括 15小题,每小题 3分,共 45分,每小题只有 1个选项符合题意)
1.化学与生活、科技、社会发展息息相关,下列说法正确的是
A.“歼-20”飞机上使用的碳纤维被誉为“新材料之王”,属于有机高分子材料
B.硫化橡胶具有较高强度,是因为二硫键将线型结构转变为网状结构
C. 合成氨厂采用的压强是 10Mpa~30MPa,因为该压强下催化剂的活性最大
D.卡塔尔世界杯球馆屋顶采用了折叠式 PTFE(聚四氟乙烯)板材,该板材属于天然高分子材料
2. NA表示阿伏加德罗常数的值。下列说法正确的是
A.7.8g 苯分子中含有的碳碳双键的数目为 0.3NA
B. 28g 乙烯和丙烯的混合气体中,含有的碳原子数目为 2NA
C.标准状况下,11.2 L 的乙醇所含的分子数为 0.5NA
D.11.2LCH4 和 44.8LCl2 (均为标准状况下)在光照下充分反应后的分子数为 2NA
3.下图是硫元素的“价 类二维图”。下列说法正确的是
A.98.3%的 f 溶液能干燥 c 和 d 气体
B. c 通入溴水中,溴水褪色,证明 c 有漂白性
C. b 与强碱溶液共热,可得到 i 和 h 的混合溶液
D. 将 a 与 c 混合,可生成淡黄色固体,反应的氧化产物与还原产物的质量之比为 2:1
第 1 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
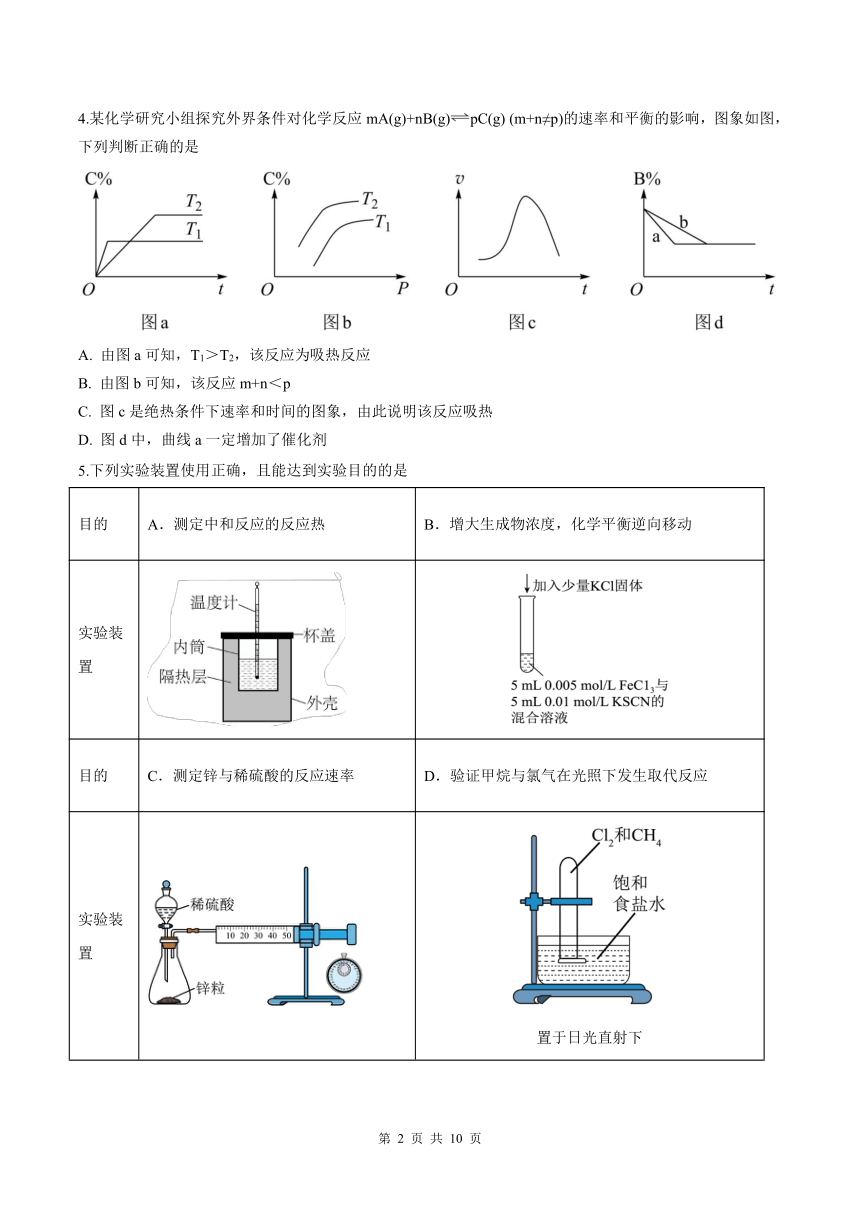
4.某化学研究小组探究外界条件对化学反应 mA(g)+nB(g) pC(g) (m+n≠p)的速率和平衡的影响,图象如图,
下列判断正确的是
A. 由图 a 可知,T1>T2,该反应为吸热反应
B. 由图 b 可知,该反应 m+n<p
C. 图 c 是绝热条件下速率和时间的图象,由此说明该反应吸热
D. 图 d 中,曲线 a 一定增加了催化剂
5.下列实验装置使用正确,且能达到实验目的的是
目的 A.测定中和反应的反应热 B.增大生成物浓度,化学平衡逆向移动
实验装
置
目的 C.测定锌与稀硫酸的反应速率 D.验证甲烷与氯气在光照下发生取代反应
实验装
置
置于日光直射下
第 2 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
6.某温度下,在密闭容器中充入一定量的 R(g),发生反应R g T g ,该反应经历两步:①R g I g 。
② I g T g ,催化剂 M 能催化第②步反应,反应历程如图所示。下列说法错误的是
c平 T c T A 平.降低温度, c I 增大,且平 c平 R
减小
B.不使用催化剂 M,反应过程中 c(I)先增大后减小
C.使用催化剂 M,反应①的活化能不变,反应②的活化能减小
D.使用催化剂 M,反应①速率不变,反应②速率加快
7.纤维电池的发明为可穿戴电子设备的发展奠定了基础。一种纤维状钠离子电池放电的总反应式为:
,其结构简图如下:
下列说法错误的是
A. 2 放电时,SO4 向乙极移动
B. 放电时,若转移 1mol ,甲电极将减少 23g
C. 放电时乙极反应式为:
D. 工作一段时间后溶液中 Na 浓度几乎不变
8.硝酸厂烟气中的大量氮氧化物(NOx)排放到空气中会污染空气,用还原法可以将 NOx转化为无害物质。常
温下,将 NO2与 H2的混合气体通入Ce SO4 与Ce2 2 SO4 3的混合溶液中,转化过程如图所示。下列说法错
误的是
A. 反应一段时间后,溶液的酸性减弱
B. 反应Ⅱ中氧化剂与还原剂的物质的量之比为 1:4
4
C. 若用 NH3替换H2,每消耗 2 mol NO2分子,最少消耗 mol NH3 3
分子
D. 反应过程中,混合溶液中Ce3 和Ce4 的总数一定保持不变
第 3 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
9.下列叙述中正确的是
A.有机物 的系统命名为 2,2,5-三甲基-3-乙基庚烷
B.丙烷的空间填充模型:
C. 分子中所有碳原子一定在同一平面上
D. 羟基(-OH)的电子式:
10.下列说法中正确的有几个
①鉴别己烯和己烷:向己烯和己烷中分别滴入酸性 KMnO4溶液,振荡,观察是否褪色
②碳原子数不同的直链烷烃一定是同系物
③CH3—CH=CH2 和环己烷的最简式相同
④聚合物( )可由单体 CH3CH=CH2和 CH2=CH2 加聚而成
⑤乙烯和聚乙烯均能使溴水褪色
⑥欲除去乙烷中混有的乙烯,应在一定条件下通入氢气,使乙烯转化为乙烷
⑦ 没有同分异构体,说明 不是平面形分子
⑧ (棱晶烷)的一氯代物有 2 种
A.4 个 B.5 个 C.6 个 D.7 个
11.有机物 A 的键线式为 ,有机物 B 是一种单烯烃,与等物质的量的氢气发生加成反应得到有
机物 A。下列有关说法错误的是
A.B 的结构可能有 5 种
B.有机物 A 的一溴代物有 6 种
C.有机物 A 的分子式为 C9H20
D.用系统命名法有机物 A:2,2,3-三甲基己烷
12. 分子式为 C5H12O 的醇,其中在铜催化下能被 O2氧化为酮的同分异构体有
A.2 种 B.3 种 C.4 种 D.8 种
第 4 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
13.由实验操作及现象,能得出相应结论的是
选
实验操作和现象 结论
项
向酸性KMnO 4 溶液中加入CH2 CHCH2OH,A CH2 CHCH2OH中含有碳碳双键
溶液褪色
向填充有经硫酸处理的 K2Cr2O7 的导管中吹入
B 乙醇有还原性
乙醇蒸气,固体由橙色变为绿色
在乙醇燃烧火焰上方罩一冷的干燥烧杯,内壁
C 有水珠出现,另罩一内壁涂有澄清石灰水的烧 乙醇由 C,H,O 三种元素组成
杯,内壁出现白色沉淀
往 75%的医用酒精中加入一小粒 Na,钠表面有
D 钠能与乙醇反应产生 H2
大量气泡产生
A.A B.B C.C D.D
14.莽草酸的结构简式如图所示,下列关于莽草酸的说法正确的是
A.1mol 莽草酸与足量的 Na 反应,标准状况下生成 11.2 LH2
B.1mol 莽草酸在催化剂条件下与 2mol H2发生加成反应
C.莽草酸的分子之间能发生酯化反应
D.1mol 莽草酸最多可与 4mol NaOH 反应
15.X 是一种常用的食品添加剂。由对甲基苯酚( )合成 X 的常用方法有 2 种(如下图)。(原
子利用率=期望产物的总质量与生成物的总质量之比)
下列说法正确的是
A.方法Ⅰ与方法Ⅱ相比,方法Ⅰ的原子利用率高
B.(CH3)2C=CH2 最多 7 个原子共面
C.(CH3)3COH 能在铜作催化剂的条件下,发生催化氧化反应
D.(CH3)2C=CH2 与氯气在光照条件下生成(CH3)2C=CHCl
第 5 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
第Ⅱ卷 (55分)
二、非选择题
16、(15 分)有机物 A 是有机化学工业的基本原料,其产量可以用来衡量一个国家石油化学工业的发展水平。
B 和 D 都是日常生活中常见的有机物,E 是一种油状、有香味的物质。下图为部分有机物间的转化关系:
回答下列问题:
Ⅰ.(1)B 的结构简式为 ,D 中含氧官能团的名称为 。
(2)丙烯(CH3CH=CH2)在催化剂、加热条件下与 O2反应可生成一种重要的化工原料丙烯酸(H2C=CHCOOH)。
下列关于丙烯酸的说法正确的是 (填字母)。
a.可用酸性 KMnO4溶液鉴别乙烯和丙烯酸
b.能发生加成反应,取代反应、中和反应
c.H2C=CHCOOH 与 OHC-CH2-CHO 互为同分异构体
d.一定条件下能发生加聚反应生成
Ⅱ.按如图所示装置制备 E。
(3)写出制备 E 的化学方程式:
(4)实验过程中未直接加热而使用水浴加热,原因是 ;浓硫酸在该反应中除了
作为催化剂外,还起到的作用是 ;饱和 Na2CO3 溶液的作用是除去挥发出的乙酸
和乙醇、 ;实验结束后,往收集到乙酸乙酯的试管中小心加入 0.5mL 紫
色石蕊试液,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间。静置,最有可能出现的现象为
(填标号)。
A.中间层为紫色,其他层均为无色 B.石蕊层为三色层,由上而下是红、紫、蓝
C.石蕊层为双色层,上层为紫色,下层为红色 D.石蕊层为三色层,由上而下是蓝、紫、红
第 6 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
17.(12 分)烯烃在有机合成中有重要作用,其反应机理及制备是化学研究的热点。回答下列问题:
Ⅰ.乙烯催化氧化的过程如图所示(部分相关离子未画出):
(1)该过程中 Cu+的作用是 ,乙烯催化氧化反应的化学方程式为 。
Ⅱ.实验室用乙醇制备乙烯原理如下:
CH 浓硫酸3CH2OH CH2 CH2 H2O,部分实验装置见图。170℃
(2)下列关于该实验的说法正确的是 (填编号)。
A.碎瓷片可防止溶液暴沸
B.应将浓硫酸缓慢加入乙醇中
C.水浴加热能满足实验所需条件
(3)用浓硫酸作催化剂时,若加热温度过高,在圆底烧瓶中会产生黑色物质 (填物质名称或
者化学式),进而发生副反应,产生SO2 气体。为证明乙烯中混有SO2 ,可选用 (填字母)。
A.稀硫酸 B.NaOH 溶液 C.酸性KMnO 4 溶液 D.品红溶液
(4)将初步净化的乙烯(除去SO2 、CO2 )通入溴的四氯化碳溶液中,溶液完全褪色需要约 4min;乙同学将
未干燥气体通入同浓度的四氯化碳溶液中,溶液完全褪色需要约 2min。
原因分析:烯烃与溴反应过程的机理如下图所示
反应物正电性部分与双键反应步骤进行得较慢,带负电粒子与正离子反应步骤进行得较快。Br2 与水反应生
成的 HBrO( )中的 Br 正电性强于Br2 中的 Br,故乙同学的实验速率快。由此机理可知,乙烯通入溴水,
除溴代烷烃外,还可能会生成有机产物 (写结构简式)。
第 7 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
18.(14 分)能源是现代文明的动力,化学电源在生产生活中有广泛的应用。回答下列问题:
(1)丙酮(CH3COCH3)在医药和国防工业等方面有着广泛用途,可通过异丙醇[CH3CH(OH)CH3]
催化分解制取,涉及反应如下:
i :CH3CH(OH)CH3 (g) CH3COCH3 (g) + H2 (g) ΔH1 = +56kJ mol-1·
ii:CH3CH(OH)CH3 (g) CH3CH = CH2 (g)+ H2O (g) ΔH2 = +52kJ -1·mol
已知上述反应中相关的化学键键能数据如下:H-O 键能 463 kJ·mol-1,H-H 键能 436 kJ·mol-1
根据上述数据判断,断开 1mol CH3COCH3(g)化学键吸收的能量 断开 1mol CH3CH=CH2(g)
化学键吸收的能量(填“>” 、“<”或“=”)。
(2)某科研团队设计的光电催化反应器,实现了由 CO2 制得异丙醇。
①A 电极反应需选用高活性和高选择性的电化学催化剂,其原因是 。
②通过该装置由 CO2 制得异丙醇的电极反应式 。
(3)已知CH3OH与O2的反应可将化学能转化为电能,其工作原理如图所示。
图中O2从 (填 A 或 B)通入,a 极的电极反应式是 。
(4)我国科学家设计的铝离子电池装置如图所示。已知电池总反应为
nAl+4nAlCl-4 +3 AlCl4 n MoSe2 =4nAl
-
2Cl7 +3MoSe2 。
①负极材料为_____(填“Al”或“MoSe2”)。
②理论上生成 2mol Al 2Cl7 时,外电路转移电子的物质的量为____mol。
第 8 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
19.(14 分)在“碳达峰、碳中和”的目标引领下,对减少二氧化碳排放的相关技术研究正成为世界各国的前沿
发展方向。回答下列问题:
(一)利用 CH4-CO2重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该过
程主要发生如下反应:
i.CH4 (g) CO2(g) 2CO(g) 2H2(g) ΔH1
ii.H2 (g) CO2 (g) CO(g) H2O(g) H2 41 kJ mol
1
反应 i 历程的能量变化如图 1 所示,C(ads)为吸附活性炭。在 4.8MPa 恒压条件下,等物质的量的 CH4和 CO2
发生重整反应,CH4和 CO2 的平衡转化率随温度变化如图 2 所示。
(1)①反应 i 历程的决速步骤反应方程式为__________________________,选择_______(填字母)条件能
够提高 CO2的平衡转化率。
a.低温高压 b.低温低压 c.高温高压 d.高温低压
(二)水蒸气和沼气的催化重整反应可用于制氢气,相关反应如下:
CI:CHH4 4((gg)) +CHO2O2((gg)) 2COCO(g()g) +23H22(g(g) ) △H1 = +206.6kJ/mol
ⅡC:HCO4 ((gg))+ HC2O(2g()g) 2CCO(2g(g)) +H22H(g2)(g) △H2 = -41.2 kJ/mol
ⅢC:CHH44((gg))+ 2CHO2O2((gg)) 2CCOO(2g()g )+24H22(g(g) ) △H3
(2)恒压绝热密闭容器中若只发生反应Ⅲ,下列不能说明反应Ⅲ达到平衡状态的是 (填标号)
A.H-H 断键速率是 C-H 的断键速率 的4倍 B.体系的温度保持不变
C.容器体积不再变化 D.混合气体总质量不再变化
(3)在催化剂作用下,反应 I 机理涉及如下过程如下(“*”代表催化剂吸附中心位点,“CH2* ” 代表吸附在
中心位点的 CH2,其他符号类比“CH2* ” ),写出过程 iii 的反应式
CH4 (g)i: CCHO4 +2(*g) 2CHO2(*g+) H 22CHH24((gg)i)i: HC2OO+2(2g*) 2CH*O+(gO)H *2H2(g)
iii: CH4 (g) CiOv:2(Hg*) 2HC2O+(2g*) CH2H4 (2g()g ) COv:C2 (Og*) 2CO+(g*) 2H2 (g)
第 9 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
(4)将 1molCH4(g)和 3molH2O(g)投入恒容密闭容器中,在初始总压 100kPa 下,发生上述三个反应,平
衡时 CO 和 CO2的选择性、平衡时 CH4 的转化率随温度的变化曲线如图所示。
n
生成 CO
【已知:CO 的选择性 n CO n CO 】 生成 生成 2
①表示 CO 选择性的曲线是 (填“a”、“b”或“c”)。判断的原因
②573K 时反应达平衡,此时测得 n(H2)=2.31mol, 则平衡时 H2O 的体积分数= (只列式不计算)。
第 10 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
沈阳二中 2024——2025 学年度下学期 6 月月考
高一(2027 届)化学试题 答案
1-5BBDDC 6-10AACAB 11-15ABBCA
16.(15分,除标注外,每空 2分)
(1)CH3CH2OH(1分) 羧基 (2)bc
CH 浓硫酸3 3COOH C2H5OH
CH
( )
3COOC2H5 H2O
(4)适当加快反应速率,减少乙醇、乙酸的挥发(共 2分,每点各 1分)
吸水剂 降低乙酸乙酯的溶解度、增加水的密度加速分层(或便于分层)(共 2分,每点各 1分)
B
17.(12分,每空 2分)
催化剂
(1)催化剂 2CH2 CH2 O2 2CH3CHO
(2)AB
(3)C或碳 D
(4)CH2OHCH2Br
18.(14分,每空 2分)
(1)> (2)①有效抑制析氢反应或减少氢气的生成(合理即可)
②3CO2 + 18e— + 18H+ = CH3CH(OH)CH3 + 5H2O
(3)B CH3OH 6e
8OH CO2 3 6H2O
(4) ① A1 ② 1.5
19. (14 分,每空 2分)
(1) ① CH4(g)+CO2(g)=C(ads)+2H2(g)+CO2(g) 或 CH4(g)=C(ads)+2H2(g) (没写状态不扣分) ② d
(2)AD
C(H34)(gC)H 2C*+OO2H(g*) 2CO*(+g)H 2 +2HC*2H(或g4 ()gC)H 2C*+OO2H(g*) 2CO*(+g)3/ 2H2H2 +2 (*g)
(4)①c 随温度升高,反应Ⅰ平衡向右移动 CO的选择性增大;反应Ⅱ向左移动,CO2的选择性减小且 CO
和 CO2的选择性加和等于 100%,所以 c代表 CO的选择性或者升高温度对反应Ⅰ影响大于反应Ⅲ,反应Ⅰ向左
1.89
移动 CO的选择性增大;反应Ⅲ向右移动,CO2的选择性减小,所以 c代表 CO的选择性 ② × 100%5.2
1
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
高一(2027届)化学试题
说明:1.测试时间:75 分钟 总分:100 分
2.客观题涂在答题纸上,主观题答在答题纸的相应位置上
可能用到的相对原子质量:H:1 C:12 Na:23
第Ⅰ卷 (45分)
一、选择题(本题包括 15小题,每小题 3分,共 45分,每小题只有 1个选项符合题意)
1.化学与生活、科技、社会发展息息相关,下列说法正确的是
A.“歼-20”飞机上使用的碳纤维被誉为“新材料之王”,属于有机高分子材料
B.硫化橡胶具有较高强度,是因为二硫键将线型结构转变为网状结构
C. 合成氨厂采用的压强是 10Mpa~30MPa,因为该压强下催化剂的活性最大
D.卡塔尔世界杯球馆屋顶采用了折叠式 PTFE(聚四氟乙烯)板材,该板材属于天然高分子材料
2. NA表示阿伏加德罗常数的值。下列说法正确的是
A.7.8g 苯分子中含有的碳碳双键的数目为 0.3NA
B. 28g 乙烯和丙烯的混合气体中,含有的碳原子数目为 2NA
C.标准状况下,11.2 L 的乙醇所含的分子数为 0.5NA
D.11.2LCH4 和 44.8LCl2 (均为标准状况下)在光照下充分反应后的分子数为 2NA
3.下图是硫元素的“价 类二维图”。下列说法正确的是
A.98.3%的 f 溶液能干燥 c 和 d 气体
B. c 通入溴水中,溴水褪色,证明 c 有漂白性
C. b 与强碱溶液共热,可得到 i 和 h 的混合溶液
D. 将 a 与 c 混合,可生成淡黄色固体,反应的氧化产物与还原产物的质量之比为 2:1
第 1 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
4.某化学研究小组探究外界条件对化学反应 mA(g)+nB(g) pC(g) (m+n≠p)的速率和平衡的影响,图象如图,
下列判断正确的是
A. 由图 a 可知,T1>T2,该反应为吸热反应
B. 由图 b 可知,该反应 m+n<p
C. 图 c 是绝热条件下速率和时间的图象,由此说明该反应吸热
D. 图 d 中,曲线 a 一定增加了催化剂
5.下列实验装置使用正确,且能达到实验目的的是
目的 A.测定中和反应的反应热 B.增大生成物浓度,化学平衡逆向移动
实验装
置
目的 C.测定锌与稀硫酸的反应速率 D.验证甲烷与氯气在光照下发生取代反应
实验装
置
置于日光直射下
第 2 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
6.某温度下,在密闭容器中充入一定量的 R(g),发生反应R g T g ,该反应经历两步:①R g I g 。
② I g T g ,催化剂 M 能催化第②步反应,反应历程如图所示。下列说法错误的是
c平 T c T A 平.降低温度, c I 增大,且平 c平 R
减小
B.不使用催化剂 M,反应过程中 c(I)先增大后减小
C.使用催化剂 M,反应①的活化能不变,反应②的活化能减小
D.使用催化剂 M,反应①速率不变,反应②速率加快
7.纤维电池的发明为可穿戴电子设备的发展奠定了基础。一种纤维状钠离子电池放电的总反应式为:
,其结构简图如下:
下列说法错误的是
A. 2 放电时,SO4 向乙极移动
B. 放电时,若转移 1mol ,甲电极将减少 23g
C. 放电时乙极反应式为:
D. 工作一段时间后溶液中 Na 浓度几乎不变
8.硝酸厂烟气中的大量氮氧化物(NOx)排放到空气中会污染空气,用还原法可以将 NOx转化为无害物质。常
温下,将 NO2与 H2的混合气体通入Ce SO4 与Ce2 2 SO4 3的混合溶液中,转化过程如图所示。下列说法错
误的是
A. 反应一段时间后,溶液的酸性减弱
B. 反应Ⅱ中氧化剂与还原剂的物质的量之比为 1:4
4
C. 若用 NH3替换H2,每消耗 2 mol NO2分子,最少消耗 mol NH3 3
分子
D. 反应过程中,混合溶液中Ce3 和Ce4 的总数一定保持不变
第 3 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
9.下列叙述中正确的是
A.有机物 的系统命名为 2,2,5-三甲基-3-乙基庚烷
B.丙烷的空间填充模型:
C. 分子中所有碳原子一定在同一平面上
D. 羟基(-OH)的电子式:
10.下列说法中正确的有几个
①鉴别己烯和己烷:向己烯和己烷中分别滴入酸性 KMnO4溶液,振荡,观察是否褪色
②碳原子数不同的直链烷烃一定是同系物
③CH3—CH=CH2 和环己烷的最简式相同
④聚合物( )可由单体 CH3CH=CH2和 CH2=CH2 加聚而成
⑤乙烯和聚乙烯均能使溴水褪色
⑥欲除去乙烷中混有的乙烯,应在一定条件下通入氢气,使乙烯转化为乙烷
⑦ 没有同分异构体,说明 不是平面形分子
⑧ (棱晶烷)的一氯代物有 2 种
A.4 个 B.5 个 C.6 个 D.7 个
11.有机物 A 的键线式为 ,有机物 B 是一种单烯烃,与等物质的量的氢气发生加成反应得到有
机物 A。下列有关说法错误的是
A.B 的结构可能有 5 种
B.有机物 A 的一溴代物有 6 种
C.有机物 A 的分子式为 C9H20
D.用系统命名法有机物 A:2,2,3-三甲基己烷
12. 分子式为 C5H12O 的醇,其中在铜催化下能被 O2氧化为酮的同分异构体有
A.2 种 B.3 种 C.4 种 D.8 种
第 4 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
13.由实验操作及现象,能得出相应结论的是
选
实验操作和现象 结论
项
向酸性KMnO 4 溶液中加入CH2 CHCH2OH,A CH2 CHCH2OH中含有碳碳双键
溶液褪色
向填充有经硫酸处理的 K2Cr2O7 的导管中吹入
B 乙醇有还原性
乙醇蒸气,固体由橙色变为绿色
在乙醇燃烧火焰上方罩一冷的干燥烧杯,内壁
C 有水珠出现,另罩一内壁涂有澄清石灰水的烧 乙醇由 C,H,O 三种元素组成
杯,内壁出现白色沉淀
往 75%的医用酒精中加入一小粒 Na,钠表面有
D 钠能与乙醇反应产生 H2
大量气泡产生
A.A B.B C.C D.D
14.莽草酸的结构简式如图所示,下列关于莽草酸的说法正确的是
A.1mol 莽草酸与足量的 Na 反应,标准状况下生成 11.2 LH2
B.1mol 莽草酸在催化剂条件下与 2mol H2发生加成反应
C.莽草酸的分子之间能发生酯化反应
D.1mol 莽草酸最多可与 4mol NaOH 反应
15.X 是一种常用的食品添加剂。由对甲基苯酚( )合成 X 的常用方法有 2 种(如下图)。(原
子利用率=期望产物的总质量与生成物的总质量之比)
下列说法正确的是
A.方法Ⅰ与方法Ⅱ相比,方法Ⅰ的原子利用率高
B.(CH3)2C=CH2 最多 7 个原子共面
C.(CH3)3COH 能在铜作催化剂的条件下,发生催化氧化反应
D.(CH3)2C=CH2 与氯气在光照条件下生成(CH3)2C=CHCl
第 5 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
第Ⅱ卷 (55分)
二、非选择题
16、(15 分)有机物 A 是有机化学工业的基本原料,其产量可以用来衡量一个国家石油化学工业的发展水平。
B 和 D 都是日常生活中常见的有机物,E 是一种油状、有香味的物质。下图为部分有机物间的转化关系:
回答下列问题:
Ⅰ.(1)B 的结构简式为 ,D 中含氧官能团的名称为 。
(2)丙烯(CH3CH=CH2)在催化剂、加热条件下与 O2反应可生成一种重要的化工原料丙烯酸(H2C=CHCOOH)。
下列关于丙烯酸的说法正确的是 (填字母)。
a.可用酸性 KMnO4溶液鉴别乙烯和丙烯酸
b.能发生加成反应,取代反应、中和反应
c.H2C=CHCOOH 与 OHC-CH2-CHO 互为同分异构体
d.一定条件下能发生加聚反应生成
Ⅱ.按如图所示装置制备 E。
(3)写出制备 E 的化学方程式:
(4)实验过程中未直接加热而使用水浴加热,原因是 ;浓硫酸在该反应中除了
作为催化剂外,还起到的作用是 ;饱和 Na2CO3 溶液的作用是除去挥发出的乙酸
和乙醇、 ;实验结束后,往收集到乙酸乙酯的试管中小心加入 0.5mL 紫
色石蕊试液,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间。静置,最有可能出现的现象为
(填标号)。
A.中间层为紫色,其他层均为无色 B.石蕊层为三色层,由上而下是红、紫、蓝
C.石蕊层为双色层,上层为紫色,下层为红色 D.石蕊层为三色层,由上而下是蓝、紫、红
第 6 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
17.(12 分)烯烃在有机合成中有重要作用,其反应机理及制备是化学研究的热点。回答下列问题:
Ⅰ.乙烯催化氧化的过程如图所示(部分相关离子未画出):
(1)该过程中 Cu+的作用是 ,乙烯催化氧化反应的化学方程式为 。
Ⅱ.实验室用乙醇制备乙烯原理如下:
CH 浓硫酸3CH2OH CH2 CH2 H2O,部分实验装置见图。170℃
(2)下列关于该实验的说法正确的是 (填编号)。
A.碎瓷片可防止溶液暴沸
B.应将浓硫酸缓慢加入乙醇中
C.水浴加热能满足实验所需条件
(3)用浓硫酸作催化剂时,若加热温度过高,在圆底烧瓶中会产生黑色物质 (填物质名称或
者化学式),进而发生副反应,产生SO2 气体。为证明乙烯中混有SO2 ,可选用 (填字母)。
A.稀硫酸 B.NaOH 溶液 C.酸性KMnO 4 溶液 D.品红溶液
(4)将初步净化的乙烯(除去SO2 、CO2 )通入溴的四氯化碳溶液中,溶液完全褪色需要约 4min;乙同学将
未干燥气体通入同浓度的四氯化碳溶液中,溶液完全褪色需要约 2min。
原因分析:烯烃与溴反应过程的机理如下图所示
反应物正电性部分与双键反应步骤进行得较慢,带负电粒子与正离子反应步骤进行得较快。Br2 与水反应生
成的 HBrO( )中的 Br 正电性强于Br2 中的 Br,故乙同学的实验速率快。由此机理可知,乙烯通入溴水,
除溴代烷烃外,还可能会生成有机产物 (写结构简式)。
第 7 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
18.(14 分)能源是现代文明的动力,化学电源在生产生活中有广泛的应用。回答下列问题:
(1)丙酮(CH3COCH3)在医药和国防工业等方面有着广泛用途,可通过异丙醇[CH3CH(OH)CH3]
催化分解制取,涉及反应如下:
i :CH3CH(OH)CH3 (g) CH3COCH3 (g) + H2 (g) ΔH1 = +56kJ mol-1·
ii:CH3CH(OH)CH3 (g) CH3CH = CH2 (g)+ H2O (g) ΔH2 = +52kJ -1·mol
已知上述反应中相关的化学键键能数据如下:H-O 键能 463 kJ·mol-1,H-H 键能 436 kJ·mol-1
根据上述数据判断,断开 1mol CH3COCH3(g)化学键吸收的能量 断开 1mol CH3CH=CH2(g)
化学键吸收的能量(填“>” 、“<”或“=”)。
(2)某科研团队设计的光电催化反应器,实现了由 CO2 制得异丙醇。
①A 电极反应需选用高活性和高选择性的电化学催化剂,其原因是 。
②通过该装置由 CO2 制得异丙醇的电极反应式 。
(3)已知CH3OH与O2的反应可将化学能转化为电能,其工作原理如图所示。
图中O2从 (填 A 或 B)通入,a 极的电极反应式是 。
(4)我国科学家设计的铝离子电池装置如图所示。已知电池总反应为
nAl+4nAlCl-4 +3 AlCl4 n MoSe2 =4nAl
-
2Cl7 +3MoSe2 。
①负极材料为_____(填“Al”或“MoSe2”)。
②理论上生成 2mol Al 2Cl7 时,外电路转移电子的物质的量为____mol。
第 8 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
19.(14 分)在“碳达峰、碳中和”的目标引领下,对减少二氧化碳排放的相关技术研究正成为世界各国的前沿
发展方向。回答下列问题:
(一)利用 CH4-CO2重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该过
程主要发生如下反应:
i.CH4 (g) CO2(g) 2CO(g) 2H2(g) ΔH1
ii.H2 (g) CO2 (g) CO(g) H2O(g) H2 41 kJ mol
1
反应 i 历程的能量变化如图 1 所示,C(ads)为吸附活性炭。在 4.8MPa 恒压条件下,等物质的量的 CH4和 CO2
发生重整反应,CH4和 CO2 的平衡转化率随温度变化如图 2 所示。
(1)①反应 i 历程的决速步骤反应方程式为__________________________,选择_______(填字母)条件能
够提高 CO2的平衡转化率。
a.低温高压 b.低温低压 c.高温高压 d.高温低压
(二)水蒸气和沼气的催化重整反应可用于制氢气,相关反应如下:
CI:CHH4 4((gg)) +CHO2O2((gg)) 2COCO(g()g) +23H22(g(g) ) △H1 = +206.6kJ/mol
ⅡC:HCO4 ((gg))+ HC2O(2g()g) 2CCO(2g(g)) +H22H(g2)(g) △H2 = -41.2 kJ/mol
ⅢC:CHH44((gg))+ 2CHO2O2((gg)) 2CCOO(2g()g )+24H22(g(g) ) △H3
(2)恒压绝热密闭容器中若只发生反应Ⅲ,下列不能说明反应Ⅲ达到平衡状态的是 (填标号)
A.H-H 断键速率是 C-H 的断键速率 的4倍 B.体系的温度保持不变
C.容器体积不再变化 D.混合气体总质量不再变化
(3)在催化剂作用下,反应 I 机理涉及如下过程如下(“*”代表催化剂吸附中心位点,“CH2* ” 代表吸附在
中心位点的 CH2,其他符号类比“CH2* ” ),写出过程 iii 的反应式
CH4 (g)i: CCHO4 +2(*g) 2CHO2(*g+) H 22CHH24((gg)i)i: HC2OO+2(2g*) 2CH*O+(gO)H *2H2(g)
iii: CH4 (g) CiOv:2(Hg*) 2HC2O+(2g*) CH2H4 (2g()g ) COv:C2 (Og*) 2CO+(g*) 2H2 (g)
第 9 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
(4)将 1molCH4(g)和 3molH2O(g)投入恒容密闭容器中,在初始总压 100kPa 下,发生上述三个反应,平
衡时 CO 和 CO2的选择性、平衡时 CH4 的转化率随温度的变化曲线如图所示。
n
生成 CO
【已知:CO 的选择性 n CO n CO 】 生成 生成 2
①表示 CO 选择性的曲线是 (填“a”、“b”或“c”)。判断的原因
②573K 时反应达平衡,此时测得 n(H2)=2.31mol, 则平衡时 H2O 的体积分数= (只列式不计算)。
第 10 页 共 10 页
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
沈阳二中 2024——2025 学年度下学期 6 月月考
高一(2027 届)化学试题 答案
1-5BBDDC 6-10AACAB 11-15ABBCA
16.(15分,除标注外,每空 2分)
(1)CH3CH2OH(1分) 羧基 (2)bc
CH 浓硫酸3 3COOH C2H5OH
CH
( )
3COOC2H5 H2O
(4)适当加快反应速率,减少乙醇、乙酸的挥发(共 2分,每点各 1分)
吸水剂 降低乙酸乙酯的溶解度、增加水的密度加速分层(或便于分层)(共 2分,每点各 1分)
B
17.(12分,每空 2分)
催化剂
(1)催化剂 2CH2 CH2 O2 2CH3CHO
(2)AB
(3)C或碳 D
(4)CH2OHCH2Br
18.(14分,每空 2分)
(1)> (2)①有效抑制析氢反应或减少氢气的生成(合理即可)
②3CO2 + 18e— + 18H+ = CH3CH(OH)CH3 + 5H2O
(3)B CH3OH 6e
8OH CO2 3 6H2O
(4) ① A1 ② 1.5
19. (14 分,每空 2分)
(1) ① CH4(g)+CO2(g)=C(ads)+2H2(g)+CO2(g) 或 CH4(g)=C(ads)+2H2(g) (没写状态不扣分) ② d
(2)AD
C(H34)(gC)H 2C*+OO2H(g*) 2CO*(+g)H 2 +2HC*2H(或g4 ()gC)H 2C*+OO2H(g*) 2CO*(+g)3/ 2H2H2 +2 (*g)
(4)①c 随温度升高,反应Ⅰ平衡向右移动 CO的选择性增大;反应Ⅱ向左移动,CO2的选择性减小且 CO
和 CO2的选择性加和等于 100%,所以 c代表 CO的选择性或者升高温度对反应Ⅰ影响大于反应Ⅲ,反应Ⅰ向左
1.89
移动 CO的选择性增大;反应Ⅲ向右移动,CO2的选择性减小,所以 c代表 CO的选择性 ② × 100%5.2
1
{#{QQABaYal4wiwkoQACB7bQUVCCEmQkIETJaoOAQAOuAwjQBNIBAA=}#}
同课章节目录
