浙江省杭州市夏衍中学2015-2016学年高二下学期期中考试化学试题(走班)
文档属性
| 名称 | 浙江省杭州市夏衍中学2015-2016学年高二下学期期中考试化学试题(走班) |  | |
| 格式 | zip | ||
| 文件大小 | 778.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-22 14:33:38 | ||
图片预览



文档简介
2016年4月杭州市夏衍中学期中考试
高二化学(走班卷)
相对原子质量:H
1
C
12
N
( http: / / www.21cnjy.com )14
O
16
Na
23
Mg
24
Al
27
Si
28
S
32
Cl
35.5
Fe
56
Cu
64
Ba
137
选择题部分
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.下列物质中没有酸性的是
A.Al2O3
B.H2SO4
C.KClO3
D.NaHSO4
2.下列仪器中不能发生化学反应的是
A.
B.
C.
D.
3.非金属性最强的元素是
A.F
B.C
C.S
D.O
4.NH4H+H2O=NH3·H2O+H2的反应类型是
A.复分解反应
B.分解反应
C.氧化还原反应
D.置换反应
5.实验室有两瓶失去标签的溶液,其中一瓶是KHSO4溶液,另一瓶是KOH溶液。鉴别时,下列选用的试纸或试剂不正确的是
A.pH试纸
B.紫色石蕊试液
C.K2CO3固体
D.KCl溶液
6.下列物质的水溶液因水解呈酸性的是
A.KCl
B.NaHSO4
C.NaHCO3
D.AlCl3
7.下列各组中,互称为同素异形体的是
A.O2与O3
B.35Cl与37Cl
C.CH3CHO与CH2—CH2
D.CH4与C2H6
8.下列关于硫酸铜溶液和氢氧化铁胶体的说法中,正确的是
A.两者都具有丁达尔效应
B.分散质的粒子直径均在1~100nm之间
C.加烧碱溶液都会沉淀
D.前者是混合物,后者是纯净物
9.下列化学用语表达错误的是
A.环己烷的实验式:CH2
B.四氯化碳分子的球棍模型:
C.HCl的电子式:
D.氟原子的结构示意图:
10.下列说法正确的是
A.煤、石油、沼气均为化石燃料,它们属于不可再生资源
B.太阳能电池是最成功的原电池
C.氢气的燃烧产物是水,不会污染环境,电解水制氢气宜推广应用
D.地沟油加工为柴油属于生物质能
11.下列物质的制备,不符合工业生产实际的是
A.工业上用电解熔融氯化镁制镁蒸汽
B.工业上用钠和熔融氯化钾反应制取钾(850℃)
C.工业上用碳酸钠制取碳酸氢钠
D.工业上炼铁时,常用石灰石除去铁矿石中的SiO2
在一定温度下,向1
L密闭容器中加入1
mol
HI(g),发生反应2HI(g)H2(g)+I2(g),
2s
时生成0.1
mol
H2,则表示该时段的化学反应速率正确的是
A.
v(HI)=0.8
mol·Lˉ1·sˉ1
B.v(I2)=0.2
mol·Lˉ1·sˉ1
C.
v(HI)=0.1
mol·Lˉ1·minˉ1
D.v(H2)=0.05
mol·Lˉ1·sˉ1
13.下列说法不正确的是
A.利用溴单质的氧化性可以把碘离子转化为碘单质
B.实验室常用NaOH溶液吸收多余的Cl2以避免污染
C.
Cl2不能使有色布条褪色,但Cl2具有氧化性
D.过量的红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl2
14.下列说法不正确的是
A.因为甲醇分子中不含有碳碳双键,所以甲醇不能使酸性高锰酸钾溶液褪色
B.甲苯不使溴水褪色,但甲苯和溴可以发生加成反应
C.乙烯在一定条件下与氧气反应生成乙醛,乙烯发生了氧化反应
D.蛋氨酸分子中含有羧基(-COOH)和氨基(-NH2)
15.下列说法正确的是
A.氯化铁的升华过程中,只需克服分子间作用力
B.NH4Br属于离子晶体,该物质中只存在离子键
C.在N2、CO2和SiC物质中,都存在共价键,它们都是由分子构成
D.金刚石和足球烯(C60)均为原子晶体
16.锌铜原电池装置如图所示,其中阳离子交
( http: / / www.21cnjy.com )换膜只允许阳离子和水分子通过,下列有关叙述正确的是
A.铜电极上发生反应Cu-2e-=Cu2+
B.工作一段时间后,乙池的c(SO42-
)减小
C.电流从铜极经过导线移向锌极
D.电池工作一段时间后,甲池的c(Zn2+
)增加
17.关于常温下pH=12的氨水和氢氧化钠溶液,下列说法正确的是
A.氨水溶液的浓度等于氢氧化钠溶液
B.NH3·H2O的电离方程式:NH3·H2O=NH4++OH
ˉ
C.c(NH3·H2O)+c(NH4+)=0.01
mol·Lˉ1
D.往两溶液中加入盐酸恰好中和,消耗盐酸多的溶液pH值小
18.下列离子方程式正确的是
A.将氯气通入氢氧化钡溶液中:Cl2+2
OH-
=H2O
+Cl-+ClO-
B.贝壳溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
C.铁与FeCl3溶液反应:Fe+Fe3+=2Fe2+
D.硫酸溶液与氢氧化钡溶液混合:Ba2++
OH
-
+H+
+
SO42-=BaSO4↓+
H2O
19.下列有关金属的说法中,正确的是
A.常温下,钠长期暴露在空气中生成白色的氧化钠固体
B.铁能与氯气发生反应,故不能用铁制容器贮存氯气
C.铜能与氯化铁溶液发生置换反应,该反应可以用于印刷电路板的制作
D.燃着的镁条伸入盛满氮气的集气瓶中能继续燃烧
20.已知:2CO(g)+O2(g)=2CO2(g)
ΔH=-565.2
kJ·molˉ1,下列说法不正确的是
A.CO(g)+O2(g)=CO2(g)
ΔH=-282.6
kJ·molˉ1
B.2mol
CO(g)与1mol
O2(g)反应生成2mol
CO2(s)放出热量小于565.2
kJ
C.相同条件下,2mol
CO(g)和1mol
O2(g)的总能量大于2mol
CO2(g)的总能量
D.拆开2mol
CO和1mol
O2的化学键所需总能量低于形成2mol
CO2化学键所放出总能量
21.下列说法不正确的是
A.1mol葡萄糖在酒化酶作用下水解生成2mol乙醇和2mol二氧化碳
B.在一定条件下CO和氢气作用得到液体燃料的过程是煤的液化途径之一
C.石油的重整可以提高汽油的质量和芳烃的产量
D.往蛋白质溶液中加入饱和硫酸钠溶液,产生的沉淀再加水又可溶解
22.设NA为阿伏伽德罗常数的值,下列说法不正确的是
A.常温下,分子数为NA的CO和C2H4混合气体的质量为28g
B.标准状况下,20g重水(D2O)中含有的中子数为10NA
C.用MnO2与浓盐酸制取Cl2时,每生成0.5mol
Cl2则转移电子数为NA
D.0.1
L
3.0
mol·L-1的NH4NO3溶液中含有NH的数目为0.3NA
23.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y所形成的一种单质有毒且易自燃。下列判断不正确的是
A.最高正化合价:XB.原子半径:W<
Y
C.气态氢化物的热稳定性:YD.最高价氧化物对应水化物的酸性:X<
Y24.下列说法正确的是
A.配制一定物质的量浓度的溶液,向量筒加水至液面离刻度线1~2
cm时,改用胶头滴管定容
B.向某溶液中先加入Ba(NO3)2溶液,再加入足量的盐酸,产生白色沉淀,则该溶液中一定含有SO42-
C.将油脂与氢氧化钠溶液混合充分反应后,再加入热的饱和食盐水,析出的肥皂浮在上层
D.分液操作时,将上层液体先从上口倒出,然后关闭旋塞,将下层液体放出。
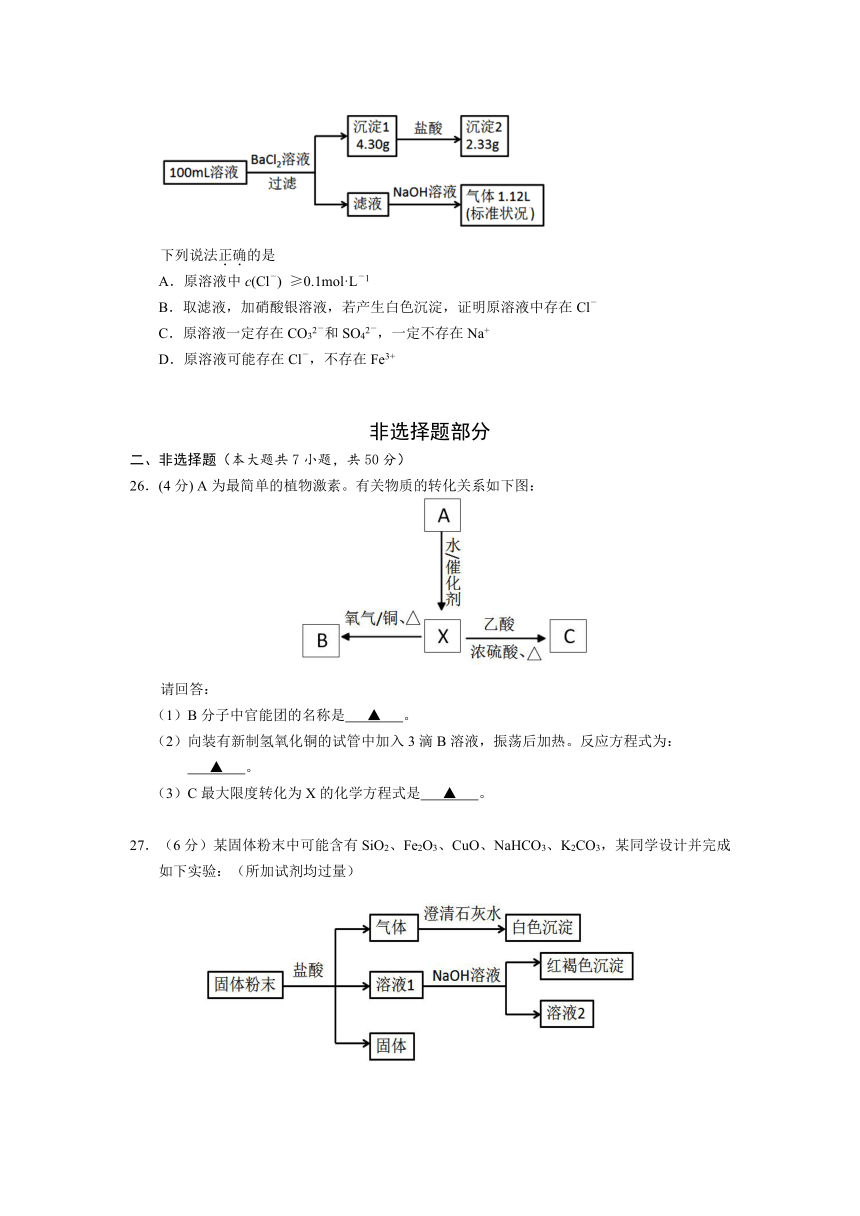
25.某100mL溶液可能含有Na+、NH
( http: / / www.21cnjy.com )4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)
( http: / / www.21cnjy.com )
下列说法正确的是
A.原溶液中c(Cl-)
≥0.1mol·L-1
B.取滤液,加硝酸银溶液,若产生白色沉淀,证明原溶液中存在Cl-
C.原溶液一定存在CO32-和SO42-,一定不存在Na+
D.原溶液可能存在Cl-,不存在Fe3+
非选择题部分
二、非选择题(本大题共7小题,共50分)
26.(4分)
A为最简单的植物激素。有关物质的转化关系如下图:
( http: / / www.21cnjy.com )
请回答:
(1)B分子中官能团的名称是
▲
。
(2)向装有新制氢氧化铜的试管中加入3滴B溶液,振荡后加热。反应方程式为:
▲
。
(3)C最大限度转化为X的化学方程式是
▲
。
27.(6分)某固体粉末中可能含有SiO2、Fe2O3、CuO、NaHCO3、K2CO3,某同学设计并完成如下实验:(所加试剂均过量)
已知:蘸取少量溶液2在酒精灯上灼烧,透过蓝色钴玻璃观察火焰不呈紫色。
请回答:
红褐色沉淀是
▲
(填化学式)。
(2)生成白色沉淀的离子方程式为
▲
。
(3)根据实验现象,
固体粉末中一定存在的组分是
▲
(填化学式)。
28.(6分)右图为浓硫酸与铜片反应的装置。
请回答:
(1)浓硫酸与铜片反应的方程式为
▲
。
(2)反应过程中,甲中的现象是
▲
。
(3)下列说法中,不正确的是
▲
。
A.该反应中浓硫酸表现酸性、氧化性、吸水性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.含0.02mol溶质的浓硫酸与足量的铜片反应,能收集到224mL的SO2(标准状况)
D.反应一段时间后,将水缓慢倒入试管甲中,溶液显蓝色
29.(4分)取100mL
( http: / / www.21cnjy.com )等物质的量浓度的硝酸和硫酸混合溶液,当加入200mL
1.5
mol·L-1的Ba(OH)2溶液时,溶液显中性。请计算:
(1)原混合液中H+的物质的量浓度为
▲
mol·L-1。
(2)当原混合液中加入0.5molCu,最终剩余铜的质量为
▲
g。
30.【加试题】(10分)室温下向10
mL
0.1
mol·L-1
NaOH溶液中逐滴加入0.1
mol·L-1的一元酸HA,溶
液pH的变化曲线如图所示。
(1)酸碱中和滴定时,用到的仪器有酸式滴定管
、碱式滴定管、铁架台(带蝴蝶夹)、
▲。
(2)a点(横坐标为10)所示溶液中,
( http: / / www.21cnjy.com )溶质是
▲
,溶液中c(Na+)、c(A-)、c(H+)、c(OH-)从大到小的顺序为
▲
,其中c(Na+)
▲
c(A-)+c(HA)(填“>”“<”或“=”)
(3)c点所示溶液中,c(Na+)
▲
c(A-)(填“>”“<”或“=”)
(4)b点所示溶液中,c(A-)
▲
c(HA)(填“>”“<”或“=”)
(5)a、b、c点所示溶液中,水的电离程度最大的是
▲
。
(6)以下滴定操作会导致V(HA)偏大的是
▲。
A、滴定管滴定前有气
( http: / / www.21cnjy.com )泡,滴定后气泡消失
B、锥形瓶洗涤后没有干燥
C、滴定时锥形瓶中有液体溅出
D、最后一滴HA溶液附在锥形瓶内壁上未冲下
E、滴定开始前读数时平视,滴定终点,读数时俯视
31.【加试题】(10分)二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:
2H2(g)+CO(g)
CH3OH(g)
ΔH=
—90.0
kJ·mol-1
①
2CH3OH(g)
CH3OCH3(g)+H2O(g)
ΔH=
—24.5
kJ·mol-1
②
CO(g)+H2O(g)
CO2(g)+H2(g)
ΔH=
—41.1
kJ·mol-1
③
(1)下列说法正确的是(
)
A.反应①的ΔS<0、ΔH<0,所以能在较低温度下自发进行。
B.反应③的H2O与CO的生成速率之比为1∶1时,表示该反应已经达到平衡状态
C.反应②属于加成反应
(2)反应①合成的甲醇在工业上可以用作燃料电池,请写出甲醇燃料电池(KOH溶液)负极电极反应式
▲
。
(3)当合成气中CO与H2的物
( http: / / www.21cnjy.com )质的量之比恒定时,温度、压强对CO转化率影响如图1所示,图1中A点的v(逆)
▲
B点的v(正)(填“>”、“<”或“=”),说明理由
▲
。
(4)一定温度下,密闭容器中发生反应③,
( http: / / www.21cnjy.com )该反应的平衡常数表达式k=
▲
;水蒸气的转化率与n(H2O)∕n(CO)的关系如图2,计算该温度下反应③的平衡常数K=
▲
。
32.【加试题】(10分)已知(注:R,R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
试回答
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性______________________b.能发生水解反应______________________
(2)A分子中的官能团是_____________,D的结构简式是_____________。
(3)C→D的反应类型是___________,E→F的反应类型是___________
a.氧化反应
b.还原反应
c.加成反应
d.取代反应
(4)写出化学方程式:A→B____________________________________________。
(5)写出E生成高聚物的化学方程式:____________________________________________。
(6)C的同分异构体Cl与
( http: / / www.21cnjy.com )C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式:______________________________
2016年4月杭州市夏衍中学期中考试
高二化学参考答案及评分标准
一、选择题(本大题共25小题,每小题2分,共50分)
题目
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
C网]
A
A
C
D
D
A
C
B
D
C
D
D
题目
14
15
16
17
18
19
20
21
22
23
24
25
/
答案
A
A
C
D
A
D
B
A
D
A
C
A
/
二、非选择题
26.(共4分)
(1)醛基
(1分)
(2)
(2分)
(3)CH3COOCH2CH3+NaOH====
CH3
COONa+CH3CH2OH
(1分)
27.(6分)
(1)Fe(OH)3
(2分)
(2)Ca2++2OH—
+
CO2=
CaCO3↓
+H2O
(2分)
(3)
SiO2、Fe2O3、NaHCO3
(写对二种给1分,写错一种不给分)(2分)
28.(6分)
(1)Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
(2分)
(2)产生无色气泡,铜片表面变黑,逐渐溶解;试管底部出现白色固体。
(2分)
(3)CD
(2分)
29.(4分)
(1)6.0
(2分)
(2)17.6
(2分)
30.(10分)
(1)锥形瓶(1分)(2)NaA(1分)
c(Na+)>c(A-)>c(OH-)>c(H+)(2分)=
(1分)
(3)=
(1分)
(4)>(1分)
(5)a
(1分)
(6)AD(2分,选对1个得1分,选错不得分)
31.(10分)每空2分
(1)A
(2)CH3OH+8OH—
–6e—
==
CO32-+6H2O
(3)<
B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率(说明:只说温度、或压强得1分)
(4)c(CO2)c(H2)/c(CO)c(H2O)
1
(10分)
((1)a、CH3CH2CH2COOH
b、CH3CH2COOCH3
(2)羟基、醛基
CH3COCH2COOH
(3)a;
b、c
(4)CH3CHOHCH2CHO
→
CH3CH=CHCHO+H2O
(5)
nCH3CH=CHCH2OH
→
[-CH-CH]n
(6)CH3CH2CH
O
.
c
7
高二化学(走班卷)
相对原子质量:H
1
C
12
N
( http: / / www.21cnjy.com )14
O
16
Na
23
Mg
24
Al
27
Si
28
S
32
Cl
35.5
Fe
56
Cu
64
Ba
137
选择题部分
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.下列物质中没有酸性的是
A.Al2O3
B.H2SO4
C.KClO3
D.NaHSO4
2.下列仪器中不能发生化学反应的是
A.
B.
C.
D.
3.非金属性最强的元素是
A.F
B.C
C.S
D.O
4.NH4H+H2O=NH3·H2O+H2的反应类型是
A.复分解反应
B.分解反应
C.氧化还原反应
D.置换反应
5.实验室有两瓶失去标签的溶液,其中一瓶是KHSO4溶液,另一瓶是KOH溶液。鉴别时,下列选用的试纸或试剂不正确的是
A.pH试纸
B.紫色石蕊试液
C.K2CO3固体
D.KCl溶液
6.下列物质的水溶液因水解呈酸性的是
A.KCl
B.NaHSO4
C.NaHCO3
D.AlCl3
7.下列各组中,互称为同素异形体的是
A.O2与O3
B.35Cl与37Cl
C.CH3CHO与CH2—CH2
D.CH4与C2H6
8.下列关于硫酸铜溶液和氢氧化铁胶体的说法中,正确的是
A.两者都具有丁达尔效应
B.分散质的粒子直径均在1~100nm之间
C.加烧碱溶液都会沉淀
D.前者是混合物,后者是纯净物
9.下列化学用语表达错误的是
A.环己烷的实验式:CH2
B.四氯化碳分子的球棍模型:
C.HCl的电子式:
D.氟原子的结构示意图:
10.下列说法正确的是
A.煤、石油、沼气均为化石燃料,它们属于不可再生资源
B.太阳能电池是最成功的原电池
C.氢气的燃烧产物是水,不会污染环境,电解水制氢气宜推广应用
D.地沟油加工为柴油属于生物质能
11.下列物质的制备,不符合工业生产实际的是
A.工业上用电解熔融氯化镁制镁蒸汽
B.工业上用钠和熔融氯化钾反应制取钾(850℃)
C.工业上用碳酸钠制取碳酸氢钠
D.工业上炼铁时,常用石灰石除去铁矿石中的SiO2
在一定温度下,向1
L密闭容器中加入1
mol
HI(g),发生反应2HI(g)H2(g)+I2(g),
2s
时生成0.1
mol
H2,则表示该时段的化学反应速率正确的是
A.
v(HI)=0.8
mol·Lˉ1·sˉ1
B.v(I2)=0.2
mol·Lˉ1·sˉ1
C.
v(HI)=0.1
mol·Lˉ1·minˉ1
D.v(H2)=0.05
mol·Lˉ1·sˉ1
13.下列说法不正确的是
A.利用溴单质的氧化性可以把碘离子转化为碘单质
B.实验室常用NaOH溶液吸收多余的Cl2以避免污染
C.
Cl2不能使有色布条褪色,但Cl2具有氧化性
D.过量的红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl2
14.下列说法不正确的是
A.因为甲醇分子中不含有碳碳双键,所以甲醇不能使酸性高锰酸钾溶液褪色
B.甲苯不使溴水褪色,但甲苯和溴可以发生加成反应
C.乙烯在一定条件下与氧气反应生成乙醛,乙烯发生了氧化反应
D.蛋氨酸分子中含有羧基(-COOH)和氨基(-NH2)
15.下列说法正确的是
A.氯化铁的升华过程中,只需克服分子间作用力
B.NH4Br属于离子晶体,该物质中只存在离子键
C.在N2、CO2和SiC物质中,都存在共价键,它们都是由分子构成
D.金刚石和足球烯(C60)均为原子晶体
16.锌铜原电池装置如图所示,其中阳离子交
( http: / / www.21cnjy.com )换膜只允许阳离子和水分子通过,下列有关叙述正确的是
A.铜电极上发生反应Cu-2e-=Cu2+
B.工作一段时间后,乙池的c(SO42-
)减小
C.电流从铜极经过导线移向锌极
D.电池工作一段时间后,甲池的c(Zn2+
)增加
17.关于常温下pH=12的氨水和氢氧化钠溶液,下列说法正确的是
A.氨水溶液的浓度等于氢氧化钠溶液
B.NH3·H2O的电离方程式:NH3·H2O=NH4++OH
ˉ
C.c(NH3·H2O)+c(NH4+)=0.01
mol·Lˉ1
D.往两溶液中加入盐酸恰好中和,消耗盐酸多的溶液pH值小
18.下列离子方程式正确的是
A.将氯气通入氢氧化钡溶液中:Cl2+2
OH-
=H2O
+Cl-+ClO-
B.贝壳溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
C.铁与FeCl3溶液反应:Fe+Fe3+=2Fe2+
D.硫酸溶液与氢氧化钡溶液混合:Ba2++
OH
-
+H+
+
SO42-=BaSO4↓+
H2O
19.下列有关金属的说法中,正确的是
A.常温下,钠长期暴露在空气中生成白色的氧化钠固体
B.铁能与氯气发生反应,故不能用铁制容器贮存氯气
C.铜能与氯化铁溶液发生置换反应,该反应可以用于印刷电路板的制作
D.燃着的镁条伸入盛满氮气的集气瓶中能继续燃烧
20.已知:2CO(g)+O2(g)=2CO2(g)
ΔH=-565.2
kJ·molˉ1,下列说法不正确的是
A.CO(g)+O2(g)=CO2(g)
ΔH=-282.6
kJ·molˉ1
B.2mol
CO(g)与1mol
O2(g)反应生成2mol
CO2(s)放出热量小于565.2
kJ
C.相同条件下,2mol
CO(g)和1mol
O2(g)的总能量大于2mol
CO2(g)的总能量
D.拆开2mol
CO和1mol
O2的化学键所需总能量低于形成2mol
CO2化学键所放出总能量
21.下列说法不正确的是
A.1mol葡萄糖在酒化酶作用下水解生成2mol乙醇和2mol二氧化碳
B.在一定条件下CO和氢气作用得到液体燃料的过程是煤的液化途径之一
C.石油的重整可以提高汽油的质量和芳烃的产量
D.往蛋白质溶液中加入饱和硫酸钠溶液,产生的沉淀再加水又可溶解
22.设NA为阿伏伽德罗常数的值,下列说法不正确的是
A.常温下,分子数为NA的CO和C2H4混合气体的质量为28g
B.标准状况下,20g重水(D2O)中含有的中子数为10NA
C.用MnO2与浓盐酸制取Cl2时,每生成0.5mol
Cl2则转移电子数为NA
D.0.1
L
3.0
mol·L-1的NH4NO3溶液中含有NH的数目为0.3NA
23.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y所形成的一种单质有毒且易自燃。下列判断不正确的是
A.最高正化合价:X
Y
C.气态氢化物的热稳定性:Y
Y
A.配制一定物质的量浓度的溶液,向量筒加水至液面离刻度线1~2
cm时,改用胶头滴管定容
B.向某溶液中先加入Ba(NO3)2溶液,再加入足量的盐酸,产生白色沉淀,则该溶液中一定含有SO42-
C.将油脂与氢氧化钠溶液混合充分反应后,再加入热的饱和食盐水,析出的肥皂浮在上层
D.分液操作时,将上层液体先从上口倒出,然后关闭旋塞,将下层液体放出。
25.某100mL溶液可能含有Na+、NH
( http: / / www.21cnjy.com )4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)
( http: / / www.21cnjy.com )
下列说法正确的是
A.原溶液中c(Cl-)
≥0.1mol·L-1
B.取滤液,加硝酸银溶液,若产生白色沉淀,证明原溶液中存在Cl-
C.原溶液一定存在CO32-和SO42-,一定不存在Na+
D.原溶液可能存在Cl-,不存在Fe3+
非选择题部分
二、非选择题(本大题共7小题,共50分)
26.(4分)
A为最简单的植物激素。有关物质的转化关系如下图:
( http: / / www.21cnjy.com )
请回答:
(1)B分子中官能团的名称是
▲
。
(2)向装有新制氢氧化铜的试管中加入3滴B溶液,振荡后加热。反应方程式为:
▲
。
(3)C最大限度转化为X的化学方程式是
▲
。
27.(6分)某固体粉末中可能含有SiO2、Fe2O3、CuO、NaHCO3、K2CO3,某同学设计并完成如下实验:(所加试剂均过量)
已知:蘸取少量溶液2在酒精灯上灼烧,透过蓝色钴玻璃观察火焰不呈紫色。
请回答:
红褐色沉淀是
▲
(填化学式)。
(2)生成白色沉淀的离子方程式为
▲
。
(3)根据实验现象,
固体粉末中一定存在的组分是
▲
(填化学式)。
28.(6分)右图为浓硫酸与铜片反应的装置。
请回答:
(1)浓硫酸与铜片反应的方程式为
▲
。
(2)反应过程中,甲中的现象是
▲
。
(3)下列说法中,不正确的是
▲
。
A.该反应中浓硫酸表现酸性、氧化性、吸水性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.含0.02mol溶质的浓硫酸与足量的铜片反应,能收集到224mL的SO2(标准状况)
D.反应一段时间后,将水缓慢倒入试管甲中,溶液显蓝色
29.(4分)取100mL
( http: / / www.21cnjy.com )等物质的量浓度的硝酸和硫酸混合溶液,当加入200mL
1.5
mol·L-1的Ba(OH)2溶液时,溶液显中性。请计算:
(1)原混合液中H+的物质的量浓度为
▲
mol·L-1。
(2)当原混合液中加入0.5molCu,最终剩余铜的质量为
▲
g。
30.【加试题】(10分)室温下向10
mL
0.1
mol·L-1
NaOH溶液中逐滴加入0.1
mol·L-1的一元酸HA,溶
液pH的变化曲线如图所示。
(1)酸碱中和滴定时,用到的仪器有酸式滴定管
、碱式滴定管、铁架台(带蝴蝶夹)、
▲。
(2)a点(横坐标为10)所示溶液中,
( http: / / www.21cnjy.com )溶质是
▲
,溶液中c(Na+)、c(A-)、c(H+)、c(OH-)从大到小的顺序为
▲
,其中c(Na+)
▲
c(A-)+c(HA)(填“>”“<”或“=”)
(3)c点所示溶液中,c(Na+)
▲
c(A-)(填“>”“<”或“=”)
(4)b点所示溶液中,c(A-)
▲
c(HA)(填“>”“<”或“=”)
(5)a、b、c点所示溶液中,水的电离程度最大的是
▲
。
(6)以下滴定操作会导致V(HA)偏大的是
▲。
A、滴定管滴定前有气
( http: / / www.21cnjy.com )泡,滴定后气泡消失
B、锥形瓶洗涤后没有干燥
C、滴定时锥形瓶中有液体溅出
D、最后一滴HA溶液附在锥形瓶内壁上未冲下
E、滴定开始前读数时平视,滴定终点,读数时俯视
31.【加试题】(10分)二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:
2H2(g)+CO(g)
CH3OH(g)
ΔH=
—90.0
kJ·mol-1
①
2CH3OH(g)
CH3OCH3(g)+H2O(g)
ΔH=
—24.5
kJ·mol-1
②
CO(g)+H2O(g)
CO2(g)+H2(g)
ΔH=
—41.1
kJ·mol-1
③
(1)下列说法正确的是(
)
A.反应①的ΔS<0、ΔH<0,所以能在较低温度下自发进行。
B.反应③的H2O与CO的生成速率之比为1∶1时,表示该反应已经达到平衡状态
C.反应②属于加成反应
(2)反应①合成的甲醇在工业上可以用作燃料电池,请写出甲醇燃料电池(KOH溶液)负极电极反应式
▲
。
(3)当合成气中CO与H2的物
( http: / / www.21cnjy.com )质的量之比恒定时,温度、压强对CO转化率影响如图1所示,图1中A点的v(逆)
▲
B点的v(正)(填“>”、“<”或“=”),说明理由
▲
。
(4)一定温度下,密闭容器中发生反应③,
( http: / / www.21cnjy.com )该反应的平衡常数表达式k=
▲
;水蒸气的转化率与n(H2O)∕n(CO)的关系如图2,计算该温度下反应③的平衡常数K=
▲
。
32.【加试题】(10分)已知(注:R,R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
试回答
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性______________________b.能发生水解反应______________________
(2)A分子中的官能团是_____________,D的结构简式是_____________。
(3)C→D的反应类型是___________,E→F的反应类型是___________
a.氧化反应
b.还原反应
c.加成反应
d.取代反应
(4)写出化学方程式:A→B____________________________________________。
(5)写出E生成高聚物的化学方程式:____________________________________________。
(6)C的同分异构体Cl与
( http: / / www.21cnjy.com )C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式:______________________________
2016年4月杭州市夏衍中学期中考试
高二化学参考答案及评分标准
一、选择题(本大题共25小题,每小题2分,共50分)
题目
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
C网]
A
A
C
D
D
A
C
B
D
C
D
D
题目
14
15
16
17
18
19
20
21
22
23
24
25
/
答案
A
A
C
D
A
D
B
A
D
A
C
A
/
二、非选择题
26.(共4分)
(1)醛基
(1分)
(2)
(2分)
(3)CH3COOCH2CH3+NaOH====
CH3
COONa+CH3CH2OH
(1分)
27.(6分)
(1)Fe(OH)3
(2分)
(2)Ca2++2OH—
+
CO2=
CaCO3↓
+H2O
(2分)
(3)
SiO2、Fe2O3、NaHCO3
(写对二种给1分,写错一种不给分)(2分)
28.(6分)
(1)Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
(2分)
(2)产生无色气泡,铜片表面变黑,逐渐溶解;试管底部出现白色固体。
(2分)
(3)CD
(2分)
29.(4分)
(1)6.0
(2分)
(2)17.6
(2分)
30.(10分)
(1)锥形瓶(1分)(2)NaA(1分)
c(Na+)>c(A-)>c(OH-)>c(H+)(2分)=
(1分)
(3)=
(1分)
(4)>(1分)
(5)a
(1分)
(6)AD(2分,选对1个得1分,选错不得分)
31.(10分)每空2分
(1)A
(2)CH3OH+8OH—
–6e—
==
CO32-+6H2O
(3)<
B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率(说明:只说温度、或压强得1分)
(4)c(CO2)c(H2)/c(CO)c(H2O)
1
(10分)
((1)a、CH3CH2CH2COOH
b、CH3CH2COOCH3
(2)羟基、醛基
CH3COCH2COOH
(3)a;
b、c
(4)CH3CHOHCH2CHO
→
CH3CH=CHCHO+H2O
(5)
nCH3CH=CHCH2OH
→
[-CH-CH]n
(6)CH3CH2CH
O
.
c
7
同课章节目录
