【期末押题卷】北京市2024-2025学年高一下学期化学期末模拟预测卷一(含解析)
文档属性
| 名称 | 【期末押题卷】北京市2024-2025学年高一下学期化学期末模拟预测卷一(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-16 09:03:06 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
北京市2024-2025学年高一下学期化学期末模拟预测卷
一.选择题(共15小题)
1.(2024秋 丰台区期末)工业上制备硝酸的主要流程如图所示。下列说法不正确的是( )
A.氧化炉中发生的化学反应是
B.物质X是H2O
C.上述流程中,理论上用N2合成1mol HNO3,至少需要2.5mol O2
D.吸收塔中为提高氮原子的利用率,可通入过量空气和循环利用尾气中NO
2.(2024秋 房山区期末)物质类别和元素价态是研究物质性质的两个重要角度。图为含氮物质的“价—类”二维图的部分信息。下列说法不正确的是( )
A.从N2→X的转化是人工固氮的重要方法
B.Y的化学式为N2O5
C.从NO2→HNO3,必需加入氧化剂
D.使用HNO3和X制备硝酸铵氮肥时,氮元素的化合价没有发生变化
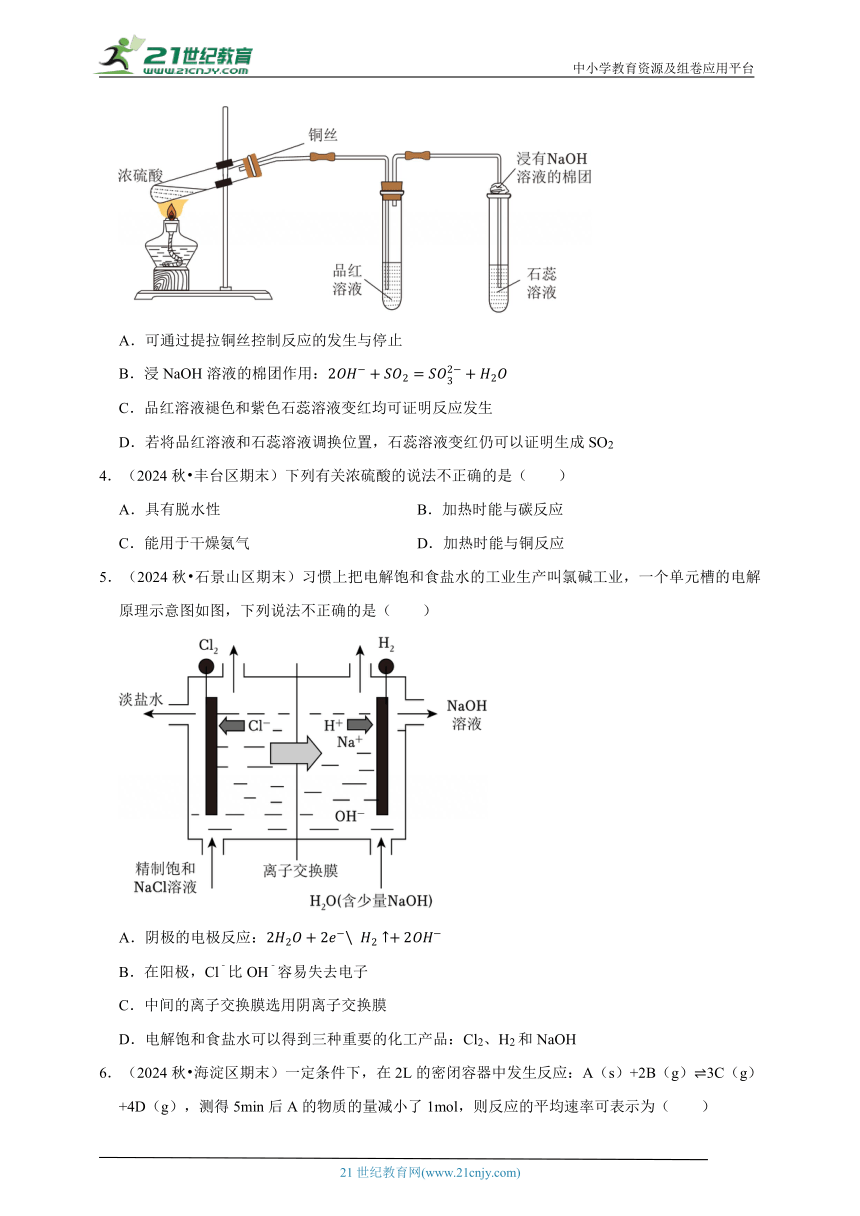
3.(2024秋 海淀区校级期末)浓硫酸与铜反应的装置如图所示,下列说法不正确的是( )
A.可通过提拉铜丝控制反应的发生与停止
B.浸NaOH溶液的棉团作用:
C.品红溶液褪色和紫色石蕊溶液变红均可证明反应发生
D.若将品红溶液和石蕊溶液调换位置,石蕊溶液变红仍可以证明生成SO2
4.(2024秋 丰台区期末)下列有关浓硫酸的说法不正确的是( )
A.具有脱水性 B.加热时能与碳反应
C.能用于干燥氨气 D.加热时能与铜反应
5.(2024秋 石景山区期末)习惯上把电解饱和食盐水的工业生产叫氯碱工业,一个单元槽的电解原理示意图如图,下列说法不正确的是( )
A.阴极的电极反应:
B.在阳极,Cl﹣比OH﹣容易失去电子
C.中间的离子交换膜选用阴离子交换膜
D.电解饱和食盐水可以得到三种重要的化工产品:Cl2、H2和NaOH
6.(2024秋 海淀区期末)一定条件下,在2L的密闭容器中发生反应:A(s)+2B(g) 3C(g)+4D(g),测得5min后A的物质的量减小了1mol,则反应的平均速率可表示为( )
A.v(A)=0.1mol L﹣1 s﹣1
B.v(B)=0.1mol L﹣1 min﹣1
C.v(C)=0.005mol L﹣1 s﹣1
D.v(D)=0.2mol L﹣1 min﹣1
7.(2024秋 海淀区期末)已知氢气燃烧反应的能量变化如图。
下列说法不正确的是( )
A.H—H键的键能小于O=O键的键能
B.破坏2mol H2和1mol O2的化学键所需的能量小于2mol H2O中的化学键所释放的能量
C.2H2(g)+O2(g)═2H2O(l)ΔH=﹣480kJ mol﹣1
D.利用该反应通过一定的装置可实现化学能到电能的转化
8.(2024秋 昌平区期末)一定温度下的密闭容器中,发生可逆反应2NO(g)+O2(g) 2NO2(g),下列情况不能说明该反应达到平衡状态的是( )
A.容器内气体颜色不再变化
B.浓度商等于化学平衡常数
C.容器内气体的浓度c(NO):c(O2):c(NO2)=2:1:2
D.容器内的压强不再变化
9.(2024秋 昌平区期末)已知丙酮()碘化反应为:。实验测得该反应的速率可表示为:v=kc(丙酮)c(H+),其中k为反应速率常数。下列说法不正确的是( )
A.其他条件不变,增加丙酮浓度,反应速率增大
B.其他条件不变,增大I2的浓度,反应速率增大
C.其他条件不变,增大催化剂H+的浓度,反应速率增大
D.催化剂H+参与反应,降低反应活化能,增大反应速率
10.(2024秋 石景山区期末)下列说法错误的是( )
A.葡萄糖氧化生成CO2和H2O的反应是吸热反应
B.核酸是一种生物大分子
C.葡萄糖和果糖互为同分异构体
D.氨基酸是组成蛋白质的基本结构单位
11.(2024秋 昌平区期末)下列说法不正确的是( )
A.淀粉作为人类重要的能量来源,是由于它能发生水解产生葡萄糖供机体利用
B.纤维素能通过酯化反应得到醋酸纤维素,是由于纤维素分子中含有羟基
C.核糖核苷酸分子间脱水后聚合形成核糖核酸
D.石油经过分馏可得到煤油、柴油等,是利用了物质的溶解性差异
12.(2018秋 昌平区期末)糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述不正确的是( )
A.葡萄糖不具有还原性
B.淀粉是多糖,可在一定条件下水解
C.油脂属于酯类化合物
D.蛋白质最终能水解成氨基酸
13.(2024秋 石景山区期末)明朝宋应星所著的《天工开物》是世界上第一部关于农业和手工业生产的综合性“工艺百科全书”,其中介绍了锌的冶炼方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐(如图所示),泥封,“其底铺薪,发火煅红”,“冷定毁罐取出”。
已知:锌的熔点为419℃,沸点为907℃。
下列说法不正确的是( )
A.冷凝区中,锌由气态转化为液态,理论上该区温度控制在419~907℃
B.“冷定”后“毁罐”取锌的原因是防止Zn在较高的温度下被氧化成ZnO
C.反应区中,ZnCO3分解生成ZnO和CO2
D.反应区中,C与nO发生置换反应得到Zn,C被还原
14.(2023秋 西城区校级期末)利用“碳捕获与储存”技术可将工厂排放的CO2收集并储存,原理如图所示。
下列说法中,不正确的是( )
A.“碳捕获与储存”有助于缓解温室效应
B.过程Ⅰ中用NaOH溶液“捕获”排放的CO2
C.过程Ⅲ和过程Ⅳ的反应类型分别为分解反应和化合反应
D.上述过程中只有NaOH能够循环利用
15.(2023秋 昌平区校级期末)为除去粗盐水中含有的杂质、Ca2+和Mg2+,得到精制食盐,设计了如图实验流程
下列说法不正确的是( )
A.NaOH溶液的作用是除去Mg2+
B.步骤i、ii的顺序可以互换
C.滤液2中有四种离子:Ca2+、Na+、Cl﹣、OH﹣
D.步骤iv中发生的离子反应为:H++OH﹣=H2O、2H+=H2O+CO2↑
二.解答题(共4小题)
16.(2024秋 西城区期末)人工固氮对于农业生产有重要意义。
(1)工业合成氨。
①N2和H2合成NH3反应的化学方程式是 。
②下列措施中,既有利于提高合成氨反应限度又有利于增大其反应速率的是 。
a.升高温度
b.增大压强
c.使用催化剂
(2)中国科学家研究Cu—Mn合金催化剂电催化还原N2制NH3,装置如图1所示。
①阴极生成NH3其电极反应式是 。
②用相同的电解装置和试剂进行实验,证明NH3来自电催化还原N2,需排除以下可能:
ⅰ.环境和电解池中存在微量的NH3
ⅱ.Cu—Mn合金与N2、H2O直接反应生成NH3
下列实验和结果能同时排除ⅰ、ⅱ的是 。
资料:自然界中的丰度:14N为99.6%,15N为0.4%。
a.用Ar代替N2进行实验,电解后未检测到NH3
b.用15N2代替N2进行实验,电解后仅检测到15NH3
c.不通电进行实验,未检测到NH3
③NH3的生成速率、NH3和H2的法拉第效率(FE)随阴极的电势变化如图2和图3所示。
资料:ⅰ.相同条件下,阴极的电势越低,电流越大。
ⅱ.某电极上产物B的FE(B)。
阴极的电势由﹣0.2V降到﹣0.3V时,NH3的生成速率增大。阴极的电势继续降低,NH3的生成速率反而减小。结合FE解释NH3的生成速率减小的原因: 。
(3)用滴定法测定溶液中的物质的量浓度的一种方法如下。
Ⅰ.取v1mL含的待测溶液。
Ⅱ.加入过量的V2mLc2mol L﹣1NaOH溶液。
Ⅲ.蒸馏,将蒸出的NH3用过量的V3mLc3mol L﹣1H2SO4溶液吸收。
Ⅳ.加入甲基橙指示剂,用c4mol L﹣1NaOH溶液滴定吸收液中过量的H2SO4消耗的NaOH溶液体积为V4mL,计算待测溶液中的物质的量浓度时用到的溶液体积: 和V4。
17.(2024秋 昌平区期末)某小组同学探究不同价态硫元素之间的相互转化。
可以选用的试剂有:①SO2水溶液②Na2SO3溶液③Na2S溶液④稀硫酸⑤浓硫酸⑥品红溶液⑦新制氯水⑧铜片
实验序号 预期的价态转化 选择的试剂(填入试剂编号) 实验现象
ⅰ +6→+4 ⑤⑧ 产生刺激性气味气体
ⅱ +4→0 ②③
ⅲ
①⑦ 黄绿色褪去
(1)实验ⅰ的化学方程式为 。设计实验证明实现了+6→+4的转化,实验操作及现象是 。
(2)结合实验ⅱ的实验目的,说明选择试剂③的理由是 。②③溶液混合后,无明显现象,加入稀硫酸后,产生淡黄色沉淀。该实验说明物质的氧化性强弱受 影响。产生淡黄色沉淀的离子方程式为 。
(3)实验ⅲ预期的价态转化为 。为验证Cl2被SO2还原为Cl﹣,甲同学向反应后的溶液中加入硝酸酸化的硝酸银溶液,观察是否产生白色沉淀。乙同学认为该方案不合理,理由是 。
18.(2024秋 朝阳区期末)以黄铁矿为原料制取硫酸的原理示意图如图。
(1)黄铁矿在通空气前需粉碎,其作用是 。
(2)反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1是制硫酸的关键步骤。使用V2O5作催化剂,涉及如下反应:
ⅰ.V2O5(s)+SO2(g) V2O4(s)+SO3(g)ΔH1=+24kJ mol﹣1
ⅱ._____+2SO3(g) _____ΔH2=_____kJ mol﹣1
ⅲ.2VOSO4(s)(g)ΔH3=+277kJ mol﹣1
①补全反应ⅱ的热化学方程式:
+2SO3(g) ΔH2= kJ mol﹣1
②下列说法不正确的是 (填序号)。
a.反应ⅰ和ⅱ均属于氧化还原反应
b.投入1mol V2O5,最多制得1mol SO3
c.使用V2O5能提高SO2的平衡转化率
(3)在体积可变的恒压密闭容器中投入8mol SO(g)11.7mol O2(g)和43.3mol N2(g),不同条件下发生反应Ⅱ。实验测得在0.1MPa、0.5MPa和5.0MPa压强下,SO2平衡转化率(α)随温度的变化如图所示。
①0.1MPa、550℃时SO2平衡转化率α= ,判断依据是 。
②工业上通常采用400~500℃和常压(0.1MPa)的条件,采用常压的原因是 。
③M点对应的平衡混合气体的体积为VL,计算该温度下反应Ⅱ的平衡常数 K= 。
(4)测定尾气中SO2的含量。用氨基磺酸铵和硫酸铵的混合溶液吸收aL尾气,将SO2转化为H2SO3,然后用淀粉作指示剂,用cmol L﹣1I2标准溶液进行滴定,消耗I2标准溶液vmL。则尾气中SO2的含量为 mg L﹣1。
已知:H2SO3+I2+H2O═H2SO4+2HI
19.(2023春 房山区期末)研究有机化合物中的典型代表物,对于有机合成的研究有重要意义。
(1)乙醇是醇类物质的典型代表物,乙醇分子结构中的各种化学键如图1所示:
①由乙醇制备乙烯的反应断键位置是 (填序号),该反应的类型属于 。
②乙醇氧化可转化为乙醛,该反应断键位置是 (填序号)。
(2)乙酸乙酯是酯类物质的典型代表物,广泛用于药物、染料、香料等工业。实验室用无水乙醇、冰醋酸和浓硫酸反应可制备乙酸乙酯,常用装置如图2所示。
①写出无水乙醇、冰醋酸和浓硫酸反应制备乙酸乙酯的化学方程式 。
②试管X中的试剂为 ,作用是 。
③为提高反应速率或限度,实验中采取的措施及对应理由不正确的是 (填字母)。
a.浓硫酸可做催化剂,提高化学反应速率
b.浓硫酸可做吸水剂,促进反应向生成乙酸乙酯的反应移动
c.已知该反应为放热反应,升高温度可同时提高化学反应速率和反应限度
(3)三种常见羧酸的pKa数值如下表(pKa数值越小,酸性越强)。乙酸中的﹣CH3具有推电子作用,使羧基中羟基的极性减小,从而难以电离出H+,故乙酸的酸性比甲酸的酸性弱。
羧酸 甲酸(HCOOH) 乙酸(CH3COOH) 三氯乙酸(CCl3COOH)
pKa 3.75 4.76 0.65
请比较乙酸与三氯乙酸的酸性强弱并解释原因 。
北京市2024-2025学年高一下学期化学期末模拟预测卷
参考答案与试题解析
一.选择题(共15小题)
1.(2024秋 丰台区期末)工业上制备硝酸的主要流程如图所示。下列说法不正确的是( )
A.氧化炉中发生的化学反应是
B.物质X是H2O
C.上述流程中,理论上用N2合成1mol HNO3,至少需要2.5mol O2
D.吸收塔中为提高氮原子的利用率,可通入过量空气和循环利用尾气中NO
【答案】C
【分析】氮气和氢气在合成塔中生成氨气,氨气在氧化炉中发生催化氧化生成一氧化氮和水,吸收塔中NO和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮。
【解答】解:A.氧化炉中NH3发生催化氧化生成NO和H2O,反应化学方程式是,故A正确;
B.NO2和水反应生成HNO3和NO,所以物质X是H2O,故B正确;
C.上述流程中,理论上用N2合成1mol 硝酸,N元素化合价由0升高为+5,O元素化合价由0降低为﹣2,根据得失电子守恒,至少需要1.25mol O2,故C错误;
D.吸收塔中为提高氮原子的利用率,可通入过量空气发生反应4NO+3O2+2H2O=4HNO3,还可以循环利用尾气中的NO,故D正确;
故选:C。
【点评】本题主要考查工业制取硝酸等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
2.(2024秋 房山区期末)物质类别和元素价态是研究物质性质的两个重要角度。图为含氮物质的“价—类”二维图的部分信息。下列说法不正确的是( )
A.从N2→X的转化是人工固氮的重要方法
B.Y的化学式为N2O5
C.从NO2→HNO3,必需加入氧化剂
D.使用HNO3和X制备硝酸铵氮肥时,氮元素的化合价没有发生变化
【答案】C
【分析】由图可知,X是NH3,Y是+5价氮的氧化物,Y是N2O5,从NO2→HNO3,发生的反应可以是:3NO2+H2O=2HNO3+NO,使用HNO3和NH3制备硝酸铵氮肥时,发生反应:HNO3+NH3=NH4NO3,据此解答。
【解答】解:A.的转化为工业合成氨,是人工固氮的重要方法,故A正确;
B.Y是+5价氮的氧化物,则Y的化学式为五氧化二氮,故B正确;
C.从NO2→HNO3,发生的反应可以是:3NO2+H2O=2HNO3+NO,该反应中二氧化氮既是氧化剂也是还原剂,不需要加入氧化剂,故C错误;
D.使用硝酸和氨气制备硝酸铵氮肥时,发生反应:HNO3+NH3=NH4NO3,氮元素的化合价没有发生变化,故D正确;
故选:C。
【点评】本题主要考查含氮物质的综合应用等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
3.(2024秋 海淀区校级期末)浓硫酸与铜反应的装置如图所示,下列说法不正确的是( )
A.可通过提拉铜丝控制反应的发生与停止
B.浸NaOH溶液的棉团作用:
C.品红溶液褪色和紫色石蕊溶液变红均可证明反应发生
D.若将品红溶液和石蕊溶液调换位置,石蕊溶液变红仍可以证明生成SO2
【答案】D
【分析】浓硫酸与铜反应生成硫酸铜、水和SO2,根据调节铜丝的高低可控制反应的开始和停止,由于SO2具有漂白性,因此将生成的SO2通入品红溶液中,品红溶液褪色,SO2为酸性氧化物,与水反应生成H2SO3,将SO2通入石蕊溶液中,石蕊溶液变红色,浸有NaOH溶液的棉团可吸收SO2。
【解答】解:A.浓硫酸与铜反应生成硫酸铜溶液和二氧化硫,根据调节铜丝的高低可控制反应的开始和停止,故A正确;
B.浸NaOH溶液的棉团可吸收二氧化硫,发生的离子方程式为,故B正确;
C.二氧化硫具有漂白性,可使品红溶液褪色,二氧化硫为酸性氧化物,与水反应生成H2SO3,将二氧化硫通入石蕊溶液中,石蕊溶液变红色,故均可证明发生了反应,故C正确;
D.若将品红溶液和石蕊溶液调换位置,若反应生成的SO3因溶于水生成了H2SO4而石蕊溶液变红,因此仅凭石蕊变红无法特定地证明生成了SO2,还需要结合其他方法才能证明生成SO2,故D错误;
故选:D。
【点评】本题主要考查浓硫酸的性质实验等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
4.(2024秋 丰台区期末)下列有关浓硫酸的说法不正确的是( )
A.具有脱水性 B.加热时能与碳反应
C.能用于干燥氨气 D.加热时能与铜反应
【答案】C
【分析】A.根据浓硫酸具有脱水性,进行分析;
B.根据浓硫酸加热时能与碳反应生成二氧化碳、二氧化硫与水,进行分析;
C.根据浓硫酸与氨气反应,进行分析;
D.根据浓硫酸加热时与铜反应生成硫酸铜、二氧化硫与水,进行分析。
【解答】解:A.浓H2SO4具有脱水性,例如浓硫酸能使蔗糖脱水、出现变黑现象,故A正确;
B.浓H2SO4加热时能与碳反应生成二氧化碳、二氧化硫与水,故B正确;
C.浓H2SO4与氨气反应,不能干燥NH3,故C错误;
D.浓H2SO4加热时与铜反应生成硫酸铜、二氧化硫与水,故D正确;
故选:C。
【点评】本题主要考查浓硫酸的特性等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
5.(2024秋 石景山区期末)习惯上把电解饱和食盐水的工业生产叫氯碱工业,一个单元槽的电解原理示意图如图,下列说法不正确的是( )
A.阴极的电极反应:
B.在阳极,Cl﹣比OH﹣容易失去电子
C.中间的离子交换膜选用阴离子交换膜
D.电解饱和食盐水可以得到三种重要的化工产品:Cl2、H2和NaOH
【答案】C
【分析】电解饱和食盐水时,左侧通入饱和食盐水,使用阳离子交换膜,由钠离子移动的方向可知,Na+穿过阳离子交换膜移向阴极室,左侧为阳极,接电源正极,阳极电极反应式为:2Cl﹣﹣2e﹣═Cl2↑,放出氢气的电极接电源负极,为电解池的阴极,阴极反应式为:2H2O﹣2e﹣═2OH﹣+H2↑,阴极产物为NaOH和H2,据此分析答题。
【解答】解:A.放出氢气的电极接电源负极,为电解池的阴极,阴极反应式为:2H2O﹣2e﹣═2OH﹣+H2↑,故A正确;
B.在阳极电极反应式为:2Cl﹣﹣2e﹣═Cl2↑,Cl﹣比OH﹣容易失去电子,故B正确;
C.移向阴极的是溶液中的阳离子,则中间的离子交换膜选用阳离子交换膜,故C错误;
D.电解饱和食盐水称为氯碱工业,可以得到三种重要的化工产品:Cl2、H2和NaOH,故D正确;
故选:C。
【点评】本题考查了电解原理,题目难度不大,明确电解饱和食盐水时的两极反应原理为解答关键,注意掌握电解原理及其应用方法,试题培养了学生的灵活应用能力。
6.(2024秋 海淀区期末)一定条件下,在2L的密闭容器中发生反应:A(s)+2B(g) 3C(g)+4D(g),测得5min后A的物质的量减小了1mol,则反应的平均速率可表示为( )
A.v(A)=0.1mol L﹣1 s﹣1
B.v(B)=0.1mol L﹣1 min﹣1
C.v(C)=0.005mol L﹣1 s﹣1
D.v(D)=0.2mol L﹣1 min﹣1
【答案】C
【分析】因为A为纯固体,不能用来表示反应速率,所以测得5min内,A的物质的量减小了5mol,则B、C、D的变化量分别为2mol、3mol、4mol,再根据v进行计算。
【解答】解:A.因为A为纯固体,不能用来表示反应速率,故A错误;
B.v(B)0.2mol L﹣1 min﹣1,故B错误;
C.v(C)0.3mol L﹣1 min﹣1=0.005mol L﹣1 s﹣1,故C正确;
D.v(D)0.4mol L﹣1 min﹣1,故D错误;
故选:C。
【点评】本题考查化学反应速率计算,明确化学反应速率计算公式中各个物理量的关系、各物质反应速率之比与其计量数之比关系是解本题关键,注意反应速率适用范围,题目难度不大。
7.(2024秋 海淀区期末)已知氢气燃烧反应的能量变化如图。
下列说法不正确的是( )
A.H—H键的键能小于O=O键的键能
B.破坏2mol H2和1mol O2的化学键所需的能量小于2mol H2O中的化学键所释放的能量
C.2H2(g)+O2(g)═2H2O(l)ΔH=﹣480kJ mol﹣1
D.利用该反应通过一定的装置可实现化学能到电能的转化
【答案】C
【分析】A.根据图示来解答;
B.根据图中数据来解答;
C.根据ΔH=反应物的总键能﹣生成物的总键能来解答;
D.原电池:化学能转化为电能。
【解答】解:A.根据图示知,H—H键的键能为436kJ mol﹣1,O=O键的键能为496kJ mol﹣1,H—H键的键能小于O=O键的键能,故A正确;
B.根据图示知,破坏2mol H2和1mol O2的化学键所需的能量为436kJ mol﹣1×2+496kJ mol﹣1=1368kJ mol﹣1,2mol H2O中的化学键所释放的能量4×462kJ mol﹣1=1848kJ mol﹣1,故破坏2mol H2和1mol O2的化学键所需的能量小于2mol H2O中的化学键所释放的能量,故B正确;
C.根据2H2(g)+O2(g)═2H2O(g)ΔH=436kJ mol﹣1×2+496kJ mol﹣1﹣4×462kJ mol﹣1=﹣480kJ mol﹣1可知,生成气态水放热480kJ,而不是生成液态水放热480kJ,故C错误;
D.此反应可以作为氢氧燃料电池的反应原理,故利用该反应通过一定的装置可实现化学能到电能的转化,故D正确;
故选:C。
【点评】考查了ΔH的计算、原电池原理等,是常考考点,难度不大。
8.(2024秋 昌平区期末)一定温度下的密闭容器中,发生可逆反应2NO(g)+O2(g) 2NO2(g),下列情况不能说明该反应达到平衡状态的是( )
A.容器内气体颜色不再变化
B.浓度商等于化学平衡常数
C.容器内气体的浓度c(NO):c(O2):c(NO2)=2:1:2
D.容器内的压强不再变化
【答案】C
【分析】化学反应达到平衡状态时,正逆反应速率相等,各组分浓度和百分含量保持不变。
【解答】解:A.容器内气体颜色不再变化,则H2、I2、HI的浓度不再改变,正逆反应速率相等,化学反应达到平衡状态,故A错误;
B.浓度商等于化学平衡常数,正逆反应速率相等,化学反应达到平衡状态,故B错误;
C.容器内气体的浓度c(NO):c(O2):c(NO2)=2:1:2不能说明化学反应达到平衡状态,故C正确;
D.反应前后气体分子数不相等,容器内的压强不再变化能判断反应达到平衡状态,故D错误;
故选:C。
【点评】本题考查化学平衡,题目难度中等,掌握平衡状态的判断方法是解题的关键。
9.(2024秋 昌平区期末)已知丙酮()碘化反应为:。实验测得该反应的速率可表示为:v=kc(丙酮)c(H+),其中k为反应速率常数。下列说法不正确的是( )
A.其他条件不变,增加丙酮浓度,反应速率增大
B.其他条件不变,增大I2的浓度,反应速率增大
C.其他条件不变,增大催化剂H+的浓度,反应速率增大
D.催化剂H+参与反应,降低反应活化能,增大反应速率
【答案】B
【分析】由反应的速率表达式v=kc(丙酮)c(H+)可知,增大丙酮的浓度或者氢离子的浓度,均可以加快反应速率,据此进行解答。
【解答】解:A.其他条件不变,增加丙酮浓度,由v=kc(丙酮)c(H+)可知反应速率增大,故A正确;
B.其他条件不变,增大I2的浓度,由v=kc(丙酮)c(H+)可知反应速率不受影响大,故B错误;
C.其他条件不变,增大催化剂H+的浓度,由v=kc(丙酮)c(H+)可知反应速率增大,故C正确;
D.催化剂H+参与反应,降低反应活化能,活化分子百分数增多,故增大反应速率,故D正确;
故选:B。
【点评】本题考查化学反应速率的相关知识,注意掌握速率常数的表示意义是解题的关键。
10.(2024秋 石景山区期末)下列说法错误的是( )
A.葡萄糖氧化生成CO2和H2O的反应是吸热反应
B.核酸是一种生物大分子
C.葡萄糖和果糖互为同分异构体
D.氨基酸是组成蛋白质的基本结构单位
【答案】A
【分析】A.葡萄糖在人体内被氧化生成CO2和H2O,该过程释放能量,用于维持人体的生命活动;
B.核酸是由许多核苷酸聚合而成的生物大分子化合物;
C.葡萄糖和果糖的分子式相同,但结构不同,葡萄糖是多羟基醛,果糖是多羟基酮,二者互为同分异构体;
D.蛋白质是由氨基酸通过脱水缩合形成的高分子化合物,氨基酸是组成蛋白质的基本结构单位。
【解答】解:A.葡萄糖在人体内被氧化生成CO2和H2O,该过程释放能量,用于维持人体的生命活动,所以是放热反应,而不是吸热反应,故A错误;
B.核酸是由许多核苷酸聚合而成的生物大分子化合物,在生物体的遗传、变异和蛋白质的生物合成中具有极其重要的作用,故B正确;
C.葡萄糖和果糖的分子式均为C6H12O6,但结构不同,葡萄糖是多羟基醛,果糖是多羟基酮,二者互为同分异构体,故C正确;
D.蛋白质是由氨基酸通过脱水缩合形成的高分子化合物,氨基酸是组成蛋白质的基本结构单位,故D正确;
故选:A。
【点评】本题可根据常见有机物的性质、同分异构体的概念以及生物大分子的相关知识来逐一分析选项。
11.(2024秋 昌平区期末)下列说法不正确的是( )
A.淀粉作为人类重要的能量来源,是由于它能发生水解产生葡萄糖供机体利用
B.纤维素能通过酯化反应得到醋酸纤维素,是由于纤维素分子中含有羟基
C.核糖核苷酸分子间脱水后聚合形成核糖核酸
D.石油经过分馏可得到煤油、柴油等,是利用了物质的溶解性差异
【答案】D
【分析】A.淀粉能发生水解产生葡萄糖;
B.酯化反应是酸和醇发生反应;
C.核糖核苷酸分子间脱水后发生缩合聚合反应形成核糖核酸;
D.因为石油蒸馏时根据各组分的沸点不同,按照不同温度范围先后蒸馏出来的。
【解答】解:A.淀粉能发生水解产生葡萄糖供机体利用,所以淀粉作为人类重要的能量来源,故A正确;
B.酯化反应是羧酸与醇发生的取代反应,纤维素能与醋酸发生酯化反应,醋酸中含羧基,则纤维素中含羟基,故B正确;
C.核糖核苷酸分子间脱水后发生缩合聚合反应形成核糖核酸,故C正确;
D.因为石油蒸馏时根据各组分的沸点不同,按照不同温度范围先后蒸馏出来的,是利用了物质的沸点不同,故D错误;
故选:D。
【点评】本题主要考查糖类、油脂、蛋白质的基础知识,熟悉糖的分类,淀粉纤维素为多糖,二糖和多糖都能水解最终得到单糖。
12.(2018秋 昌平区期末)糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述不正确的是( )
A.葡萄糖不具有还原性
B.淀粉是多糖,可在一定条件下水解
C.油脂属于酯类化合物
D.蛋白质最终能水解成氨基酸
【答案】A
【分析】A、葡萄糖是还原性糖;
B、淀粉是葡萄糖的脱水缩合物;
C、油脂是高级脂肪酸的甘油酯;
D、蛋白质是氨基酸的脱水缩合物。
【解答】解:A、葡萄糖是还原性糖,是还原性糖,故A错误;
B、淀粉是葡萄糖的脱水缩合物,能水解出许多分子的葡萄糖,是多糖,故B正确;
C、油脂是高级脂肪酸的甘油酯,属于酯类,能水解,故C正确;
D、蛋白质是氨基酸的脱水缩合物,能水解出氨基酸,故D正确。
故选:A。
【点评】本题考查了糖类、油脂和蛋白质的结构和性质,难度不大,掌握常见的还原性糖包括葡萄糖和麦芽糖。
13.(2024秋 石景山区期末)明朝宋应星所著的《天工开物》是世界上第一部关于农业和手工业生产的综合性“工艺百科全书”,其中介绍了锌的冶炼方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐(如图所示),泥封,“其底铺薪,发火煅红”,“冷定毁罐取出”。
已知:锌的熔点为419℃,沸点为907℃。
下列说法不正确的是( )
A.冷凝区中,锌由气态转化为液态,理论上该区温度控制在419~907℃
B.“冷定”后“毁罐”取锌的原因是防止Zn在较高的温度下被氧化成ZnO
C.反应区中,ZnCO3分解生成ZnO和CO2
D.反应区中,C与nO发生置换反应得到Zn,C被还原
【答案】D
【分析】A.锌的熔点为419℃,沸点为907℃,据此分析判断;
B.锌为金属,高温下和空气中的氧气反应生成氧化锌;
C.反应区中1100~1300℃,碳酸锌分解生成氧化锌和二氧化碳;
D.碳和氧化锌反应生成锌和一氧化碳。
【解答】解:A.锌的熔点为419℃,沸点为907℃,冷凝区中,锌由气态转化为液态,理论上该区温度控制在419~907℃,故A正确;
B.题干信息可知,“冷定”后“毁罐”取锌的原因是:防止Zn在较高的温度下被氧化成ZnO,故B正确;
C.反应区中1100~1300℃,碳酸锌分解生成氧化锌和二氧化碳,ZnCO3ZnO+CO2↑,故C正确;
D.反应区中,C与ZnO发生置换反应得到Zn反应的化学方程式:C+ZnOZn+CO,C被氧化,故D错误;
故选:D。
【点评】本题考查了物质制备过程的分析判断,主要是氧化还原反应的理解应用,题目难度中等。
14.(2023秋 西城区校级期末)利用“碳捕获与储存”技术可将工厂排放的CO2收集并储存,原理如图所示。
下列说法中,不正确的是( )
A.“碳捕获与储存”有助于缓解温室效应
B.过程Ⅰ中用NaOH溶液“捕获”排放的CO2
C.过程Ⅲ和过程Ⅳ的反应类型分别为分解反应和化合反应
D.上述过程中只有NaOH能够循环利用
【答案】D
【分析】A.根据减少二氧化碳的排放,有助于缓解温室效应进行分析;
B.根据用NaOH溶液“捕获”排放的CO2,进行分析;
C.根据过程Ⅲ为分解反应,过程Ⅳ为化合反应,进行分析;
D.根据NaOH和Ca(OH)2既参与反应,又生成,能够循环利用进行分析。
【解答】解:A.“碳捕获与储存”能减少二氧化碳的排放,有助于缓解温室效应,故A正确;
B.过程Ⅰ中用NaOH溶液“捕获”排放的二氧化碳,发生反应,故B正确;
C.由图知,过程Ⅲ为分解反应,过程Ⅳ为化合反应,故C正确;
D.根据图示可知,氢氧化钠和氢氧化钙既参与反应,又生成,能够循环利用,故D错误;
故选:D。
【点评】本题主要考查“三废”处理与环境保护等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
15.(2023秋 昌平区校级期末)为除去粗盐水中含有的杂质、Ca2+和Mg2+,得到精制食盐,设计了如图实验流程
下列说法不正确的是( )
A.NaOH溶液的作用是除去Mg2+
B.步骤i、ii的顺序可以互换
C.滤液2中有四种离子:Ca2+、Na+、Cl﹣、OH﹣
D.步骤iv中发生的离子反应为:H++OH﹣=H2O、2H+=H2O+CO2↑
【答案】C
【分析】粗盐水中先加入氢氧化钡(或氯化钡)溶液,硫酸根离子与钡离子反应生成硫酸钡沉淀,镁离子与氢氧根离子反应生成氢氧化镁沉淀,过滤后得到溶液A中含有过量的氢氧化钡和钙离子,再加入试剂为碳酸钠,除去过量的钡离子和钙离子,沉淀为碳酸钙和碳酸钡,滤液中加入HCl,除去多余的碳酸钠和氢氧根离子,得到精制食盐水,结晶得到氯化钠。
【解答】解:A.镁离子与氢氧根离子反应生成氢氧化镁沉淀,NaOH溶液的作用是除去Mg2+,故A正确;
B.加入过量氢氧化钡(或氯化钡)溶液是除去硫酸根离子,加入过量氢氧化钠溶液是除去镁离子,加入过量碳酸钠溶液目的是除去钙离子和过量钡离子,则加入氢氧化钠和氢氧化钡(或氯化钡)溶液的顺序可以调换,但是加入碳酸钠必须在加入氢氧化钡(或氯化钡)溶液之后,故B正确;
C.滤液2中除了四种离子:Ca2+、Na+、Cl﹣、OH﹣,还含有过量的钡离子,故C错误;
D.滤液中加入HCl,除去多余的碳酸钠和氢氧根离子,反应为H++OH﹣=H2O、,故D正确;
故选:C。
【点评】本题主要考查粗盐提纯等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
二.解答题(共4小题)
16.(2024秋 西城区期末)人工固氮对于农业生产有重要意义。
(1)工业合成氨。
①N2和H2合成NH3反应的化学方程式是 N2+3H22NH3 。
②下列措施中,既有利于提高合成氨反应限度又有利于增大其反应速率的是 b 。
a.升高温度
b.增大压强
c.使用催化剂
(2)中国科学家研究Cu—Mn合金催化剂电催化还原N2制NH3,装置如图1所示。
①阴极生成NH3其电极反应式是 N2+6H++6e﹣=2NH3 。
②用相同的电解装置和试剂进行实验,证明NH3来自电催化还原N2,需排除以下可能:
ⅰ.环境和电解池中存在微量的NH3
ⅱ.Cu—Mn合金与N2、H2O直接反应生成NH3
下列实验和结果能同时排除ⅰ、ⅱ的是 b 。
资料:自然界中的丰度:14N为99.6%,15N为0.4%。
a.用Ar代替N2进行实验,电解后未检测到NH3
b.用15N2代替N2进行实验,电解后仅检测到15NH3
c.不通电进行实验,未检测到NH3
③NH3的生成速率、NH3和H2的法拉第效率(FE)随阴极的电势变化如图2和图3所示。
资料:ⅰ.相同条件下,阴极的电势越低,电流越大。
ⅱ.某电极上产物B的FE(B)。
阴极的电势由﹣0.2V降到﹣0.3V时,NH3的生成速率增大。阴极的电势继续降低,NH3的生成速率反而减小。结合FE解释NH3的生成速率减小的原因: 阴极的电势继续降低,生成H2的逐渐增多,生成NH3的量逐渐减少,速率减小 。
(3)用滴定法测定溶液中的物质的量浓度的一种方法如下。
Ⅰ.取v1mL含的待测溶液。
Ⅱ.加入过量的V2mLc2mol L﹣1NaOH溶液。
Ⅲ.蒸馏,将蒸出的NH3用过量的V3mLc3mol L﹣1H2SO4溶液吸收。
Ⅳ.加入甲基橙指示剂,用c4mol L﹣1NaOH溶液滴定吸收液中过量的H2SO4消耗的NaOH溶液体积为V4mL,计算待测溶液中的物质的量浓度时用到的溶液体积: V1 和V4。
【答案】(1)①N2+3H22NH3;
②b;
(2)①N2+6H++6e﹣=2NH3;
②b。
③阴极的电势继续降低,生成H2的逐渐增多,生成NH3的量逐渐减少,速率减小;
(3)V1。
【分析】(1)①N2和H2在高温、高压、催化剂的条件下反应,生成NH3;
②a.升高温度,能够加快反应速率,但合成氨反应是放热反应,升高温度,平衡逆向移动;
b.增大压强,反应速率增大,平衡正向移动;
c.使用催化剂只能加快反应速率,不能改变反应限度;
(2)①由图可知,阴极N2和H+得到e﹣生成NH3;
②a.用Ar代替N2进行实验,电解后未检测到NH3,无法确定NH3是否来自电催化还原N2;
b.用15N2代替N2进行实验,电解后仅检测到15NH3,说明15NH3是来自电催化还原15N2;
c.不通电进行实验,未检测到NH3,无法确定NH3是否来自电催化还原N2;
③由图可知阴极的电势继续降低,生成H2的逐渐增多,生成NH3的量逐渐减少,速率减小;
(3)根据题意可知,计算待测溶液中的物质的量浓度时用到的溶液体积:V1和V4,V1是待测溶液的体积,用于计算的物质的量浓度,V4是滴定过量硫酸消耗的NaOH溶液的体积,用于计算蒸出的NH3消耗的V3mLc3mol L﹣1H2SO4溶液中硫酸的物质的量,根据关系式:2~2NH3~H2SO4,进一步计算的物质的量及其浓度。
【解答】解:(1)①N2和H2合成NH3反应的化学方程式是:N2+3H22NH3,
故答案为:N2+3H22NH3;
②a.升高温度,能够加快反应速率,但合成氨反应是放热反应,升高温度,平衡逆向移动,反应限度降低,故a错误;
b.增大压强,反应速率增大,平衡正向移动,反应限度增大,故b正确;
c.使用催化剂只能加快反应速率,不能改变反应限度,故c错误;
故答案为:b;
(2)①由图可知,阴极生成NH3其电极反应式是:N2+6H++6e﹣=2NH3,
故答案为:N2+6H++6e﹣=2NH3;
②a.用Ar代替N2进行实验,电解后未检测到NH3,无法确定NH3是否来自电催化还原N2,故a错误;
b.用15N2代替N2进行实验,电解后仅检测到15NH3,说明15NH3是来自电催化还原15N2,故b正确;
c.不通电进行实验,未检测到NH3,无法确定NH3是否来自电催化还原N2,NH3也可能来自Cu—Mn合金与N2、H2O直接反应生成,故c错误;
故答案为:b。
③由图可知,阴极的电势由﹣0.2V降到﹣0.3V时,NH3的生成速率增大,阴极的电势继续降低,NH3的生成速率反而减小,结合FE解释NH3的生成速率减小的原因是阴极的电势继续降低,生成H2的逐渐增多,生成NH3的量逐渐减少,速率减小,
故答案为:阴极的电势继续降低,生成H2的逐渐增多,生成NH3的量逐渐减少,速率减小;
(3)根据题意可知,计算待测溶液中的物质的量浓度时用到的溶液体积:V1和V4,V1是待测溶液的体积,用于计算的物质的量浓度,V4是滴定过量硫酸消耗的NaOH溶液的体积,用于计算蒸出的NH3消耗的V3mLc3mol L﹣1H2SO4溶液中硫酸的物质的量,根据关系式:2~2NH3~H2SO4,进一步计算的物质的量及其浓度,
故答案为:V1。
【点评】本题主要考查氨气的工业制法,电极反应式的书写,同时考查学生的获取信息的能力,属于基本知识的考查,难度中等。
17.(2024秋 昌平区期末)某小组同学探究不同价态硫元素之间的相互转化。
可以选用的试剂有:①SO2水溶液②Na2SO3溶液③Na2S溶液④稀硫酸⑤浓硫酸⑥品红溶液⑦新制氯水⑧铜片
实验序号 预期的价态转化 选择的试剂(填入试剂编号) 实验现象
ⅰ +6→+4 ⑤⑧ 产生刺激性气味气体
ⅱ +4→0 ②③
产生淡黄色沉淀
ⅲ
+4→+6
①⑦ 黄绿色褪去
(1)实验ⅰ的化学方程式为 Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O 。设计实验证明实现了+6→+4的转化,实验操作及现象是 将产生的气体通入品红溶液中,品红溶液褪色 。
(2)结合实验ⅱ的实验目的,说明选择试剂③的理由是 Na2S中硫元素为﹣2价,具有还原性,可将Na2SO3中+4价硫还原; 。②③溶液混合后,无明显现象,加入稀硫酸后,产生淡黄色沉淀。该实验说明物质的氧化性强弱受 溶液酸碱性 影响。产生淡黄色沉淀的离子方程式为 2S2﹣6H+=3S↓+3H2O 。
(3)实验ⅲ预期的价态转化为 +4→+6 。为验证Cl2被SO2还原为Cl﹣,甲同学向反应后的溶液中加入硝酸酸化的硝酸银溶液,观察是否产生白色沉淀。乙同学认为该方案不合理,理由是 新制氯水中含有Cl﹣,且硝酸具有强氧化性,能将SO2氧化为,干扰Cl﹣的检验 。
【答案】(1)Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O;将产生的气体通入品红溶液中,品红溶液褪色;
(2)Na2S中硫元素为﹣2价,具有还原性,可将Na2SO3中+4价硫还原;溶液酸碱性;2S2﹣6H+=3S↓+3H2O;
(3)+4→+6;新制氯水中含有Cl﹣,且硝酸具有强氧化性,能将SO2氧化为,干扰Cl﹣的检验;
实验ⅱ现象为:产生淡黄色沉淀;
实验ⅲ预期的价态转化:+4→+6。
【分析】(1)实验ⅰ中浓硫酸(H2SO4,S为+6价)与铜片在加热条件下反应生成硫酸铜、二氧化硫(SO2,S为+4价)和水,证明实现了S元素+6价到+4价的转化,即证明有二氧化硫生成,二氧化硫能使品红溶液褪色;
(2)实验ⅱ的实验目的S元素+4价到0价的转化,Na2SO3(S为+4价)具有氧化性,Na2S(S为﹣2价)具有还原性,选择试剂③的理由是Na2S中硫元素为﹣2价,具有还原性,可将Na2SO3中+4价硫还原;②③溶液混合后,无明显现象,加入稀硫酸后,产生淡黄色沉淀(硫单质),说明物质的氧化性强弱受溶液酸碱性影响;
(3)实验ⅲ中SO2水溶液与新制氯水反应,预期的价态转化为+4→+6,甲同学向反应后的溶液中加入硝酸酸化的硝酸银溶液,观察是否产生白色沉淀来验证Cl2被SO2还原为Cl﹣,该方案不合理,因为新制氯水中含有Cl﹣,且硝酸具有强氧化性,能将SO2氧化为,干扰Cl﹣的检验;
【解答】解:(1)实验ⅰ中浓硫酸(H2SO4,S为+6价)与铜片在加热条件下反应生成硫酸铜、二氧化硫(SO2,S为+4价)和水,其反应方程式为:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,证明实现了S元素+6价到+4价的转化,即证明有二氧化硫生成,二氧化硫能使品红溶液褪色,实验现象是:将产生的气体通入品红溶液中,品红溶液褪色,
故答案为:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O;将产生的气体通入品红溶液中,品红溶液褪色;
(2)实验ⅱ的实验目的S元素+4价到0价的转化,Na2SO3(S为+4价)具有氧化性,Na2S(S为﹣2价)具有还原性,选择试剂③的理由是Na2S中硫元素为﹣2价,具有还原性,可将Na2SO3中+4价硫还原;②③溶液混合后,无明显现象,加入稀硫酸后,产生淡黄色沉淀(硫单质),说明物质的氧化性强弱受溶液酸碱性影响,其离子反应方程式为:2S2﹣6H+=3S↓+3H2O,
故答案为:Na2S中硫元素为﹣2价,具有还原性,可将Na2SO3中+4价硫还原;溶液酸碱性;2S2﹣6H+=3S↓+3H2O;
(3)实验ⅲ中SO2水溶液与新制氯水反应,预期的价态转化为+4→+6,甲同学向反应后的溶液中加入硝酸酸化的硝酸银溶液,观察是否产生白色沉淀来验证Cl2被SO2还原为Cl﹣,该方案不合理,因为新制氯水中含有Cl﹣,且硝酸具有强氧化性,能将SO2氧化为,干扰Cl﹣的检验,
故答案为:+4→+6;新制氯水中含有Cl﹣,且硝酸具有强氧化性,能将SO2氧化为,干扰Cl﹣的检验。
【点评】本题主要考查硫及其化合物的性质及应用,考查学生的实验分析和探究能力,及其不同价态硫的转化,为综合性较强且难度较大的题型。
18.(2024秋 朝阳区期末)以黄铁矿为原料制取硫酸的原理示意图如图。
(1)黄铁矿在通空气前需粉碎,其作用是 增大接触面积,加快反应速率 。
(2)反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1是制硫酸的关键步骤。使用V2O5作催化剂,涉及如下反应:
ⅰ.V2O5(s)+SO2(g) V2O4(s)+SO3(g)ΔH1=+24kJ mol﹣1
ⅱ._____+2SO3(g) _____ΔH2=_____kJ mol﹣1
ⅲ.2VOSO4(s)(g)ΔH3=+277kJ mol﹣1
①补全反应ⅱ的热化学方程式:
V2O4(s) +2SO3(g) 2VOSO4(s) ΔH2= ﹣399 kJ mol﹣1
②下列说法不正确的是 abc (填序号)。
a.反应ⅰ和ⅱ均属于氧化还原反应
b.投入1mol V2O5,最多制得1mol SO3
c.使用V2O5能提高SO2的平衡转化率
(3)在体积可变的恒压密闭容器中投入8mol SO(g)11.7mol O2(g)和43.3mol N2(g),不同条件下发生反应Ⅱ。实验测得在0.1MPa、0.5MPa和5.0MPa压强下,SO2平衡转化率(α)随温度的变化如图所示。
①0.1MPa、550℃时SO2平衡转化率α= 0.85 ,判断依据是 该反应是气体分子数减小的反应,其它条件相同时,增大压强平衡正向进行,二氧化硫转化率增大,p3=0.1MPa 。
②工业上通常采用400~500℃和常压(0.1MPa)的条件,采用常压的原因是 400~500℃和常压(0.1MPa)的条件时,二氧化硫转化率已经很高,增大压强对材料、设备、动力要求更高,生产成本增加 。
③M点对应的平衡混合气体的体积为VL,计算该温度下反应Ⅱ的平衡常数 K= 10V 。
(4)测定尾气中SO2的含量。用氨基磺酸铵和硫酸铵的混合溶液吸收aL尾气,将SO2转化为H2SO3,然后用淀粉作指示剂,用cmol L﹣1I2标准溶液进行滴定,消耗I2标准溶液vmL。则尾气中SO2的含量为 mg L﹣1。
已知:H2SO3+I2+H2O═H2SO4+2HI
【答案】(1)增大接触面积,加快反应速率;
(2)①V2O4(s);2VOSO4(s);﹣399;
②abc;
(3)①0.85;该反应是气体分子数减小的反应,其它条件相同时,增大压强平衡正向进行,二氧化硫转化率增大,p3=0.1MPa;
②400~500℃和常压(0.1MPa)的条件时,二氧化硫转化率已经很高,增大压强对材料、设备、动力要求更高,生产成本增加;
③10V;
(4)。
【分析】黄铁矿和空气中的O2在加热条件下发生反应,生成SO2和Fe3O4,SO2和空气中的O2在400~500℃、常压、催化剂的作用下发生反应得到SO3,用98.3%的浓硫酸吸收SO3,得到H2SO4,结合问题分析判断和计算应用,
(1)矿石粉碎可以增大接触面积,加快反应速率;
(2)①反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1是制硫酸的关键步骤,使用V2O5作催化剂,涉及如下反应,ⅰ.V2O5(s)+SO2(g) V2O4(s)+SO3(g)ΔH1=+24kJ mol﹣1,ⅲ.2VOSO4(s)(g)ΔH3=+277kJ mol﹣1,结合盖斯定律计算得到,反应Ⅱ(i+ii+iii)得到反应ii;
②a.反应ⅱ不属于氧化还原反应;
b.投入1mol V2O5,反应为可逆反应;
c.催化剂改变反应速率,不能改变平衡;
(3)①体积可变的恒压密闭容器中投入8mol SO2(g)11.7mol O2(g)和43.3mol N2(g),不同条件下发生反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1,实验测得在0.1MPa、0.5MPa和5.0MPa压强下,SO2平衡转化率(α)随温度的变化如图所示,反应是气体体积减小的反应,增大压强,平衡正向进行,二氧化硫转化率增大,则p1、p2、p3分别为5.0MPa压强、0.5MPa、0.1MPa,p3=0.1MPa时;
②400~500℃和常压(0.1MPa)的条件时,二氧化硫转化率已经很高,增大压强,会增大设备成本;
③体积可变的恒压密闭容器中投入8mol SO(g)11.7mol O2(g)和43.3mol N2(g),不同条件下发生反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1,M点对应的平衡混合气体的体积为VL,p3=0.1MPa,二氧化硫转化率90%,结合三段式列式计算,
2SO2(g)+O2(g) 2SO3(g)
起始量(mol) 8 11.7 0
变化量(mol)7.2 3.6 7.2
平衡量(mol) 0.8 8.1 7.2
计算该温度下反应Ⅱ的平衡常数 K;
(4)用氨基磺酸铵和硫酸铵的混合溶液吸收aL尾气,将SO2转化为H2SO3,然后用淀粉作指示剂,用cmol L﹣1I2标准溶液进行滴定,H2SO3+I2+H2O═H2SO4+2HI,消耗I2标准溶液vmL,硫元素守恒计算得到尾气中SO2的含量。
【解答】解:(1)黄铁矿在通空气前需粉碎,其作用是增大接触面积,加快反应速率,
故答案为:增大接触面积,加快反应速率;
(2)①反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1是制硫酸的关键步骤,使用V2O5作催化剂,涉及如下反应,ⅰ.V2O5(s)+SO2(g) V2O4(s)+SO3(g)ΔH1=+24kJ mol﹣1,ⅲ.2VOSO4(s)(g)ΔH3=+277kJ mol﹣1,结合盖斯定律计算得到,反应Ⅱ(i+ii+iii)得到反应ii为:ⅱ.V2O4(s)+2SO3(g) 2VOSO4(s),ΔH2=﹣399kJ mol﹣1,
故答案为:V2O4(s);2VOSO4(s);﹣399;
②a.反应ⅱ不属于氧化还原反应,故a错误;
b.投入1mol V2O5,反应为可逆反应,不能制得1mol SO3,故b错误;
c.催化剂改变反应速率,不能改变平衡,使用V2O5不能能提高SO2的平衡转化率,故c错误;
故答案为:abc;
(3)①体积可变的恒压密闭容器中投入8mol SO2(g)11.7mol O2(g)和43.3mol N2(g),不同条件下发生反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1,实验测得在0.1MPa、0.5MPa和5.0MPa压强下,SO2平衡转化率(α)随温度的变化如图所示,反应是气体体积减小的反应,增大压强,平衡正向进行,二氧化硫转化率增大,则p1、p2、p3分别为5.0MPa压强、0.5MPa、0.1MPa,p3=0.1MPa时,图中得到对应二氧化硫转化率0.85,
故答案为:0.85;该反应是气体分子数减小的反应,其它条件相同时,增大压强平衡正向进行,二氧化硫转化率增大,p3=0.1MPa;
②工业上通常采用400~500℃和常压(0.1MPa)的条件,采用常压的原因是:400~500℃和常压(0.1MPa)的条件时,二氧化硫转化率已经很高,增大压强对材料、设备、动力要求更高,生产成本增加,
故答案为:400~500℃和常压(0.1MPa)的条件时,二氧化硫转化率已经很高,增大压强对材料、设备、动力要求更高,生产成本增加;
③体积可变的恒压密闭容器中投入8mol SO(g)11.7mol O2(g)和43.3mol N2(g),不同条件下发生反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1,M点对应的平衡混合气体的体积为VL,p3=0.1MPa,二氧化硫转化率90%,结合三段式列式计算,
2SO2(g)+O2(g) 2SO3(g)
起始量(mol) 8 11.7 0
变化量(mol)7.2 3.6 7.2
平衡量(mol) 0.8 8.1 7.2
计算该温度下反应Ⅱ的平衡常数 K10V,
故答案为:10V;
(4)用氨基磺酸铵和硫酸铵的混合溶液吸收aL尾气,将SO2转化为H2SO3,然后用淀粉作指示剂,用cmol L﹣1I2标准溶液进行滴定,H2SO3+I2+H2O═H2SO4+2HI,消耗I2标准溶液vmL,硫元素守恒计算得到尾气中SO2的含量mg L﹣1,
故答案为:。
【点评】本题考查盖斯定律、化学平衡计算等知识点,把握化学反应原理及各个物理量关系是解本题关键,难点是化学平衡计算,注意知识的熟练掌握,题目难度中等。
19.(2023春 房山区期末)研究有机化合物中的典型代表物,对于有机合成的研究有重要意义。
(1)乙醇是醇类物质的典型代表物,乙醇分子结构中的各种化学键如图1所示:
①由乙醇制备乙烯的反应断键位置是 ①④ (填序号),该反应的类型属于 消去反应 。
②乙醇氧化可转化为乙醛,该反应断键位置是 ③⑤ (填序号)。
(2)乙酸乙酯是酯类物质的典型代表物,广泛用于药物、染料、香料等工业。实验室用无水乙醇、冰醋酸和浓硫酸反应可制备乙酸乙酯,常用装置如图2所示。
①写出无水乙醇、冰醋酸和浓硫酸反应制备乙酸乙酯的化学方程式 CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O 。
②试管X中的试剂为 饱和Na2CO3溶液 ,作用是 除去乙酸,吸收乙醇,降低乙酸乙酯溶解度 。
③为提高反应速率或限度,实验中采取的措施及对应理由不正确的是 c (填字母)。
a.浓硫酸可做催化剂,提高化学反应速率
b.浓硫酸可做吸水剂,促进反应向生成乙酸乙酯的反应移动
c.已知该反应为放热反应,升高温度可同时提高化学反应速率和反应限度
(3)三种常见羧酸的pKa数值如下表(pKa数值越小,酸性越强)。乙酸中的﹣CH3具有推电子作用,使羧基中羟基的极性减小,从而难以电离出H+,故乙酸的酸性比甲酸的酸性弱。
羧酸 甲酸(HCOOH) 乙酸(CH3COOH) 三氯乙酸(CCl3COOH)
pKa 3.75 4.76 0.65
请比较乙酸与三氯乙酸的酸性强弱并解释原因 三氯乙酸的酸性比CH3COOH更强,因为Cl的电负性大,有吸电子作用,使CCl3COOH中羟基极性增大,从而更易电离出H+ 。
【答案】(1)①:①④;消去反应;
②:③⑤;
(2)①CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;
②饱和Na2CO3溶液;除去乙酸,吸收乙醇,降低乙酸乙酯溶解度;
③c;
(3)三氯乙酸的酸性比CH3COOH更强,因为Cl的电负性大,有吸电子作用,使CCl3COOH中羟基极性增大,从而更易电离出H+。
【分析】(1)①由乙醇制备乙烯的反应是脱去羟基和β﹣H,该反应属于消去反应;
②乙醇催化氧化可转化为乙醛脱去的羟基H和α﹣H;
(2)①无水乙醇、冰醋酸和浓硫酸反应生成 CH3COOCH2CH3、H2O;
②试管X中的试剂为饱和Na2CO3溶液,作用是除去乙酸,吸收乙醇,降低乙酸乙酯溶解度;
③a.催化剂可以提高化学反应速率;
b.浓硫酸可做吸水剂,即减小生成物的浓度,平衡正向移动;
c.升高温度可提高化学反应速率,但平衡向吸热反应方向移动;
(3)因为Cl的电负性大,有吸电子作用,使CCl3COOH中羟基极性增大,从而更易电离出H+。
【解答】解:(1)①由乙醇制备乙烯的反应断键位置是①④,该反应的类型属于消去反应,
故答案为:①④;消去反应;
②乙醇氧化可转化为乙醛,该反应断键位置是③⑤,
故答案为:③⑤;
(2)①无水乙醇、冰醋酸和浓硫酸反应制备乙酸乙酯的化学方程式为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;
②试管X中的试剂为饱和Na2CO3溶液,作用是除去乙酸,吸收乙醇,降低乙酸乙酯溶解度,
故答案为:饱和Na2CO3溶液;除去乙酸,吸收乙醇,降低乙酸乙酯溶解度;
③a.浓硫酸可做催化剂,可以提高化学反应速率,故a正确;
b.浓硫酸可做吸水剂,即减小生成物的浓度,促进反应向生成乙酸乙酯的反应移动,故b正确;
c.已知该反应为放热反应,升高温度可提高化学反应速率,但不能提高反应的限度,因为升高温度,平衡逆向移动,故c错误;
故答案为:c;
(3)因为Cl的电负性大,有吸电子作用,使CCl3COOH中羟基极性增大,从而更易电离出H+,故三氯乙酸的酸性比CH3COOH更强,
故答案为:三氯乙酸的酸性比CH3COOH更强,因为Cl的电负性大,有吸电子作用,使CCl3COOH中羟基极性增大,从而更易电离出H+。
【点评】本题主要考查乙醇的相关知识,属于基本知识的考查,难度不大。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
北京市2024-2025学年高一下学期化学期末模拟预测卷
一.选择题(共15小题)
1.(2024秋 丰台区期末)工业上制备硝酸的主要流程如图所示。下列说法不正确的是( )
A.氧化炉中发生的化学反应是
B.物质X是H2O
C.上述流程中,理论上用N2合成1mol HNO3,至少需要2.5mol O2
D.吸收塔中为提高氮原子的利用率,可通入过量空气和循环利用尾气中NO
2.(2024秋 房山区期末)物质类别和元素价态是研究物质性质的两个重要角度。图为含氮物质的“价—类”二维图的部分信息。下列说法不正确的是( )
A.从N2→X的转化是人工固氮的重要方法
B.Y的化学式为N2O5
C.从NO2→HNO3,必需加入氧化剂
D.使用HNO3和X制备硝酸铵氮肥时,氮元素的化合价没有发生变化
3.(2024秋 海淀区校级期末)浓硫酸与铜反应的装置如图所示,下列说法不正确的是( )
A.可通过提拉铜丝控制反应的发生与停止
B.浸NaOH溶液的棉团作用:
C.品红溶液褪色和紫色石蕊溶液变红均可证明反应发生
D.若将品红溶液和石蕊溶液调换位置,石蕊溶液变红仍可以证明生成SO2
4.(2024秋 丰台区期末)下列有关浓硫酸的说法不正确的是( )
A.具有脱水性 B.加热时能与碳反应
C.能用于干燥氨气 D.加热时能与铜反应
5.(2024秋 石景山区期末)习惯上把电解饱和食盐水的工业生产叫氯碱工业,一个单元槽的电解原理示意图如图,下列说法不正确的是( )
A.阴极的电极反应:
B.在阳极,Cl﹣比OH﹣容易失去电子
C.中间的离子交换膜选用阴离子交换膜
D.电解饱和食盐水可以得到三种重要的化工产品:Cl2、H2和NaOH
6.(2024秋 海淀区期末)一定条件下,在2L的密闭容器中发生反应:A(s)+2B(g) 3C(g)+4D(g),测得5min后A的物质的量减小了1mol,则反应的平均速率可表示为( )
A.v(A)=0.1mol L﹣1 s﹣1
B.v(B)=0.1mol L﹣1 min﹣1
C.v(C)=0.005mol L﹣1 s﹣1
D.v(D)=0.2mol L﹣1 min﹣1
7.(2024秋 海淀区期末)已知氢气燃烧反应的能量变化如图。
下列说法不正确的是( )
A.H—H键的键能小于O=O键的键能
B.破坏2mol H2和1mol O2的化学键所需的能量小于2mol H2O中的化学键所释放的能量
C.2H2(g)+O2(g)═2H2O(l)ΔH=﹣480kJ mol﹣1
D.利用该反应通过一定的装置可实现化学能到电能的转化
8.(2024秋 昌平区期末)一定温度下的密闭容器中,发生可逆反应2NO(g)+O2(g) 2NO2(g),下列情况不能说明该反应达到平衡状态的是( )
A.容器内气体颜色不再变化
B.浓度商等于化学平衡常数
C.容器内气体的浓度c(NO):c(O2):c(NO2)=2:1:2
D.容器内的压强不再变化
9.(2024秋 昌平区期末)已知丙酮()碘化反应为:。实验测得该反应的速率可表示为:v=kc(丙酮)c(H+),其中k为反应速率常数。下列说法不正确的是( )
A.其他条件不变,增加丙酮浓度,反应速率增大
B.其他条件不变,增大I2的浓度,反应速率增大
C.其他条件不变,增大催化剂H+的浓度,反应速率增大
D.催化剂H+参与反应,降低反应活化能,增大反应速率
10.(2024秋 石景山区期末)下列说法错误的是( )
A.葡萄糖氧化生成CO2和H2O的反应是吸热反应
B.核酸是一种生物大分子
C.葡萄糖和果糖互为同分异构体
D.氨基酸是组成蛋白质的基本结构单位
11.(2024秋 昌平区期末)下列说法不正确的是( )
A.淀粉作为人类重要的能量来源,是由于它能发生水解产生葡萄糖供机体利用
B.纤维素能通过酯化反应得到醋酸纤维素,是由于纤维素分子中含有羟基
C.核糖核苷酸分子间脱水后聚合形成核糖核酸
D.石油经过分馏可得到煤油、柴油等,是利用了物质的溶解性差异
12.(2018秋 昌平区期末)糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述不正确的是( )
A.葡萄糖不具有还原性
B.淀粉是多糖,可在一定条件下水解
C.油脂属于酯类化合物
D.蛋白质最终能水解成氨基酸
13.(2024秋 石景山区期末)明朝宋应星所著的《天工开物》是世界上第一部关于农业和手工业生产的综合性“工艺百科全书”,其中介绍了锌的冶炼方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐(如图所示),泥封,“其底铺薪,发火煅红”,“冷定毁罐取出”。
已知:锌的熔点为419℃,沸点为907℃。
下列说法不正确的是( )
A.冷凝区中,锌由气态转化为液态,理论上该区温度控制在419~907℃
B.“冷定”后“毁罐”取锌的原因是防止Zn在较高的温度下被氧化成ZnO
C.反应区中,ZnCO3分解生成ZnO和CO2
D.反应区中,C与nO发生置换反应得到Zn,C被还原
14.(2023秋 西城区校级期末)利用“碳捕获与储存”技术可将工厂排放的CO2收集并储存,原理如图所示。
下列说法中,不正确的是( )
A.“碳捕获与储存”有助于缓解温室效应
B.过程Ⅰ中用NaOH溶液“捕获”排放的CO2
C.过程Ⅲ和过程Ⅳ的反应类型分别为分解反应和化合反应
D.上述过程中只有NaOH能够循环利用
15.(2023秋 昌平区校级期末)为除去粗盐水中含有的杂质、Ca2+和Mg2+,得到精制食盐,设计了如图实验流程
下列说法不正确的是( )
A.NaOH溶液的作用是除去Mg2+
B.步骤i、ii的顺序可以互换
C.滤液2中有四种离子:Ca2+、Na+、Cl﹣、OH﹣
D.步骤iv中发生的离子反应为:H++OH﹣=H2O、2H+=H2O+CO2↑
二.解答题(共4小题)
16.(2024秋 西城区期末)人工固氮对于农业生产有重要意义。
(1)工业合成氨。
①N2和H2合成NH3反应的化学方程式是 。
②下列措施中,既有利于提高合成氨反应限度又有利于增大其反应速率的是 。
a.升高温度
b.增大压强
c.使用催化剂
(2)中国科学家研究Cu—Mn合金催化剂电催化还原N2制NH3,装置如图1所示。
①阴极生成NH3其电极反应式是 。
②用相同的电解装置和试剂进行实验,证明NH3来自电催化还原N2,需排除以下可能:
ⅰ.环境和电解池中存在微量的NH3
ⅱ.Cu—Mn合金与N2、H2O直接反应生成NH3
下列实验和结果能同时排除ⅰ、ⅱ的是 。
资料:自然界中的丰度:14N为99.6%,15N为0.4%。
a.用Ar代替N2进行实验,电解后未检测到NH3
b.用15N2代替N2进行实验,电解后仅检测到15NH3
c.不通电进行实验,未检测到NH3
③NH3的生成速率、NH3和H2的法拉第效率(FE)随阴极的电势变化如图2和图3所示。
资料:ⅰ.相同条件下,阴极的电势越低,电流越大。
ⅱ.某电极上产物B的FE(B)。
阴极的电势由﹣0.2V降到﹣0.3V时,NH3的生成速率增大。阴极的电势继续降低,NH3的生成速率反而减小。结合FE解释NH3的生成速率减小的原因: 。
(3)用滴定法测定溶液中的物质的量浓度的一种方法如下。
Ⅰ.取v1mL含的待测溶液。
Ⅱ.加入过量的V2mLc2mol L﹣1NaOH溶液。
Ⅲ.蒸馏,将蒸出的NH3用过量的V3mLc3mol L﹣1H2SO4溶液吸收。
Ⅳ.加入甲基橙指示剂,用c4mol L﹣1NaOH溶液滴定吸收液中过量的H2SO4消耗的NaOH溶液体积为V4mL,计算待测溶液中的物质的量浓度时用到的溶液体积: 和V4。
17.(2024秋 昌平区期末)某小组同学探究不同价态硫元素之间的相互转化。
可以选用的试剂有:①SO2水溶液②Na2SO3溶液③Na2S溶液④稀硫酸⑤浓硫酸⑥品红溶液⑦新制氯水⑧铜片
实验序号 预期的价态转化 选择的试剂(填入试剂编号) 实验现象
ⅰ +6→+4 ⑤⑧ 产生刺激性气味气体
ⅱ +4→0 ②③
ⅲ
①⑦ 黄绿色褪去
(1)实验ⅰ的化学方程式为 。设计实验证明实现了+6→+4的转化,实验操作及现象是 。
(2)结合实验ⅱ的实验目的,说明选择试剂③的理由是 。②③溶液混合后,无明显现象,加入稀硫酸后,产生淡黄色沉淀。该实验说明物质的氧化性强弱受 影响。产生淡黄色沉淀的离子方程式为 。
(3)实验ⅲ预期的价态转化为 。为验证Cl2被SO2还原为Cl﹣,甲同学向反应后的溶液中加入硝酸酸化的硝酸银溶液,观察是否产生白色沉淀。乙同学认为该方案不合理,理由是 。
18.(2024秋 朝阳区期末)以黄铁矿为原料制取硫酸的原理示意图如图。
(1)黄铁矿在通空气前需粉碎,其作用是 。
(2)反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1是制硫酸的关键步骤。使用V2O5作催化剂,涉及如下反应:
ⅰ.V2O5(s)+SO2(g) V2O4(s)+SO3(g)ΔH1=+24kJ mol﹣1
ⅱ._____+2SO3(g) _____ΔH2=_____kJ mol﹣1
ⅲ.2VOSO4(s)(g)ΔH3=+277kJ mol﹣1
①补全反应ⅱ的热化学方程式:
+2SO3(g) ΔH2= kJ mol﹣1
②下列说法不正确的是 (填序号)。
a.反应ⅰ和ⅱ均属于氧化还原反应
b.投入1mol V2O5,最多制得1mol SO3
c.使用V2O5能提高SO2的平衡转化率
(3)在体积可变的恒压密闭容器中投入8mol SO(g)11.7mol O2(g)和43.3mol N2(g),不同条件下发生反应Ⅱ。实验测得在0.1MPa、0.5MPa和5.0MPa压强下,SO2平衡转化率(α)随温度的变化如图所示。
①0.1MPa、550℃时SO2平衡转化率α= ,判断依据是 。
②工业上通常采用400~500℃和常压(0.1MPa)的条件,采用常压的原因是 。
③M点对应的平衡混合气体的体积为VL,计算该温度下反应Ⅱ的平衡常数 K= 。
(4)测定尾气中SO2的含量。用氨基磺酸铵和硫酸铵的混合溶液吸收aL尾气,将SO2转化为H2SO3,然后用淀粉作指示剂,用cmol L﹣1I2标准溶液进行滴定,消耗I2标准溶液vmL。则尾气中SO2的含量为 mg L﹣1。
已知:H2SO3+I2+H2O═H2SO4+2HI
19.(2023春 房山区期末)研究有机化合物中的典型代表物,对于有机合成的研究有重要意义。
(1)乙醇是醇类物质的典型代表物,乙醇分子结构中的各种化学键如图1所示:
①由乙醇制备乙烯的反应断键位置是 (填序号),该反应的类型属于 。
②乙醇氧化可转化为乙醛,该反应断键位置是 (填序号)。
(2)乙酸乙酯是酯类物质的典型代表物,广泛用于药物、染料、香料等工业。实验室用无水乙醇、冰醋酸和浓硫酸反应可制备乙酸乙酯,常用装置如图2所示。
①写出无水乙醇、冰醋酸和浓硫酸反应制备乙酸乙酯的化学方程式 。
②试管X中的试剂为 ,作用是 。
③为提高反应速率或限度,实验中采取的措施及对应理由不正确的是 (填字母)。
a.浓硫酸可做催化剂,提高化学反应速率
b.浓硫酸可做吸水剂,促进反应向生成乙酸乙酯的反应移动
c.已知该反应为放热反应,升高温度可同时提高化学反应速率和反应限度
(3)三种常见羧酸的pKa数值如下表(pKa数值越小,酸性越强)。乙酸中的﹣CH3具有推电子作用,使羧基中羟基的极性减小,从而难以电离出H+,故乙酸的酸性比甲酸的酸性弱。
羧酸 甲酸(HCOOH) 乙酸(CH3COOH) 三氯乙酸(CCl3COOH)
pKa 3.75 4.76 0.65
请比较乙酸与三氯乙酸的酸性强弱并解释原因 。
北京市2024-2025学年高一下学期化学期末模拟预测卷
参考答案与试题解析
一.选择题(共15小题)
1.(2024秋 丰台区期末)工业上制备硝酸的主要流程如图所示。下列说法不正确的是( )
A.氧化炉中发生的化学反应是
B.物质X是H2O
C.上述流程中,理论上用N2合成1mol HNO3,至少需要2.5mol O2
D.吸收塔中为提高氮原子的利用率,可通入过量空气和循环利用尾气中NO
【答案】C
【分析】氮气和氢气在合成塔中生成氨气,氨气在氧化炉中发生催化氧化生成一氧化氮和水,吸收塔中NO和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮。
【解答】解:A.氧化炉中NH3发生催化氧化生成NO和H2O,反应化学方程式是,故A正确;
B.NO2和水反应生成HNO3和NO,所以物质X是H2O,故B正确;
C.上述流程中,理论上用N2合成1mol 硝酸,N元素化合价由0升高为+5,O元素化合价由0降低为﹣2,根据得失电子守恒,至少需要1.25mol O2,故C错误;
D.吸收塔中为提高氮原子的利用率,可通入过量空气发生反应4NO+3O2+2H2O=4HNO3,还可以循环利用尾气中的NO,故D正确;
故选:C。
【点评】本题主要考查工业制取硝酸等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
2.(2024秋 房山区期末)物质类别和元素价态是研究物质性质的两个重要角度。图为含氮物质的“价—类”二维图的部分信息。下列说法不正确的是( )
A.从N2→X的转化是人工固氮的重要方法
B.Y的化学式为N2O5
C.从NO2→HNO3,必需加入氧化剂
D.使用HNO3和X制备硝酸铵氮肥时,氮元素的化合价没有发生变化
【答案】C
【分析】由图可知,X是NH3,Y是+5价氮的氧化物,Y是N2O5,从NO2→HNO3,发生的反应可以是:3NO2+H2O=2HNO3+NO,使用HNO3和NH3制备硝酸铵氮肥时,发生反应:HNO3+NH3=NH4NO3,据此解答。
【解答】解:A.的转化为工业合成氨,是人工固氮的重要方法,故A正确;
B.Y是+5价氮的氧化物,则Y的化学式为五氧化二氮,故B正确;
C.从NO2→HNO3,发生的反应可以是:3NO2+H2O=2HNO3+NO,该反应中二氧化氮既是氧化剂也是还原剂,不需要加入氧化剂,故C错误;
D.使用硝酸和氨气制备硝酸铵氮肥时,发生反应:HNO3+NH3=NH4NO3,氮元素的化合价没有发生变化,故D正确;
故选:C。
【点评】本题主要考查含氮物质的综合应用等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
3.(2024秋 海淀区校级期末)浓硫酸与铜反应的装置如图所示,下列说法不正确的是( )
A.可通过提拉铜丝控制反应的发生与停止
B.浸NaOH溶液的棉团作用:
C.品红溶液褪色和紫色石蕊溶液变红均可证明反应发生
D.若将品红溶液和石蕊溶液调换位置,石蕊溶液变红仍可以证明生成SO2
【答案】D
【分析】浓硫酸与铜反应生成硫酸铜、水和SO2,根据调节铜丝的高低可控制反应的开始和停止,由于SO2具有漂白性,因此将生成的SO2通入品红溶液中,品红溶液褪色,SO2为酸性氧化物,与水反应生成H2SO3,将SO2通入石蕊溶液中,石蕊溶液变红色,浸有NaOH溶液的棉团可吸收SO2。
【解答】解:A.浓硫酸与铜反应生成硫酸铜溶液和二氧化硫,根据调节铜丝的高低可控制反应的开始和停止,故A正确;
B.浸NaOH溶液的棉团可吸收二氧化硫,发生的离子方程式为,故B正确;
C.二氧化硫具有漂白性,可使品红溶液褪色,二氧化硫为酸性氧化物,与水反应生成H2SO3,将二氧化硫通入石蕊溶液中,石蕊溶液变红色,故均可证明发生了反应,故C正确;
D.若将品红溶液和石蕊溶液调换位置,若反应生成的SO3因溶于水生成了H2SO4而石蕊溶液变红,因此仅凭石蕊变红无法特定地证明生成了SO2,还需要结合其他方法才能证明生成SO2,故D错误;
故选:D。
【点评】本题主要考查浓硫酸的性质实验等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
4.(2024秋 丰台区期末)下列有关浓硫酸的说法不正确的是( )
A.具有脱水性 B.加热时能与碳反应
C.能用于干燥氨气 D.加热时能与铜反应
【答案】C
【分析】A.根据浓硫酸具有脱水性,进行分析;
B.根据浓硫酸加热时能与碳反应生成二氧化碳、二氧化硫与水,进行分析;
C.根据浓硫酸与氨气反应,进行分析;
D.根据浓硫酸加热时与铜反应生成硫酸铜、二氧化硫与水,进行分析。
【解答】解:A.浓H2SO4具有脱水性,例如浓硫酸能使蔗糖脱水、出现变黑现象,故A正确;
B.浓H2SO4加热时能与碳反应生成二氧化碳、二氧化硫与水,故B正确;
C.浓H2SO4与氨气反应,不能干燥NH3,故C错误;
D.浓H2SO4加热时与铜反应生成硫酸铜、二氧化硫与水,故D正确;
故选:C。
【点评】本题主要考查浓硫酸的特性等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
5.(2024秋 石景山区期末)习惯上把电解饱和食盐水的工业生产叫氯碱工业,一个单元槽的电解原理示意图如图,下列说法不正确的是( )
A.阴极的电极反应:
B.在阳极,Cl﹣比OH﹣容易失去电子
C.中间的离子交换膜选用阴离子交换膜
D.电解饱和食盐水可以得到三种重要的化工产品:Cl2、H2和NaOH
【答案】C
【分析】电解饱和食盐水时,左侧通入饱和食盐水,使用阳离子交换膜,由钠离子移动的方向可知,Na+穿过阳离子交换膜移向阴极室,左侧为阳极,接电源正极,阳极电极反应式为:2Cl﹣﹣2e﹣═Cl2↑,放出氢气的电极接电源负极,为电解池的阴极,阴极反应式为:2H2O﹣2e﹣═2OH﹣+H2↑,阴极产物为NaOH和H2,据此分析答题。
【解答】解:A.放出氢气的电极接电源负极,为电解池的阴极,阴极反应式为:2H2O﹣2e﹣═2OH﹣+H2↑,故A正确;
B.在阳极电极反应式为:2Cl﹣﹣2e﹣═Cl2↑,Cl﹣比OH﹣容易失去电子,故B正确;
C.移向阴极的是溶液中的阳离子,则中间的离子交换膜选用阳离子交换膜,故C错误;
D.电解饱和食盐水称为氯碱工业,可以得到三种重要的化工产品:Cl2、H2和NaOH,故D正确;
故选:C。
【点评】本题考查了电解原理,题目难度不大,明确电解饱和食盐水时的两极反应原理为解答关键,注意掌握电解原理及其应用方法,试题培养了学生的灵活应用能力。
6.(2024秋 海淀区期末)一定条件下,在2L的密闭容器中发生反应:A(s)+2B(g) 3C(g)+4D(g),测得5min后A的物质的量减小了1mol,则反应的平均速率可表示为( )
A.v(A)=0.1mol L﹣1 s﹣1
B.v(B)=0.1mol L﹣1 min﹣1
C.v(C)=0.005mol L﹣1 s﹣1
D.v(D)=0.2mol L﹣1 min﹣1
【答案】C
【分析】因为A为纯固体,不能用来表示反应速率,所以测得5min内,A的物质的量减小了5mol,则B、C、D的变化量分别为2mol、3mol、4mol,再根据v进行计算。
【解答】解:A.因为A为纯固体,不能用来表示反应速率,故A错误;
B.v(B)0.2mol L﹣1 min﹣1,故B错误;
C.v(C)0.3mol L﹣1 min﹣1=0.005mol L﹣1 s﹣1,故C正确;
D.v(D)0.4mol L﹣1 min﹣1,故D错误;
故选:C。
【点评】本题考查化学反应速率计算,明确化学反应速率计算公式中各个物理量的关系、各物质反应速率之比与其计量数之比关系是解本题关键,注意反应速率适用范围,题目难度不大。
7.(2024秋 海淀区期末)已知氢气燃烧反应的能量变化如图。
下列说法不正确的是( )
A.H—H键的键能小于O=O键的键能
B.破坏2mol H2和1mol O2的化学键所需的能量小于2mol H2O中的化学键所释放的能量
C.2H2(g)+O2(g)═2H2O(l)ΔH=﹣480kJ mol﹣1
D.利用该反应通过一定的装置可实现化学能到电能的转化
【答案】C
【分析】A.根据图示来解答;
B.根据图中数据来解答;
C.根据ΔH=反应物的总键能﹣生成物的总键能来解答;
D.原电池:化学能转化为电能。
【解答】解:A.根据图示知,H—H键的键能为436kJ mol﹣1,O=O键的键能为496kJ mol﹣1,H—H键的键能小于O=O键的键能,故A正确;
B.根据图示知,破坏2mol H2和1mol O2的化学键所需的能量为436kJ mol﹣1×2+496kJ mol﹣1=1368kJ mol﹣1,2mol H2O中的化学键所释放的能量4×462kJ mol﹣1=1848kJ mol﹣1,故破坏2mol H2和1mol O2的化学键所需的能量小于2mol H2O中的化学键所释放的能量,故B正确;
C.根据2H2(g)+O2(g)═2H2O(g)ΔH=436kJ mol﹣1×2+496kJ mol﹣1﹣4×462kJ mol﹣1=﹣480kJ mol﹣1可知,生成气态水放热480kJ,而不是生成液态水放热480kJ,故C错误;
D.此反应可以作为氢氧燃料电池的反应原理,故利用该反应通过一定的装置可实现化学能到电能的转化,故D正确;
故选:C。
【点评】考查了ΔH的计算、原电池原理等,是常考考点,难度不大。
8.(2024秋 昌平区期末)一定温度下的密闭容器中,发生可逆反应2NO(g)+O2(g) 2NO2(g),下列情况不能说明该反应达到平衡状态的是( )
A.容器内气体颜色不再变化
B.浓度商等于化学平衡常数
C.容器内气体的浓度c(NO):c(O2):c(NO2)=2:1:2
D.容器内的压强不再变化
【答案】C
【分析】化学反应达到平衡状态时,正逆反应速率相等,各组分浓度和百分含量保持不变。
【解答】解:A.容器内气体颜色不再变化,则H2、I2、HI的浓度不再改变,正逆反应速率相等,化学反应达到平衡状态,故A错误;
B.浓度商等于化学平衡常数,正逆反应速率相等,化学反应达到平衡状态,故B错误;
C.容器内气体的浓度c(NO):c(O2):c(NO2)=2:1:2不能说明化学反应达到平衡状态,故C正确;
D.反应前后气体分子数不相等,容器内的压强不再变化能判断反应达到平衡状态,故D错误;
故选:C。
【点评】本题考查化学平衡,题目难度中等,掌握平衡状态的判断方法是解题的关键。
9.(2024秋 昌平区期末)已知丙酮()碘化反应为:。实验测得该反应的速率可表示为:v=kc(丙酮)c(H+),其中k为反应速率常数。下列说法不正确的是( )
A.其他条件不变,增加丙酮浓度,反应速率增大
B.其他条件不变,增大I2的浓度,反应速率增大
C.其他条件不变,增大催化剂H+的浓度,反应速率增大
D.催化剂H+参与反应,降低反应活化能,增大反应速率
【答案】B
【分析】由反应的速率表达式v=kc(丙酮)c(H+)可知,增大丙酮的浓度或者氢离子的浓度,均可以加快反应速率,据此进行解答。
【解答】解:A.其他条件不变,增加丙酮浓度,由v=kc(丙酮)c(H+)可知反应速率增大,故A正确;
B.其他条件不变,增大I2的浓度,由v=kc(丙酮)c(H+)可知反应速率不受影响大,故B错误;
C.其他条件不变,增大催化剂H+的浓度,由v=kc(丙酮)c(H+)可知反应速率增大,故C正确;
D.催化剂H+参与反应,降低反应活化能,活化分子百分数增多,故增大反应速率,故D正确;
故选:B。
【点评】本题考查化学反应速率的相关知识,注意掌握速率常数的表示意义是解题的关键。
10.(2024秋 石景山区期末)下列说法错误的是( )
A.葡萄糖氧化生成CO2和H2O的反应是吸热反应
B.核酸是一种生物大分子
C.葡萄糖和果糖互为同分异构体
D.氨基酸是组成蛋白质的基本结构单位
【答案】A
【分析】A.葡萄糖在人体内被氧化生成CO2和H2O,该过程释放能量,用于维持人体的生命活动;
B.核酸是由许多核苷酸聚合而成的生物大分子化合物;
C.葡萄糖和果糖的分子式相同,但结构不同,葡萄糖是多羟基醛,果糖是多羟基酮,二者互为同分异构体;
D.蛋白质是由氨基酸通过脱水缩合形成的高分子化合物,氨基酸是组成蛋白质的基本结构单位。
【解答】解:A.葡萄糖在人体内被氧化生成CO2和H2O,该过程释放能量,用于维持人体的生命活动,所以是放热反应,而不是吸热反应,故A错误;
B.核酸是由许多核苷酸聚合而成的生物大分子化合物,在生物体的遗传、变异和蛋白质的生物合成中具有极其重要的作用,故B正确;
C.葡萄糖和果糖的分子式均为C6H12O6,但结构不同,葡萄糖是多羟基醛,果糖是多羟基酮,二者互为同分异构体,故C正确;
D.蛋白质是由氨基酸通过脱水缩合形成的高分子化合物,氨基酸是组成蛋白质的基本结构单位,故D正确;
故选:A。
【点评】本题可根据常见有机物的性质、同分异构体的概念以及生物大分子的相关知识来逐一分析选项。
11.(2024秋 昌平区期末)下列说法不正确的是( )
A.淀粉作为人类重要的能量来源,是由于它能发生水解产生葡萄糖供机体利用
B.纤维素能通过酯化反应得到醋酸纤维素,是由于纤维素分子中含有羟基
C.核糖核苷酸分子间脱水后聚合形成核糖核酸
D.石油经过分馏可得到煤油、柴油等,是利用了物质的溶解性差异
【答案】D
【分析】A.淀粉能发生水解产生葡萄糖;
B.酯化反应是酸和醇发生反应;
C.核糖核苷酸分子间脱水后发生缩合聚合反应形成核糖核酸;
D.因为石油蒸馏时根据各组分的沸点不同,按照不同温度范围先后蒸馏出来的。
【解答】解:A.淀粉能发生水解产生葡萄糖供机体利用,所以淀粉作为人类重要的能量来源,故A正确;
B.酯化反应是羧酸与醇发生的取代反应,纤维素能与醋酸发生酯化反应,醋酸中含羧基,则纤维素中含羟基,故B正确;
C.核糖核苷酸分子间脱水后发生缩合聚合反应形成核糖核酸,故C正确;
D.因为石油蒸馏时根据各组分的沸点不同,按照不同温度范围先后蒸馏出来的,是利用了物质的沸点不同,故D错误;
故选:D。
【点评】本题主要考查糖类、油脂、蛋白质的基础知识,熟悉糖的分类,淀粉纤维素为多糖,二糖和多糖都能水解最终得到单糖。
12.(2018秋 昌平区期末)糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述不正确的是( )
A.葡萄糖不具有还原性
B.淀粉是多糖,可在一定条件下水解
C.油脂属于酯类化合物
D.蛋白质最终能水解成氨基酸
【答案】A
【分析】A、葡萄糖是还原性糖;
B、淀粉是葡萄糖的脱水缩合物;
C、油脂是高级脂肪酸的甘油酯;
D、蛋白质是氨基酸的脱水缩合物。
【解答】解:A、葡萄糖是还原性糖,是还原性糖,故A错误;
B、淀粉是葡萄糖的脱水缩合物,能水解出许多分子的葡萄糖,是多糖,故B正确;
C、油脂是高级脂肪酸的甘油酯,属于酯类,能水解,故C正确;
D、蛋白质是氨基酸的脱水缩合物,能水解出氨基酸,故D正确。
故选:A。
【点评】本题考查了糖类、油脂和蛋白质的结构和性质,难度不大,掌握常见的还原性糖包括葡萄糖和麦芽糖。
13.(2024秋 石景山区期末)明朝宋应星所著的《天工开物》是世界上第一部关于农业和手工业生产的综合性“工艺百科全书”,其中介绍了锌的冶炼方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐(如图所示),泥封,“其底铺薪,发火煅红”,“冷定毁罐取出”。
已知:锌的熔点为419℃,沸点为907℃。
下列说法不正确的是( )
A.冷凝区中,锌由气态转化为液态,理论上该区温度控制在419~907℃
B.“冷定”后“毁罐”取锌的原因是防止Zn在较高的温度下被氧化成ZnO
C.反应区中,ZnCO3分解生成ZnO和CO2
D.反应区中,C与nO发生置换反应得到Zn,C被还原
【答案】D
【分析】A.锌的熔点为419℃,沸点为907℃,据此分析判断;
B.锌为金属,高温下和空气中的氧气反应生成氧化锌;
C.反应区中1100~1300℃,碳酸锌分解生成氧化锌和二氧化碳;
D.碳和氧化锌反应生成锌和一氧化碳。
【解答】解:A.锌的熔点为419℃,沸点为907℃,冷凝区中,锌由气态转化为液态,理论上该区温度控制在419~907℃,故A正确;
B.题干信息可知,“冷定”后“毁罐”取锌的原因是:防止Zn在较高的温度下被氧化成ZnO,故B正确;
C.反应区中1100~1300℃,碳酸锌分解生成氧化锌和二氧化碳,ZnCO3ZnO+CO2↑,故C正确;
D.反应区中,C与ZnO发生置换反应得到Zn反应的化学方程式:C+ZnOZn+CO,C被氧化,故D错误;
故选:D。
【点评】本题考查了物质制备过程的分析判断,主要是氧化还原反应的理解应用,题目难度中等。
14.(2023秋 西城区校级期末)利用“碳捕获与储存”技术可将工厂排放的CO2收集并储存,原理如图所示。
下列说法中,不正确的是( )
A.“碳捕获与储存”有助于缓解温室效应
B.过程Ⅰ中用NaOH溶液“捕获”排放的CO2
C.过程Ⅲ和过程Ⅳ的反应类型分别为分解反应和化合反应
D.上述过程中只有NaOH能够循环利用
【答案】D
【分析】A.根据减少二氧化碳的排放,有助于缓解温室效应进行分析;
B.根据用NaOH溶液“捕获”排放的CO2,进行分析;
C.根据过程Ⅲ为分解反应,过程Ⅳ为化合反应,进行分析;
D.根据NaOH和Ca(OH)2既参与反应,又生成,能够循环利用进行分析。
【解答】解:A.“碳捕获与储存”能减少二氧化碳的排放,有助于缓解温室效应,故A正确;
B.过程Ⅰ中用NaOH溶液“捕获”排放的二氧化碳,发生反应,故B正确;
C.由图知,过程Ⅲ为分解反应,过程Ⅳ为化合反应,故C正确;
D.根据图示可知,氢氧化钠和氢氧化钙既参与反应,又生成,能够循环利用,故D错误;
故选:D。
【点评】本题主要考查“三废”处理与环境保护等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
15.(2023秋 昌平区校级期末)为除去粗盐水中含有的杂质、Ca2+和Mg2+,得到精制食盐,设计了如图实验流程
下列说法不正确的是( )
A.NaOH溶液的作用是除去Mg2+
B.步骤i、ii的顺序可以互换
C.滤液2中有四种离子:Ca2+、Na+、Cl﹣、OH﹣
D.步骤iv中发生的离子反应为:H++OH﹣=H2O、2H+=H2O+CO2↑
【答案】C
【分析】粗盐水中先加入氢氧化钡(或氯化钡)溶液,硫酸根离子与钡离子反应生成硫酸钡沉淀,镁离子与氢氧根离子反应生成氢氧化镁沉淀,过滤后得到溶液A中含有过量的氢氧化钡和钙离子,再加入试剂为碳酸钠,除去过量的钡离子和钙离子,沉淀为碳酸钙和碳酸钡,滤液中加入HCl,除去多余的碳酸钠和氢氧根离子,得到精制食盐水,结晶得到氯化钠。
【解答】解:A.镁离子与氢氧根离子反应生成氢氧化镁沉淀,NaOH溶液的作用是除去Mg2+,故A正确;
B.加入过量氢氧化钡(或氯化钡)溶液是除去硫酸根离子,加入过量氢氧化钠溶液是除去镁离子,加入过量碳酸钠溶液目的是除去钙离子和过量钡离子,则加入氢氧化钠和氢氧化钡(或氯化钡)溶液的顺序可以调换,但是加入碳酸钠必须在加入氢氧化钡(或氯化钡)溶液之后,故B正确;
C.滤液2中除了四种离子:Ca2+、Na+、Cl﹣、OH﹣,还含有过量的钡离子,故C错误;
D.滤液中加入HCl,除去多余的碳酸钠和氢氧根离子,反应为H++OH﹣=H2O、,故D正确;
故选:C。
【点评】本题主要考查粗盐提纯等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
二.解答题(共4小题)
16.(2024秋 西城区期末)人工固氮对于农业生产有重要意义。
(1)工业合成氨。
①N2和H2合成NH3反应的化学方程式是 N2+3H22NH3 。
②下列措施中,既有利于提高合成氨反应限度又有利于增大其反应速率的是 b 。
a.升高温度
b.增大压强
c.使用催化剂
(2)中国科学家研究Cu—Mn合金催化剂电催化还原N2制NH3,装置如图1所示。
①阴极生成NH3其电极反应式是 N2+6H++6e﹣=2NH3 。
②用相同的电解装置和试剂进行实验,证明NH3来自电催化还原N2,需排除以下可能:
ⅰ.环境和电解池中存在微量的NH3
ⅱ.Cu—Mn合金与N2、H2O直接反应生成NH3
下列实验和结果能同时排除ⅰ、ⅱ的是 b 。
资料:自然界中的丰度:14N为99.6%,15N为0.4%。
a.用Ar代替N2进行实验,电解后未检测到NH3
b.用15N2代替N2进行实验,电解后仅检测到15NH3
c.不通电进行实验,未检测到NH3
③NH3的生成速率、NH3和H2的法拉第效率(FE)随阴极的电势变化如图2和图3所示。
资料:ⅰ.相同条件下,阴极的电势越低,电流越大。
ⅱ.某电极上产物B的FE(B)。
阴极的电势由﹣0.2V降到﹣0.3V时,NH3的生成速率增大。阴极的电势继续降低,NH3的生成速率反而减小。结合FE解释NH3的生成速率减小的原因: 阴极的电势继续降低,生成H2的逐渐增多,生成NH3的量逐渐减少,速率减小 。
(3)用滴定法测定溶液中的物质的量浓度的一种方法如下。
Ⅰ.取v1mL含的待测溶液。
Ⅱ.加入过量的V2mLc2mol L﹣1NaOH溶液。
Ⅲ.蒸馏,将蒸出的NH3用过量的V3mLc3mol L﹣1H2SO4溶液吸收。
Ⅳ.加入甲基橙指示剂,用c4mol L﹣1NaOH溶液滴定吸收液中过量的H2SO4消耗的NaOH溶液体积为V4mL,计算待测溶液中的物质的量浓度时用到的溶液体积: V1 和V4。
【答案】(1)①N2+3H22NH3;
②b;
(2)①N2+6H++6e﹣=2NH3;
②b。
③阴极的电势继续降低,生成H2的逐渐增多,生成NH3的量逐渐减少,速率减小;
(3)V1。
【分析】(1)①N2和H2在高温、高压、催化剂的条件下反应,生成NH3;
②a.升高温度,能够加快反应速率,但合成氨反应是放热反应,升高温度,平衡逆向移动;
b.增大压强,反应速率增大,平衡正向移动;
c.使用催化剂只能加快反应速率,不能改变反应限度;
(2)①由图可知,阴极N2和H+得到e﹣生成NH3;
②a.用Ar代替N2进行实验,电解后未检测到NH3,无法确定NH3是否来自电催化还原N2;
b.用15N2代替N2进行实验,电解后仅检测到15NH3,说明15NH3是来自电催化还原15N2;
c.不通电进行实验,未检测到NH3,无法确定NH3是否来自电催化还原N2;
③由图可知阴极的电势继续降低,生成H2的逐渐增多,生成NH3的量逐渐减少,速率减小;
(3)根据题意可知,计算待测溶液中的物质的量浓度时用到的溶液体积:V1和V4,V1是待测溶液的体积,用于计算的物质的量浓度,V4是滴定过量硫酸消耗的NaOH溶液的体积,用于计算蒸出的NH3消耗的V3mLc3mol L﹣1H2SO4溶液中硫酸的物质的量,根据关系式:2~2NH3~H2SO4,进一步计算的物质的量及其浓度。
【解答】解:(1)①N2和H2合成NH3反应的化学方程式是:N2+3H22NH3,
故答案为:N2+3H22NH3;
②a.升高温度,能够加快反应速率,但合成氨反应是放热反应,升高温度,平衡逆向移动,反应限度降低,故a错误;
b.增大压强,反应速率增大,平衡正向移动,反应限度增大,故b正确;
c.使用催化剂只能加快反应速率,不能改变反应限度,故c错误;
故答案为:b;
(2)①由图可知,阴极生成NH3其电极反应式是:N2+6H++6e﹣=2NH3,
故答案为:N2+6H++6e﹣=2NH3;
②a.用Ar代替N2进行实验,电解后未检测到NH3,无法确定NH3是否来自电催化还原N2,故a错误;
b.用15N2代替N2进行实验,电解后仅检测到15NH3,说明15NH3是来自电催化还原15N2,故b正确;
c.不通电进行实验,未检测到NH3,无法确定NH3是否来自电催化还原N2,NH3也可能来自Cu—Mn合金与N2、H2O直接反应生成,故c错误;
故答案为:b。
③由图可知,阴极的电势由﹣0.2V降到﹣0.3V时,NH3的生成速率增大,阴极的电势继续降低,NH3的生成速率反而减小,结合FE解释NH3的生成速率减小的原因是阴极的电势继续降低,生成H2的逐渐增多,生成NH3的量逐渐减少,速率减小,
故答案为:阴极的电势继续降低,生成H2的逐渐增多,生成NH3的量逐渐减少,速率减小;
(3)根据题意可知,计算待测溶液中的物质的量浓度时用到的溶液体积:V1和V4,V1是待测溶液的体积,用于计算的物质的量浓度,V4是滴定过量硫酸消耗的NaOH溶液的体积,用于计算蒸出的NH3消耗的V3mLc3mol L﹣1H2SO4溶液中硫酸的物质的量,根据关系式:2~2NH3~H2SO4,进一步计算的物质的量及其浓度,
故答案为:V1。
【点评】本题主要考查氨气的工业制法,电极反应式的书写,同时考查学生的获取信息的能力,属于基本知识的考查,难度中等。
17.(2024秋 昌平区期末)某小组同学探究不同价态硫元素之间的相互转化。
可以选用的试剂有:①SO2水溶液②Na2SO3溶液③Na2S溶液④稀硫酸⑤浓硫酸⑥品红溶液⑦新制氯水⑧铜片
实验序号 预期的价态转化 选择的试剂(填入试剂编号) 实验现象
ⅰ +6→+4 ⑤⑧ 产生刺激性气味气体
ⅱ +4→0 ②③
产生淡黄色沉淀
ⅲ
+4→+6
①⑦ 黄绿色褪去
(1)实验ⅰ的化学方程式为 Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O 。设计实验证明实现了+6→+4的转化,实验操作及现象是 将产生的气体通入品红溶液中,品红溶液褪色 。
(2)结合实验ⅱ的实验目的,说明选择试剂③的理由是 Na2S中硫元素为﹣2价,具有还原性,可将Na2SO3中+4价硫还原; 。②③溶液混合后,无明显现象,加入稀硫酸后,产生淡黄色沉淀。该实验说明物质的氧化性强弱受 溶液酸碱性 影响。产生淡黄色沉淀的离子方程式为 2S2﹣6H+=3S↓+3H2O 。
(3)实验ⅲ预期的价态转化为 +4→+6 。为验证Cl2被SO2还原为Cl﹣,甲同学向反应后的溶液中加入硝酸酸化的硝酸银溶液,观察是否产生白色沉淀。乙同学认为该方案不合理,理由是 新制氯水中含有Cl﹣,且硝酸具有强氧化性,能将SO2氧化为,干扰Cl﹣的检验 。
【答案】(1)Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O;将产生的气体通入品红溶液中,品红溶液褪色;
(2)Na2S中硫元素为﹣2价,具有还原性,可将Na2SO3中+4价硫还原;溶液酸碱性;2S2﹣6H+=3S↓+3H2O;
(3)+4→+6;新制氯水中含有Cl﹣,且硝酸具有强氧化性,能将SO2氧化为,干扰Cl﹣的检验;
实验ⅱ现象为:产生淡黄色沉淀;
实验ⅲ预期的价态转化:+4→+6。
【分析】(1)实验ⅰ中浓硫酸(H2SO4,S为+6价)与铜片在加热条件下反应生成硫酸铜、二氧化硫(SO2,S为+4价)和水,证明实现了S元素+6价到+4价的转化,即证明有二氧化硫生成,二氧化硫能使品红溶液褪色;
(2)实验ⅱ的实验目的S元素+4价到0价的转化,Na2SO3(S为+4价)具有氧化性,Na2S(S为﹣2价)具有还原性,选择试剂③的理由是Na2S中硫元素为﹣2价,具有还原性,可将Na2SO3中+4价硫还原;②③溶液混合后,无明显现象,加入稀硫酸后,产生淡黄色沉淀(硫单质),说明物质的氧化性强弱受溶液酸碱性影响;
(3)实验ⅲ中SO2水溶液与新制氯水反应,预期的价态转化为+4→+6,甲同学向反应后的溶液中加入硝酸酸化的硝酸银溶液,观察是否产生白色沉淀来验证Cl2被SO2还原为Cl﹣,该方案不合理,因为新制氯水中含有Cl﹣,且硝酸具有强氧化性,能将SO2氧化为,干扰Cl﹣的检验;
【解答】解:(1)实验ⅰ中浓硫酸(H2SO4,S为+6价)与铜片在加热条件下反应生成硫酸铜、二氧化硫(SO2,S为+4价)和水,其反应方程式为:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,证明实现了S元素+6价到+4价的转化,即证明有二氧化硫生成,二氧化硫能使品红溶液褪色,实验现象是:将产生的气体通入品红溶液中,品红溶液褪色,
故答案为:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O;将产生的气体通入品红溶液中,品红溶液褪色;
(2)实验ⅱ的实验目的S元素+4价到0价的转化,Na2SO3(S为+4价)具有氧化性,Na2S(S为﹣2价)具有还原性,选择试剂③的理由是Na2S中硫元素为﹣2价,具有还原性,可将Na2SO3中+4价硫还原;②③溶液混合后,无明显现象,加入稀硫酸后,产生淡黄色沉淀(硫单质),说明物质的氧化性强弱受溶液酸碱性影响,其离子反应方程式为:2S2﹣6H+=3S↓+3H2O,
故答案为:Na2S中硫元素为﹣2价,具有还原性,可将Na2SO3中+4价硫还原;溶液酸碱性;2S2﹣6H+=3S↓+3H2O;
(3)实验ⅲ中SO2水溶液与新制氯水反应,预期的价态转化为+4→+6,甲同学向反应后的溶液中加入硝酸酸化的硝酸银溶液,观察是否产生白色沉淀来验证Cl2被SO2还原为Cl﹣,该方案不合理,因为新制氯水中含有Cl﹣,且硝酸具有强氧化性,能将SO2氧化为,干扰Cl﹣的检验,
故答案为:+4→+6;新制氯水中含有Cl﹣,且硝酸具有强氧化性,能将SO2氧化为,干扰Cl﹣的检验。
【点评】本题主要考查硫及其化合物的性质及应用,考查学生的实验分析和探究能力,及其不同价态硫的转化,为综合性较强且难度较大的题型。
18.(2024秋 朝阳区期末)以黄铁矿为原料制取硫酸的原理示意图如图。
(1)黄铁矿在通空气前需粉碎,其作用是 增大接触面积,加快反应速率 。
(2)反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1是制硫酸的关键步骤。使用V2O5作催化剂,涉及如下反应:
ⅰ.V2O5(s)+SO2(g) V2O4(s)+SO3(g)ΔH1=+24kJ mol﹣1
ⅱ._____+2SO3(g) _____ΔH2=_____kJ mol﹣1
ⅲ.2VOSO4(s)(g)ΔH3=+277kJ mol﹣1
①补全反应ⅱ的热化学方程式:
V2O4(s) +2SO3(g) 2VOSO4(s) ΔH2= ﹣399 kJ mol﹣1
②下列说法不正确的是 abc (填序号)。
a.反应ⅰ和ⅱ均属于氧化还原反应
b.投入1mol V2O5,最多制得1mol SO3
c.使用V2O5能提高SO2的平衡转化率
(3)在体积可变的恒压密闭容器中投入8mol SO(g)11.7mol O2(g)和43.3mol N2(g),不同条件下发生反应Ⅱ。实验测得在0.1MPa、0.5MPa和5.0MPa压强下,SO2平衡转化率(α)随温度的变化如图所示。
①0.1MPa、550℃时SO2平衡转化率α= 0.85 ,判断依据是 该反应是气体分子数减小的反应,其它条件相同时,增大压强平衡正向进行,二氧化硫转化率增大,p3=0.1MPa 。
②工业上通常采用400~500℃和常压(0.1MPa)的条件,采用常压的原因是 400~500℃和常压(0.1MPa)的条件时,二氧化硫转化率已经很高,增大压强对材料、设备、动力要求更高,生产成本增加 。
③M点对应的平衡混合气体的体积为VL,计算该温度下反应Ⅱ的平衡常数 K= 10V 。
(4)测定尾气中SO2的含量。用氨基磺酸铵和硫酸铵的混合溶液吸收aL尾气,将SO2转化为H2SO3,然后用淀粉作指示剂,用cmol L﹣1I2标准溶液进行滴定,消耗I2标准溶液vmL。则尾气中SO2的含量为 mg L﹣1。
已知:H2SO3+I2+H2O═H2SO4+2HI
【答案】(1)增大接触面积,加快反应速率;
(2)①V2O4(s);2VOSO4(s);﹣399;
②abc;
(3)①0.85;该反应是气体分子数减小的反应,其它条件相同时,增大压强平衡正向进行,二氧化硫转化率增大,p3=0.1MPa;
②400~500℃和常压(0.1MPa)的条件时,二氧化硫转化率已经很高,增大压强对材料、设备、动力要求更高,生产成本增加;
③10V;
(4)。
【分析】黄铁矿和空气中的O2在加热条件下发生反应,生成SO2和Fe3O4,SO2和空气中的O2在400~500℃、常压、催化剂的作用下发生反应得到SO3,用98.3%的浓硫酸吸收SO3,得到H2SO4,结合问题分析判断和计算应用,
(1)矿石粉碎可以增大接触面积,加快反应速率;
(2)①反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1是制硫酸的关键步骤,使用V2O5作催化剂,涉及如下反应,ⅰ.V2O5(s)+SO2(g) V2O4(s)+SO3(g)ΔH1=+24kJ mol﹣1,ⅲ.2VOSO4(s)(g)ΔH3=+277kJ mol﹣1,结合盖斯定律计算得到,反应Ⅱ(i+ii+iii)得到反应ii;
②a.反应ⅱ不属于氧化还原反应;
b.投入1mol V2O5,反应为可逆反应;
c.催化剂改变反应速率,不能改变平衡;
(3)①体积可变的恒压密闭容器中投入8mol SO2(g)11.7mol O2(g)和43.3mol N2(g),不同条件下发生反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1,实验测得在0.1MPa、0.5MPa和5.0MPa压强下,SO2平衡转化率(α)随温度的变化如图所示,反应是气体体积减小的反应,增大压强,平衡正向进行,二氧化硫转化率增大,则p1、p2、p3分别为5.0MPa压强、0.5MPa、0.1MPa,p3=0.1MPa时;
②400~500℃和常压(0.1MPa)的条件时,二氧化硫转化率已经很高,增大压强,会增大设备成本;
③体积可变的恒压密闭容器中投入8mol SO(g)11.7mol O2(g)和43.3mol N2(g),不同条件下发生反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1,M点对应的平衡混合气体的体积为VL,p3=0.1MPa,二氧化硫转化率90%,结合三段式列式计算,
2SO2(g)+O2(g) 2SO3(g)
起始量(mol) 8 11.7 0
变化量(mol)7.2 3.6 7.2
平衡量(mol) 0.8 8.1 7.2
计算该温度下反应Ⅱ的平衡常数 K;
(4)用氨基磺酸铵和硫酸铵的混合溶液吸收aL尾气,将SO2转化为H2SO3,然后用淀粉作指示剂,用cmol L﹣1I2标准溶液进行滴定,H2SO3+I2+H2O═H2SO4+2HI,消耗I2标准溶液vmL,硫元素守恒计算得到尾气中SO2的含量。
【解答】解:(1)黄铁矿在通空气前需粉碎,其作用是增大接触面积,加快反应速率,
故答案为:增大接触面积,加快反应速率;
(2)①反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1是制硫酸的关键步骤,使用V2O5作催化剂,涉及如下反应,ⅰ.V2O5(s)+SO2(g) V2O4(s)+SO3(g)ΔH1=+24kJ mol﹣1,ⅲ.2VOSO4(s)(g)ΔH3=+277kJ mol﹣1,结合盖斯定律计算得到,反应Ⅱ(i+ii+iii)得到反应ii为:ⅱ.V2O4(s)+2SO3(g) 2VOSO4(s),ΔH2=﹣399kJ mol﹣1,
故答案为:V2O4(s);2VOSO4(s);﹣399;
②a.反应ⅱ不属于氧化还原反应,故a错误;
b.投入1mol V2O5,反应为可逆反应,不能制得1mol SO3,故b错误;
c.催化剂改变反应速率,不能改变平衡,使用V2O5不能能提高SO2的平衡转化率,故c错误;
故答案为:abc;
(3)①体积可变的恒压密闭容器中投入8mol SO2(g)11.7mol O2(g)和43.3mol N2(g),不同条件下发生反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1,实验测得在0.1MPa、0.5MPa和5.0MPa压强下,SO2平衡转化率(α)随温度的变化如图所示,反应是气体体积减小的反应,增大压强,平衡正向进行,二氧化硫转化率增大,则p1、p2、p3分别为5.0MPa压强、0.5MPa、0.1MPa,p3=0.1MPa时,图中得到对应二氧化硫转化率0.85,
故答案为:0.85;该反应是气体分子数减小的反应,其它条件相同时,增大压强平衡正向进行,二氧化硫转化率增大,p3=0.1MPa;
②工业上通常采用400~500℃和常压(0.1MPa)的条件,采用常压的原因是:400~500℃和常压(0.1MPa)的条件时,二氧化硫转化率已经很高,增大压强对材料、设备、动力要求更高,生产成本增加,
故答案为:400~500℃和常压(0.1MPa)的条件时,二氧化硫转化率已经很高,增大压强对材料、设备、动力要求更高,生产成本增加;
③体积可变的恒压密闭容器中投入8mol SO(g)11.7mol O2(g)和43.3mol N2(g),不同条件下发生反应Ⅱ:2SO2(g)+O2(g) 2SO3(g)ΔH=﹣196kJ mol﹣1,M点对应的平衡混合气体的体积为VL,p3=0.1MPa,二氧化硫转化率90%,结合三段式列式计算,
2SO2(g)+O2(g) 2SO3(g)
起始量(mol) 8 11.7 0
变化量(mol)7.2 3.6 7.2
平衡量(mol) 0.8 8.1 7.2
计算该温度下反应Ⅱ的平衡常数 K10V,
故答案为:10V;
(4)用氨基磺酸铵和硫酸铵的混合溶液吸收aL尾气,将SO2转化为H2SO3,然后用淀粉作指示剂,用cmol L﹣1I2标准溶液进行滴定,H2SO3+I2+H2O═H2SO4+2HI,消耗I2标准溶液vmL,硫元素守恒计算得到尾气中SO2的含量mg L﹣1,
故答案为:。
【点评】本题考查盖斯定律、化学平衡计算等知识点,把握化学反应原理及各个物理量关系是解本题关键,难点是化学平衡计算,注意知识的熟练掌握,题目难度中等。
19.(2023春 房山区期末)研究有机化合物中的典型代表物,对于有机合成的研究有重要意义。
(1)乙醇是醇类物质的典型代表物,乙醇分子结构中的各种化学键如图1所示:
①由乙醇制备乙烯的反应断键位置是 ①④ (填序号),该反应的类型属于 消去反应 。
②乙醇氧化可转化为乙醛,该反应断键位置是 ③⑤ (填序号)。
(2)乙酸乙酯是酯类物质的典型代表物,广泛用于药物、染料、香料等工业。实验室用无水乙醇、冰醋酸和浓硫酸反应可制备乙酸乙酯,常用装置如图2所示。
①写出无水乙醇、冰醋酸和浓硫酸反应制备乙酸乙酯的化学方程式 CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O 。
②试管X中的试剂为 饱和Na2CO3溶液 ,作用是 除去乙酸,吸收乙醇,降低乙酸乙酯溶解度 。
③为提高反应速率或限度,实验中采取的措施及对应理由不正确的是 c (填字母)。
a.浓硫酸可做催化剂,提高化学反应速率
b.浓硫酸可做吸水剂,促进反应向生成乙酸乙酯的反应移动
c.已知该反应为放热反应,升高温度可同时提高化学反应速率和反应限度
(3)三种常见羧酸的pKa数值如下表(pKa数值越小,酸性越强)。乙酸中的﹣CH3具有推电子作用,使羧基中羟基的极性减小,从而难以电离出H+,故乙酸的酸性比甲酸的酸性弱。
羧酸 甲酸(HCOOH) 乙酸(CH3COOH) 三氯乙酸(CCl3COOH)
pKa 3.75 4.76 0.65
请比较乙酸与三氯乙酸的酸性强弱并解释原因 三氯乙酸的酸性比CH3COOH更强,因为Cl的电负性大,有吸电子作用,使CCl3COOH中羟基极性增大,从而更易电离出H+ 。
【答案】(1)①:①④;消去反应;
②:③⑤;
(2)①CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;
②饱和Na2CO3溶液;除去乙酸,吸收乙醇,降低乙酸乙酯溶解度;
③c;
(3)三氯乙酸的酸性比CH3COOH更强,因为Cl的电负性大,有吸电子作用,使CCl3COOH中羟基极性增大,从而更易电离出H+。
【分析】(1)①由乙醇制备乙烯的反应是脱去羟基和β﹣H,该反应属于消去反应;
②乙醇催化氧化可转化为乙醛脱去的羟基H和α﹣H;
(2)①无水乙醇、冰醋酸和浓硫酸反应生成 CH3COOCH2CH3、H2O;
②试管X中的试剂为饱和Na2CO3溶液,作用是除去乙酸,吸收乙醇,降低乙酸乙酯溶解度;
③a.催化剂可以提高化学反应速率;
b.浓硫酸可做吸水剂,即减小生成物的浓度,平衡正向移动;
c.升高温度可提高化学反应速率,但平衡向吸热反应方向移动;
(3)因为Cl的电负性大,有吸电子作用,使CCl3COOH中羟基极性增大,从而更易电离出H+。
【解答】解:(1)①由乙醇制备乙烯的反应断键位置是①④,该反应的类型属于消去反应,
故答案为:①④;消去反应;
②乙醇氧化可转化为乙醛,该反应断键位置是③⑤,
故答案为:③⑤;
(2)①无水乙醇、冰醋酸和浓硫酸反应制备乙酸乙酯的化学方程式为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;
②试管X中的试剂为饱和Na2CO3溶液,作用是除去乙酸,吸收乙醇,降低乙酸乙酯溶解度,
故答案为:饱和Na2CO3溶液;除去乙酸,吸收乙醇,降低乙酸乙酯溶解度;
③a.浓硫酸可做催化剂,可以提高化学反应速率,故a正确;
b.浓硫酸可做吸水剂,即减小生成物的浓度,促进反应向生成乙酸乙酯的反应移动,故b正确;
c.已知该反应为放热反应,升高温度可提高化学反应速率,但不能提高反应的限度,因为升高温度,平衡逆向移动,故c错误;
故答案为:c;
(3)因为Cl的电负性大,有吸电子作用,使CCl3COOH中羟基极性增大,从而更易电离出H+,故三氯乙酸的酸性比CH3COOH更强,
故答案为:三氯乙酸的酸性比CH3COOH更强,因为Cl的电负性大,有吸电子作用,使CCl3COOH中羟基极性增大,从而更易电离出H+。
【点评】本题主要考查乙醇的相关知识,属于基本知识的考查,难度不大。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
