【中考押题预测】2025年中考化学核心考点考前冲刺 化学方程式的计算(含解析)
文档属性
| 名称 | 【中考押题预测】2025年中考化学核心考点考前冲刺 化学方程式的计算(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-15 16:27:15 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
中考核心考点 化学方程式的计算
一.选择题(共10小题)
1.(2025 河南二模)一定量的甲烷与氧气在密闭容器中恰好完全反应,生成一氧化碳、二氧化碳和水蒸气,则混合气中氧元素的质量分数不可能是下列的( )
A.74.2% B.76.5% C.77.8% D.78.9%
2.(2025 河南模拟)现有相等质量的四种燃料:①甲烷、②一氧化碳、③乙醇、④甲醇(CH3OH),分别在氧气中充分燃烧,产生二氧化碳的质量由小到大的顺序是( )
A.④<③<②<① B.②<①<④<③ C.①<②<③<④ D.④<②<③<①
3.(2025 京口区模拟)已知:,Cu2(OH)3Cl+3HCl=2CuCl2+3H2O某同学称取废铜屑9.4g【Cu含杂质Cu2(OH)2CO3(相对分子质量222)和Cu2(OH)3Cl(相对分子质量214.5)】,在空气中充分加热至质量不变为止,测得剩余固体质量为9g。将加热时生成的气体全部通入足量的AgNO3溶液,得到沉淀2.87g。下列说法不正确的是( )
A.固体中含铜元素质量为7.2g
B.加热时生成HCl质量0.73g
C.废铜屑中Cu2(OH)2CO3和Cu2(OH)3Cl的质量比为111:429
D.该废铜屑与10%稀盐酸恰好完全反应时,消耗稀盐酸质量为82.1g
4.(2025春 宁阳县月考)3g的碳和10g的氧气完全反应,产生二氧化碳的质量是( )
A.13g B.11g C.大于11g D.小于11g
5.(2025春 绥化月考)含有氢气和氧气的混合气体共10g,点燃充分反应后,恢复到室温,气体质量减少了9g,则原混合气体中的成分可能是( )
A.1g氢气和9g氧气
B.氢气和氧气的质量比为1:80
C.5g氢气和5g氧气
D.3g氢气和7g氧气
6.(2025 郑州模拟)将3g某金属混合物放入烧杯中,向其中加入50g稀盐酸恰好完全反应,烧杯中剩余物的总质量是52.9g,该混合物不可能是( )
A.Mg、Al B.Fe、Zn C.Cu、Fe D.Cu、Al
7.(2025 郑州二模)取铁粉、氧化铁粉末、四氧化三铁粉末的混合物60g,通入足量的一氧化碳,高温条件下充分反应,冷却后称得剩余固体质量为44g,则原固体混合物中铁粉的质量可能是( )
A.38g B.16g C.10g D.5g
8.(2025 朝阳区模拟)消防员在进入火灾现场时,佩戴的呼吸面罩中有过氧化钠,过氧化钠与二氧化碳发生反应:2Na2O2+2CO2=2Na2CO3+O2。在真空密闭容器中,将13.2gCO2与一定质量的N2O2固体充分反应后,收集到气体M质量为xg。下列说法错误的是( )
A.若x=4.8,气体M中不含有CO2
B.若x=4.8,生成的Na2CO3的质量为31.8g
C.若x=7.6,Na2O2反应后可能有剩余
D.若x=7.6,气体M中有CO2与O2
9.(2025春 青岛月考)取一定质量的CaCO3固体高温加热一段时间后,冷却,测得剩余固体的质量为8.0g,其中,钙元素的质量分数为50.0%。下列判断正确的是( )
A.原来CaCO3的质量为14.5g
B.生成2.0gCO2气体
C.剩余8.0g固体为纯净物
D.剩余8.0g固体中加入稀盐酸无气泡产生
10.(2025 淄博一模)工业上,高温煅烧石灰石可制取生石灰,发生反应CaCO3CaO+CO2↑.把6.0gCaCO3高温煅烧段时间后,剩余固体的质量为3.8g。下列推断不符合客观事实的是( )
A.生成CO2的质量是2.2g
B.生成物中Ca O的质量是2.8g
C.剩余固体中钙元素的质量分数为52.6%
D.剩余固体中碳、氧元素质量比为3:32
二.计算题(共10小题)
11.(2025 邯郸二模)实验室有一瓶含少量杂质的高锰酸钾试剂,某兴趣小组的同学为了测定其中高锰酸钾的质量分数,设计图1装置制取氧气(完全反应),实验过程中称量反应前后固体的质量,相关数据如图2所示。请计算:
(1)产生O2的质量为 g;
(2)完全反应后,试管中固体的成分是 ;
(3)计算该样品中高锰酸钾的质量分数是多少?(计算结果精确到0.1%)
12.(2025 东营一模)如图是厨房中某品牌食用纯碱的成分表,兴趣小组同学称取16g样品置于烧杯中,并将烧杯放在电子天平上,加入50g稀盐酸(足量),用玻璃棒不断搅拌,每分钟记录一次天平示数,具体数据如表:
时间(分钟) 0 1 2 3 4 5 6
天平示数(g) 116.0 112.7 110.5 109.4 109.4 109.4 109.4
(1)玻璃棒的作用是 。
(2)分析表中数据可知,第 分钟,样品与稀盐酸已完全反应。完全反应时产生气体的总质量是 g。
(3)计算样品中碳酸钠的质量(写出计算过程)
(4)若实验中使用浓盐酸,会导致碳酸钠的质量分数测量结果 (选填“不变”、“偏小”或“偏大”)。
13.(2025 福山区一模)小苏打是发酵粉的主要成分,可用于制作发面食品。化学兴趣小组为测定某品牌小苏打样品(含杂质氯化钠)中碳酸氢钠的含量做了如下实验:将该样品20.0g放入锥形瓶中,加水全部溶解后,得到208.8g样品溶液,向该样品溶液中不断加入稀盐酸,反应过程中锥形瓶中溶液质量的变化如表所示(忽略二氧化碳在水中的溶解)。
加入稀盐酸的总质量/g 25 50 75
锥形瓶中溶液的质量/g 229.4 250 275
相关反应方程式:NaHCO3+HCl=NaCl+H2O+CO2↑
试计算:(1)恰好完全反应时,生成二氧化碳的总质量为 g,当加入75g稀盐酸时,充分反应后所得溶液中的微粒有 (填化学符号)。
(2)小苏打样品中碳酸氢钠的质量分数(写出计算过程,计算结果精确到0.1%)。
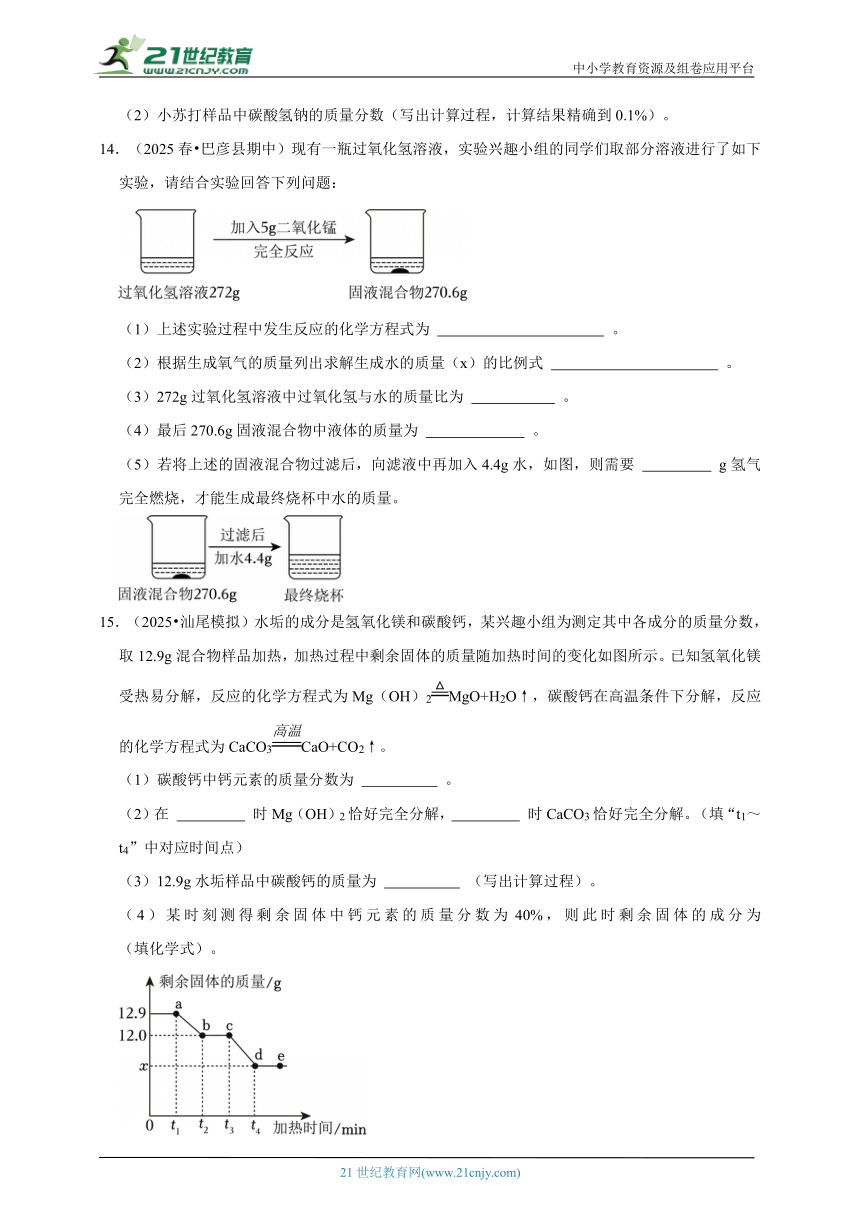
14.(2025春 巴彦县期中)现有一瓶过氧化氢溶液,实验兴趣小组的同学们取部分溶液进行了如下实验,请结合实验回答下列问题:
(1)上述实验过程中发生反应的化学方程式为 。
(2)根据生成氧气的质量列出求解生成水的质量(x)的比例式 。
(3)272g过氧化氢溶液中过氧化氢与水的质量比为 。
(4)最后270.6g固液混合物中液体的质量为 。
(5)若将上述的固液混合物过滤后,向滤液中再加入4.4g水,如图,则需要 g氢气完全燃烧,才能生成最终烧杯中水的质量。
15.(2025 汕尾模拟)水垢的成分是氢氧化镁和碳酸钙,某兴趣小组为测定其中各成分的质量分数,取12.9g混合物样品加热,加热过程中剩余固体的质量随加热时间的变化如图所示。已知氢氧化镁受热易分解,反应的化学方程式为Mg(OH)2MgO+H2O↑,碳酸钙在高温条件下分解,反应的化学方程式为CaCO3CaO+CO2↑。
(1)碳酸钙中钙元素的质量分数为 。
(2)在 时Mg(OH)2恰好完全分解, 时CaCO3恰好完全分解。(填“t1~t4”中对应时间点)
(3)12.9g水垢样品中碳酸钙的质量为 (写出计算过程)。
(4)某时刻测得剩余固体中钙元素的质量分数为40%,则此时剩余固体的成分为 (填化学式)。
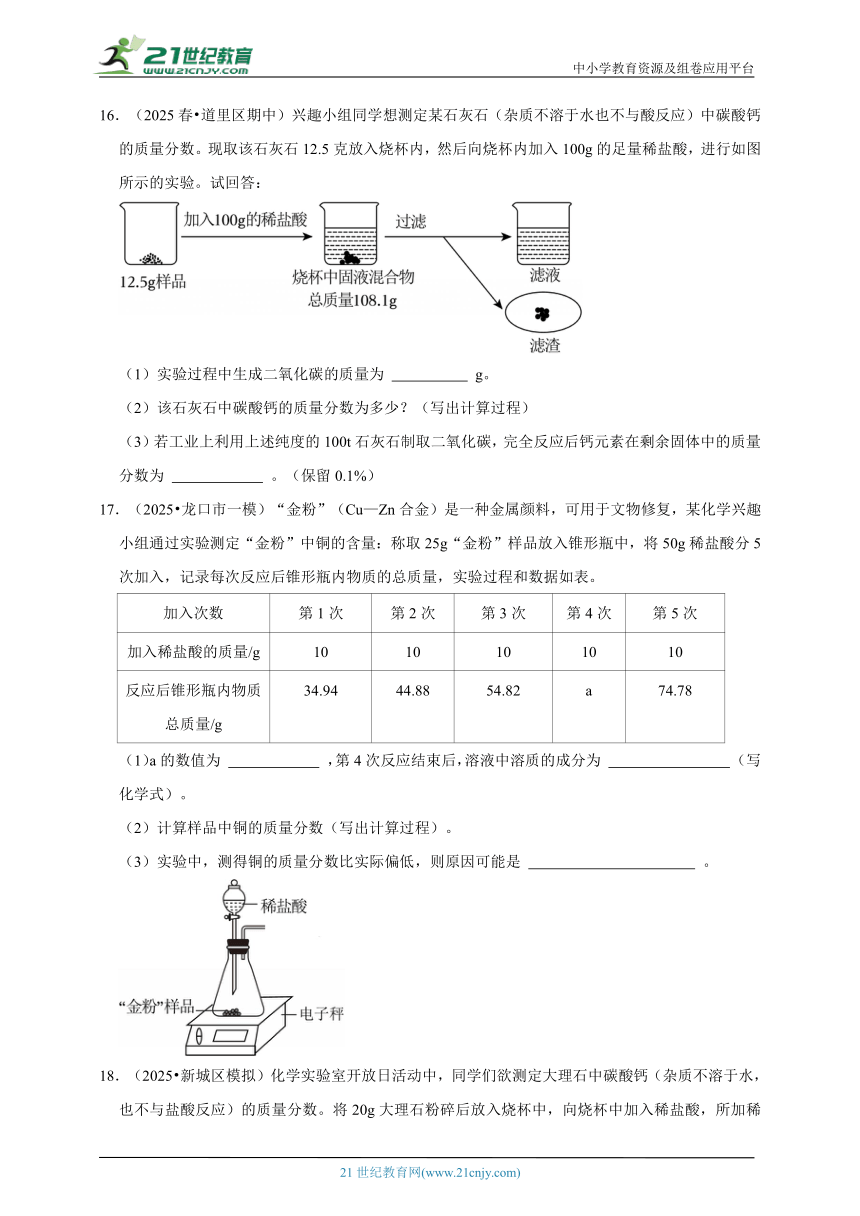
16.(2025春 道里区期中)兴趣小组同学想测定某石灰石(杂质不溶于水也不与酸反应)中碳酸钙的质量分数。现取该石灰石12.5克放入烧杯内,然后向烧杯内加入100g的足量稀盐酸,进行如图所示的实验。试回答:
(1)实验过程中生成二氧化碳的质量为 g。
(2)该石灰石中碳酸钙的质量分数为多少?(写出计算过程)
(3)若工业上利用上述纯度的100t石灰石制取二氧化碳,完全反应后钙元素在剩余固体中的质量分数为 。(保留0.1%)
17.(2025 龙口市一模)“金粉”(Cu—Zn合金)是一种金属颜料,可用于文物修复,某化学兴趣小组通过实验测定“金粉”中铜的含量:称取25g“金粉”样品放入锥形瓶中,将50g稀盐酸分5次加入,记录每次反应后锥形瓶内物质的总质量,实验过程和数据如表。
加入次数 第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量/g 10 10 10 10 10
反应后锥形瓶内物质总质量/g 34.94 44.88 54.82 a 74.78
(1)a的数值为 ,第4次反应结束后,溶液中溶质的成分为 (写化学式)。
(2)计算样品中铜的质量分数(写出计算过程)。
(3)实验中,测得铜的质量分数比实际偏低,则原因可能是 。
18.(2025 新城区模拟)化学实验室开放日活动中,同学们欲测定大理石中碳酸钙(杂质不溶于水,也不与盐酸反应)的质量分数。将20g大理石粉碎后放入烧杯中,向烧杯中加入稀盐酸,所加稀盐酸的质量与生成气体的质量关系如图所示。
(1)A点对应溶液中的溶质是 。
(2)加入50g稀盐酸时生成二氧化碳的质量是 。
(3)计算大理石中碳酸钙的质量分数。
19.(2025 利津县一模)如图是碳酸钙D3片标签的部分信息。化学社团为测定该药片中碳酸钙的量是否与标签相符,进行实验:取8片药片研碎后,分6次加入质量分数为7.3%的稀盐酸溶液150g,充分反应。实验相关数据如表格所示(假设其他成分不参加反应)。
盐酸质量(g) 25 50 75 100 125 150
CO2的质量(g) 1.1 2.2 3.3 4.4 4.4 4.4
(1)恰好完全反应时消耗稀盐酸的质量为 g。
(2)计算每片药片中碳酸钙质量并判断是否与标签相符。(写出计算过程)
20.(2025 香坊区二模)某钢铁厂实验室为了测定赤铁矿中Fe2O3的含量,将矿石粉碎(杂质既不溶于水,也不与酸反应)加入稀硫酸,进行如下实验。请回答问题:
(1)发生反应的化学方程式为 。
(2)将矿石粉碎的目的是 。
(3)该矿石中Fe2O3的含量为 。
(4)a的数值为 。
(5)若用460t上述赤铁矿炼铁,炼铁过程中矿石利用率为80%,则可以得到含铁92%的生铁的质量为 。
中考核心考点 化学方程式的计算
参考答案与试题解析
一.选择题(共10小题)
1.(2025 河南二模)一定量的甲烷与氧气在密闭容器中恰好完全反应,生成一氧化碳、二氧化碳和水蒸气,则混合气中氧元素的质量分数不可能是下列的( )
A.74.2% B.76.5% C.77.8% D.78.9%
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】A
【分析】根据甲烷完全燃烧生成二氧化碳和水,甲烷燃烧生成一氧化碳和水分别计算氧元素的质量分数,进一步分析。
【解答】解:设甲烷的质量为x,
若完全燃烧生成二氧化碳和水,则:
CH4+2O2CO2+2H2O
16 64
x 4x
根据质量守恒定律可知,混合气中氧元素的质量分数为:;
若完全燃烧生成一氧化碳和水,则:
2CH4+3O22CO+4H2O
32 96
x 3x
根据质量守恒定律可知,混合气中氧元素的质量分数为:;
所以一定量的甲烷与氧气在密闭容器中恰好完全反应,生成一氧化碳、二氧化碳和水蒸气,则混合气中氧元素的质量分数在75%﹣80%之间。
故选:A。
【点评】本题主要考查了根据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
2.(2025 河南模拟)现有相等质量的四种燃料:①甲烷、②一氧化碳、③乙醇、④甲醇(CH3OH),分别在氧气中充分燃烧,产生二氧化碳的质量由小到大的顺序是( )
A.④<③<②<① B.②<①<④<③ C.①<②<③<④ D.④<②<③<①
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】D
【分析】甲烷燃烧生成二氧化碳和水,一氧化碳燃烧生成二氧化碳,乙醇燃烧生成二氧化碳和水,甲醇燃烧生成二氧化碳和水,根据质量守恒定律,化学反应前后元素的种类和质量不变,四种燃料中的碳元素完全转化到了二氧化碳中进行分析。
【解答】解:根据质量守恒定律,化学反应前后元素的种类和质量不变,四种燃料中的碳元素完全转化到了二氧化碳中,四种燃料的质量相等,则四种燃料中碳元素的质量分数越大,充分燃烧生成二氧化碳的质量越大,甲烷中碳元素的质量分数为:,一氧化碳中碳元素的质量分数:,乙醇中碳元素的质量分数为:,甲醇中碳元素的质量分数为:,故产生二氧化碳的质量由小到大的顺序是:④<②<③<①。
故选:D。
【点评】本题主要考查了根据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
3.(2025 京口区模拟)已知:,Cu2(OH)3Cl+3HCl=2CuCl2+3H2O某同学称取废铜屑9.4g【Cu含杂质Cu2(OH)2CO3(相对分子质量222)和Cu2(OH)3Cl(相对分子质量214.5)】,在空气中充分加热至质量不变为止,测得剩余固体质量为9g。将加热时生成的气体全部通入足量的AgNO3溶液,得到沉淀2.87g。下列说法不正确的是( )
A.固体中含铜元素质量为7.2g
B.加热时生成HCl质量0.73g
C.废铜屑中Cu2(OH)2CO3和Cu2(OH)3Cl的质量比为111:429
D.该废铜屑与10%稀盐酸恰好完全反应时,消耗稀盐酸质量为82.1g
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】D
【分析】根据,Cu2(OH)3Cl+3HCl=2CuCl2+3H2O,结合题干中的数据进行分析计算。
【解答】解:A、,碱式碳酸铜加热分解生成氧化铜、水和二氧化碳,铜在空气中加热和氧气反应生成氧化铜。所以剩余固体质量为9g,都是氧化铜,则铜元素的质量为,故正确;
B、加热生成的气体通入硝酸银得到2.87g沉淀,说明排出的气体中有氯化氢。设氯化氢质量为x,
HCl+AgNO3═AgCl↓+HNO3
36.5 143.5
x 2.87g
x=0.73g。所以加热时生成HCl质量0.73g,故正确;
C、根据Cu2(OH)3Cl2CuO+H2O+HCl↑
214.5 160 36.5
4.29g 3.2g 0.73g
可知,0.73g氯化氢需要分解4.29g Cu2(OH)3Cl得到,同时生成3.2g氧化铜。假设废铜屑中Cu2(OH)2CO3和Cu2(OH)3Cl的质量比为111:429,则有Cu2(OH)2CO3的质量为1.11g,铜的质量为9.4g﹣4.29g﹣1.11g=4g。
Cu2(OH)2CO32CuO+H2O+CO2↑,
222 160
1.11g 0.8g
2Cu+O22CuO
128 160
4g 5g
5g+0.8g+3.2g=9g,与剩余固体质量9g相等。所以废铜屑中Cu2(OH)2CO3和Cu2(OH)3Cl的质量比为111:429,故正确;
D、铜和稀盐酸不反应。
Cu2(OH)3Cl+3HCl=2CuCl2+3H2O
214.5 109.5
4.29g 2.19g
Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑
222 146
1.11g 0.73g
29.2g≠82.1g,故错误;
故选:D。
【点评】本题主要考查了根据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
4.(2025春 宁阳县月考)3g的碳和10g的氧气完全反应,产生二氧化碳的质量是( )
A.13g B.11g C.大于11g D.小于11g
【考点】不含杂质的化学方程式计算;有关质量守恒定律的计算.
【专题】有关化学方程式的计算.
【答案】B
【分析】根据碳与氧气反应的化学方程式,得出各物质之间的质量的比例式,就可计算出3克碳与氧气完全反应所需的氧气质量和生成二氧化碳的质量来分析解答。
【解答】解:由化学方程式C+O2CO2可知,参加反应的碳与氧气的质量比是3:8,则3g碳与8g氧气恰好完全反应,有2g氧气没有反应,根据质量守恒定律,产生二氧化碳的质量是3g+8g=11g。
故选:B。
【点评】本题主要考查学生运用化学方程式和物质之间反应的质量关系综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力。
5.(2025春 绥化月考)含有氢气和氧气的混合气体共10g,点燃充分反应后,恢复到室温,气体质量减少了9g,则原混合气体中的成分可能是( )
A.1g氢气和9g氧气
B.氢气和氧气的质量比为1:80
C.5g氢气和5g氧气
D.3g氢气和7g氧气
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】A
【分析】氢气和氧气的混合气体共10g,点燃充分反应后,恢复到室温,气体质量减少了9g,说明反应的气体质量为9g,剩余气体1g,则根据质量守恒定律可知生成水的质量为9g,利用化学反应方程式可求出参加反应的氢气和氧气的质量来分析解答。
【解答】解:A、由上面分析可知,生成水的质量为9g,
设参加反应的氢气和氧气的质量分别为x、y,
2H2+O22H2O
4 32 36
x y 9g
x=1g
y=8g
剩余气体为1g,若为氢气,则原混合气体中氢气的质量可能为1g+1g=2g,氧气为8g,若为氧气,则原混合气体中氧气气的质量可能为1g+8g=9g,氢气为1g,故A正确;
B、由A中分析可知,氢气和氧气的质量分别为2g和8g或1g和9g,则比为氢气和氧气的质量2:8或1:9,故B错误;
C、由A中分析可知,氢气和氧气的质量分别为2g和8g或1g和9g,故C错误;
D、由A中分析可知,氢气和氧气的质量分别为2g和8g或1g和9g,故D错误;
故选:A。
【点评】在解此类题时,首相根据体重的条件列出关系式,解出题中需要的量,然后结合题意再进一步解答。
6.(2025 郑州模拟)将3g某金属混合物放入烧杯中,向其中加入50g稀盐酸恰好完全反应,烧杯中剩余物的总质量是52.9g,该混合物不可能是( )
A.Mg、Al B.Fe、Zn C.Cu、Fe D.Cu、Al
【考点】根据化学反应方程式的计算;根据计算结果推断金属混合物的组成.
【专题】金属与金属材料.
【答案】A
【分析】根据反应前后元素种类不变,则可知生成氢气的质量为3g+50g﹣52.9g=0.1g,则说明生成0.1g氢气时,分别需要一种金属的质量大于3g,另一种金属的质量小于3g。
【解答】A、设分别生成0.1g氢气时,需要的镁和铝的质量分别为x、y,则
Mg+2HCl═MgCl2+H2↑
24 2
x 0.1g
x=1.2g
2Al+6HCl=2AlCl3+3H2↑
54 6
y 0.1g
y=0.9g
需要镁和铝的质量均小于3g,则不可能为镁和铝,故选项符合题意;
B、设分别需要的铁和锌的质量分别为m、n,则
Fe+2HCl═FeCl2+H2↑
56 2
m 0.1g
x=2.8g
Zn+2HCl═ZnCl2+H2↑
65 2
n 0.1g
y=3.25g
需要铁的质量小于3g,需要锌的质量大于3g,则可能为铁和锌,故选项不符合题意;
C、铜不能和盐酸反应,需要的铁的质量小于3g,则可能为铜和铁,故选项不符合题意;
D、铜不能和盐酸反应,需要铝的质量小于3g,则可能为铜和铝,故选项不符合题意。
故选:A。
【点评】本题主要考查了根据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
7.(2025 郑州二模)取铁粉、氧化铁粉末、四氧化三铁粉末的混合物60g,通入足量的一氧化碳,高温条件下充分反应,冷却后称得剩余固体质量为44g,则原固体混合物中铁粉的质量可能是( )
A.38g B.16g C.10g D.5g
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】D
【分析】根据铁和一氧化碳不反应,氧化铁和一氧化碳在高温的条件下生成铁和二氧化碳,四氧化三铁和一氧化碳在高温的条件下生成铁和二氧化碳,由题中数据结合化学方程式的计算来分析。
【解答】解:取铁粉、氧化铁粉末、四氧化三铁粉末的混合物60g,通入足量的一氧化碳,高温条件下充分反应,冷却后称得剩余固体质量为44g,铁和一氧化碳不反应,氧化铁和一氧化碳在高温的条件下生成铁和二氧化碳,四氧化三铁和一氧化碳在高温的条件下生成铁和二氧化碳;
假设固体中只有铁粉和氧化铁粉末,氧化铁和一氧化碳反应的化学方程式及其质量关系如下:
Fe2O3+3CO2Fe+3CO2 固体质量差
160 112 160﹣112=48
g 60g﹣44g=16g
此时原混合物中铁粉的质量为:60ggg;
假设固体中只有铁粉和四氧化三铁粉末,四氧化三铁和一氧化碳反应的化学方程式及其质量关系如下:
Fe3O4+4CO3Fe+4CO2 固体质量差
232 168 232﹣168=64
58g 60g﹣44g=16g
此时原混合物中铁粉的质量为:60g﹣58g=2g;
则原混合物中铁粉的质量大于2g小于g,结合选项可知,5g符合题意。
故选:D。
【点评】本题主要考查了物质的性质和化学方程式的计算,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
8.(2025 朝阳区模拟)消防员在进入火灾现场时,佩戴的呼吸面罩中有过氧化钠,过氧化钠与二氧化碳发生反应:2Na2O2+2CO2=2Na2CO3+O2。在真空密闭容器中,将13.2gCO2与一定质量的N2O2固体充分反应后,收集到气体M质量为xg。下列说法错误的是( )
A.若x=4.8,气体M中不含有CO2
B.若x=4.8,生成的Na2CO3的质量为31.8g
C.若x=7.6,Na2O2反应后可能有剩余
D.若x=7.6,气体M中有CO2与O2
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】C
【分析】根据过氧化钠和二氧化碳反应生成碳酸钠和氧气,由题中数据结合化学方程式的计算来分析。
【解答】解:A、设x=4.8时,反应的二氧化碳质量为m,生成碳酸钠质量为n。
2Na2O2+2CO2=2Na2CO3+O2 气体减轻的质量
88 212 32 88﹣32=56
m n 13.2g﹣4.8g=8.4g
,
m=13.2g,n=31.8g
此时二氧化碳完全反应,气体M中不含有CO2,故选项说法正确。
B、由A的计算可知,若x=4.8,生成的Na2CO3的质量为31.8g,故选项说法正确。
C、设x=7.6时,参加反应的二氧化碳的质量为a。
2Na2O2+2CO2=2Na2CO3+O2 气体减轻的质量
88 88﹣32=56
a 13.2g﹣7.6g=5.6g
a=8.8g
此时参加反应的二氧化碳的质量有剩余,则Na2O2已经完全反应,反应后没有剩余,故选项说法错误。
D、由C的计算可知,二氧化碳有剩余,M为二氧化碳和氧气的混合物,故选项说法正确。
故选:C。
【点评】本题主要考查了物质的性质和化学方程式的计算,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
9.(2025春 青岛月考)取一定质量的CaCO3固体高温加热一段时间后,冷却,测得剩余固体的质量为8.0g,其中,钙元素的质量分数为50.0%。下列判断正确的是( )
A.原来CaCO3的质量为14.5g
B.生成2.0gCO2气体
C.剩余8.0g固体为纯净物
D.剩余8.0g固体中加入稀盐酸无气泡产生
【考点】化学方程式与实验的计算;有关质量守恒定律的计算.
【专题】有关化学方程式的计算.
【答案】B
【分析】根据碳酸钙分解的化学方程式为CaCO3CaO+CO2↑,结合质量守恒定律可知,在反应前后钙元素的质量相等,反应后剩余物质中钙元素的质量即为反应前碳酸钙中钙元素的质量,进行分析判断。
【解答】解:钙元素的质量为8.0g×50.0%=4.0g,反应前碳酸钙的质量为4.0g÷(100%)=10.0g;根据质量守恒定律,则生成二氧化碳的质量为10.0g﹣8.0g=2.0g。
设生成氧化钙的质量为x,参加反应的碳酸钙的质量为y。
CaCO3CaO+CO2↑
100 56 44
y x 2.0g
x≈2.55g
y≈4.55g
A、根据上述解析可知,原来碳酸钙的质量为10g,故选项说法错误。
B、根据质量守恒定律可知,生成二氧化碳的质量为10.0g﹣8.0g=2.0g,故选项说法正确。
C、生成氧化钙的质量为2.55g,剩余8.0g固体为氧化钙和碳酸钙的混合物,不是纯净物,故选项说法错误。
D、剩余的碳酸钙的质量为10.0g﹣4.55g=5.45g,加入稀盐酸,碳酸钙和稀盐酸反应生成二氧化碳气体,会产生气泡,故选项说法错误。
故选:B。
【点评】本题有一定难度,明确化学反应前后钙元素的种类不变是正确解答本题的关键。
10.(2025 淄博一模)工业上,高温煅烧石灰石可制取生石灰,发生反应CaCO3CaO+CO2↑.把6.0gCaCO3高温煅烧段时间后,剩余固体的质量为3.8g。下列推断不符合客观事实的是( )
A.生成CO2的质量是2.2g
B.生成物中Ca O的质量是2.8g
C.剩余固体中钙元素的质量分数为52.6%
D.剩余固体中碳、氧元素质量比为3:32
【考点】根据化学反应方程式的计算.
【专题】有关化学方程式的计算.
【答案】C
【分析】根据质量守恒定律可得二氧化碳的质量。根据二氧化碳的质量结合化学方程式计算相关量。
【解答】解:A、由质量守恒定律,反应生成的CO2的质量为6.0g﹣3.8g=2.2g,故正确;
B、设生成物中CaO的质量是x
CaCO3CaO+CO2↑,
56 44
x 2.2g
,x=2.8g,故正确;
C、分解的碳酸钙为2.2g+2.8g=5g,剩余固体中钙元素的质量为2.8g100%+(6g﹣5g)100%=2.4g,
剩余固体中钙元素的质量分数为100%=63.2%,故错误;
D、剩余碳酸钙中碳元素的质量为(6.0g﹣5g)100%=0.12g,剩余固体中钙元素的质量为6.0g100%=2.4g,剩余固体中碳元素的质量为3.8g﹣0.12g﹣2.4g=1.28g,剩余固体中碳、氧元素质量比为0.12g:1.28g=3:32,故正确。
故选:C。
【点评】本题难度较大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键。
二.计算题(共10小题)
11.(2025 邯郸二模)实验室有一瓶含少量杂质的高锰酸钾试剂,某兴趣小组的同学为了测定其中高锰酸钾的质量分数,设计图1装置制取氧气(完全反应),实验过程中称量反应前后固体的质量,相关数据如图2所示。请计算:
(1)产生O2的质量为 1.6 g;
(2)完全反应后,试管中固体的成分是 锰酸钾、二氧化锰 ;
(3)计算该样品中高锰酸钾的质量分数是多少?(计算结果精确到0.1%)
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)1.6;
(2)锰酸钾、二氧化锰;
(3)83.2%。
【分析】(1)根据质量守恒定律,化学反应前后物质的总质量不变来分析;
(2)根据高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气来分析;
(3)根据产生氧气的质量和化学方程式的计算来分析。
【解答】解:(1)根据质量守恒定律,化学反应前后物质的总质量不变,则产生氧气的质量为:19.0g﹣17.4g=1.6g;
(2)高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,完全反应后,试管中固体的成分是锰酸钾(K2MnO4)、二氧化锰(MnO2);
(3)设参加反应的高锰酸钾的质量为x。
2KMnO4K2MnO4+MnO2+O2↑
316 32
x 1.6g
x=15.8g
则该样品中高锰酸钾的质量分数为:。
答:该样品中高锰酸钾的质量分数是83.2%。
故答案为:
(1)1.6;
(2)锰酸钾、二氧化锰;
(3)83.2%。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
12.(2025 东营一模)如图是厨房中某品牌食用纯碱的成分表,兴趣小组同学称取16g样品置于烧杯中,并将烧杯放在电子天平上,加入50g稀盐酸(足量),用玻璃棒不断搅拌,每分钟记录一次天平示数,具体数据如表:
时间(分钟) 0 1 2 3 4 5 6
天平示数(g) 116.0 112.7 110.5 109.4 109.4 109.4 109.4
(1)玻璃棒的作用是 搅拌,加快反应速率 。
(2)分析表中数据可知,第 3 分钟,样品与稀盐酸已完全反应。完全反应时产生气体的总质量是 6.6 g。
(3)计算样品中碳酸钠的质量(写出计算过程)
(4)若实验中使用浓盐酸,会导致碳酸钠的质量分数测量结果 偏大 (选填“不变”、“偏小”或“偏大”)。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)搅拌,加快反应速率;
(2)3;6.6;
(3)15.9g;
(4)偏大。
【分析】(1)根据用玻璃棒搅拌可以加快反应速率来分析;
(2)根据表中数据来分析;
(3)根据生成二氧化碳的质量和化学方程式的计算来分析;
(4)根据浓盐酸具有挥发性,会使反应后物质的总质量减少偏大来分析。
【解答】解:(1)玻璃棒的作用是搅拌,加快反应速率;
(2)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,由表中数据可知,第2分钟时,天平示数为110.5g,第3﹣6分钟时,天平示数均为109.4g,说明从第3分钟开始,样品与稀盐酸已完全反应,根据质量守恒定律,化学反应前后物质的总质量不变,则完全反应时产生二氧化碳气体的总质量是:116.0g﹣109.4g=6.6g;
(3)设样品中碳酸钠的质量为x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 6.6g
x=15.9g
答:样品中碳酸钠的质量为15.9g。
(4)若实验中使用浓盐酸,浓盐酸具有挥发性,会挥发出氯化氢气体,使反应后物质的总质量减少偏大,导致碳酸钠的质量分数测量结果偏大。
故答案为:
(1)搅拌,加快反应速率;
(2)3;6.6;
(3)15.9g;
(4)偏大。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
13.(2025 福山区一模)小苏打是发酵粉的主要成分,可用于制作发面食品。化学兴趣小组为测定某品牌小苏打样品(含杂质氯化钠)中碳酸氢钠的含量做了如下实验:将该样品20.0g放入锥形瓶中,加水全部溶解后,得到208.8g样品溶液,向该样品溶液中不断加入稀盐酸,反应过程中锥形瓶中溶液质量的变化如表所示(忽略二氧化碳在水中的溶解)。
加入稀盐酸的总质量/g 25 50 75
锥形瓶中溶液的质量/g 229.4 250 275
相关反应方程式:NaHCO3+HCl=NaCl+H2O+CO2↑
试计算:(1)恰好完全反应时,生成二氧化碳的总质量为 8.8g g,当加入75g稀盐酸时,充分反应后所得溶液中的微粒有 H2O、Na+、Cl﹣、H+ (填化学符号)。
(2)小苏打样品中碳酸氢钠的质量分数(写出计算过程,计算结果精确到0.1%)。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)8.8;H2O、Na+、Cl﹣、H+;
(2)84.0%。
【分析】(1)根据化学反应前后物质的总质量不变,结合题中数据来分析;
(2)根据生成二氧化碳的质量和化学方程式的计算来分析。
【解答】解:(1)根据质量守恒定律,化学反应前后物质的总质量不变,由题中数据可知,恰好完全反应时,生成二氧化碳的总质量为:208.8g+75g﹣275g=8.8g;加入25g稀盐酸时,生成二氧化碳的质量为:208.8g+25g﹣229.4g=4.4g,而生成二氧化碳的总质量为8.8g=4.4g×2,所以加入50g稀盐酸时碳酸氢钠已经完全反应,当加入75g稀盐酸时,稀盐酸过量,充分反应后所得溶液中的微粒有水分子、钠离子、氯离子、氢离子,化学符号为:H2O、Na+、Cl﹣、H+;
(2)设样品中碳酸氢钠的质量为x。
NaHCO3+HCl=NaCl+H2O+CO2↑
84 44
x 8.8g
x=16.8g
则样品中碳酸氢钠的质量分数为:。
答:小苏打样品中碳酸氢钠质量分数为84.0%。
故答案为:
(1)8.8;H2O、Na+、Cl﹣、H+;
(2)84.0%。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
14.(2025春 巴彦县期中)现有一瓶过氧化氢溶液,实验兴趣小组的同学们取部分溶液进行了如下实验,请结合实验回答下列问题:
(1)上述实验过程中发生反应的化学方程式为 2H2O22H2O+O2↑ 。
(2)根据生成氧气的质量列出求解生成水的质量(x)的比例式 。
(3)272g过氧化氢溶液中过氧化氢与水的质量比为 1:19 。
(4)最后270.6g固液混合物中液体的质量为 265.6g 。
(5)若将上述的固液混合物过滤后,向滤液中再加入4.4g水,如图,则需要 30 g氢气完全燃烧,才能生成最终烧杯中水的质量。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)2H2O22H2O+O2↑;
(2);
(3)1:19;
(4)265.6g;
(5)30。
【分析】(1)根据过氧化氢在二氧化锰催化作用下生成水和氧气分析;
(2)根据质量守恒定律结合化学方程式列比例式;
(3)根据氧气的质量结合化学方程式进行计算;
(4)根据催化剂的特点分析;
(5)根据水的质量结合化学方程式进行计算。
【解答】解:(1)过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式为:2H2O22H2O+O2↑;
(2)根据质量守恒定律,生成的氧气的质量为272g+5g﹣270.6g=6.4g;
设反应生成的水的质量为x。
生成水的质量(x)的比例式为;
(3)设过氧化氢的质量为y
y=13.6g
272g过氧化氢溶液中过氧化氢的质量为13.6g,272g过氧化氢溶液中水的质量为:272g﹣13.6g=258.4g,272g过氧化氢溶液中过氧化氢与水的质量比为13.6g:258.4g=1:19;
(4)二氧化锰为催化剂,反应前后质量不变,最后270.6g固液混合物中液体的质量为270.6g﹣5g=265.6g;
(5)若将上述的固液混合物过滤后,只含有265.6g的水,在加入4.4g的水,共有270g的水,
设需要氢气的质量为w。
2H2+O22H2O
4 36
w 270g
w=30g
需要30g氢气完全燃烧,才能生成最终烧杯中水的质量。
故答案为:
(1)2H2O22H2O+O2↑;
(2);
(3)1:19;
(4)265.6g;
(5)30。
【点评】本题主要考查了根据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
15.(2025 汕尾模拟)水垢的成分是氢氧化镁和碳酸钙,某兴趣小组为测定其中各成分的质量分数,取12.9g混合物样品加热,加热过程中剩余固体的质量随加热时间的变化如图所示。已知氢氧化镁受热易分解,反应的化学方程式为Mg(OH)2MgO+H2O↑,碳酸钙在高温条件下分解,反应的化学方程式为CaCO3CaO+CO2↑。
(1)碳酸钙中钙元素的质量分数为 40% 。
(2)在 t2 时Mg(OH)2恰好完全分解, t4 时CaCO3恰好完全分解。(填“t1~t4”中对应时间点)
(3)12.9g水垢样品中碳酸钙的质量为 10g (写出计算过程)。
(4)某时刻测得剩余固体中钙元素的质量分数为40%,则此时剩余固体的成分为 CaO、CaCO3、MgO (填化学式)。
【考点】化学方程式与实验的计算;元素的质量分数计算.
【专题】有关化学方程式的计算.
【答案】(1)40%
(2)t2;t4;
(3)10g;
(4)CaO、CaCO3、MgO。
【分析】(1)根据元素质量分数的计算来分析;
(2)根据氢氧化镁受热易分解,碳酸钙在高温条件下分解,加热时氢氧化镁先分解生成氧化镁和水来分析;
(3)根据氢氧化镁受热分解生成水的质量和化学方程式的计算来分析;
(4)根据在碳酸钙和氧化镁的混合物中钙元素的质量分数,以及碳酸钙完全分解后剩余固体中钙元素的质量分数来分析。
【解答】解:(1)碳酸钙(CaCO3)中钙元素的质量分数为:。
(2)已知氢氧化镁受热易分解,反应的化学方程式为Mg(OH)2MgO+H2O↑,碳酸钙在高温条件下分解,反应的化学方程式为CaCO3CaO+CO2↑,加热时氢氧化镁先分解生成氧化镁和水,图中ab段表示氢氧化镁分解过程,cd段表示碳酸钙的分解过程,在t2时氢氧化镁恰好完全分解,t4时表示碳酸钙恰好完全分解。
(3)由图可知,氢氧化镁受热分解生成水的质量为:12.9g﹣12.0g=0.9g;
设12.9g水垢样品中氢氧化镁的质量为x。
Mg(OH)2MgO+H2O↑
58 18
x 0.9g
x=2.9
则12.9g水垢样品中碳酸钙的质量为:12.9g﹣2.9g=10g。
答:12.9g水垢样品中碳酸钙的质量为10g。
(4)由上述计算可知,碳酸钙的质量为10g,在碳酸钙和氧化镁的混合物中钙元素的质量分数为:;
设10g碳酸钙完全分解生成氧化钙的质量为y。
CaCO3CaO+CO2↑
100 56
10g y
x=5.6g
碳酸钙完全分解,剩余固体中钙元素的质量分数为:。
剩余固体中钙元素的质量分数为40%,33.3%<40%<52.6%,说明氢氧化镁已完全分解,碳酸钙未完全分解,则剩余固体的成分为CaO、CaCO3、MgO。
故答案为:
(1)40%
(2)t2;t4;
(3)10g;
(4)CaO、CaCO3、MgO。
【点评】本题主要考查了物质的性质和化学方程式的计算,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
16.(2025春 道里区期中)兴趣小组同学想测定某石灰石(杂质不溶于水也不与酸反应)中碳酸钙的质量分数。现取该石灰石12.5克放入烧杯内,然后向烧杯内加入100g的足量稀盐酸,进行如图所示的实验。试回答:
(1)实验过程中生成二氧化碳的质量为 4.4 g。
(2)该石灰石中碳酸钙的质量分数为多少?(写出计算过程)
(3)若工业上利用上述纯度的100t石灰石制取二氧化碳,完全反应后钙元素在剩余固体中的质量分数为 49.4% 。(保留0.1%)
【考点】化学方程式与实验的计算.
【答案】(1)4.4;
(2)80%;
(3)49.4%。
【分析】(1)根据质量守恒定律分析;
(2)根据二氧化碳的质量结合化学方程式进行计算;
(3)根据元素守恒分析。
【解答】解:(1)实验过程中生成二氧化碳的质量为12.5g+100g﹣108.1g=4.4g;
(2)设石灰石中碳酸钙的质量分数为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
12.5gx 4.4g
x=80%
答:石灰石中碳酸钙的质量分数为80%。
(3)设100t石灰石制取二氧化碳的质量为y,
CaCO3CaO+CO2↑
100 44
100t×80%=80t y
y=35.2t
根据钙元素的守恒,完全反应后钙元素在剩余固体中的质量80t32t,
所以完全反应后钙元素在剩余固体中的质量分数为49.4%,
答:完全反应后钙元素在剩余固体中的质量分数为49.4%。
故答案为:(1)4.4;
(2)80%;
(3)49.4%。
【点评】本题主要考查了根据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
17.(2025 龙口市一模)“金粉”(Cu—Zn合金)是一种金属颜料,可用于文物修复,某化学兴趣小组通过实验测定“金粉”中铜的含量:称取25g“金粉”样品放入锥形瓶中,将50g稀盐酸分5次加入,记录每次反应后锥形瓶内物质的总质量,实验过程和数据如表。
加入次数 第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量/g 10 10 10 10 10
反应后锥形瓶内物质总质量/g 34.94 44.88 54.82 a 74.78
(1)a的数值为 64.78 ,第4次反应结束后,溶液中溶质的成分为 ZnCl2、HCl (写化学式)。
(2)计算样品中铜的质量分数(写出计算过程)。
(3)实验中,测得铜的质量分数比实际偏低,则原因可能是 盐酸具有挥发性,会使反应后锥形瓶内物质总质量偏小 。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)64.78;ZnCl2、HCl;
(2)71.4%;
(3)盐酸具有挥发性,会使反应后锥形瓶内物质总质量偏小。
【分析】(1)根据质量守恒定律,化学反应前后物质的总质量不变,结合题中数据来分析;
(2)根据生成氢气的总质量和化学方程式的计算来分析;
(3)根据盐酸具有挥发性,会使反应后锥形瓶内物质总质量偏小来分析。
【解答】解:(1)根据质量守恒定律,化学反应前后物质的总质量不变,则生成氢气的总质量为25g+10g×5﹣74.78g=0.22g,第1次加入10g稀盐酸,锥形瓶内减少的质量为25g+10g﹣34.94g=0.06g,第2次加入10g稀盐酸,锥形瓶内减少的质量为34.94g+10g﹣44.88g=0.06g,第3次加入10g稀盐酸,锥形瓶内减少的质量为44.88g+10g﹣54.82g=0.06g,说明每10g稀盐酸完全反应,产生氢气的质量为0.06g,前三次生成氢气的总质量为:0.06g×3=0.18g,整个反应过程中生成氢气的总质量为0.22g,则第4次加入10g稀盐酸,生成氢气的总质量为0.22g﹣0.18g=0.04g<0.06g,所以第四次时锌已经完全反应,稀盐酸过量,反应后锥形瓶内物质的总质量为54.82+10g﹣0.04g=64.78g,则a的数值为64.78;第4次反应结束后,溶液中溶质的成分为生成的氯化锌和过氧的氯化锌,化学式为:ZnCl2、HCl。
(2)由上述分析可知,生成氢气的总质量为0.22g;
设样品中锌的质量为x。
Zn+H2SO4=ZnCl2+H2↑
65 2
x 0.22g
x=7.15g
即样品中锌的质量为7.15g,则样品中铜的质量为:25g﹣7.15g=17.85g,则样品中铜的质量分数为:100%=71.4%。
答:样品中铜的质量分数为71.4%。
(3)盐酸具有挥发性,会使反应后锥形瓶内物质总质量偏小,导致生成气体的质量偏大,从而使锌质量的计算结果偏大,导致测得铜的质量分数比实际偏低。
故答案为:
(1)64.78;ZnCl2、HCl;
(2)71.4%;
(3)盐酸具有挥发性,会使反应后锥形瓶内物质总质量偏小。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
18.(2025 新城区模拟)化学实验室开放日活动中,同学们欲测定大理石中碳酸钙(杂质不溶于水,也不与盐酸反应)的质量分数。将20g大理石粉碎后放入烧杯中,向烧杯中加入稀盐酸,所加稀盐酸的质量与生成气体的质量关系如图所示。
(1)A点对应溶液中的溶质是 CaCl2 。
(2)加入50g稀盐酸时生成二氧化碳的质量是 4.4g 。
(3)计算大理石中碳酸钙的质量分数。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)CaCl2;
(2)4.4g;
(3)75%。
【分析】(1)根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,以及A点时碳酸钙还未反应完来分析;
(2)根据图中数据,加入50g稀盐酸时生成二氧化碳的质量是4.4g来分析;
(3)根据生成二氧化碳的总质量结合化学方程式的计算来分析。
【解答】解:(1)大理石的主要成分是碳酸钙,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,由图可知,A点时碳酸钙还未反应完,此时溶液中的溶质是生成的氯化钙(CaCl2)。
(2)由图可知,加入50g稀盐酸时生成二氧化碳的质量是4.4g。
(3)由图可知,生成二氧化碳的总质量为6.6g;
设大理石中碳酸钙的质量分数为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
20gx 6.6g
x=75%
答:大理石中碳酸钙的质量分数为75%。
故答案为:
(1)CaCl2;
(2)4.4g;
(3)75%。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
19.(2025 利津县一模)如图是碳酸钙D3片标签的部分信息。化学社团为测定该药片中碳酸钙的量是否与标签相符,进行实验:取8片药片研碎后,分6次加入质量分数为7.3%的稀盐酸溶液150g,充分反应。实验相关数据如表格所示(假设其他成分不参加反应)。
盐酸质量(g) 25 50 75 100 125 150
CO2的质量(g) 1.1 2.2 3.3 4.4 4.4 4.4
(1)恰好完全反应时消耗稀盐酸的质量为 100 g。
(2)计算每片药片中碳酸钙质量并判断是否与标签相符。(写出计算过程)
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)100;
(2)1.25g,与标签相符。
【分析】(1)根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,结合表中数据来分析;
(2)根据二氧化碳的质量和化学方程式的计算来分析。
【解答】解:(1)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,由表中数据可知,恰好完全反应时消耗稀盐酸的质量为100g;
(2)设8片药片中碳酸钙的总质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
x=10g
则每片药片中碳酸钙的质量为:10g÷8=1.25g,与标签相符。
答:每片药片中碳酸钙的质量为1.25g,与标签相符。
故答案为:
(1)100;
(2)1.25g,与标签相符。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
20.(2025 香坊区二模)某钢铁厂实验室为了测定赤铁矿中Fe2O3的含量,将矿石粉碎(杂质既不溶于水,也不与酸反应)加入稀硫酸,进行如下实验。请回答问题:
(1)发生反应的化学方程式为 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 。
(2)将矿石粉碎的目的是 增大反应物之间的接触面积,使反应更快、更充分 。
(3)该矿石中Fe2O3的含量为 80% 。
(4)a的数值为 42 。
(5)若用460t上述赤铁矿炼铁,炼铁过程中矿石利用率为80%,则可以得到含铁92%的生铁的质量为 224t 。
【考点】含杂质的化学方程式计算;铁的冶炼.
【专题】有关化学方程式的计算.
【答案】(1)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)增大反应物之间的接触面积,使反应更快、更充分;
(3)80%;
(4)42;
(5)224t。
【分析】(1)根据氧化铁和稀硫酸反应生成硫酸铁和水来分析解答;
(2)根据将矿石粉碎可以增大反应物之间的接触面积,使反应更快、更充分来分析解答;
(3)根据反应前后总质量不变来分析解答;
(4)根据氧化铁的质量和方程式来分析解答;
(5)根据题中数据来分析解答。
【解答】解:(1)赤铁矿的主要成分是氧化铁,加入稀硫酸后,氧化铁和稀硫酸反应生成硫酸铁和水,反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)将矿石粉碎的目的是增大反应物之间的接触面积,使反应更快、更充分;
(3)赤铁矿的主要成分是氧化铁,加入稀硫酸,氧化铁和稀硫酸反应生成硫酸铁和水,则杂质的质量为10g+150g﹣158g=2g,氧化铁的质量为10g﹣2g=8g,则该矿石中氧化铁的含量为100%=80%;
(4)设反应生成硫酸铁的质量为x,
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
160 400
8g x
x=20g
则100%=10%,a=42;
(5)氧化铁的质量为460t×80%×80%=294.4t,
设可以得到含铁92%的生铁的质量为y,
3CO+Fe2O32Fe+3CO2
160 112
294.4t 92%y
y=224t
即可以得到含铁92%的生铁的质量为224t。
【点评】本题主要考查化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
中考核心考点 化学方程式的计算
一.选择题(共10小题)
1.(2025 河南二模)一定量的甲烷与氧气在密闭容器中恰好完全反应,生成一氧化碳、二氧化碳和水蒸气,则混合气中氧元素的质量分数不可能是下列的( )
A.74.2% B.76.5% C.77.8% D.78.9%
2.(2025 河南模拟)现有相等质量的四种燃料:①甲烷、②一氧化碳、③乙醇、④甲醇(CH3OH),分别在氧气中充分燃烧,产生二氧化碳的质量由小到大的顺序是( )
A.④<③<②<① B.②<①<④<③ C.①<②<③<④ D.④<②<③<①
3.(2025 京口区模拟)已知:,Cu2(OH)3Cl+3HCl=2CuCl2+3H2O某同学称取废铜屑9.4g【Cu含杂质Cu2(OH)2CO3(相对分子质量222)和Cu2(OH)3Cl(相对分子质量214.5)】,在空气中充分加热至质量不变为止,测得剩余固体质量为9g。将加热时生成的气体全部通入足量的AgNO3溶液,得到沉淀2.87g。下列说法不正确的是( )
A.固体中含铜元素质量为7.2g
B.加热时生成HCl质量0.73g
C.废铜屑中Cu2(OH)2CO3和Cu2(OH)3Cl的质量比为111:429
D.该废铜屑与10%稀盐酸恰好完全反应时,消耗稀盐酸质量为82.1g
4.(2025春 宁阳县月考)3g的碳和10g的氧气完全反应,产生二氧化碳的质量是( )
A.13g B.11g C.大于11g D.小于11g
5.(2025春 绥化月考)含有氢气和氧气的混合气体共10g,点燃充分反应后,恢复到室温,气体质量减少了9g,则原混合气体中的成分可能是( )
A.1g氢气和9g氧气
B.氢气和氧气的质量比为1:80
C.5g氢气和5g氧气
D.3g氢气和7g氧气
6.(2025 郑州模拟)将3g某金属混合物放入烧杯中,向其中加入50g稀盐酸恰好完全反应,烧杯中剩余物的总质量是52.9g,该混合物不可能是( )
A.Mg、Al B.Fe、Zn C.Cu、Fe D.Cu、Al
7.(2025 郑州二模)取铁粉、氧化铁粉末、四氧化三铁粉末的混合物60g,通入足量的一氧化碳,高温条件下充分反应,冷却后称得剩余固体质量为44g,则原固体混合物中铁粉的质量可能是( )
A.38g B.16g C.10g D.5g
8.(2025 朝阳区模拟)消防员在进入火灾现场时,佩戴的呼吸面罩中有过氧化钠,过氧化钠与二氧化碳发生反应:2Na2O2+2CO2=2Na2CO3+O2。在真空密闭容器中,将13.2gCO2与一定质量的N2O2固体充分反应后,收集到气体M质量为xg。下列说法错误的是( )
A.若x=4.8,气体M中不含有CO2
B.若x=4.8,生成的Na2CO3的质量为31.8g
C.若x=7.6,Na2O2反应后可能有剩余
D.若x=7.6,气体M中有CO2与O2
9.(2025春 青岛月考)取一定质量的CaCO3固体高温加热一段时间后,冷却,测得剩余固体的质量为8.0g,其中,钙元素的质量分数为50.0%。下列判断正确的是( )
A.原来CaCO3的质量为14.5g
B.生成2.0gCO2气体
C.剩余8.0g固体为纯净物
D.剩余8.0g固体中加入稀盐酸无气泡产生
10.(2025 淄博一模)工业上,高温煅烧石灰石可制取生石灰,发生反应CaCO3CaO+CO2↑.把6.0gCaCO3高温煅烧段时间后,剩余固体的质量为3.8g。下列推断不符合客观事实的是( )
A.生成CO2的质量是2.2g
B.生成物中Ca O的质量是2.8g
C.剩余固体中钙元素的质量分数为52.6%
D.剩余固体中碳、氧元素质量比为3:32
二.计算题(共10小题)
11.(2025 邯郸二模)实验室有一瓶含少量杂质的高锰酸钾试剂,某兴趣小组的同学为了测定其中高锰酸钾的质量分数,设计图1装置制取氧气(完全反应),实验过程中称量反应前后固体的质量,相关数据如图2所示。请计算:
(1)产生O2的质量为 g;
(2)完全反应后,试管中固体的成分是 ;
(3)计算该样品中高锰酸钾的质量分数是多少?(计算结果精确到0.1%)
12.(2025 东营一模)如图是厨房中某品牌食用纯碱的成分表,兴趣小组同学称取16g样品置于烧杯中,并将烧杯放在电子天平上,加入50g稀盐酸(足量),用玻璃棒不断搅拌,每分钟记录一次天平示数,具体数据如表:
时间(分钟) 0 1 2 3 4 5 6
天平示数(g) 116.0 112.7 110.5 109.4 109.4 109.4 109.4
(1)玻璃棒的作用是 。
(2)分析表中数据可知,第 分钟,样品与稀盐酸已完全反应。完全反应时产生气体的总质量是 g。
(3)计算样品中碳酸钠的质量(写出计算过程)
(4)若实验中使用浓盐酸,会导致碳酸钠的质量分数测量结果 (选填“不变”、“偏小”或“偏大”)。
13.(2025 福山区一模)小苏打是发酵粉的主要成分,可用于制作发面食品。化学兴趣小组为测定某品牌小苏打样品(含杂质氯化钠)中碳酸氢钠的含量做了如下实验:将该样品20.0g放入锥形瓶中,加水全部溶解后,得到208.8g样品溶液,向该样品溶液中不断加入稀盐酸,反应过程中锥形瓶中溶液质量的变化如表所示(忽略二氧化碳在水中的溶解)。
加入稀盐酸的总质量/g 25 50 75
锥形瓶中溶液的质量/g 229.4 250 275
相关反应方程式:NaHCO3+HCl=NaCl+H2O+CO2↑
试计算:(1)恰好完全反应时,生成二氧化碳的总质量为 g,当加入75g稀盐酸时,充分反应后所得溶液中的微粒有 (填化学符号)。
(2)小苏打样品中碳酸氢钠的质量分数(写出计算过程,计算结果精确到0.1%)。
14.(2025春 巴彦县期中)现有一瓶过氧化氢溶液,实验兴趣小组的同学们取部分溶液进行了如下实验,请结合实验回答下列问题:
(1)上述实验过程中发生反应的化学方程式为 。
(2)根据生成氧气的质量列出求解生成水的质量(x)的比例式 。
(3)272g过氧化氢溶液中过氧化氢与水的质量比为 。
(4)最后270.6g固液混合物中液体的质量为 。
(5)若将上述的固液混合物过滤后,向滤液中再加入4.4g水,如图,则需要 g氢气完全燃烧,才能生成最终烧杯中水的质量。
15.(2025 汕尾模拟)水垢的成分是氢氧化镁和碳酸钙,某兴趣小组为测定其中各成分的质量分数,取12.9g混合物样品加热,加热过程中剩余固体的质量随加热时间的变化如图所示。已知氢氧化镁受热易分解,反应的化学方程式为Mg(OH)2MgO+H2O↑,碳酸钙在高温条件下分解,反应的化学方程式为CaCO3CaO+CO2↑。
(1)碳酸钙中钙元素的质量分数为 。
(2)在 时Mg(OH)2恰好完全分解, 时CaCO3恰好完全分解。(填“t1~t4”中对应时间点)
(3)12.9g水垢样品中碳酸钙的质量为 (写出计算过程)。
(4)某时刻测得剩余固体中钙元素的质量分数为40%,则此时剩余固体的成分为 (填化学式)。
16.(2025春 道里区期中)兴趣小组同学想测定某石灰石(杂质不溶于水也不与酸反应)中碳酸钙的质量分数。现取该石灰石12.5克放入烧杯内,然后向烧杯内加入100g的足量稀盐酸,进行如图所示的实验。试回答:
(1)实验过程中生成二氧化碳的质量为 g。
(2)该石灰石中碳酸钙的质量分数为多少?(写出计算过程)
(3)若工业上利用上述纯度的100t石灰石制取二氧化碳,完全反应后钙元素在剩余固体中的质量分数为 。(保留0.1%)
17.(2025 龙口市一模)“金粉”(Cu—Zn合金)是一种金属颜料,可用于文物修复,某化学兴趣小组通过实验测定“金粉”中铜的含量:称取25g“金粉”样品放入锥形瓶中,将50g稀盐酸分5次加入,记录每次反应后锥形瓶内物质的总质量,实验过程和数据如表。
加入次数 第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量/g 10 10 10 10 10
反应后锥形瓶内物质总质量/g 34.94 44.88 54.82 a 74.78
(1)a的数值为 ,第4次反应结束后,溶液中溶质的成分为 (写化学式)。
(2)计算样品中铜的质量分数(写出计算过程)。
(3)实验中,测得铜的质量分数比实际偏低,则原因可能是 。
18.(2025 新城区模拟)化学实验室开放日活动中,同学们欲测定大理石中碳酸钙(杂质不溶于水,也不与盐酸反应)的质量分数。将20g大理石粉碎后放入烧杯中,向烧杯中加入稀盐酸,所加稀盐酸的质量与生成气体的质量关系如图所示。
(1)A点对应溶液中的溶质是 。
(2)加入50g稀盐酸时生成二氧化碳的质量是 。
(3)计算大理石中碳酸钙的质量分数。
19.(2025 利津县一模)如图是碳酸钙D3片标签的部分信息。化学社团为测定该药片中碳酸钙的量是否与标签相符,进行实验:取8片药片研碎后,分6次加入质量分数为7.3%的稀盐酸溶液150g,充分反应。实验相关数据如表格所示(假设其他成分不参加反应)。
盐酸质量(g) 25 50 75 100 125 150
CO2的质量(g) 1.1 2.2 3.3 4.4 4.4 4.4
(1)恰好完全反应时消耗稀盐酸的质量为 g。
(2)计算每片药片中碳酸钙质量并判断是否与标签相符。(写出计算过程)
20.(2025 香坊区二模)某钢铁厂实验室为了测定赤铁矿中Fe2O3的含量,将矿石粉碎(杂质既不溶于水,也不与酸反应)加入稀硫酸,进行如下实验。请回答问题:
(1)发生反应的化学方程式为 。
(2)将矿石粉碎的目的是 。
(3)该矿石中Fe2O3的含量为 。
(4)a的数值为 。
(5)若用460t上述赤铁矿炼铁,炼铁过程中矿石利用率为80%,则可以得到含铁92%的生铁的质量为 。
中考核心考点 化学方程式的计算
参考答案与试题解析
一.选择题(共10小题)
1.(2025 河南二模)一定量的甲烷与氧气在密闭容器中恰好完全反应,生成一氧化碳、二氧化碳和水蒸气,则混合气中氧元素的质量分数不可能是下列的( )
A.74.2% B.76.5% C.77.8% D.78.9%
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】A
【分析】根据甲烷完全燃烧生成二氧化碳和水,甲烷燃烧生成一氧化碳和水分别计算氧元素的质量分数,进一步分析。
【解答】解:设甲烷的质量为x,
若完全燃烧生成二氧化碳和水,则:
CH4+2O2CO2+2H2O
16 64
x 4x
根据质量守恒定律可知,混合气中氧元素的质量分数为:;
若完全燃烧生成一氧化碳和水,则:
2CH4+3O22CO+4H2O
32 96
x 3x
根据质量守恒定律可知,混合气中氧元素的质量分数为:;
所以一定量的甲烷与氧气在密闭容器中恰好完全反应,生成一氧化碳、二氧化碳和水蒸气,则混合气中氧元素的质量分数在75%﹣80%之间。
故选:A。
【点评】本题主要考查了根据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
2.(2025 河南模拟)现有相等质量的四种燃料:①甲烷、②一氧化碳、③乙醇、④甲醇(CH3OH),分别在氧气中充分燃烧,产生二氧化碳的质量由小到大的顺序是( )
A.④<③<②<① B.②<①<④<③ C.①<②<③<④ D.④<②<③<①
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】D
【分析】甲烷燃烧生成二氧化碳和水,一氧化碳燃烧生成二氧化碳,乙醇燃烧生成二氧化碳和水,甲醇燃烧生成二氧化碳和水,根据质量守恒定律,化学反应前后元素的种类和质量不变,四种燃料中的碳元素完全转化到了二氧化碳中进行分析。
【解答】解:根据质量守恒定律,化学反应前后元素的种类和质量不变,四种燃料中的碳元素完全转化到了二氧化碳中,四种燃料的质量相等,则四种燃料中碳元素的质量分数越大,充分燃烧生成二氧化碳的质量越大,甲烷中碳元素的质量分数为:,一氧化碳中碳元素的质量分数:,乙醇中碳元素的质量分数为:,甲醇中碳元素的质量分数为:,故产生二氧化碳的质量由小到大的顺序是:④<②<③<①。
故选:D。
【点评】本题主要考查了根据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
3.(2025 京口区模拟)已知:,Cu2(OH)3Cl+3HCl=2CuCl2+3H2O某同学称取废铜屑9.4g【Cu含杂质Cu2(OH)2CO3(相对分子质量222)和Cu2(OH)3Cl(相对分子质量214.5)】,在空气中充分加热至质量不变为止,测得剩余固体质量为9g。将加热时生成的气体全部通入足量的AgNO3溶液,得到沉淀2.87g。下列说法不正确的是( )
A.固体中含铜元素质量为7.2g
B.加热时生成HCl质量0.73g
C.废铜屑中Cu2(OH)2CO3和Cu2(OH)3Cl的质量比为111:429
D.该废铜屑与10%稀盐酸恰好完全反应时,消耗稀盐酸质量为82.1g
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】D
【分析】根据,Cu2(OH)3Cl+3HCl=2CuCl2+3H2O,结合题干中的数据进行分析计算。
【解答】解:A、,碱式碳酸铜加热分解生成氧化铜、水和二氧化碳,铜在空气中加热和氧气反应生成氧化铜。所以剩余固体质量为9g,都是氧化铜,则铜元素的质量为,故正确;
B、加热生成的气体通入硝酸银得到2.87g沉淀,说明排出的气体中有氯化氢。设氯化氢质量为x,
HCl+AgNO3═AgCl↓+HNO3
36.5 143.5
x 2.87g
x=0.73g。所以加热时生成HCl质量0.73g,故正确;
C、根据Cu2(OH)3Cl2CuO+H2O+HCl↑
214.5 160 36.5
4.29g 3.2g 0.73g
可知,0.73g氯化氢需要分解4.29g Cu2(OH)3Cl得到,同时生成3.2g氧化铜。假设废铜屑中Cu2(OH)2CO3和Cu2(OH)3Cl的质量比为111:429,则有Cu2(OH)2CO3的质量为1.11g,铜的质量为9.4g﹣4.29g﹣1.11g=4g。
Cu2(OH)2CO32CuO+H2O+CO2↑,
222 160
1.11g 0.8g
2Cu+O22CuO
128 160
4g 5g
5g+0.8g+3.2g=9g,与剩余固体质量9g相等。所以废铜屑中Cu2(OH)2CO3和Cu2(OH)3Cl的质量比为111:429,故正确;
D、铜和稀盐酸不反应。
Cu2(OH)3Cl+3HCl=2CuCl2+3H2O
214.5 109.5
4.29g 2.19g
Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑
222 146
1.11g 0.73g
29.2g≠82.1g,故错误;
故选:D。
【点评】本题主要考查了根据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
4.(2025春 宁阳县月考)3g的碳和10g的氧气完全反应,产生二氧化碳的质量是( )
A.13g B.11g C.大于11g D.小于11g
【考点】不含杂质的化学方程式计算;有关质量守恒定律的计算.
【专题】有关化学方程式的计算.
【答案】B
【分析】根据碳与氧气反应的化学方程式,得出各物质之间的质量的比例式,就可计算出3克碳与氧气完全反应所需的氧气质量和生成二氧化碳的质量来分析解答。
【解答】解:由化学方程式C+O2CO2可知,参加反应的碳与氧气的质量比是3:8,则3g碳与8g氧气恰好完全反应,有2g氧气没有反应,根据质量守恒定律,产生二氧化碳的质量是3g+8g=11g。
故选:B。
【点评】本题主要考查学生运用化学方程式和物质之间反应的质量关系综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力。
5.(2025春 绥化月考)含有氢气和氧气的混合气体共10g,点燃充分反应后,恢复到室温,气体质量减少了9g,则原混合气体中的成分可能是( )
A.1g氢气和9g氧气
B.氢气和氧气的质量比为1:80
C.5g氢气和5g氧气
D.3g氢气和7g氧气
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】A
【分析】氢气和氧气的混合气体共10g,点燃充分反应后,恢复到室温,气体质量减少了9g,说明反应的气体质量为9g,剩余气体1g,则根据质量守恒定律可知生成水的质量为9g,利用化学反应方程式可求出参加反应的氢气和氧气的质量来分析解答。
【解答】解:A、由上面分析可知,生成水的质量为9g,
设参加反应的氢气和氧气的质量分别为x、y,
2H2+O22H2O
4 32 36
x y 9g
x=1g
y=8g
剩余气体为1g,若为氢气,则原混合气体中氢气的质量可能为1g+1g=2g,氧气为8g,若为氧气,则原混合气体中氧气气的质量可能为1g+8g=9g,氢气为1g,故A正确;
B、由A中分析可知,氢气和氧气的质量分别为2g和8g或1g和9g,则比为氢气和氧气的质量2:8或1:9,故B错误;
C、由A中分析可知,氢气和氧气的质量分别为2g和8g或1g和9g,故C错误;
D、由A中分析可知,氢气和氧气的质量分别为2g和8g或1g和9g,故D错误;
故选:A。
【点评】在解此类题时,首相根据体重的条件列出关系式,解出题中需要的量,然后结合题意再进一步解答。
6.(2025 郑州模拟)将3g某金属混合物放入烧杯中,向其中加入50g稀盐酸恰好完全反应,烧杯中剩余物的总质量是52.9g,该混合物不可能是( )
A.Mg、Al B.Fe、Zn C.Cu、Fe D.Cu、Al
【考点】根据化学反应方程式的计算;根据计算结果推断金属混合物的组成.
【专题】金属与金属材料.
【答案】A
【分析】根据反应前后元素种类不变,则可知生成氢气的质量为3g+50g﹣52.9g=0.1g,则说明生成0.1g氢气时,分别需要一种金属的质量大于3g,另一种金属的质量小于3g。
【解答】A、设分别生成0.1g氢气时,需要的镁和铝的质量分别为x、y,则
Mg+2HCl═MgCl2+H2↑
24 2
x 0.1g
x=1.2g
2Al+6HCl=2AlCl3+3H2↑
54 6
y 0.1g
y=0.9g
需要镁和铝的质量均小于3g,则不可能为镁和铝,故选项符合题意;
B、设分别需要的铁和锌的质量分别为m、n,则
Fe+2HCl═FeCl2+H2↑
56 2
m 0.1g
x=2.8g
Zn+2HCl═ZnCl2+H2↑
65 2
n 0.1g
y=3.25g
需要铁的质量小于3g,需要锌的质量大于3g,则可能为铁和锌,故选项不符合题意;
C、铜不能和盐酸反应,需要的铁的质量小于3g,则可能为铜和铁,故选项不符合题意;
D、铜不能和盐酸反应,需要铝的质量小于3g,则可能为铜和铝,故选项不符合题意。
故选:A。
【点评】本题主要考查了根据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
7.(2025 郑州二模)取铁粉、氧化铁粉末、四氧化三铁粉末的混合物60g,通入足量的一氧化碳,高温条件下充分反应,冷却后称得剩余固体质量为44g,则原固体混合物中铁粉的质量可能是( )
A.38g B.16g C.10g D.5g
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】D
【分析】根据铁和一氧化碳不反应,氧化铁和一氧化碳在高温的条件下生成铁和二氧化碳,四氧化三铁和一氧化碳在高温的条件下生成铁和二氧化碳,由题中数据结合化学方程式的计算来分析。
【解答】解:取铁粉、氧化铁粉末、四氧化三铁粉末的混合物60g,通入足量的一氧化碳,高温条件下充分反应,冷却后称得剩余固体质量为44g,铁和一氧化碳不反应,氧化铁和一氧化碳在高温的条件下生成铁和二氧化碳,四氧化三铁和一氧化碳在高温的条件下生成铁和二氧化碳;
假设固体中只有铁粉和氧化铁粉末,氧化铁和一氧化碳反应的化学方程式及其质量关系如下:
Fe2O3+3CO2Fe+3CO2 固体质量差
160 112 160﹣112=48
g 60g﹣44g=16g
此时原混合物中铁粉的质量为:60ggg;
假设固体中只有铁粉和四氧化三铁粉末,四氧化三铁和一氧化碳反应的化学方程式及其质量关系如下:
Fe3O4+4CO3Fe+4CO2 固体质量差
232 168 232﹣168=64
58g 60g﹣44g=16g
此时原混合物中铁粉的质量为:60g﹣58g=2g;
则原混合物中铁粉的质量大于2g小于g,结合选项可知,5g符合题意。
故选:D。
【点评】本题主要考查了物质的性质和化学方程式的计算,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
8.(2025 朝阳区模拟)消防员在进入火灾现场时,佩戴的呼吸面罩中有过氧化钠,过氧化钠与二氧化碳发生反应:2Na2O2+2CO2=2Na2CO3+O2。在真空密闭容器中,将13.2gCO2与一定质量的N2O2固体充分反应后,收集到气体M质量为xg。下列说法错误的是( )
A.若x=4.8,气体M中不含有CO2
B.若x=4.8,生成的Na2CO3的质量为31.8g
C.若x=7.6,Na2O2反应后可能有剩余
D.若x=7.6,气体M中有CO2与O2
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】C
【分析】根据过氧化钠和二氧化碳反应生成碳酸钠和氧气,由题中数据结合化学方程式的计算来分析。
【解答】解:A、设x=4.8时,反应的二氧化碳质量为m,生成碳酸钠质量为n。
2Na2O2+2CO2=2Na2CO3+O2 气体减轻的质量
88 212 32 88﹣32=56
m n 13.2g﹣4.8g=8.4g
,
m=13.2g,n=31.8g
此时二氧化碳完全反应,气体M中不含有CO2,故选项说法正确。
B、由A的计算可知,若x=4.8,生成的Na2CO3的质量为31.8g,故选项说法正确。
C、设x=7.6时,参加反应的二氧化碳的质量为a。
2Na2O2+2CO2=2Na2CO3+O2 气体减轻的质量
88 88﹣32=56
a 13.2g﹣7.6g=5.6g
a=8.8g
此时参加反应的二氧化碳的质量有剩余,则Na2O2已经完全反应,反应后没有剩余,故选项说法错误。
D、由C的计算可知,二氧化碳有剩余,M为二氧化碳和氧气的混合物,故选项说法正确。
故选:C。
【点评】本题主要考查了物质的性质和化学方程式的计算,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
9.(2025春 青岛月考)取一定质量的CaCO3固体高温加热一段时间后,冷却,测得剩余固体的质量为8.0g,其中,钙元素的质量分数为50.0%。下列判断正确的是( )
A.原来CaCO3的质量为14.5g
B.生成2.0gCO2气体
C.剩余8.0g固体为纯净物
D.剩余8.0g固体中加入稀盐酸无气泡产生
【考点】化学方程式与实验的计算;有关质量守恒定律的计算.
【专题】有关化学方程式的计算.
【答案】B
【分析】根据碳酸钙分解的化学方程式为CaCO3CaO+CO2↑,结合质量守恒定律可知,在反应前后钙元素的质量相等,反应后剩余物质中钙元素的质量即为反应前碳酸钙中钙元素的质量,进行分析判断。
【解答】解:钙元素的质量为8.0g×50.0%=4.0g,反应前碳酸钙的质量为4.0g÷(100%)=10.0g;根据质量守恒定律,则生成二氧化碳的质量为10.0g﹣8.0g=2.0g。
设生成氧化钙的质量为x,参加反应的碳酸钙的质量为y。
CaCO3CaO+CO2↑
100 56 44
y x 2.0g
x≈2.55g
y≈4.55g
A、根据上述解析可知,原来碳酸钙的质量为10g,故选项说法错误。
B、根据质量守恒定律可知,生成二氧化碳的质量为10.0g﹣8.0g=2.0g,故选项说法正确。
C、生成氧化钙的质量为2.55g,剩余8.0g固体为氧化钙和碳酸钙的混合物,不是纯净物,故选项说法错误。
D、剩余的碳酸钙的质量为10.0g﹣4.55g=5.45g,加入稀盐酸,碳酸钙和稀盐酸反应生成二氧化碳气体,会产生气泡,故选项说法错误。
故选:B。
【点评】本题有一定难度,明确化学反应前后钙元素的种类不变是正确解答本题的关键。
10.(2025 淄博一模)工业上,高温煅烧石灰石可制取生石灰,发生反应CaCO3CaO+CO2↑.把6.0gCaCO3高温煅烧段时间后,剩余固体的质量为3.8g。下列推断不符合客观事实的是( )
A.生成CO2的质量是2.2g
B.生成物中Ca O的质量是2.8g
C.剩余固体中钙元素的质量分数为52.6%
D.剩余固体中碳、氧元素质量比为3:32
【考点】根据化学反应方程式的计算.
【专题】有关化学方程式的计算.
【答案】C
【分析】根据质量守恒定律可得二氧化碳的质量。根据二氧化碳的质量结合化学方程式计算相关量。
【解答】解:A、由质量守恒定律,反应生成的CO2的质量为6.0g﹣3.8g=2.2g,故正确;
B、设生成物中CaO的质量是x
CaCO3CaO+CO2↑,
56 44
x 2.2g
,x=2.8g,故正确;
C、分解的碳酸钙为2.2g+2.8g=5g,剩余固体中钙元素的质量为2.8g100%+(6g﹣5g)100%=2.4g,
剩余固体中钙元素的质量分数为100%=63.2%,故错误;
D、剩余碳酸钙中碳元素的质量为(6.0g﹣5g)100%=0.12g,剩余固体中钙元素的质量为6.0g100%=2.4g,剩余固体中碳元素的质量为3.8g﹣0.12g﹣2.4g=1.28g,剩余固体中碳、氧元素质量比为0.12g:1.28g=3:32,故正确。
故选:C。
【点评】本题难度较大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键。
二.计算题(共10小题)
11.(2025 邯郸二模)实验室有一瓶含少量杂质的高锰酸钾试剂,某兴趣小组的同学为了测定其中高锰酸钾的质量分数,设计图1装置制取氧气(完全反应),实验过程中称量反应前后固体的质量,相关数据如图2所示。请计算:
(1)产生O2的质量为 1.6 g;
(2)完全反应后,试管中固体的成分是 锰酸钾、二氧化锰 ;
(3)计算该样品中高锰酸钾的质量分数是多少?(计算结果精确到0.1%)
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)1.6;
(2)锰酸钾、二氧化锰;
(3)83.2%。
【分析】(1)根据质量守恒定律,化学反应前后物质的总质量不变来分析;
(2)根据高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气来分析;
(3)根据产生氧气的质量和化学方程式的计算来分析。
【解答】解:(1)根据质量守恒定律,化学反应前后物质的总质量不变,则产生氧气的质量为:19.0g﹣17.4g=1.6g;
(2)高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,完全反应后,试管中固体的成分是锰酸钾(K2MnO4)、二氧化锰(MnO2);
(3)设参加反应的高锰酸钾的质量为x。
2KMnO4K2MnO4+MnO2+O2↑
316 32
x 1.6g
x=15.8g
则该样品中高锰酸钾的质量分数为:。
答:该样品中高锰酸钾的质量分数是83.2%。
故答案为:
(1)1.6;
(2)锰酸钾、二氧化锰;
(3)83.2%。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
12.(2025 东营一模)如图是厨房中某品牌食用纯碱的成分表,兴趣小组同学称取16g样品置于烧杯中,并将烧杯放在电子天平上,加入50g稀盐酸(足量),用玻璃棒不断搅拌,每分钟记录一次天平示数,具体数据如表:
时间(分钟) 0 1 2 3 4 5 6
天平示数(g) 116.0 112.7 110.5 109.4 109.4 109.4 109.4
(1)玻璃棒的作用是 搅拌,加快反应速率 。
(2)分析表中数据可知,第 3 分钟,样品与稀盐酸已完全反应。完全反应时产生气体的总质量是 6.6 g。
(3)计算样品中碳酸钠的质量(写出计算过程)
(4)若实验中使用浓盐酸,会导致碳酸钠的质量分数测量结果 偏大 (选填“不变”、“偏小”或“偏大”)。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)搅拌,加快反应速率;
(2)3;6.6;
(3)15.9g;
(4)偏大。
【分析】(1)根据用玻璃棒搅拌可以加快反应速率来分析;
(2)根据表中数据来分析;
(3)根据生成二氧化碳的质量和化学方程式的计算来分析;
(4)根据浓盐酸具有挥发性,会使反应后物质的总质量减少偏大来分析。
【解答】解:(1)玻璃棒的作用是搅拌,加快反应速率;
(2)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,由表中数据可知,第2分钟时,天平示数为110.5g,第3﹣6分钟时,天平示数均为109.4g,说明从第3分钟开始,样品与稀盐酸已完全反应,根据质量守恒定律,化学反应前后物质的总质量不变,则完全反应时产生二氧化碳气体的总质量是:116.0g﹣109.4g=6.6g;
(3)设样品中碳酸钠的质量为x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 6.6g
x=15.9g
答:样品中碳酸钠的质量为15.9g。
(4)若实验中使用浓盐酸,浓盐酸具有挥发性,会挥发出氯化氢气体,使反应后物质的总质量减少偏大,导致碳酸钠的质量分数测量结果偏大。
故答案为:
(1)搅拌,加快反应速率;
(2)3;6.6;
(3)15.9g;
(4)偏大。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
13.(2025 福山区一模)小苏打是发酵粉的主要成分,可用于制作发面食品。化学兴趣小组为测定某品牌小苏打样品(含杂质氯化钠)中碳酸氢钠的含量做了如下实验:将该样品20.0g放入锥形瓶中,加水全部溶解后,得到208.8g样品溶液,向该样品溶液中不断加入稀盐酸,反应过程中锥形瓶中溶液质量的变化如表所示(忽略二氧化碳在水中的溶解)。
加入稀盐酸的总质量/g 25 50 75
锥形瓶中溶液的质量/g 229.4 250 275
相关反应方程式:NaHCO3+HCl=NaCl+H2O+CO2↑
试计算:(1)恰好完全反应时,生成二氧化碳的总质量为 8.8g g,当加入75g稀盐酸时,充分反应后所得溶液中的微粒有 H2O、Na+、Cl﹣、H+ (填化学符号)。
(2)小苏打样品中碳酸氢钠的质量分数(写出计算过程,计算结果精确到0.1%)。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)8.8;H2O、Na+、Cl﹣、H+;
(2)84.0%。
【分析】(1)根据化学反应前后物质的总质量不变,结合题中数据来分析;
(2)根据生成二氧化碳的质量和化学方程式的计算来分析。
【解答】解:(1)根据质量守恒定律,化学反应前后物质的总质量不变,由题中数据可知,恰好完全反应时,生成二氧化碳的总质量为:208.8g+75g﹣275g=8.8g;加入25g稀盐酸时,生成二氧化碳的质量为:208.8g+25g﹣229.4g=4.4g,而生成二氧化碳的总质量为8.8g=4.4g×2,所以加入50g稀盐酸时碳酸氢钠已经完全反应,当加入75g稀盐酸时,稀盐酸过量,充分反应后所得溶液中的微粒有水分子、钠离子、氯离子、氢离子,化学符号为:H2O、Na+、Cl﹣、H+;
(2)设样品中碳酸氢钠的质量为x。
NaHCO3+HCl=NaCl+H2O+CO2↑
84 44
x 8.8g
x=16.8g
则样品中碳酸氢钠的质量分数为:。
答:小苏打样品中碳酸氢钠质量分数为84.0%。
故答案为:
(1)8.8;H2O、Na+、Cl﹣、H+;
(2)84.0%。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
14.(2025春 巴彦县期中)现有一瓶过氧化氢溶液,实验兴趣小组的同学们取部分溶液进行了如下实验,请结合实验回答下列问题:
(1)上述实验过程中发生反应的化学方程式为 2H2O22H2O+O2↑ 。
(2)根据生成氧气的质量列出求解生成水的质量(x)的比例式 。
(3)272g过氧化氢溶液中过氧化氢与水的质量比为 1:19 。
(4)最后270.6g固液混合物中液体的质量为 265.6g 。
(5)若将上述的固液混合物过滤后,向滤液中再加入4.4g水,如图,则需要 30 g氢气完全燃烧,才能生成最终烧杯中水的质量。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)2H2O22H2O+O2↑;
(2);
(3)1:19;
(4)265.6g;
(5)30。
【分析】(1)根据过氧化氢在二氧化锰催化作用下生成水和氧气分析;
(2)根据质量守恒定律结合化学方程式列比例式;
(3)根据氧气的质量结合化学方程式进行计算;
(4)根据催化剂的特点分析;
(5)根据水的质量结合化学方程式进行计算。
【解答】解:(1)过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式为:2H2O22H2O+O2↑;
(2)根据质量守恒定律,生成的氧气的质量为272g+5g﹣270.6g=6.4g;
设反应生成的水的质量为x。
生成水的质量(x)的比例式为;
(3)设过氧化氢的质量为y
y=13.6g
272g过氧化氢溶液中过氧化氢的质量为13.6g,272g过氧化氢溶液中水的质量为:272g﹣13.6g=258.4g,272g过氧化氢溶液中过氧化氢与水的质量比为13.6g:258.4g=1:19;
(4)二氧化锰为催化剂,反应前后质量不变,最后270.6g固液混合物中液体的质量为270.6g﹣5g=265.6g;
(5)若将上述的固液混合物过滤后,只含有265.6g的水,在加入4.4g的水,共有270g的水,
设需要氢气的质量为w。
2H2+O22H2O
4 36
w 270g
w=30g
需要30g氢气完全燃烧,才能生成最终烧杯中水的质量。
故答案为:
(1)2H2O22H2O+O2↑;
(2);
(3)1:19;
(4)265.6g;
(5)30。
【点评】本题主要考查了根据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
15.(2025 汕尾模拟)水垢的成分是氢氧化镁和碳酸钙,某兴趣小组为测定其中各成分的质量分数,取12.9g混合物样品加热,加热过程中剩余固体的质量随加热时间的变化如图所示。已知氢氧化镁受热易分解,反应的化学方程式为Mg(OH)2MgO+H2O↑,碳酸钙在高温条件下分解,反应的化学方程式为CaCO3CaO+CO2↑。
(1)碳酸钙中钙元素的质量分数为 40% 。
(2)在 t2 时Mg(OH)2恰好完全分解, t4 时CaCO3恰好完全分解。(填“t1~t4”中对应时间点)
(3)12.9g水垢样品中碳酸钙的质量为 10g (写出计算过程)。
(4)某时刻测得剩余固体中钙元素的质量分数为40%,则此时剩余固体的成分为 CaO、CaCO3、MgO (填化学式)。
【考点】化学方程式与实验的计算;元素的质量分数计算.
【专题】有关化学方程式的计算.
【答案】(1)40%
(2)t2;t4;
(3)10g;
(4)CaO、CaCO3、MgO。
【分析】(1)根据元素质量分数的计算来分析;
(2)根据氢氧化镁受热易分解,碳酸钙在高温条件下分解,加热时氢氧化镁先分解生成氧化镁和水来分析;
(3)根据氢氧化镁受热分解生成水的质量和化学方程式的计算来分析;
(4)根据在碳酸钙和氧化镁的混合物中钙元素的质量分数,以及碳酸钙完全分解后剩余固体中钙元素的质量分数来分析。
【解答】解:(1)碳酸钙(CaCO3)中钙元素的质量分数为:。
(2)已知氢氧化镁受热易分解,反应的化学方程式为Mg(OH)2MgO+H2O↑,碳酸钙在高温条件下分解,反应的化学方程式为CaCO3CaO+CO2↑,加热时氢氧化镁先分解生成氧化镁和水,图中ab段表示氢氧化镁分解过程,cd段表示碳酸钙的分解过程,在t2时氢氧化镁恰好完全分解,t4时表示碳酸钙恰好完全分解。
(3)由图可知,氢氧化镁受热分解生成水的质量为:12.9g﹣12.0g=0.9g;
设12.9g水垢样品中氢氧化镁的质量为x。
Mg(OH)2MgO+H2O↑
58 18
x 0.9g
x=2.9
则12.9g水垢样品中碳酸钙的质量为:12.9g﹣2.9g=10g。
答:12.9g水垢样品中碳酸钙的质量为10g。
(4)由上述计算可知,碳酸钙的质量为10g,在碳酸钙和氧化镁的混合物中钙元素的质量分数为:;
设10g碳酸钙完全分解生成氧化钙的质量为y。
CaCO3CaO+CO2↑
100 56
10g y
x=5.6g
碳酸钙完全分解,剩余固体中钙元素的质量分数为:。
剩余固体中钙元素的质量分数为40%,33.3%<40%<52.6%,说明氢氧化镁已完全分解,碳酸钙未完全分解,则剩余固体的成分为CaO、CaCO3、MgO。
故答案为:
(1)40%
(2)t2;t4;
(3)10g;
(4)CaO、CaCO3、MgO。
【点评】本题主要考查了物质的性质和化学方程式的计算,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
16.(2025春 道里区期中)兴趣小组同学想测定某石灰石(杂质不溶于水也不与酸反应)中碳酸钙的质量分数。现取该石灰石12.5克放入烧杯内,然后向烧杯内加入100g的足量稀盐酸,进行如图所示的实验。试回答:
(1)实验过程中生成二氧化碳的质量为 4.4 g。
(2)该石灰石中碳酸钙的质量分数为多少?(写出计算过程)
(3)若工业上利用上述纯度的100t石灰石制取二氧化碳,完全反应后钙元素在剩余固体中的质量分数为 49.4% 。(保留0.1%)
【考点】化学方程式与实验的计算.
【答案】(1)4.4;
(2)80%;
(3)49.4%。
【分析】(1)根据质量守恒定律分析;
(2)根据二氧化碳的质量结合化学方程式进行计算;
(3)根据元素守恒分析。
【解答】解:(1)实验过程中生成二氧化碳的质量为12.5g+100g﹣108.1g=4.4g;
(2)设石灰石中碳酸钙的质量分数为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
12.5gx 4.4g
x=80%
答:石灰石中碳酸钙的质量分数为80%。
(3)设100t石灰石制取二氧化碳的质量为y,
CaCO3CaO+CO2↑
100 44
100t×80%=80t y
y=35.2t
根据钙元素的守恒,完全反应后钙元素在剩余固体中的质量80t32t,
所以完全反应后钙元素在剩余固体中的质量分数为49.4%,
答:完全反应后钙元素在剩余固体中的质量分数为49.4%。
故答案为:(1)4.4;
(2)80%;
(3)49.4%。
【点评】本题主要考查了根据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
17.(2025 龙口市一模)“金粉”(Cu—Zn合金)是一种金属颜料,可用于文物修复,某化学兴趣小组通过实验测定“金粉”中铜的含量:称取25g“金粉”样品放入锥形瓶中,将50g稀盐酸分5次加入,记录每次反应后锥形瓶内物质的总质量,实验过程和数据如表。
加入次数 第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量/g 10 10 10 10 10
反应后锥形瓶内物质总质量/g 34.94 44.88 54.82 a 74.78
(1)a的数值为 64.78 ,第4次反应结束后,溶液中溶质的成分为 ZnCl2、HCl (写化学式)。
(2)计算样品中铜的质量分数(写出计算过程)。
(3)实验中,测得铜的质量分数比实际偏低,则原因可能是 盐酸具有挥发性,会使反应后锥形瓶内物质总质量偏小 。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)64.78;ZnCl2、HCl;
(2)71.4%;
(3)盐酸具有挥发性,会使反应后锥形瓶内物质总质量偏小。
【分析】(1)根据质量守恒定律,化学反应前后物质的总质量不变,结合题中数据来分析;
(2)根据生成氢气的总质量和化学方程式的计算来分析;
(3)根据盐酸具有挥发性,会使反应后锥形瓶内物质总质量偏小来分析。
【解答】解:(1)根据质量守恒定律,化学反应前后物质的总质量不变,则生成氢气的总质量为25g+10g×5﹣74.78g=0.22g,第1次加入10g稀盐酸,锥形瓶内减少的质量为25g+10g﹣34.94g=0.06g,第2次加入10g稀盐酸,锥形瓶内减少的质量为34.94g+10g﹣44.88g=0.06g,第3次加入10g稀盐酸,锥形瓶内减少的质量为44.88g+10g﹣54.82g=0.06g,说明每10g稀盐酸完全反应,产生氢气的质量为0.06g,前三次生成氢气的总质量为:0.06g×3=0.18g,整个反应过程中生成氢气的总质量为0.22g,则第4次加入10g稀盐酸,生成氢气的总质量为0.22g﹣0.18g=0.04g<0.06g,所以第四次时锌已经完全反应,稀盐酸过量,反应后锥形瓶内物质的总质量为54.82+10g﹣0.04g=64.78g,则a的数值为64.78;第4次反应结束后,溶液中溶质的成分为生成的氯化锌和过氧的氯化锌,化学式为:ZnCl2、HCl。
(2)由上述分析可知,生成氢气的总质量为0.22g;
设样品中锌的质量为x。
Zn+H2SO4=ZnCl2+H2↑
65 2
x 0.22g
x=7.15g
即样品中锌的质量为7.15g,则样品中铜的质量为:25g﹣7.15g=17.85g,则样品中铜的质量分数为:100%=71.4%。
答:样品中铜的质量分数为71.4%。
(3)盐酸具有挥发性,会使反应后锥形瓶内物质总质量偏小,导致生成气体的质量偏大,从而使锌质量的计算结果偏大,导致测得铜的质量分数比实际偏低。
故答案为:
(1)64.78;ZnCl2、HCl;
(2)71.4%;
(3)盐酸具有挥发性,会使反应后锥形瓶内物质总质量偏小。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
18.(2025 新城区模拟)化学实验室开放日活动中,同学们欲测定大理石中碳酸钙(杂质不溶于水,也不与盐酸反应)的质量分数。将20g大理石粉碎后放入烧杯中,向烧杯中加入稀盐酸,所加稀盐酸的质量与生成气体的质量关系如图所示。
(1)A点对应溶液中的溶质是 CaCl2 。
(2)加入50g稀盐酸时生成二氧化碳的质量是 4.4g 。
(3)计算大理石中碳酸钙的质量分数。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)CaCl2;
(2)4.4g;
(3)75%。
【分析】(1)根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,以及A点时碳酸钙还未反应完来分析;
(2)根据图中数据,加入50g稀盐酸时生成二氧化碳的质量是4.4g来分析;
(3)根据生成二氧化碳的总质量结合化学方程式的计算来分析。
【解答】解:(1)大理石的主要成分是碳酸钙,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,由图可知,A点时碳酸钙还未反应完,此时溶液中的溶质是生成的氯化钙(CaCl2)。
(2)由图可知,加入50g稀盐酸时生成二氧化碳的质量是4.4g。
(3)由图可知,生成二氧化碳的总质量为6.6g;
设大理石中碳酸钙的质量分数为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
20gx 6.6g
x=75%
答:大理石中碳酸钙的质量分数为75%。
故答案为:
(1)CaCl2;
(2)4.4g;
(3)75%。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
19.(2025 利津县一模)如图是碳酸钙D3片标签的部分信息。化学社团为测定该药片中碳酸钙的量是否与标签相符,进行实验:取8片药片研碎后,分6次加入质量分数为7.3%的稀盐酸溶液150g,充分反应。实验相关数据如表格所示(假设其他成分不参加反应)。
盐酸质量(g) 25 50 75 100 125 150
CO2的质量(g) 1.1 2.2 3.3 4.4 4.4 4.4
(1)恰好完全反应时消耗稀盐酸的质量为 100 g。
(2)计算每片药片中碳酸钙质量并判断是否与标签相符。(写出计算过程)
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)100;
(2)1.25g,与标签相符。
【分析】(1)根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,结合表中数据来分析;
(2)根据二氧化碳的质量和化学方程式的计算来分析。
【解答】解:(1)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,由表中数据可知,恰好完全反应时消耗稀盐酸的质量为100g;
(2)设8片药片中碳酸钙的总质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
x=10g
则每片药片中碳酸钙的质量为:10g÷8=1.25g,与标签相符。
答:每片药片中碳酸钙的质量为1.25g,与标签相符。
故答案为:
(1)100;
(2)1.25g,与标签相符。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
20.(2025 香坊区二模)某钢铁厂实验室为了测定赤铁矿中Fe2O3的含量,将矿石粉碎(杂质既不溶于水,也不与酸反应)加入稀硫酸,进行如下实验。请回答问题:
(1)发生反应的化学方程式为 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 。
(2)将矿石粉碎的目的是 增大反应物之间的接触面积,使反应更快、更充分 。
(3)该矿石中Fe2O3的含量为 80% 。
(4)a的数值为 42 。
(5)若用460t上述赤铁矿炼铁,炼铁过程中矿石利用率为80%,则可以得到含铁92%的生铁的质量为 224t 。
【考点】含杂质的化学方程式计算;铁的冶炼.
【专题】有关化学方程式的计算.
【答案】(1)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)增大反应物之间的接触面积,使反应更快、更充分;
(3)80%;
(4)42;
(5)224t。
【分析】(1)根据氧化铁和稀硫酸反应生成硫酸铁和水来分析解答;
(2)根据将矿石粉碎可以增大反应物之间的接触面积,使反应更快、更充分来分析解答;
(3)根据反应前后总质量不变来分析解答;
(4)根据氧化铁的质量和方程式来分析解答;
(5)根据题中数据来分析解答。
【解答】解:(1)赤铁矿的主要成分是氧化铁,加入稀硫酸后,氧化铁和稀硫酸反应生成硫酸铁和水,反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)将矿石粉碎的目的是增大反应物之间的接触面积,使反应更快、更充分;
(3)赤铁矿的主要成分是氧化铁,加入稀硫酸,氧化铁和稀硫酸反应生成硫酸铁和水,则杂质的质量为10g+150g﹣158g=2g,氧化铁的质量为10g﹣2g=8g,则该矿石中氧化铁的含量为100%=80%;
(4)设反应生成硫酸铁的质量为x,
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
160 400
8g x
x=20g
则100%=10%,a=42;
(5)氧化铁的质量为460t×80%×80%=294.4t,
设可以得到含铁92%的生铁的质量为y,
3CO+Fe2O32Fe+3CO2
160 112
294.4t 92%y
y=224t
即可以得到含铁92%的生铁的质量为224t。
【点评】本题主要考查化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
