【中考押题预测】2025年中考化学核心考点考前冲刺 质量守恒定律及其应用(含解析)
文档属性
| 名称 | 【中考押题预测】2025年中考化学核心考点考前冲刺 质量守恒定律及其应用(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 577.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-15 23:25:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
中考核心考点 质量守恒定律及其应用
一.选择题(共20小题)
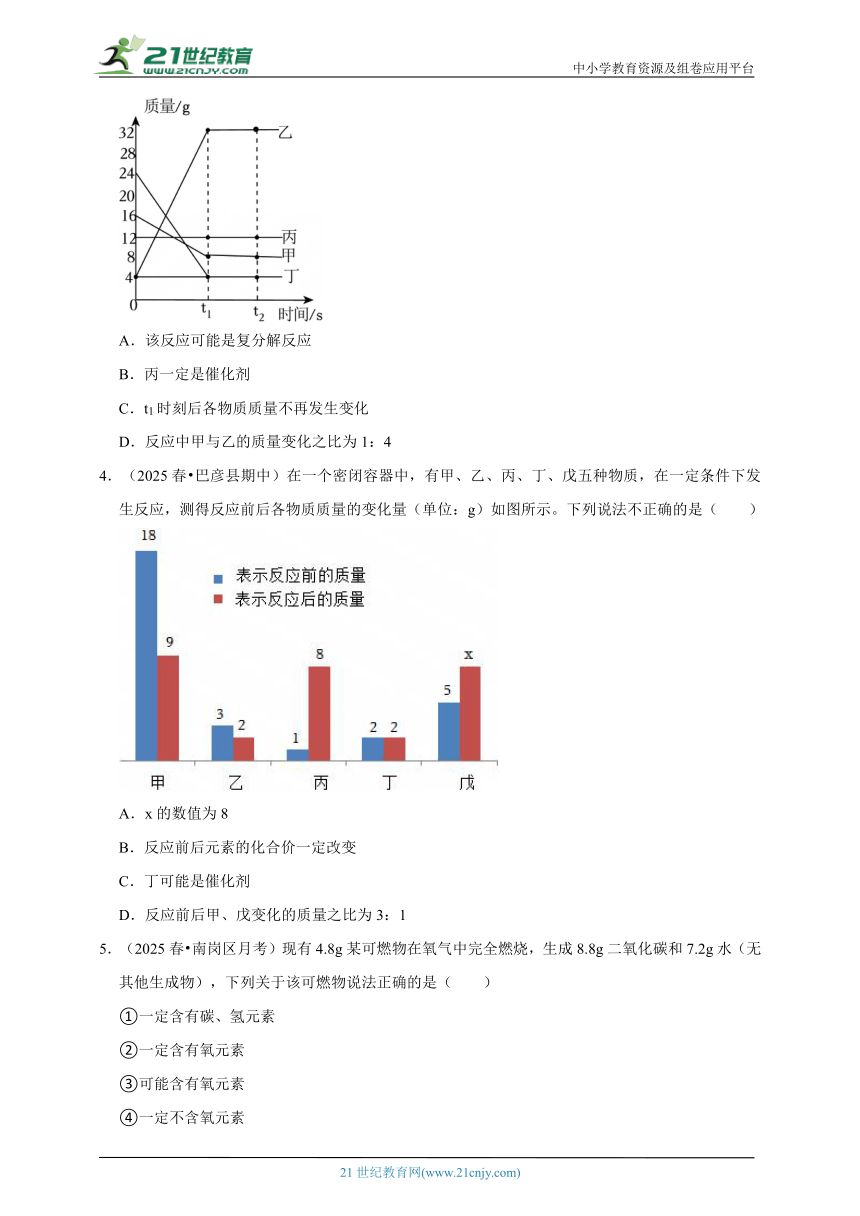
1.(2025 广阳区一模)学习小组加热锥形瓶中的过量铜粉验证质量守恒定律如图1,某变量y随时间的变化趋势如图2所示,下列说法错误的是( )
A.图1中锥形瓶加热结束,待冷却至室温再放到电子秤上称量
B.实验后瓶内的部分固体由红色变为黑色
C.图2中y可以表示锥形瓶内氧气的质量
D.反应前锥形瓶内铜粉和空气的总质量等于生成氧化铜的质量
2.(2025 市北区二模)用如图所示两个实验测定化学反应前后物质的质量关系,则下列说法不正确的是( )
A.甲中加热锥形瓶时观察到红色粉末变黑,气球先胀大后缩小
B.甲中锥形瓶冷却后放回天平,示数不变,拔松橡胶塞,示数减小
C.乙中若取用锌粒的量不足,对实验的结果没有影响
D.乙组实验中气球胀大后再称量质量,发现天平指针向右偏转
3.(2025 盘锦三模)在密闭容器内.有甲、乙、丙、丁四种物质,在一定条件下充分混合反应一段时间,测得反应前后各物质的质量如图所示,下列说法正确的是( )
A.该反应可能是复分解反应
B.丙一定是催化剂
C.t1时刻后各物质质量不再发生变化
D.反应中甲与乙的质量变化之比为1:4
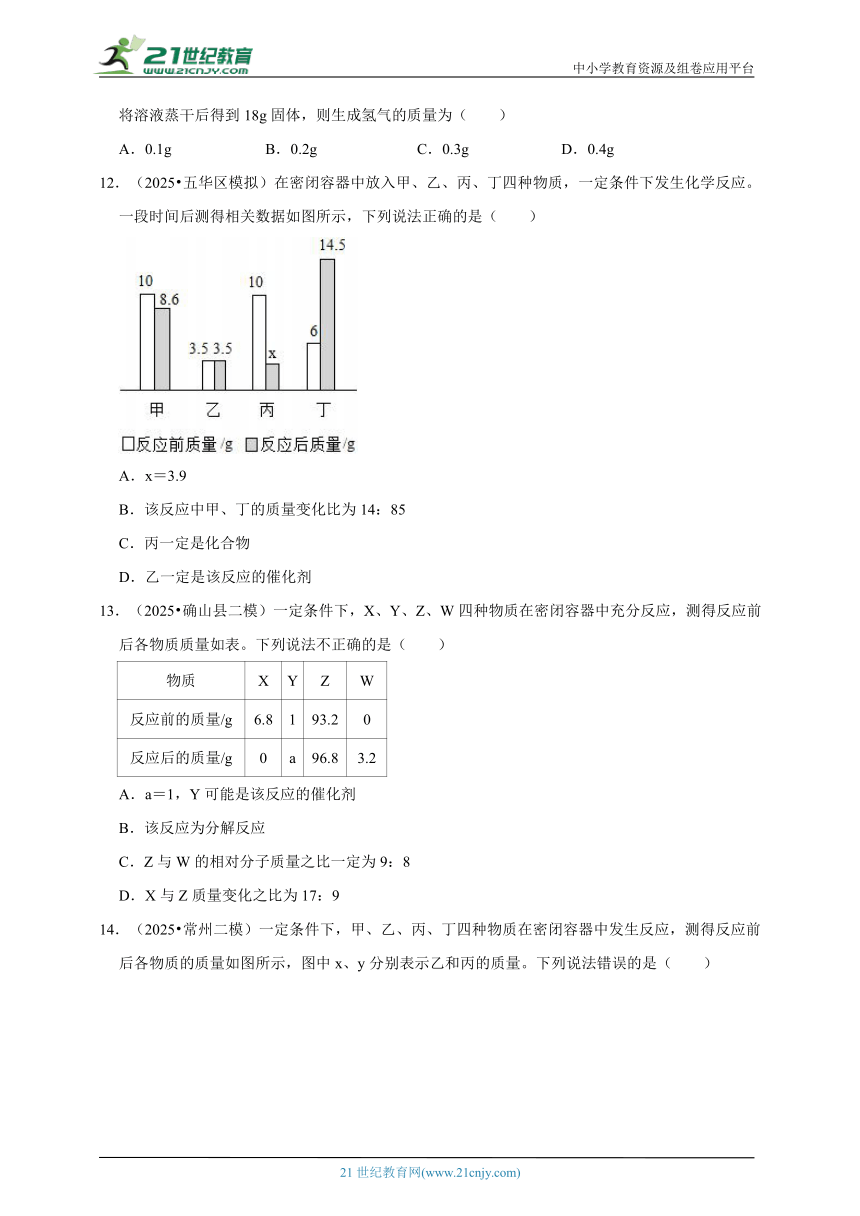
4.(2025春 巴彦县期中)在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质质量的变化量(单位:g)如图所示。下列说法不正确的是( )
A.x的数值为8
B.反应前后元素的化合价一定改变
C.丁可能是催化剂
D.反应前后甲、戊变化的质量之比为3:1
5.(2025春 南岗区月考)现有4.8g某可燃物在氧气中完全燃烧,生成8.8g二氧化碳和7.2g水(无其他生成物),下列关于该可燃物说法正确的是( )
①一定含有碳、氢元素
②一定含有氧元素
③可能含有氧元素
④一定不含氧元素
⑤碳、氢元素的质量比为3:1
⑥碳、氢元素的质量比为4:1
⑦碳、氢原子的个数比为1:3
⑧碳、氢原子的个数比为1:4
A.①②⑤⑧ B.①③⑤⑧ C.①④⑥⑦ D.①②⑤⑦
6.(2025 洛阳三模)将4.2g镁粉、铝粉的混合物加入200g质量分数为9.8%的稀硫酸中,恰好完全反应得到不饱和溶液,将溶液蒸干后得到固体的质量为( )
A.21g B.23.4g C.26.6g D.28.8g
7.(2025 汝南县三模)一定质量的乙醇在氧气不充足的条件下燃烧,可生成一氧化碳和二氧化碳的总质量为7.2g,同时生成水的质量为5.4g,则生成一氧化碳的质量是( )
A.0.7g B.1.4g C.2.8g D.5.6g
8.(2025 方城县二模)实验室有部分被氧化的铝片8.0g,与300.0g溶质质量分数为7.3%的稀盐酸恰好完全反应,该铝片中铝元素的质量为( )
A.7.8g B.5.4g C.6.0g D.2.7g
9.(2025 龙岩模拟)用下图装置进行实验,实验中观察到无水硫酸铜变蓝、澄清石灰水变浑浊。已知:无水硫酸铜为白色粉末,遇水变蓝。实验视作气体x在氧气氛围中燃烧。下列说法正确的是( )
A.气体x一定为纯净物
B.气体x与y含有的物质完全相同
C.气体x中一定含有C、H元素
D.气体x中一定含有C、H、O元素
10.(2025 洛阳模拟)实验室有部分被氧化的镁条8g,与300g溶质质量分数为7.3%的稀盐酸恰好完全反应,该镁条中镁元素的质量为( )
A.2.4g B.4.8g C.7.2g D.7.8g
11.(2025 荥阳市二模)向盛有3.6gMg、Zn两种金属混合物的烧杯中滴加稀硫酸至不再产生气体,将溶液蒸干后得到18g固体,则生成氢气的质量为( )
A.0.1g B.0.2g C.0.3g D.0.4g
12.(2025 五华区模拟)在密闭容器中放入甲、乙、丙、丁四种物质,一定条件下发生化学反应。一段时间后测得相关数据如图所示,下列说法正确的是( )
A.x=3.9
B.该反应中甲、丁的质量变化比为14:85
C.丙一定是化合物
D.乙一定是该反应的催化剂
13.(2025 确山县二模)一定条件下,X、Y、Z、W四种物质在密闭容器中充分反应,测得反应前后各物质质量如表。下列说法不正确的是( )
物质 X Y Z W
反应前的质量/g 6.8 1 93.2 0
反应后的质量/g 0 a 96.8 3.2
A.a=1,Y可能是该反应的催化剂
B.该反应为分解反应
C.Z与W的相对分子质量之比一定为9:8
D.X与Z质量变化之比为17:9
14.(2025 常州二模)一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如图所示,图中x、y分别表示乙和丙的质量。下列说法错误的是( )
A.x的取值范围:0≤x≤40
B.反应后丁的质量分数是12%
C.反应中丁与丙的质量比可以是2:1或1:2
D.y≤30时,该反应一定是化合反应
15.(2025 确山县二模)为了保护环境,我国的城市燃气已经广泛使用较为清洁的天然气,天然气的主要成分为甲烷。一定质量的甲烷与32g氧气在密闭容器中充分反应,生成CO和H2O的质量比为14:27,则甲烷的质量为( )
A.1.6g B.3.2g C.6.4g D.9.6g
16.(2025春 南岗区期中)下列叙述正确的是( )
A.在化合物中,非金属元素只能显负价
B.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
C.在反应2A+B=2C中,24gA完全反应生成40gC,C的相对分子质量为40,则B的相对分子质量为16
D.SO2、CO2、H2O2中氧元素的化合价相同
17.(2025春 南岗区期中)下列有关内容用质量守恒定律解释正确的是( )
A.10mL水和10mL酒精混合后,总体积一定是20mL
B.某化合物在氧气中燃烧只生成二氧化碳,则该化合物一定含碳元素和氧元素
C.煤燃烧后产生的煤渣的质量一定等于所用煤的质量
D.将5gA和5gB混合后发生化合反应,一定能生成10gC
18.(2025 福田区二模)某小组用氧气传感器探究过氧化钠(Na2O2)与水反应(图1):①取Na2O2于试管中,加少量H2O塞紧传感器;②取下传感器,加少量MnO2并塞紧。氧气体积分数随时间变化曲线如图2。实验中包含下列反应Na2O2+H2O→NaOH+X;X→H2O+O2,下列说法错误的是( )
A.物质X为H2O2
B.a→c过程中无气泡生成
C.d→e过程装置内压强变大
D.该反应总的化学方程式:2Na2O2+2H2O=4NaOH+O2↑
19.(2025 秦淮区一模)丙烷(化学式为C3H8)是液化石油气的主要成分之一。现有4.4g丙烷与一定量氧气混合于密闭容器内,在一定条件下全部转化为一氧化碳、二氧化碳和水,恢复至室温,测得所得气体中氧元素质量分数为70%,则参加反应的氧气的质量为( )
A.16g B.14.8g C.11.2g D.8.4g
20.(2025春 龙口市期中)化学中经常用燃烧法测定有机物的组成。现取3.2g某有机物在足量的氧气中充分燃烧,生成4.4gCO2和3.6gH2O,则下列关于该有机物的说法错误的是( )
A.一定含有C、H、O三种元素
B.消耗氧气的质量为4.8g
C.化学式可能为CH4O
D.有机物中C和O的质量比为1:1
中考核心考点 质量守恒定律及其应用
参考答案与试题解析
一.选择题(共20小题)
1.(2025 广阳区一模)学习小组加热锥形瓶中的过量铜粉验证质量守恒定律如图1,某变量y随时间的变化趋势如图2所示,下列说法错误的是( )
A.图1中锥形瓶加热结束,待冷却至室温再放到电子秤上称量
B.实验后瓶内的部分固体由红色变为黑色
C.图2中y可以表示锥形瓶内氧气的质量
D.反应前锥形瓶内铜粉和空气的总质量等于生成氧化铜的质量
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【答案】D
【分析】化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【解答】解:A、反应结束后,冷却至室温前气球受到空气的浮力不断变化,应冷却至室温再称量,故选项正确。
B、铜粉加热与氧气反应生成黑色的氧化铜,但铜粉过量,所以铜粉不会全部变为黑色氧化铜,故选项正确。
C、铜与氧气在加热的条件下反应生成氧化铜,氧气质量减少,图2中y可以表示氧气质量,故选项正确。
D、根据质量守恒定律,参加反应的物质的总质量与生成物的总质量相等,则生成氧化铜的质量等于参加反应的铜粉的质量和参加反应的氧气的质量之和,故选项不正确。
故选:D。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
2.(2025 市北区二模)用如图所示两个实验测定化学反应前后物质的质量关系,则下列说法不正确的是( )
A.甲中加热锥形瓶时观察到红色粉末变黑,气球先胀大后缩小
B.甲中锥形瓶冷却后放回天平,示数不变,拔松橡胶塞,示数减小
C.乙中若取用锌粒的量不足,对实验的结果没有影响
D.乙组实验中气球胀大后再称量质量,发现天平指针向右偏转
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】验证质量守恒定律的实验时,选用试剂和装置应考虑:①只有用天平称量质量没有变化的化学变化才能直接用于验证质量守恒;②如果反应物中有气体参加反应,或生成物中有气体生成,应该选用密闭装置。
【解答】解:A、甲中加热锥形瓶时,铜和氧气在加热条件下生成氧化铜,装置内空气受热膨胀,随着反应的进行,氧气被消耗,装置中气体体积减少,压强减小,观察到红色粉末变黑,气球先胀大后缩小,故选项说法正确。
B、甲中反应在密闭容器中进行,根据质量守恒定律,化学反应前后物质的总质量不变,锥形瓶冷却后放回天平,示数不变;拔松橡胶塞,由于消耗了氧气,外界空气会进入装置,导致装置质量增大,示数应增大,而不是减小,故选项说法错误。
C、参加反应的锌和硫酸的质量之和等于反应生成的硫酸锌和氢气的质量之和,取用锌粒的量的多少对实验结果无影响,故选项说法正确。
D、乙组实验中,锌和稀硫酸反应生成氢气,气球胀大,受到空气浮力增大,导致左侧质量测量值偏小,天平指针向右偏转,故选项说法正确。
故选:B。
【点评】本题难度不大,理解质量守恒定律,明确在设计验证质量守恒定律的实验时最好在密闭容器中进行是正确解答本题的关键。
3.(2025 盘锦三模)在密闭容器内.有甲、乙、丙、丁四种物质,在一定条件下充分混合反应一段时间,测得反应前后各物质的质量如图所示,下列说法正确的是( )
A.该反应可能是复分解反应
B.丙一定是催化剂
C.t1时刻后各物质质量不再发生变化
D.反应中甲与乙的质量变化之比为1:4
【考点】有关质量守恒定律的计算;反应类型的判定.
【专题】化学用语和质量守恒定律.
【答案】C
【分析】由图可知,t1时刻后各物质质量不再发生变化,则t1时刻反应已经停止;反应后甲的质量减少了16g﹣8g=8g,则甲是反应物;反应后乙质量增加了32g﹣4g=28g,则乙是生成物;反应前后丙的质量不变,则丙可能是该反应的催化剂,也可能是杂质;反应后丁的质量减少了24g﹣4g=20g,则丁是反应物;该反应是甲和丁在一定条件下反应生成乙,符合多变一的特点,属于化合反应;据此分析解答。
【解答】解:A、该反应是甲和丁在一定条件下反应生成乙,符合多变一的特点,属于化合反应,故选项说法不正确。
B、反应前后丙的质量不变,则丙可能是该反应的催化剂,也可能是杂质,故选项说法不正确。
C、由图可知,t1时刻后各物质质量不再发生变化,故选项说法正确。
D、反应中甲与乙的质量变化之比为(16g﹣8g):(32g﹣4g)=2:7,故选项说法不正确。
故选:C。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
4.(2025春 巴彦县期中)在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质质量的变化量(单位:g)如图所示。下列说法不正确的是( )
A.x的数值为8
B.反应前后元素的化合价一定改变
C.丁可能是催化剂
D.反应前后甲、戊变化的质量之比为3:1
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】根据质量守恒定律,化学反应前后物质的总质量不变,由图中数据可知,x=18+3+1+2+5﹣9﹣2﹣8﹣2=8;反应后甲的质量减少了18g﹣9g=9g,则甲是反应物;反应后乙的质量减少了3g﹣2g=1g,则乙是反应物;反应后丙的质量增加了8g﹣1g=7g,则丙是生成物;反应前后丁的质量不变,则丁可能是该反应的催化剂,也可能是杂质;反应后戊的质量增加了8g﹣5g=3g,则戊是生成物;该反应是甲和乙在一定条件下反应生成丙和戊;据此分析解答。
【解答】解:A、由图中数据可知,x=18+3+1+2+5﹣9﹣2﹣8﹣2=8,故选项说法正确。
B、该反应是甲和乙在一定条件下反应生成丙和戊,由于不知道,甲、乙、丙、戊是单质还是化合物,所以反应前后元素的化合价可能不变,故选项说法错误。
C、反应前后丁的质量不变,则丁可能是该反应的催化剂,也可能是杂质,故选项说法正确。
D、反应前后甲、戊变化的质量之比为(18g﹣9g):(8g﹣5g)=3:1,故选项说法正确。
故选:B。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
5.(2025春 南岗区月考)现有4.8g某可燃物在氧气中完全燃烧,生成8.8g二氧化碳和7.2g水(无其他生成物),下列关于该可燃物说法正确的是( )
①一定含有碳、氢元素
②一定含有氧元素
③可能含有氧元素
④一定不含氧元素
⑤碳、氢元素的质量比为3:1
⑥碳、氢元素的质量比为4:1
⑦碳、氢原子的个数比为1:3
⑧碳、氢原子的个数比为1:4
A.①②⑤⑧ B.①③⑤⑧ C.①④⑥⑦ D.①②⑤⑦
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】A
【分析】根据质量守恒定律,化学反应前后元素的种类和质量不变来分析。
【解答】解:现有4.8g某可燃物在氧气中完全燃烧,生成8.8g二氧化碳和7.2g水(无其他生成物),根据质量守恒定律,化学反应前后元素的种类和质量不变,生成物二氧化碳和水中含有碳、氢、氧三种元素,反应物氧气中只含有氧元素,则该可燃物中一定含有碳、氢元素,8.8g二氧化碳中碳元素的质量为:,7.2g水中氢元素的质量为:,2.4g+0.8g=3.2g<4.8g,则该可燃物中还含有4.8g﹣3.2g=1.6g氧元素;该可燃物中C、H元素的质量比为2.4g:0.8g=3:1;该可燃物中C、H元素的原子个数比为。
由上述分析可知,正确的是:①②⑤⑧。
故选:A。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
6.(2025 洛阳三模)将4.2g镁粉、铝粉的混合物加入200g质量分数为9.8%的稀硫酸中,恰好完全反应得到不饱和溶液,将溶液蒸干后得到固体的质量为( )
A.21g B.23.4g C.26.6g D.28.8g
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】根据质量守恒定律,镁和硫酸反应生成硫酸镁和氢气,铝和硫酸反应生成硫酸铝和氢气,硫酸根全部来自于硫酸,蒸干后得到固体硫酸镁和硫酸铝的质量等于金属的质量加上硫酸根的质量来分析。
【解答】解:将4.2g镁粉、铝粉的混合物加入200g质量分数为9.8%的稀硫酸中,恰好完全反应得到不饱和溶液,镁和硫酸反应生成硫酸镁和氢气,铝和硫酸反应生成硫酸铝和氢气,则溶液中的溶质是硫酸镁和硫酸铝,将溶液蒸干后得到固体为硫酸镁和硫酸铝,硫酸根全部来自于硫酸,则蒸干后得到固体硫酸镁和硫酸铝的质量等于金属的质量加上硫酸根的质量,200g质量分数为 9.8%的稀硫酸中硫酸根的质量为:200g×9.8%100%=19.2g,则将溶液蒸干后得到固体的质量为:19.2g+4.2g=23.4g。
故选:B。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
7.(2025 汝南县三模)一定质量的乙醇在氧气不充足的条件下燃烧,可生成一氧化碳和二氧化碳的总质量为7.2g,同时生成水的质量为5.4g,则生成一氧化碳的质量是( )
A.0.7g B.1.4g C.2.8g D.5.6g
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】C
【分析】根据质量守恒定律,化学反应前后元素的种类和质量不变,结合题中数据来分析。
【解答】解:一定质量的乙醇在氧气不充足的条件下燃烧,可生成一氧化碳和二氧化碳的总质量为7.2g,同时生成水的质量为5.4g,根据质量守恒定律,化学反应前后元素的种类和质量不变,5.4g水(H2O)中氢元素的质量为:5.4g100%=0.6g,则乙醇的质量为:0.6g÷(100%)=4.6g,4.6g乙醇中碳元素的质量为:4.6g100%=2.4g,设一氧化碳的质量为x,则二氧化碳的质量为7.2g﹣x,由碳元素守恒可得:x100%+(7.2g﹣x)100%=2.4g,解得:x=2.8g,则生成一氧化碳的质量是2.8g。
故选:C。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
8.(2025 方城县二模)实验室有部分被氧化的铝片8.0g,与300.0g溶质质量分数为7.3%的稀盐酸恰好完全反应,该铝片中铝元素的质量为( )
A.7.8g B.5.4g C.6.0g D.2.7g
【考点】有关质量守恒定律的计算;化合物中某元素的质量计算.
【专题】化学式的计算.
【答案】B
【分析】根据质量守恒定律,化学反应前后元素的质量不变,进行分析解答。
【解答】解:氧化铝和稀盐酸反应生成氯化铝和水,铝和稀盐酸反应生成氯化铝和氢气,根据质量守恒定律,化学反应前后元素的种类和质量不变,盐酸中的氯元素完全转化到了氯化铝中,铝片中的铝元素完全转化到了氯化铝中,氯元素的质量为,设铝元素的质量为x,则x:21.3g=27:106.5,x=5.4g。
故选:B。
【点评】本题难度不大,了解化学反应前后元素的质量不变、化学式的有关计算等是正确解答本题的关键。
9.(2025 龙岩模拟)用下图装置进行实验,实验中观察到无水硫酸铜变蓝、澄清石灰水变浑浊。已知:无水硫酸铜为白色粉末,遇水变蓝。实验视作气体x在氧气氛围中燃烧。下列说法正确的是( )
A.气体x一定为纯净物
B.气体x与y含有的物质完全相同
C.气体x中一定含有C、H元素
D.气体x中一定含有C、H、O元素
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】C
【分析】根据质量守恒定律、物质的性质及其检验方法来分析。
【解答】解:无水硫酸铜变蓝,证明有水蒸气生成,澄清石灰水变浑浊,证明有二氧化碳生成。由质量守恒定律可知,气体x中一定含有碳元素与氢元素,可能含有氧元素。
A、该气体燃烧生成水和二氧化碳,该气体可能是纯净物,如甲烷,也可能是一氧化碳与氢气的混合物,故选项A说法不正确;
B、气体y中一定含有二氧化碳,x中不一定含有二氧化碳,因此二者的成分可能不同,故选项B说法不正确;
C、结合前面分析可知,气体x中一定含有C、H元素,故选项C说法正确;
D、结合前面分析可知,气体x中一定含有碳、氢元素,可能含有氧元素,故选项D说法不正确。
故选:C。
【点评】本题难度不大,掌握质量守恒定律以及物质的检验方法是解题的关键。
10.(2025 洛阳模拟)实验室有部分被氧化的镁条8g,与300g溶质质量分数为7.3%的稀盐酸恰好完全反应,该镁条中镁元素的质量为( )
A.2.4g B.4.8g C.7.2g D.7.8g
【考点】有关质量守恒定律的计算;化合物中某元素的质量计算.
【专题】化学用语和质量守恒定律.
【答案】C
【分析】根据质量守恒定律,化学反应前后氯元素的质量不变,进行分析判断。
【解答】解:盐酸氧化镁和稀盐酸反应生成氯化镁和水,镁和稀盐酸反应生成氯化镁和氢气,生成的氯化镁中氯元素的质量为300g×7.3%21.3g,生成氯化镁的质量为21.3g28.5g。由质量守恒定律,反应前后氯元素的质量不变,氯化镁中镁元素的质量即为样品中镁元素的质量,该镁条中镁元素的质量为28.5g﹣21.3g=7.2g。
故选:C。
【点评】本题难度不大,明确化学反应前后氯元素的质量不变是正确解答本题的关键。
11.(2025 荥阳市二模)向盛有3.6gMg、Zn两种金属混合物的烧杯中滴加稀硫酸至不再产生气体,将溶液蒸干后得到18g固体,则生成氢气的质量为( )
A.0.1g B.0.2g C.0.3g D.0.4g
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】C
【分析】根据镁和硫酸反应生成硫酸镁和氢气,锌和硫酸反应生成硫酸锌和氢气,固体增加的质量为硫酸根离子的质量,由题中数据结合质量守恒定律来分析。
【解答】解:向盛有3.6gMg、Zn两种金属混合物的烧杯中滴加稀硫酸至不再产生气体,镁和硫酸反应生成硫酸镁和氢气,锌和硫酸反应生成硫酸锌和氢气,将溶液蒸干后得到18g固体,则固体增加的质量为硫酸根离子的质量,为:18g﹣3.6g=14.4g,固体中的硫酸根来自硫酸,则硫酸质量为:14.4g÷(100%)=14.7g,硫酸中氢元素质量为:14.7g﹣14.4g=0.3g,根据质量守恒定律,氢气中的氢元素全部来自硫酸,则生成氢气质量为0.3g。
故选:C。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
12.(2025 五华区模拟)在密闭容器中放入甲、乙、丙、丁四种物质,一定条件下发生化学反应。一段时间后测得相关数据如图所示,下列说法正确的是( )
A.x=3.9
B.该反应中甲、丁的质量变化比为14:85
C.丙一定是化合物
D.乙一定是该反应的催化剂
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。反应后质量增加的是生成物,减少的是反应物,所以10+3.5+10+6=8.6+3.5+x+14.5,解得x=2.9,所以甲、丙为反应物,丁为生成物,该反应为化合反应,乙可能是催化剂也可能是不参加反应的杂质;据此分析解答。
【解答】解:A、由分析可知,x=2.9,故选项说法不正确。
B、反应的甲、丁的质量比为(10g﹣8.6g):(14.5g﹣6g)=14:85,故选项说法正确。
C、丙为化合反应的反应物之一,可能是单质也可能是化合物,故选项说法不正确。
D、乙反应前后质量不变,可能是催化剂,也可能为不参加反应的杂质,故选项说法不正确。
故选:B。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
13.(2025 确山县二模)一定条件下,X、Y、Z、W四种物质在密闭容器中充分反应,测得反应前后各物质质量如表。下列说法不正确的是( )
物质 X Y Z W
反应前的质量/g 6.8 1 93.2 0
反应后的质量/g 0 a 96.8 3.2
A.a=1,Y可能是该反应的催化剂
B.该反应为分解反应
C.Z与W的相对分子质量之比一定为9:8
D.X与Z质量变化之比为17:9
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】C
【分析】根据质量守恒定律,化学反应前后物质的总质量不变,由表中数据可知,a=6.8+1+93.2+0﹣0﹣96.8﹣3.2=1,反应后X的质量减小了6.8g,则X是反应物;反应前后Y的质量不变,则Y可能是该反应的催化剂,也可能是杂质;反应后Z的质量增加了3.6g,则Z是生成物;反应后W的质量增加了3.2g,则W是生成物;该反应是X在一定条件下反应生成Z和W,符合一变多的特点,属于分解反应;据此分析解答。
【解答】解:A、由表中数据可知,a=6.8+1+93.2+0﹣0﹣96.8﹣3.2=1,反应前后Y的质量不变,则Y可能是该反应的催化剂,也可能是杂质,故选项说法正确。
B、该反应是X在一定条件下反应生成Z和W,符合一变多的特点,属于分解反应,故选项说法正确。
C、该反应中生成Z与W的质量比为(96.8g﹣93.2g):(3.2g﹣0)=9:8,由于不知道化学计量数,无法判断Z与W的相对分子质量之比,故选项说法不正确。
D、该反应中X与Z的质量变化之比为(6.8g﹣0):(96.8g﹣93.2g)=17:9,故选项说法正确。
故选:C。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
14.(2025 常州二模)一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如图所示,图中x、y分别表示乙和丙的质量。下列说法错误的是( )
A.x的取值范围:0≤x≤40
B.反应后丁的质量分数是12%
C.反应中丁与丙的质量比可以是2:1或1:2
D.y≤30时,该反应一定是化合反应
【考点】有关质量守恒定律的计算;反应类型的判定.
【专题】化学用语和质量守恒定律.
【答案】A
【分析】根据质量守恒定律,化学反应前后物质的总质量不变,由表中数据可知,x+y=30+40+30+25﹣10﹣15=100,即反应后乙与丙的质量和为100g;反应后甲的质量减少了30g﹣10g=20g,则甲是反应物;反应后丁的质量减少了25g﹣15g=10g,则丁是反应物;反应后乙和丙的质量总共增加了100g﹣(40g+30g)=30g,与甲、丁减少的质量和相等;据此分析解答。
【解答】解:A、当y=0时,x=30+40+30+25﹣10﹣15=100,则x的取值范围是0≤x≤100,故选项说法错误。
B、密闭容器中物质的总质量为:30g+40g+30g+25g=125g,反应后丁的质量为15g,则反应后丁的质量分数为:100%=12%,故选项说法正确。
C、参加反应的丁的质量为10g,反应后乙与丙的质量和为100g,则丙的质量可以是5g或20g,则反应中丁与丙的质量比可以是2:1或1:2,故选项说法正确。
D、当y=30时,甲、丁是反应物,乙是生成物,生成物只有一种,当y小于30时,甲、丁、丙是反应物,乙是生成物,生成物只有一种,则y≤30时,该反应一定是化合反应,故选项说法正确。
故选:A。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
15.(2025 确山县二模)为了保护环境,我国的城市燃气已经广泛使用较为清洁的天然气,天然气的主要成分为甲烷。一定质量的甲烷与32g氧气在密闭容器中充分反应,生成CO和H2O的质量比为14:27,则甲烷的质量为( )
A.1.6g B.3.2g C.6.4g D.9.6g
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】D
【分析】根据质量守恒定律,化学反应前后元素的种类和质量不变,结合题中数据来分析。
【解答】解:一定质量的甲烷(CH4)与32g氧气在密闭容器中充分反应,生成CO和H2O的质量比为14:27,设生成一氧化碳的质量为14x,则生成水的质量为27x,水中氢元素的质量为:,根据质量守恒定律,化学反应前后元素的种类和质量不变,则甲烷中氢元素的质量等于生成水中氢元素的质量,甲烷中碳、氢元素的质量比为12:4=3:1,则甲烷中碳元素的质量为:3x×3 =9x,一氧化碳中碳元素质量为:,则生成二氧化碳中碳元素的质量为:9x﹣6x=3x,二氧化碳(CO2)中碳、氧元素的质量比为3:8,所以二氧化碳中氧元素的质量为:,一氧化碳中氧元素质量为:,水中氧元素质量为:,反应前氧气的质量为32g,根据氧元素守恒可知,8x+8x+24x=32g,解得x=0.8g,所以甲烷的质量为:9x+3x=12x=12×0.8g=9.6g。
故选:D。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
16.(2025春 南岗区期中)下列叙述正确的是( )
A.在化合物中,非金属元素只能显负价
B.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
C.在反应2A+B=2C中,24gA完全反应生成40gC,C的相对分子质量为40,则B的相对分子质量为16
D.SO2、CO2、H2O2中氧元素的化合价相同
【考点】有关质量守恒定律的计算;氢气的化学性质与燃烧实验;化合价规律和原则;有关元素化合价的计算.
【专题】化学式的计算;化学用语和质量守恒定律.
【答案】B
【分析】A、根据在化合物中,非金属元素既能显正价也能显负价来分析;
B、根据碳和氧气反应的化学方程式及其质量关系来分析;
C、根据质量守恒定律和化学方程式的相关计算来分析;
D、根据SO2、CO2中氧元素的化合价都为﹣2价,而H2O2中氧元素的化合价为﹣1价来分析。
【解答】解:A、在化合物中,非金属元素既能显正价也能显负价,比如碳酸钠中,碳元素显+4价,氧元素显﹣2价,故选项说法不正确。
B、碳和氧气在点燃的条件下生成二氧化碳,反应的化学方程式为:C+O2CO2,每12份质量的碳和32份质量的氧气恰好完全反应生成44份质量的二氧化碳,则1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳,故选项说法正确。
C、在反应2A+B=2C中,24gA完全反应生成40gC,则参加反应的B的质量为:40g﹣24g=16g,C的相对分子质量为40,则B的相对分子质量为:40×232,故选项说法不正确。
D、SO2、CO2中氧元素的化合价都为﹣2价,而H2O2中氧元素的化合价为﹣1价,则氧元素的化合价不相同,故选项说法不正确。
故选:B。
【点评】本题主要考查了化合价原则、质量守恒定律和化学方程式的相关计算,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
17.(2025春 南岗区期中)下列有关内容用质量守恒定律解释正确的是( )
A.10mL水和10mL酒精混合后,总体积一定是20mL
B.某化合物在氧气中燃烧只生成二氧化碳,则该化合物一定含碳元素和氧元素
C.煤燃烧后产生的煤渣的质量一定等于所用煤的质量
D.将5gA和5gB混合后发生化合反应,一定能生成10gC
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】根据质量守恒定律是物质在发生化学变化中表现出来的一种规律,适用于化学变化;物质发生物理变化,则不适用于质量守恒定律来解释,进行分析判断。
【解答】解:A、10mL水和10mL酒精混合后,总体积小于20mL,是因为分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,且属于物理变化,不能用
质量守恒定律解释,故选项说法错误。
B、某化合物在氧气中燃烧只生成二氧化碳,CO2中含有碳、氧两种元素,根据质量守恒定律,反应前后元素种类不变,反应物氧气中只含有氧元素,则该化合物一定含碳元素和氧元素,故选项说法正确。
C、煤的主要成分是碳,煤燃烧后生成二氧化碳气体,生成的氢氧化铜气体逸出,则产生的煤渣的质量一定小于所用煤的质量,故选项说法错误。
D、将5gA和5gB混合后发生化合反应,A或B可能有剩余,不一定能生成10gC,故选项说法错误。
故选:B。
【点评】本题难度不大,理解质量守恒定律、化学变化和物理变化的判别并能灵活运用是正确解答本题的关键。
18.(2025 福田区二模)某小组用氧气传感器探究过氧化钠(Na2O2)与水反应(图1):①取Na2O2于试管中,加少量H2O塞紧传感器;②取下传感器,加少量MnO2并塞紧。氧气体积分数随时间变化曲线如图2。实验中包含下列反应Na2O2+H2O→NaOH+X;X→H2O+O2,下列说法错误的是( )
A.物质X为H2O2
B.a→c过程中无气泡生成
C.d→e过程装置内压强变大
D.该反应总的化学方程式:2Na2O2+2H2O=4NaOH+O2↑
【考点】根据质量守恒定律判断物质的化学式.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】A、根据过氧化氢能分解生成水和氧气来分析;
B、根据a→c过程中装置内的氧气体积分数增大来分析;
C、根据d→e过程中装置内的氧气体积分数迅速增大来分析;
D、根据过氧化钠和水反应生成氢氧化钠和氧气来分析。
【解答】解:A、由反应的化学方程式Na2O2+H2O→NaOH+X,X→H2O+O2可知,物质X为H2O2,故选项说法正确。
B、由图可知,a→c过程中装置内的氧气体积分数增大,说明有氧气产生,故选项说法不正确。
C、由图可知,d→e过程中装置内的氧气体积分数迅速增大,说明产生大量氧气,则装置内压强变大,故选项说法正确。
D、总的反应是过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑,故选项说法正确。
故选:B。
【点评】本题主要考查了物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
19.(2025 秦淮区一模)丙烷(化学式为C3H8)是液化石油气的主要成分之一。现有4.4g丙烷与一定量氧气混合于密闭容器内,在一定条件下全部转化为一氧化碳、二氧化碳和水,恢复至室温,测得所得气体中氧元素质量分数为70%,则参加反应的氧气的质量为( )
A.16g B.14.8g C.11.2g D.8.4g
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】根据质量守恒定律,化学反应前后元素的种类和质量不变,物质的总质量不变来分析。
【解答】解:现有4.4g丙烷与一定量氧气混合于密闭容器内,在一定条件下全部转化为一氧化碳、二氧化碳和水,4.4g丙烷中碳元素的质量为:4.4g100%=3.6g,氢元素的质量为:4.4g﹣3.6g=0.8g,恢复至室温,所得气体是一氧化碳和二氧化碳的混合物,其中氧元素的质量分数为70%,则碳元素的质量分数为:1﹣70%=30%,由碳元素守恒可知,混合气体的质量为:3.6g÷30%=12g,由氢元素守恒可知,丙烷燃烧生成水的质量为:0.8g÷(100%)=7.2g,由质量守恒定律可知,参加反应的氧气的质量为:12g+7.2g﹣4.4g=14.8g。
故选:B。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
20.(2025春 龙口市期中)化学中经常用燃烧法测定有机物的组成。现取3.2g某有机物在足量的氧气中充分燃烧,生成4.4gCO2和3.6gH2O,则下列关于该有机物的说法错误的是( )
A.一定含有C、H、O三种元素
B.消耗氧气的质量为4.8g
C.化学式可能为CH4O
D.有机物中C和O的质量比为1:1
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】D
【分析】现取3.2g某有机物在足量的氧气中充分燃烧,生成4.4gCO2和3.6gH2O,根据质量守恒定律,化学反应前后物质的总质量不变,则消耗氧气的质量为:4.4g+3.6g﹣3.2g=4.8g;根据质量守恒定律,化学反应前后元素的种类和质量不变,生成物二氧化碳和水中含有碳、氢、氧三种元素,反应物氧气中只含有氧元素,则该物质中一定含有碳、氢元素,可能含有氧元素,4.4g二氧化碳中碳元素质量为:,3.6g水中氢元素质量为:,则该有机物中含有1.2g碳元素和0.4g氢元素,1.2g+0.4g=1.6g<3.2g,则该有机物中还含有3.2g﹣1.2g﹣0.4g=1.6g氧元素;据此分析解答。
【解答】解:A、由分析可知,该有机物中一定含有C、H、O三种元素,故选项说法正确。
B、由分析可知,该消耗氧气的质量为4.8g,故选项说法正确。
C、由分析可知,该有机物中含有1.2g碳元素、0.4g氢元素和1.6g氧元素,其中碳、氢、氧原子个数比为,则该有机物的化学式可能为CH4O,故选项说法正确。
D、由分析可知,有机物中C和O的质量比为1.2g:1.6g=3:4,故选项说法错误。
故选:D。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
中考核心考点 质量守恒定律及其应用
一.选择题(共20小题)
1.(2025 广阳区一模)学习小组加热锥形瓶中的过量铜粉验证质量守恒定律如图1,某变量y随时间的变化趋势如图2所示,下列说法错误的是( )
A.图1中锥形瓶加热结束,待冷却至室温再放到电子秤上称量
B.实验后瓶内的部分固体由红色变为黑色
C.图2中y可以表示锥形瓶内氧气的质量
D.反应前锥形瓶内铜粉和空气的总质量等于生成氧化铜的质量
2.(2025 市北区二模)用如图所示两个实验测定化学反应前后物质的质量关系,则下列说法不正确的是( )
A.甲中加热锥形瓶时观察到红色粉末变黑,气球先胀大后缩小
B.甲中锥形瓶冷却后放回天平,示数不变,拔松橡胶塞,示数减小
C.乙中若取用锌粒的量不足,对实验的结果没有影响
D.乙组实验中气球胀大后再称量质量,发现天平指针向右偏转
3.(2025 盘锦三模)在密闭容器内.有甲、乙、丙、丁四种物质,在一定条件下充分混合反应一段时间,测得反应前后各物质的质量如图所示,下列说法正确的是( )
A.该反应可能是复分解反应
B.丙一定是催化剂
C.t1时刻后各物质质量不再发生变化
D.反应中甲与乙的质量变化之比为1:4
4.(2025春 巴彦县期中)在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质质量的变化量(单位:g)如图所示。下列说法不正确的是( )
A.x的数值为8
B.反应前后元素的化合价一定改变
C.丁可能是催化剂
D.反应前后甲、戊变化的质量之比为3:1
5.(2025春 南岗区月考)现有4.8g某可燃物在氧气中完全燃烧,生成8.8g二氧化碳和7.2g水(无其他生成物),下列关于该可燃物说法正确的是( )
①一定含有碳、氢元素
②一定含有氧元素
③可能含有氧元素
④一定不含氧元素
⑤碳、氢元素的质量比为3:1
⑥碳、氢元素的质量比为4:1
⑦碳、氢原子的个数比为1:3
⑧碳、氢原子的个数比为1:4
A.①②⑤⑧ B.①③⑤⑧ C.①④⑥⑦ D.①②⑤⑦
6.(2025 洛阳三模)将4.2g镁粉、铝粉的混合物加入200g质量分数为9.8%的稀硫酸中,恰好完全反应得到不饱和溶液,将溶液蒸干后得到固体的质量为( )
A.21g B.23.4g C.26.6g D.28.8g
7.(2025 汝南县三模)一定质量的乙醇在氧气不充足的条件下燃烧,可生成一氧化碳和二氧化碳的总质量为7.2g,同时生成水的质量为5.4g,则生成一氧化碳的质量是( )
A.0.7g B.1.4g C.2.8g D.5.6g
8.(2025 方城县二模)实验室有部分被氧化的铝片8.0g,与300.0g溶质质量分数为7.3%的稀盐酸恰好完全反应,该铝片中铝元素的质量为( )
A.7.8g B.5.4g C.6.0g D.2.7g
9.(2025 龙岩模拟)用下图装置进行实验,实验中观察到无水硫酸铜变蓝、澄清石灰水变浑浊。已知:无水硫酸铜为白色粉末,遇水变蓝。实验视作气体x在氧气氛围中燃烧。下列说法正确的是( )
A.气体x一定为纯净物
B.气体x与y含有的物质完全相同
C.气体x中一定含有C、H元素
D.气体x中一定含有C、H、O元素
10.(2025 洛阳模拟)实验室有部分被氧化的镁条8g,与300g溶质质量分数为7.3%的稀盐酸恰好完全反应,该镁条中镁元素的质量为( )
A.2.4g B.4.8g C.7.2g D.7.8g
11.(2025 荥阳市二模)向盛有3.6gMg、Zn两种金属混合物的烧杯中滴加稀硫酸至不再产生气体,将溶液蒸干后得到18g固体,则生成氢气的质量为( )
A.0.1g B.0.2g C.0.3g D.0.4g
12.(2025 五华区模拟)在密闭容器中放入甲、乙、丙、丁四种物质,一定条件下发生化学反应。一段时间后测得相关数据如图所示,下列说法正确的是( )
A.x=3.9
B.该反应中甲、丁的质量变化比为14:85
C.丙一定是化合物
D.乙一定是该反应的催化剂
13.(2025 确山县二模)一定条件下,X、Y、Z、W四种物质在密闭容器中充分反应,测得反应前后各物质质量如表。下列说法不正确的是( )
物质 X Y Z W
反应前的质量/g 6.8 1 93.2 0
反应后的质量/g 0 a 96.8 3.2
A.a=1,Y可能是该反应的催化剂
B.该反应为分解反应
C.Z与W的相对分子质量之比一定为9:8
D.X与Z质量变化之比为17:9
14.(2025 常州二模)一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如图所示,图中x、y分别表示乙和丙的质量。下列说法错误的是( )
A.x的取值范围:0≤x≤40
B.反应后丁的质量分数是12%
C.反应中丁与丙的质量比可以是2:1或1:2
D.y≤30时,该反应一定是化合反应
15.(2025 确山县二模)为了保护环境,我国的城市燃气已经广泛使用较为清洁的天然气,天然气的主要成分为甲烷。一定质量的甲烷与32g氧气在密闭容器中充分反应,生成CO和H2O的质量比为14:27,则甲烷的质量为( )
A.1.6g B.3.2g C.6.4g D.9.6g
16.(2025春 南岗区期中)下列叙述正确的是( )
A.在化合物中,非金属元素只能显负价
B.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
C.在反应2A+B=2C中,24gA完全反应生成40gC,C的相对分子质量为40,则B的相对分子质量为16
D.SO2、CO2、H2O2中氧元素的化合价相同
17.(2025春 南岗区期中)下列有关内容用质量守恒定律解释正确的是( )
A.10mL水和10mL酒精混合后,总体积一定是20mL
B.某化合物在氧气中燃烧只生成二氧化碳,则该化合物一定含碳元素和氧元素
C.煤燃烧后产生的煤渣的质量一定等于所用煤的质量
D.将5gA和5gB混合后发生化合反应,一定能生成10gC
18.(2025 福田区二模)某小组用氧气传感器探究过氧化钠(Na2O2)与水反应(图1):①取Na2O2于试管中,加少量H2O塞紧传感器;②取下传感器,加少量MnO2并塞紧。氧气体积分数随时间变化曲线如图2。实验中包含下列反应Na2O2+H2O→NaOH+X;X→H2O+O2,下列说法错误的是( )
A.物质X为H2O2
B.a→c过程中无气泡生成
C.d→e过程装置内压强变大
D.该反应总的化学方程式:2Na2O2+2H2O=4NaOH+O2↑
19.(2025 秦淮区一模)丙烷(化学式为C3H8)是液化石油气的主要成分之一。现有4.4g丙烷与一定量氧气混合于密闭容器内,在一定条件下全部转化为一氧化碳、二氧化碳和水,恢复至室温,测得所得气体中氧元素质量分数为70%,则参加反应的氧气的质量为( )
A.16g B.14.8g C.11.2g D.8.4g
20.(2025春 龙口市期中)化学中经常用燃烧法测定有机物的组成。现取3.2g某有机物在足量的氧气中充分燃烧,生成4.4gCO2和3.6gH2O,则下列关于该有机物的说法错误的是( )
A.一定含有C、H、O三种元素
B.消耗氧气的质量为4.8g
C.化学式可能为CH4O
D.有机物中C和O的质量比为1:1
中考核心考点 质量守恒定律及其应用
参考答案与试题解析
一.选择题(共20小题)
1.(2025 广阳区一模)学习小组加热锥形瓶中的过量铜粉验证质量守恒定律如图1,某变量y随时间的变化趋势如图2所示,下列说法错误的是( )
A.图1中锥形瓶加热结束,待冷却至室温再放到电子秤上称量
B.实验后瓶内的部分固体由红色变为黑色
C.图2中y可以表示锥形瓶内氧气的质量
D.反应前锥形瓶内铜粉和空气的总质量等于生成氧化铜的质量
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【答案】D
【分析】化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【解答】解:A、反应结束后,冷却至室温前气球受到空气的浮力不断变化,应冷却至室温再称量,故选项正确。
B、铜粉加热与氧气反应生成黑色的氧化铜,但铜粉过量,所以铜粉不会全部变为黑色氧化铜,故选项正确。
C、铜与氧气在加热的条件下反应生成氧化铜,氧气质量减少,图2中y可以表示氧气质量,故选项正确。
D、根据质量守恒定律,参加反应的物质的总质量与生成物的总质量相等,则生成氧化铜的质量等于参加反应的铜粉的质量和参加反应的氧气的质量之和,故选项不正确。
故选:D。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
2.(2025 市北区二模)用如图所示两个实验测定化学反应前后物质的质量关系,则下列说法不正确的是( )
A.甲中加热锥形瓶时观察到红色粉末变黑,气球先胀大后缩小
B.甲中锥形瓶冷却后放回天平,示数不变,拔松橡胶塞,示数减小
C.乙中若取用锌粒的量不足,对实验的结果没有影响
D.乙组实验中气球胀大后再称量质量,发现天平指针向右偏转
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】验证质量守恒定律的实验时,选用试剂和装置应考虑:①只有用天平称量质量没有变化的化学变化才能直接用于验证质量守恒;②如果反应物中有气体参加反应,或生成物中有气体生成,应该选用密闭装置。
【解答】解:A、甲中加热锥形瓶时,铜和氧气在加热条件下生成氧化铜,装置内空气受热膨胀,随着反应的进行,氧气被消耗,装置中气体体积减少,压强减小,观察到红色粉末变黑,气球先胀大后缩小,故选项说法正确。
B、甲中反应在密闭容器中进行,根据质量守恒定律,化学反应前后物质的总质量不变,锥形瓶冷却后放回天平,示数不变;拔松橡胶塞,由于消耗了氧气,外界空气会进入装置,导致装置质量增大,示数应增大,而不是减小,故选项说法错误。
C、参加反应的锌和硫酸的质量之和等于反应生成的硫酸锌和氢气的质量之和,取用锌粒的量的多少对实验结果无影响,故选项说法正确。
D、乙组实验中,锌和稀硫酸反应生成氢气,气球胀大,受到空气浮力增大,导致左侧质量测量值偏小,天平指针向右偏转,故选项说法正确。
故选:B。
【点评】本题难度不大,理解质量守恒定律,明确在设计验证质量守恒定律的实验时最好在密闭容器中进行是正确解答本题的关键。
3.(2025 盘锦三模)在密闭容器内.有甲、乙、丙、丁四种物质,在一定条件下充分混合反应一段时间,测得反应前后各物质的质量如图所示,下列说法正确的是( )
A.该反应可能是复分解反应
B.丙一定是催化剂
C.t1时刻后各物质质量不再发生变化
D.反应中甲与乙的质量变化之比为1:4
【考点】有关质量守恒定律的计算;反应类型的判定.
【专题】化学用语和质量守恒定律.
【答案】C
【分析】由图可知,t1时刻后各物质质量不再发生变化,则t1时刻反应已经停止;反应后甲的质量减少了16g﹣8g=8g,则甲是反应物;反应后乙质量增加了32g﹣4g=28g,则乙是生成物;反应前后丙的质量不变,则丙可能是该反应的催化剂,也可能是杂质;反应后丁的质量减少了24g﹣4g=20g,则丁是反应物;该反应是甲和丁在一定条件下反应生成乙,符合多变一的特点,属于化合反应;据此分析解答。
【解答】解:A、该反应是甲和丁在一定条件下反应生成乙,符合多变一的特点,属于化合反应,故选项说法不正确。
B、反应前后丙的质量不变,则丙可能是该反应的催化剂,也可能是杂质,故选项说法不正确。
C、由图可知,t1时刻后各物质质量不再发生变化,故选项说法正确。
D、反应中甲与乙的质量变化之比为(16g﹣8g):(32g﹣4g)=2:7,故选项说法不正确。
故选:C。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
4.(2025春 巴彦县期中)在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质质量的变化量(单位:g)如图所示。下列说法不正确的是( )
A.x的数值为8
B.反应前后元素的化合价一定改变
C.丁可能是催化剂
D.反应前后甲、戊变化的质量之比为3:1
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】根据质量守恒定律,化学反应前后物质的总质量不变,由图中数据可知,x=18+3+1+2+5﹣9﹣2﹣8﹣2=8;反应后甲的质量减少了18g﹣9g=9g,则甲是反应物;反应后乙的质量减少了3g﹣2g=1g,则乙是反应物;反应后丙的质量增加了8g﹣1g=7g,则丙是生成物;反应前后丁的质量不变,则丁可能是该反应的催化剂,也可能是杂质;反应后戊的质量增加了8g﹣5g=3g,则戊是生成物;该反应是甲和乙在一定条件下反应生成丙和戊;据此分析解答。
【解答】解:A、由图中数据可知,x=18+3+1+2+5﹣9﹣2﹣8﹣2=8,故选项说法正确。
B、该反应是甲和乙在一定条件下反应生成丙和戊,由于不知道,甲、乙、丙、戊是单质还是化合物,所以反应前后元素的化合价可能不变,故选项说法错误。
C、反应前后丁的质量不变,则丁可能是该反应的催化剂,也可能是杂质,故选项说法正确。
D、反应前后甲、戊变化的质量之比为(18g﹣9g):(8g﹣5g)=3:1,故选项说法正确。
故选:B。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
5.(2025春 南岗区月考)现有4.8g某可燃物在氧气中完全燃烧,生成8.8g二氧化碳和7.2g水(无其他生成物),下列关于该可燃物说法正确的是( )
①一定含有碳、氢元素
②一定含有氧元素
③可能含有氧元素
④一定不含氧元素
⑤碳、氢元素的质量比为3:1
⑥碳、氢元素的质量比为4:1
⑦碳、氢原子的个数比为1:3
⑧碳、氢原子的个数比为1:4
A.①②⑤⑧ B.①③⑤⑧ C.①④⑥⑦ D.①②⑤⑦
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】A
【分析】根据质量守恒定律,化学反应前后元素的种类和质量不变来分析。
【解答】解:现有4.8g某可燃物在氧气中完全燃烧,生成8.8g二氧化碳和7.2g水(无其他生成物),根据质量守恒定律,化学反应前后元素的种类和质量不变,生成物二氧化碳和水中含有碳、氢、氧三种元素,反应物氧气中只含有氧元素,则该可燃物中一定含有碳、氢元素,8.8g二氧化碳中碳元素的质量为:,7.2g水中氢元素的质量为:,2.4g+0.8g=3.2g<4.8g,则该可燃物中还含有4.8g﹣3.2g=1.6g氧元素;该可燃物中C、H元素的质量比为2.4g:0.8g=3:1;该可燃物中C、H元素的原子个数比为。
由上述分析可知,正确的是:①②⑤⑧。
故选:A。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
6.(2025 洛阳三模)将4.2g镁粉、铝粉的混合物加入200g质量分数为9.8%的稀硫酸中,恰好完全反应得到不饱和溶液,将溶液蒸干后得到固体的质量为( )
A.21g B.23.4g C.26.6g D.28.8g
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】根据质量守恒定律,镁和硫酸反应生成硫酸镁和氢气,铝和硫酸反应生成硫酸铝和氢气,硫酸根全部来自于硫酸,蒸干后得到固体硫酸镁和硫酸铝的质量等于金属的质量加上硫酸根的质量来分析。
【解答】解:将4.2g镁粉、铝粉的混合物加入200g质量分数为9.8%的稀硫酸中,恰好完全反应得到不饱和溶液,镁和硫酸反应生成硫酸镁和氢气,铝和硫酸反应生成硫酸铝和氢气,则溶液中的溶质是硫酸镁和硫酸铝,将溶液蒸干后得到固体为硫酸镁和硫酸铝,硫酸根全部来自于硫酸,则蒸干后得到固体硫酸镁和硫酸铝的质量等于金属的质量加上硫酸根的质量,200g质量分数为 9.8%的稀硫酸中硫酸根的质量为:200g×9.8%100%=19.2g,则将溶液蒸干后得到固体的质量为:19.2g+4.2g=23.4g。
故选:B。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
7.(2025 汝南县三模)一定质量的乙醇在氧气不充足的条件下燃烧,可生成一氧化碳和二氧化碳的总质量为7.2g,同时生成水的质量为5.4g,则生成一氧化碳的质量是( )
A.0.7g B.1.4g C.2.8g D.5.6g
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】C
【分析】根据质量守恒定律,化学反应前后元素的种类和质量不变,结合题中数据来分析。
【解答】解:一定质量的乙醇在氧气不充足的条件下燃烧,可生成一氧化碳和二氧化碳的总质量为7.2g,同时生成水的质量为5.4g,根据质量守恒定律,化学反应前后元素的种类和质量不变,5.4g水(H2O)中氢元素的质量为:5.4g100%=0.6g,则乙醇的质量为:0.6g÷(100%)=4.6g,4.6g乙醇中碳元素的质量为:4.6g100%=2.4g,设一氧化碳的质量为x,则二氧化碳的质量为7.2g﹣x,由碳元素守恒可得:x100%+(7.2g﹣x)100%=2.4g,解得:x=2.8g,则生成一氧化碳的质量是2.8g。
故选:C。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
8.(2025 方城县二模)实验室有部分被氧化的铝片8.0g,与300.0g溶质质量分数为7.3%的稀盐酸恰好完全反应,该铝片中铝元素的质量为( )
A.7.8g B.5.4g C.6.0g D.2.7g
【考点】有关质量守恒定律的计算;化合物中某元素的质量计算.
【专题】化学式的计算.
【答案】B
【分析】根据质量守恒定律,化学反应前后元素的质量不变,进行分析解答。
【解答】解:氧化铝和稀盐酸反应生成氯化铝和水,铝和稀盐酸反应生成氯化铝和氢气,根据质量守恒定律,化学反应前后元素的种类和质量不变,盐酸中的氯元素完全转化到了氯化铝中,铝片中的铝元素完全转化到了氯化铝中,氯元素的质量为,设铝元素的质量为x,则x:21.3g=27:106.5,x=5.4g。
故选:B。
【点评】本题难度不大,了解化学反应前后元素的质量不变、化学式的有关计算等是正确解答本题的关键。
9.(2025 龙岩模拟)用下图装置进行实验,实验中观察到无水硫酸铜变蓝、澄清石灰水变浑浊。已知:无水硫酸铜为白色粉末,遇水变蓝。实验视作气体x在氧气氛围中燃烧。下列说法正确的是( )
A.气体x一定为纯净物
B.气体x与y含有的物质完全相同
C.气体x中一定含有C、H元素
D.气体x中一定含有C、H、O元素
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】C
【分析】根据质量守恒定律、物质的性质及其检验方法来分析。
【解答】解:无水硫酸铜变蓝,证明有水蒸气生成,澄清石灰水变浑浊,证明有二氧化碳生成。由质量守恒定律可知,气体x中一定含有碳元素与氢元素,可能含有氧元素。
A、该气体燃烧生成水和二氧化碳,该气体可能是纯净物,如甲烷,也可能是一氧化碳与氢气的混合物,故选项A说法不正确;
B、气体y中一定含有二氧化碳,x中不一定含有二氧化碳,因此二者的成分可能不同,故选项B说法不正确;
C、结合前面分析可知,气体x中一定含有C、H元素,故选项C说法正确;
D、结合前面分析可知,气体x中一定含有碳、氢元素,可能含有氧元素,故选项D说法不正确。
故选:C。
【点评】本题难度不大,掌握质量守恒定律以及物质的检验方法是解题的关键。
10.(2025 洛阳模拟)实验室有部分被氧化的镁条8g,与300g溶质质量分数为7.3%的稀盐酸恰好完全反应,该镁条中镁元素的质量为( )
A.2.4g B.4.8g C.7.2g D.7.8g
【考点】有关质量守恒定律的计算;化合物中某元素的质量计算.
【专题】化学用语和质量守恒定律.
【答案】C
【分析】根据质量守恒定律,化学反应前后氯元素的质量不变,进行分析判断。
【解答】解:盐酸氧化镁和稀盐酸反应生成氯化镁和水,镁和稀盐酸反应生成氯化镁和氢气,生成的氯化镁中氯元素的质量为300g×7.3%21.3g,生成氯化镁的质量为21.3g28.5g。由质量守恒定律,反应前后氯元素的质量不变,氯化镁中镁元素的质量即为样品中镁元素的质量,该镁条中镁元素的质量为28.5g﹣21.3g=7.2g。
故选:C。
【点评】本题难度不大,明确化学反应前后氯元素的质量不变是正确解答本题的关键。
11.(2025 荥阳市二模)向盛有3.6gMg、Zn两种金属混合物的烧杯中滴加稀硫酸至不再产生气体,将溶液蒸干后得到18g固体,则生成氢气的质量为( )
A.0.1g B.0.2g C.0.3g D.0.4g
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】C
【分析】根据镁和硫酸反应生成硫酸镁和氢气,锌和硫酸反应生成硫酸锌和氢气,固体增加的质量为硫酸根离子的质量,由题中数据结合质量守恒定律来分析。
【解答】解:向盛有3.6gMg、Zn两种金属混合物的烧杯中滴加稀硫酸至不再产生气体,镁和硫酸反应生成硫酸镁和氢气,锌和硫酸反应生成硫酸锌和氢气,将溶液蒸干后得到18g固体,则固体增加的质量为硫酸根离子的质量,为:18g﹣3.6g=14.4g,固体中的硫酸根来自硫酸,则硫酸质量为:14.4g÷(100%)=14.7g,硫酸中氢元素质量为:14.7g﹣14.4g=0.3g,根据质量守恒定律,氢气中的氢元素全部来自硫酸,则生成氢气质量为0.3g。
故选:C。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
12.(2025 五华区模拟)在密闭容器中放入甲、乙、丙、丁四种物质,一定条件下发生化学反应。一段时间后测得相关数据如图所示,下列说法正确的是( )
A.x=3.9
B.该反应中甲、丁的质量变化比为14:85
C.丙一定是化合物
D.乙一定是该反应的催化剂
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。反应后质量增加的是生成物,减少的是反应物,所以10+3.5+10+6=8.6+3.5+x+14.5,解得x=2.9,所以甲、丙为反应物,丁为生成物,该反应为化合反应,乙可能是催化剂也可能是不参加反应的杂质;据此分析解答。
【解答】解:A、由分析可知,x=2.9,故选项说法不正确。
B、反应的甲、丁的质量比为(10g﹣8.6g):(14.5g﹣6g)=14:85,故选项说法正确。
C、丙为化合反应的反应物之一,可能是单质也可能是化合物,故选项说法不正确。
D、乙反应前后质量不变,可能是催化剂,也可能为不参加反应的杂质,故选项说法不正确。
故选:B。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
13.(2025 确山县二模)一定条件下,X、Y、Z、W四种物质在密闭容器中充分反应,测得反应前后各物质质量如表。下列说法不正确的是( )
物质 X Y Z W
反应前的质量/g 6.8 1 93.2 0
反应后的质量/g 0 a 96.8 3.2
A.a=1,Y可能是该反应的催化剂
B.该反应为分解反应
C.Z与W的相对分子质量之比一定为9:8
D.X与Z质量变化之比为17:9
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】C
【分析】根据质量守恒定律,化学反应前后物质的总质量不变,由表中数据可知,a=6.8+1+93.2+0﹣0﹣96.8﹣3.2=1,反应后X的质量减小了6.8g,则X是反应物;反应前后Y的质量不变,则Y可能是该反应的催化剂,也可能是杂质;反应后Z的质量增加了3.6g,则Z是生成物;反应后W的质量增加了3.2g,则W是生成物;该反应是X在一定条件下反应生成Z和W,符合一变多的特点,属于分解反应;据此分析解答。
【解答】解:A、由表中数据可知,a=6.8+1+93.2+0﹣0﹣96.8﹣3.2=1,反应前后Y的质量不变,则Y可能是该反应的催化剂,也可能是杂质,故选项说法正确。
B、该反应是X在一定条件下反应生成Z和W,符合一变多的特点,属于分解反应,故选项说法正确。
C、该反应中生成Z与W的质量比为(96.8g﹣93.2g):(3.2g﹣0)=9:8,由于不知道化学计量数,无法判断Z与W的相对分子质量之比,故选项说法不正确。
D、该反应中X与Z的质量变化之比为(6.8g﹣0):(96.8g﹣93.2g)=17:9,故选项说法正确。
故选:C。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
14.(2025 常州二模)一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如图所示,图中x、y分别表示乙和丙的质量。下列说法错误的是( )
A.x的取值范围:0≤x≤40
B.反应后丁的质量分数是12%
C.反应中丁与丙的质量比可以是2:1或1:2
D.y≤30时,该反应一定是化合反应
【考点】有关质量守恒定律的计算;反应类型的判定.
【专题】化学用语和质量守恒定律.
【答案】A
【分析】根据质量守恒定律,化学反应前后物质的总质量不变,由表中数据可知,x+y=30+40+30+25﹣10﹣15=100,即反应后乙与丙的质量和为100g;反应后甲的质量减少了30g﹣10g=20g,则甲是反应物;反应后丁的质量减少了25g﹣15g=10g,则丁是反应物;反应后乙和丙的质量总共增加了100g﹣(40g+30g)=30g,与甲、丁减少的质量和相等;据此分析解答。
【解答】解:A、当y=0时,x=30+40+30+25﹣10﹣15=100,则x的取值范围是0≤x≤100,故选项说法错误。
B、密闭容器中物质的总质量为:30g+40g+30g+25g=125g,反应后丁的质量为15g,则反应后丁的质量分数为:100%=12%,故选项说法正确。
C、参加反应的丁的质量为10g,反应后乙与丙的质量和为100g,则丙的质量可以是5g或20g,则反应中丁与丙的质量比可以是2:1或1:2,故选项说法正确。
D、当y=30时,甲、丁是反应物,乙是生成物,生成物只有一种,当y小于30时,甲、丁、丙是反应物,乙是生成物,生成物只有一种,则y≤30时,该反应一定是化合反应,故选项说法正确。
故选:A。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
15.(2025 确山县二模)为了保护环境,我国的城市燃气已经广泛使用较为清洁的天然气,天然气的主要成分为甲烷。一定质量的甲烷与32g氧气在密闭容器中充分反应,生成CO和H2O的质量比为14:27,则甲烷的质量为( )
A.1.6g B.3.2g C.6.4g D.9.6g
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】D
【分析】根据质量守恒定律,化学反应前后元素的种类和质量不变,结合题中数据来分析。
【解答】解:一定质量的甲烷(CH4)与32g氧气在密闭容器中充分反应,生成CO和H2O的质量比为14:27,设生成一氧化碳的质量为14x,则生成水的质量为27x,水中氢元素的质量为:,根据质量守恒定律,化学反应前后元素的种类和质量不变,则甲烷中氢元素的质量等于生成水中氢元素的质量,甲烷中碳、氢元素的质量比为12:4=3:1,则甲烷中碳元素的质量为:3x×3 =9x,一氧化碳中碳元素质量为:,则生成二氧化碳中碳元素的质量为:9x﹣6x=3x,二氧化碳(CO2)中碳、氧元素的质量比为3:8,所以二氧化碳中氧元素的质量为:,一氧化碳中氧元素质量为:,水中氧元素质量为:,反应前氧气的质量为32g,根据氧元素守恒可知,8x+8x+24x=32g,解得x=0.8g,所以甲烷的质量为:9x+3x=12x=12×0.8g=9.6g。
故选:D。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
16.(2025春 南岗区期中)下列叙述正确的是( )
A.在化合物中,非金属元素只能显负价
B.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
C.在反应2A+B=2C中,24gA完全反应生成40gC,C的相对分子质量为40,则B的相对分子质量为16
D.SO2、CO2、H2O2中氧元素的化合价相同
【考点】有关质量守恒定律的计算;氢气的化学性质与燃烧实验;化合价规律和原则;有关元素化合价的计算.
【专题】化学式的计算;化学用语和质量守恒定律.
【答案】B
【分析】A、根据在化合物中,非金属元素既能显正价也能显负价来分析;
B、根据碳和氧气反应的化学方程式及其质量关系来分析;
C、根据质量守恒定律和化学方程式的相关计算来分析;
D、根据SO2、CO2中氧元素的化合价都为﹣2价,而H2O2中氧元素的化合价为﹣1价来分析。
【解答】解:A、在化合物中,非金属元素既能显正价也能显负价,比如碳酸钠中,碳元素显+4价,氧元素显﹣2价,故选项说法不正确。
B、碳和氧气在点燃的条件下生成二氧化碳,反应的化学方程式为:C+O2CO2,每12份质量的碳和32份质量的氧气恰好完全反应生成44份质量的二氧化碳,则1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳,故选项说法正确。
C、在反应2A+B=2C中,24gA完全反应生成40gC,则参加反应的B的质量为:40g﹣24g=16g,C的相对分子质量为40,则B的相对分子质量为:40×232,故选项说法不正确。
D、SO2、CO2中氧元素的化合价都为﹣2价,而H2O2中氧元素的化合价为﹣1价,则氧元素的化合价不相同,故选项说法不正确。
故选:B。
【点评】本题主要考查了化合价原则、质量守恒定律和化学方程式的相关计算,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
17.(2025春 南岗区期中)下列有关内容用质量守恒定律解释正确的是( )
A.10mL水和10mL酒精混合后,总体积一定是20mL
B.某化合物在氧气中燃烧只生成二氧化碳,则该化合物一定含碳元素和氧元素
C.煤燃烧后产生的煤渣的质量一定等于所用煤的质量
D.将5gA和5gB混合后发生化合反应,一定能生成10gC
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】根据质量守恒定律是物质在发生化学变化中表现出来的一种规律,适用于化学变化;物质发生物理变化,则不适用于质量守恒定律来解释,进行分析判断。
【解答】解:A、10mL水和10mL酒精混合后,总体积小于20mL,是因为分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,且属于物理变化,不能用
质量守恒定律解释,故选项说法错误。
B、某化合物在氧气中燃烧只生成二氧化碳,CO2中含有碳、氧两种元素,根据质量守恒定律,反应前后元素种类不变,反应物氧气中只含有氧元素,则该化合物一定含碳元素和氧元素,故选项说法正确。
C、煤的主要成分是碳,煤燃烧后生成二氧化碳气体,生成的氢氧化铜气体逸出,则产生的煤渣的质量一定小于所用煤的质量,故选项说法错误。
D、将5gA和5gB混合后发生化合反应,A或B可能有剩余,不一定能生成10gC,故选项说法错误。
故选:B。
【点评】本题难度不大,理解质量守恒定律、化学变化和物理变化的判别并能灵活运用是正确解答本题的关键。
18.(2025 福田区二模)某小组用氧气传感器探究过氧化钠(Na2O2)与水反应(图1):①取Na2O2于试管中,加少量H2O塞紧传感器;②取下传感器,加少量MnO2并塞紧。氧气体积分数随时间变化曲线如图2。实验中包含下列反应Na2O2+H2O→NaOH+X;X→H2O+O2,下列说法错误的是( )
A.物质X为H2O2
B.a→c过程中无气泡生成
C.d→e过程装置内压强变大
D.该反应总的化学方程式:2Na2O2+2H2O=4NaOH+O2↑
【考点】根据质量守恒定律判断物质的化学式.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】A、根据过氧化氢能分解生成水和氧气来分析;
B、根据a→c过程中装置内的氧气体积分数增大来分析;
C、根据d→e过程中装置内的氧气体积分数迅速增大来分析;
D、根据过氧化钠和水反应生成氢氧化钠和氧气来分析。
【解答】解:A、由反应的化学方程式Na2O2+H2O→NaOH+X,X→H2O+O2可知,物质X为H2O2,故选项说法正确。
B、由图可知,a→c过程中装置内的氧气体积分数增大,说明有氧气产生,故选项说法不正确。
C、由图可知,d→e过程中装置内的氧气体积分数迅速增大,说明产生大量氧气,则装置内压强变大,故选项说法正确。
D、总的反应是过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑,故选项说法正确。
故选:B。
【点评】本题主要考查了物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
19.(2025 秦淮区一模)丙烷(化学式为C3H8)是液化石油气的主要成分之一。现有4.4g丙烷与一定量氧气混合于密闭容器内,在一定条件下全部转化为一氧化碳、二氧化碳和水,恢复至室温,测得所得气体中氧元素质量分数为70%,则参加反应的氧气的质量为( )
A.16g B.14.8g C.11.2g D.8.4g
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】B
【分析】根据质量守恒定律,化学反应前后元素的种类和质量不变,物质的总质量不变来分析。
【解答】解:现有4.4g丙烷与一定量氧气混合于密闭容器内,在一定条件下全部转化为一氧化碳、二氧化碳和水,4.4g丙烷中碳元素的质量为:4.4g100%=3.6g,氢元素的质量为:4.4g﹣3.6g=0.8g,恢复至室温,所得气体是一氧化碳和二氧化碳的混合物,其中氧元素的质量分数为70%,则碳元素的质量分数为:1﹣70%=30%,由碳元素守恒可知,混合气体的质量为:3.6g÷30%=12g,由氢元素守恒可知,丙烷燃烧生成水的质量为:0.8g÷(100%)=7.2g,由质量守恒定律可知,参加反应的氧气的质量为:12g+7.2g﹣4.4g=14.8g。
故选:B。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
20.(2025春 龙口市期中)化学中经常用燃烧法测定有机物的组成。现取3.2g某有机物在足量的氧气中充分燃烧,生成4.4gCO2和3.6gH2O,则下列关于该有机物的说法错误的是( )
A.一定含有C、H、O三种元素
B.消耗氧气的质量为4.8g
C.化学式可能为CH4O
D.有机物中C和O的质量比为1:1
【考点】有关质量守恒定律的计算.
【专题】化学用语和质量守恒定律.
【答案】D
【分析】现取3.2g某有机物在足量的氧气中充分燃烧,生成4.4gCO2和3.6gH2O,根据质量守恒定律,化学反应前后物质的总质量不变,则消耗氧气的质量为:4.4g+3.6g﹣3.2g=4.8g;根据质量守恒定律,化学反应前后元素的种类和质量不变,生成物二氧化碳和水中含有碳、氢、氧三种元素,反应物氧气中只含有氧元素,则该物质中一定含有碳、氢元素,可能含有氧元素,4.4g二氧化碳中碳元素质量为:,3.6g水中氢元素质量为:,则该有机物中含有1.2g碳元素和0.4g氢元素,1.2g+0.4g=1.6g<3.2g,则该有机物中还含有3.2g﹣1.2g﹣0.4g=1.6g氧元素;据此分析解答。
【解答】解:A、由分析可知,该有机物中一定含有C、H、O三种元素,故选项说法正确。
B、由分析可知,该消耗氧气的质量为4.8g,故选项说法正确。
C、由分析可知,该有机物中含有1.2g碳元素、0.4g氢元素和1.6g氧元素,其中碳、氢、氧原子个数比为,则该有机物的化学式可能为CH4O,故选项说法正确。
D、由分析可知,有机物中C和O的质量比为1.2g:1.6g=3:4,故选项说法错误。
故选:D。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
