【中考押题预测】2025年中考化学人教版(2024)核心考点考前冲刺 粗盐提纯(含解析)
文档属性
| 名称 | 【中考押题预测】2025年中考化学人教版(2024)核心考点考前冲刺 粗盐提纯(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-15 23:28:57 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
中考核心考点 粗盐提纯
一.选择题(共8小题)
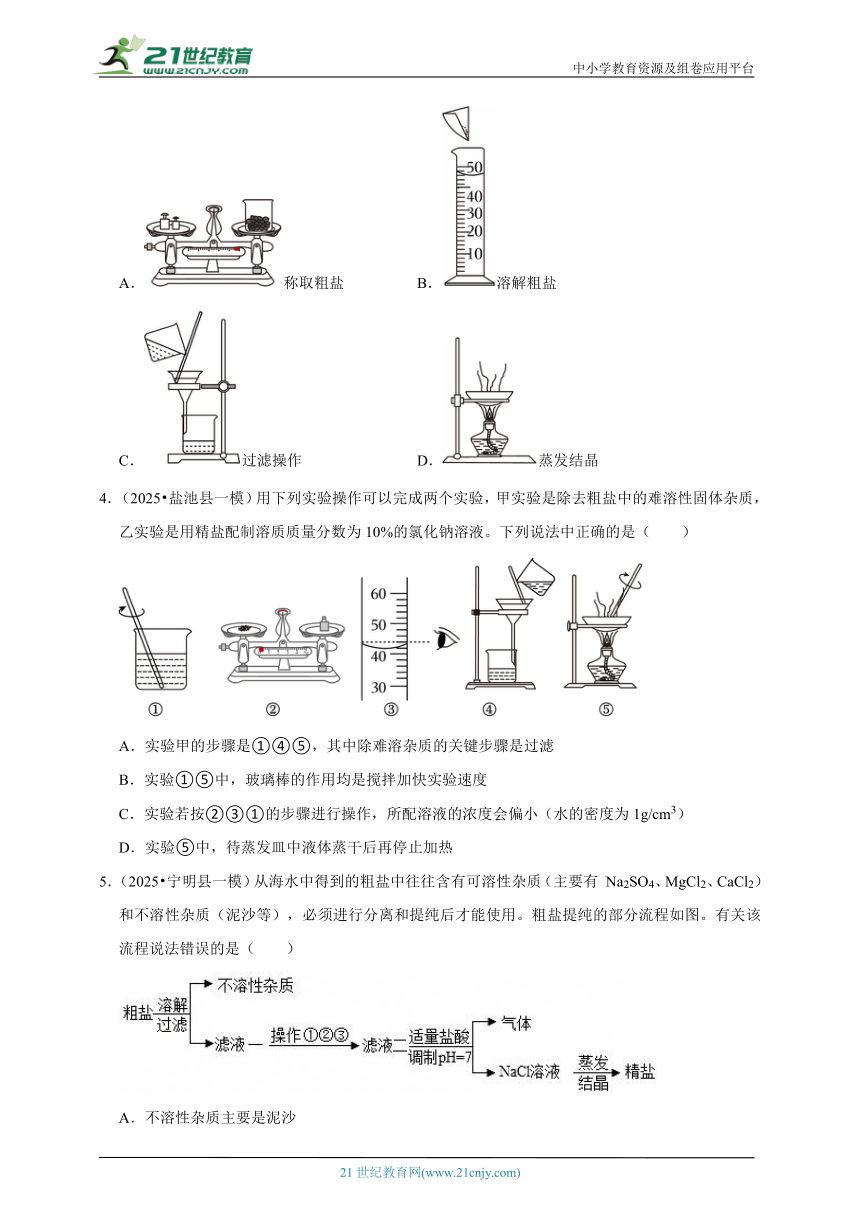
1.(2025 巢湖市二模)下列关于“粗盐中难溶性杂质的去除”实验操作正确的是( )
A.称量 B.溶解
C.过滤 D.蒸发
2.(2025春 重庆校级期中)实验室进行粗盐提纯并配制16%的NaCl溶液。下列仪器必须用到的是( )
①天平
②蒸发皿
③坩埚
④分液漏斗
⑤漏斗
⑥烧杯
⑦酒精灯
⑧量筒
⑨玻璃棒
A.①②④⑥⑦⑨ B.①③⑤⑥⑦⑧⑨ C.②③④⑤⑥⑦ D.①②⑤⑥⑦⑧⑨
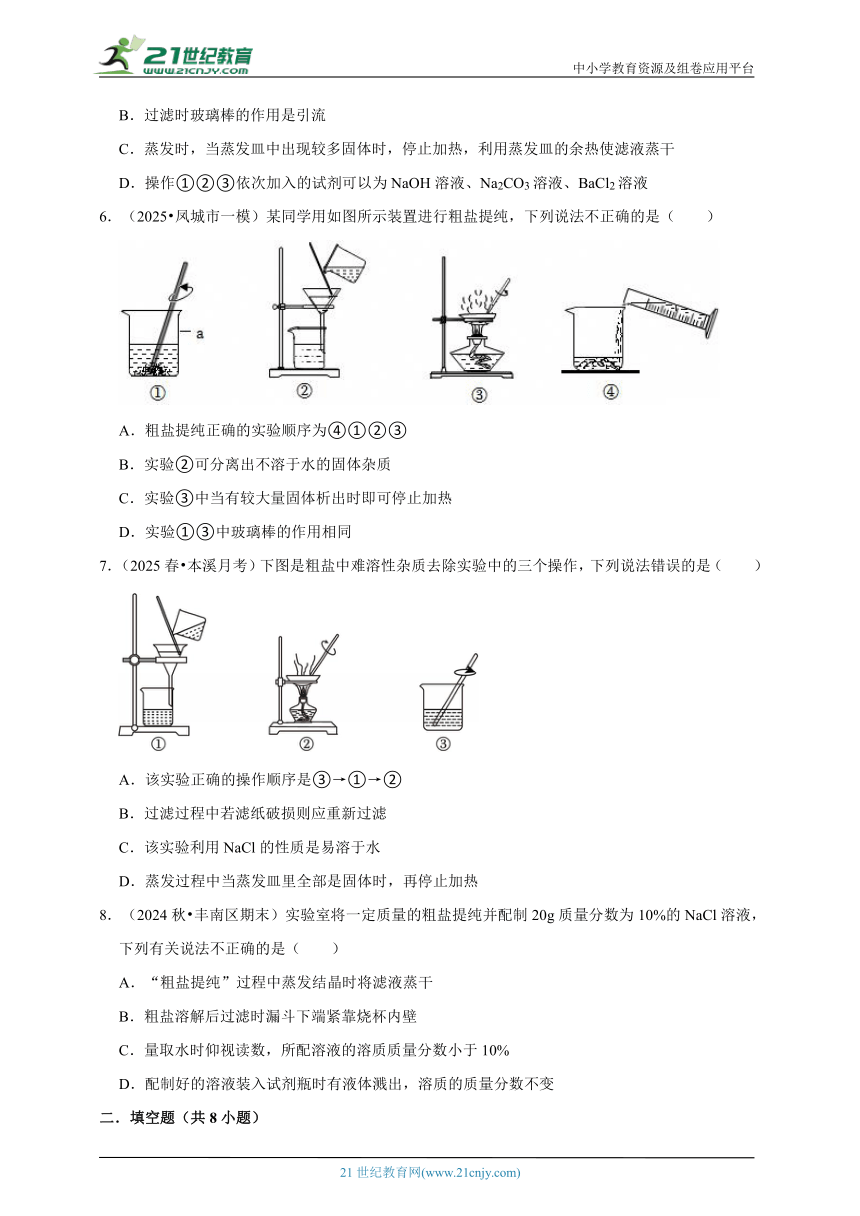
3.(2025 市中区二模)下列粗盐提纯实验中的相关操作正确的是( )
A.称取粗盐 B.溶解粗盐
C.过滤操作 D.蒸发结晶
4.(2025 盐池县一模)用下列实验操作可以完成两个实验,甲实验是除去粗盐中的难溶性固体杂质,乙实验是用精盐配制溶质质量分数为10%的氯化钠溶液。下列说法中正确的是( )
A.实验甲的步骤是①④⑤,其中除难溶杂质的关键步骤是过滤
B.实验①⑤中,玻璃棒的作用均是搅拌加快实验速度
C.实验若按②③①的步骤进行操作,所配溶液的浓度会偏小(水的密度为1g/cm3)
D.实验⑤中,待蒸发皿中液体蒸干后再停止加热
5.(2025 宁明县一模)从海水中得到的粗盐中往往含有可溶性杂质(主要有 Na2SO4、MgCl2、CaCl2)和不溶性杂质(泥沙等),必须进行分离和提纯后才能使用。粗盐提纯的部分流程如图。有关该流程说法错误的是( )
A.不溶性杂质主要是泥沙
B.过滤时玻璃棒的作用是引流
C.蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干
D.操作①②③依次加入的试剂可以为NaOH溶液、Na2CO3溶液、BaCl2溶液
6.(2025 凤城市一模)某同学用如图所示装置进行粗盐提纯,下列说法不正确的是( )
A.粗盐提纯正确的实验顺序为④①②③
B.实验②可分离出不溶于水的固体杂质
C.实验③中当有较大量固体析出时即可停止加热
D.实验①③中玻璃棒的作用相同
7.(2025春 本溪月考)下图是粗盐中难溶性杂质去除实验中的三个操作,下列说法错误的是( )
A.该实验正确的操作顺序是③→①→②
B.过滤过程中若滤纸破损则应重新过滤
C.该实验利用NaCl的性质是易溶于水
D.蒸发过程中当蒸发皿里全部是固体时,再停止加热
8.(2024秋 丰南区期末)实验室将一定质量的粗盐提纯并配制20g质量分数为10%的NaCl溶液,下列有关说法不正确的是( )
A.“粗盐提纯”过程中蒸发结晶时将滤液蒸干
B.粗盐溶解后过滤时漏斗下端紧靠烧杯内壁
C.量取水时仰视读数,所配溶液的溶质质量分数小于10%
D.配制好的溶液装入试剂瓶时有液体溅出,溶质的质量分数不变
二.填空题(共8小题)
9.(2024春 朝阳区校级月考)除去粗盐中的难溶性杂质,需要进行如下操作。
(1)溶解:玻璃棒搅拌的作用是 ;
(2)过滤:需要的玻璃仪器有玻璃棒、烧杯和 ;
(3)蒸发:当观察到蒸发皿中 停止加热,利用余热蒸干。
10.(2024 郸城县四模)实验室除去粗盐水中难溶性杂质的主要实验步骤是 ;除去粗盐水中的CaCl2、MgCl2、Na2SO4杂质,可依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液,过滤出沉淀后向滤液中加入适量的 ;其中加入NaOH溶液时发生反应的化学方程式为 。
11.(2025春 金安区校级期中)明代《天工开物》中记录了用天然气煮盐的过程:“西川有火井(天然气),事奇甚。其井居然冷水,绝无火气,但以长竹剖开去节合缝漆布,一头插入井底,其上曲接,以口紧对釜脐,注卤水釜中。只见火意烘烘,水即沸腾。启竹而视之,绝无半点焦炎意。”
(1)在煮盐时天然气燃烧,从燃烧条件分析,曲竹未燃烧(如图)的原因是 。
(2)粗盐(含(制NaCl时,除杂试剂为BaCl2溶液、NaOH溶液、盐酸、Na2CO3溶液,除杂时试剂的滴加顺序可依次为过量的NaOH溶液、 。盐酸。加入盐酸发生的反应 (与一个方程式),加热蒸发氯化钠溶液,用玻璃棒搅拌至 时停止加热。
(3)Na2CO3和NaCl是厨房中常用物质,溶解度曲线如图。下列说法正确的是 。
A.NaCl的溶解度受温度影响更大
B.10℃时,Na2CO3溶液中溶质与溶液的质量比为1:11
C.20℃时,不能配制浓度相同的Na2CO3和NaCl溶液
D.Na2CO3中含有少量NaCl,可溶于适量热水再降温结晶提纯
12.(2024 东港区校级二模)在宏观、微观和符号之间建立联系是学习化学的重要思维方式。如图为氟、钠、氯、溴四种元素在元素周期表中的相关信息及溴原子的结构示意图,请回答下列问题。
(1)溴元素在元素周期表中位于第 周期。
(2)钠元素和溴元素组成化合物的化学式为 。上述元素中,与溴元素的化学性质相似的有 。(填元素符号)
(3)氯和钠属于不同种元素,是因为它们的原子中 不同;它们可以组成物质氯化钠。
a.从微粒角度看:氯化钠是由 构成(用微粒符号表示)。
b.从制备角度看:将海水进行 (填操作方法)得到粗盐。除去粗盐中含有的、Ca2+、Mg2+等杂质,常加入过量的①Na2CO3溶液、②BaCl2溶液、③NaOH溶液,三种试剂的加入顺序为 (填序号)。
(4)空气中的自由电子附着在氧分子上形成的负氧离子(),被称为“空气维生素”。日照国家森林公园获“中国森林氧吧”荣誉称号,负氧离子浓度高达4.75万个/立方厘米。一个所含电子总数是 个。
13.(2024 罗山县二模)南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发。正确的操作顺序是 (填字母)。加Na2CO3溶液的作用是除去 ;
(2)海水“制碱”。氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 。
14.(2024 天祝县三模)为了除去粗盐中的泥沙、Ca2+、Mg2+、等杂质,将粗盐溶于水,然后进行下列五步操作:
①过滤;
②加过量的氢氧化钠溶液;
③加适量盐酸;
④加过量的碳酸钠溶液;
⑤加过量的氯化钡溶液;正确的操作顺序是 。
15.(2024春 淮阳区校级月考)除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①加过量的NaOH溶液;②加过量的BaCl2溶液;③过滤;④加适量的盐酸;⑤加过量的Na2CO3溶液。
(1)以上操作合理的先后顺序为 (数字序号不能重复使用)。
(2)加过量的Na2CO3溶液时反应的化学方程式为 。
(3)上述试剂中稀盐酸不能用稀硫酸代替,原因是 。
16.(2024 平桥区三模)已知粗盐中含有泥沙、氯化钙和氯化镁等杂质。为制得纯净的氯化钠固体,某化学兴趣小组进行了如图操作:
(1)写出X溶液中溶质的化学式: 。
(2)请设计实验证明溶液B中含有的杂质。(简要写出检验步骤和现象)
(3)最后制得氯化钠的质量大于粗盐中氯化钠的质量,写出一个可使氯化钠质量增加的化学方程式。
中考核心考点 粗盐提纯
参考答案与试题解析
一.选择题(共8小题)
1.(2025 巢湖市二模)下列关于“粗盐中难溶性杂质的去除”实验操作正确的是( )
A.称量 B.溶解
C.过滤 D.蒸发
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】D
【分析】A、根据托盘天平的使用要遵循“左物右码”的原则,进行分析判断。
B、根据溶解操作的方法,进行分析判断。
C、根据过滤要注意“一贴、二低、三靠”的原则,进行分析判断。
D、根据蒸发操作的方法、注意事项,进行分析判断。
【解答】解:A、托盘天平的使用要遵循“左物右码”的原则,图中砝码与试剂的位置放反了,故选项实验操作错误。
B、溶解操作应在烧杯中进行,不能在量筒内进行,故选项实验操作错误。
C、过滤时要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,故选项实验操作错误。
D、蒸发时,应用玻璃棒不断搅拌,防止局部温度过高,造成液滴飞溅,故选项实验操作正确。
故选:D。
【点评】本题难度不大,了解粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、注意事项等是正确解答本题的关键。
2.(2025春 重庆校级期中)实验室进行粗盐提纯并配制16%的NaCl溶液。下列仪器必须用到的是( )
①天平
②蒸发皿
③坩埚
④分液漏斗
⑤漏斗
⑥烧杯
⑦酒精灯
⑧量筒
⑨玻璃棒
A.①②④⑥⑦⑨ B.①③⑤⑥⑦⑧⑨ C.②③④⑤⑥⑦ D.①②⑤⑥⑦⑧⑨
【考点】粗盐提纯操作所需仪器;配制一定质量分数溶液的仪器.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】根据粗盐的主要成分是氯化钠,氯化钠易溶于水,泥沙难溶于水,配制溶质质量分数一定的溶液的步骤,分析各操作需要的仪器,进行分析解答。
【解答】解:粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐的过程),所需的仪器有烧杯、玻璃棒、铁架台、漏斗、蒸发皿、酒精灯等;配制16%的NaCl溶液的实验步骤是计算、称量、量取、溶解、贴签装瓶,必备的仪器有托盘天平、酒精灯、量筒、烧杯、玻璃棒等,则实验室进行粗盐提纯并配制16%的NaCl溶液,必须用到的仪器是①②⑤⑥⑦⑧⑨。
故选:D。
【点评】本题难度不大,了解粗盐提纯的原理、配制溶质质量分数一定的溶液的实验步骤、所需仪器等是正确解答本题的关键。
3.(2025 市中区二模)下列粗盐提纯实验中的相关操作正确的是( )
A.称取粗盐 B.溶解粗盐
C.过滤操作 D.蒸发结晶
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】C
【分析】A、根据托盘天平的使用要遵循“左物右码”的原则,进行分析判断。
B、根据溶解操作的方法,进行分析判断。
C、根据过滤要注意“一贴、二低、三靠”的原则,进行分析判断。
D、根据蒸发操作的方法、注意事项,进行分析判断。
【解答】解:A、托盘天平的使用要遵循“左物右码”的原则,图中砝码与试剂的位置放反了,故选项实验操作错误。
B、溶解操作应在烧杯中进行,不能在量筒内进行,故选项实验操作错误。
C、过滤时要注意“一贴、二低、三靠”的原则,故选项实验操作正确。
D、蒸发时,应用玻璃棒不断搅拌,防止局部温度过高,造成液体飞溅,故选项实验操作错误。
故选:C。
【点评】本题难度不大,了解粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、注意事项等是正确解答本题的关键。
4.(2025 盐池县一模)用下列实验操作可以完成两个实验,甲实验是除去粗盐中的难溶性固体杂质,乙实验是用精盐配制溶质质量分数为10%的氯化钠溶液。下列说法中正确的是( )
A.实验甲的步骤是①④⑤,其中除难溶杂质的关键步骤是过滤
B.实验①⑤中,玻璃棒的作用均是搅拌加快实验速度
C.实验若按②③①的步骤进行操作,所配溶液的浓度会偏小(水的密度为1g/cm3)
D.实验⑤中,待蒸发皿中液体蒸干后再停止加热
【考点】粗盐提纯的操作步骤;固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度;常见的盐 化学肥料.
【答案】A
【分析】A、粗盐提纯的实验步骤为:溶解、过滤、蒸发;除难溶杂质的关键步骤是过滤;
B、根据玻璃棒作用分析;
C、量筒量取水时,视线未与量筒内液体凹液面的最低处保持水平,会导致量取水的体积偏小,溶液质量偏小,导致所配溶液的浓度偏大;
D、根据蒸发操作注意事项分析。
【解答】解:A、粗盐提纯的实验步骤为:溶解、过滤、蒸发,故实验甲的步骤是①④⑤,其中除难溶杂质的关键步骤是过滤,故正确;
B、①为溶解,溶解时,玻璃棒的作用是:搅拌,加速溶解,⑤为蒸发,蒸发时,玻璃棒的作用是搅拌,防止局部温度过高,造成液滴飞溅,故不正确;
C、实验若按②③①的步骤进行操作,③中量取水时,视线未与量筒内液体凹液面的最低处保持水平,会导致量取水的体积偏小,溶液质量偏小,导致所配溶液的浓度偏大,故不正确;
D、实验⑤中,应待大部分固体析出时,停止加热,利用余热将其蒸干,故不正确。
故选:A。
【点评】本题难度不大,掌握粗盐提纯的原理、溶液的配制、实验步骤、所需的仪器是正确解答本题的关键。
5.(2025 宁明县一模)从海水中得到的粗盐中往往含有可溶性杂质(主要有 Na2SO4、MgCl2、CaCl2)和不溶性杂质(泥沙等),必须进行分离和提纯后才能使用。粗盐提纯的部分流程如图。有关该流程说法错误的是( )
A.不溶性杂质主要是泥沙
B.过滤时玻璃棒的作用是引流
C.蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干
D.操作①②③依次加入的试剂可以为NaOH溶液、Na2CO3溶液、BaCl2溶液
【考点】粗盐提纯中的试剂添加问题;粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】D
【分析】A、根据粗盐中不溶性杂质(泥沙等),进行分析判断。
B、根据过滤时玻璃棒的作用,进行分析判断。
C、根据蒸发操作的注意事项,进行分析判断。
D、根据盐的化学性质,进行分析判断
【解答】解:A、由题意,粗盐中含有不溶性杂质(泥沙等),则不溶性杂质主要是泥沙,A说法正确。
B、过滤时玻璃棒的作用是引流,B说法正确。
C、蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干,C说法正确。
D、加入过量的氢氧化钠可将镁离子除去;加入过量的氯化钡溶液将硫酸根离子沉淀除去;加入过量的碳酸钠溶液将钙离子转化为沉淀除去,后面加入试剂要将前面加入的过量试剂除去,故加入的碳酸钠溶液要放在加入氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;操作①②③依次加入的试剂顺序为NaOH溶液、Na2CO3溶液、BaCl2溶液时,过量的氯化钡无法除去,D错误;
故选:D。
【点评】本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
6.(2025 凤城市一模)某同学用如图所示装置进行粗盐提纯,下列说法不正确的是( )
A.粗盐提纯正确的实验顺序为④①②③
B.实验②可分离出不溶于水的固体杂质
C.实验③中当有较大量固体析出时即可停止加热
D.实验①③中玻璃棒的作用相同
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】D
【分析】A、根据粗盐提纯的步骤是:溶解、过滤、蒸发进行分析;
B、根据过滤可以除去水中的不溶性杂质进行分析;
C、根据蒸发过程的注意事项进行分析;
D、根据溶解过程中玻璃的作用是加速溶解;蒸发过程中玻璃棒的作用是:搅拌,防止因局部温度过高,造成液滴飞溅进行分析。
【解答】解:A、粗盐提纯的步骤是:溶解、过滤、蒸发,所以粗盐提纯正确的实验顺序为④①②③,故A正确;
B、过滤可以除去水中的不溶性杂质,所以实验②可分离出不溶于水的固体杂质,故B正确;
C、实验③中当有较大量固体析出时即可停止加热,故C正确;
D、溶解过程中玻璃的作用是加速溶解;蒸发过程中玻璃棒的作用是:搅拌,防止因局部温度过高,造成液滴飞溅,所以实验①③中玻璃棒的作用不同,故D错误。
故选:D。
【点评】本题难度不大,掌握粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、注意事项等是正确解答本题的关键。
7.(2025春 本溪月考)下图是粗盐中难溶性杂质去除实验中的三个操作,下列说法错误的是( )
A.该实验正确的操作顺序是③→①→②
B.过滤过程中若滤纸破损则应重新过滤
C.该实验利用NaCl的性质是易溶于水
D.蒸发过程中当蒸发皿里全部是固体时,再停止加热
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】D
【分析】A、根据粗盐的主要成分是氯化钠,氯化钠易溶于水,泥沙难溶于水,进行分析判断。
B、根据过滤操作的注意事项,进行分析判断。
C、根据氯化钠的溶解性,进行分析判断。
D、根据蒸发操作中停止加热的时机,进行分析判断。
【解答】解:A、粗盐的主要成分是氯化钠,氯化钠易溶于水,泥沙难溶于水,通过溶解(把不溶物与氯化钠初步分离)、过滤(把不溶物彻底除去)、蒸发(氯化钠从溶液中分离出来)能得到精盐,正确的操作顺序是③→①→②,故选项说法正确。
B、过滤过程中若滤纸破损,会使得液体中的不溶物进入下面的烧杯,从而使得滤液浑浊,则应重新过滤,故选项说法正确。
C、该实验利用NaCl的性质是易溶于水,故选项说法正确。
D、蒸发时,当蒸发皿中出现较多固体时,应停止加热,利用余热将剩余水分蒸干,故选项说法错误。
故选:D。
【点评】本题难度不大,了解粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、注意事项等是正确解答本题的关键。
8.(2024秋 丰南区期末)实验室将一定质量的粗盐提纯并配制20g质量分数为10%的NaCl溶液,下列有关说法不正确的是( )
A.“粗盐提纯”过程中蒸发结晶时将滤液蒸干
B.粗盐溶解后过滤时漏斗下端紧靠烧杯内壁
C.量取水时仰视读数,所配溶液的溶质质量分数小于10%
D.配制好的溶液装入试剂瓶时有液体溅出,溶质的质量分数不变
【考点】粗盐提纯的操作步骤;固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度;常见的盐 化学肥料.
【答案】A
【分析】A、根据蒸发操作中停止加热的时机,进行分析判断。
B、根据过滤要注意“一贴、二低、三靠”的原则,进行分析判断。
C、根据用量筒量取水时,仰视读数,读数比实际液体体积小,进行分析判断。
D、根据溶液具有均一性,进行分析判断。
【解答】解:A、蒸发时,当蒸发皿中出现较多固体时,应停止加热,利用余热将剩余水分蒸干,故选项说法错误。
B、过滤要注意“一贴、二低、三靠”的原则,粗盐溶解后过滤时漏斗下端紧靠烧杯内壁,故选项说法正确。
C、用量筒量取水时,仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,使溶质质量分数偏小,故选项说法正确。
D、配制好的溶液装入试剂瓶时有液体溅出,溶液具有均一性,溶质的质量分数不变,故选项说法正确。
故选:A。
【点评】本题难度不大,了解粗盐提纯的原理、配制一定溶质质量分数的溶液主要实验步骤、实验步骤、注意事项等是正确解答本题的关键。
二.填空题(共8小题)
9.(2024春 朝阳区校级月考)除去粗盐中的难溶性杂质,需要进行如下操作。
(1)溶解:玻璃棒搅拌的作用是 搅拌,加快溶解速率 ;
(2)过滤:需要的玻璃仪器有玻璃棒、烧杯和 漏斗 ;
(3)蒸发:当观察到蒸发皿中 出现较多固体时 停止加热,利用余热蒸干。
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】(1)搅拌,加快溶解速率;
(2)漏斗;
(3)出现较多固体时。
【分析】(1)根据溶解操作中玻璃棒的作用,进行分析解答。
(2)过滤是把不溶于液体的固体与液体分离的一种方法,判断所需的仪器,进行分析解答。
(3)根据蒸发操作中停止加热的时机,进行分析解答。
【解答】解:(1)溶解操作中玻璃棒的作用是搅拌,加快溶解速率。
(2)过滤是把不溶于液体的固体与液体分离的一种方法,过滤操作的装置由铁架台、烧杯、玻璃棒、漏斗四种仪器组成,其中需要的玻璃仪器有玻璃棒、烧杯和漏斗。
(3)蒸发时,当蒸发皿中出现较多固体时,应停止加热,利用余热将剩余水分蒸干。
故答案为:
(1)搅拌,加快溶解速率;
(2)漏斗;
(3)出现较多固体时。
【点评】本题难度不大,了解粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、注意事项等是正确解答本题的关键。
10.(2024 郸城县四模)实验室除去粗盐水中难溶性杂质的主要实验步骤是 过滤 ;除去粗盐水中的CaCl2、MgCl2、Na2SO4杂质,可依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液,过滤出沉淀后向滤液中加入适量的 稀盐酸 ;其中加入NaOH溶液时发生反应的化学方程式为 MgCl2+2NaOH=Mg(OH)2↓+2NaCl 。
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】过滤;稀盐酸;MgCl2+2NaOH=Mg(OH)2↓+2NaCl。
【分析】根据分离混合物的方法、粗盐中可溶性杂质的去除方法、化学反应的原理来分析。
【解答】解:粗盐的主要成分是氯化钠,氯化钠易溶于水,泥沙难溶于水,粗盐提纯是通过溶解(把不溶物与氯化钠初步分离)、过滤(把不溶物彻底除去)、蒸发(氯化钠从溶液中分离出来)得到精盐的过程。氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,反应的化学方程式依次为BaCl2+Na2SO4═BaSO4↓+2NaCl、2NaOH+MgCl2=Mg(OH)2↓+2NaCl、CaCl2+Na2CO3═CaCO3↓+2NaCl、BaCl2+Na2CO3═BaCO3↓+2NaCl。分离出沉淀后溶液中含有碳酸钠、氢氧化钠和氯化钠,再加入适量稀盐酸除去反应剩余的氢氧根离子和碳酸根离子,即除去过量的氢氧化钠和碳酸钠。
故答案为:过滤;稀盐酸;MgCl2+2NaOH=Mg(OH)2↓+2NaCl。
【点评】本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
11.(2025春 金安区校级期中)明代《天工开物》中记录了用天然气煮盐的过程:“西川有火井(天然气),事奇甚。其井居然冷水,绝无火气,但以长竹剖开去节合缝漆布,一头插入井底,其上曲接,以口紧对釜脐,注卤水釜中。只见火意烘烘,水即沸腾。启竹而视之,绝无半点焦炎意。”
(1)在煮盐时天然气燃烧,从燃烧条件分析,曲竹未燃烧(如图)的原因是 温度没有达到曲竹的着火点 。
(2)粗盐(含(制NaCl时,除杂试剂为BaCl2溶液、NaOH溶液、盐酸、Na2CO3溶液,除杂时试剂的滴加顺序可依次为过量的NaOH溶液、 BaCl2溶液、Na2CO3溶液 。盐酸。加入盐酸发生的反应 Na2CO3+2HCl=2NaCl+H2O+CO2↑或NaOH+HCl=NaCl+H2O (与一个方程式),加热蒸发氯化钠溶液,用玻璃棒搅拌至 蒸发皿中出现较多固体 时停止加热。
(3)Na2CO3和NaCl是厨房中常用物质,溶解度曲线如图。下列说法正确的是 D 。
A.NaCl的溶解度受温度影响更大
B.10℃时,Na2CO3溶液中溶质与溶液的质量比为1:11
C.20℃时,不能配制浓度相同的Na2CO3和NaCl溶液
D.Na2CO3中含有少量NaCl,可溶于适量热水再降温结晶提纯
【考点】粗盐提纯中的试剂添加问题;燃烧与燃烧的条件;固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法.
【专题】化学与能源;溶液、浊液与溶解度;常见的盐 化学肥料.
【答案】(1)温度没有达到曲竹的着火点。
(2)BaCl2溶液、Na2CO3溶液;Na2CO3+2HCl=2NaCl+H2O+CO2↑或NaOH+HCl=NaCl+H2O;蒸发皿中出现较多固体;
(3)D。
【分析】(1)根据燃烧需要同时满足三个条件:可燃物、与氧气(或空气)接触、温度达到可燃物的着火点分析。
(2)加入过量的NaOH溶液除去Mg2+,加入过量的BaCl2溶液除去,然后加入过量的Na2CO3溶液除去Ca2+和过量的BaCl2溶液,最后加入盐酸除去过量的NaOH和Na2CO3;蒸发时蒸发皿中出现较多固体时停止加热;
(3)A、根据溶解度曲线分析。
B、根据溶解度含义分析。
C、根据溶质质量分数定义分析。
D、根据结晶方法分析。
【解答】解:(1)燃烧需要同时满足三个条件:可燃物、与氧气(或空气)接触、温度达到可燃物的着火点。曲竹是可燃物,也与氧气接触,未燃烧的原因是温度没有达到曲竹的着火点。故答案为:温度没有达到曲竹的着火点。
(2)除去粗盐中的Ca2+、Mg2+、,加入过量的NaOH溶液除去Mg2+,加入过量的BaCl2溶液除去,然后加入过量的Na2CO3溶液除去Ca2+和过量的BaCl2溶液,最后加入盐酸除去过量的NaOH和Na2CO3,所以除杂时试剂的滴加顺序可依次为过量的NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸。碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑;氢氧化钠和盐酸生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O。加热蒸发氯化钠溶液,用玻璃棒搅拌至蒸发皿中出现较多固体时停止加热,利用余热将水蒸干。故答案为:BaCl2溶液、Na2CO3溶液;Na2CO3+2HCl=2NaCl+H2O+CO2↑或NaOH+HCl=NaCl+H2O;蒸发皿中出现较多固体;
(3)A、由溶解度曲线可知,NaCl的溶解度受温度影响较小,故A错误。
B、10℃时,碳酸钠的溶解度为10g,此时饱和碳酸钠溶液中溶质与溶液的质量比为10g:(10g+100g)=1:11,但题目未说明是饱和溶液,故B错误。
C、20℃时,碳酸钠和氯化钠的溶解度不同,但可以配制溶质质量分数相同的不饱和溶液,故C错误。
D、碳酸钠的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,Na2CO3中含有少量NaCl,可溶于适量热水再降温结晶提纯碳酸钠,故D正确。
故选:D。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
12.(2024 东港区校级二模)在宏观、微观和符号之间建立联系是学习化学的重要思维方式。如图为氟、钠、氯、溴四种元素在元素周期表中的相关信息及溴原子的结构示意图,请回答下列问题。
(1)溴元素在元素周期表中位于第 四 周期。
(2)钠元素和溴元素组成化合物的化学式为 NaBr 。上述元素中,与溴元素的化学性质相似的有 F、Cl 。(填元素符号)
(3)氯和钠属于不同种元素,是因为它们的原子中 质子数 不同;它们可以组成物质氯化钠。
a.从微粒角度看:氯化钠是由 Na+、Cl﹣ 构成(用微粒符号表示)。
b.从制备角度看:将海水进行 蒸发结晶 (填操作方法)得到粗盐。除去粗盐中含有的、Ca2+、Mg2+等杂质,常加入过量的①Na2CO3溶液、②BaCl2溶液、③NaOH溶液,三种试剂的加入顺序为 ②③①或③②①或②①③ (填序号)。
(4)空气中的自由电子附着在氧分子上形成的负氧离子(),被称为“空气维生素”。日照国家森林公园获“中国森林氧吧”荣誉称号,负氧离子浓度高达4.75万个/立方厘米。一个所含电子总数是 17 个。
【考点】粗盐提纯中的试剂添加问题;分子、原子、离子、元素与物质之间的关系;原子和离子的相互转化;周期表信息示意图及结构示意图的综合考查.
【专题】物质的微观构成与物质的宏观组成;常见的盐 化学肥料.
【答案】(1)四;
(2)NaBr;F、Cl;
(3)质子数;
a.Na+、Cl﹣;b.蒸发结晶;②③①或③②①或②①③;
(4)17。
【分析】(1)根据周期数=原子核外电子层数,进行分析解答。
(2)根据化合价的数值等于离子所带电荷的数值,且符号一致,决定元素的化学性质是原子的最外层电子数,进行分析解答。
(3)根据质子数决定元素的种类,进行分析解答。
a.根据氯化钠是由钠离子和氯离子构成的,进行分析解答。
b.根据氯化钠的溶解度受温度的影响变化不大,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,进行分析解答。
(4)根据氧原子的核电荷数为8,核外电子数为8,进行分析解答。
【解答】解:(1)周期数=原子核外电子层数,溴元素的原子核外有4个电子层,溴元素在元素周期表中位于第四周期。
(2)钠原子最外层电子数为1,易失去1个电子而形成带1个单位正电荷的阳离子,化合价的数值等于离子所带电荷的数值,且符号一致,则钠元素的化合价为+1价;由溴原子的原子结构示意图可知,溴原子最外层电子数为7,易得到一个电子形成带1个单位负电荷的阴离子,溴元素的化合价为﹣1价,组成的化合物的化学式为NaBr;决定元素的化学性质是原子的最外层电子数,原子的最外层电子数相同,化学性质相似,溴原子的最外层电子数为7,则与其化学性质相似的粒子结构示意图中最外层电子数也应为7,氟原子、氯原子的最外层电子数是7,其元素符号分别是F、Cl。
(3)质子数决定元素的种类,钠元素与氯元素之间最本质的区别是质子数不同。
a.氯化钠是由钠离子和氯离子构成的,其离子符号为Na+、Cl﹣。
b.氯化钠的溶解度受温度的影响变化不大,从制备角度看:将海水进行蒸发结晶可得到粗盐;NaOH溶液除去镁离子,BaCl2溶液除去硫酸根离子,Na2CO3溶液为了除去钙离子以及过量的钡离子(碳酸钠溶液必须在氯化钡溶液之后),常加入过量的①Na2CO3溶液、②BaCl2溶液、③NaOH溶液,三种试剂的加入顺序为②③①或③②①或②①③。
(4)氧原子的核电荷数为8,核外电子数为8,,一个所含电子总数是2×8+1=17。
故答案为:
(1)四;
(2)NaBr;F、Cl;
(3)质子数;
a.Na+、Cl﹣;b.蒸发结晶;②③①或③②①或②①③;
(4)17。
【点评】本题难度不大,了解粗盐提纯中离子的除杂、元素周期表和原子结构示意图的含义等是正确解答本题的关键。
13.(2024 罗山县二模)南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发。正确的操作顺序是 acdbe (填字母)。加Na2CO3溶液的作用是除去 氯化钙和过量的氢氧化钡 ;
(2)海水“制碱”。氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl 。
【考点】粗盐提纯中的试剂添加问题;书写化学方程式、文字表达式、电离方程式.
【专题】常见的盐 化学肥料.
【答案】(1)acdbe;氯化钙和过量的氢氧化钡;
(2)NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl。
【分析】(1)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氢氧化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
(2)根据氨碱法制纯碱中生成NaHCO3和NH4Cl,氨气、氯化钠、水和二氧化碳反应生成碳酸氢钠和氯化铵,进行分析解答。
【解答】解:(1)氢氧化钡和硫酸镁反应生成硫酸钡沉淀和氢氧化镁沉淀,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠和过量的氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,稀盐酸和氢氧化钠反应生成氯化钠和水,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,正确的操作顺序是:加过量的Ba(OH)2溶液除去硫酸镁、加过量的Na2CO3溶液除去氯化钙和过量的氢氧化钡、过滤除去沉淀、加稍过量的盐酸除去过量的碳酸钠和反应生成的氢氧化钠、蒸发得到氯化钠,正确的操作顺序是acdbe。加Na2CO3溶液的作用是除去氯化钙和过量的氢氧化钡。
(2)氨碱法制纯碱是先通过化学反应生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3制得纯碱,氨气、氯化钠、水和二氧化碳反应生成碳酸氢钠和氯化铵,该反应化学方程式为NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl。
故答案为:
(1)acdbe;氯化钙和过量的氢氧化钡;
(2)NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl。
【点评】本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
14.(2024 天祝县三模)为了除去粗盐中的泥沙、Ca2+、Mg2+、等杂质,将粗盐溶于水,然后进行下列五步操作:
①过滤;
②加过量的氢氧化钠溶液;
③加适量盐酸;
④加过量的碳酸钠溶液;
⑤加过量的氯化钡溶液;正确的操作顺序是 ②⑤④①③或⑤②④①③或⑤④②①③ 。
【考点】粗盐提纯中的试剂添加问题.
【专题】常见的盐 化学肥料.
【答案】②⑤④①③或⑤②④①③或⑤④②①③。
【分析】根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
【解答】解:镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去过量的氯化钡;完全反应后,再进行过滤,最后再加入适量盐酸除去反应剩余的氢氧根离子和碳酸根离子,故除去粗盐中的泥沙、Ca2+、Mg2+、等杂质的正确的顺序为:②⑤④①③②⑤④①③或⑤②④①③或⑤④②①③。
故答案为:
②⑤④①③或⑤②④①③或⑤④②①③。
【点评】本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
15.(2024春 淮阳区校级月考)除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①加过量的NaOH溶液;②加过量的BaCl2溶液;③过滤;④加适量的盐酸;⑤加过量的Na2CO3溶液。
(1)以上操作合理的先后顺序为 ①②⑤③④或②①⑤③④或②⑤①③④ (数字序号不能重复使用)。
(2)加过量的Na2CO3溶液时反应的化学方程式为 CaCl2+Na2CO3═CaCO3↓+2NaCl、BaCl2+Na2CO3═BaCO3↓+2NaCl 。
(3)上述试剂中稀盐酸不能用稀硫酸代替,原因是 会生成新的杂质硫酸钠 。
【考点】粗盐提纯中的试剂添加问题.
【专题】常见的盐 化学肥料.
【答案】(1)①②⑤③④或②①⑤③④或②⑤①③④;
(2)CaCl2+Na2CO3═CaCO3↓+2NaCl、BaCl2+Na2CO3═BaCO3↓+2NaCl;
(3)会生成新的杂质硫酸钠。
【分析】根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
【解答】解:(1)镁离子与氢氧根离子形成氢氧化镁沉淀,硫酸根离子与钡离子形成硫酸钡沉淀,钙离子和钡离子均可用碳酸根离子沉淀,因为要完全除去各杂质离子,所加试剂都应该过量,而碳酸钠可以将过量的钡离子沉淀,则加碳酸钠要放在加氯化钡之后,盐酸可除去过量的碳酸钠和氢氧化钠,则过滤掉沉淀后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,所以合理的而先后顺序为①②⑤③④或②①⑤③④或②⑤①③④。
(2)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,反应的化学方程式分别为CaCl2+Na2CO3═CaCO3↓+2NaCl、BaCl2+Na2CO3═BaCO3↓+2NaCl。
(3)题干中用盐酸除去过量的碳酸钠和氢氧化钠,如果用稀硫酸代替稀盐酸,会产生硫酸钠,就引入了新的杂质。
故答案为:
(1)①②⑤③④或②①⑤③④或②⑤①③④;
(2)CaCl2+Na2CO3═CaCO3↓+2NaCl、BaCl2+Na2CO3═BaCO3↓+2NaCl;
(3)会生成新的杂质硫酸钠。
【点评】本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
16.(2024 平桥区三模)已知粗盐中含有泥沙、氯化钙和氯化镁等杂质。为制得纯净的氯化钠固体,某化学兴趣小组进行了如图操作:
(1)写出X溶液中溶质的化学式: NaOH或Ca(OH)2 。
(2)请设计实验证明溶液B中含有的杂质。(简要写出检验步骤和现象)
(3)最后制得氯化钠的质量大于粗盐中氯化钠的质量,写出一个可使氯化钠质量增加的化学方程式。
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】(1)NaOH或Ca(OH)2;
(2)取少量溶液B于试管中,加入过量的CaCl2溶液,产生白色沉淀,证明含有碳酸钠;静置,取上层清液,滴加酚酞溶液,溶液变红,说明溶液中含有氢氧化钠;
(3)2NaOH+MgCl2=Mg(OH)2↓+2NaCl(或CaCl2+Na2CO3=CaCO3↓+2NaCl或HCl+NaOH=NaCl+H2O或Na2CO3+2HCl=2NaCl+H2O+CO2↑)。
【分析】根据镁离子用氢氧根离子沉淀,钙离子用碳酸根离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
【解答】解:(1)镁离子用氢氧根离子沉淀,X溶液为氢氧化钠溶液或氢氧化钙溶液,用于除去氯化镁,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠或氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,氢氧化钠和氢氧化钙的化学式分别是NaOH、Ca(OH)2。
(2)加入过量的碳酸钠溶液除去氯化钙,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,若X为氢氧化钙,碳酸钠还用于除去过量的氢氧化钙,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,过滤后,溶液B中含有氯化钠、氢氧化钠、碳酸钠,溶液B中含有的杂质是氢氧化钠和碳酸钠,氢氧化钠和碳酸钠都显碱性,碳酸钠会干扰氢氧化钠的检验,应先检验碳酸钠并将其除去,再检验氢氧化钠,具体方案为:取少量溶液B于试管中,加入过量的CaCl2溶液,产生白色沉淀,证明含有碳酸钠,静置,取上层清液,滴加酚酞溶液,溶液变红,说明溶液中含有氢氧化钠。
(3)最后制得氯化钠的质量大于粗盐中氯化钠的质量,是因为氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,稀盐酸和氢氧化钠反应生成氯化钠和水,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,反应的化学方程式分别为2NaOH+MgCl2=Mg(OH)2↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl、HCl+NaOH=NaCl+H2O、Na2CO3+2HCl=2NaCl+H2O+CO2↑。
故答案为:
(1)NaOH或Ca(OH)2;
(2)取少量溶液B于试管中,加入过量的CaCl2溶液,产生白色沉淀,证明含有碳酸钠;静置,取上层清液,滴加酚酞溶液,溶液变红,说明溶液中含有氢氧化钠;
(3)2NaOH+MgCl2=Mg(OH)2↓+2NaCl(或CaCl2+Na2CO3=CaCO3↓+2NaCl或HCl+NaOH=NaCl+H2O或Na2CO3+2HCl=2NaCl+H2O+CO2↑)。
【点评】本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
中考核心考点 粗盐提纯
一.选择题(共8小题)
1.(2025 巢湖市二模)下列关于“粗盐中难溶性杂质的去除”实验操作正确的是( )
A.称量 B.溶解
C.过滤 D.蒸发
2.(2025春 重庆校级期中)实验室进行粗盐提纯并配制16%的NaCl溶液。下列仪器必须用到的是( )
①天平
②蒸发皿
③坩埚
④分液漏斗
⑤漏斗
⑥烧杯
⑦酒精灯
⑧量筒
⑨玻璃棒
A.①②④⑥⑦⑨ B.①③⑤⑥⑦⑧⑨ C.②③④⑤⑥⑦ D.①②⑤⑥⑦⑧⑨
3.(2025 市中区二模)下列粗盐提纯实验中的相关操作正确的是( )
A.称取粗盐 B.溶解粗盐
C.过滤操作 D.蒸发结晶
4.(2025 盐池县一模)用下列实验操作可以完成两个实验,甲实验是除去粗盐中的难溶性固体杂质,乙实验是用精盐配制溶质质量分数为10%的氯化钠溶液。下列说法中正确的是( )
A.实验甲的步骤是①④⑤,其中除难溶杂质的关键步骤是过滤
B.实验①⑤中,玻璃棒的作用均是搅拌加快实验速度
C.实验若按②③①的步骤进行操作,所配溶液的浓度会偏小(水的密度为1g/cm3)
D.实验⑤中,待蒸发皿中液体蒸干后再停止加热
5.(2025 宁明县一模)从海水中得到的粗盐中往往含有可溶性杂质(主要有 Na2SO4、MgCl2、CaCl2)和不溶性杂质(泥沙等),必须进行分离和提纯后才能使用。粗盐提纯的部分流程如图。有关该流程说法错误的是( )
A.不溶性杂质主要是泥沙
B.过滤时玻璃棒的作用是引流
C.蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干
D.操作①②③依次加入的试剂可以为NaOH溶液、Na2CO3溶液、BaCl2溶液
6.(2025 凤城市一模)某同学用如图所示装置进行粗盐提纯,下列说法不正确的是( )
A.粗盐提纯正确的实验顺序为④①②③
B.实验②可分离出不溶于水的固体杂质
C.实验③中当有较大量固体析出时即可停止加热
D.实验①③中玻璃棒的作用相同
7.(2025春 本溪月考)下图是粗盐中难溶性杂质去除实验中的三个操作,下列说法错误的是( )
A.该实验正确的操作顺序是③→①→②
B.过滤过程中若滤纸破损则应重新过滤
C.该实验利用NaCl的性质是易溶于水
D.蒸发过程中当蒸发皿里全部是固体时,再停止加热
8.(2024秋 丰南区期末)实验室将一定质量的粗盐提纯并配制20g质量分数为10%的NaCl溶液,下列有关说法不正确的是( )
A.“粗盐提纯”过程中蒸发结晶时将滤液蒸干
B.粗盐溶解后过滤时漏斗下端紧靠烧杯内壁
C.量取水时仰视读数,所配溶液的溶质质量分数小于10%
D.配制好的溶液装入试剂瓶时有液体溅出,溶质的质量分数不变
二.填空题(共8小题)
9.(2024春 朝阳区校级月考)除去粗盐中的难溶性杂质,需要进行如下操作。
(1)溶解:玻璃棒搅拌的作用是 ;
(2)过滤:需要的玻璃仪器有玻璃棒、烧杯和 ;
(3)蒸发:当观察到蒸发皿中 停止加热,利用余热蒸干。
10.(2024 郸城县四模)实验室除去粗盐水中难溶性杂质的主要实验步骤是 ;除去粗盐水中的CaCl2、MgCl2、Na2SO4杂质,可依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液,过滤出沉淀后向滤液中加入适量的 ;其中加入NaOH溶液时发生反应的化学方程式为 。
11.(2025春 金安区校级期中)明代《天工开物》中记录了用天然气煮盐的过程:“西川有火井(天然气),事奇甚。其井居然冷水,绝无火气,但以长竹剖开去节合缝漆布,一头插入井底,其上曲接,以口紧对釜脐,注卤水釜中。只见火意烘烘,水即沸腾。启竹而视之,绝无半点焦炎意。”
(1)在煮盐时天然气燃烧,从燃烧条件分析,曲竹未燃烧(如图)的原因是 。
(2)粗盐(含(制NaCl时,除杂试剂为BaCl2溶液、NaOH溶液、盐酸、Na2CO3溶液,除杂时试剂的滴加顺序可依次为过量的NaOH溶液、 。盐酸。加入盐酸发生的反应 (与一个方程式),加热蒸发氯化钠溶液,用玻璃棒搅拌至 时停止加热。
(3)Na2CO3和NaCl是厨房中常用物质,溶解度曲线如图。下列说法正确的是 。
A.NaCl的溶解度受温度影响更大
B.10℃时,Na2CO3溶液中溶质与溶液的质量比为1:11
C.20℃时,不能配制浓度相同的Na2CO3和NaCl溶液
D.Na2CO3中含有少量NaCl,可溶于适量热水再降温结晶提纯
12.(2024 东港区校级二模)在宏观、微观和符号之间建立联系是学习化学的重要思维方式。如图为氟、钠、氯、溴四种元素在元素周期表中的相关信息及溴原子的结构示意图,请回答下列问题。
(1)溴元素在元素周期表中位于第 周期。
(2)钠元素和溴元素组成化合物的化学式为 。上述元素中,与溴元素的化学性质相似的有 。(填元素符号)
(3)氯和钠属于不同种元素,是因为它们的原子中 不同;它们可以组成物质氯化钠。
a.从微粒角度看:氯化钠是由 构成(用微粒符号表示)。
b.从制备角度看:将海水进行 (填操作方法)得到粗盐。除去粗盐中含有的、Ca2+、Mg2+等杂质,常加入过量的①Na2CO3溶液、②BaCl2溶液、③NaOH溶液,三种试剂的加入顺序为 (填序号)。
(4)空气中的自由电子附着在氧分子上形成的负氧离子(),被称为“空气维生素”。日照国家森林公园获“中国森林氧吧”荣誉称号,负氧离子浓度高达4.75万个/立方厘米。一个所含电子总数是 个。
13.(2024 罗山县二模)南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发。正确的操作顺序是 (填字母)。加Na2CO3溶液的作用是除去 ;
(2)海水“制碱”。氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 。
14.(2024 天祝县三模)为了除去粗盐中的泥沙、Ca2+、Mg2+、等杂质,将粗盐溶于水,然后进行下列五步操作:
①过滤;
②加过量的氢氧化钠溶液;
③加适量盐酸;
④加过量的碳酸钠溶液;
⑤加过量的氯化钡溶液;正确的操作顺序是 。
15.(2024春 淮阳区校级月考)除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①加过量的NaOH溶液;②加过量的BaCl2溶液;③过滤;④加适量的盐酸;⑤加过量的Na2CO3溶液。
(1)以上操作合理的先后顺序为 (数字序号不能重复使用)。
(2)加过量的Na2CO3溶液时反应的化学方程式为 。
(3)上述试剂中稀盐酸不能用稀硫酸代替,原因是 。
16.(2024 平桥区三模)已知粗盐中含有泥沙、氯化钙和氯化镁等杂质。为制得纯净的氯化钠固体,某化学兴趣小组进行了如图操作:
(1)写出X溶液中溶质的化学式: 。
(2)请设计实验证明溶液B中含有的杂质。(简要写出检验步骤和现象)
(3)最后制得氯化钠的质量大于粗盐中氯化钠的质量,写出一个可使氯化钠质量增加的化学方程式。
中考核心考点 粗盐提纯
参考答案与试题解析
一.选择题(共8小题)
1.(2025 巢湖市二模)下列关于“粗盐中难溶性杂质的去除”实验操作正确的是( )
A.称量 B.溶解
C.过滤 D.蒸发
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】D
【分析】A、根据托盘天平的使用要遵循“左物右码”的原则,进行分析判断。
B、根据溶解操作的方法,进行分析判断。
C、根据过滤要注意“一贴、二低、三靠”的原则,进行分析判断。
D、根据蒸发操作的方法、注意事项,进行分析判断。
【解答】解:A、托盘天平的使用要遵循“左物右码”的原则,图中砝码与试剂的位置放反了,故选项实验操作错误。
B、溶解操作应在烧杯中进行,不能在量筒内进行,故选项实验操作错误。
C、过滤时要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,故选项实验操作错误。
D、蒸发时,应用玻璃棒不断搅拌,防止局部温度过高,造成液滴飞溅,故选项实验操作正确。
故选:D。
【点评】本题难度不大,了解粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、注意事项等是正确解答本题的关键。
2.(2025春 重庆校级期中)实验室进行粗盐提纯并配制16%的NaCl溶液。下列仪器必须用到的是( )
①天平
②蒸发皿
③坩埚
④分液漏斗
⑤漏斗
⑥烧杯
⑦酒精灯
⑧量筒
⑨玻璃棒
A.①②④⑥⑦⑨ B.①③⑤⑥⑦⑧⑨ C.②③④⑤⑥⑦ D.①②⑤⑥⑦⑧⑨
【考点】粗盐提纯操作所需仪器;配制一定质量分数溶液的仪器.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】根据粗盐的主要成分是氯化钠,氯化钠易溶于水,泥沙难溶于水,配制溶质质量分数一定的溶液的步骤,分析各操作需要的仪器,进行分析解答。
【解答】解:粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐的过程),所需的仪器有烧杯、玻璃棒、铁架台、漏斗、蒸发皿、酒精灯等;配制16%的NaCl溶液的实验步骤是计算、称量、量取、溶解、贴签装瓶,必备的仪器有托盘天平、酒精灯、量筒、烧杯、玻璃棒等,则实验室进行粗盐提纯并配制16%的NaCl溶液,必须用到的仪器是①②⑤⑥⑦⑧⑨。
故选:D。
【点评】本题难度不大,了解粗盐提纯的原理、配制溶质质量分数一定的溶液的实验步骤、所需仪器等是正确解答本题的关键。
3.(2025 市中区二模)下列粗盐提纯实验中的相关操作正确的是( )
A.称取粗盐 B.溶解粗盐
C.过滤操作 D.蒸发结晶
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】C
【分析】A、根据托盘天平的使用要遵循“左物右码”的原则,进行分析判断。
B、根据溶解操作的方法,进行分析判断。
C、根据过滤要注意“一贴、二低、三靠”的原则,进行分析判断。
D、根据蒸发操作的方法、注意事项,进行分析判断。
【解答】解:A、托盘天平的使用要遵循“左物右码”的原则,图中砝码与试剂的位置放反了,故选项实验操作错误。
B、溶解操作应在烧杯中进行,不能在量筒内进行,故选项实验操作错误。
C、过滤时要注意“一贴、二低、三靠”的原则,故选项实验操作正确。
D、蒸发时,应用玻璃棒不断搅拌,防止局部温度过高,造成液体飞溅,故选项实验操作错误。
故选:C。
【点评】本题难度不大,了解粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、注意事项等是正确解答本题的关键。
4.(2025 盐池县一模)用下列实验操作可以完成两个实验,甲实验是除去粗盐中的难溶性固体杂质,乙实验是用精盐配制溶质质量分数为10%的氯化钠溶液。下列说法中正确的是( )
A.实验甲的步骤是①④⑤,其中除难溶杂质的关键步骤是过滤
B.实验①⑤中,玻璃棒的作用均是搅拌加快实验速度
C.实验若按②③①的步骤进行操作,所配溶液的浓度会偏小(水的密度为1g/cm3)
D.实验⑤中,待蒸发皿中液体蒸干后再停止加热
【考点】粗盐提纯的操作步骤;固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度;常见的盐 化学肥料.
【答案】A
【分析】A、粗盐提纯的实验步骤为:溶解、过滤、蒸发;除难溶杂质的关键步骤是过滤;
B、根据玻璃棒作用分析;
C、量筒量取水时,视线未与量筒内液体凹液面的最低处保持水平,会导致量取水的体积偏小,溶液质量偏小,导致所配溶液的浓度偏大;
D、根据蒸发操作注意事项分析。
【解答】解:A、粗盐提纯的实验步骤为:溶解、过滤、蒸发,故实验甲的步骤是①④⑤,其中除难溶杂质的关键步骤是过滤,故正确;
B、①为溶解,溶解时,玻璃棒的作用是:搅拌,加速溶解,⑤为蒸发,蒸发时,玻璃棒的作用是搅拌,防止局部温度过高,造成液滴飞溅,故不正确;
C、实验若按②③①的步骤进行操作,③中量取水时,视线未与量筒内液体凹液面的最低处保持水平,会导致量取水的体积偏小,溶液质量偏小,导致所配溶液的浓度偏大,故不正确;
D、实验⑤中,应待大部分固体析出时,停止加热,利用余热将其蒸干,故不正确。
故选:A。
【点评】本题难度不大,掌握粗盐提纯的原理、溶液的配制、实验步骤、所需的仪器是正确解答本题的关键。
5.(2025 宁明县一模)从海水中得到的粗盐中往往含有可溶性杂质(主要有 Na2SO4、MgCl2、CaCl2)和不溶性杂质(泥沙等),必须进行分离和提纯后才能使用。粗盐提纯的部分流程如图。有关该流程说法错误的是( )
A.不溶性杂质主要是泥沙
B.过滤时玻璃棒的作用是引流
C.蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干
D.操作①②③依次加入的试剂可以为NaOH溶液、Na2CO3溶液、BaCl2溶液
【考点】粗盐提纯中的试剂添加问题;粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】D
【分析】A、根据粗盐中不溶性杂质(泥沙等),进行分析判断。
B、根据过滤时玻璃棒的作用,进行分析判断。
C、根据蒸发操作的注意事项,进行分析判断。
D、根据盐的化学性质,进行分析判断
【解答】解:A、由题意,粗盐中含有不溶性杂质(泥沙等),则不溶性杂质主要是泥沙,A说法正确。
B、过滤时玻璃棒的作用是引流,B说法正确。
C、蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干,C说法正确。
D、加入过量的氢氧化钠可将镁离子除去;加入过量的氯化钡溶液将硫酸根离子沉淀除去;加入过量的碳酸钠溶液将钙离子转化为沉淀除去,后面加入试剂要将前面加入的过量试剂除去,故加入的碳酸钠溶液要放在加入氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;操作①②③依次加入的试剂顺序为NaOH溶液、Na2CO3溶液、BaCl2溶液时,过量的氯化钡无法除去,D错误;
故选:D。
【点评】本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
6.(2025 凤城市一模)某同学用如图所示装置进行粗盐提纯,下列说法不正确的是( )
A.粗盐提纯正确的实验顺序为④①②③
B.实验②可分离出不溶于水的固体杂质
C.实验③中当有较大量固体析出时即可停止加热
D.实验①③中玻璃棒的作用相同
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】D
【分析】A、根据粗盐提纯的步骤是:溶解、过滤、蒸发进行分析;
B、根据过滤可以除去水中的不溶性杂质进行分析;
C、根据蒸发过程的注意事项进行分析;
D、根据溶解过程中玻璃的作用是加速溶解;蒸发过程中玻璃棒的作用是:搅拌,防止因局部温度过高,造成液滴飞溅进行分析。
【解答】解:A、粗盐提纯的步骤是:溶解、过滤、蒸发,所以粗盐提纯正确的实验顺序为④①②③,故A正确;
B、过滤可以除去水中的不溶性杂质,所以实验②可分离出不溶于水的固体杂质,故B正确;
C、实验③中当有较大量固体析出时即可停止加热,故C正确;
D、溶解过程中玻璃的作用是加速溶解;蒸发过程中玻璃棒的作用是:搅拌,防止因局部温度过高,造成液滴飞溅,所以实验①③中玻璃棒的作用不同,故D错误。
故选:D。
【点评】本题难度不大,掌握粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、注意事项等是正确解答本题的关键。
7.(2025春 本溪月考)下图是粗盐中难溶性杂质去除实验中的三个操作,下列说法错误的是( )
A.该实验正确的操作顺序是③→①→②
B.过滤过程中若滤纸破损则应重新过滤
C.该实验利用NaCl的性质是易溶于水
D.蒸发过程中当蒸发皿里全部是固体时,再停止加热
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】D
【分析】A、根据粗盐的主要成分是氯化钠,氯化钠易溶于水,泥沙难溶于水,进行分析判断。
B、根据过滤操作的注意事项,进行分析判断。
C、根据氯化钠的溶解性,进行分析判断。
D、根据蒸发操作中停止加热的时机,进行分析判断。
【解答】解:A、粗盐的主要成分是氯化钠,氯化钠易溶于水,泥沙难溶于水,通过溶解(把不溶物与氯化钠初步分离)、过滤(把不溶物彻底除去)、蒸发(氯化钠从溶液中分离出来)能得到精盐,正确的操作顺序是③→①→②,故选项说法正确。
B、过滤过程中若滤纸破损,会使得液体中的不溶物进入下面的烧杯,从而使得滤液浑浊,则应重新过滤,故选项说法正确。
C、该实验利用NaCl的性质是易溶于水,故选项说法正确。
D、蒸发时,当蒸发皿中出现较多固体时,应停止加热,利用余热将剩余水分蒸干,故选项说法错误。
故选:D。
【点评】本题难度不大,了解粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、注意事项等是正确解答本题的关键。
8.(2024秋 丰南区期末)实验室将一定质量的粗盐提纯并配制20g质量分数为10%的NaCl溶液,下列有关说法不正确的是( )
A.“粗盐提纯”过程中蒸发结晶时将滤液蒸干
B.粗盐溶解后过滤时漏斗下端紧靠烧杯内壁
C.量取水时仰视读数,所配溶液的溶质质量分数小于10%
D.配制好的溶液装入试剂瓶时有液体溅出,溶质的质量分数不变
【考点】粗盐提纯的操作步骤;固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度;常见的盐 化学肥料.
【答案】A
【分析】A、根据蒸发操作中停止加热的时机,进行分析判断。
B、根据过滤要注意“一贴、二低、三靠”的原则,进行分析判断。
C、根据用量筒量取水时,仰视读数,读数比实际液体体积小,进行分析判断。
D、根据溶液具有均一性,进行分析判断。
【解答】解:A、蒸发时,当蒸发皿中出现较多固体时,应停止加热,利用余热将剩余水分蒸干,故选项说法错误。
B、过滤要注意“一贴、二低、三靠”的原则,粗盐溶解后过滤时漏斗下端紧靠烧杯内壁,故选项说法正确。
C、用量筒量取水时,仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,使溶质质量分数偏小,故选项说法正确。
D、配制好的溶液装入试剂瓶时有液体溅出,溶液具有均一性,溶质的质量分数不变,故选项说法正确。
故选:A。
【点评】本题难度不大,了解粗盐提纯的原理、配制一定溶质质量分数的溶液主要实验步骤、实验步骤、注意事项等是正确解答本题的关键。
二.填空题(共8小题)
9.(2024春 朝阳区校级月考)除去粗盐中的难溶性杂质,需要进行如下操作。
(1)溶解:玻璃棒搅拌的作用是 搅拌,加快溶解速率 ;
(2)过滤:需要的玻璃仪器有玻璃棒、烧杯和 漏斗 ;
(3)蒸发:当观察到蒸发皿中 出现较多固体时 停止加热,利用余热蒸干。
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】(1)搅拌,加快溶解速率;
(2)漏斗;
(3)出现较多固体时。
【分析】(1)根据溶解操作中玻璃棒的作用,进行分析解答。
(2)过滤是把不溶于液体的固体与液体分离的一种方法,判断所需的仪器,进行分析解答。
(3)根据蒸发操作中停止加热的时机,进行分析解答。
【解答】解:(1)溶解操作中玻璃棒的作用是搅拌,加快溶解速率。
(2)过滤是把不溶于液体的固体与液体分离的一种方法,过滤操作的装置由铁架台、烧杯、玻璃棒、漏斗四种仪器组成,其中需要的玻璃仪器有玻璃棒、烧杯和漏斗。
(3)蒸发时,当蒸发皿中出现较多固体时,应停止加热,利用余热将剩余水分蒸干。
故答案为:
(1)搅拌,加快溶解速率;
(2)漏斗;
(3)出现较多固体时。
【点评】本题难度不大,了解粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、注意事项等是正确解答本题的关键。
10.(2024 郸城县四模)实验室除去粗盐水中难溶性杂质的主要实验步骤是 过滤 ;除去粗盐水中的CaCl2、MgCl2、Na2SO4杂质,可依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液,过滤出沉淀后向滤液中加入适量的 稀盐酸 ;其中加入NaOH溶液时发生反应的化学方程式为 MgCl2+2NaOH=Mg(OH)2↓+2NaCl 。
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】过滤;稀盐酸;MgCl2+2NaOH=Mg(OH)2↓+2NaCl。
【分析】根据分离混合物的方法、粗盐中可溶性杂质的去除方法、化学反应的原理来分析。
【解答】解:粗盐的主要成分是氯化钠,氯化钠易溶于水,泥沙难溶于水,粗盐提纯是通过溶解(把不溶物与氯化钠初步分离)、过滤(把不溶物彻底除去)、蒸发(氯化钠从溶液中分离出来)得到精盐的过程。氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,反应的化学方程式依次为BaCl2+Na2SO4═BaSO4↓+2NaCl、2NaOH+MgCl2=Mg(OH)2↓+2NaCl、CaCl2+Na2CO3═CaCO3↓+2NaCl、BaCl2+Na2CO3═BaCO3↓+2NaCl。分离出沉淀后溶液中含有碳酸钠、氢氧化钠和氯化钠,再加入适量稀盐酸除去反应剩余的氢氧根离子和碳酸根离子,即除去过量的氢氧化钠和碳酸钠。
故答案为:过滤;稀盐酸;MgCl2+2NaOH=Mg(OH)2↓+2NaCl。
【点评】本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
11.(2025春 金安区校级期中)明代《天工开物》中记录了用天然气煮盐的过程:“西川有火井(天然气),事奇甚。其井居然冷水,绝无火气,但以长竹剖开去节合缝漆布,一头插入井底,其上曲接,以口紧对釜脐,注卤水釜中。只见火意烘烘,水即沸腾。启竹而视之,绝无半点焦炎意。”
(1)在煮盐时天然气燃烧,从燃烧条件分析,曲竹未燃烧(如图)的原因是 温度没有达到曲竹的着火点 。
(2)粗盐(含(制NaCl时,除杂试剂为BaCl2溶液、NaOH溶液、盐酸、Na2CO3溶液,除杂时试剂的滴加顺序可依次为过量的NaOH溶液、 BaCl2溶液、Na2CO3溶液 。盐酸。加入盐酸发生的反应 Na2CO3+2HCl=2NaCl+H2O+CO2↑或NaOH+HCl=NaCl+H2O (与一个方程式),加热蒸发氯化钠溶液,用玻璃棒搅拌至 蒸发皿中出现较多固体 时停止加热。
(3)Na2CO3和NaCl是厨房中常用物质,溶解度曲线如图。下列说法正确的是 D 。
A.NaCl的溶解度受温度影响更大
B.10℃时,Na2CO3溶液中溶质与溶液的质量比为1:11
C.20℃时,不能配制浓度相同的Na2CO3和NaCl溶液
D.Na2CO3中含有少量NaCl,可溶于适量热水再降温结晶提纯
【考点】粗盐提纯中的试剂添加问题;燃烧与燃烧的条件;固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法.
【专题】化学与能源;溶液、浊液与溶解度;常见的盐 化学肥料.
【答案】(1)温度没有达到曲竹的着火点。
(2)BaCl2溶液、Na2CO3溶液;Na2CO3+2HCl=2NaCl+H2O+CO2↑或NaOH+HCl=NaCl+H2O;蒸发皿中出现较多固体;
(3)D。
【分析】(1)根据燃烧需要同时满足三个条件:可燃物、与氧气(或空气)接触、温度达到可燃物的着火点分析。
(2)加入过量的NaOH溶液除去Mg2+,加入过量的BaCl2溶液除去,然后加入过量的Na2CO3溶液除去Ca2+和过量的BaCl2溶液,最后加入盐酸除去过量的NaOH和Na2CO3;蒸发时蒸发皿中出现较多固体时停止加热;
(3)A、根据溶解度曲线分析。
B、根据溶解度含义分析。
C、根据溶质质量分数定义分析。
D、根据结晶方法分析。
【解答】解:(1)燃烧需要同时满足三个条件:可燃物、与氧气(或空气)接触、温度达到可燃物的着火点。曲竹是可燃物,也与氧气接触,未燃烧的原因是温度没有达到曲竹的着火点。故答案为:温度没有达到曲竹的着火点。
(2)除去粗盐中的Ca2+、Mg2+、,加入过量的NaOH溶液除去Mg2+,加入过量的BaCl2溶液除去,然后加入过量的Na2CO3溶液除去Ca2+和过量的BaCl2溶液,最后加入盐酸除去过量的NaOH和Na2CO3,所以除杂时试剂的滴加顺序可依次为过量的NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸。碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑;氢氧化钠和盐酸生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O。加热蒸发氯化钠溶液,用玻璃棒搅拌至蒸发皿中出现较多固体时停止加热,利用余热将水蒸干。故答案为:BaCl2溶液、Na2CO3溶液;Na2CO3+2HCl=2NaCl+H2O+CO2↑或NaOH+HCl=NaCl+H2O;蒸发皿中出现较多固体;
(3)A、由溶解度曲线可知,NaCl的溶解度受温度影响较小,故A错误。
B、10℃时,碳酸钠的溶解度为10g,此时饱和碳酸钠溶液中溶质与溶液的质量比为10g:(10g+100g)=1:11,但题目未说明是饱和溶液,故B错误。
C、20℃时,碳酸钠和氯化钠的溶解度不同,但可以配制溶质质量分数相同的不饱和溶液,故C错误。
D、碳酸钠的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,Na2CO3中含有少量NaCl,可溶于适量热水再降温结晶提纯碳酸钠,故D正确。
故选:D。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
12.(2024 东港区校级二模)在宏观、微观和符号之间建立联系是学习化学的重要思维方式。如图为氟、钠、氯、溴四种元素在元素周期表中的相关信息及溴原子的结构示意图,请回答下列问题。
(1)溴元素在元素周期表中位于第 四 周期。
(2)钠元素和溴元素组成化合物的化学式为 NaBr 。上述元素中,与溴元素的化学性质相似的有 F、Cl 。(填元素符号)
(3)氯和钠属于不同种元素,是因为它们的原子中 质子数 不同;它们可以组成物质氯化钠。
a.从微粒角度看:氯化钠是由 Na+、Cl﹣ 构成(用微粒符号表示)。
b.从制备角度看:将海水进行 蒸发结晶 (填操作方法)得到粗盐。除去粗盐中含有的、Ca2+、Mg2+等杂质,常加入过量的①Na2CO3溶液、②BaCl2溶液、③NaOH溶液,三种试剂的加入顺序为 ②③①或③②①或②①③ (填序号)。
(4)空气中的自由电子附着在氧分子上形成的负氧离子(),被称为“空气维生素”。日照国家森林公园获“中国森林氧吧”荣誉称号,负氧离子浓度高达4.75万个/立方厘米。一个所含电子总数是 17 个。
【考点】粗盐提纯中的试剂添加问题;分子、原子、离子、元素与物质之间的关系;原子和离子的相互转化;周期表信息示意图及结构示意图的综合考查.
【专题】物质的微观构成与物质的宏观组成;常见的盐 化学肥料.
【答案】(1)四;
(2)NaBr;F、Cl;
(3)质子数;
a.Na+、Cl﹣;b.蒸发结晶;②③①或③②①或②①③;
(4)17。
【分析】(1)根据周期数=原子核外电子层数,进行分析解答。
(2)根据化合价的数值等于离子所带电荷的数值,且符号一致,决定元素的化学性质是原子的最外层电子数,进行分析解答。
(3)根据质子数决定元素的种类,进行分析解答。
a.根据氯化钠是由钠离子和氯离子构成的,进行分析解答。
b.根据氯化钠的溶解度受温度的影响变化不大,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,进行分析解答。
(4)根据氧原子的核电荷数为8,核外电子数为8,进行分析解答。
【解答】解:(1)周期数=原子核外电子层数,溴元素的原子核外有4个电子层,溴元素在元素周期表中位于第四周期。
(2)钠原子最外层电子数为1,易失去1个电子而形成带1个单位正电荷的阳离子,化合价的数值等于离子所带电荷的数值,且符号一致,则钠元素的化合价为+1价;由溴原子的原子结构示意图可知,溴原子最外层电子数为7,易得到一个电子形成带1个单位负电荷的阴离子,溴元素的化合价为﹣1价,组成的化合物的化学式为NaBr;决定元素的化学性质是原子的最外层电子数,原子的最外层电子数相同,化学性质相似,溴原子的最外层电子数为7,则与其化学性质相似的粒子结构示意图中最外层电子数也应为7,氟原子、氯原子的最外层电子数是7,其元素符号分别是F、Cl。
(3)质子数决定元素的种类,钠元素与氯元素之间最本质的区别是质子数不同。
a.氯化钠是由钠离子和氯离子构成的,其离子符号为Na+、Cl﹣。
b.氯化钠的溶解度受温度的影响变化不大,从制备角度看:将海水进行蒸发结晶可得到粗盐;NaOH溶液除去镁离子,BaCl2溶液除去硫酸根离子,Na2CO3溶液为了除去钙离子以及过量的钡离子(碳酸钠溶液必须在氯化钡溶液之后),常加入过量的①Na2CO3溶液、②BaCl2溶液、③NaOH溶液,三种试剂的加入顺序为②③①或③②①或②①③。
(4)氧原子的核电荷数为8,核外电子数为8,,一个所含电子总数是2×8+1=17。
故答案为:
(1)四;
(2)NaBr;F、Cl;
(3)质子数;
a.Na+、Cl﹣;b.蒸发结晶;②③①或③②①或②①③;
(4)17。
【点评】本题难度不大,了解粗盐提纯中离子的除杂、元素周期表和原子结构示意图的含义等是正确解答本题的关键。
13.(2024 罗山县二模)南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发。正确的操作顺序是 acdbe (填字母)。加Na2CO3溶液的作用是除去 氯化钙和过量的氢氧化钡 ;
(2)海水“制碱”。氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl 。
【考点】粗盐提纯中的试剂添加问题;书写化学方程式、文字表达式、电离方程式.
【专题】常见的盐 化学肥料.
【答案】(1)acdbe;氯化钙和过量的氢氧化钡;
(2)NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl。
【分析】(1)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氢氧化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
(2)根据氨碱法制纯碱中生成NaHCO3和NH4Cl,氨气、氯化钠、水和二氧化碳反应生成碳酸氢钠和氯化铵,进行分析解答。
【解答】解:(1)氢氧化钡和硫酸镁反应生成硫酸钡沉淀和氢氧化镁沉淀,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠和过量的氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,稀盐酸和氢氧化钠反应生成氯化钠和水,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,正确的操作顺序是:加过量的Ba(OH)2溶液除去硫酸镁、加过量的Na2CO3溶液除去氯化钙和过量的氢氧化钡、过滤除去沉淀、加稍过量的盐酸除去过量的碳酸钠和反应生成的氢氧化钠、蒸发得到氯化钠,正确的操作顺序是acdbe。加Na2CO3溶液的作用是除去氯化钙和过量的氢氧化钡。
(2)氨碱法制纯碱是先通过化学反应生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3制得纯碱,氨气、氯化钠、水和二氧化碳反应生成碳酸氢钠和氯化铵,该反应化学方程式为NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl。
故答案为:
(1)acdbe;氯化钙和过量的氢氧化钡;
(2)NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl。
【点评】本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
14.(2024 天祝县三模)为了除去粗盐中的泥沙、Ca2+、Mg2+、等杂质,将粗盐溶于水,然后进行下列五步操作:
①过滤;
②加过量的氢氧化钠溶液;
③加适量盐酸;
④加过量的碳酸钠溶液;
⑤加过量的氯化钡溶液;正确的操作顺序是 ②⑤④①③或⑤②④①③或⑤④②①③ 。
【考点】粗盐提纯中的试剂添加问题.
【专题】常见的盐 化学肥料.
【答案】②⑤④①③或⑤②④①③或⑤④②①③。
【分析】根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
【解答】解:镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去过量的氯化钡;完全反应后,再进行过滤,最后再加入适量盐酸除去反应剩余的氢氧根离子和碳酸根离子,故除去粗盐中的泥沙、Ca2+、Mg2+、等杂质的正确的顺序为:②⑤④①③②⑤④①③或⑤②④①③或⑤④②①③。
故答案为:
②⑤④①③或⑤②④①③或⑤④②①③。
【点评】本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
15.(2024春 淮阳区校级月考)除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①加过量的NaOH溶液;②加过量的BaCl2溶液;③过滤;④加适量的盐酸;⑤加过量的Na2CO3溶液。
(1)以上操作合理的先后顺序为 ①②⑤③④或②①⑤③④或②⑤①③④ (数字序号不能重复使用)。
(2)加过量的Na2CO3溶液时反应的化学方程式为 CaCl2+Na2CO3═CaCO3↓+2NaCl、BaCl2+Na2CO3═BaCO3↓+2NaCl 。
(3)上述试剂中稀盐酸不能用稀硫酸代替,原因是 会生成新的杂质硫酸钠 。
【考点】粗盐提纯中的试剂添加问题.
【专题】常见的盐 化学肥料.
【答案】(1)①②⑤③④或②①⑤③④或②⑤①③④;
(2)CaCl2+Na2CO3═CaCO3↓+2NaCl、BaCl2+Na2CO3═BaCO3↓+2NaCl;
(3)会生成新的杂质硫酸钠。
【分析】根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
【解答】解:(1)镁离子与氢氧根离子形成氢氧化镁沉淀,硫酸根离子与钡离子形成硫酸钡沉淀,钙离子和钡离子均可用碳酸根离子沉淀,因为要完全除去各杂质离子,所加试剂都应该过量,而碳酸钠可以将过量的钡离子沉淀,则加碳酸钠要放在加氯化钡之后,盐酸可除去过量的碳酸钠和氢氧化钠,则过滤掉沉淀后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,所以合理的而先后顺序为①②⑤③④或②①⑤③④或②⑤①③④。
(2)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,反应的化学方程式分别为CaCl2+Na2CO3═CaCO3↓+2NaCl、BaCl2+Na2CO3═BaCO3↓+2NaCl。
(3)题干中用盐酸除去过量的碳酸钠和氢氧化钠,如果用稀硫酸代替稀盐酸,会产生硫酸钠,就引入了新的杂质。
故答案为:
(1)①②⑤③④或②①⑤③④或②⑤①③④;
(2)CaCl2+Na2CO3═CaCO3↓+2NaCl、BaCl2+Na2CO3═BaCO3↓+2NaCl;
(3)会生成新的杂质硫酸钠。
【点评】本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
16.(2024 平桥区三模)已知粗盐中含有泥沙、氯化钙和氯化镁等杂质。为制得纯净的氯化钠固体,某化学兴趣小组进行了如图操作:
(1)写出X溶液中溶质的化学式: NaOH或Ca(OH)2 。
(2)请设计实验证明溶液B中含有的杂质。(简要写出检验步骤和现象)
(3)最后制得氯化钠的质量大于粗盐中氯化钠的质量,写出一个可使氯化钠质量增加的化学方程式。
【考点】粗盐提纯的操作步骤.
【专题】常见的盐 化学肥料.
【答案】(1)NaOH或Ca(OH)2;
(2)取少量溶液B于试管中,加入过量的CaCl2溶液,产生白色沉淀,证明含有碳酸钠;静置,取上层清液,滴加酚酞溶液,溶液变红,说明溶液中含有氢氧化钠;
(3)2NaOH+MgCl2=Mg(OH)2↓+2NaCl(或CaCl2+Na2CO3=CaCO3↓+2NaCl或HCl+NaOH=NaCl+H2O或Na2CO3+2HCl=2NaCl+H2O+CO2↑)。
【分析】根据镁离子用氢氧根离子沉淀,钙离子用碳酸根离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
【解答】解:(1)镁离子用氢氧根离子沉淀,X溶液为氢氧化钠溶液或氢氧化钙溶液,用于除去氯化镁,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠或氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,氢氧化钠和氢氧化钙的化学式分别是NaOH、Ca(OH)2。
(2)加入过量的碳酸钠溶液除去氯化钙,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,若X为氢氧化钙,碳酸钠还用于除去过量的氢氧化钙,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,过滤后,溶液B中含有氯化钠、氢氧化钠、碳酸钠,溶液B中含有的杂质是氢氧化钠和碳酸钠,氢氧化钠和碳酸钠都显碱性,碳酸钠会干扰氢氧化钠的检验,应先检验碳酸钠并将其除去,再检验氢氧化钠,具体方案为:取少量溶液B于试管中,加入过量的CaCl2溶液,产生白色沉淀,证明含有碳酸钠,静置,取上层清液,滴加酚酞溶液,溶液变红,说明溶液中含有氢氧化钠。
(3)最后制得氯化钠的质量大于粗盐中氯化钠的质量,是因为氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,稀盐酸和氢氧化钠反应生成氯化钠和水,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,反应的化学方程式分别为2NaOH+MgCl2=Mg(OH)2↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl、HCl+NaOH=NaCl+H2O、Na2CO3+2HCl=2NaCl+H2O+CO2↑。
故答案为:
(1)NaOH或Ca(OH)2;
(2)取少量溶液B于试管中,加入过量的CaCl2溶液,产生白色沉淀,证明含有碳酸钠;静置,取上层清液,滴加酚酞溶液,溶液变红,说明溶液中含有氢氧化钠;
(3)2NaOH+MgCl2=Mg(OH)2↓+2NaCl(或CaCl2+Na2CO3=CaCO3↓+2NaCl或HCl+NaOH=NaCl+H2O或Na2CO3+2HCl=2NaCl+H2O+CO2↑)。
【点评】本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
