【中考押题预测】2025年中考化学人教版(2024)核心考点考前冲刺 计算题(含解析)
文档属性
| 名称 | 【中考押题预测】2025年中考化学人教版(2024)核心考点考前冲刺 计算题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 290.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-16 23:52:34 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
中考核心考点 计算题
一.计算题(共17小题)
1.(2024 南京模拟)铁矿石冶炼成铁是一个复杂的过程。
(1)高炉炼铁的原料是铁矿石、 、石灰石、空气。
(2)高炉炼铁得到生铁。生铁的硬度 纯铁的硬度(填“>”或“<”,下同);生铁的含碳量 钢的含碳量。
(3)用500t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
(利用化学方程式进行计算,写出计算过程,计算结果保留一位小数)
2.(2022 南浔区模拟)草木灰(主要成分为K2CO3)是一种常见的肥料。烧制草木灰是我国传统农耕方式,但会造成一定的环境污染。为护卫蓝天白云,我市明令禁止露天烧制草木灰。
(1)从化学肥料分类角度分析,草木灰属于 (填“氮肥”、“磷肥”或“钾肥”)
(2)碳酸钾中钾元素的质量分数为(结果保留一位小数) 。
(3)在农业中,若将熟石灰粉与草木灰(主要成分是K2CO3)按一定比例混合物制得高效环保农药“黑白粉”。写出混合物制“黑白粉”的化学方程式 。
3.(2025 武威一模)某化工有限公司生产的硫酸铜溶液的标签示意图如图,根据标签计算:
(1)这瓶硫酸铜溶液中溶剂的质量是 ;
(2)现需要配制2400g溶质质量分数为12%的硫酸铜溶液,需要溶质质量分数为20%的硫酸铜溶液多少毫升?
4.(2024秋 岱岳区期末)分别对200g溶质质量分数为5%的硝酸钾溶液进行如下操作:
(1)将该溶液蒸发掉 g水,在无固体析出的情况下,溶液中溶质质量分数变为20%。
(2)向该溶液中加入 g水,稀释为2%的硝酸钾溶液。
5.(2024 朝阳区校级模拟)如图是某补钙药物包装袋上的部分说明,根据标回答下列问题。
作用:本品为维生素与矿物质类非处方药药品 规格:每片质量为2克,含维生素D,2.5微克,碳酸钙0.75g 成分:碳酸钙、维生素D3、山梨醇、硬脂酸镁等; 用法用量:儿童:一次1片,一日一次; 成人:一次2片,一日一次。 贮藏:密封干燥处保存。 包装:每瓶60片。
(1)碳酸钙的化学式为 ;
(2)钙元素可以预防幼儿及青少年患 和发育不良。
A.佝偻病
B.甲状腺肿大
C.夜盲症
(3)碳酸钙中钙元素与氧元素质量比为 ;
(4)每片药品中含有钙元素的质量分数为 ;
(5)计算完全反应完每片钙片中的碳酸钙需要消耗胃液中含有 gHCl的盐酸(保留小数点后一位数字)。
6.(2025 琼山区模拟)在农业生产上,常用质量分数为16%的氯化钠溶液选种。现要配制该氯化钠溶液50kg,需要氯化钠固体的质量为多少。(直接写出答案)
7.(2022 长兴县模拟)安吉白茶富含人体所需18种氨基酸,其中茶氨酸(C7H14N2O3)能增强血液免疫细胞干扰素分泌量、保护神经细胞、提高人体的抵抗力、记忆力、降低血压、减肥等功效。
(1)氨基酸主要用于合成人体必需的营养物质 。
(2)从上述信息可以看出,茶氨酸主要对人体的血液循环系统和 系统产生影响。
(3)348毫克茶氨酸与多少毫克尿素CO(NH2)2)中的氮元素质量相等?
8.(2023 获嘉县二模)如图是某试剂瓶标签上的部分内容。
(1)要把100g该试剂稀释为20%的硫酸,需要水的质量是多少?(写出计算的过程)
(2)写出测定稀释后溶液酸碱性的方法 。
9.(2025春 海口校级月考)葡萄糖(化学式为C6H12O6)能为人体组织提供营养。某葡萄糖注射液的标签如图所示,请计算:
(1)该瓶葡萄糖注射液中含葡萄糖的质量为 g。
(2)要把20g这种葡萄糖溶液稀释为溶质质量分数为2%的溶液,所加水的质量为多少?(写出计算过程)
10.(2023秋 定边县校级期末)实验室中盛装还未使用的浓硫酸试剂瓶上的标签如表所示,根据有关信息计算:
硫酸 化学纯(CP) (500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98%
(1)从该试剂瓶中取出50g浓硫酸,取出溶液中的溶质质量分数是 。
(2)要把50g该浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是多少?
11.(2023 庆云县二模)为测定某胃药中碳酸氢钠的含量,向一锥形瓶中加入10g该胃药,再加入100g一定质量分数的稀盐酸,恰好完全反应,气体全部逸出,反应后锥形瓶内物质的总质量为105.6g(胃药中的其他成分不参与反应,不考虑稀盐酸挥发)。请计算:
(1)反应结束共产生气体的质量是 g。
(2)该胃药中碳酸氢钠的质量分数(写出计算过程)。
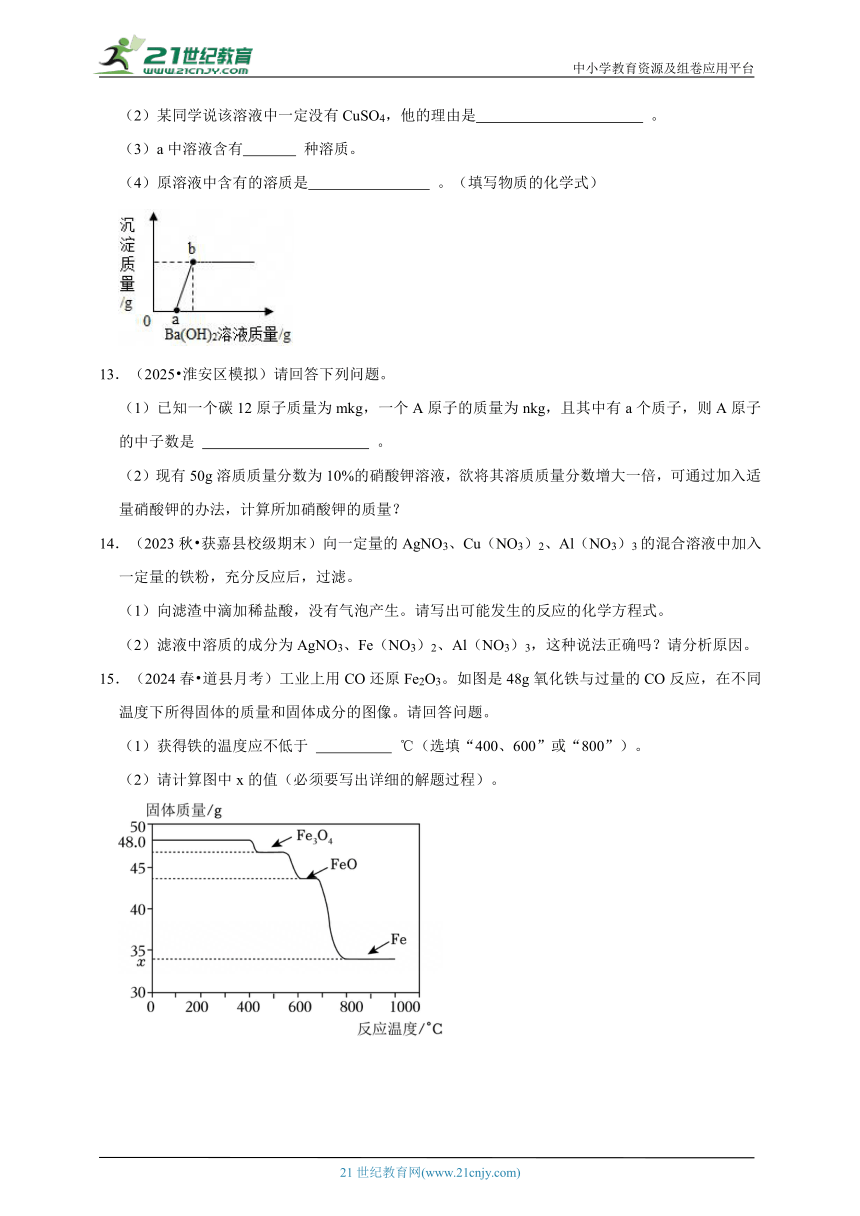
12.(2020 富阳区一模)某溶液可能含CuSO4、HCl、MgCl2、Na2CO3中的几种,向其中加入一定溶质质量分数的Ba(OH)2溶液,反应中加入的Ba(OH)2溶液质量与产生沉淀的质量关系如图,回答下列问题。
(1)ab段生成的沉淀是: (填写物质的化学式)。
(2)某同学说该溶液中一定没有CuSO4,他的理由是 。
(3)a中溶液含有 种溶质。
(4)原溶液中含有的溶质是 。(填写物质的化学式)
13.(2025 淮安区模拟)请回答下列问题。
(1)已知一个碳12原子质量为mkg,一个A原子的质量为nkg,且其中有a个质子,则A原子的中子数是 。
(2)现有50g溶质质量分数为10%的硝酸钾溶液,欲将其溶质质量分数增大一倍,可通过加入适量硝酸钾的办法,计算所加硝酸钾的质量?
14.(2023秋 获嘉县校级期末)向一定量的AgNO3、Cu(NO3)2、Al(NO3)3的混合溶液中加入一定量的铁粉,充分反应后,过滤。
(1)向滤渣中滴加稀盐酸,没有气泡产生。请写出可能发生的反应的化学方程式。
(2)滤液中溶质的成分为AgNO3、Fe(NO3)2、Al(NO3)3,这种说法正确吗?请分析原因。
15.(2024春 道县月考)工业上用CO还原Fe2O3。如图是48g氧化铁与过量的CO反应,在不同温度下所得固体的质量和固体成分的图像。请回答问题。
(1)获得铁的温度应不低于 ℃(选填“400、600”或“800”)。
(2)请计算图中x的值(必须要写出详细的解题过程)。
16.(2023 娄底三模)工业上可采用某铁矿石(主要成分四氧化三铁)冶炼铁,反应原理为:Fe3O4+4CO3Fe+4CO2,若现用100t含四氧化三铁为46.4%的该矿石冶炼金属铁。
请计算:
(1)该铁矿石中含四氧化三铁的质量是 。
(2)理论上可炼出含铁96%的生铁的质量是多少?
17.(2023秋 高州市校级期中)连花清瘟胶囊具有清瘟解毒、宣肺泄热的功效,能够治疗热毒袭肺引起的流感等病症,它的主要成分有金银花等。金银花中含有棕榈酸(化学式为C16H32O2)等成分。
(1)在棕榈酸(C16H32O2)中,碳元素与氧元素的质量比为 。
(2)计算256g棕榈酸(C16H32O2)中含氧元素的质量与多少克CO2中含氧元素的质量相等?(写出计算过程)
中考核心考点 计算题
参考答案与试题解析
一.计算题(共17小题)
1.(2024 南京模拟)铁矿石冶炼成铁是一个复杂的过程。
(1)高炉炼铁的原料是铁矿石、 焦炭 、石灰石、空气。
(2)高炉炼铁得到生铁。生铁的硬度 > 纯铁的硬度(填“>”或“<”,下同);生铁的含碳量 > 钢的含碳量。
(3)用500t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
(利用化学方程式进行计算,写出计算过程,计算结果保留一位小数)
【考点】金属冶炼的计算;含杂质的化学方程式计算;生铁和钢.
【专题】金属与金属材料.
【答案】(1)焦炭;
(2)>;>;
(3)291.7t。
【分析】(1)根据高炉炼铁的原料进行分析;
(2)根据合金的性质,生铁和钢的含碳量进行分析;
(3)根据氧化铁与一氧化碳高温下反应的方程式中有关物质的质量关系列式进行计算。
【解答】解:(1)高炉炼铁的原料是铁矿石、焦炭、石灰石、空气;
(2)高炉炼铁得到生铁,生铁为铁碳合金,合金的硬度大于各成分的硬度,因此生铁的硬度>纯铁的硬度;生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%,因此生铁的含碳量>钢的含碳量;
(3)设理论上可以炼出含铁96%的生铁的质量是x
Fe2O3+3CO2Fe+3CO2
160 112
500t×80% 96%x
,解得x≈291.7t;
答:理论上可以炼出含铁96%的生铁的质量是291.7t;
故答案为:
(1)焦炭;
(2)>;>;
(3)291.7t。
【点评】本题考查了铁的冶炼、生铁和钢区别,含有杂质物质的化学反应的有关计算等相关知识,掌握学科基础知识即可解答。
2.(2022 南浔区模拟)草木灰(主要成分为K2CO3)是一种常见的肥料。烧制草木灰是我国传统农耕方式,但会造成一定的环境污染。为护卫蓝天白云,我市明令禁止露天烧制草木灰。
(1)从化学肥料分类角度分析,草木灰属于 钾肥 (填“氮肥”、“磷肥”或“钾肥”)
(2)碳酸钾中钾元素的质量分数为(结果保留一位小数) 56.5% 。
(3)在农业中,若将熟石灰粉与草木灰(主要成分是K2CO3)按一定比例混合物制得高效环保农药“黑白粉”。写出混合物制“黑白粉”的化学方程式 Ca(OH)2+K2CO3=CaCO3↓2KOH 。
【考点】常见化肥的种类和作用;元素的质量分数计算;书写化学方程式、文字表达式、电离方程式.
【专题】常见的盐 化学肥料.
【答案】(1)钾肥;
(2)56.5%;
(3)Ca(OH)2+K2CO3=CaCO3↓2KOH。
【分析】(1)根据化肥的定义解答;
(2)根据某元素的质量分数的计算公式解答;
(3)根据氢氧化钙与碳酸钾反应的化学方程式解答。
【解答】解:(1)碳酸钾中只含氮、磷、钾三种元素中的钾元素,属于钾肥;
(2)碳酸钾中钾元素的质量分数为100%≈56.5%;
(3)熟石灰粉与草木灰混合制“黑白粉”,即氢氧化钙与碳酸钾反应,故化学方程式是Ca(OH)2+K2CO3=CaCO3↓2KOH;
故答案为:(1)钾肥;
(2)56.5%;
(3)Ca(OH)2+K2CO3=CaCO3↓2KOH。
【点评】本题难度系数中等,考查学生多方面的知识,掌握基础是解答本题的关键。
3.(2025 武威一模)某化工有限公司生产的硫酸铜溶液的标签示意图如图,根据标签计算:
(1)这瓶硫酸铜溶液中溶剂的质量是 192g ;
(2)现需要配制2400g溶质质量分数为12%的硫酸铜溶液,需要溶质质量分数为20%的硫酸铜溶液多少毫升?
【考点】用水稀释改变浓度的方法;有关溶质质量分数的简单计算.
【专题】溶液的组成及溶质质量分数的计算.
【答案】(1)192g;
(2)1200mL。
【分析】(1)根据溶液的体积和密度溶质的质量分数的计算公式分析计算;
(2)根据溶质质量不变原理分析计算。
【解答】解:(1)这瓶硫酸铜溶液中溶剂的质量是:200mL×1.2g/mL﹣(200mL×1.2g/mL)×20%=192g;
(2)设需要溶质质量分数为20%的硫酸铜溶液体积是x。
x×1.2g/mL×20%=2400g×12%
解得:x=1200mL
答:需要溶质质量分数为20%的硫酸铜溶液1200mL。
故答案为:(1)192g;
(2)1200mL。
【点评】本题难度不大,掌握溶液稀释前后溶质的质量不变、溶质质量=溶液质量×溶质的质量分数等是正确解答本题的关键。
4.(2024秋 岱岳区期末)分别对200g溶质质量分数为5%的硝酸钾溶液进行如下操作:
(1)将该溶液蒸发掉 150 g水,在无固体析出的情况下,溶液中溶质质量分数变为20%。
(2)向该溶液中加入 300 g水,稀释为2%的硝酸钾溶液。
【考点】用水稀释改变浓度的方法;有关溶质质量分数的简单计算.
【专题】溶液的组成及溶质质量分数的计算.
【答案】(1)150;
(2)300。
【分析】根据溶质质量分数的概念分析。
【解答】解:(1)将该溶液蒸发水的质量为:200g﹣(200g×5%÷20%)=150g;
(2)向该溶液中加入水的质量为:200g×5%÷2%﹣200g=300g。
故答案为:(1)150g;
(2)300g。
【点评】本题考查溶液质量分数的计算,难度不大。
5.(2024 朝阳区校级模拟)如图是某补钙药物包装袋上的部分说明,根据标回答下列问题。
作用:本品为维生素与矿物质类非处方药药品 规格:每片质量为2克,含维生素D,2.5微克,碳酸钙0.75g 成分:碳酸钙、维生素D3、山梨醇、硬脂酸镁等; 用法用量:儿童:一次1片,一日一次; 成人:一次2片,一日一次。 贮藏:密封干燥处保存。 包装:每瓶60片。
(1)碳酸钙的化学式为 CaCO3 ;
(2)钙元素可以预防幼儿及青少年患 A 和发育不良。
A.佝偻病
B.甲状腺肿大
C.夜盲症
(3)碳酸钙中钙元素与氧元素质量比为 5:6 ;
(4)每片药品中含有钙元素的质量分数为 15% ;
(5)计算完全反应完每片钙片中的碳酸钙需要消耗胃液中含有 0.5 gHCl的盐酸(保留小数点后一位数字)。
【考点】人体内的常量元素;化学式的书写及意义;元素质量比的计算;元素的质量分数计算;不含杂质的化学方程式计算.
【专题】化学与生活.
【答案】(1)CaCO3;
(2)A;
(3)5:6;
(4)15%;
(5)0.5。
【分析】根据已有的物质的化学式,结合根据化学式的相关计算,元素与人体健康关系等进行分析解答即可。
【解答】解:(1)碳酸钙的化学式为CaCO3;
(2)幼儿及青少年缺钙容易患佝偻病,故选:A;
(3)碳酸钙中钙元素与氧元素质量比为:40:(16×3)=5:6;
(4)碳酸钙中钙元素的质量=0.75g100%=0.3g;
每片药品中含有钙元素的质量分数为15%
(5)解:设消耗HCl的质量为x。
x=0.5g。
答:完全反应元每片钙片中的碳酸钙消耗胃液中HCl的质量为0.5g。
故答案为:(1)CaCO3;
(2)A;
(3)5:6;
(4)15%;
(5)0.5。
【点评】本题难度较小,解答关键是了解化学式的书写,结合根据化学式的相关计算,元素与人体健康关系等。
6.(2025 琼山区模拟)在农业生产上,常用质量分数为16%的氯化钠溶液选种。现要配制该氯化钠溶液50kg,需要氯化钠固体的质量为多少。(直接写出答案)
【考点】有关溶质质量分数的简单计算.
【专题】溶液的组成及溶质质量分数的计算.
【答案】8kg。
【分析】根据溶质质量=溶液质量×溶质的质量分数,进行分析解答。
【解答】解:配制16%的氯化钠溶液50kg,需要氯化钠固体的质量为50kg×16%=8kg。
故答案为:8kg。
【点评】本题难度不大,了解溶质质量=溶液质量×溶质的质量分数是正确解答本题的关键。
7.(2022 长兴县模拟)安吉白茶富含人体所需18种氨基酸,其中茶氨酸(C7H14N2O3)能增强血液免疫细胞干扰素分泌量、保护神经细胞、提高人体的抵抗力、记忆力、降低血压、减肥等功效。
(1)氨基酸主要用于合成人体必需的营养物质 蛋白质 。
(2)从上述信息可以看出,茶氨酸主要对人体的血液循环系统和 免疫 系统产生影响。
(3)348毫克茶氨酸与多少毫克尿素CO(NH2)2)中的氮元素质量相等?
【考点】蛋白质;化合物中某元素的质量计算.
【专题】化学式的计算;化学与生活.
【答案】(1)蛋白质;
(2)免疫;
(3)120g。
【分析】(1)根据蛋白质在人体中的代谢进行分析;
(2)根据题目信息进行分析;
(3)根据化学式中元素质量的计算方法进行计算。
【解答】解:(1)氨基酸在人体中主要用于合成蛋白质,故答案为:蛋白质;
(2)根据题目信息可知茶氨酸能增强血液免疫细胞干扰素分泌量、保护神经细胞、提高人体的抵抗力、记忆力、降低血压、减肥等功效,因此茶氨酸主要对人体的血液循环系统和免疫系统产生影响,故答案为:免疫;
(3)348g茶氨酸中氮元素的质量为348g100%=56g,则尿素的质量为56g100%=120g,故答案为:120g。
【点评】此题难度不大,考查人体中的六大营养素和有关化学式的计算,注重基础。
8.(2023 获嘉县二模)如图是某试剂瓶标签上的部分内容。
(1)要把100g该试剂稀释为20%的硫酸,需要水的质量是多少?(写出计算的过程)
(2)写出测定稀释后溶液酸碱性的方法 取少量溶液于试管中,滴加紫色石蕊溶液,溶液变红,说明溶液呈酸性(合理即可) 。
【考点】溶液的酸碱性测定;用水稀释改变浓度的方法.
【专题】溶液的组成及溶质质量分数的计算;常见的酸 酸的通性.
【答案】(1)390g;
(2)取少量溶液于试管中,滴加紫色石蕊溶液,溶液变红,说明溶液呈酸性(合理即可)。
【分析】(1)根据溶液稀释前后溶质的质量不变,进行分析解答。
(2)根据测定溶液酸碱性的方法,进行分析解答。
【解答】解:(1)设要加水的质量为x,根据溶液稀释前后溶质的质量不变,则100g×98%=(100g+x)×20%,x=390g。
答:需要水的质量是390g。
(2)稀释后稀硫酸显酸性,测定稀释后溶液酸碱性的方法是取少量溶液于试管中,滴加紫色石蕊溶液,溶液变红,说明溶液呈酸性(合理即可)。
故答案为:
(1)390g;
(2)取少量溶液于试管中,滴加紫色石蕊溶液,溶液变红,说明溶液呈酸性(合理即可)。
【点评】本题难度不大,了解测定溶液酸碱性的方法、溶液稀释前后溶质的质量不变等是正确解答本题的关键。
9.(2025春 海口校级月考)葡萄糖(化学式为C6H12O6)能为人体组织提供营养。某葡萄糖注射液的标签如图所示,请计算:
(1)该瓶葡萄糖注射液中含葡萄糖的质量为 25 g。
(2)要把20g这种葡萄糖溶液稀释为溶质质量分数为2%的溶液,所加水的质量为多少?(写出计算过程)
【考点】用水稀释改变浓度的方法;有关溶质质量分数的简单计算.
【专题】溶液的组成及溶质质量分数的计算.
【答案】(1)25;
(2)30g。
【分析】(1)根据溶质质量=溶液质量×溶质的质量分数,进行分析解答。
(2)根据溶液稀释前后溶质质量不变,进行分析解答。
【解答】解:(1)该瓶葡萄糖注射液的规格为500mL,溶质质量分数为5%,密度为1g/mL,则该瓶葡萄糖注射液中含葡萄糖的质量为1g/mL×500mL×5%=25g。
故答案为:25。
(2)根据溶液稀释前后溶质质量不变,设加入水质量为x,则20g×5%=(20g+x)×2%,x=30g。
答:所加水的质量为30g。
【点评】本题难度不大,了解溶液稀释前后溶质质量不变、溶质质量=溶液质量×溶质的质量分数是正确解答本题的关键。
10.(2023秋 定边县校级期末)实验室中盛装还未使用的浓硫酸试剂瓶上的标签如表所示,根据有关信息计算:
硫酸 化学纯(CP) (500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98%
(1)从该试剂瓶中取出50g浓硫酸,取出溶液中的溶质质量分数是 98% 。
(2)要把50g该浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是多少?
【考点】用水稀释改变浓度的方法;有关溶质质量分数的简单计算.
【专题】溶液的组成及溶质质量分数的计算.
【答案】(1)98%;
(2)440g。
【分析】(1)根据溶液具有均一性,进行分析解答。
(2)根据溶液稀释前后溶质的质量不变,进行分析解答。
【解答】解:(1)从该试剂瓶中取出50g浓硫酸,取出溶液中的溶质质量分数是98%。
故答案为:98%。
(2)设需要水的质量为x,根据溶液稀释前后溶质的质量不变,
50g×98%=(50g+x)×10% x=440g
答:需要水的质量是440g。
【点评】本题难度不大,明确溶液稀释前后溶质的质量不变、溶液具有均一性是正确解答本题的关键所在。
11.(2023 庆云县二模)为测定某胃药中碳酸氢钠的含量,向一锥形瓶中加入10g该胃药,再加入100g一定质量分数的稀盐酸,恰好完全反应,气体全部逸出,反应后锥形瓶内物质的总质量为105.6g(胃药中的其他成分不参与反应,不考虑稀盐酸挥发)。请计算:
(1)反应结束共产生气体的质量是 4.4 g。
(2)该胃药中碳酸氢钠的质量分数(写出计算过程)。
【考点】根据化学反应方程式的计算.
【专题】有关化学方程式的计算.
【答案】(1)4.4。
(2)84%。
【分析】碳酸氢钠和稀盐酸反应生成氯化钠、水和二氧化碳,根据反应的化学方程式及其提供数据可以进行相关方面的计算和判断。
【解答】解:(1)反应结束共产生气体的质量是10g+100g﹣105.6g=4.4g。
故答案为:4.4。
(2)设该胃药中碳酸氢钠的质量分数是x。
NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
10gx 4.4g
x=84%
答:该胃药中碳酸氢钠的质量分数是84%。
【点评】本题主要考查学生进行计算和推断的能力,计算时要注意规范性和准确性。
12.(2020 富阳区一模)某溶液可能含CuSO4、HCl、MgCl2、Na2CO3中的几种,向其中加入一定溶质质量分数的Ba(OH)2溶液,反应中加入的Ba(OH)2溶液质量与产生沉淀的质量关系如图,回答下列问题。
(1)ab段生成的沉淀是: Mg(OH)2 (填写物质的化学式)。
(2)某同学说该溶液中一定没有CuSO4,他的理由是 硫酸铜能与氢氧化钡反应生成了硫酸钡,图象中开始没有沉淀生成 。
(3)a中溶液含有 2 种溶质。
(4)原溶液中含有的溶质是 HCl、MgCl2 。(填写物质的化学式)
【考点】盐的化学性质;碱的通性.
【专题】常见的碱 碱的通性;常见的盐 化学肥料.
【答案】见试题解答内容
【分析】此题为混合物质组成推断题,根据物质的性质进行分析,碳酸钠与盐酸不能共存,氢氧化钡能与硫酸铜反应生成不溶于水和酸的硫酸钡沉淀,由图象可以看出,刚开始无沉淀产生,则溶液中一定含有盐酸,有盐酸则不含有碳酸钠,过一段时间产生沉淀说明溶液中含有氯化镁,则不含有硫酸铜,一定含有盐酸和氯化镁。
【解答】解:由物质的性质进行分析可知,碳酸钠与盐酸不能共存,氢氧化钡能与硫酸铜反应生成不溶于水和酸的硫酸钡沉淀;由图象可以看出,刚开始无沉淀产生,则说明了溶液中一定含有盐酸,有盐酸则不含有碳酸钠,过一段时间产生沉淀说明溶液中含有氯化镁,则不含有硫酸铜,一定含有盐酸和氯化镁。由此可知:
(1)ab段生成的沉淀是氢氧化镁沉淀,化学式是:Mg(OH)2。
(2)某同学说该溶液中一定没有CuSO4,他的理由是硫酸铜能与氢氧化钡反应生成了硫酸钡,图象中开始没有沉淀生成。
(3)由图象可知,a点时,氢氧化钡和稀盐酸恰好反应,溶液含中生成的BaCl2与没有反应的MgCl2两种溶质组成。
(4)由上述分析可知,原溶液中含有的溶质是HCl、MgCl2
故答案为:(1)Mg(OH)2;(2)硫酸铜能与氢氧化钡反应生成了硫酸钡,图象中开始没有沉淀生成。(3)2;(4)HCl、MgCl2。
【点评】本题考查了常见混合物组成的推断题,可以依据物质的性质以及物质间的反应进行解答。
13.(2025 淮安区模拟)请回答下列问题。
(1)已知一个碳12原子质量为mkg,一个A原子的质量为nkg,且其中有a个质子,则A原子的中子数是 。
(2)现有50g溶质质量分数为10%的硝酸钾溶液,欲将其溶质质量分数增大一倍,可通过加入适量硝酸钾的办法,计算所加硝酸钾的质量?
【考点】有关溶质质量分数的简单计算;相对原子质量的概念及其计算方法.
【专题】溶液的组成及溶质质量分数的计算;物质的微观构成与物质的宏观组成.
【答案】(1);
(2)6.25g。
【分析】(1)利用相对原子质量是以一个碳﹣12原子(核内有6个质子、6个中子)质量的作为标准,任何一个原子的真实质量跟一个碳﹣12原子质量的的比值,称为该原子的相对原子质量这一概念解决此题;
(2)根据混合前后溶质的质量不变分析,进行分析解答。
【解答】解:(1)原子的相对原子质量,因为相对原子质量=质子数+中子数,故该原子的中子数;
(2)设所加硝酸钾的质量为x,
(50g+x)×20%=50g×10%+x
解得x=6.25g
故答案为:
(1);
(2)6.25g。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
14.(2023秋 获嘉县校级期末)向一定量的AgNO3、Cu(NO3)2、Al(NO3)3的混合溶液中加入一定量的铁粉,充分反应后,过滤。
(1)向滤渣中滴加稀盐酸,没有气泡产生。请写出可能发生的反应的化学方程式。
(2)滤液中溶质的成分为AgNO3、Fe(NO3)2、Al(NO3)3,这种说法正确吗?请分析原因。
【考点】金属与盐溶液反应的原理.
【专题】金属与金属材料.
【答案】(1)Fe+Cu(NO3)2=Fe(NO3)2+Cu。
(2)不正确。溶液中有AgNO3,则一定有Cu(NO3)2。
【分析】金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来,并且金属越活泼,越容易先和盐溶液反应。
【解答】解:向一定量的AgNO3、Cu(NO3)2、Al(NO3)3的混合溶液中加入一定量的铁粉,铁不能和硝酸铝反应,先和硝酸银反应生成硝酸亚铁和银,后和硝酸铜反应生成硝酸亚铁和铜。
(1)向滤渣中滴加稀盐酸,没有气泡产生,说明滤渣中不含有铁,铁一定和硝酸银反应,可能发生的反应的化学方程式是 Fe+Cu(NO3)2=Fe(NO3)2+Cu。
(2)滤液中溶质的成分为AgNO3、Fe(NO3)2、Al(NO3)3,这种说法不正确,是因为如果溶液中有AgNO3,则一定有Cu(NO3)2。
故答案为:(1)Fe+Cu(NO3)2=Fe(NO3)2+Cu。
(2)不正确。溶液中有AgNO3,则一定有Cu(NO3)2。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
15.(2024春 道县月考)工业上用CO还原Fe2O3。如图是48g氧化铁与过量的CO反应,在不同温度下所得固体的质量和固体成分的图像。请回答问题。
(1)获得铁的温度应不低于 800 ℃(选填“400、600”或“800”)。
(2)请计算图中x的值(必须要写出详细的解题过程)。
【考点】金属冶炼的计算;一氧化碳还原氧化铁.
【专题】金属与金属材料.
【答案】(1)800;
(2)33.6。
【分析】(1)根据图示信息进行分析;
(2)根据反应前后铁元素的质量守恒进行分析。
【解答】解:(1)根据图示可知,温度大于等于800℃时,生成的固体只有铁,则用CO炼铁时,获得铁的温度应不低于800℃;
(2)由图可知,最初氧化铁固体质量为48.0g,其中的铁元素全部转化到铁单质中,则铁的质量为33.6g,则x=33.6g。
故答案为:
(1)800;
(2)33.6。
【点评】读懂图示信息,利用好质量守恒定律等相关知识是解答本题的关键。
16.(2023 娄底三模)工业上可采用某铁矿石(主要成分四氧化三铁)冶炼铁,反应原理为:Fe3O4+4CO3Fe+4CO2,若现用100t含四氧化三铁为46.4%的该矿石冶炼金属铁。
请计算:
(1)该铁矿石中含四氧化三铁的质量是 46.4t 。
(2)理论上可炼出含铁96%的生铁的质量是多少?
【考点】含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】(1)46.4t。
(2)35t。
【分析】根据反应的化学方程式及其提供数据可以进行相关方面的计算和判断。
【解答】解:(1)该铁矿石中含四氧化三铁的质量是100t×46.4%=46.4t。
故答案为:46.4t。
(2)设理论上可炼出含铁96%的生铁的质量是x。
Fe3O4+4CO3Fe+4CO2,
232 168
46.4t x×96%
x=35t
答:理论上可炼出含铁96%的生铁的质量是35t。
【点评】本题主要考查学生进行计算和推断的能力,计算时要注意规范性和准确性。
17.(2023秋 高州市校级期中)连花清瘟胶囊具有清瘟解毒、宣肺泄热的功效,能够治疗热毒袭肺引起的流感等病症,它的主要成分有金银花等。金银花中含有棕榈酸(化学式为C16H32O2)等成分。
(1)在棕榈酸(C16H32O2)中,碳元素与氧元素的质量比为 6:1 。
(2)计算256g棕榈酸(C16H32O2)中含氧元素的质量与多少克CO2中含氧元素的质量相等?(写出计算过程)
【考点】化合物中某元素的质量计算;元素质量比的计算.
【专题】化学式的计算.
【答案】(1)6:1;
(2)44g。
【分析】(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比进行计算;
(2)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
【解答】解:(1)由化学式可知,棕榈酸中含有碳、氢、氧三种元素组成;其中碳元素与氧元素的质量比为(12×16):(16×2)=6:1;
(2)设二氧化碳的质量为x。
x=44g。
答:二氧化碳的质量为44g。
故答案为:
(1)6:1;
(2)44g。
【点评】本题主要考查了化合物中某元素的质量计算以及元素质量比的计算,理解化学式的含义并掌握计算方法为解答该题的关键。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
中考核心考点 计算题
一.计算题(共17小题)
1.(2024 南京模拟)铁矿石冶炼成铁是一个复杂的过程。
(1)高炉炼铁的原料是铁矿石、 、石灰石、空气。
(2)高炉炼铁得到生铁。生铁的硬度 纯铁的硬度(填“>”或“<”,下同);生铁的含碳量 钢的含碳量。
(3)用500t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
(利用化学方程式进行计算,写出计算过程,计算结果保留一位小数)
2.(2022 南浔区模拟)草木灰(主要成分为K2CO3)是一种常见的肥料。烧制草木灰是我国传统农耕方式,但会造成一定的环境污染。为护卫蓝天白云,我市明令禁止露天烧制草木灰。
(1)从化学肥料分类角度分析,草木灰属于 (填“氮肥”、“磷肥”或“钾肥”)
(2)碳酸钾中钾元素的质量分数为(结果保留一位小数) 。
(3)在农业中,若将熟石灰粉与草木灰(主要成分是K2CO3)按一定比例混合物制得高效环保农药“黑白粉”。写出混合物制“黑白粉”的化学方程式 。
3.(2025 武威一模)某化工有限公司生产的硫酸铜溶液的标签示意图如图,根据标签计算:
(1)这瓶硫酸铜溶液中溶剂的质量是 ;
(2)现需要配制2400g溶质质量分数为12%的硫酸铜溶液,需要溶质质量分数为20%的硫酸铜溶液多少毫升?
4.(2024秋 岱岳区期末)分别对200g溶质质量分数为5%的硝酸钾溶液进行如下操作:
(1)将该溶液蒸发掉 g水,在无固体析出的情况下,溶液中溶质质量分数变为20%。
(2)向该溶液中加入 g水,稀释为2%的硝酸钾溶液。
5.(2024 朝阳区校级模拟)如图是某补钙药物包装袋上的部分说明,根据标回答下列问题。
作用:本品为维生素与矿物质类非处方药药品 规格:每片质量为2克,含维生素D,2.5微克,碳酸钙0.75g 成分:碳酸钙、维生素D3、山梨醇、硬脂酸镁等; 用法用量:儿童:一次1片,一日一次; 成人:一次2片,一日一次。 贮藏:密封干燥处保存。 包装:每瓶60片。
(1)碳酸钙的化学式为 ;
(2)钙元素可以预防幼儿及青少年患 和发育不良。
A.佝偻病
B.甲状腺肿大
C.夜盲症
(3)碳酸钙中钙元素与氧元素质量比为 ;
(4)每片药品中含有钙元素的质量分数为 ;
(5)计算完全反应完每片钙片中的碳酸钙需要消耗胃液中含有 gHCl的盐酸(保留小数点后一位数字)。
6.(2025 琼山区模拟)在农业生产上,常用质量分数为16%的氯化钠溶液选种。现要配制该氯化钠溶液50kg,需要氯化钠固体的质量为多少。(直接写出答案)
7.(2022 长兴县模拟)安吉白茶富含人体所需18种氨基酸,其中茶氨酸(C7H14N2O3)能增强血液免疫细胞干扰素分泌量、保护神经细胞、提高人体的抵抗力、记忆力、降低血压、减肥等功效。
(1)氨基酸主要用于合成人体必需的营养物质 。
(2)从上述信息可以看出,茶氨酸主要对人体的血液循环系统和 系统产生影响。
(3)348毫克茶氨酸与多少毫克尿素CO(NH2)2)中的氮元素质量相等?
8.(2023 获嘉县二模)如图是某试剂瓶标签上的部分内容。
(1)要把100g该试剂稀释为20%的硫酸,需要水的质量是多少?(写出计算的过程)
(2)写出测定稀释后溶液酸碱性的方法 。
9.(2025春 海口校级月考)葡萄糖(化学式为C6H12O6)能为人体组织提供营养。某葡萄糖注射液的标签如图所示,请计算:
(1)该瓶葡萄糖注射液中含葡萄糖的质量为 g。
(2)要把20g这种葡萄糖溶液稀释为溶质质量分数为2%的溶液,所加水的质量为多少?(写出计算过程)
10.(2023秋 定边县校级期末)实验室中盛装还未使用的浓硫酸试剂瓶上的标签如表所示,根据有关信息计算:
硫酸 化学纯(CP) (500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98%
(1)从该试剂瓶中取出50g浓硫酸,取出溶液中的溶质质量分数是 。
(2)要把50g该浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是多少?
11.(2023 庆云县二模)为测定某胃药中碳酸氢钠的含量,向一锥形瓶中加入10g该胃药,再加入100g一定质量分数的稀盐酸,恰好完全反应,气体全部逸出,反应后锥形瓶内物质的总质量为105.6g(胃药中的其他成分不参与反应,不考虑稀盐酸挥发)。请计算:
(1)反应结束共产生气体的质量是 g。
(2)该胃药中碳酸氢钠的质量分数(写出计算过程)。
12.(2020 富阳区一模)某溶液可能含CuSO4、HCl、MgCl2、Na2CO3中的几种,向其中加入一定溶质质量分数的Ba(OH)2溶液,反应中加入的Ba(OH)2溶液质量与产生沉淀的质量关系如图,回答下列问题。
(1)ab段生成的沉淀是: (填写物质的化学式)。
(2)某同学说该溶液中一定没有CuSO4,他的理由是 。
(3)a中溶液含有 种溶质。
(4)原溶液中含有的溶质是 。(填写物质的化学式)
13.(2025 淮安区模拟)请回答下列问题。
(1)已知一个碳12原子质量为mkg,一个A原子的质量为nkg,且其中有a个质子,则A原子的中子数是 。
(2)现有50g溶质质量分数为10%的硝酸钾溶液,欲将其溶质质量分数增大一倍,可通过加入适量硝酸钾的办法,计算所加硝酸钾的质量?
14.(2023秋 获嘉县校级期末)向一定量的AgNO3、Cu(NO3)2、Al(NO3)3的混合溶液中加入一定量的铁粉,充分反应后,过滤。
(1)向滤渣中滴加稀盐酸,没有气泡产生。请写出可能发生的反应的化学方程式。
(2)滤液中溶质的成分为AgNO3、Fe(NO3)2、Al(NO3)3,这种说法正确吗?请分析原因。
15.(2024春 道县月考)工业上用CO还原Fe2O3。如图是48g氧化铁与过量的CO反应,在不同温度下所得固体的质量和固体成分的图像。请回答问题。
(1)获得铁的温度应不低于 ℃(选填“400、600”或“800”)。
(2)请计算图中x的值(必须要写出详细的解题过程)。
16.(2023 娄底三模)工业上可采用某铁矿石(主要成分四氧化三铁)冶炼铁,反应原理为:Fe3O4+4CO3Fe+4CO2,若现用100t含四氧化三铁为46.4%的该矿石冶炼金属铁。
请计算:
(1)该铁矿石中含四氧化三铁的质量是 。
(2)理论上可炼出含铁96%的生铁的质量是多少?
17.(2023秋 高州市校级期中)连花清瘟胶囊具有清瘟解毒、宣肺泄热的功效,能够治疗热毒袭肺引起的流感等病症,它的主要成分有金银花等。金银花中含有棕榈酸(化学式为C16H32O2)等成分。
(1)在棕榈酸(C16H32O2)中,碳元素与氧元素的质量比为 。
(2)计算256g棕榈酸(C16H32O2)中含氧元素的质量与多少克CO2中含氧元素的质量相等?(写出计算过程)
中考核心考点 计算题
参考答案与试题解析
一.计算题(共17小题)
1.(2024 南京模拟)铁矿石冶炼成铁是一个复杂的过程。
(1)高炉炼铁的原料是铁矿石、 焦炭 、石灰石、空气。
(2)高炉炼铁得到生铁。生铁的硬度 > 纯铁的硬度(填“>”或“<”,下同);生铁的含碳量 > 钢的含碳量。
(3)用500t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
(利用化学方程式进行计算,写出计算过程,计算结果保留一位小数)
【考点】金属冶炼的计算;含杂质的化学方程式计算;生铁和钢.
【专题】金属与金属材料.
【答案】(1)焦炭;
(2)>;>;
(3)291.7t。
【分析】(1)根据高炉炼铁的原料进行分析;
(2)根据合金的性质,生铁和钢的含碳量进行分析;
(3)根据氧化铁与一氧化碳高温下反应的方程式中有关物质的质量关系列式进行计算。
【解答】解:(1)高炉炼铁的原料是铁矿石、焦炭、石灰石、空气;
(2)高炉炼铁得到生铁,生铁为铁碳合金,合金的硬度大于各成分的硬度,因此生铁的硬度>纯铁的硬度;生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%,因此生铁的含碳量>钢的含碳量;
(3)设理论上可以炼出含铁96%的生铁的质量是x
Fe2O3+3CO2Fe+3CO2
160 112
500t×80% 96%x
,解得x≈291.7t;
答:理论上可以炼出含铁96%的生铁的质量是291.7t;
故答案为:
(1)焦炭;
(2)>;>;
(3)291.7t。
【点评】本题考查了铁的冶炼、生铁和钢区别,含有杂质物质的化学反应的有关计算等相关知识,掌握学科基础知识即可解答。
2.(2022 南浔区模拟)草木灰(主要成分为K2CO3)是一种常见的肥料。烧制草木灰是我国传统农耕方式,但会造成一定的环境污染。为护卫蓝天白云,我市明令禁止露天烧制草木灰。
(1)从化学肥料分类角度分析,草木灰属于 钾肥 (填“氮肥”、“磷肥”或“钾肥”)
(2)碳酸钾中钾元素的质量分数为(结果保留一位小数) 56.5% 。
(3)在农业中,若将熟石灰粉与草木灰(主要成分是K2CO3)按一定比例混合物制得高效环保农药“黑白粉”。写出混合物制“黑白粉”的化学方程式 Ca(OH)2+K2CO3=CaCO3↓2KOH 。
【考点】常见化肥的种类和作用;元素的质量分数计算;书写化学方程式、文字表达式、电离方程式.
【专题】常见的盐 化学肥料.
【答案】(1)钾肥;
(2)56.5%;
(3)Ca(OH)2+K2CO3=CaCO3↓2KOH。
【分析】(1)根据化肥的定义解答;
(2)根据某元素的质量分数的计算公式解答;
(3)根据氢氧化钙与碳酸钾反应的化学方程式解答。
【解答】解:(1)碳酸钾中只含氮、磷、钾三种元素中的钾元素,属于钾肥;
(2)碳酸钾中钾元素的质量分数为100%≈56.5%;
(3)熟石灰粉与草木灰混合制“黑白粉”,即氢氧化钙与碳酸钾反应,故化学方程式是Ca(OH)2+K2CO3=CaCO3↓2KOH;
故答案为:(1)钾肥;
(2)56.5%;
(3)Ca(OH)2+K2CO3=CaCO3↓2KOH。
【点评】本题难度系数中等,考查学生多方面的知识,掌握基础是解答本题的关键。
3.(2025 武威一模)某化工有限公司生产的硫酸铜溶液的标签示意图如图,根据标签计算:
(1)这瓶硫酸铜溶液中溶剂的质量是 192g ;
(2)现需要配制2400g溶质质量分数为12%的硫酸铜溶液,需要溶质质量分数为20%的硫酸铜溶液多少毫升?
【考点】用水稀释改变浓度的方法;有关溶质质量分数的简单计算.
【专题】溶液的组成及溶质质量分数的计算.
【答案】(1)192g;
(2)1200mL。
【分析】(1)根据溶液的体积和密度溶质的质量分数的计算公式分析计算;
(2)根据溶质质量不变原理分析计算。
【解答】解:(1)这瓶硫酸铜溶液中溶剂的质量是:200mL×1.2g/mL﹣(200mL×1.2g/mL)×20%=192g;
(2)设需要溶质质量分数为20%的硫酸铜溶液体积是x。
x×1.2g/mL×20%=2400g×12%
解得:x=1200mL
答:需要溶质质量分数为20%的硫酸铜溶液1200mL。
故答案为:(1)192g;
(2)1200mL。
【点评】本题难度不大,掌握溶液稀释前后溶质的质量不变、溶质质量=溶液质量×溶质的质量分数等是正确解答本题的关键。
4.(2024秋 岱岳区期末)分别对200g溶质质量分数为5%的硝酸钾溶液进行如下操作:
(1)将该溶液蒸发掉 150 g水,在无固体析出的情况下,溶液中溶质质量分数变为20%。
(2)向该溶液中加入 300 g水,稀释为2%的硝酸钾溶液。
【考点】用水稀释改变浓度的方法;有关溶质质量分数的简单计算.
【专题】溶液的组成及溶质质量分数的计算.
【答案】(1)150;
(2)300。
【分析】根据溶质质量分数的概念分析。
【解答】解:(1)将该溶液蒸发水的质量为:200g﹣(200g×5%÷20%)=150g;
(2)向该溶液中加入水的质量为:200g×5%÷2%﹣200g=300g。
故答案为:(1)150g;
(2)300g。
【点评】本题考查溶液质量分数的计算,难度不大。
5.(2024 朝阳区校级模拟)如图是某补钙药物包装袋上的部分说明,根据标回答下列问题。
作用:本品为维生素与矿物质类非处方药药品 规格:每片质量为2克,含维生素D,2.5微克,碳酸钙0.75g 成分:碳酸钙、维生素D3、山梨醇、硬脂酸镁等; 用法用量:儿童:一次1片,一日一次; 成人:一次2片,一日一次。 贮藏:密封干燥处保存。 包装:每瓶60片。
(1)碳酸钙的化学式为 CaCO3 ;
(2)钙元素可以预防幼儿及青少年患 A 和发育不良。
A.佝偻病
B.甲状腺肿大
C.夜盲症
(3)碳酸钙中钙元素与氧元素质量比为 5:6 ;
(4)每片药品中含有钙元素的质量分数为 15% ;
(5)计算完全反应完每片钙片中的碳酸钙需要消耗胃液中含有 0.5 gHCl的盐酸(保留小数点后一位数字)。
【考点】人体内的常量元素;化学式的书写及意义;元素质量比的计算;元素的质量分数计算;不含杂质的化学方程式计算.
【专题】化学与生活.
【答案】(1)CaCO3;
(2)A;
(3)5:6;
(4)15%;
(5)0.5。
【分析】根据已有的物质的化学式,结合根据化学式的相关计算,元素与人体健康关系等进行分析解答即可。
【解答】解:(1)碳酸钙的化学式为CaCO3;
(2)幼儿及青少年缺钙容易患佝偻病,故选:A;
(3)碳酸钙中钙元素与氧元素质量比为:40:(16×3)=5:6;
(4)碳酸钙中钙元素的质量=0.75g100%=0.3g;
每片药品中含有钙元素的质量分数为15%
(5)解:设消耗HCl的质量为x。
x=0.5g。
答:完全反应元每片钙片中的碳酸钙消耗胃液中HCl的质量为0.5g。
故答案为:(1)CaCO3;
(2)A;
(3)5:6;
(4)15%;
(5)0.5。
【点评】本题难度较小,解答关键是了解化学式的书写,结合根据化学式的相关计算,元素与人体健康关系等。
6.(2025 琼山区模拟)在农业生产上,常用质量分数为16%的氯化钠溶液选种。现要配制该氯化钠溶液50kg,需要氯化钠固体的质量为多少。(直接写出答案)
【考点】有关溶质质量分数的简单计算.
【专题】溶液的组成及溶质质量分数的计算.
【答案】8kg。
【分析】根据溶质质量=溶液质量×溶质的质量分数,进行分析解答。
【解答】解:配制16%的氯化钠溶液50kg,需要氯化钠固体的质量为50kg×16%=8kg。
故答案为:8kg。
【点评】本题难度不大,了解溶质质量=溶液质量×溶质的质量分数是正确解答本题的关键。
7.(2022 长兴县模拟)安吉白茶富含人体所需18种氨基酸,其中茶氨酸(C7H14N2O3)能增强血液免疫细胞干扰素分泌量、保护神经细胞、提高人体的抵抗力、记忆力、降低血压、减肥等功效。
(1)氨基酸主要用于合成人体必需的营养物质 蛋白质 。
(2)从上述信息可以看出,茶氨酸主要对人体的血液循环系统和 免疫 系统产生影响。
(3)348毫克茶氨酸与多少毫克尿素CO(NH2)2)中的氮元素质量相等?
【考点】蛋白质;化合物中某元素的质量计算.
【专题】化学式的计算;化学与生活.
【答案】(1)蛋白质;
(2)免疫;
(3)120g。
【分析】(1)根据蛋白质在人体中的代谢进行分析;
(2)根据题目信息进行分析;
(3)根据化学式中元素质量的计算方法进行计算。
【解答】解:(1)氨基酸在人体中主要用于合成蛋白质,故答案为:蛋白质;
(2)根据题目信息可知茶氨酸能增强血液免疫细胞干扰素分泌量、保护神经细胞、提高人体的抵抗力、记忆力、降低血压、减肥等功效,因此茶氨酸主要对人体的血液循环系统和免疫系统产生影响,故答案为:免疫;
(3)348g茶氨酸中氮元素的质量为348g100%=56g,则尿素的质量为56g100%=120g,故答案为:120g。
【点评】此题难度不大,考查人体中的六大营养素和有关化学式的计算,注重基础。
8.(2023 获嘉县二模)如图是某试剂瓶标签上的部分内容。
(1)要把100g该试剂稀释为20%的硫酸,需要水的质量是多少?(写出计算的过程)
(2)写出测定稀释后溶液酸碱性的方法 取少量溶液于试管中,滴加紫色石蕊溶液,溶液变红,说明溶液呈酸性(合理即可) 。
【考点】溶液的酸碱性测定;用水稀释改变浓度的方法.
【专题】溶液的组成及溶质质量分数的计算;常见的酸 酸的通性.
【答案】(1)390g;
(2)取少量溶液于试管中,滴加紫色石蕊溶液,溶液变红,说明溶液呈酸性(合理即可)。
【分析】(1)根据溶液稀释前后溶质的质量不变,进行分析解答。
(2)根据测定溶液酸碱性的方法,进行分析解答。
【解答】解:(1)设要加水的质量为x,根据溶液稀释前后溶质的质量不变,则100g×98%=(100g+x)×20%,x=390g。
答:需要水的质量是390g。
(2)稀释后稀硫酸显酸性,测定稀释后溶液酸碱性的方法是取少量溶液于试管中,滴加紫色石蕊溶液,溶液变红,说明溶液呈酸性(合理即可)。
故答案为:
(1)390g;
(2)取少量溶液于试管中,滴加紫色石蕊溶液,溶液变红,说明溶液呈酸性(合理即可)。
【点评】本题难度不大,了解测定溶液酸碱性的方法、溶液稀释前后溶质的质量不变等是正确解答本题的关键。
9.(2025春 海口校级月考)葡萄糖(化学式为C6H12O6)能为人体组织提供营养。某葡萄糖注射液的标签如图所示,请计算:
(1)该瓶葡萄糖注射液中含葡萄糖的质量为 25 g。
(2)要把20g这种葡萄糖溶液稀释为溶质质量分数为2%的溶液,所加水的质量为多少?(写出计算过程)
【考点】用水稀释改变浓度的方法;有关溶质质量分数的简单计算.
【专题】溶液的组成及溶质质量分数的计算.
【答案】(1)25;
(2)30g。
【分析】(1)根据溶质质量=溶液质量×溶质的质量分数,进行分析解答。
(2)根据溶液稀释前后溶质质量不变,进行分析解答。
【解答】解:(1)该瓶葡萄糖注射液的规格为500mL,溶质质量分数为5%,密度为1g/mL,则该瓶葡萄糖注射液中含葡萄糖的质量为1g/mL×500mL×5%=25g。
故答案为:25。
(2)根据溶液稀释前后溶质质量不变,设加入水质量为x,则20g×5%=(20g+x)×2%,x=30g。
答:所加水的质量为30g。
【点评】本题难度不大,了解溶液稀释前后溶质质量不变、溶质质量=溶液质量×溶质的质量分数是正确解答本题的关键。
10.(2023秋 定边县校级期末)实验室中盛装还未使用的浓硫酸试剂瓶上的标签如表所示,根据有关信息计算:
硫酸 化学纯(CP) (500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98%
(1)从该试剂瓶中取出50g浓硫酸,取出溶液中的溶质质量分数是 98% 。
(2)要把50g该浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是多少?
【考点】用水稀释改变浓度的方法;有关溶质质量分数的简单计算.
【专题】溶液的组成及溶质质量分数的计算.
【答案】(1)98%;
(2)440g。
【分析】(1)根据溶液具有均一性,进行分析解答。
(2)根据溶液稀释前后溶质的质量不变,进行分析解答。
【解答】解:(1)从该试剂瓶中取出50g浓硫酸,取出溶液中的溶质质量分数是98%。
故答案为:98%。
(2)设需要水的质量为x,根据溶液稀释前后溶质的质量不变,
50g×98%=(50g+x)×10% x=440g
答:需要水的质量是440g。
【点评】本题难度不大,明确溶液稀释前后溶质的质量不变、溶液具有均一性是正确解答本题的关键所在。
11.(2023 庆云县二模)为测定某胃药中碳酸氢钠的含量,向一锥形瓶中加入10g该胃药,再加入100g一定质量分数的稀盐酸,恰好完全反应,气体全部逸出,反应后锥形瓶内物质的总质量为105.6g(胃药中的其他成分不参与反应,不考虑稀盐酸挥发)。请计算:
(1)反应结束共产生气体的质量是 4.4 g。
(2)该胃药中碳酸氢钠的质量分数(写出计算过程)。
【考点】根据化学反应方程式的计算.
【专题】有关化学方程式的计算.
【答案】(1)4.4。
(2)84%。
【分析】碳酸氢钠和稀盐酸反应生成氯化钠、水和二氧化碳,根据反应的化学方程式及其提供数据可以进行相关方面的计算和判断。
【解答】解:(1)反应结束共产生气体的质量是10g+100g﹣105.6g=4.4g。
故答案为:4.4。
(2)设该胃药中碳酸氢钠的质量分数是x。
NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
10gx 4.4g
x=84%
答:该胃药中碳酸氢钠的质量分数是84%。
【点评】本题主要考查学生进行计算和推断的能力,计算时要注意规范性和准确性。
12.(2020 富阳区一模)某溶液可能含CuSO4、HCl、MgCl2、Na2CO3中的几种,向其中加入一定溶质质量分数的Ba(OH)2溶液,反应中加入的Ba(OH)2溶液质量与产生沉淀的质量关系如图,回答下列问题。
(1)ab段生成的沉淀是: Mg(OH)2 (填写物质的化学式)。
(2)某同学说该溶液中一定没有CuSO4,他的理由是 硫酸铜能与氢氧化钡反应生成了硫酸钡,图象中开始没有沉淀生成 。
(3)a中溶液含有 2 种溶质。
(4)原溶液中含有的溶质是 HCl、MgCl2 。(填写物质的化学式)
【考点】盐的化学性质;碱的通性.
【专题】常见的碱 碱的通性;常见的盐 化学肥料.
【答案】见试题解答内容
【分析】此题为混合物质组成推断题,根据物质的性质进行分析,碳酸钠与盐酸不能共存,氢氧化钡能与硫酸铜反应生成不溶于水和酸的硫酸钡沉淀,由图象可以看出,刚开始无沉淀产生,则溶液中一定含有盐酸,有盐酸则不含有碳酸钠,过一段时间产生沉淀说明溶液中含有氯化镁,则不含有硫酸铜,一定含有盐酸和氯化镁。
【解答】解:由物质的性质进行分析可知,碳酸钠与盐酸不能共存,氢氧化钡能与硫酸铜反应生成不溶于水和酸的硫酸钡沉淀;由图象可以看出,刚开始无沉淀产生,则说明了溶液中一定含有盐酸,有盐酸则不含有碳酸钠,过一段时间产生沉淀说明溶液中含有氯化镁,则不含有硫酸铜,一定含有盐酸和氯化镁。由此可知:
(1)ab段生成的沉淀是氢氧化镁沉淀,化学式是:Mg(OH)2。
(2)某同学说该溶液中一定没有CuSO4,他的理由是硫酸铜能与氢氧化钡反应生成了硫酸钡,图象中开始没有沉淀生成。
(3)由图象可知,a点时,氢氧化钡和稀盐酸恰好反应,溶液含中生成的BaCl2与没有反应的MgCl2两种溶质组成。
(4)由上述分析可知,原溶液中含有的溶质是HCl、MgCl2
故答案为:(1)Mg(OH)2;(2)硫酸铜能与氢氧化钡反应生成了硫酸钡,图象中开始没有沉淀生成。(3)2;(4)HCl、MgCl2。
【点评】本题考查了常见混合物组成的推断题,可以依据物质的性质以及物质间的反应进行解答。
13.(2025 淮安区模拟)请回答下列问题。
(1)已知一个碳12原子质量为mkg,一个A原子的质量为nkg,且其中有a个质子,则A原子的中子数是 。
(2)现有50g溶质质量分数为10%的硝酸钾溶液,欲将其溶质质量分数增大一倍,可通过加入适量硝酸钾的办法,计算所加硝酸钾的质量?
【考点】有关溶质质量分数的简单计算;相对原子质量的概念及其计算方法.
【专题】溶液的组成及溶质质量分数的计算;物质的微观构成与物质的宏观组成.
【答案】(1);
(2)6.25g。
【分析】(1)利用相对原子质量是以一个碳﹣12原子(核内有6个质子、6个中子)质量的作为标准,任何一个原子的真实质量跟一个碳﹣12原子质量的的比值,称为该原子的相对原子质量这一概念解决此题;
(2)根据混合前后溶质的质量不变分析,进行分析解答。
【解答】解:(1)原子的相对原子质量,因为相对原子质量=质子数+中子数,故该原子的中子数;
(2)设所加硝酸钾的质量为x,
(50g+x)×20%=50g×10%+x
解得x=6.25g
故答案为:
(1);
(2)6.25g。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
14.(2023秋 获嘉县校级期末)向一定量的AgNO3、Cu(NO3)2、Al(NO3)3的混合溶液中加入一定量的铁粉,充分反应后,过滤。
(1)向滤渣中滴加稀盐酸,没有气泡产生。请写出可能发生的反应的化学方程式。
(2)滤液中溶质的成分为AgNO3、Fe(NO3)2、Al(NO3)3,这种说法正确吗?请分析原因。
【考点】金属与盐溶液反应的原理.
【专题】金属与金属材料.
【答案】(1)Fe+Cu(NO3)2=Fe(NO3)2+Cu。
(2)不正确。溶液中有AgNO3,则一定有Cu(NO3)2。
【分析】金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来,并且金属越活泼,越容易先和盐溶液反应。
【解答】解:向一定量的AgNO3、Cu(NO3)2、Al(NO3)3的混合溶液中加入一定量的铁粉,铁不能和硝酸铝反应,先和硝酸银反应生成硝酸亚铁和银,后和硝酸铜反应生成硝酸亚铁和铜。
(1)向滤渣中滴加稀盐酸,没有气泡产生,说明滤渣中不含有铁,铁一定和硝酸银反应,可能发生的反应的化学方程式是 Fe+Cu(NO3)2=Fe(NO3)2+Cu。
(2)滤液中溶质的成分为AgNO3、Fe(NO3)2、Al(NO3)3,这种说法不正确,是因为如果溶液中有AgNO3,则一定有Cu(NO3)2。
故答案为:(1)Fe+Cu(NO3)2=Fe(NO3)2+Cu。
(2)不正确。溶液中有AgNO3,则一定有Cu(NO3)2。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
15.(2024春 道县月考)工业上用CO还原Fe2O3。如图是48g氧化铁与过量的CO反应,在不同温度下所得固体的质量和固体成分的图像。请回答问题。
(1)获得铁的温度应不低于 800 ℃(选填“400、600”或“800”)。
(2)请计算图中x的值(必须要写出详细的解题过程)。
【考点】金属冶炼的计算;一氧化碳还原氧化铁.
【专题】金属与金属材料.
【答案】(1)800;
(2)33.6。
【分析】(1)根据图示信息进行分析;
(2)根据反应前后铁元素的质量守恒进行分析。
【解答】解:(1)根据图示可知,温度大于等于800℃时,生成的固体只有铁,则用CO炼铁时,获得铁的温度应不低于800℃;
(2)由图可知,最初氧化铁固体质量为48.0g,其中的铁元素全部转化到铁单质中,则铁的质量为33.6g,则x=33.6g。
故答案为:
(1)800;
(2)33.6。
【点评】读懂图示信息,利用好质量守恒定律等相关知识是解答本题的关键。
16.(2023 娄底三模)工业上可采用某铁矿石(主要成分四氧化三铁)冶炼铁,反应原理为:Fe3O4+4CO3Fe+4CO2,若现用100t含四氧化三铁为46.4%的该矿石冶炼金属铁。
请计算:
(1)该铁矿石中含四氧化三铁的质量是 46.4t 。
(2)理论上可炼出含铁96%的生铁的质量是多少?
【考点】含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】(1)46.4t。
(2)35t。
【分析】根据反应的化学方程式及其提供数据可以进行相关方面的计算和判断。
【解答】解:(1)该铁矿石中含四氧化三铁的质量是100t×46.4%=46.4t。
故答案为:46.4t。
(2)设理论上可炼出含铁96%的生铁的质量是x。
Fe3O4+4CO3Fe+4CO2,
232 168
46.4t x×96%
x=35t
答:理论上可炼出含铁96%的生铁的质量是35t。
【点评】本题主要考查学生进行计算和推断的能力,计算时要注意规范性和准确性。
17.(2023秋 高州市校级期中)连花清瘟胶囊具有清瘟解毒、宣肺泄热的功效,能够治疗热毒袭肺引起的流感等病症,它的主要成分有金银花等。金银花中含有棕榈酸(化学式为C16H32O2)等成分。
(1)在棕榈酸(C16H32O2)中,碳元素与氧元素的质量比为 6:1 。
(2)计算256g棕榈酸(C16H32O2)中含氧元素的质量与多少克CO2中含氧元素的质量相等?(写出计算过程)
【考点】化合物中某元素的质量计算;元素质量比的计算.
【专题】化学式的计算.
【答案】(1)6:1;
(2)44g。
【分析】(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比进行计算;
(2)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
【解答】解:(1)由化学式可知,棕榈酸中含有碳、氢、氧三种元素组成;其中碳元素与氧元素的质量比为(12×16):(16×2)=6:1;
(2)设二氧化碳的质量为x。
x=44g。
答:二氧化碳的质量为44g。
故答案为:
(1)6:1;
(2)44g。
【点评】本题主要考查了化合物中某元素的质量计算以及元素质量比的计算,理解化学式的含义并掌握计算方法为解答该题的关键。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
