【中考押题预测】2025年中考化学人教版(2024)核心考点考前冲刺 金属活动性顺序及应用(含解析)
文档属性
| 名称 | 【中考押题预测】2025年中考化学人教版(2024)核心考点考前冲刺 金属活动性顺序及应用(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-16 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
中考核心考点 金属活动性顺序及应用
一.选择题(共10小题)
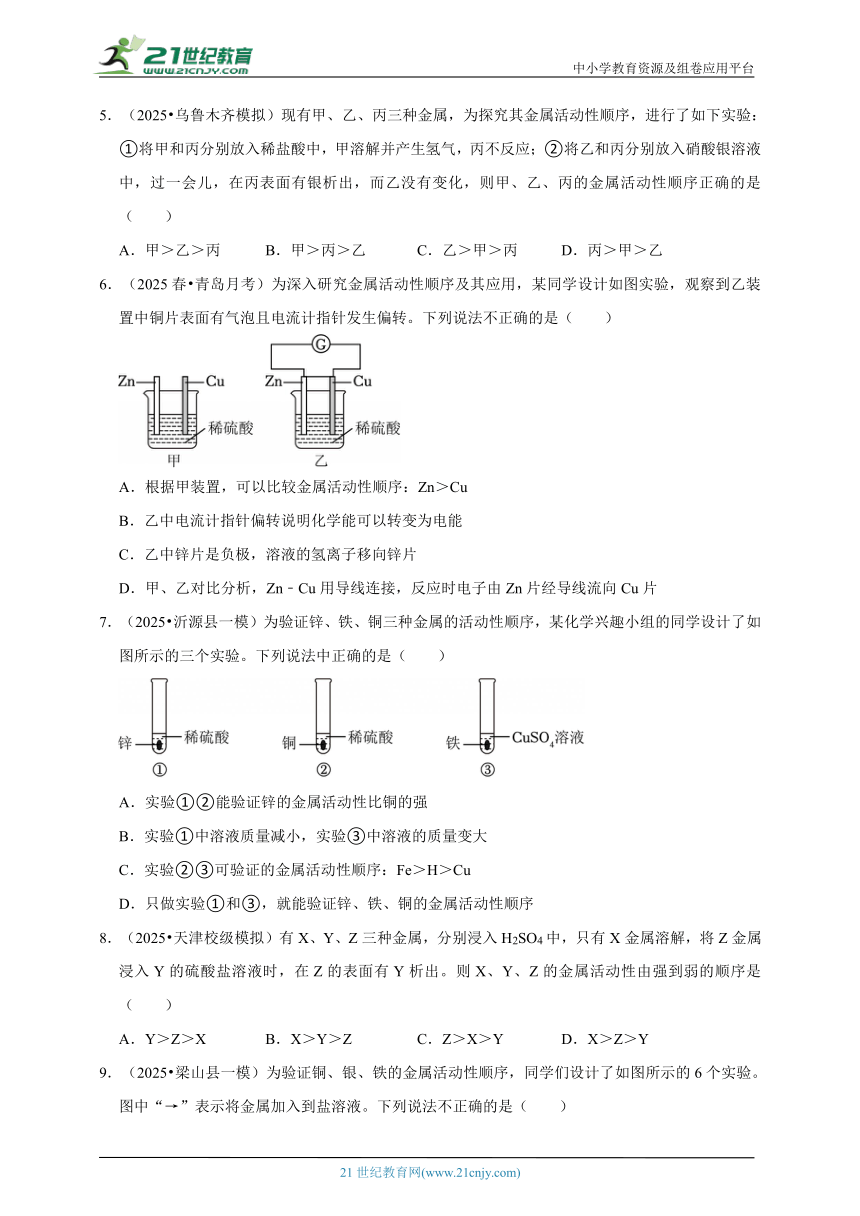
1.(2025 北碚区模拟)化学兴趣小组利用置换反应来判断Fe、M、N三种金属的活动性顺序,设计了下图所示的5种方案。下列说法正确的是( )
A.若方案①能反应,则方案③一定能反应
B.仅凭方案②,无法确定N与Fe的活动性顺序
C.结合方案④、⑤,一定能够判断M和N的活动性
D.若方案②、④均不能反应,则活动性:N>Fe>M
2.(2025 碑林区三模)现欲探究铝、铁的金属活动性顺序,下列实验方案能得出两种金属的活动性顺序的是( )
A.将铝片和铁片分别放入等体积等浓度的稀盐酸中,观察反应剧烈程度
B.将铝片和铁片分别放入蒸馏水中,观察是否有气泡产生
C.将铝片和铁片分别放入等体积等浓度的氢氧化钠溶液中,观察是否有气体产生
D.将铝片和铁片分别放入等体积等浓度的硫酸铜溶液中,观察是否有红色固体析出
3.(2025 北京校级模拟)下列实验组合中,能得出铝、铜、银的金属活动性顺序的是( )
A.①④ B.②④ C.③④ D.①③
4.(2025 银川一模)下列各组合能验证Zn、Fe、Cu三种金属活动性强弱的是( )
①稀盐酸、锌粉、铁粉、铜粉
②Zn、FeSO4溶液、Cu
③ZnSO4溶液、Fe、Cu(NO3)2溶液
④ZnSO4溶液、Fe、Cu
A.①④ B.①②③ C.①③④ D.①②③④
5.(2025 乌鲁木齐模拟)现有甲、乙、丙三种金属,为探究其金属活动性顺序,进行了如下实验:①将甲和丙分别放入稀盐酸中,甲溶解并产生氢气,丙不反应;②将乙和丙分别放入硝酸银溶液中,过一会儿,在丙表面有银析出,而乙没有变化,则甲、乙、丙的金属活动性顺序正确的是( )
A.甲>乙>丙 B.甲>丙>乙 C.乙>甲>丙 D.丙>甲>乙
6.(2025春 青岛月考)为深入研究金属活动性顺序及其应用,某同学设计如图实验,观察到乙装置中铜片表面有气泡且电流计指针发生偏转。下列说法不正确的是( )
A.根据甲装置,可以比较金属活动性顺序:Zn>Cu
B.乙中电流计指针偏转说明化学能可以转变为电能
C.乙中锌片是负极,溶液的氢离子移向锌片
D.甲、乙对比分析,Zn﹣Cu用导线连接,反应时电子由Zn片经导线流向Cu片
7.(2025 沂源县一模)为验证锌、铁、铜三种金属的活动性顺序,某化学兴趣小组的同学设计了如图所示的三个实验。下列说法中正确的是( )
A.实验①②能验证锌的金属活动性比铜的强
B.实验①中溶液质量减小,实验③中溶液的质量变大
C.实验②③可验证的金属活动性顺序:Fe>H>Cu
D.只做实验①和③,就能验证锌、铁、铜的金属活动性顺序
8.(2025 天津校级模拟)有X、Y、Z三种金属,分别浸入H2SO4中,只有X金属溶解,将Z金属浸入Y的硫酸盐溶液时,在Z的表面有Y析出。则X、Y、Z的金属活动性由强到弱的顺序是( )
A.Y>Z>X B.X>Y>Z C.Z>X>Y D.X>Z>Y
9.(2025 梁山县一模)为验证铜、银、铁的金属活动性顺序,同学们设计了如图所示的6个实验。图中“→”表示将金属加入到盐溶液。下列说法不正确的是( )
A.实验②的目的是验证铜、银的金属活动性顺序
B.仅由④和⑥就能得出铜、银、铁的金属活动性顺序
C.铁在⑤和⑥反应的产物中都显+2价
D.仅由①和②就能得出铜、银、铁的金属活动性顺序
10.(2025 栾城区校级一模)人类开发利用金属的时间和金属的活动性有关。为探究金属的活动性强弱,用如图实验进行探究。下列说法不正确的是( )
A.实验前需要打磨金属片,除去表面的氧化膜
B.若用稀盐酸能比较两金属的活动性,则只有金属片X表面产生气泡
C.若将铜片放入X的盐溶液,则能比较出X与铜的金属活动性
D.若X为Zn,向两支试管加入AgNO3溶液,能得出金属活动性:Zn>Cu>Ag
二.填空题(共8小题)
11.(2025 咸阳一模)金属的发现和使用推动了人类社会发展。部分金属的发现历程如图所示,请根据要求回答下列问题。
(1)据图分析,金属的发现的先后与金属的 有关。
(2)铝被广泛地应用于生产和生活之中,除了因为改进铝的冶炼方法使其成本降低,以及铝的密度小外,还由于铝具有较好的 性。
(3)老师提供了氯化铝溶液和硫酸铜溶液,让同学们验证铜、铁、铝三种金属的活动性顺序,他们选择了一种金属,通过实验得出了正确的结论。请你结合他们选择的金属,写出实验时发生反应的化学方程式: 。
12.(2025 碑林区校级三模)“卧薪尝胆,三千越甲可吞吴”这句话传颂的是春秋时期越王勾践的励志故事,他的宝剑——越王勾践剑被称为天下第一剑。检测数据显示剑身主要含有铜、锡(Sn),另外含有少量铁、铝。
(1)越王勾践剑剑身材料与纯铜相比,具有硬度 (填“大”或“小”)的优良性能。
(2)越王勾践剑在出土时剑身未被腐蚀的原因之一是剑身与剑鞘之间的吻合度极高,有效隔绝了剑身与 的直接接触。
(3)将打磨过的铜片、铁片、铝片分别插入稀盐酸中,写出其中一种金属与稀盐酸反应的化学方程式: 。
(4)为验证铜、铁、铝的金属活动性顺序,以下方案中所选试剂不能达到目的的是 (多选,填字母)。
A.稀硫酸、铜片、硫酸亚铁溶液
B.铜片、硫酸亚铁溶液、铝片
C.铁片、硫酸铜溶液、硫酸铝溶液
D.铜片、铁片、硫酸铝溶液
13.(2025春 莆田校级期中)“福建舰”解缆启航,标志着我国航空母舰建设迈向新征程。
Ⅰ.航母建造
(1)航母建造需使用纯铜、钢铁、铝合金等。
①航母电缆用纯铜制作,主要利用铜的延展性和 性。
②航母在建造过程中大量使用特种钢。建造过程中用该特种钢不用纯铁的原因是 。
③航母内部大量使用Al、Fe、Cu三种金属材料或其合金的设备。可以选用稀盐酸对三种金属的活动性顺序进行探究。写出其中一个能与稀盐酸反应的化学方程式 ,该反应所属的基本反应类型是 。请选择其他合适的试剂,这三种金属的活动性顺序进行探究,能达到目的的是 。
Ⅱ.能源供给
(2)航母动力由重油(含C18H18等多种成分)燃烧提供。其充分燃烧后产物有 (填化学式)。
(3)通讯工具使用的锂电池,工作时能量转化的主要方式为 。
14.(2025 灞桥区校级模拟)金属材料在人类的生产生活中有着广泛的应用。
【实验1】设计如图实验,验证金属活动性顺序表中Fe、Cu、Ag三种金属与H的位置关系。
(1)为达到实验目的,C实验中X溶液可以选择下列中的 (填字母)。
A.FeSO4溶液
B.CuSO4溶液
C.稀硫酸
(2)写出B试管中发生反应的化学方程式: 。
【实验2】在实验室中,把一定量铁粉加入到一定量的Zn(NO3)2、Cu(NO3)2、AgNO3的混合溶液中,请根据下图中的信息回答相关问题:
(3)滤液A中一定存在的金属阳离子是 (填离子符号)。
(4)向滤渣B中滴加稀盐酸时,还能观察到溶液由无色变为 色。
15.(2025 乾县校级三模)金属在生产和生活中应用极为广泛。
(1)下列生活用品利用金属良好导热性的是 (填字母)。
A.镀铬水龙头
B.铸铁暖气片
C.包糖果的铝箔
(2)铝制品耐腐蚀的原因是 (用化学方程式解释)。
(3)镍(Ni)广泛用于合金的制造,这与其化学性质密切相关。为探究它的活动性,向镍(Ni)中加入足量的稀硫酸,观察到有气泡产生,溶液变为绿色(Ni2+)。结合上述实验事实,限用一种试剂对Ni、Cu、Ag三种金属的活动性强弱进行验证,则该试剂是 (填字母)。
A.稀硫酸
B.CuSO4溶液
C.NiCl2溶液
D.AgNO3溶液
16.(2025 牡丹江模拟)金属材料在日常生活、工农业生产中有广泛应用,结合所学知识回答下列问题:
(1)铜块能制成铜丝是利用了铜的 性。
(2)青铜是人类最早使用的铜锡合金,下列说法不正确的是 (填字母序号)。
A.青铜属于金属材料
B.铜的硬度比青铜大
C.青铜耐腐蚀
(3)为了探究X、Y、Z三种金属的活动性顺序,某小组同学做了以下三个实验:
①将X放入Y的盐溶液中,有Y固体析出
②将X放入Z的盐溶液中,有Z固体析出
③将Y放入Z的盐溶液中,有Z固体析出
经过讨论,实验 (填数字序号)是多余的,可得出三种金属的活动性顺序为 。
(4)将一定量的锌粉加入到硝酸镁和硝酸铜的混合液中,充分反应后过滤,得到滤渣和滤液。下列判断正确的是 。
A.若滤液为蓝色,则滤渣中一定有锌、镁、铜
B.若向滤渣中加入稀盐酸有气泡产生,则滤液中一定有硝酸镁、硝酸锌、硝酸铜
C.若向滤液中加入氢氧化钠溶液,则一定有氢氧化铜生成
D.滤渣中一定含有铜,滤液中一定含有硝酸镁和硝酸锌
17.(2025 舒城县模拟)《梦溪笔谈》是北宋科学家、政治家沈括撰写的一部涉及古代中国自然科学、工艺技术及社会历史现象的综合性笔记体著作。该著作中“古人以剂钢为刃,柔铁为茎干,不尔则多断折”“熬胆矾铁釜,久之亦化为铜”记录了古代铁器生产、使用的情形。请回答有关问题。
(1)剂钢指的是一种高碳钢,质地坚硬但很脆,柔铁则是一种低碳钢,质地坚韧但无钢性。生铁和钢主要含铁和碳,生铁的含碳量比钢 (填“高”或“低”),钢的硬度比纯铁 (填“大”或“小”)。
(2)人类对铁的利用比铜晚了1500多年,这是因为铁的金属活动性比铜 (填“强”或“弱”)。已知胆矾溶于水得到硫酸铜溶液,请用化学方程式解释“熬胆矾铁釜,久之亦化为铜”的原因: 。
18.(2025 宁江区一模)《梦溪笔谈》中“古人以剂钢为刃,柔铁为茎干”“熬胆矾铁釜,久之亦化为铜“记录了古代铁器生产、使用的情形。回答问题:
(1)炼铁的原理是利用CO与Fe2O3的反应。Fe2O3中Fe的化合价为 。
(2)“剂钢”指的是合金钢,钢的硬度比纯铁的 (选填“大”或“小”)。
(3)人类对铁的利用比铜晚了1500多年,这是因为铁的金属活动性比铜的 (填选“强”或“弱”)。已知胆矾溶于水得到硫酸铜溶液,请用化学方程式解释“熬胆矾铁釜,久之亦化为铜”的原因: 。
中考核心考点 金属活动性顺序及应用
参考答案与试题解析
一.选择题(共10小题)
1.(2025 北碚区模拟)化学兴趣小组利用置换反应来判断Fe、M、N三种金属的活动性顺序,设计了下图所示的5种方案。下列说法正确的是( )
A.若方案①能反应,则方案③一定能反应
B.仅凭方案②,无法确定N与Fe的活动性顺序
C.结合方案④、⑤,一定能够判断M和N的活动性
D.若方案②、④均不能反应,则活动性:N>Fe>M
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】D
【分析】根据在金属活动性顺序中,只有排在氢前面的金属才能和酸反应,排在前面的金属能把排在后面的金属从它的盐溶液中置换出来进行分析。
【解答】解:A、若方案①铁能与M的盐溶液反应,说明铁的活动性大于M,但M的活动性不一定比氢强,比如硫酸铜能与铁反应生成铜和硫酸亚铁,但铜不能和稀硫酸反应,所以方案③不一定能反应,故选项错误;
B、方案②为铁与N的盐溶液,如果不能反应,说明N的活动性大于铁,如果能反应,说明铁的活动性大于N;所以仅凭方案②能确定N与铁的活动性顺序,故选项错误;
C、方案⑤为N和硫酸亚铁溶液,若能反应,说明N的活动性大于铁,方案④为M和硫酸亚铁溶液,若能反应,说明M的活动性大于铁;但仅根据这两个方案,若M、N都能与硫酸亚铁反应,无法判断M和N的活动性强弱,故选项错误;
D、方案④为M和硫酸亚铁溶液,若方案④不能反应,说明M的活动性小于Fe,方案②为铁与N的盐溶液,若方案②不能反应,说明N的活动性大于Fe;所以活动性顺序为N>Fe>M,故选项正确;
故选:D。
【点评】在金属活动性顺序中,只有排在氢前面的金属才能和酸反应,排在前面的金属能把排在后面的金属从它的盐溶液中置换出来。
2.(2025 碑林区三模)现欲探究铝、铁的金属活动性顺序,下列实验方案能得出两种金属的活动性顺序的是( )
A.将铝片和铁片分别放入等体积等浓度的稀盐酸中,观察反应剧烈程度
B.将铝片和铁片分别放入蒸馏水中,观察是否有气泡产生
C.将铝片和铁片分别放入等体积等浓度的氢氧化钠溶液中,观察是否有气体产生
D.将铝片和铁片分别放入等体积等浓度的硫酸铜溶液中,观察是否有红色固体析出
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】A
【分析】在金属活动性顺序表中,位于前面的金属能把位于它后面的金属从其盐溶液中置换出来,所以可以根据它们的金属活动性顺序及其应用来进行解答。
【解答】解:A、将铝片和铁片分别放入等体积等浓度的稀盐酸中,金属与酸反应时,反应越剧烈,说明金属的活动性越强。通过观察铝片和铁片与稀盐酸反应的剧烈程度,可以比较出铝和铁的金属活动性顺序,该方案可行,故正确;
B、铝和铁在常温下与蒸馏水都不反应,都不会有气泡产生,所以无法通过该实验比较铝和铁的金属活动性顺序,该方案不可行,故错误;
C、铁与氢氧化钠溶液不反应,铝能与氢氧化钠溶液反应产生氢气,但这只能说明铝能与氢氧化钠溶液发生反应,不能直接比较铝和铁的金属活动性顺序(金属活动性顺序一般是通过金属与酸、盐溶液等反应来比较 ),该方案不可行,故错误;
D、将铝片和铁片分别放入等体积等浓度的硫酸铜溶液中,铝和铁都能置换出硫酸铜溶液中的铜,都有红色固体析出,只能说明铝和铁的活动性都比铜强,但无法比较铝和铁之间的活动性顺序,该方案不可行,故错误;
故选:A。
【点评】本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,强调了学生整合基本化学知识的能力。
3.(2025 北京校级模拟)下列实验组合中,能得出铝、铜、银的金属活动性顺序的是( )
A.①④ B.②④ C.③④ D.①③
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】C
【分析】根据在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,进行分析判断。
【解答】解:根据金属和酸反应、金属和盐反应的条件;
A、①铝丝和稀硫酸反应生成氢气,铝的位置排在氢的前面;④铜丝和硝酸银溶液反应,能置换出银,铜的金属活动性比银强,但无法确定铝和铜的活动性强弱,故选项错误。
B、②铜和稀硫酸不反应,铜的位置排在氢的后面;④铜丝和硝酸银溶液反应,能置换出银,铜的金属活动性比银强,但无法确定铝和铜的活动性强弱,故选项错误。
C、③铝丝和硫酸铜反应能置换出铜,铝的金属活动性比铜强;④铜丝和硝酸银溶液反应,能置换出银,铜的金属活动性比银强,可得出三种金属活动性铝>铜>银,故选项正确。
D、①铝丝和稀硫酸反应生成氢气,位置排在氢的前面;③铝丝和硫酸铜反应能置换出铜,铝的金属活动性比铜强;但无法确定银和铜的活动性强弱,故选项错误。
故选:C。
【点评】本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
4.(2025 银川一模)下列各组合能验证Zn、Fe、Cu三种金属活动性强弱的是( )
①稀盐酸、锌粉、铁粉、铜粉
②Zn、FeSO4溶液、Cu
③ZnSO4溶液、Fe、Cu(NO3)2溶液
④ZnSO4溶液、Fe、Cu
A.①④ B.①②③ C.①③④ D.①②③④
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】B
【分析】根据在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,进行分析判断。
【解答】解:①Zn、Fe均能与稀盐酸反应产生气泡,且Zn反应较剧烈,产生气泡的速率较快,说明活动性Zn>Fe>H,Cu不能与稀硫酸反应,说明活动性H>Cu,可得出金属活动性Zn>Fe>Cu。
②将Zn、Cu分别加入FeSO4溶液中,实验中可以观察到Cu与FeSO4不反应,说明金属活动性Fe>Cu;可以观察到Zn可以与FeSO4反应,说明金属活动性Zn>Fe,可得出金属活动性Zn>Fe>Cu。
③Fe不能与ZnSO4反应,说明金属活动性Zn>Fe;Fe加入Cu(NO3)2溶液中能观察到铁表面有红色固体析出,证明Fe能置换出铜,说明金属活动性Fe>Cu,可得出金属活动性Zn>Fe>Cu。
④Fe、Cu均不能与ZnSO4溶液反应,可以说明金属活动性Zn>Fe,Zn>Cu,无法比较Fe、Cu的金属活动性。
故①②③能验证Zn、Fe、Cu三种金属活动性强弱。
故选:B。
【点评】本题难度不大,考查金属活动性应用,明确金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
5.(2025 乌鲁木齐模拟)现有甲、乙、丙三种金属,为探究其金属活动性顺序,进行了如下实验:①将甲和丙分别放入稀盐酸中,甲溶解并产生氢气,丙不反应;②将乙和丙分别放入硝酸银溶液中,过一会儿,在丙表面有银析出,而乙没有变化,则甲、乙、丙的金属活动性顺序正确的是( )
A.甲>乙>丙 B.甲>丙>乙 C.乙>甲>丙 D.丙>甲>乙
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】A
【分析】根据金属活动性顺序的意义进行分析,在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来。
【解答】解:由题意可知,把甲和乙分别放入稀硫酸中,甲溶解并产生氢气,而乙不反应,说明金属的活动性强弱是:甲>H>乙,把乙和丙分别放入硝酸银溶液中,过一会儿,在乙表面有银析出,而丙没有变化,说明乙>Ag>丙,所以甲、乙、丙的活动性为:甲>乙>丙;
故选:A。
【点评】与酸反应剧烈,金属活动性越强,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来。
6.(2025春 青岛月考)为深入研究金属活动性顺序及其应用,某同学设计如图实验,观察到乙装置中铜片表面有气泡且电流计指针发生偏转。下列说法不正确的是( )
A.根据甲装置,可以比较金属活动性顺序:Zn>Cu
B.乙中电流计指针偏转说明化学能可以转变为电能
C.乙中锌片是负极,溶液的氢离子移向锌片
D.甲、乙对比分析,Zn﹣Cu用导线连接,反应时电子由Zn片经导线流向Cu片
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】C
【分析】A、根据锌能和硫酸反应,但铜不能和硫酸反应分析;
B、根据乙中电流计指针偏转,说明有电流产生分析;
C、根据锌和硫酸反应生成硫酸锌和氢气分析;
D、根据反应时电子由Zn片经导线流向Cu片分析。
【解答】解:A、锌能和硫酸反应,但铜不能和硫酸反应,则说明锌比铜活泼,故正确;
B、乙中电流计指针偏转,说明有电流产生,即化学能可以转变为电能,故正确;
C、锌和硫酸反应生成硫酸锌和氢气,锌单质中锌为0价,但硫酸锌中锌化合价为+2价,反应过程中化合价升高,则反应过程中锌失去电子,电子由锌片移向铜片,则电流由铜片移向锌片,则锌为负极,但溶液中的氢离子会移向铜片,从而得到电子,故不正确;
D、结合前面分析可知,反应时电子由Zn片经导线流向Cu片,故正确。
故选:C。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
7.(2025 沂源县一模)为验证锌、铁、铜三种金属的活动性顺序,某化学兴趣小组的同学设计了如图所示的三个实验。下列说法中正确的是( )
A.实验①②能验证锌的金属活动性比铜的强
B.实验①中溶液质量减小,实验③中溶液的质量变大
C.实验②③可验证的金属活动性顺序:Fe>H>Cu
D.只做实验①和③,就能验证锌、铁、铜的金属活动性顺序
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】A
【分析】根据在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,进行分析判断。
【解答】解:A.实验①中会产生气泡,说明锌能与稀硫酸反应,则在金属活动性顺序中锌的位置排在氢之前;同理,由实验②可得,在金属活动性顺序中的位置排在氢之后;则通过实验①②能验证锌的金属活动性比铜的强,故选项说法正确;
B.实验①中铁与稀硫酸反应生成硫酸亚铁和氢气,反应方程式为Fe+H2SO4=FeSO4+H2↑,有56份质量的铁进入溶液,放出2份质量的气体,因此溶液质量增大;实验③中铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为Fe+CuSO4═FeSO4+Cu,每56份质量的铁反应能置换出64份质量的铜,则反应后溶液质量减小,故选项说法错误;
C.实验②③可验证的金属活动性顺序:Fe>Cu,但无法验证铁在氢前面还是在氢后面,故选项说法错误;
D.做实验①和③,能验证Fe>Cu,但无法验证锌、铁的金属活动性顺序,故选项说法错误;
故选:A。
【点评】本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
8.(2025 天津校级模拟)有X、Y、Z三种金属,分别浸入H2SO4中,只有X金属溶解,将Z金属浸入Y的硫酸盐溶液时,在Z的表面有Y析出。则X、Y、Z的金属活动性由强到弱的顺序是( )
A.Y>Z>X B.X>Y>Z C.Z>X>Y D.X>Z>Y
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】D
【分析】根据在金属活动性顺序中,只有排在氢前面的金属才能和酸反应,排在前面的金属能把排在后面的金属从它的盐溶液中置换出来进行分析。
【解答】解:有X、Y、Z三种金属,分别浸入H2SO4中,只有X金属溶解,说明X的金属活动性比Y、Z强;将Z金属浸入Y的硫酸盐溶液时,在Z的表面有Y析出,说明Z的活动性比Y强,所以这三种金属的活动性顺序为:X>Z>Y。
故选:D。
【点评】本题主要考查金属活动性顺序的应用,金属活动性顺序的应用主要表现在两个方面:一是排在氢前面的金属能和酸反应生成氢气(位置越靠前,反应越剧烈),二是排在前面的金属能将排在后面的金属从它的盐溶液中置换出来。
9.(2025 梁山县一模)为验证铜、银、铁的金属活动性顺序,同学们设计了如图所示的6个实验。图中“→”表示将金属加入到盐溶液。下列说法不正确的是( )
A.实验②的目的是验证铜、银的金属活动性顺序
B.仅由④和⑥就能得出铜、银、铁的金属活动性顺序
C.铁在⑤和⑥反应的产物中都显+2价
D.仅由①和②就能得出铜、银、铁的金属活动性顺序
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】B
【分析】A、根据铜和硝酸银反应生成硝酸铜和银来分析;
B、根据银和硫酸铜不反应,铁和硝酸银反应生成硝酸亚铁和银来分析;
C、根据铁和硫酸铜反应生成硫酸亚铁和铜,铁和硝酸银反应生成硝酸亚铁和银来分析;
D、根据铜和硫酸亚铁不反应,铜和硝酸银反应生成硝酸铜和银来分析。
【解答】解:A、实验②中铜和硝酸银反应生成硝酸铜和银,说明铜的金属活动性强于银,故选项说法正确。
B、实验④中银和硫酸铜不反应,说明铜的金属活动性强于银,实验⑥中铁和硝酸银反应生成硝酸亚铁和银,说明铁的金属活动性强于银,实验④和⑥只能得出铜、铁的金属活动性都强于银,不能比较铜、铁的金属活动性强弱,故选项说法不正确。
C、实验⑤中铁和硫酸铜反应生成硫酸亚铁和铜,实验⑥中铁和硝酸银反应生成硝酸亚铁和银,铁在⑤和⑥反应的产物中都显+2价,故选项说法正确。
D、实验①中铜和硫酸亚铁不反应,说明铁的金属活动性强于铜,实验②中铜和硝酸银反应生成硝酸铜和银,说明铜的金属活动性强于银,仅由①和②就能得出铜、银、铁的金属活动性顺序为:铁>铜>银,故选项说法正确。
故选:B。
【点评】本题主要考查金属活动性顺序的应用,理解在金属活动性顺序中,排在前面的金属能将排在后面的金属从它的盐溶液中置换出来是解题关键。
10.(2025 栾城区校级一模)人类开发利用金属的时间和金属的活动性有关。为探究金属的活动性强弱,用如图实验进行探究。下列说法不正确的是( )
A.实验前需要打磨金属片,除去表面的氧化膜
B.若用稀盐酸能比较两金属的活动性,则只有金属片X表面产生气泡
C.若将铜片放入X的盐溶液,则能比较出X与铜的金属活动性
D.若X为Zn,向两支试管加入AgNO3溶液,能得出金属活动性:Zn>Cu>Ag
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】D
【分析】根据在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,进行分析判断。
【解答】解:A、实验前需要打磨金属片,是为了除去表面的氧化膜,从而防止氧化膜阻碍反应的进行,故不符合题意;
B、铜不和稀盐酸反应,若用稀盐酸能比较两金属的活动性,则只有金属片X表面产生气泡,故不符合题意;
C、若将铜片放入X的盐溶液,无明显现象,说明铜不与X溶液反应,即铜的活动性比X弱,能比较出X与铜的金属活动性,故不符合题意;
D、若向甲、乙试管加入AgNO3溶液,锌和铜都能与硝酸银反应置换出银,能得出金属的活动性:Zn>Ag,Cu>Ag,但无法比较锌和铜的金属活动性,故符合题意。
故选:D。
【点评】本题难度不大,考查金属活动性应用,明确金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
二.填空题(共8小题)
11.(2025 咸阳一模)金属的发现和使用推动了人类社会发展。部分金属的发现历程如图所示,请根据要求回答下列问题。
(1)据图分析,金属的发现的先后与金属的 活动性 有关。
(2)铝被广泛地应用于生产和生活之中,除了因为改进铝的冶炼方法使其成本降低,以及铝的密度小外,还由于铝具有较好的 抗腐蚀 性。
(3)老师提供了氯化铝溶液和硫酸铜溶液,让同学们验证铜、铁、铝三种金属的活动性顺序,他们选择了一种金属,通过实验得出了正确的结论。请你结合他们选择的金属,写出实验时发生反应的化学方程式: Fe+CuSO4=FeSO4+Cu 。
【考点】金属活动性强弱的判断;金属的物理性质及用途.
【专题】金属与金属材料.
【答案】(1)活动性;
(2)抗腐蚀;
(3)Fe+CuSO4=FeSO4+Cu。
【分析】(1)观察金属发现和冶炼历程图,分析不同金属被发现和冶炼的时间与金属自身性质之间的联系,从而确定金属的发现和冶炼历程与金属的何种性质有关。
(2)根据合金的特点分析。
(3)验证金属的活动性顺序是否合理,可根据“反应则活泼,不反应则不活泼”进行分析判断。
【解答】解:(1)金属的活动性:Al>Fe>Cu,由图可知金属的发现历程是:铜最早、然后是铁、最后是铝,说明金属的发现先后与金属的活动性有关;
(2)铝在常温下能与空气中的氧气反应生成一层致密的氧化铝薄膜,能阻止内部金属进一步被氧化,因此铝还具有较好的抗腐蚀性;
(3)验证铜、铁、铝三种金属的活动性顺序,可用氯化铝溶液和硫酸铜溶液分别与铁进行实验,铁与氯化铝不反应,说明金属活动性Al>Fe,铁与硫酸铜反应生成铜和硫酸亚铁,说明金属活动性Fe>Cu,由此可得三种金属的活动性顺序为Al>Fe>Cu,则发生反应的化学方程式为Fe+CuSO4=FeSO4+Cu。
故答案为:(1)活动性;
(2)抗腐蚀;
(3)Fe+CuSO4=FeSO4+Cu。
【点评】本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,强调了学生整合基本化学知识的能力。
12.(2025 碑林区校级三模)“卧薪尝胆,三千越甲可吞吴”这句话传颂的是春秋时期越王勾践的励志故事,他的宝剑——越王勾践剑被称为天下第一剑。检测数据显示剑身主要含有铜、锡(Sn),另外含有少量铁、铝。
(1)越王勾践剑剑身材料与纯铜相比,具有硬度 大 (填“大”或“小”)的优良性能。
(2)越王勾践剑在出土时剑身未被腐蚀的原因之一是剑身与剑鞘之间的吻合度极高,有效隔绝了剑身与 氧气、水 的直接接触。
(3)将打磨过的铜片、铁片、铝片分别插入稀盐酸中,写出其中一种金属与稀盐酸反应的化学方程式: Fe+2HCl=FeCl2+H2↑ 。
(4)为验证铜、铁、铝的金属活动性顺序,以下方案中所选试剂不能达到目的的是 AD (多选,填字母)。
A.稀硫酸、铜片、硫酸亚铁溶液
B.铜片、硫酸亚铁溶液、铝片
C.铁片、硫酸铜溶液、硫酸铝溶液
D.铜片、铁片、硫酸铝溶液
【考点】金属活动性强弱的判断;合金与合金的性质;金属与氧气的反应;金属与酸的反应原理.
【专题】金属与金属材料.
【答案】(1)大;
(2)氧气、水;
(3)Fe+2HCl=FeCl2+H2↑;
(4)AD。
【分析】(1)根据合金的硬度比组成合金的纯金属的硬度大来分析;
(2)根据金属与氧气、水直接接触易锈蚀来分析;
(3)根据铜和稀盐酸不反应,铁和盐酸反应生成氯化亚铁和氢气,铝和盐酸反应生成氯化铝和氢气来分析;
(4)根据在金属活动性顺序中,只有排在氢前面的金属才能和酸反应,排在前面的金属能把排在后面的金属从它的盐溶液中置换出来来分析。
【解答】解:(1)合金的硬度比组成合金的纯金属的硬度大,越王勾践剑剑身材料(剑身主要含有铜、锡,另外含有少量铁、铝)与纯铜相比,具有硬度大的优良性能。
(2)越王勾践剑在出土时剑身未被腐蚀的原因之一是剑身与剑鞘之间的吻合度极高,有效隔绝了剑身与氧气、水的直接接触。
(3)将打磨过的铜片、铁片、铝片分别插入稀盐酸中,铜和稀盐酸不反应,铁和盐酸反应生成氯化亚铁和氢气,铝和盐酸反应生成氯化铝和氢气,反应的化学方程式分别为:Fe+2HCl=FeCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑。
(4)A、铜片和稀硫酸、硫酸亚铁溶液都不反应,无法验证铜、铁、铝的金属活动性顺序,故选项符合题意;
B、铜片和硫酸亚铁溶液不反应,说明金属活动性铁>铜,铝片和硫酸亚铁溶液反应生成硫酸铝和铁,说明金属活动性铝>铁,能验证铜、铁、铝的金属活动性顺序为:铝>铁>铜,故选项不符合题意;
C、铁片和硫酸铜溶液反应生成硫酸亚铁和铜,说明金属活动性铁>铜,铁片和硫酸铝溶液不反应,说明金属活动性铝>铁,能验证铜、铁、铝的金属活动性顺序为:铝>铁>铜,故选项不符合题意;
D、铜片、铁片都不能和硫酸铝溶液反应,无法验证铜、铁、铝的金属活动性顺序,故选项符合题意;
故选项:AD。
故答案为:
(1)大;
(2)氧气、水;
(3)Fe+2HCl=FeCl2+H2↑;
(4)AD。
【点评】本题主要考查了物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
13.(2025春 莆田校级期中)“福建舰”解缆启航,标志着我国航空母舰建设迈向新征程。
Ⅰ.航母建造
(1)航母建造需使用纯铜、钢铁、铝合金等。
①航母电缆用纯铜制作,主要利用铜的延展性和 导电 性。
②航母在建造过程中大量使用特种钢。建造过程中用该特种钢不用纯铁的原因是 抗腐蚀性更强(答案不唯一) 。
③航母内部大量使用Al、Fe、Cu三种金属材料或其合金的设备。可以选用稀盐酸对三种金属的活动性顺序进行探究。写出其中一个能与稀盐酸反应的化学方程式 2Al+6HCl=2AlCl3+3H2↑或Fe+2HCl=FeCl2+H2↑ ,该反应所属的基本反应类型是 置换反应 。请选择其他合适的试剂,这三种金属的活动性顺序进行探究,能达到目的的是 Al、FeSO4溶液
、Cu(答案不唯一) 。
Ⅱ.能源供给
(2)航母动力由重油(含C18H18等多种成分)燃烧提供。其充分燃烧后产物有 CO2、H2O (填化学式)。
(3)通讯工具使用的锂电池,工作时能量转化的主要方式为 化学能转化为电能 。
【考点】金属活动性强弱的判断;物质发生化学变化时的能量变化;金属的物理性质及用途;合金与合金的性质.
【专题】金属与金属材料.
【答案】(1)①导电;
②抗腐蚀性更强(答案不唯一);
③2Al+6HCl=2AlCl3+3H2↑或Fe+2HCl=FeCl2+H2↑;置换反应;Al、FeSO4溶液、Cu(答案不唯一);
(2)CO2、H2O;
(3)化学能转化为电能。
【分析】(1)①根据金属的性质分析;
②根据合金的特点分析;
③根据铝和盐酸反应生成氯化铝和氢气,铁和盐酸反应生成氯化亚铁和氢气分析;
(2)根据质量守恒定律分析;
(3)根据化学变化中的能量变化分析。
【解答】解:(1)①铜可作电缆,主要利用了铜的延展性和导电性。
②一般,合金的硬度比其组成的纯金属的硬度大、耐腐蚀性强,钢和生铁是常见的铁合金,则航母在建造过程中大量使用特种钢,是因为该特种钢的耐腐蚀性能比纯铁的好、硬度比纯铁大等。
③在金属活动性顺序中,铝、铁位于氢元素前面,则均能和盐酸反应,其中铝和盐酸反应生成氯化铝和氢气,反应的化学方程式为:2Al+6HCl=2AlCl3+3H2↑、铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑;
该反应为一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;
铝能和硫酸亚铁反应,但铜不能和硫酸亚铁反应,则可选用铝、硫酸亚铁、铜验证这三种金属的活动性顺序。
(2)反应前后元素种类不变,则重油充分燃烧后的产物有CO2、H2O。
(3)电池工作时,化学能转化为电能。
故答案为:(1)①导电;
②抗腐蚀性更强(答案不唯一);
③2Al+6HCl=2AlCl3+3H2↑或Fe+2HCl=FeCl2+H2↑;置换反应;Al、FeSO4溶液、Cu(答案不唯一);
(2)CO2、H2O;
(3)化学能转化为电能。
【点评】本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,强调了学生整合基本化学知识的能力。
14.(2025 灞桥区校级模拟)金属材料在人类的生产生活中有着广泛的应用。
【实验1】设计如图实验,验证金属活动性顺序表中Fe、Cu、Ag三种金属与H的位置关系。
(1)为达到实验目的,C实验中X溶液可以选择下列中的 AC (填字母)。
A.FeSO4溶液
B.CuSO4溶液
C.稀硫酸
(2)写出B试管中发生反应的化学方程式: Cu+2AgNO3=Cu(NO3)2+2Ag 。
【实验2】在实验室中,把一定量铁粉加入到一定量的Zn(NO3)2、Cu(NO3)2、AgNO3的混合溶液中,请根据下图中的信息回答相关问题:
(3)滤液A中一定存在的金属阳离子是 Fe2+、Zn2+ (填离子符号)。
(4)向滤渣B中滴加稀盐酸时,还能观察到溶液由无色变为 浅绿 色。
【考点】金属活动性强弱的判断;金属与盐溶液反应的原理.
【专题】金属与金属材料.
【答案】(1)AC;
(2)Cu+2AgNO3=Cu(NO3)2+2Ag;
(3)Fe2+、Zn2+;
(4)浅绿。
【分析】(1)根据金属的的活动性分析;
(2)根据铜和硝酸银反应生成银和硝酸铜分析;
(3)根据铁、银、铜三者的金属活动性顺序为锌>铁>铜>银,往硝酸银、硝酸锌和硝酸铜的混合溶液中加入一定量的铁粉,先置换最弱的金属银,然后再置换较强的铜,铁与硝酸锌不反应分析;
(4)根据铁和稀盐酸反应生成氯化亚铁和氢气分析。
【解答】解:(1)为达到实验目的,C实验中X溶液可以选择下列中的FeSO4溶液(铜不能和硫酸亚铁反应,说明铁比铜活泼)、H2SO4溶液(铁能和稀硫酸反应,铜不能和稀硫酸反应,说明铁比铜活泼),故答案为:AC;
(2)B实验中发生反应是铜和硝酸银反应生成银和硝酸铜,反应的化学方程式为Cu+2AgNO3=Cu(NO3)2+2Ag;
(3)铁、银、铜三者的金属活动性顺序为锌>铁>铜>银,往硝酸银、硝酸锌和硝酸铜的混合溶液中加入一定量的铁粉,先置换最弱的金属银,然后再置换较强的铜,铁与硝酸锌不反应。由以上分析可知,滤液A中一定含有:硝酸锌、硝酸亚铁,可能有硝酸银、硝酸铜,所以一定含有的金属阳离子是:Fe2+、Zn2+;
(4)向滤渣B中滴加稀盐酸后,有气体生成,说明是铁和稀盐酸反应生成氯化亚铁和氢气,所以现象还有:溶液由无色变为变成浅绿色。
故答案为:(1)AC;
(2)Cu+2AgNO3=Cu(NO3)2+2Ag;
(3)Fe2+、Zn2+;
(4)浅绿。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
15.(2025 乾县校级三模)金属在生产和生活中应用极为广泛。
(1)下列生活用品利用金属良好导热性的是 B (填字母)。
A.镀铬水龙头
B.铸铁暖气片
C.包糖果的铝箔
(2)铝制品耐腐蚀的原因是 4Al+3O2=2Al2O3 (用化学方程式解释)。
(3)镍(Ni)广泛用于合金的制造,这与其化学性质密切相关。为探究它的活动性,向镍(Ni)中加入足量的稀硫酸,观察到有气泡产生,溶液变为绿色(Ni2+)。结合上述实验事实,限用一种试剂对Ni、Cu、Ag三种金属的活动性强弱进行验证,则该试剂是 B (填字母)。
A.稀硫酸
B.CuSO4溶液
C.NiCl2溶液
D.AgNO3溶液
【考点】金属活动性强弱的判断;金属的物理性质及用途;金属与氧气的反应.
【专题】金属与金属材料.
【答案】(1)B;
(2)4Al+3O2=2Al2O3;
(3)B。
【分析】(1)根据金属的性质与用途分析;
(2)根据铝在常温下能与空气中的氧气发生反应分析;
(3)验证三种金属活动性强弱时,通常采取“三取中”的方法,即取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应。
【解答】解:(1)A、镀铬水龙头更耐腐,不符合题意;
B、铸铁暖气片利用铁有良好的导热性,符合题意;
C、包糖果的铝箔:主要利用了铝的延展性,不符合题意。
故选B;
(2)铝在常温下能与空气中的氧气发生反应,在其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化。该反应的化学方程式为:4Al+3O2=2Al2O3;
(3)已知向镍(Ni)中加入足量的稀硫酸,观察到有气泡产生,说明Ni的活动性在H之前,Ni>H;
A、稀硫酸只能验证出Ni比H活泼,不能与Cu、Ag反应,无法比较Cu和Ag的活动性,不符合题意;
B、CuSO4溶液:将Ni放入CuSO4溶液中,如果Ni表面有红色物质析出,说明Ni能置换出Cu,即Ni>Cu;将Ag放入CuSO4溶液中,无明显现象,说明Cu>Ag,从而可以验证Ni>Cu>Ag,符合题意;
C、将Cu和Ag分别放入NiCl2溶液中,都无明显现象,只能说明Ni比Cu和Ag活泼,但无法比较Cu和Ag的活动性,不符合题意;
D、Ni和Cu都能与AgNO3溶液反应,说明Ni和Cu都比Ag活泼,但无法比较Ni和Cu的活动性,不符合题意。
故选B。
故答案为:
(1)B;
(2)4Al+3O2=2Al2O3;
(3)B。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
16.(2025 牡丹江模拟)金属材料在日常生活、工农业生产中有广泛应用,结合所学知识回答下列问题:
(1)铜块能制成铜丝是利用了铜的 延展 性。
(2)青铜是人类最早使用的铜锡合金,下列说法不正确的是 B (填字母序号)。
A.青铜属于金属材料
B.铜的硬度比青铜大
C.青铜耐腐蚀
(3)为了探究X、Y、Z三种金属的活动性顺序,某小组同学做了以下三个实验:
①将X放入Y的盐溶液中,有Y固体析出
②将X放入Z的盐溶液中,有Z固体析出
③将Y放入Z的盐溶液中,有Z固体析出
经过讨论,实验 ② (填数字序号)是多余的,可得出三种金属的活动性顺序为 X>Y>Z 。
(4)将一定量的锌粉加入到硝酸镁和硝酸铜的混合液中,充分反应后过滤,得到滤渣和滤液。下列判断正确的是 D 。
A.若滤液为蓝色,则滤渣中一定有锌、镁、铜
B.若向滤渣中加入稀盐酸有气泡产生,则滤液中一定有硝酸镁、硝酸锌、硝酸铜
C.若向滤液中加入氢氧化钠溶液,则一定有氢氧化铜生成
D.滤渣中一定含有铜,滤液中一定含有硝酸镁和硝酸锌
【考点】金属活动性强弱的判断;金属的物理性质及用途;合金与合金的性质;金属与盐溶液反应的原理.
【专题】金属与金属材料.
【答案】(1)延展;
(2)B;
(3)②;X>Y>Z;
(4)D。
【分析】(1)根据铜具有延展性,能制成铜丝来分析;
(2)A、根据金属材料包括纯金属及其合金来分析;
B、根据合金的硬度比组成合金的纯金属的硬度大来分析;
C、根据合金的耐腐蚀性能好来分析;
(3)根据在金属活动性顺序中,排在前面的金属能把排在后面的金属从它的盐溶液中置换出来来分析;
(4)根据锌的金属活动性比铜强,比镁弱,将一定量的锌粉加入到硝酸镁和硝酸铜的混合液中,锌不能与Mg(NO3)2溶液反应,锌能与Cu(NO3)2反应生成硝酸锌和铜来分析。
【解答】解:(1)铜块能制成铜丝是利用了铜的延展性。
(2)A、金属材料包括纯金属及其合金,青铜是铜锡合金,属于金属材料,故选项说法正确;
B、合金的硬度比组成合金的纯金属的硬度大,则青铜的硬度比铜大,故选项说法不正确;
C、合金的耐腐蚀性能好,青铜是铜锡合金,则青铜耐腐蚀,故选项说法正确;
故选:B。
(3)①将X放入Y的盐溶液中,有Y固体析出,说明X的活动性比Y强;
②将X放入Z的盐溶液中,有Z固体析出,说明X的活动性比Z强;
③将Y放入Z的盐溶液中,有Z固体析出,说明Y的活动性比Z强;
经过讨论,实验②是多余的,由实验①③可得出三种金属的活动性顺序为:X>Y>Z。
(4)A、锌的金属活动性比铜强,比镁弱,将一定量的锌粉加入到硝酸镁和硝酸铜的混合液中,锌不能与Mg(NO3)2溶液反应,锌能与Cu(NO3)2反应生成硝酸锌和铜;若滤液为蓝色,说明滤液中含有硝酸铜,则滤渣中一定有铜,一定没有锌、镁,故选项说法错误;
B、若向滤渣中加入稀盐酸有气泡产生,说明锌是过量的,则滤液中一定有硝酸镁、硝酸锌,一定不含硝酸铜,故选项说法错误;
C、滤液中一定含有硝酸镁、硝酸锌,可能含有硝酸铜,若向滤液中加入氢氧化钠溶液,则会观察到产生白色沉淀,可能同时产生蓝色沉淀,故选项说法错误;
D、一定发生了锌和硝酸铜的反应,无法确定反应进行的程度,则滤渣中一定含有铜,滤液中一定含有硝酸镁和硝酸锌,故选项说法正确;
故选:D。
故答案为:
(1)延展;
(2)B;
(3)②;X>Y>Z;
(4)D。
【点评】本题主要考查金属活动性顺序的应用,金属活动性顺序的应用主要表现在两个方面:一是排在氢前面的金属能和酸反应生成氢气(位置越靠前,反应越剧烈),二是排在前面的金属能将排在后面的金属从它的盐溶液中置换出来。
17.(2025 舒城县模拟)《梦溪笔谈》是北宋科学家、政治家沈括撰写的一部涉及古代中国自然科学、工艺技术及社会历史现象的综合性笔记体著作。该著作中“古人以剂钢为刃,柔铁为茎干,不尔则多断折”“熬胆矾铁釜,久之亦化为铜”记录了古代铁器生产、使用的情形。请回答有关问题。
(1)剂钢指的是一种高碳钢,质地坚硬但很脆,柔铁则是一种低碳钢,质地坚韧但无钢性。生铁和钢主要含铁和碳,生铁的含碳量比钢 高 (填“高”或“低”),钢的硬度比纯铁 大 (填“大”或“小”)。
(2)人类对铁的利用比铜晚了1500多年,这是因为铁的金属活动性比铜 强 (填“强”或“弱”)。已知胆矾溶于水得到硫酸铜溶液,请用化学方程式解释“熬胆矾铁釜,久之亦化为铜”的原因: Fe+CuSO4=FeSO4+Cu 。
【考点】金属活动性强弱的判断;生铁和钢;金属与盐溶液反应的原理.
【专题】金属与金属材料.
【答案】(1)高;大;
(2)强;Fe+CuSO4=FeSO4+Cu。
【分析】(1)根据生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%,以及合金的硬度比组成合金的纯金属的硬度大来分析;
(2)根据铁的金属活动性比铜强,铁比铜更难从其化合物中还原出来,以及铁和硫酸铜反应生成硫酸亚铁和铜来分析。
【解答】解:(1)生铁和钢主要含铁和碳,生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%,则生铁的含碳量比钢高;合金的硬度比组成合金的纯金属的硬度大,则钢的硬度比纯铁大。
(2)人类对铁的利用比铜晚了1500多年,这是因为铁的金属活动性比铜强,铁比铜更难从其化合物中还原出来;“熬胆矾铁釜,久之亦化为铜”的原理是铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu。
故答案为:
(1)高;大;
(2)强;Fe+CuSO4=FeSO4+Cu。
【点评】本题主要考查了生铁和钢的性质和金属活动性的应用,难度不大,根据所学知识,结合题中信息,认真分析即可解答。
18.(2025 宁江区一模)《梦溪笔谈》中“古人以剂钢为刃,柔铁为茎干”“熬胆矾铁釜,久之亦化为铜“记录了古代铁器生产、使用的情形。回答问题:
(1)炼铁的原理是利用CO与Fe2O3的反应。Fe2O3中Fe的化合价为 +3 。
(2)“剂钢”指的是合金钢,钢的硬度比纯铁的 大 (选填“大”或“小”)。
(3)人类对铁的利用比铜晚了1500多年,这是因为铁的金属活动性比铜的 强 (填选“强”或“弱”)。已知胆矾溶于水得到硫酸铜溶液,请用化学方程式解释“熬胆矾铁釜,久之亦化为铜”的原因: Fe+CuSO4=FeSO4+Cu 。
【考点】金属活动性强弱的判断;有关元素化合价的计算;合金与合金的性质;金属与盐溶液反应的原理.
【专题】金属与金属材料.
【答案】(1)+3;
(2)大;
(3)强;Fe+CuSO4=FeSO4+Cu。
【分析】(1)根据化合物中各元素正负化合价的代数和为零来分析;
(2)根据合金的硬度比组成合金的纯金属的硬度大来分析;
(3)根据铁的金属活动性比铜强,铁比铜更难从其化合物中还原出来,以及铁和硫酸铜反应生成硫酸亚铁和铜来分析。
【解答】解:(1)Fe2O3中氧元素的化合价为﹣2,设铁元素的化合价是x,根据化合物中各元素正负化合价的代数和为零,则2x+(﹣2)x3=0,解得x﹣+3,所以Fe2O3中铁元素的化合价为+3。
(2)合金的硬度比组成合金的纯金属的硬度大,钢是铁的合金,其硬度比纯铁的大。
(3)人类对铁的利用比铜晚了1500多年,这是因为铁的金属活动性比铜强,铁比铜更难从其化合物中还原出来;“熬胆矾铁釜,久之亦化为铜”的原理是铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu。
故答案为:
(1)+3;
(2)大;
(3)强;Fe+CuSO4=FeSO4+Cu。
【点评】本题主要考查了化合价原则、合金的性质以及金属的活动性,难度不大,根据所学知识,结合题中信息,认真分析即可解答。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
中考核心考点 金属活动性顺序及应用
一.选择题(共10小题)
1.(2025 北碚区模拟)化学兴趣小组利用置换反应来判断Fe、M、N三种金属的活动性顺序,设计了下图所示的5种方案。下列说法正确的是( )
A.若方案①能反应,则方案③一定能反应
B.仅凭方案②,无法确定N与Fe的活动性顺序
C.结合方案④、⑤,一定能够判断M和N的活动性
D.若方案②、④均不能反应,则活动性:N>Fe>M
2.(2025 碑林区三模)现欲探究铝、铁的金属活动性顺序,下列实验方案能得出两种金属的活动性顺序的是( )
A.将铝片和铁片分别放入等体积等浓度的稀盐酸中,观察反应剧烈程度
B.将铝片和铁片分别放入蒸馏水中,观察是否有气泡产生
C.将铝片和铁片分别放入等体积等浓度的氢氧化钠溶液中,观察是否有气体产生
D.将铝片和铁片分别放入等体积等浓度的硫酸铜溶液中,观察是否有红色固体析出
3.(2025 北京校级模拟)下列实验组合中,能得出铝、铜、银的金属活动性顺序的是( )
A.①④ B.②④ C.③④ D.①③
4.(2025 银川一模)下列各组合能验证Zn、Fe、Cu三种金属活动性强弱的是( )
①稀盐酸、锌粉、铁粉、铜粉
②Zn、FeSO4溶液、Cu
③ZnSO4溶液、Fe、Cu(NO3)2溶液
④ZnSO4溶液、Fe、Cu
A.①④ B.①②③ C.①③④ D.①②③④
5.(2025 乌鲁木齐模拟)现有甲、乙、丙三种金属,为探究其金属活动性顺序,进行了如下实验:①将甲和丙分别放入稀盐酸中,甲溶解并产生氢气,丙不反应;②将乙和丙分别放入硝酸银溶液中,过一会儿,在丙表面有银析出,而乙没有变化,则甲、乙、丙的金属活动性顺序正确的是( )
A.甲>乙>丙 B.甲>丙>乙 C.乙>甲>丙 D.丙>甲>乙
6.(2025春 青岛月考)为深入研究金属活动性顺序及其应用,某同学设计如图实验,观察到乙装置中铜片表面有气泡且电流计指针发生偏转。下列说法不正确的是( )
A.根据甲装置,可以比较金属活动性顺序:Zn>Cu
B.乙中电流计指针偏转说明化学能可以转变为电能
C.乙中锌片是负极,溶液的氢离子移向锌片
D.甲、乙对比分析,Zn﹣Cu用导线连接,反应时电子由Zn片经导线流向Cu片
7.(2025 沂源县一模)为验证锌、铁、铜三种金属的活动性顺序,某化学兴趣小组的同学设计了如图所示的三个实验。下列说法中正确的是( )
A.实验①②能验证锌的金属活动性比铜的强
B.实验①中溶液质量减小,实验③中溶液的质量变大
C.实验②③可验证的金属活动性顺序:Fe>H>Cu
D.只做实验①和③,就能验证锌、铁、铜的金属活动性顺序
8.(2025 天津校级模拟)有X、Y、Z三种金属,分别浸入H2SO4中,只有X金属溶解,将Z金属浸入Y的硫酸盐溶液时,在Z的表面有Y析出。则X、Y、Z的金属活动性由强到弱的顺序是( )
A.Y>Z>X B.X>Y>Z C.Z>X>Y D.X>Z>Y
9.(2025 梁山县一模)为验证铜、银、铁的金属活动性顺序,同学们设计了如图所示的6个实验。图中“→”表示将金属加入到盐溶液。下列说法不正确的是( )
A.实验②的目的是验证铜、银的金属活动性顺序
B.仅由④和⑥就能得出铜、银、铁的金属活动性顺序
C.铁在⑤和⑥反应的产物中都显+2价
D.仅由①和②就能得出铜、银、铁的金属活动性顺序
10.(2025 栾城区校级一模)人类开发利用金属的时间和金属的活动性有关。为探究金属的活动性强弱,用如图实验进行探究。下列说法不正确的是( )
A.实验前需要打磨金属片,除去表面的氧化膜
B.若用稀盐酸能比较两金属的活动性,则只有金属片X表面产生气泡
C.若将铜片放入X的盐溶液,则能比较出X与铜的金属活动性
D.若X为Zn,向两支试管加入AgNO3溶液,能得出金属活动性:Zn>Cu>Ag
二.填空题(共8小题)
11.(2025 咸阳一模)金属的发现和使用推动了人类社会发展。部分金属的发现历程如图所示,请根据要求回答下列问题。
(1)据图分析,金属的发现的先后与金属的 有关。
(2)铝被广泛地应用于生产和生活之中,除了因为改进铝的冶炼方法使其成本降低,以及铝的密度小外,还由于铝具有较好的 性。
(3)老师提供了氯化铝溶液和硫酸铜溶液,让同学们验证铜、铁、铝三种金属的活动性顺序,他们选择了一种金属,通过实验得出了正确的结论。请你结合他们选择的金属,写出实验时发生反应的化学方程式: 。
12.(2025 碑林区校级三模)“卧薪尝胆,三千越甲可吞吴”这句话传颂的是春秋时期越王勾践的励志故事,他的宝剑——越王勾践剑被称为天下第一剑。检测数据显示剑身主要含有铜、锡(Sn),另外含有少量铁、铝。
(1)越王勾践剑剑身材料与纯铜相比,具有硬度 (填“大”或“小”)的优良性能。
(2)越王勾践剑在出土时剑身未被腐蚀的原因之一是剑身与剑鞘之间的吻合度极高,有效隔绝了剑身与 的直接接触。
(3)将打磨过的铜片、铁片、铝片分别插入稀盐酸中,写出其中一种金属与稀盐酸反应的化学方程式: 。
(4)为验证铜、铁、铝的金属活动性顺序,以下方案中所选试剂不能达到目的的是 (多选,填字母)。
A.稀硫酸、铜片、硫酸亚铁溶液
B.铜片、硫酸亚铁溶液、铝片
C.铁片、硫酸铜溶液、硫酸铝溶液
D.铜片、铁片、硫酸铝溶液
13.(2025春 莆田校级期中)“福建舰”解缆启航,标志着我国航空母舰建设迈向新征程。
Ⅰ.航母建造
(1)航母建造需使用纯铜、钢铁、铝合金等。
①航母电缆用纯铜制作,主要利用铜的延展性和 性。
②航母在建造过程中大量使用特种钢。建造过程中用该特种钢不用纯铁的原因是 。
③航母内部大量使用Al、Fe、Cu三种金属材料或其合金的设备。可以选用稀盐酸对三种金属的活动性顺序进行探究。写出其中一个能与稀盐酸反应的化学方程式 ,该反应所属的基本反应类型是 。请选择其他合适的试剂,这三种金属的活动性顺序进行探究,能达到目的的是 。
Ⅱ.能源供给
(2)航母动力由重油(含C18H18等多种成分)燃烧提供。其充分燃烧后产物有 (填化学式)。
(3)通讯工具使用的锂电池,工作时能量转化的主要方式为 。
14.(2025 灞桥区校级模拟)金属材料在人类的生产生活中有着广泛的应用。
【实验1】设计如图实验,验证金属活动性顺序表中Fe、Cu、Ag三种金属与H的位置关系。
(1)为达到实验目的,C实验中X溶液可以选择下列中的 (填字母)。
A.FeSO4溶液
B.CuSO4溶液
C.稀硫酸
(2)写出B试管中发生反应的化学方程式: 。
【实验2】在实验室中,把一定量铁粉加入到一定量的Zn(NO3)2、Cu(NO3)2、AgNO3的混合溶液中,请根据下图中的信息回答相关问题:
(3)滤液A中一定存在的金属阳离子是 (填离子符号)。
(4)向滤渣B中滴加稀盐酸时,还能观察到溶液由无色变为 色。
15.(2025 乾县校级三模)金属在生产和生活中应用极为广泛。
(1)下列生活用品利用金属良好导热性的是 (填字母)。
A.镀铬水龙头
B.铸铁暖气片
C.包糖果的铝箔
(2)铝制品耐腐蚀的原因是 (用化学方程式解释)。
(3)镍(Ni)广泛用于合金的制造,这与其化学性质密切相关。为探究它的活动性,向镍(Ni)中加入足量的稀硫酸,观察到有气泡产生,溶液变为绿色(Ni2+)。结合上述实验事实,限用一种试剂对Ni、Cu、Ag三种金属的活动性强弱进行验证,则该试剂是 (填字母)。
A.稀硫酸
B.CuSO4溶液
C.NiCl2溶液
D.AgNO3溶液
16.(2025 牡丹江模拟)金属材料在日常生活、工农业生产中有广泛应用,结合所学知识回答下列问题:
(1)铜块能制成铜丝是利用了铜的 性。
(2)青铜是人类最早使用的铜锡合金,下列说法不正确的是 (填字母序号)。
A.青铜属于金属材料
B.铜的硬度比青铜大
C.青铜耐腐蚀
(3)为了探究X、Y、Z三种金属的活动性顺序,某小组同学做了以下三个实验:
①将X放入Y的盐溶液中,有Y固体析出
②将X放入Z的盐溶液中,有Z固体析出
③将Y放入Z的盐溶液中,有Z固体析出
经过讨论,实验 (填数字序号)是多余的,可得出三种金属的活动性顺序为 。
(4)将一定量的锌粉加入到硝酸镁和硝酸铜的混合液中,充分反应后过滤,得到滤渣和滤液。下列判断正确的是 。
A.若滤液为蓝色,则滤渣中一定有锌、镁、铜
B.若向滤渣中加入稀盐酸有气泡产生,则滤液中一定有硝酸镁、硝酸锌、硝酸铜
C.若向滤液中加入氢氧化钠溶液,则一定有氢氧化铜生成
D.滤渣中一定含有铜,滤液中一定含有硝酸镁和硝酸锌
17.(2025 舒城县模拟)《梦溪笔谈》是北宋科学家、政治家沈括撰写的一部涉及古代中国自然科学、工艺技术及社会历史现象的综合性笔记体著作。该著作中“古人以剂钢为刃,柔铁为茎干,不尔则多断折”“熬胆矾铁釜,久之亦化为铜”记录了古代铁器生产、使用的情形。请回答有关问题。
(1)剂钢指的是一种高碳钢,质地坚硬但很脆,柔铁则是一种低碳钢,质地坚韧但无钢性。生铁和钢主要含铁和碳,生铁的含碳量比钢 (填“高”或“低”),钢的硬度比纯铁 (填“大”或“小”)。
(2)人类对铁的利用比铜晚了1500多年,这是因为铁的金属活动性比铜 (填“强”或“弱”)。已知胆矾溶于水得到硫酸铜溶液,请用化学方程式解释“熬胆矾铁釜,久之亦化为铜”的原因: 。
18.(2025 宁江区一模)《梦溪笔谈》中“古人以剂钢为刃,柔铁为茎干”“熬胆矾铁釜,久之亦化为铜“记录了古代铁器生产、使用的情形。回答问题:
(1)炼铁的原理是利用CO与Fe2O3的反应。Fe2O3中Fe的化合价为 。
(2)“剂钢”指的是合金钢,钢的硬度比纯铁的 (选填“大”或“小”)。
(3)人类对铁的利用比铜晚了1500多年,这是因为铁的金属活动性比铜的 (填选“强”或“弱”)。已知胆矾溶于水得到硫酸铜溶液,请用化学方程式解释“熬胆矾铁釜,久之亦化为铜”的原因: 。
中考核心考点 金属活动性顺序及应用
参考答案与试题解析
一.选择题(共10小题)
1.(2025 北碚区模拟)化学兴趣小组利用置换反应来判断Fe、M、N三种金属的活动性顺序,设计了下图所示的5种方案。下列说法正确的是( )
A.若方案①能反应,则方案③一定能反应
B.仅凭方案②,无法确定N与Fe的活动性顺序
C.结合方案④、⑤,一定能够判断M和N的活动性
D.若方案②、④均不能反应,则活动性:N>Fe>M
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】D
【分析】根据在金属活动性顺序中,只有排在氢前面的金属才能和酸反应,排在前面的金属能把排在后面的金属从它的盐溶液中置换出来进行分析。
【解答】解:A、若方案①铁能与M的盐溶液反应,说明铁的活动性大于M,但M的活动性不一定比氢强,比如硫酸铜能与铁反应生成铜和硫酸亚铁,但铜不能和稀硫酸反应,所以方案③不一定能反应,故选项错误;
B、方案②为铁与N的盐溶液,如果不能反应,说明N的活动性大于铁,如果能反应,说明铁的活动性大于N;所以仅凭方案②能确定N与铁的活动性顺序,故选项错误;
C、方案⑤为N和硫酸亚铁溶液,若能反应,说明N的活动性大于铁,方案④为M和硫酸亚铁溶液,若能反应,说明M的活动性大于铁;但仅根据这两个方案,若M、N都能与硫酸亚铁反应,无法判断M和N的活动性强弱,故选项错误;
D、方案④为M和硫酸亚铁溶液,若方案④不能反应,说明M的活动性小于Fe,方案②为铁与N的盐溶液,若方案②不能反应,说明N的活动性大于Fe;所以活动性顺序为N>Fe>M,故选项正确;
故选:D。
【点评】在金属活动性顺序中,只有排在氢前面的金属才能和酸反应,排在前面的金属能把排在后面的金属从它的盐溶液中置换出来。
2.(2025 碑林区三模)现欲探究铝、铁的金属活动性顺序,下列实验方案能得出两种金属的活动性顺序的是( )
A.将铝片和铁片分别放入等体积等浓度的稀盐酸中,观察反应剧烈程度
B.将铝片和铁片分别放入蒸馏水中,观察是否有气泡产生
C.将铝片和铁片分别放入等体积等浓度的氢氧化钠溶液中,观察是否有气体产生
D.将铝片和铁片分别放入等体积等浓度的硫酸铜溶液中,观察是否有红色固体析出
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】A
【分析】在金属活动性顺序表中,位于前面的金属能把位于它后面的金属从其盐溶液中置换出来,所以可以根据它们的金属活动性顺序及其应用来进行解答。
【解答】解:A、将铝片和铁片分别放入等体积等浓度的稀盐酸中,金属与酸反应时,反应越剧烈,说明金属的活动性越强。通过观察铝片和铁片与稀盐酸反应的剧烈程度,可以比较出铝和铁的金属活动性顺序,该方案可行,故正确;
B、铝和铁在常温下与蒸馏水都不反应,都不会有气泡产生,所以无法通过该实验比较铝和铁的金属活动性顺序,该方案不可行,故错误;
C、铁与氢氧化钠溶液不反应,铝能与氢氧化钠溶液反应产生氢气,但这只能说明铝能与氢氧化钠溶液发生反应,不能直接比较铝和铁的金属活动性顺序(金属活动性顺序一般是通过金属与酸、盐溶液等反应来比较 ),该方案不可行,故错误;
D、将铝片和铁片分别放入等体积等浓度的硫酸铜溶液中,铝和铁都能置换出硫酸铜溶液中的铜,都有红色固体析出,只能说明铝和铁的活动性都比铜强,但无法比较铝和铁之间的活动性顺序,该方案不可行,故错误;
故选:A。
【点评】本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,强调了学生整合基本化学知识的能力。
3.(2025 北京校级模拟)下列实验组合中,能得出铝、铜、银的金属活动性顺序的是( )
A.①④ B.②④ C.③④ D.①③
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】C
【分析】根据在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,进行分析判断。
【解答】解:根据金属和酸反应、金属和盐反应的条件;
A、①铝丝和稀硫酸反应生成氢气,铝的位置排在氢的前面;④铜丝和硝酸银溶液反应,能置换出银,铜的金属活动性比银强,但无法确定铝和铜的活动性强弱,故选项错误。
B、②铜和稀硫酸不反应,铜的位置排在氢的后面;④铜丝和硝酸银溶液反应,能置换出银,铜的金属活动性比银强,但无法确定铝和铜的活动性强弱,故选项错误。
C、③铝丝和硫酸铜反应能置换出铜,铝的金属活动性比铜强;④铜丝和硝酸银溶液反应,能置换出银,铜的金属活动性比银强,可得出三种金属活动性铝>铜>银,故选项正确。
D、①铝丝和稀硫酸反应生成氢气,位置排在氢的前面;③铝丝和硫酸铜反应能置换出铜,铝的金属活动性比铜强;但无法确定银和铜的活动性强弱,故选项错误。
故选:C。
【点评】本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
4.(2025 银川一模)下列各组合能验证Zn、Fe、Cu三种金属活动性强弱的是( )
①稀盐酸、锌粉、铁粉、铜粉
②Zn、FeSO4溶液、Cu
③ZnSO4溶液、Fe、Cu(NO3)2溶液
④ZnSO4溶液、Fe、Cu
A.①④ B.①②③ C.①③④ D.①②③④
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】B
【分析】根据在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,进行分析判断。
【解答】解:①Zn、Fe均能与稀盐酸反应产生气泡,且Zn反应较剧烈,产生气泡的速率较快,说明活动性Zn>Fe>H,Cu不能与稀硫酸反应,说明活动性H>Cu,可得出金属活动性Zn>Fe>Cu。
②将Zn、Cu分别加入FeSO4溶液中,实验中可以观察到Cu与FeSO4不反应,说明金属活动性Fe>Cu;可以观察到Zn可以与FeSO4反应,说明金属活动性Zn>Fe,可得出金属活动性Zn>Fe>Cu。
③Fe不能与ZnSO4反应,说明金属活动性Zn>Fe;Fe加入Cu(NO3)2溶液中能观察到铁表面有红色固体析出,证明Fe能置换出铜,说明金属活动性Fe>Cu,可得出金属活动性Zn>Fe>Cu。
④Fe、Cu均不能与ZnSO4溶液反应,可以说明金属活动性Zn>Fe,Zn>Cu,无法比较Fe、Cu的金属活动性。
故①②③能验证Zn、Fe、Cu三种金属活动性强弱。
故选:B。
【点评】本题难度不大,考查金属活动性应用,明确金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
5.(2025 乌鲁木齐模拟)现有甲、乙、丙三种金属,为探究其金属活动性顺序,进行了如下实验:①将甲和丙分别放入稀盐酸中,甲溶解并产生氢气,丙不反应;②将乙和丙分别放入硝酸银溶液中,过一会儿,在丙表面有银析出,而乙没有变化,则甲、乙、丙的金属活动性顺序正确的是( )
A.甲>乙>丙 B.甲>丙>乙 C.乙>甲>丙 D.丙>甲>乙
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】A
【分析】根据金属活动性顺序的意义进行分析,在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来。
【解答】解:由题意可知,把甲和乙分别放入稀硫酸中,甲溶解并产生氢气,而乙不反应,说明金属的活动性强弱是:甲>H>乙,把乙和丙分别放入硝酸银溶液中,过一会儿,在乙表面有银析出,而丙没有变化,说明乙>Ag>丙,所以甲、乙、丙的活动性为:甲>乙>丙;
故选:A。
【点评】与酸反应剧烈,金属活动性越强,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来。
6.(2025春 青岛月考)为深入研究金属活动性顺序及其应用,某同学设计如图实验,观察到乙装置中铜片表面有气泡且电流计指针发生偏转。下列说法不正确的是( )
A.根据甲装置,可以比较金属活动性顺序:Zn>Cu
B.乙中电流计指针偏转说明化学能可以转变为电能
C.乙中锌片是负极,溶液的氢离子移向锌片
D.甲、乙对比分析,Zn﹣Cu用导线连接,反应时电子由Zn片经导线流向Cu片
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】C
【分析】A、根据锌能和硫酸反应,但铜不能和硫酸反应分析;
B、根据乙中电流计指针偏转,说明有电流产生分析;
C、根据锌和硫酸反应生成硫酸锌和氢气分析;
D、根据反应时电子由Zn片经导线流向Cu片分析。
【解答】解:A、锌能和硫酸反应,但铜不能和硫酸反应,则说明锌比铜活泼,故正确;
B、乙中电流计指针偏转,说明有电流产生,即化学能可以转变为电能,故正确;
C、锌和硫酸反应生成硫酸锌和氢气,锌单质中锌为0价,但硫酸锌中锌化合价为+2价,反应过程中化合价升高,则反应过程中锌失去电子,电子由锌片移向铜片,则电流由铜片移向锌片,则锌为负极,但溶液中的氢离子会移向铜片,从而得到电子,故不正确;
D、结合前面分析可知,反应时电子由Zn片经导线流向Cu片,故正确。
故选:C。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
7.(2025 沂源县一模)为验证锌、铁、铜三种金属的活动性顺序,某化学兴趣小组的同学设计了如图所示的三个实验。下列说法中正确的是( )
A.实验①②能验证锌的金属活动性比铜的强
B.实验①中溶液质量减小,实验③中溶液的质量变大
C.实验②③可验证的金属活动性顺序:Fe>H>Cu
D.只做实验①和③,就能验证锌、铁、铜的金属活动性顺序
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】A
【分析】根据在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,进行分析判断。
【解答】解:A.实验①中会产生气泡,说明锌能与稀硫酸反应,则在金属活动性顺序中锌的位置排在氢之前;同理,由实验②可得,在金属活动性顺序中的位置排在氢之后;则通过实验①②能验证锌的金属活动性比铜的强,故选项说法正确;
B.实验①中铁与稀硫酸反应生成硫酸亚铁和氢气,反应方程式为Fe+H2SO4=FeSO4+H2↑,有56份质量的铁进入溶液,放出2份质量的气体,因此溶液质量增大;实验③中铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为Fe+CuSO4═FeSO4+Cu,每56份质量的铁反应能置换出64份质量的铜,则反应后溶液质量减小,故选项说法错误;
C.实验②③可验证的金属活动性顺序:Fe>Cu,但无法验证铁在氢前面还是在氢后面,故选项说法错误;
D.做实验①和③,能验证Fe>Cu,但无法验证锌、铁的金属活动性顺序,故选项说法错误;
故选:A。
【点评】本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
8.(2025 天津校级模拟)有X、Y、Z三种金属,分别浸入H2SO4中,只有X金属溶解,将Z金属浸入Y的硫酸盐溶液时,在Z的表面有Y析出。则X、Y、Z的金属活动性由强到弱的顺序是( )
A.Y>Z>X B.X>Y>Z C.Z>X>Y D.X>Z>Y
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】D
【分析】根据在金属活动性顺序中,只有排在氢前面的金属才能和酸反应,排在前面的金属能把排在后面的金属从它的盐溶液中置换出来进行分析。
【解答】解:有X、Y、Z三种金属,分别浸入H2SO4中,只有X金属溶解,说明X的金属活动性比Y、Z强;将Z金属浸入Y的硫酸盐溶液时,在Z的表面有Y析出,说明Z的活动性比Y强,所以这三种金属的活动性顺序为:X>Z>Y。
故选:D。
【点评】本题主要考查金属活动性顺序的应用,金属活动性顺序的应用主要表现在两个方面:一是排在氢前面的金属能和酸反应生成氢气(位置越靠前,反应越剧烈),二是排在前面的金属能将排在后面的金属从它的盐溶液中置换出来。
9.(2025 梁山县一模)为验证铜、银、铁的金属活动性顺序,同学们设计了如图所示的6个实验。图中“→”表示将金属加入到盐溶液。下列说法不正确的是( )
A.实验②的目的是验证铜、银的金属活动性顺序
B.仅由④和⑥就能得出铜、银、铁的金属活动性顺序
C.铁在⑤和⑥反应的产物中都显+2价
D.仅由①和②就能得出铜、银、铁的金属活动性顺序
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】B
【分析】A、根据铜和硝酸银反应生成硝酸铜和银来分析;
B、根据银和硫酸铜不反应,铁和硝酸银反应生成硝酸亚铁和银来分析;
C、根据铁和硫酸铜反应生成硫酸亚铁和铜,铁和硝酸银反应生成硝酸亚铁和银来分析;
D、根据铜和硫酸亚铁不反应,铜和硝酸银反应生成硝酸铜和银来分析。
【解答】解:A、实验②中铜和硝酸银反应生成硝酸铜和银,说明铜的金属活动性强于银,故选项说法正确。
B、实验④中银和硫酸铜不反应,说明铜的金属活动性强于银,实验⑥中铁和硝酸银反应生成硝酸亚铁和银,说明铁的金属活动性强于银,实验④和⑥只能得出铜、铁的金属活动性都强于银,不能比较铜、铁的金属活动性强弱,故选项说法不正确。
C、实验⑤中铁和硫酸铜反应生成硫酸亚铁和铜,实验⑥中铁和硝酸银反应生成硝酸亚铁和银,铁在⑤和⑥反应的产物中都显+2价,故选项说法正确。
D、实验①中铜和硫酸亚铁不反应,说明铁的金属活动性强于铜,实验②中铜和硝酸银反应生成硝酸铜和银,说明铜的金属活动性强于银,仅由①和②就能得出铜、银、铁的金属活动性顺序为:铁>铜>银,故选项说法正确。
故选:B。
【点评】本题主要考查金属活动性顺序的应用,理解在金属活动性顺序中,排在前面的金属能将排在后面的金属从它的盐溶液中置换出来是解题关键。
10.(2025 栾城区校级一模)人类开发利用金属的时间和金属的活动性有关。为探究金属的活动性强弱,用如图实验进行探究。下列说法不正确的是( )
A.实验前需要打磨金属片,除去表面的氧化膜
B.若用稀盐酸能比较两金属的活动性,则只有金属片X表面产生气泡
C.若将铜片放入X的盐溶液,则能比较出X与铜的金属活动性
D.若X为Zn,向两支试管加入AgNO3溶液,能得出金属活动性:Zn>Cu>Ag
【考点】金属活动性强弱的判断.
【专题】金属与金属材料.
【答案】D
【分析】根据在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,进行分析判断。
【解答】解:A、实验前需要打磨金属片,是为了除去表面的氧化膜,从而防止氧化膜阻碍反应的进行,故不符合题意;
B、铜不和稀盐酸反应,若用稀盐酸能比较两金属的活动性,则只有金属片X表面产生气泡,故不符合题意;
C、若将铜片放入X的盐溶液,无明显现象,说明铜不与X溶液反应,即铜的活动性比X弱,能比较出X与铜的金属活动性,故不符合题意;
D、若向甲、乙试管加入AgNO3溶液,锌和铜都能与硝酸银反应置换出银,能得出金属的活动性:Zn>Ag,Cu>Ag,但无法比较锌和铜的金属活动性,故符合题意。
故选:D。
【点评】本题难度不大,考查金属活动性应用,明确金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
二.填空题(共8小题)
11.(2025 咸阳一模)金属的发现和使用推动了人类社会发展。部分金属的发现历程如图所示,请根据要求回答下列问题。
(1)据图分析,金属的发现的先后与金属的 活动性 有关。
(2)铝被广泛地应用于生产和生活之中,除了因为改进铝的冶炼方法使其成本降低,以及铝的密度小外,还由于铝具有较好的 抗腐蚀 性。
(3)老师提供了氯化铝溶液和硫酸铜溶液,让同学们验证铜、铁、铝三种金属的活动性顺序,他们选择了一种金属,通过实验得出了正确的结论。请你结合他们选择的金属,写出实验时发生反应的化学方程式: Fe+CuSO4=FeSO4+Cu 。
【考点】金属活动性强弱的判断;金属的物理性质及用途.
【专题】金属与金属材料.
【答案】(1)活动性;
(2)抗腐蚀;
(3)Fe+CuSO4=FeSO4+Cu。
【分析】(1)观察金属发现和冶炼历程图,分析不同金属被发现和冶炼的时间与金属自身性质之间的联系,从而确定金属的发现和冶炼历程与金属的何种性质有关。
(2)根据合金的特点分析。
(3)验证金属的活动性顺序是否合理,可根据“反应则活泼,不反应则不活泼”进行分析判断。
【解答】解:(1)金属的活动性:Al>Fe>Cu,由图可知金属的发现历程是:铜最早、然后是铁、最后是铝,说明金属的发现先后与金属的活动性有关;
(2)铝在常温下能与空气中的氧气反应生成一层致密的氧化铝薄膜,能阻止内部金属进一步被氧化,因此铝还具有较好的抗腐蚀性;
(3)验证铜、铁、铝三种金属的活动性顺序,可用氯化铝溶液和硫酸铜溶液分别与铁进行实验,铁与氯化铝不反应,说明金属活动性Al>Fe,铁与硫酸铜反应生成铜和硫酸亚铁,说明金属活动性Fe>Cu,由此可得三种金属的活动性顺序为Al>Fe>Cu,则发生反应的化学方程式为Fe+CuSO4=FeSO4+Cu。
故答案为:(1)活动性;
(2)抗腐蚀;
(3)Fe+CuSO4=FeSO4+Cu。
【点评】本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,强调了学生整合基本化学知识的能力。
12.(2025 碑林区校级三模)“卧薪尝胆,三千越甲可吞吴”这句话传颂的是春秋时期越王勾践的励志故事,他的宝剑——越王勾践剑被称为天下第一剑。检测数据显示剑身主要含有铜、锡(Sn),另外含有少量铁、铝。
(1)越王勾践剑剑身材料与纯铜相比,具有硬度 大 (填“大”或“小”)的优良性能。
(2)越王勾践剑在出土时剑身未被腐蚀的原因之一是剑身与剑鞘之间的吻合度极高,有效隔绝了剑身与 氧气、水 的直接接触。
(3)将打磨过的铜片、铁片、铝片分别插入稀盐酸中,写出其中一种金属与稀盐酸反应的化学方程式: Fe+2HCl=FeCl2+H2↑ 。
(4)为验证铜、铁、铝的金属活动性顺序,以下方案中所选试剂不能达到目的的是 AD (多选,填字母)。
A.稀硫酸、铜片、硫酸亚铁溶液
B.铜片、硫酸亚铁溶液、铝片
C.铁片、硫酸铜溶液、硫酸铝溶液
D.铜片、铁片、硫酸铝溶液
【考点】金属活动性强弱的判断;合金与合金的性质;金属与氧气的反应;金属与酸的反应原理.
【专题】金属与金属材料.
【答案】(1)大;
(2)氧气、水;
(3)Fe+2HCl=FeCl2+H2↑;
(4)AD。
【分析】(1)根据合金的硬度比组成合金的纯金属的硬度大来分析;
(2)根据金属与氧气、水直接接触易锈蚀来分析;
(3)根据铜和稀盐酸不反应,铁和盐酸反应生成氯化亚铁和氢气,铝和盐酸反应生成氯化铝和氢气来分析;
(4)根据在金属活动性顺序中,只有排在氢前面的金属才能和酸反应,排在前面的金属能把排在后面的金属从它的盐溶液中置换出来来分析。
【解答】解:(1)合金的硬度比组成合金的纯金属的硬度大,越王勾践剑剑身材料(剑身主要含有铜、锡,另外含有少量铁、铝)与纯铜相比,具有硬度大的优良性能。
(2)越王勾践剑在出土时剑身未被腐蚀的原因之一是剑身与剑鞘之间的吻合度极高,有效隔绝了剑身与氧气、水的直接接触。
(3)将打磨过的铜片、铁片、铝片分别插入稀盐酸中,铜和稀盐酸不反应,铁和盐酸反应生成氯化亚铁和氢气,铝和盐酸反应生成氯化铝和氢气,反应的化学方程式分别为:Fe+2HCl=FeCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑。
(4)A、铜片和稀硫酸、硫酸亚铁溶液都不反应,无法验证铜、铁、铝的金属活动性顺序,故选项符合题意;
B、铜片和硫酸亚铁溶液不反应,说明金属活动性铁>铜,铝片和硫酸亚铁溶液反应生成硫酸铝和铁,说明金属活动性铝>铁,能验证铜、铁、铝的金属活动性顺序为:铝>铁>铜,故选项不符合题意;
C、铁片和硫酸铜溶液反应生成硫酸亚铁和铜,说明金属活动性铁>铜,铁片和硫酸铝溶液不反应,说明金属活动性铝>铁,能验证铜、铁、铝的金属活动性顺序为:铝>铁>铜,故选项不符合题意;
D、铜片、铁片都不能和硫酸铝溶液反应,无法验证铜、铁、铝的金属活动性顺序,故选项符合题意;
故选项:AD。
故答案为:
(1)大;
(2)氧气、水;
(3)Fe+2HCl=FeCl2+H2↑;
(4)AD。
【点评】本题主要考查了物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
13.(2025春 莆田校级期中)“福建舰”解缆启航,标志着我国航空母舰建设迈向新征程。
Ⅰ.航母建造
(1)航母建造需使用纯铜、钢铁、铝合金等。
①航母电缆用纯铜制作,主要利用铜的延展性和 导电 性。
②航母在建造过程中大量使用特种钢。建造过程中用该特种钢不用纯铁的原因是 抗腐蚀性更强(答案不唯一) 。
③航母内部大量使用Al、Fe、Cu三种金属材料或其合金的设备。可以选用稀盐酸对三种金属的活动性顺序进行探究。写出其中一个能与稀盐酸反应的化学方程式 2Al+6HCl=2AlCl3+3H2↑或Fe+2HCl=FeCl2+H2↑ ,该反应所属的基本反应类型是 置换反应 。请选择其他合适的试剂,这三种金属的活动性顺序进行探究,能达到目的的是 Al、FeSO4溶液
、Cu(答案不唯一) 。
Ⅱ.能源供给
(2)航母动力由重油(含C18H18等多种成分)燃烧提供。其充分燃烧后产物有 CO2、H2O (填化学式)。
(3)通讯工具使用的锂电池,工作时能量转化的主要方式为 化学能转化为电能 。
【考点】金属活动性强弱的判断;物质发生化学变化时的能量变化;金属的物理性质及用途;合金与合金的性质.
【专题】金属与金属材料.
【答案】(1)①导电;
②抗腐蚀性更强(答案不唯一);
③2Al+6HCl=2AlCl3+3H2↑或Fe+2HCl=FeCl2+H2↑;置换反应;Al、FeSO4溶液、Cu(答案不唯一);
(2)CO2、H2O;
(3)化学能转化为电能。
【分析】(1)①根据金属的性质分析;
②根据合金的特点分析;
③根据铝和盐酸反应生成氯化铝和氢气,铁和盐酸反应生成氯化亚铁和氢气分析;
(2)根据质量守恒定律分析;
(3)根据化学变化中的能量变化分析。
【解答】解:(1)①铜可作电缆,主要利用了铜的延展性和导电性。
②一般,合金的硬度比其组成的纯金属的硬度大、耐腐蚀性强,钢和生铁是常见的铁合金,则航母在建造过程中大量使用特种钢,是因为该特种钢的耐腐蚀性能比纯铁的好、硬度比纯铁大等。
③在金属活动性顺序中,铝、铁位于氢元素前面,则均能和盐酸反应,其中铝和盐酸反应生成氯化铝和氢气,反应的化学方程式为:2Al+6HCl=2AlCl3+3H2↑、铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑;
该反应为一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;
铝能和硫酸亚铁反应,但铜不能和硫酸亚铁反应,则可选用铝、硫酸亚铁、铜验证这三种金属的活动性顺序。
(2)反应前后元素种类不变,则重油充分燃烧后的产物有CO2、H2O。
(3)电池工作时,化学能转化为电能。
故答案为:(1)①导电;
②抗腐蚀性更强(答案不唯一);
③2Al+6HCl=2AlCl3+3H2↑或Fe+2HCl=FeCl2+H2↑;置换反应;Al、FeSO4溶液、Cu(答案不唯一);
(2)CO2、H2O;
(3)化学能转化为电能。
【点评】本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,强调了学生整合基本化学知识的能力。
14.(2025 灞桥区校级模拟)金属材料在人类的生产生活中有着广泛的应用。
【实验1】设计如图实验,验证金属活动性顺序表中Fe、Cu、Ag三种金属与H的位置关系。
(1)为达到实验目的,C实验中X溶液可以选择下列中的 AC (填字母)。
A.FeSO4溶液
B.CuSO4溶液
C.稀硫酸
(2)写出B试管中发生反应的化学方程式: Cu+2AgNO3=Cu(NO3)2+2Ag 。
【实验2】在实验室中,把一定量铁粉加入到一定量的Zn(NO3)2、Cu(NO3)2、AgNO3的混合溶液中,请根据下图中的信息回答相关问题:
(3)滤液A中一定存在的金属阳离子是 Fe2+、Zn2+ (填离子符号)。
(4)向滤渣B中滴加稀盐酸时,还能观察到溶液由无色变为 浅绿 色。
【考点】金属活动性强弱的判断;金属与盐溶液反应的原理.
【专题】金属与金属材料.
【答案】(1)AC;
(2)Cu+2AgNO3=Cu(NO3)2+2Ag;
(3)Fe2+、Zn2+;
(4)浅绿。
【分析】(1)根据金属的的活动性分析;
(2)根据铜和硝酸银反应生成银和硝酸铜分析;
(3)根据铁、银、铜三者的金属活动性顺序为锌>铁>铜>银,往硝酸银、硝酸锌和硝酸铜的混合溶液中加入一定量的铁粉,先置换最弱的金属银,然后再置换较强的铜,铁与硝酸锌不反应分析;
(4)根据铁和稀盐酸反应生成氯化亚铁和氢气分析。
【解答】解:(1)为达到实验目的,C实验中X溶液可以选择下列中的FeSO4溶液(铜不能和硫酸亚铁反应,说明铁比铜活泼)、H2SO4溶液(铁能和稀硫酸反应,铜不能和稀硫酸反应,说明铁比铜活泼),故答案为:AC;
(2)B实验中发生反应是铜和硝酸银反应生成银和硝酸铜,反应的化学方程式为Cu+2AgNO3=Cu(NO3)2+2Ag;
(3)铁、银、铜三者的金属活动性顺序为锌>铁>铜>银,往硝酸银、硝酸锌和硝酸铜的混合溶液中加入一定量的铁粉,先置换最弱的金属银,然后再置换较强的铜,铁与硝酸锌不反应。由以上分析可知,滤液A中一定含有:硝酸锌、硝酸亚铁,可能有硝酸银、硝酸铜,所以一定含有的金属阳离子是:Fe2+、Zn2+;
(4)向滤渣B中滴加稀盐酸后,有气体生成,说明是铁和稀盐酸反应生成氯化亚铁和氢气,所以现象还有:溶液由无色变为变成浅绿色。
故答案为:(1)AC;
(2)Cu+2AgNO3=Cu(NO3)2+2Ag;
(3)Fe2+、Zn2+;
(4)浅绿。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
15.(2025 乾县校级三模)金属在生产和生活中应用极为广泛。
(1)下列生活用品利用金属良好导热性的是 B (填字母)。
A.镀铬水龙头
B.铸铁暖气片
C.包糖果的铝箔
(2)铝制品耐腐蚀的原因是 4Al+3O2=2Al2O3 (用化学方程式解释)。
(3)镍(Ni)广泛用于合金的制造,这与其化学性质密切相关。为探究它的活动性,向镍(Ni)中加入足量的稀硫酸,观察到有气泡产生,溶液变为绿色(Ni2+)。结合上述实验事实,限用一种试剂对Ni、Cu、Ag三种金属的活动性强弱进行验证,则该试剂是 B (填字母)。
A.稀硫酸
B.CuSO4溶液
C.NiCl2溶液
D.AgNO3溶液
【考点】金属活动性强弱的判断;金属的物理性质及用途;金属与氧气的反应.
【专题】金属与金属材料.
【答案】(1)B;
(2)4Al+3O2=2Al2O3;
(3)B。
【分析】(1)根据金属的性质与用途分析;
(2)根据铝在常温下能与空气中的氧气发生反应分析;
(3)验证三种金属活动性强弱时,通常采取“三取中”的方法,即取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应。
【解答】解:(1)A、镀铬水龙头更耐腐,不符合题意;
B、铸铁暖气片利用铁有良好的导热性,符合题意;
C、包糖果的铝箔:主要利用了铝的延展性,不符合题意。
故选B;
(2)铝在常温下能与空气中的氧气发生反应,在其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化。该反应的化学方程式为:4Al+3O2=2Al2O3;
(3)已知向镍(Ni)中加入足量的稀硫酸,观察到有气泡产生,说明Ni的活动性在H之前,Ni>H;
A、稀硫酸只能验证出Ni比H活泼,不能与Cu、Ag反应,无法比较Cu和Ag的活动性,不符合题意;
B、CuSO4溶液:将Ni放入CuSO4溶液中,如果Ni表面有红色物质析出,说明Ni能置换出Cu,即Ni>Cu;将Ag放入CuSO4溶液中,无明显现象,说明Cu>Ag,从而可以验证Ni>Cu>Ag,符合题意;
C、将Cu和Ag分别放入NiCl2溶液中,都无明显现象,只能说明Ni比Cu和Ag活泼,但无法比较Cu和Ag的活动性,不符合题意;
D、Ni和Cu都能与AgNO3溶液反应,说明Ni和Cu都比Ag活泼,但无法比较Ni和Cu的活动性,不符合题意。
故选B。
故答案为:
(1)B;
(2)4Al+3O2=2Al2O3;
(3)B。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
16.(2025 牡丹江模拟)金属材料在日常生活、工农业生产中有广泛应用,结合所学知识回答下列问题:
(1)铜块能制成铜丝是利用了铜的 延展 性。
(2)青铜是人类最早使用的铜锡合金,下列说法不正确的是 B (填字母序号)。
A.青铜属于金属材料
B.铜的硬度比青铜大
C.青铜耐腐蚀
(3)为了探究X、Y、Z三种金属的活动性顺序,某小组同学做了以下三个实验:
①将X放入Y的盐溶液中,有Y固体析出
②将X放入Z的盐溶液中,有Z固体析出
③将Y放入Z的盐溶液中,有Z固体析出
经过讨论,实验 ② (填数字序号)是多余的,可得出三种金属的活动性顺序为 X>Y>Z 。
(4)将一定量的锌粉加入到硝酸镁和硝酸铜的混合液中,充分反应后过滤,得到滤渣和滤液。下列判断正确的是 D 。
A.若滤液为蓝色,则滤渣中一定有锌、镁、铜
B.若向滤渣中加入稀盐酸有气泡产生,则滤液中一定有硝酸镁、硝酸锌、硝酸铜
C.若向滤液中加入氢氧化钠溶液,则一定有氢氧化铜生成
D.滤渣中一定含有铜,滤液中一定含有硝酸镁和硝酸锌
【考点】金属活动性强弱的判断;金属的物理性质及用途;合金与合金的性质;金属与盐溶液反应的原理.
【专题】金属与金属材料.
【答案】(1)延展;
(2)B;
(3)②;X>Y>Z;
(4)D。
【分析】(1)根据铜具有延展性,能制成铜丝来分析;
(2)A、根据金属材料包括纯金属及其合金来分析;
B、根据合金的硬度比组成合金的纯金属的硬度大来分析;
C、根据合金的耐腐蚀性能好来分析;
(3)根据在金属活动性顺序中,排在前面的金属能把排在后面的金属从它的盐溶液中置换出来来分析;
(4)根据锌的金属活动性比铜强,比镁弱,将一定量的锌粉加入到硝酸镁和硝酸铜的混合液中,锌不能与Mg(NO3)2溶液反应,锌能与Cu(NO3)2反应生成硝酸锌和铜来分析。
【解答】解:(1)铜块能制成铜丝是利用了铜的延展性。
(2)A、金属材料包括纯金属及其合金,青铜是铜锡合金,属于金属材料,故选项说法正确;
B、合金的硬度比组成合金的纯金属的硬度大,则青铜的硬度比铜大,故选项说法不正确;
C、合金的耐腐蚀性能好,青铜是铜锡合金,则青铜耐腐蚀,故选项说法正确;
故选:B。
(3)①将X放入Y的盐溶液中,有Y固体析出,说明X的活动性比Y强;
②将X放入Z的盐溶液中,有Z固体析出,说明X的活动性比Z强;
③将Y放入Z的盐溶液中,有Z固体析出,说明Y的活动性比Z强;
经过讨论,实验②是多余的,由实验①③可得出三种金属的活动性顺序为:X>Y>Z。
(4)A、锌的金属活动性比铜强,比镁弱,将一定量的锌粉加入到硝酸镁和硝酸铜的混合液中,锌不能与Mg(NO3)2溶液反应,锌能与Cu(NO3)2反应生成硝酸锌和铜;若滤液为蓝色,说明滤液中含有硝酸铜,则滤渣中一定有铜,一定没有锌、镁,故选项说法错误;
B、若向滤渣中加入稀盐酸有气泡产生,说明锌是过量的,则滤液中一定有硝酸镁、硝酸锌,一定不含硝酸铜,故选项说法错误;
C、滤液中一定含有硝酸镁、硝酸锌,可能含有硝酸铜,若向滤液中加入氢氧化钠溶液,则会观察到产生白色沉淀,可能同时产生蓝色沉淀,故选项说法错误;
D、一定发生了锌和硝酸铜的反应,无法确定反应进行的程度,则滤渣中一定含有铜,滤液中一定含有硝酸镁和硝酸锌,故选项说法正确;
故选:D。
故答案为:
(1)延展;
(2)B;
(3)②;X>Y>Z;
(4)D。
【点评】本题主要考查金属活动性顺序的应用,金属活动性顺序的应用主要表现在两个方面:一是排在氢前面的金属能和酸反应生成氢气(位置越靠前,反应越剧烈),二是排在前面的金属能将排在后面的金属从它的盐溶液中置换出来。
17.(2025 舒城县模拟)《梦溪笔谈》是北宋科学家、政治家沈括撰写的一部涉及古代中国自然科学、工艺技术及社会历史现象的综合性笔记体著作。该著作中“古人以剂钢为刃,柔铁为茎干,不尔则多断折”“熬胆矾铁釜,久之亦化为铜”记录了古代铁器生产、使用的情形。请回答有关问题。
(1)剂钢指的是一种高碳钢,质地坚硬但很脆,柔铁则是一种低碳钢,质地坚韧但无钢性。生铁和钢主要含铁和碳,生铁的含碳量比钢 高 (填“高”或“低”),钢的硬度比纯铁 大 (填“大”或“小”)。
(2)人类对铁的利用比铜晚了1500多年,这是因为铁的金属活动性比铜 强 (填“强”或“弱”)。已知胆矾溶于水得到硫酸铜溶液,请用化学方程式解释“熬胆矾铁釜,久之亦化为铜”的原因: Fe+CuSO4=FeSO4+Cu 。
【考点】金属活动性强弱的判断;生铁和钢;金属与盐溶液反应的原理.
【专题】金属与金属材料.
【答案】(1)高;大;
(2)强;Fe+CuSO4=FeSO4+Cu。
【分析】(1)根据生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%,以及合金的硬度比组成合金的纯金属的硬度大来分析;
(2)根据铁的金属活动性比铜强,铁比铜更难从其化合物中还原出来,以及铁和硫酸铜反应生成硫酸亚铁和铜来分析。
【解答】解:(1)生铁和钢主要含铁和碳,生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%,则生铁的含碳量比钢高;合金的硬度比组成合金的纯金属的硬度大,则钢的硬度比纯铁大。
(2)人类对铁的利用比铜晚了1500多年,这是因为铁的金属活动性比铜强,铁比铜更难从其化合物中还原出来;“熬胆矾铁釜,久之亦化为铜”的原理是铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu。
故答案为:
(1)高;大;
(2)强;Fe+CuSO4=FeSO4+Cu。
【点评】本题主要考查了生铁和钢的性质和金属活动性的应用,难度不大,根据所学知识,结合题中信息,认真分析即可解答。
18.(2025 宁江区一模)《梦溪笔谈》中“古人以剂钢为刃,柔铁为茎干”“熬胆矾铁釜,久之亦化为铜“记录了古代铁器生产、使用的情形。回答问题:
(1)炼铁的原理是利用CO与Fe2O3的反应。Fe2O3中Fe的化合价为 +3 。
(2)“剂钢”指的是合金钢,钢的硬度比纯铁的 大 (选填“大”或“小”)。
(3)人类对铁的利用比铜晚了1500多年,这是因为铁的金属活动性比铜的 强 (填选“强”或“弱”)。已知胆矾溶于水得到硫酸铜溶液,请用化学方程式解释“熬胆矾铁釜,久之亦化为铜”的原因: Fe+CuSO4=FeSO4+Cu 。
【考点】金属活动性强弱的判断;有关元素化合价的计算;合金与合金的性质;金属与盐溶液反应的原理.
【专题】金属与金属材料.
【答案】(1)+3;
(2)大;
(3)强;Fe+CuSO4=FeSO4+Cu。
【分析】(1)根据化合物中各元素正负化合价的代数和为零来分析;
(2)根据合金的硬度比组成合金的纯金属的硬度大来分析;
(3)根据铁的金属活动性比铜强,铁比铜更难从其化合物中还原出来,以及铁和硫酸铜反应生成硫酸亚铁和铜来分析。
【解答】解:(1)Fe2O3中氧元素的化合价为﹣2,设铁元素的化合价是x,根据化合物中各元素正负化合价的代数和为零,则2x+(﹣2)x3=0,解得x﹣+3,所以Fe2O3中铁元素的化合价为+3。
(2)合金的硬度比组成合金的纯金属的硬度大,钢是铁的合金,其硬度比纯铁的大。
(3)人类对铁的利用比铜晚了1500多年,这是因为铁的金属活动性比铜强,铁比铜更难从其化合物中还原出来;“熬胆矾铁釜,久之亦化为铜”的原理是铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu。
故答案为:
(1)+3;
(2)大;
(3)强;Fe+CuSO4=FeSO4+Cu。
【点评】本题主要考查了化合价原则、合金的性质以及金属的活动性,难度不大,根据所学知识,结合题中信息,认真分析即可解答。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
