【中考押题预测】2025年中考化学人教版(2024)核心考点考前冲刺 酸碱中和反应及其应用(含解析)
文档属性
| 名称 | 【中考押题预测】2025年中考化学人教版(2024)核心考点考前冲刺 酸碱中和反应及其应用(含解析) | 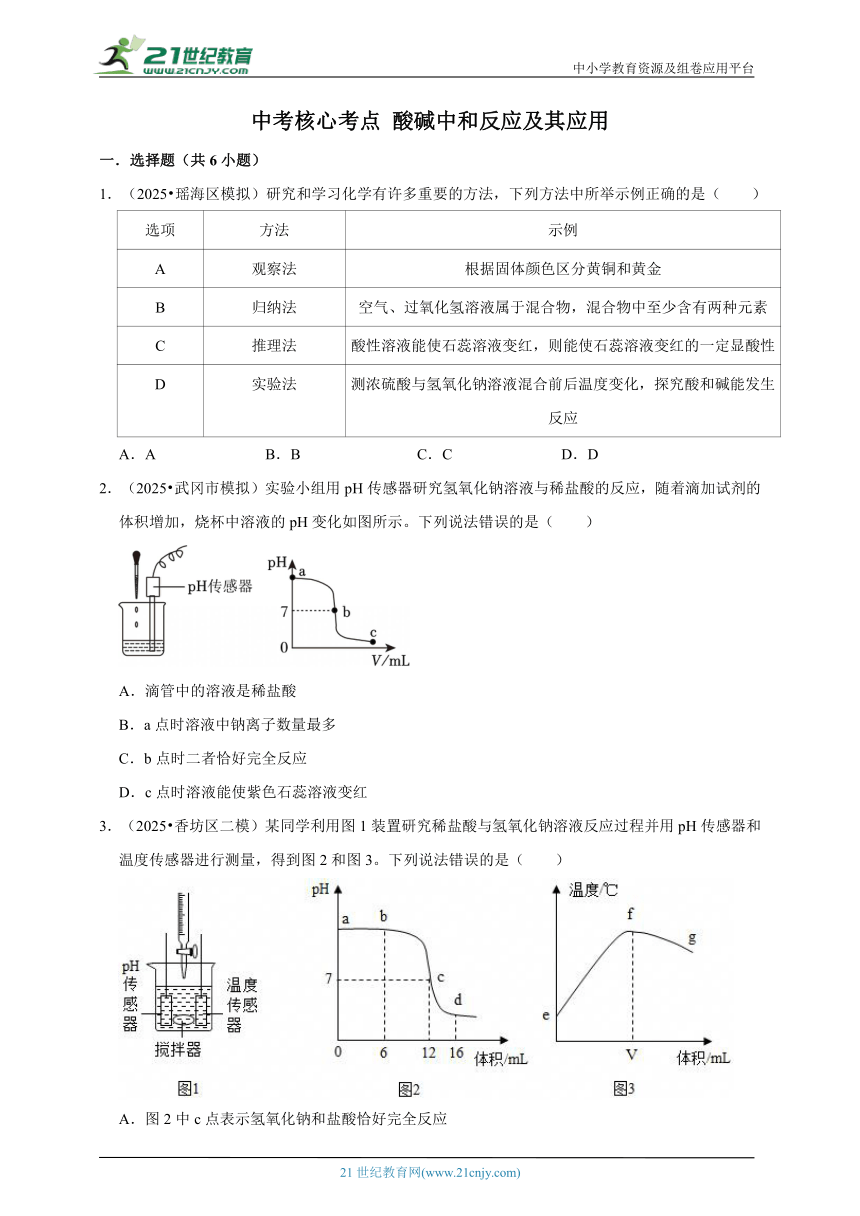 | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-17 09:52:23 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
中考核心考点 酸碱中和反应及其应用
一.选择题(共6小题)
1.(2025 瑶海区模拟)研究和学习化学有许多重要的方法,下列方法中所举示例正确的是( )
选项 方法 示例
A 观察法 根据固体颜色区分黄铜和黄金
B 归纳法 空气、过氧化氢溶液属于混合物,混合物中至少含有两种元素
C 推理法 酸性溶液能使石蕊溶液变红,则能使石蕊溶液变红的一定显酸性
D 实验法 测浓硫酸与氢氧化钠溶液混合前后温度变化,探究酸和碱能发生反应
A.A B.B C.C D.D
2.(2025 武冈市模拟)实验小组用pH传感器研究氢氧化钠溶液与稀盐酸的反应,随着滴加试剂的体积增加,烧杯中溶液的pH变化如图所示。下列说法错误的是( )
A.滴管中的溶液是稀盐酸
B.a点时溶液中钠离子数量最多
C.b点时二者恰好完全反应
D.c点时溶液能使紫色石蕊溶液变红
3.(2025 香坊区二模)某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应过程并用pH传感器和温度传感器进行测量,得到图2和图3。下列说法错误的是( )
A.图2中c点表示氢氧化钠和盐酸恰好完全反应
B.图2中b点所示溶液中的溶质为NaCl和NaOH
C.图2中c→d所示溶液中NaCl的质量不断增加
D.图3中e→f变化趋势说明该反应放出热量
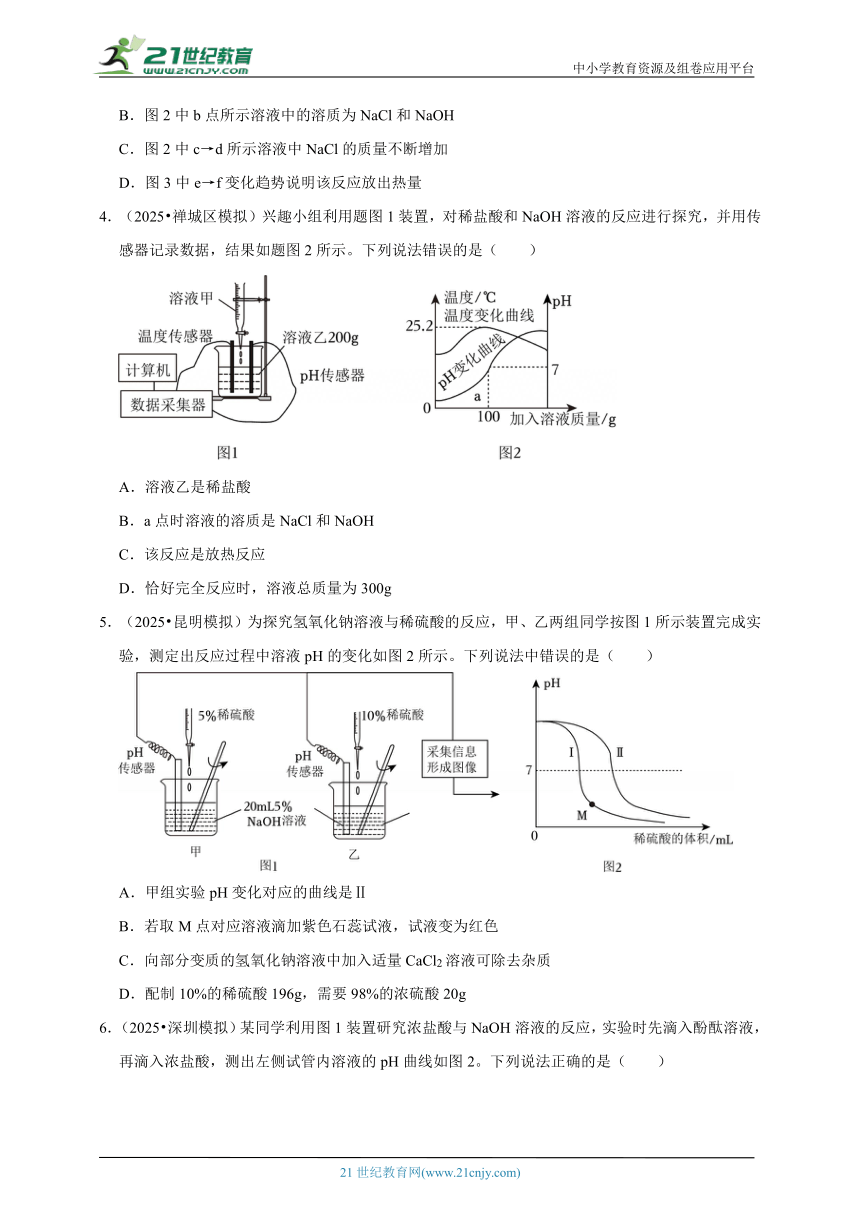
4.(2025 禅城区模拟)兴趣小组利用题图1装置,对稀盐酸和NaOH溶液的反应进行探究,并用传感器记录数据,结果如题图2所示。下列说法错误的是( )
A.溶液乙是稀盐酸
B.a点时溶液的溶质是NaCl和NaOH
C.该反应是放热反应
D.恰好完全反应时,溶液总质量为300g
5.(2025 昆明模拟)为探究氢氧化钠溶液与稀硫酸的反应,甲、乙两组同学按图1所示装置完成实验,测定出反应过程中溶液pH的变化如图2所示。下列说法中错误的是( )
A.甲组实验pH变化对应的曲线是Ⅱ
B.若取M点对应溶液滴加紫色石蕊试液,试液变为红色
C.向部分变质的氢氧化钠溶液中加入适量CaCl2溶液可除去杂质
D.配制10%的稀硫酸196g,需要98%的浓硫酸20g
6.(2025 深圳模拟)某同学利用图1装置研究浓盐酸与NaOH溶液的反应,实验时先滴入酚酞溶液,再滴入浓盐酸,测出左侧试管内溶液的pH曲线如图2。下列说法正确的是( )
A.实验中浓盐酸可换成浓硫酸
B.t1时,a点溶液中有大量的H+
C.t2时,b点溶液的颜色为红色
D.c点溶液中溶质有酚酞、HCl和NaCl
二.填空题(共13小题)
7.(2025 郑州模拟)中和反应在日常生活和工农业生产中有着广泛的应用。
(1)若土壤的酸性过强,可加入 进行改良。
(2)印染厂的碱性废水可用硫酸进行中和处理。在处理过程中,废水pH的变化为 。
(3)胃酸(主要成分为盐酸)过多的病人,可服用含氢氧化铝的药物治疗。写出该反应的化学方程式: 。
8.(2024春 梁溪区校级月考)“二十四节气”是我国古代农耕文化的产物,农耕生产与节气息息相关。
(1)“立春”:万物复苏,春暖花开。乙酸苯甲酯(C9H10O2)是一种具有茉莉花香味的物质,乙酸苯甲酯中碳、氢、氧元素质量比是 (填最简整数比)。
(2)“谷雨”:时雨乃降,百果乃登。正常雨水略显酸性,请用化学方程式表示其原因是 。酸雨容易导致土壤酸化,不利于农作物生长,常用 (填字母)改良酸性土壤。
A.氢氧化钠
B.氢氧化钙
C.碳酸
D.KNO3
(3)“小满”:小满不满,麦有一险。为促进小麦生长,需追加肥料。草木灰是一种钾肥,主要成分是碳酸钾,碳酸钾溶液中的阴离子主要有 。
9.(2024 厦门校级模拟)小阳把自制的一种黄色花汁,分别滴加到下列不同的试剂中,并记录观察到的现象如表所示:
请分析上表,并回答下列问题:
试剂 稀盐酸 食醋 蔗糖水 蒸馏水 肥皂水 烧碱溶液
颜色 红 红 黄 黄 绿 绿
(1)该花汁 (填“可以”或“不可以”)作酸碱指示剂。
(2)蚊子叮咬人时射入蚁酸(具有酸的性质),使皮肤红肿、痛痒。要缓解这种症状,简易可行的办法是在叮咬处涂抹上述试剂中的 。
(3)胃酸的主要成分是盐酸,胃舒平[主要成分Al(OH)3]常用于治疗胃酸过多症,写出胃舒平治疗胃酸过多症时的化学反应方程式: 。
10.(2024 肥城市模拟)科学食用营养物质,可以保障人体健康。
(1)某同学的部分体液的pH如图所示。
①图中碱性最强的体液是 。
②该同学胃酸(主要成分为盐酸)过多,可服用胃舒平【主要成分为Al(OH)3】治疗,其原理是 (用化学方程式表示)。
(2)某84消毒液产品的部分说明如下表。
【产品特点】主要成分为次氯酸钠(NaClO),有效氯的质量分数为5.1%~6.9%。 【餐具消毒】用有效氯的质量分数为0.04%的消毒液浸泡,20min后用生活饮用水冲净。 【注意事项】①外用消毒剂,须稀释后使用。 ②不得将本产品与酸性产品(如厕类清洁产品)同时使用。
①次氯酸钠中氯元素的化合价为 ,次氯酸的化学式为 。
②据表信息,将有效氯的质量分数为6.0%的84消毒液10g加入 g水进行稀释,即可用于餐具消毒。
③洁厕灵(主要成分为盐酸)与84消毒液混合会产生有毒的氯气(Cl2)。请将该反应的化学方程式补充完整:2HCl+NaClO= +Cl2↑+H2O。
11.(2024 西城区校级模拟)地球表面的氧化铁多形成于数亿年前的两次“大氧化事件”。微生物在进化过程中,演化出的“铁载体”对动植物吸收利用铁元素起着关键作用。
(1)“大氧化事件”中的某一重要反应如下:4Fe(OH)2+O2+2H2O=4Fe(OH)3,反应前后化合价改变的元素有 。
(2)土壤的酸碱性会影响铁载体细菌的生长。
①某地土壤的pH为6,该土壤呈 (填“酸性”、“中性”或“碱性”)。
②农业上常用于改良酸性土壤(含硫酸)的化学方程式是 。
12.(2024 夏津县一模)中华优秀传统文化是中华文明的智慧结晶和精华所在,赋予了中华民族伟大的生命力和凝聚力。
(1)中国年味:过年贴春联是中华民族的传统习俗,书法家用墨书写对联,墨的主要成分是碳,对联能保存很长时间而不变色,因为 。
(2)中国节气:“谷雨”:时雨乃降,百果乃登。正常雨水的pH≈5.6是由于空气中的 溶解在雨水中造成的,农业上常用 改良酸性土壤。
(3)中国科技:“玉兔号”月球车是中国首辆月球车,月球车上的太阳能电池板主要材料为硅。工业上可利用氢气和四氯化硅(SiCl4)在高温条件下反应制取高纯硅(Si),同时生成氯化氢,该反应的化学方程式为 ,反应后硅元素的化合价 (填“升高”“降低”“不变”之一)。
(4)中国智慧:古代人使用的金属制品从3000多年前的青铜器到1500多年前的铁器再到距今100多年前的铝器,过程展现了古代人的智慧,这些金属材料中铝制品比铁制品耐腐蚀的原因是 。
13.(2025 长春模拟)以宏观、微观、符号相结合的方式认识和表征化学变化是学习化学的重要思维方式。某实验小组同学探究酸碱中和反应,向滴有酚酞的稀NaOH溶液中加入稀盐酸,发生反应的微观过程如图。
(1)反应结束时,溶液的pH 7。
(2)由图可知,NaOH溶液与盐酸反应的实质是 。
14.(2025 广州一模)同学们借助传感器研究氢氧化钠溶液与稀硫酸的中和反应,实验过程中溶液pH及温度的变化如图1、图2所示。
(1)由图1可知该实验是将 溶液滴入 溶液中,反应的化学方程式为 。由图2可知,此反应属于 反应。(填“吸热”或“放热”)
(2)a、b、c、d四点对应的溶液中,能使酚酞试液变红的是 (填标号)。d点对应溶液的溶质是 (填化学式)。
(3)下列有关说法,正确的是 (填标号)。
A.a→b时,溶液的温度在升高
B.a→d时,溶液的pH在减小
C.b→c时,钠盐的质量在增加
D.b点溶液中阴、阳离子个数相等
15.(2025春 嵩县期中)某同学用传感器测定稀硫酸滴入稀氢氧化钡溶液的过程中pH的变化,测定的结果如图所示。硫酸与氢氧化钡反应的化学方程式为 ;a点所表示的溶液中溶质为 ;在c点所表示的溶液中滴加酚酞溶液,溶液显 色。
16.(2025 高青县一模)某同学用pH传感器测定稀硫酸滴入氢氧化钾溶液的过程中pH的变化,测定的结果如图所示。
(1)在a点的溶液中滴加酚酞溶液,溶液会显 色。此时,溶液中存在的阴离子有 (填离子符号)。
(2)b点处溶液pH 7,硫酸与氢氧化钾反应的化学方程式为 。该反应的类型是 反应,反应的实质是 。
(3)c点的溶液中溶质为 。
17.(2025 宣威市校级模拟)小聪利用pH传感器探究稀盐酸和氢氧化钠溶液的反应过程,实验装置如图1。向盛有一定量含有酚酞的X溶液中逐滴加入Y溶液,同时搅拌,测定烧杯中溶液的pH如图2所示。
(1)烧杯中的X溶液是 。
(2)结合图像分析上述实验,a点溶液的pH (选填“>”“=”或“<”)7;烧杯中NaCl的质量分数 (选填“先增大后减小”或“先减小后增大”)。
(3)写出氢氧化钠与盐酸发生反应的化学方程式为 。
(4)当pH=7时,消耗4%的氢氧化钠溶液10克,则被中和的盐酸溶质质量为 g。
18.(2025 许昌一模)室温时,向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液温度的变化)。
(1)a点溶液中的微粒为 。
(2)b点烧杯内液体的pH 7(填“>”“=”“<”)。
(3)c点溶液中滴加紫色石蕊溶液,溶液颜色为 。
19.(2025 襄城县模拟)图甲是利用数字化传感器测得的盐酸和氢氧化钠溶液反应时溶液pH的变化图像。
(1)该反应的化学方程式为 。
(2)当溶液呈中性时,所消耗氢氧化钠溶液的体积是 mL。
(3)请在图乙的虚线框内将C点时溶液中的微粒补画完整。
中考核心考点 酸碱中和反应及其应用
参考答案与试题解析
一.选择题(共6小题)
1.(2025 瑶海区模拟)研究和学习化学有许多重要的方法,下列方法中所举示例正确的是( )
选项 方法 示例
A 观察法 根据固体颜色区分黄铜和黄金
B 归纳法 空气、过氧化氢溶液属于混合物,混合物中至少含有两种元素
C 推理法 酸性溶液能使石蕊溶液变红,则能使石蕊溶液变红的一定显酸性
D 实验法 测浓硫酸与氢氧化钠溶液混合前后温度变化,探究酸和碱能发生反应
A.A B.B C.C D.D
【考点】中和反应相关实验与计算;纯净物和混合物的判别;合金与合金的性质;常见的酸碱指示剂及其变色情况.
【专题】物质的鉴别题;物质的分类;常见的酸 酸的通性.
【答案】C
【分析】A、根据黄铜和黄金的颜色,进行分析判断。
B、根据常见物质的元素组成,进行分析判断。
C、紫色石蕊溶液遇酸性溶液变红,遇中性溶液不变色,遇碱性溶液变蓝色。
D、根据浓硫酸溶于水放热,进行分析判断。
【解答】解:A、黄铜和黄金均为黄色固体,通过观察颜色无法区分,故选项说法错误。
B、空气含氮气、氧气等多种物质,过氧化氢溶液含过氧化氢和水,属于混合物。但混合物是由两种或多种物质混合而成,不一定至少含两种元素,如氧气(O2)和臭氧(O3)混合,只含一种氧元素,故选项说法错误。
C、酸性溶液能使石蕊溶液变红,则能使石蕊溶液变红的溶液一定显酸性,故选项说法正确。
D、浓硫酸溶于水放热,测浓硫酸与氢氧化钠溶液混合前后温度变化,不能确定是酸和碱发生反应放热,还是浓硫酸溶于水放热,不能有效探究酸和碱能否发生反应,故选项说法错误。
故选:C。
【点评】本题难度不大,了解浓硫酸溶于水放热、常见物质的元素组成、紫色石蕊溶液的性质等是正确解答本题的关键。
2.(2025 武冈市模拟)实验小组用pH传感器研究氢氧化钠溶液与稀盐酸的反应,随着滴加试剂的体积增加,烧杯中溶液的pH变化如图所示。下列说法错误的是( )
A.滴管中的溶液是稀盐酸
B.a点时溶液中钠离子数量最多
C.b点时二者恰好完全反应
D.c点时溶液能使紫色石蕊溶液变红
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】B
【分析】A、根据溶液的pH变化来分析;
B、根据化学反应的原理来分析;
C、根据溶液的pH来分析;
D、根据溶液的pH与酸碱性的关系、酸碱指示剂的变色情况来分析。
【解答】解:氢氧化钠溶液与稀盐酸反应生成氯化钠和水,发生的反应是NaOH+HCl=NaCl+H2O。
A、稀盐酸呈酸性,氢氧化钠溶液呈碱性,氯化钠溶液呈中性。由图可知,溶液的pH开始时大于7,呈碱性,随着试剂滴加,pH逐渐减小,说明是向氢氧化钠溶液中滴加稀盐酸,所以滴管中的溶液是稀盐酸,故选项A说法正确;
B、在反应过程中,钠离子没有参与反应,其数量始终不变,并非a点时最多,故选项B说法错误;
C、b点时溶液的pH=7,说明氢氧化钠溶液和稀盐酸恰好完全反应,故选项C说法正确;
D、c点时溶液的pH小于7,溶液呈酸性,酸性溶液能使紫色石蕊溶液变红,故选项D说法正确。
故选:B。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系等是正确解答本题的关键。
3.(2025 香坊区二模)某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应过程并用pH传感器和温度传感器进行测量,得到图2和图3。下列说法错误的是( )
A.图2中c点表示氢氧化钠和盐酸恰好完全反应
B.图2中b点所示溶液中的溶质为NaCl和NaOH
C.图2中c→d所示溶液中NaCl的质量不断增加
D.图3中e→f变化趋势说明该反应放出热量
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】C
【分析】A、根据c点溶液的pH=7,进行分析判断。
B、根据b点时溶液的pH>7,进行分析判断。
C、根据c点时是氢氧化钠溶液与稀盐酸恰好反应,进行分析判断。
D、根据e→f温度升高,进行分析判断。
【解答】解:A、c点时溶液的pH=7,溶液显中性,表示氧化钠和盐酸恰好完全反应,故选项说法正确。
B、b点时溶液的pH>7,说明氢氧化钠没有被完全反应,图中b点所示溶液中的溶质是NaCl和NaOH,故选项说法正确。
C、图中c点时是氢氧化钠溶液与稀盐酸恰好反应,图中c→d是溶液由中性变为酸性,表示所示溶液中稀盐酸的质量不断增加,这时氢氧化钠已被完全消耗,不能再生成氯化钠,故选项说法错误。
D、图中e→f温度升高,该变化趋势可说明该反应是放热反应,故选项说法正确。
故选:C。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
4.(2025 禅城区模拟)兴趣小组利用题图1装置,对稀盐酸和NaOH溶液的反应进行探究,并用传感器记录数据,结果如题图2所示。下列说法错误的是( )
A.溶液乙是稀盐酸
B.a点时溶液的溶质是NaCl和NaOH
C.该反应是放热反应
D.恰好完全反应时,溶液总质量为300g
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】B
【分析】A、根据溶液pH的变化来分析;
B、根据溶液pH与酸碱性的关系来分析;
C、根据化学反应过程中温度的变化来分析;
D、根据质量守恒定律来分析。
【解答】解:A、由溶液的pH变化曲线可知,原烧杯内乙溶液的pH小于7,显酸性,因此溶液乙是稀盐酸,则溶液甲是氢氧化钠溶液,故A说法正确;
B、氢氧化钠与盐酸反应生成氯化钠和水,a点所示溶液的pH小于7,显酸性,则该点所示溶液中的溶质是氯化钠和氯化氢,故B说法错误;
C、由化学反应中的温度变化曲线可知,反应过程中温度升高,因此该反应是放热反应,故C说法正确;
D、烧杯内原稀盐酸的质量为200g,由图像可知,恰好反应时,滴加氢氧化钠溶液的质量为100g,由质量守恒定律可知,恰好完全反应时,溶液总质量为300g,故D说法正确。
故选:B。
【点评】此题主要考查常见物质的性质,主要利用物质的性质来分析和解决有关问题,结合各方面的条件得出正确结论。
5.(2025 昆明模拟)为探究氢氧化钠溶液与稀硫酸的反应,甲、乙两组同学按图1所示装置完成实验,测定出反应过程中溶液pH的变化如图2所示。下列说法中错误的是( )
A.甲组实验pH变化对应的曲线是Ⅱ
B.若取M点对应溶液滴加紫色石蕊试液,试液变为红色
C.向部分变质的氢氧化钠溶液中加入适量CaCl2溶液可除去杂质
D.配制10%的稀硫酸196g,需要98%的浓硫酸20g
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】C
【分析】A、根据甲组同学中选用5%的稀硫酸,乙组同学选用10%的稀硫酸,进行分析判断。
B、根据M点对应溶液的pH小于7,进行分析判断。
C、根据部分变质的氢氧化钠溶液中溶质是碳酸钠、氢氧化钠,进行分析判断。
D、根据溶液稀释前后溶质的质量不变,进行分析判断。
【解答】解:A、甲组同学中选用5%的稀硫酸,乙组同学选用10%的稀硫酸,相同体积时,乙组消耗的氢氧化钠的质量大,溶液的pH下降的快,故乙组实验pH变化对应的曲线是Ⅰ,甲组实验pH变化对应的曲线是Ⅱ,故选项说法正确。
B、M点对应溶液的pH小于7,显酸性,若取M点对应溶液滴加紫色石蕊试液,试液变为红色,故选项说法正确。
C、部分变质的氢氧化钠溶液中溶质是碳酸钠、氢氧化钠,向部分变质的氢氧化钠溶液中加入适量CaCl2溶液,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,能除去杂质但引入了新的杂质氯化钠,不符合除杂原则,故选项说法错误。
D、配制10%的稀硫酸196g,设需要98%的浓硫酸的质量为x,根据溶液稀释前后溶质的质量不变,则196g×10%=x×98%,x=20g,故选项说法正确。
故选:C。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
6.(2025 深圳模拟)某同学利用图1装置研究浓盐酸与NaOH溶液的反应,实验时先滴入酚酞溶液,再滴入浓盐酸,测出左侧试管内溶液的pH曲线如图2。下列说法正确的是( )
A.实验中浓盐酸可换成浓硫酸
B.t1时,a点溶液中有大量的H+
C.t2时,b点溶液的颜色为红色
D.c点溶液中溶质有酚酞、HCl和NaCl
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】D
【分析】A、根据浓盐酸具有挥发性,进行分析判断。
B、根据a点溶液的pH>7,进行分析判断。
C、根据b点溶液的pH=7,进行分析判断。
D、根据c点溶液的pH<7,进行分析判断。
【解答】解:A、浓盐酸具有挥发性,挥发出的氯化氢溶于水形成盐酸,盐酸和氢氧化钠发生反应生成氯化钠和水。浓硫酸不具有挥发性,不能将浓盐酸换成浓硫酸,故选项说法错误。
B、a点溶液的pH>7,显碱性,溶液中有大量的氢氧根离子,故选项说法错误。
C、b点溶液的pH=7,酚酞遇中性溶液为无色,溶液颜色为无色,故选项说法错误。
D、c点溶液的pH<7,溶液中氢氧化钠被全部反应,盐酸过量;氢氧化钠和盐酸反应生成氯化钠和水,c点溶液中溶质有酚酞、HCl和NaCl,故选项说法正确。
故选:D。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
二.填空题(共13小题)
7.(2025 郑州模拟)中和反应在日常生活和工农业生产中有着广泛的应用。
(1)若土壤的酸性过强,可加入 氢氧化钙或熟石灰或Ca(OH)2 进行改良。
(2)印染厂的碱性废水可用硫酸进行中和处理。在处理过程中,废水pH的变化为 由大到小(或逐渐减小) 。
(3)胃酸(主要成分为盐酸)过多的病人,可服用含氢氧化铝的药物治疗。写出该反应的化学方程式: Al(OH)3+3HCl═AlCl3+3H2O 。
【考点】中和反应的实际应用;溶液的酸碱性与pH的关系;书写化学方程式、文字表达式、电离方程式.
【专题】常见的酸 酸的通性.
【答案】(1)氢氧化钙或熟石灰或Ca(OH)2;
(2)由大到小(或逐渐减小);
(3)Al(OH)3+3HCl═AlCl3+3H2O。
【分析】(1)根据改良酸性土壤的方法来分析;
(2)根据溶液酸碱性的变化来分析;
(3)根据化学反应的原理来分析。
【解答】解:(1)氢氧化钙俗称熟石灰,是一种碱,能与土壤中的酸性物质反应,因此可用氢氧化钙改良酸性土壤;故答案为:氢氧化钙或熟石灰或Ca(OH)2;
(2)碱性溶液的pH大于7,随着与硫酸的反应,溶液的碱性减弱,pH变小,故印染厂的碱性废水可用硫酸进行中和处理。在处理过程中,废水pH的变化为由大到小或逐渐减小;故答案为:由大到小(或逐渐减小);
(3)氢氧化铝与盐酸反应生成氯化铝和水,化学方程式为Al(OH)3+3HCl═AlCl3+3H2O;故答案为:Al(OH)3+3HCl═AlCl3+3H2O。
【点评】要想解答好这类题目,首先,要理解和熟记中和反应及其应用等相关知识。然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生活经验所得,细致地分析题意(或实验、图表信息)等各种信息资源,联系起来综合分析,并细心地探究、推理后,按照题目要求进行认真地选择或解答即。
8.(2024春 梁溪区校级月考)“二十四节气”是我国古代农耕文化的产物,农耕生产与节气息息相关。
(1)“立春”:万物复苏,春暖花开。乙酸苯甲酯(C9H10O2)是一种具有茉莉花香味的物质,乙酸苯甲酯中碳、氢、氧元素质量比是 54:5:16 (填最简整数比)。
(2)“谷雨”:时雨乃降,百果乃登。正常雨水略显酸性,请用化学方程式表示其原因是 CO2+H2O=H2CO3 。酸雨容易导致土壤酸化,不利于农作物生长,常用 B (填字母)改良酸性土壤。
A.氢氧化钠
B.氢氧化钙
C.碳酸
D.KNO3
(3)“小满”:小满不满,麦有一险。为促进小麦生长,需追加肥料。草木灰是一种钾肥,主要成分是碳酸钾,碳酸钾溶液中的阴离子主要有 。
【考点】中和反应的实际应用;酸雨的产生、危害及防治;分子、原子、离子、元素与物质之间的关系;元素质量比的计算;书写化学方程式、文字表达式、电离方程式.
【专题】化学式的计算;物质的微观构成与物质的宏观组成;常见的酸 酸的通性.
【答案】(1)54:5:16;
(2)CO2+H2O=H2CO3;B;
(3)。
【分析】(1)根据化合物中各元素质量比的计算方法,即各元素的相对原子质量乘以原子个数之比,来计算乙酸苯甲酯中碳、氢、氧元素质量比。
(2)正常雨水略显酸性是因为二氧化碳与水反应生成碳酸;改良酸性土壤需要使用碱性物质,分析各选项物质的酸碱性来选择合适的改良剂。
(3)碳酸钾在水中会解离出钾离子和碳酸根离子,找出其中的阴离子。
【解答】解:(1)乙酸苯甲酯中碳、氢、氧元素质量比为(12×9):(1×10):(16×2)=54:5:16;
(2)正常雨水略显酸性,是因为空气中的二氧化碳与水反应生成碳酸,碳酸显酸性,化学方程式为CO2+H2O=H2CO3;酸雨容易导致土壤酸化,不利于农作物生长,常用熟石灰改良酸性土壤,故选:B;
(3)草木灰是一种钾肥,主要成分是碳酸钾,一般不与铵态氮肥混合使用,铵态氮肥能与碱性物质反应生成氨气会降低肥效,说明碳酸钾溶液显碱性,即碳酸钾溶液中含有氢氧根离子;碳酸钾由碳酸根离子和钾离子构成,因此碳酸钾溶液中的阴离子主要有。
故答案为:
(1)54:5:16;
(2)CO2+H2O=H2CO3;B;
(3)。
【点评】本题考查了化学知识在节气相关情境中的应用。解题关键在于掌握化合物元素质量比计算、二氧化碳性质及常见物质的用途。这有助于提升学生将化学知识与实际联系的能力。
9.(2024 厦门校级模拟)小阳把自制的一种黄色花汁,分别滴加到下列不同的试剂中,并记录观察到的现象如表所示:
请分析上表,并回答下列问题:
试剂 稀盐酸 食醋 蔗糖水 蒸馏水 肥皂水 烧碱溶液
颜色 红 红 黄 黄 绿 绿
(1)该花汁 可以 (填“可以”或“不可以”)作酸碱指示剂。
(2)蚊子叮咬人时射入蚁酸(具有酸的性质),使皮肤红肿、痛痒。要缓解这种症状,简易可行的办法是在叮咬处涂抹上述试剂中的 肥皂水 。
(3)胃酸的主要成分是盐酸,胃舒平[主要成分Al(OH)3]常用于治疗胃酸过多症,写出胃舒平治疗胃酸过多症时的化学反应方程式: Al(OH)3+3HCl=AlCl3+3H2O 。
【考点】中和反应的实际应用;书写化学方程式、文字表达式、电离方程式;酸碱指示剂的选择及自制.
【专题】常见的酸 酸的通性.
【答案】(1)可以;
(2)肥皂水;
(3)Al(OH)3+3HCl=AlCl3+3H2O。
【分析】(1)根据稀盐酸、食醋显酸性;蔗糖水、蒸馏水呈中性;肥皂水、烧碱溶液呈碱性,从表中的颜色变化可知:该花汁遇到酸、碱以及中性溶液均会呈现不同的颜色进行分析;
(2)根据蚁酸呈酸性能导致皮肤红肿、痛痒,要消除症状应该涂抹碱性物质,所以应在肥皂水和烧碱溶液中选择进行分析;
(3)根据氢氧化铝和盐酸反应生成氯化铝和水进行分析。
【解答】解:(1)稀盐酸、食醋显酸性;蔗糖水、蒸馏水呈中性;肥皂水、烧碱溶液呈碱性,从表中的颜色变化可知:该花汁遇到酸、碱以及中性溶液均会呈现不同的颜色,可以作酸碱指示剂;
(2)由于蚁酸呈酸性能导致皮肤红肿、痛痒,故要消除症状应该涂抹碱性物质,烧碱溶液对皮肤具有强烈的腐蚀性,所以应该涂抹肥皂水;
(3)氢氧化铝和盐酸反应生成氯化铝和水,化学方程式为:Al(OH)3+3HCl=AlCl3+3H2O。
故答案为:(1)可以;
(2)肥皂水;
(3)Al(OH)3+3HCl=AlCl3+3H2O。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
10.(2024 肥城市模拟)科学食用营养物质,可以保障人体健康。
(1)某同学的部分体液的pH如图所示。
①图中碱性最强的体液是 胰液 。
②该同学胃酸(主要成分为盐酸)过多,可服用胃舒平【主要成分为Al(OH)3】治疗,其原理是 HCl+Al(OH)3=AlCl3+3H2O (用化学方程式表示)。
(2)某84消毒液产品的部分说明如下表。
【产品特点】主要成分为次氯酸钠(NaClO),有效氯的质量分数为5.1%~6.9%。 【餐具消毒】用有效氯的质量分数为0.04%的消毒液浸泡,20min后用生活饮用水冲净。 【注意事项】①外用消毒剂,须稀释后使用。 ②不得将本产品与酸性产品(如厕类清洁产品)同时使用。
①次氯酸钠中氯元素的化合价为 +1 ,次氯酸的化学式为 HClO 。
②据表信息,将有效氯的质量分数为6.0%的84消毒液10g加入 1490 g水进行稀释,即可用于餐具消毒。
③洁厕灵(主要成分为盐酸)与84消毒液混合会产生有毒的氯气(Cl2)。请将该反应的化学方程式补充完整:2HCl+NaClO= NaCl +Cl2↑+H2O。
【考点】中和反应的实际应用;溶液的酸碱性与pH的关系;化学式的书写及意义;有关元素化合价的计算;根据质量守恒定律判断物质的化学式;用水稀释改变浓度的方法.
【专题】化学式的计算;溶液的组成及溶质质量分数的计算;化学用语和质量守恒定律;常见的酸 酸的通性.
【答案】(1)胰液;HCl+Al(OH)3=AlCl3+3H2O;
(2)①+1;HClO;②1490;③NaCl。
【分析】(1)显碱性溶液pH大于7,pH越大碱性越强。氢氧化铝和盐酸反应生成氯化铝和水。
(2)①根据化合价原则进行分析;
②根据稀释前后溶质质量不变分析;
③根据原子数目守恒原则分析。
【解答】解:(1)①物质的pH>7,呈碱性,pH越大,碱性越强。故图中碱性最强的体液是胰液;
②氢氧化铝和盐酸反应生成氯化铝和水,化学方程式为3HCl+Al(OH)3=AlCl3+3H2O;
(2)①化合物中,钠元素的化合价为+1价,氧元素的化合价为﹣2价,设氯元素的化合价为x,根据化合物中各元素的化合价的代数和为零,则(+1)+x+(﹣2)=0,解得x=+1,次氯酸钠中钠元素化合价是+1价,次氯酸根是﹣1价,次氯酸中氢元素化合价是+1价,因此次氯酸的化学式为HClO;
②解:设加水的质量为x,根据稀释前后溶质质量不变可得10×6.0%=(10+x)×0.04%,x=1490,解得x=1490g;
③根据原子数目守恒原则,反应前有2个氢原子、3个氯原子、1个钠原子、1个氧原子;反应后有2个氯原子、2个氢原子、1个氧原子,发现反应后缺少1个钠原子和1个氯原子。
故答案为:(1)胰液;HCl+Al(OH)3=AlCl3+3H2O;
(2)①+1;HClO;②1490;③NaCl。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
11.(2024 西城区校级模拟)地球表面的氧化铁多形成于数亿年前的两次“大氧化事件”。微生物在进化过程中,演化出的“铁载体”对动植物吸收利用铁元素起着关键作用。
(1)“大氧化事件”中的某一重要反应如下:4Fe(OH)2+O2+2H2O=4Fe(OH)3,反应前后化合价改变的元素有 Fe、O 。
(2)土壤的酸碱性会影响铁载体细菌的生长。
①某地土壤的pH为6,该土壤呈 酸性 (填“酸性”、“中性”或“碱性”)。
②农业上常用于改良酸性土壤(含硫酸)的化学方程式是 H2SO4+Ca(OH)2=CaSO4+2H2O 。
【考点】中和反应的实际应用;溶液的酸碱性与pH的关系;有关元素化合价的计算.
【专题】常见的酸 酸的通性.
【答案】(1)Fe、O;
(2)①酸性;②H2SO4+Ca(OH)2=CaSO4+2H2O。
【分析】(1)根据单质中元素的化合价为0、在化合物中正负化合价的代数和为零,进行分析解答。
(2)①根据当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性,进行分析解答。
②根据氢氧化钙和硫酸反应生成硫酸钙和水,进行分析解答。
【解答】解:(1)Fe(OH)2中铁元素显+2价,氧元素显﹣2价,氢元素显+1价,O2中氧元素显0价,H2O中氧元素显﹣2价,氢元素显+1价,Fe(OH)3中铁元素显+3价,氧元素显﹣2价,氢元素显+1价,反应前后化合价改变的元素有Fe、O。
(2)①某地土壤的pH为6,<7,则该土壤呈酸性。
②氢氧化钙(俗称熟石灰、消石灰)具有碱性,农业上常用于改良酸性土壤的物质是熟石灰,氢氧化钙和硫酸反应生成硫酸钙和水,反应的化学方程式为H2SO4+Ca(OH)2=CaSO4+2H2O。
故答案为:
(1)Fe、O;
(2)①酸性;②H2SO4+Ca(OH)2=CaSO4+2H2O。
【点评】本题难度不大,了解中和反应的应用、溶液的酸碱性和溶液pH大小之间的关系等是正确解答本题的关键。
12.(2024 夏津县一模)中华优秀传统文化是中华文明的智慧结晶和精华所在,赋予了中华民族伟大的生命力和凝聚力。
(1)中国年味:过年贴春联是中华民族的传统习俗,书法家用墨书写对联,墨的主要成分是碳,对联能保存很长时间而不变色,因为 常温下,碳的化学性质稳定 。
(2)中国节气:“谷雨”:时雨乃降,百果乃登。正常雨水的pH≈5.6是由于空气中的 CO2 溶解在雨水中造成的,农业上常用 熟石灰 改良酸性土壤。
(3)中国科技:“玉兔号”月球车是中国首辆月球车,月球车上的太阳能电池板主要材料为硅。工业上可利用氢气和四氯化硅(SiCl4)在高温条件下反应制取高纯硅(Si),同时生成氯化氢,该反应的化学方程式为 ,反应后硅元素的化合价 降低 (填“升高”“降低”“不变”之一)。
(4)中国智慧:古代人使用的金属制品从3000多年前的青铜器到1500多年前的铁器再到距今100多年前的铝器,过程展现了古代人的智慧,这些金属材料中铝制品比铁制品耐腐蚀的原因是 铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止内部的铝进一步氧化 。
【考点】中和反应的实际应用;有关元素化合价的计算;书写化学方程式、文字表达式、电离方程式;碳的稳定性及应用;二氧化碳与水的反应及实验;金属与氧气的反应.
【专题】化学式的计算;化学用语和质量守恒定律;碳单质与含碳化合物的性质与用途;金属与金属材料;常见的酸 酸的通性.
【答案】见试题解答内容
【分析】(1)根据在常温下,碳的化学性质稳定分析。
(2)根据物质的性质来分析;
(3)根据化学反应的原理以及元素化合价的概念来分析;
(4)根据铝的化学性质来分析。
【解答】解:(1)在常温下,碳的化学性质稳定,则用墨书写的对联能保存很长时间而不变色。
(2)正常雨水显酸性,是因为空气中的二氧化碳和水反应生成碳酸,碳酸显酸性;
熟石灰为氢氧化钙的俗称,能和酸反应,可用于改良酸性土壤。
(3)氢气和四氯化硅在高温条件下反应生成硅和氯化氢,反应的化学方程式为:;
四氯化硅中,氯元素化合价为﹣1价,设硅元素化合价为x,根据“化合物中各元素化合价代数和为零”,则x+(﹣1)×4=0,解得x=+4,而硅单质中,硅元素化合价为0,则反应后硅元素化合价降低。
(4)铝具有耐腐蚀性,是因为常温下,铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止内部的铝进一步氧化。
故答案为:
(1)常温下,碳的化学性质稳定;
(2)CO2;熟石灰;
(3);降低;
(4)铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止内部的铝进一步氧化。
【点评】本题难度不大,掌握物质的性质及其用途、元素的化合价、化学方程式的写法是解题的关键。
13.(2025 长春模拟)以宏观、微观、符号相结合的方式认识和表征化学变化是学习化学的重要思维方式。某实验小组同学探究酸碱中和反应,向滴有酚酞的稀NaOH溶液中加入稀盐酸,发生反应的微观过程如图。
(1)反应结束时,溶液的pH < 7。
(2)由图可知,NaOH溶液与盐酸反应的实质是 氢离子与氢氧根离子结合生成水分子 。
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】(1)<;
(2)氢离子与氢氧根离子结合生成水分子。
【分析】(1)根据反应的微观过程图,进行分析解答。
(2)根据中和反应的实质,进行分析解答。
【解答】解:(1)由反应的微观过程图可知,反应后溶液中存在氢离子,即反应后溶液中存在盐酸,溶液的pH小于7。
(2)NaOH溶液与盐酸反应的实质是氢离子与氢氧根离子结合生成水分子。
故答案为:
(1)<;
(2)氢离子与氢氧根离子结合生成水分子。
【点评】本题难度不大,了解中和反应的原理、实质是正确解答本题的关键。
14.(2025 广州一模)同学们借助传感器研究氢氧化钠溶液与稀硫酸的中和反应,实验过程中溶液pH及温度的变化如图1、图2所示。
(1)由图1可知该实验是将 稀硫酸 溶液滴入 氢氧化钠 溶液中,反应的化学方程式为 2NaOH+H2SO4═Na2SO4+2H2O 。由图2可知,此反应属于 放热 反应。(填“吸热”或“放热”)
(2)a、b、c、d四点对应的溶液中,能使酚酞试液变红的是 a (填标号)。d点对应溶液的溶质是 Na2SO4、H2SO4 (填化学式)。
(3)下列有关说法,正确的是 AB (填标号)。
A.a→b时,溶液的温度在升高
B.a→d时,溶液的pH在减小
C.b→c时,钠盐的质量在增加
D.b点溶液中阴、阳离子个数相等
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】(1)稀硫酸;氢氧化钠;
(2)2NaOH+H2SO4═Na2SO4+2H2O;放热;
(3)a;AB。
【分析】(1)根据图像中pH的变化是从大于7逐渐减小到小于7,进行分析解答。
(2)根据无色酚酞溶液遇酸性溶液不变色,遇中性溶液不变色,遇碱性溶液变红色,
(3)A.根据中和反应属于放热反应,进行分析判断。
B.根据d点溶液是氢氧化钠和硫酸恰好完全反应后继续滴加稀硫酸,进行分析判断。
C.根据b→c时,是硫酸和氢氧化钠恰好完全反应后继续滴加稀硫酸,进行分析判断。
D.根据b点溶液的pH=7,进行分析判断。
【解答】解:(1)由图像可知,pH开始时大于7,逐渐减小到7,然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀硫酸滴加到氢氧化钠溶液中。氢氧化钠和硫酸反应生成硫酸钠和水,反应的化学方程式为2NaOH+H2SO4═Na2SO4+2H2O。由图2可知,反应过程中温度升高,此反应属于放热反应。
(2)a、b、c、d四点对应的溶液中,a点溶液的pH大于7,显碱性,能使酚酞试液变红;d点溶液是氢氧化钠和硫酸恰好完全反应后继续滴加稀硫酸,d点对应溶液的溶质是Na2SO4、H2SO4。
(3)A.中和反应属于放热反应,a→b时,溶液的温度在升高,故选项说法正确。
B.d点溶液是氢氧化钠和硫酸恰好完全反应后继续滴加稀硫酸,a→d时,溶液的pH在减小,故选项说法正确。
C.b→c时,是硫酸和氢氧化钠恰好完全反应后继续滴加稀硫酸,钠盐的质量不变,故选项说法错误。
D.b点溶液的pH=7,溶质是硫酸钠,其化学式为Na2SO4,b点溶液中阴、阳离子个数不相等,故选项说法错误。
故答案为:
(1)稀硫酸;氢氧化钠;
(2)2NaOH+H2SO4═Na2SO4+2H2O;放热;
(3)a;AB。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
15.(2025春 嵩县期中)某同学用传感器测定稀硫酸滴入稀氢氧化钡溶液的过程中pH的变化,测定的结果如图所示。硫酸与氢氧化钡反应的化学方程式为 H2SO4+Ba(OH)2=BaSO4↓+2H2O ;a点所表示的溶液中溶质为 Ba(OH)2 ;在c点所表示的溶液中滴加酚酞溶液,溶液显 无 色。
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】H2SO4+Ba(OH)2=BaSO4↓+2H2O;Ba(OH)2;无。
【分析】根据硫酸与氢氧化钡反应生成硫酸钡沉淀和水,a点所表示的溶液的pH大于7,c点所表示的溶液的pH小于7,进行分析解答。
【解答】解:硫酸与氢氧化钡反应生成硫酸钡沉淀和水,反应的化学方程式为H2SO4+Ba(OH)2=BaSO4↓+2H2O;a点所表示的溶液的pH大于7,显碱性,溶液中溶质为Ba(OH)2;c点所表示的溶液的pH小于7,显酸性,在c点所表示的溶液中滴加酚酞溶液,溶液显无色。
故答案为:
H2SO4+Ba(OH)2=BaSO4↓+2H2O;Ba(OH)2;无。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
16.(2025 高青县一模)某同学用pH传感器测定稀硫酸滴入氢氧化钾溶液的过程中pH的变化,测定的结果如图所示。
(1)在a点的溶液中滴加酚酞溶液,溶液会显 红 色。此时,溶液中存在的阴离子有 OH﹣、 (填离子符号)。
(2)b点处溶液pH = 7,硫酸与氢氧化钾反应的化学方程式为 2KOH+H2SO4=K2SO4+2H2O 。该反应的类型是 复分解 反应,反应的实质是 H+和OH﹣结合生成H2O 。
(3)c点的溶液中溶质为 K2SO4、H2SO4 。
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】(1)红;OH﹣、;
(2)=;2KOH+H2SO4=K2SO4+2H2O;复分解;H+和OH﹣结合生成H2O;
(3)K2SO4、H2SO4。
【分析】(1)观察图像,a点溶液pH大于7,溶液呈碱性,据此判断酚酞溶液的显色情况;碱性溶液中存在氢氧根离子,硫酸与氢氧化钾反应生成硫酸钾,溶液中还存在硫酸钾电离出的硫酸根离子。
(2)b 点pH等于7,说明此时硫酸与氢氧化钾恰好完全反应。
(3)c 点溶液pH小于7,呈酸性,说明硫酸过量,溶液中的溶质为硫酸钾和硫酸;根据硫酸与氢氧化钾反应生成硫酸钾和水的事实,写出化学方程式,判断反应类型并分析反应实质。
【解答】解:(1)a点溶液pH大于7,显碱性,在a点的溶液中滴加酚酞溶液,溶液会显红色。此时溶液中存在氢氧化钾与硫酸反应生成的硫酸钾,还有未反应完的氢氧化钾,所以溶液中存在的阴离子有OH﹣、。
(2)b点处溶液pH=7。硫酸与氢氧化钾反应生成硫酸钾和水,化学方程式为2KOH+H2SO4=K2SO4+2H2O;该反应是两种化合物相互交换成分生成另外两种化合物的反应,属于复分解反应;反应的实质是H+和OH﹣结合生成H2O。
(3)c 点溶液pH小于 7,硫酸过量,溶液中溶质为K2SO4、H2SO4。
故答案为:
(1)红;OH﹣、;
(2)=;2KOH+H2SO4=K2SO4+2H2O;复分解;H+和OH﹣结合生成H2O;
(3)K2SO4、H2SO4。
【点评】本题考查酸碱中和反应与pH的相关知识。解题关键在于理解pH与溶液酸碱性的关系,以及酸碱中和反应的原理和实质。通过分析图像数据来解答问题,有助于提升对酸碱反应知识的理解和应用能力。
17.(2025 宣威市校级模拟)小聪利用pH传感器探究稀盐酸和氢氧化钠溶液的反应过程,实验装置如图1。向盛有一定量含有酚酞的X溶液中逐滴加入Y溶液,同时搅拌,测定烧杯中溶液的pH如图2所示。
(1)烧杯中的X溶液是 稀盐酸 。
(2)结合图像分析上述实验,a点溶液的pH < (选填“>”“=”或“<”)7;烧杯中NaCl的质量分数 先增大、后减小 (选填“先增大后减小”或“先减小后增大”)。
(3)写出氢氧化钠与盐酸发生反应的化学方程式为 HCl+NaOH=NaCl+H2O 。
(4)当pH=7时,消耗4%的氢氧化钠溶液10克,则被中和的盐酸溶质质量为 0.365 g。
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】(1)稀盐酸;
(2)<;先增大、后减小;
(3)HCl+NaOH=NaCl+H2O;
(4)0.365。
【分析】(1)根据溶液的pH变化情况来分析;
(2)根据溶液的pH以及化学反应的原理来分析;
(3)根据化学反应的原理来分析;
(4)根据溶液中氢氧化钠的质量,利用化学方程式来分析计算。
【解答】解:(1)由图可知,一开始pH小于7,随着反应的进行,pH逐渐增大至大于7,故该实验是将氢氧化钠溶液滴入稀盐酸中,故烧杯中的X溶液是稀盐酸;
(2)由图可知,a点时,溶液的pH<7;氢氧化钠和稀盐酸反应生成氯化钠和水,反应生成了氯化钠,溶质质量逐渐增加,溶质质量分数逐渐增大,待完全反应后,氯化钠的质量不再变化,继续滴入稀盐酸,溶液质量增加,故溶质质量分数逐渐减小,故烧杯中氯化钠的质量分数先增大、后减小;
(3)氢氧化钠与稀盐酸反应生成氯化钠和水,该反应的化学方程式为:HCl+NaOH=NaCl+H2O;
(4)设被中和的盐酸中溶质质量为x,则:
HCl+NaOH=NaCl+H2O
36.5 40
x 10g×4%
x=0.365g
答:被中和的盐酸溶质质量为0.365g。
故答案为:(1)稀盐酸;
(2)<;先增大、后减小;
(3)HCl+NaOH=NaCl+H2O;
(4)0.365。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
18.(2025 许昌一模)室温时,向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液温度的变化)。
(1)a点溶液中的微粒为 氢离子、硫酸根离子、水分子(或H+、、H2O) 。
(2)b点烧杯内液体的pH = 7(填“>”“=”“<”)。
(3)c点溶液中滴加紫色石蕊溶液,溶液颜色为 蓝色 。
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】(1)氢离子、硫酸根离子、水分子(或H+、、H2O);
(2)=;
(3)蓝色。
【分析】根据向盛有稀H2SO4的烧杯中逐滴加入Ba(OH)2溶液,硫酸与氢氧化钡反应生成硫酸钡沉淀和水,溶液中溶质的质量逐渐减小,二者恰好完全反应后,继续滴加氢氧化钡溶液,溶液变为Ba(OH)2溶液,溶质质量又会逐渐增加,进行分析解答。
【解答】解:(1)向盛有稀H2SO4的烧杯中逐滴加入Ba(OH)2溶液,硫酸与氢氧化钡反应生成硫酸钡沉淀和水,溶液中溶质的质量逐渐减小,a点为稀H2SO4有剩余,a点溶液中的微粒为氢离子、硫酸根离子、水分子(或H+、、H2O)。
(2)b点硫酸与氢氧化钡恰好完全反应,为水,显中性,烧杯内液体的pH=7。
(3)c点溶液为Ba(OH)2溶液,溶液呈碱性,滴加紫色石蕊溶液,溶液为蓝色。
故答案为:
(1)氢离子、硫酸根离子、水分子(或H+、、H2O);
(2)=;
(3)蓝色。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
19.(2025 襄城县模拟)图甲是利用数字化传感器测得的盐酸和氢氧化钠溶液反应时溶液pH的变化图像。
(1)该反应的化学方程式为 HCl+NaOH═NaCl+H2O。 。
(2)当溶液呈中性时,所消耗氢氧化钠溶液的体积是 10 mL。
(3)请在图乙的虚线框内将C点时溶液中的微粒补画完整。
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】(1)HCl+NaOH=NaCl+H2O;
(2)10;
(3)。
【分析】(1)根据盐酸和氢氧化钠反应生成氯化钠和水,进行分析解答。
(2)根据当溶液呈中性时,溶液的pH=7,进行分析解答。
(3)根据C点时溶液的pH大于7,进行分析解答。
【解答】解:(1)盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式为HCl+NaOH═NaCl+H2O。
(2)当溶液呈中性时,溶液的pH=7,所消耗氢氧化钠溶液的体积是10mL。
(3)C点时溶液的pH大于7,溶液显碱性,氢氧化钠溶液过量,溶液中溶质是氢氧化钠、氯化钠,虚线框内微粒为钠离子、氢氧根离子,其离子符号分别是Na+、OH﹣,即。
故答案为:
(1)HCl+NaOH=NaCl+H2O;
(2)10;
(3)。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
中考核心考点 酸碱中和反应及其应用
一.选择题(共6小题)
1.(2025 瑶海区模拟)研究和学习化学有许多重要的方法,下列方法中所举示例正确的是( )
选项 方法 示例
A 观察法 根据固体颜色区分黄铜和黄金
B 归纳法 空气、过氧化氢溶液属于混合物,混合物中至少含有两种元素
C 推理法 酸性溶液能使石蕊溶液变红,则能使石蕊溶液变红的一定显酸性
D 实验法 测浓硫酸与氢氧化钠溶液混合前后温度变化,探究酸和碱能发生反应
A.A B.B C.C D.D
2.(2025 武冈市模拟)实验小组用pH传感器研究氢氧化钠溶液与稀盐酸的反应,随着滴加试剂的体积增加,烧杯中溶液的pH变化如图所示。下列说法错误的是( )
A.滴管中的溶液是稀盐酸
B.a点时溶液中钠离子数量最多
C.b点时二者恰好完全反应
D.c点时溶液能使紫色石蕊溶液变红
3.(2025 香坊区二模)某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应过程并用pH传感器和温度传感器进行测量,得到图2和图3。下列说法错误的是( )
A.图2中c点表示氢氧化钠和盐酸恰好完全反应
B.图2中b点所示溶液中的溶质为NaCl和NaOH
C.图2中c→d所示溶液中NaCl的质量不断增加
D.图3中e→f变化趋势说明该反应放出热量
4.(2025 禅城区模拟)兴趣小组利用题图1装置,对稀盐酸和NaOH溶液的反应进行探究,并用传感器记录数据,结果如题图2所示。下列说法错误的是( )
A.溶液乙是稀盐酸
B.a点时溶液的溶质是NaCl和NaOH
C.该反应是放热反应
D.恰好完全反应时,溶液总质量为300g
5.(2025 昆明模拟)为探究氢氧化钠溶液与稀硫酸的反应,甲、乙两组同学按图1所示装置完成实验,测定出反应过程中溶液pH的变化如图2所示。下列说法中错误的是( )
A.甲组实验pH变化对应的曲线是Ⅱ
B.若取M点对应溶液滴加紫色石蕊试液,试液变为红色
C.向部分变质的氢氧化钠溶液中加入适量CaCl2溶液可除去杂质
D.配制10%的稀硫酸196g,需要98%的浓硫酸20g
6.(2025 深圳模拟)某同学利用图1装置研究浓盐酸与NaOH溶液的反应,实验时先滴入酚酞溶液,再滴入浓盐酸,测出左侧试管内溶液的pH曲线如图2。下列说法正确的是( )
A.实验中浓盐酸可换成浓硫酸
B.t1时,a点溶液中有大量的H+
C.t2时,b点溶液的颜色为红色
D.c点溶液中溶质有酚酞、HCl和NaCl
二.填空题(共13小题)
7.(2025 郑州模拟)中和反应在日常生活和工农业生产中有着广泛的应用。
(1)若土壤的酸性过强,可加入 进行改良。
(2)印染厂的碱性废水可用硫酸进行中和处理。在处理过程中,废水pH的变化为 。
(3)胃酸(主要成分为盐酸)过多的病人,可服用含氢氧化铝的药物治疗。写出该反应的化学方程式: 。
8.(2024春 梁溪区校级月考)“二十四节气”是我国古代农耕文化的产物,农耕生产与节气息息相关。
(1)“立春”:万物复苏,春暖花开。乙酸苯甲酯(C9H10O2)是一种具有茉莉花香味的物质,乙酸苯甲酯中碳、氢、氧元素质量比是 (填最简整数比)。
(2)“谷雨”:时雨乃降,百果乃登。正常雨水略显酸性,请用化学方程式表示其原因是 。酸雨容易导致土壤酸化,不利于农作物生长,常用 (填字母)改良酸性土壤。
A.氢氧化钠
B.氢氧化钙
C.碳酸
D.KNO3
(3)“小满”:小满不满,麦有一险。为促进小麦生长,需追加肥料。草木灰是一种钾肥,主要成分是碳酸钾,碳酸钾溶液中的阴离子主要有 。
9.(2024 厦门校级模拟)小阳把自制的一种黄色花汁,分别滴加到下列不同的试剂中,并记录观察到的现象如表所示:
请分析上表,并回答下列问题:
试剂 稀盐酸 食醋 蔗糖水 蒸馏水 肥皂水 烧碱溶液
颜色 红 红 黄 黄 绿 绿
(1)该花汁 (填“可以”或“不可以”)作酸碱指示剂。
(2)蚊子叮咬人时射入蚁酸(具有酸的性质),使皮肤红肿、痛痒。要缓解这种症状,简易可行的办法是在叮咬处涂抹上述试剂中的 。
(3)胃酸的主要成分是盐酸,胃舒平[主要成分Al(OH)3]常用于治疗胃酸过多症,写出胃舒平治疗胃酸过多症时的化学反应方程式: 。
10.(2024 肥城市模拟)科学食用营养物质,可以保障人体健康。
(1)某同学的部分体液的pH如图所示。
①图中碱性最强的体液是 。
②该同学胃酸(主要成分为盐酸)过多,可服用胃舒平【主要成分为Al(OH)3】治疗,其原理是 (用化学方程式表示)。
(2)某84消毒液产品的部分说明如下表。
【产品特点】主要成分为次氯酸钠(NaClO),有效氯的质量分数为5.1%~6.9%。 【餐具消毒】用有效氯的质量分数为0.04%的消毒液浸泡,20min后用生活饮用水冲净。 【注意事项】①外用消毒剂,须稀释后使用。 ②不得将本产品与酸性产品(如厕类清洁产品)同时使用。
①次氯酸钠中氯元素的化合价为 ,次氯酸的化学式为 。
②据表信息,将有效氯的质量分数为6.0%的84消毒液10g加入 g水进行稀释,即可用于餐具消毒。
③洁厕灵(主要成分为盐酸)与84消毒液混合会产生有毒的氯气(Cl2)。请将该反应的化学方程式补充完整:2HCl+NaClO= +Cl2↑+H2O。
11.(2024 西城区校级模拟)地球表面的氧化铁多形成于数亿年前的两次“大氧化事件”。微生物在进化过程中,演化出的“铁载体”对动植物吸收利用铁元素起着关键作用。
(1)“大氧化事件”中的某一重要反应如下:4Fe(OH)2+O2+2H2O=4Fe(OH)3,反应前后化合价改变的元素有 。
(2)土壤的酸碱性会影响铁载体细菌的生长。
①某地土壤的pH为6,该土壤呈 (填“酸性”、“中性”或“碱性”)。
②农业上常用于改良酸性土壤(含硫酸)的化学方程式是 。
12.(2024 夏津县一模)中华优秀传统文化是中华文明的智慧结晶和精华所在,赋予了中华民族伟大的生命力和凝聚力。
(1)中国年味:过年贴春联是中华民族的传统习俗,书法家用墨书写对联,墨的主要成分是碳,对联能保存很长时间而不变色,因为 。
(2)中国节气:“谷雨”:时雨乃降,百果乃登。正常雨水的pH≈5.6是由于空气中的 溶解在雨水中造成的,农业上常用 改良酸性土壤。
(3)中国科技:“玉兔号”月球车是中国首辆月球车,月球车上的太阳能电池板主要材料为硅。工业上可利用氢气和四氯化硅(SiCl4)在高温条件下反应制取高纯硅(Si),同时生成氯化氢,该反应的化学方程式为 ,反应后硅元素的化合价 (填“升高”“降低”“不变”之一)。
(4)中国智慧:古代人使用的金属制品从3000多年前的青铜器到1500多年前的铁器再到距今100多年前的铝器,过程展现了古代人的智慧,这些金属材料中铝制品比铁制品耐腐蚀的原因是 。
13.(2025 长春模拟)以宏观、微观、符号相结合的方式认识和表征化学变化是学习化学的重要思维方式。某实验小组同学探究酸碱中和反应,向滴有酚酞的稀NaOH溶液中加入稀盐酸,发生反应的微观过程如图。
(1)反应结束时,溶液的pH 7。
(2)由图可知,NaOH溶液与盐酸反应的实质是 。
14.(2025 广州一模)同学们借助传感器研究氢氧化钠溶液与稀硫酸的中和反应,实验过程中溶液pH及温度的变化如图1、图2所示。
(1)由图1可知该实验是将 溶液滴入 溶液中,反应的化学方程式为 。由图2可知,此反应属于 反应。(填“吸热”或“放热”)
(2)a、b、c、d四点对应的溶液中,能使酚酞试液变红的是 (填标号)。d点对应溶液的溶质是 (填化学式)。
(3)下列有关说法,正确的是 (填标号)。
A.a→b时,溶液的温度在升高
B.a→d时,溶液的pH在减小
C.b→c时,钠盐的质量在增加
D.b点溶液中阴、阳离子个数相等
15.(2025春 嵩县期中)某同学用传感器测定稀硫酸滴入稀氢氧化钡溶液的过程中pH的变化,测定的结果如图所示。硫酸与氢氧化钡反应的化学方程式为 ;a点所表示的溶液中溶质为 ;在c点所表示的溶液中滴加酚酞溶液,溶液显 色。
16.(2025 高青县一模)某同学用pH传感器测定稀硫酸滴入氢氧化钾溶液的过程中pH的变化,测定的结果如图所示。
(1)在a点的溶液中滴加酚酞溶液,溶液会显 色。此时,溶液中存在的阴离子有 (填离子符号)。
(2)b点处溶液pH 7,硫酸与氢氧化钾反应的化学方程式为 。该反应的类型是 反应,反应的实质是 。
(3)c点的溶液中溶质为 。
17.(2025 宣威市校级模拟)小聪利用pH传感器探究稀盐酸和氢氧化钠溶液的反应过程,实验装置如图1。向盛有一定量含有酚酞的X溶液中逐滴加入Y溶液,同时搅拌,测定烧杯中溶液的pH如图2所示。
(1)烧杯中的X溶液是 。
(2)结合图像分析上述实验,a点溶液的pH (选填“>”“=”或“<”)7;烧杯中NaCl的质量分数 (选填“先增大后减小”或“先减小后增大”)。
(3)写出氢氧化钠与盐酸发生反应的化学方程式为 。
(4)当pH=7时,消耗4%的氢氧化钠溶液10克,则被中和的盐酸溶质质量为 g。
18.(2025 许昌一模)室温时,向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液温度的变化)。
(1)a点溶液中的微粒为 。
(2)b点烧杯内液体的pH 7(填“>”“=”“<”)。
(3)c点溶液中滴加紫色石蕊溶液,溶液颜色为 。
19.(2025 襄城县模拟)图甲是利用数字化传感器测得的盐酸和氢氧化钠溶液反应时溶液pH的变化图像。
(1)该反应的化学方程式为 。
(2)当溶液呈中性时,所消耗氢氧化钠溶液的体积是 mL。
(3)请在图乙的虚线框内将C点时溶液中的微粒补画完整。
中考核心考点 酸碱中和反应及其应用
参考答案与试题解析
一.选择题(共6小题)
1.(2025 瑶海区模拟)研究和学习化学有许多重要的方法,下列方法中所举示例正确的是( )
选项 方法 示例
A 观察法 根据固体颜色区分黄铜和黄金
B 归纳法 空气、过氧化氢溶液属于混合物,混合物中至少含有两种元素
C 推理法 酸性溶液能使石蕊溶液变红,则能使石蕊溶液变红的一定显酸性
D 实验法 测浓硫酸与氢氧化钠溶液混合前后温度变化,探究酸和碱能发生反应
A.A B.B C.C D.D
【考点】中和反应相关实验与计算;纯净物和混合物的判别;合金与合金的性质;常见的酸碱指示剂及其变色情况.
【专题】物质的鉴别题;物质的分类;常见的酸 酸的通性.
【答案】C
【分析】A、根据黄铜和黄金的颜色,进行分析判断。
B、根据常见物质的元素组成,进行分析判断。
C、紫色石蕊溶液遇酸性溶液变红,遇中性溶液不变色,遇碱性溶液变蓝色。
D、根据浓硫酸溶于水放热,进行分析判断。
【解答】解:A、黄铜和黄金均为黄色固体,通过观察颜色无法区分,故选项说法错误。
B、空气含氮气、氧气等多种物质,过氧化氢溶液含过氧化氢和水,属于混合物。但混合物是由两种或多种物质混合而成,不一定至少含两种元素,如氧气(O2)和臭氧(O3)混合,只含一种氧元素,故选项说法错误。
C、酸性溶液能使石蕊溶液变红,则能使石蕊溶液变红的溶液一定显酸性,故选项说法正确。
D、浓硫酸溶于水放热,测浓硫酸与氢氧化钠溶液混合前后温度变化,不能确定是酸和碱发生反应放热,还是浓硫酸溶于水放热,不能有效探究酸和碱能否发生反应,故选项说法错误。
故选:C。
【点评】本题难度不大,了解浓硫酸溶于水放热、常见物质的元素组成、紫色石蕊溶液的性质等是正确解答本题的关键。
2.(2025 武冈市模拟)实验小组用pH传感器研究氢氧化钠溶液与稀盐酸的反应,随着滴加试剂的体积增加,烧杯中溶液的pH变化如图所示。下列说法错误的是( )
A.滴管中的溶液是稀盐酸
B.a点时溶液中钠离子数量最多
C.b点时二者恰好完全反应
D.c点时溶液能使紫色石蕊溶液变红
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】B
【分析】A、根据溶液的pH变化来分析;
B、根据化学反应的原理来分析;
C、根据溶液的pH来分析;
D、根据溶液的pH与酸碱性的关系、酸碱指示剂的变色情况来分析。
【解答】解:氢氧化钠溶液与稀盐酸反应生成氯化钠和水,发生的反应是NaOH+HCl=NaCl+H2O。
A、稀盐酸呈酸性,氢氧化钠溶液呈碱性,氯化钠溶液呈中性。由图可知,溶液的pH开始时大于7,呈碱性,随着试剂滴加,pH逐渐减小,说明是向氢氧化钠溶液中滴加稀盐酸,所以滴管中的溶液是稀盐酸,故选项A说法正确;
B、在反应过程中,钠离子没有参与反应,其数量始终不变,并非a点时最多,故选项B说法错误;
C、b点时溶液的pH=7,说明氢氧化钠溶液和稀盐酸恰好完全反应,故选项C说法正确;
D、c点时溶液的pH小于7,溶液呈酸性,酸性溶液能使紫色石蕊溶液变红,故选项D说法正确。
故选:B。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系等是正确解答本题的关键。
3.(2025 香坊区二模)某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应过程并用pH传感器和温度传感器进行测量,得到图2和图3。下列说法错误的是( )
A.图2中c点表示氢氧化钠和盐酸恰好完全反应
B.图2中b点所示溶液中的溶质为NaCl和NaOH
C.图2中c→d所示溶液中NaCl的质量不断增加
D.图3中e→f变化趋势说明该反应放出热量
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】C
【分析】A、根据c点溶液的pH=7,进行分析判断。
B、根据b点时溶液的pH>7,进行分析判断。
C、根据c点时是氢氧化钠溶液与稀盐酸恰好反应,进行分析判断。
D、根据e→f温度升高,进行分析判断。
【解答】解:A、c点时溶液的pH=7,溶液显中性,表示氧化钠和盐酸恰好完全反应,故选项说法正确。
B、b点时溶液的pH>7,说明氢氧化钠没有被完全反应,图中b点所示溶液中的溶质是NaCl和NaOH,故选项说法正确。
C、图中c点时是氢氧化钠溶液与稀盐酸恰好反应,图中c→d是溶液由中性变为酸性,表示所示溶液中稀盐酸的质量不断增加,这时氢氧化钠已被完全消耗,不能再生成氯化钠,故选项说法错误。
D、图中e→f温度升高,该变化趋势可说明该反应是放热反应,故选项说法正确。
故选:C。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
4.(2025 禅城区模拟)兴趣小组利用题图1装置,对稀盐酸和NaOH溶液的反应进行探究,并用传感器记录数据,结果如题图2所示。下列说法错误的是( )
A.溶液乙是稀盐酸
B.a点时溶液的溶质是NaCl和NaOH
C.该反应是放热反应
D.恰好完全反应时,溶液总质量为300g
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】B
【分析】A、根据溶液pH的变化来分析;
B、根据溶液pH与酸碱性的关系来分析;
C、根据化学反应过程中温度的变化来分析;
D、根据质量守恒定律来分析。
【解答】解:A、由溶液的pH变化曲线可知,原烧杯内乙溶液的pH小于7,显酸性,因此溶液乙是稀盐酸,则溶液甲是氢氧化钠溶液,故A说法正确;
B、氢氧化钠与盐酸反应生成氯化钠和水,a点所示溶液的pH小于7,显酸性,则该点所示溶液中的溶质是氯化钠和氯化氢,故B说法错误;
C、由化学反应中的温度变化曲线可知,反应过程中温度升高,因此该反应是放热反应,故C说法正确;
D、烧杯内原稀盐酸的质量为200g,由图像可知,恰好反应时,滴加氢氧化钠溶液的质量为100g,由质量守恒定律可知,恰好完全反应时,溶液总质量为300g,故D说法正确。
故选:B。
【点评】此题主要考查常见物质的性质,主要利用物质的性质来分析和解决有关问题,结合各方面的条件得出正确结论。
5.(2025 昆明模拟)为探究氢氧化钠溶液与稀硫酸的反应,甲、乙两组同学按图1所示装置完成实验,测定出反应过程中溶液pH的变化如图2所示。下列说法中错误的是( )
A.甲组实验pH变化对应的曲线是Ⅱ
B.若取M点对应溶液滴加紫色石蕊试液,试液变为红色
C.向部分变质的氢氧化钠溶液中加入适量CaCl2溶液可除去杂质
D.配制10%的稀硫酸196g,需要98%的浓硫酸20g
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】C
【分析】A、根据甲组同学中选用5%的稀硫酸,乙组同学选用10%的稀硫酸,进行分析判断。
B、根据M点对应溶液的pH小于7,进行分析判断。
C、根据部分变质的氢氧化钠溶液中溶质是碳酸钠、氢氧化钠,进行分析判断。
D、根据溶液稀释前后溶质的质量不变,进行分析判断。
【解答】解:A、甲组同学中选用5%的稀硫酸,乙组同学选用10%的稀硫酸,相同体积时,乙组消耗的氢氧化钠的质量大,溶液的pH下降的快,故乙组实验pH变化对应的曲线是Ⅰ,甲组实验pH变化对应的曲线是Ⅱ,故选项说法正确。
B、M点对应溶液的pH小于7,显酸性,若取M点对应溶液滴加紫色石蕊试液,试液变为红色,故选项说法正确。
C、部分变质的氢氧化钠溶液中溶质是碳酸钠、氢氧化钠,向部分变质的氢氧化钠溶液中加入适量CaCl2溶液,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,能除去杂质但引入了新的杂质氯化钠,不符合除杂原则,故选项说法错误。
D、配制10%的稀硫酸196g,设需要98%的浓硫酸的质量为x,根据溶液稀释前后溶质的质量不变,则196g×10%=x×98%,x=20g,故选项说法正确。
故选:C。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
6.(2025 深圳模拟)某同学利用图1装置研究浓盐酸与NaOH溶液的反应,实验时先滴入酚酞溶液,再滴入浓盐酸,测出左侧试管内溶液的pH曲线如图2。下列说法正确的是( )
A.实验中浓盐酸可换成浓硫酸
B.t1时,a点溶液中有大量的H+
C.t2时,b点溶液的颜色为红色
D.c点溶液中溶质有酚酞、HCl和NaCl
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】D
【分析】A、根据浓盐酸具有挥发性,进行分析判断。
B、根据a点溶液的pH>7,进行分析判断。
C、根据b点溶液的pH=7,进行分析判断。
D、根据c点溶液的pH<7,进行分析判断。
【解答】解:A、浓盐酸具有挥发性,挥发出的氯化氢溶于水形成盐酸,盐酸和氢氧化钠发生反应生成氯化钠和水。浓硫酸不具有挥发性,不能将浓盐酸换成浓硫酸,故选项说法错误。
B、a点溶液的pH>7,显碱性,溶液中有大量的氢氧根离子,故选项说法错误。
C、b点溶液的pH=7,酚酞遇中性溶液为无色,溶液颜色为无色,故选项说法错误。
D、c点溶液的pH<7,溶液中氢氧化钠被全部反应,盐酸过量;氢氧化钠和盐酸反应生成氯化钠和水,c点溶液中溶质有酚酞、HCl和NaCl,故选项说法正确。
故选:D。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
二.填空题(共13小题)
7.(2025 郑州模拟)中和反应在日常生活和工农业生产中有着广泛的应用。
(1)若土壤的酸性过强,可加入 氢氧化钙或熟石灰或Ca(OH)2 进行改良。
(2)印染厂的碱性废水可用硫酸进行中和处理。在处理过程中,废水pH的变化为 由大到小(或逐渐减小) 。
(3)胃酸(主要成分为盐酸)过多的病人,可服用含氢氧化铝的药物治疗。写出该反应的化学方程式: Al(OH)3+3HCl═AlCl3+3H2O 。
【考点】中和反应的实际应用;溶液的酸碱性与pH的关系;书写化学方程式、文字表达式、电离方程式.
【专题】常见的酸 酸的通性.
【答案】(1)氢氧化钙或熟石灰或Ca(OH)2;
(2)由大到小(或逐渐减小);
(3)Al(OH)3+3HCl═AlCl3+3H2O。
【分析】(1)根据改良酸性土壤的方法来分析;
(2)根据溶液酸碱性的变化来分析;
(3)根据化学反应的原理来分析。
【解答】解:(1)氢氧化钙俗称熟石灰,是一种碱,能与土壤中的酸性物质反应,因此可用氢氧化钙改良酸性土壤;故答案为:氢氧化钙或熟石灰或Ca(OH)2;
(2)碱性溶液的pH大于7,随着与硫酸的反应,溶液的碱性减弱,pH变小,故印染厂的碱性废水可用硫酸进行中和处理。在处理过程中,废水pH的变化为由大到小或逐渐减小;故答案为:由大到小(或逐渐减小);
(3)氢氧化铝与盐酸反应生成氯化铝和水,化学方程式为Al(OH)3+3HCl═AlCl3+3H2O;故答案为:Al(OH)3+3HCl═AlCl3+3H2O。
【点评】要想解答好这类题目,首先,要理解和熟记中和反应及其应用等相关知识。然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生活经验所得,细致地分析题意(或实验、图表信息)等各种信息资源,联系起来综合分析,并细心地探究、推理后,按照题目要求进行认真地选择或解答即。
8.(2024春 梁溪区校级月考)“二十四节气”是我国古代农耕文化的产物,农耕生产与节气息息相关。
(1)“立春”:万物复苏,春暖花开。乙酸苯甲酯(C9H10O2)是一种具有茉莉花香味的物质,乙酸苯甲酯中碳、氢、氧元素质量比是 54:5:16 (填最简整数比)。
(2)“谷雨”:时雨乃降,百果乃登。正常雨水略显酸性,请用化学方程式表示其原因是 CO2+H2O=H2CO3 。酸雨容易导致土壤酸化,不利于农作物生长,常用 B (填字母)改良酸性土壤。
A.氢氧化钠
B.氢氧化钙
C.碳酸
D.KNO3
(3)“小满”:小满不满,麦有一险。为促进小麦生长,需追加肥料。草木灰是一种钾肥,主要成分是碳酸钾,碳酸钾溶液中的阴离子主要有 。
【考点】中和反应的实际应用;酸雨的产生、危害及防治;分子、原子、离子、元素与物质之间的关系;元素质量比的计算;书写化学方程式、文字表达式、电离方程式.
【专题】化学式的计算;物质的微观构成与物质的宏观组成;常见的酸 酸的通性.
【答案】(1)54:5:16;
(2)CO2+H2O=H2CO3;B;
(3)。
【分析】(1)根据化合物中各元素质量比的计算方法,即各元素的相对原子质量乘以原子个数之比,来计算乙酸苯甲酯中碳、氢、氧元素质量比。
(2)正常雨水略显酸性是因为二氧化碳与水反应生成碳酸;改良酸性土壤需要使用碱性物质,分析各选项物质的酸碱性来选择合适的改良剂。
(3)碳酸钾在水中会解离出钾离子和碳酸根离子,找出其中的阴离子。
【解答】解:(1)乙酸苯甲酯中碳、氢、氧元素质量比为(12×9):(1×10):(16×2)=54:5:16;
(2)正常雨水略显酸性,是因为空气中的二氧化碳与水反应生成碳酸,碳酸显酸性,化学方程式为CO2+H2O=H2CO3;酸雨容易导致土壤酸化,不利于农作物生长,常用熟石灰改良酸性土壤,故选:B;
(3)草木灰是一种钾肥,主要成分是碳酸钾,一般不与铵态氮肥混合使用,铵态氮肥能与碱性物质反应生成氨气会降低肥效,说明碳酸钾溶液显碱性,即碳酸钾溶液中含有氢氧根离子;碳酸钾由碳酸根离子和钾离子构成,因此碳酸钾溶液中的阴离子主要有。
故答案为:
(1)54:5:16;
(2)CO2+H2O=H2CO3;B;
(3)。
【点评】本题考查了化学知识在节气相关情境中的应用。解题关键在于掌握化合物元素质量比计算、二氧化碳性质及常见物质的用途。这有助于提升学生将化学知识与实际联系的能力。
9.(2024 厦门校级模拟)小阳把自制的一种黄色花汁,分别滴加到下列不同的试剂中,并记录观察到的现象如表所示:
请分析上表,并回答下列问题:
试剂 稀盐酸 食醋 蔗糖水 蒸馏水 肥皂水 烧碱溶液
颜色 红 红 黄 黄 绿 绿
(1)该花汁 可以 (填“可以”或“不可以”)作酸碱指示剂。
(2)蚊子叮咬人时射入蚁酸(具有酸的性质),使皮肤红肿、痛痒。要缓解这种症状,简易可行的办法是在叮咬处涂抹上述试剂中的 肥皂水 。
(3)胃酸的主要成分是盐酸,胃舒平[主要成分Al(OH)3]常用于治疗胃酸过多症,写出胃舒平治疗胃酸过多症时的化学反应方程式: Al(OH)3+3HCl=AlCl3+3H2O 。
【考点】中和反应的实际应用;书写化学方程式、文字表达式、电离方程式;酸碱指示剂的选择及自制.
【专题】常见的酸 酸的通性.
【答案】(1)可以;
(2)肥皂水;
(3)Al(OH)3+3HCl=AlCl3+3H2O。
【分析】(1)根据稀盐酸、食醋显酸性;蔗糖水、蒸馏水呈中性;肥皂水、烧碱溶液呈碱性,从表中的颜色变化可知:该花汁遇到酸、碱以及中性溶液均会呈现不同的颜色进行分析;
(2)根据蚁酸呈酸性能导致皮肤红肿、痛痒,要消除症状应该涂抹碱性物质,所以应在肥皂水和烧碱溶液中选择进行分析;
(3)根据氢氧化铝和盐酸反应生成氯化铝和水进行分析。
【解答】解:(1)稀盐酸、食醋显酸性;蔗糖水、蒸馏水呈中性;肥皂水、烧碱溶液呈碱性,从表中的颜色变化可知:该花汁遇到酸、碱以及中性溶液均会呈现不同的颜色,可以作酸碱指示剂;
(2)由于蚁酸呈酸性能导致皮肤红肿、痛痒,故要消除症状应该涂抹碱性物质,烧碱溶液对皮肤具有强烈的腐蚀性,所以应该涂抹肥皂水;
(3)氢氧化铝和盐酸反应生成氯化铝和水,化学方程式为:Al(OH)3+3HCl=AlCl3+3H2O。
故答案为:(1)可以;
(2)肥皂水;
(3)Al(OH)3+3HCl=AlCl3+3H2O。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
10.(2024 肥城市模拟)科学食用营养物质,可以保障人体健康。
(1)某同学的部分体液的pH如图所示。
①图中碱性最强的体液是 胰液 。
②该同学胃酸(主要成分为盐酸)过多,可服用胃舒平【主要成分为Al(OH)3】治疗,其原理是 HCl+Al(OH)3=AlCl3+3H2O (用化学方程式表示)。
(2)某84消毒液产品的部分说明如下表。
【产品特点】主要成分为次氯酸钠(NaClO),有效氯的质量分数为5.1%~6.9%。 【餐具消毒】用有效氯的质量分数为0.04%的消毒液浸泡,20min后用生活饮用水冲净。 【注意事项】①外用消毒剂,须稀释后使用。 ②不得将本产品与酸性产品(如厕类清洁产品)同时使用。
①次氯酸钠中氯元素的化合价为 +1 ,次氯酸的化学式为 HClO 。
②据表信息,将有效氯的质量分数为6.0%的84消毒液10g加入 1490 g水进行稀释,即可用于餐具消毒。
③洁厕灵(主要成分为盐酸)与84消毒液混合会产生有毒的氯气(Cl2)。请将该反应的化学方程式补充完整:2HCl+NaClO= NaCl +Cl2↑+H2O。
【考点】中和反应的实际应用;溶液的酸碱性与pH的关系;化学式的书写及意义;有关元素化合价的计算;根据质量守恒定律判断物质的化学式;用水稀释改变浓度的方法.
【专题】化学式的计算;溶液的组成及溶质质量分数的计算;化学用语和质量守恒定律;常见的酸 酸的通性.
【答案】(1)胰液;HCl+Al(OH)3=AlCl3+3H2O;
(2)①+1;HClO;②1490;③NaCl。
【分析】(1)显碱性溶液pH大于7,pH越大碱性越强。氢氧化铝和盐酸反应生成氯化铝和水。
(2)①根据化合价原则进行分析;
②根据稀释前后溶质质量不变分析;
③根据原子数目守恒原则分析。
【解答】解:(1)①物质的pH>7,呈碱性,pH越大,碱性越强。故图中碱性最强的体液是胰液;
②氢氧化铝和盐酸反应生成氯化铝和水,化学方程式为3HCl+Al(OH)3=AlCl3+3H2O;
(2)①化合物中,钠元素的化合价为+1价,氧元素的化合价为﹣2价,设氯元素的化合价为x,根据化合物中各元素的化合价的代数和为零,则(+1)+x+(﹣2)=0,解得x=+1,次氯酸钠中钠元素化合价是+1价,次氯酸根是﹣1价,次氯酸中氢元素化合价是+1价,因此次氯酸的化学式为HClO;
②解:设加水的质量为x,根据稀释前后溶质质量不变可得10×6.0%=(10+x)×0.04%,x=1490,解得x=1490g;
③根据原子数目守恒原则,反应前有2个氢原子、3个氯原子、1个钠原子、1个氧原子;反应后有2个氯原子、2个氢原子、1个氧原子,发现反应后缺少1个钠原子和1个氯原子。
故答案为:(1)胰液;HCl+Al(OH)3=AlCl3+3H2O;
(2)①+1;HClO;②1490;③NaCl。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
11.(2024 西城区校级模拟)地球表面的氧化铁多形成于数亿年前的两次“大氧化事件”。微生物在进化过程中,演化出的“铁载体”对动植物吸收利用铁元素起着关键作用。
(1)“大氧化事件”中的某一重要反应如下:4Fe(OH)2+O2+2H2O=4Fe(OH)3,反应前后化合价改变的元素有 Fe、O 。
(2)土壤的酸碱性会影响铁载体细菌的生长。
①某地土壤的pH为6,该土壤呈 酸性 (填“酸性”、“中性”或“碱性”)。
②农业上常用于改良酸性土壤(含硫酸)的化学方程式是 H2SO4+Ca(OH)2=CaSO4+2H2O 。
【考点】中和反应的实际应用;溶液的酸碱性与pH的关系;有关元素化合价的计算.
【专题】常见的酸 酸的通性.
【答案】(1)Fe、O;
(2)①酸性;②H2SO4+Ca(OH)2=CaSO4+2H2O。
【分析】(1)根据单质中元素的化合价为0、在化合物中正负化合价的代数和为零,进行分析解答。
(2)①根据当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性,进行分析解答。
②根据氢氧化钙和硫酸反应生成硫酸钙和水,进行分析解答。
【解答】解:(1)Fe(OH)2中铁元素显+2价,氧元素显﹣2价,氢元素显+1价,O2中氧元素显0价,H2O中氧元素显﹣2价,氢元素显+1价,Fe(OH)3中铁元素显+3价,氧元素显﹣2价,氢元素显+1价,反应前后化合价改变的元素有Fe、O。
(2)①某地土壤的pH为6,<7,则该土壤呈酸性。
②氢氧化钙(俗称熟石灰、消石灰)具有碱性,农业上常用于改良酸性土壤的物质是熟石灰,氢氧化钙和硫酸反应生成硫酸钙和水,反应的化学方程式为H2SO4+Ca(OH)2=CaSO4+2H2O。
故答案为:
(1)Fe、O;
(2)①酸性;②H2SO4+Ca(OH)2=CaSO4+2H2O。
【点评】本题难度不大,了解中和反应的应用、溶液的酸碱性和溶液pH大小之间的关系等是正确解答本题的关键。
12.(2024 夏津县一模)中华优秀传统文化是中华文明的智慧结晶和精华所在,赋予了中华民族伟大的生命力和凝聚力。
(1)中国年味:过年贴春联是中华民族的传统习俗,书法家用墨书写对联,墨的主要成分是碳,对联能保存很长时间而不变色,因为 常温下,碳的化学性质稳定 。
(2)中国节气:“谷雨”:时雨乃降,百果乃登。正常雨水的pH≈5.6是由于空气中的 CO2 溶解在雨水中造成的,农业上常用 熟石灰 改良酸性土壤。
(3)中国科技:“玉兔号”月球车是中国首辆月球车,月球车上的太阳能电池板主要材料为硅。工业上可利用氢气和四氯化硅(SiCl4)在高温条件下反应制取高纯硅(Si),同时生成氯化氢,该反应的化学方程式为 ,反应后硅元素的化合价 降低 (填“升高”“降低”“不变”之一)。
(4)中国智慧:古代人使用的金属制品从3000多年前的青铜器到1500多年前的铁器再到距今100多年前的铝器,过程展现了古代人的智慧,这些金属材料中铝制品比铁制品耐腐蚀的原因是 铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止内部的铝进一步氧化 。
【考点】中和反应的实际应用;有关元素化合价的计算;书写化学方程式、文字表达式、电离方程式;碳的稳定性及应用;二氧化碳与水的反应及实验;金属与氧气的反应.
【专题】化学式的计算;化学用语和质量守恒定律;碳单质与含碳化合物的性质与用途;金属与金属材料;常见的酸 酸的通性.
【答案】见试题解答内容
【分析】(1)根据在常温下,碳的化学性质稳定分析。
(2)根据物质的性质来分析;
(3)根据化学反应的原理以及元素化合价的概念来分析;
(4)根据铝的化学性质来分析。
【解答】解:(1)在常温下,碳的化学性质稳定,则用墨书写的对联能保存很长时间而不变色。
(2)正常雨水显酸性,是因为空气中的二氧化碳和水反应生成碳酸,碳酸显酸性;
熟石灰为氢氧化钙的俗称,能和酸反应,可用于改良酸性土壤。
(3)氢气和四氯化硅在高温条件下反应生成硅和氯化氢,反应的化学方程式为:;
四氯化硅中,氯元素化合价为﹣1价,设硅元素化合价为x,根据“化合物中各元素化合价代数和为零”,则x+(﹣1)×4=0,解得x=+4,而硅单质中,硅元素化合价为0,则反应后硅元素化合价降低。
(4)铝具有耐腐蚀性,是因为常温下,铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止内部的铝进一步氧化。
故答案为:
(1)常温下,碳的化学性质稳定;
(2)CO2;熟石灰;
(3);降低;
(4)铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止内部的铝进一步氧化。
【点评】本题难度不大,掌握物质的性质及其用途、元素的化合价、化学方程式的写法是解题的关键。
13.(2025 长春模拟)以宏观、微观、符号相结合的方式认识和表征化学变化是学习化学的重要思维方式。某实验小组同学探究酸碱中和反应,向滴有酚酞的稀NaOH溶液中加入稀盐酸,发生反应的微观过程如图。
(1)反应结束时,溶液的pH < 7。
(2)由图可知,NaOH溶液与盐酸反应的实质是 氢离子与氢氧根离子结合生成水分子 。
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】(1)<;
(2)氢离子与氢氧根离子结合生成水分子。
【分析】(1)根据反应的微观过程图,进行分析解答。
(2)根据中和反应的实质,进行分析解答。
【解答】解:(1)由反应的微观过程图可知,反应后溶液中存在氢离子,即反应后溶液中存在盐酸,溶液的pH小于7。
(2)NaOH溶液与盐酸反应的实质是氢离子与氢氧根离子结合生成水分子。
故答案为:
(1)<;
(2)氢离子与氢氧根离子结合生成水分子。
【点评】本题难度不大,了解中和反应的原理、实质是正确解答本题的关键。
14.(2025 广州一模)同学们借助传感器研究氢氧化钠溶液与稀硫酸的中和反应,实验过程中溶液pH及温度的变化如图1、图2所示。
(1)由图1可知该实验是将 稀硫酸 溶液滴入 氢氧化钠 溶液中,反应的化学方程式为 2NaOH+H2SO4═Na2SO4+2H2O 。由图2可知,此反应属于 放热 反应。(填“吸热”或“放热”)
(2)a、b、c、d四点对应的溶液中,能使酚酞试液变红的是 a (填标号)。d点对应溶液的溶质是 Na2SO4、H2SO4 (填化学式)。
(3)下列有关说法,正确的是 AB (填标号)。
A.a→b时,溶液的温度在升高
B.a→d时,溶液的pH在减小
C.b→c时,钠盐的质量在增加
D.b点溶液中阴、阳离子个数相等
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】(1)稀硫酸;氢氧化钠;
(2)2NaOH+H2SO4═Na2SO4+2H2O;放热;
(3)a;AB。
【分析】(1)根据图像中pH的变化是从大于7逐渐减小到小于7,进行分析解答。
(2)根据无色酚酞溶液遇酸性溶液不变色,遇中性溶液不变色,遇碱性溶液变红色,
(3)A.根据中和反应属于放热反应,进行分析判断。
B.根据d点溶液是氢氧化钠和硫酸恰好完全反应后继续滴加稀硫酸,进行分析判断。
C.根据b→c时,是硫酸和氢氧化钠恰好完全反应后继续滴加稀硫酸,进行分析判断。
D.根据b点溶液的pH=7,进行分析判断。
【解答】解:(1)由图像可知,pH开始时大于7,逐渐减小到7,然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀硫酸滴加到氢氧化钠溶液中。氢氧化钠和硫酸反应生成硫酸钠和水,反应的化学方程式为2NaOH+H2SO4═Na2SO4+2H2O。由图2可知,反应过程中温度升高,此反应属于放热反应。
(2)a、b、c、d四点对应的溶液中,a点溶液的pH大于7,显碱性,能使酚酞试液变红;d点溶液是氢氧化钠和硫酸恰好完全反应后继续滴加稀硫酸,d点对应溶液的溶质是Na2SO4、H2SO4。
(3)A.中和反应属于放热反应,a→b时,溶液的温度在升高,故选项说法正确。
B.d点溶液是氢氧化钠和硫酸恰好完全反应后继续滴加稀硫酸,a→d时,溶液的pH在减小,故选项说法正确。
C.b→c时,是硫酸和氢氧化钠恰好完全反应后继续滴加稀硫酸,钠盐的质量不变,故选项说法错误。
D.b点溶液的pH=7,溶质是硫酸钠,其化学式为Na2SO4,b点溶液中阴、阳离子个数不相等,故选项说法错误。
故答案为:
(1)稀硫酸;氢氧化钠;
(2)2NaOH+H2SO4═Na2SO4+2H2O;放热;
(3)a;AB。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
15.(2025春 嵩县期中)某同学用传感器测定稀硫酸滴入稀氢氧化钡溶液的过程中pH的变化,测定的结果如图所示。硫酸与氢氧化钡反应的化学方程式为 H2SO4+Ba(OH)2=BaSO4↓+2H2O ;a点所表示的溶液中溶质为 Ba(OH)2 ;在c点所表示的溶液中滴加酚酞溶液,溶液显 无 色。
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】H2SO4+Ba(OH)2=BaSO4↓+2H2O;Ba(OH)2;无。
【分析】根据硫酸与氢氧化钡反应生成硫酸钡沉淀和水,a点所表示的溶液的pH大于7,c点所表示的溶液的pH小于7,进行分析解答。
【解答】解:硫酸与氢氧化钡反应生成硫酸钡沉淀和水,反应的化学方程式为H2SO4+Ba(OH)2=BaSO4↓+2H2O;a点所表示的溶液的pH大于7,显碱性,溶液中溶质为Ba(OH)2;c点所表示的溶液的pH小于7,显酸性,在c点所表示的溶液中滴加酚酞溶液,溶液显无色。
故答案为:
H2SO4+Ba(OH)2=BaSO4↓+2H2O;Ba(OH)2;无。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
16.(2025 高青县一模)某同学用pH传感器测定稀硫酸滴入氢氧化钾溶液的过程中pH的变化,测定的结果如图所示。
(1)在a点的溶液中滴加酚酞溶液,溶液会显 红 色。此时,溶液中存在的阴离子有 OH﹣、 (填离子符号)。
(2)b点处溶液pH = 7,硫酸与氢氧化钾反应的化学方程式为 2KOH+H2SO4=K2SO4+2H2O 。该反应的类型是 复分解 反应,反应的实质是 H+和OH﹣结合生成H2O 。
(3)c点的溶液中溶质为 K2SO4、H2SO4 。
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】(1)红;OH﹣、;
(2)=;2KOH+H2SO4=K2SO4+2H2O;复分解;H+和OH﹣结合生成H2O;
(3)K2SO4、H2SO4。
【分析】(1)观察图像,a点溶液pH大于7,溶液呈碱性,据此判断酚酞溶液的显色情况;碱性溶液中存在氢氧根离子,硫酸与氢氧化钾反应生成硫酸钾,溶液中还存在硫酸钾电离出的硫酸根离子。
(2)b 点pH等于7,说明此时硫酸与氢氧化钾恰好完全反应。
(3)c 点溶液pH小于7,呈酸性,说明硫酸过量,溶液中的溶质为硫酸钾和硫酸;根据硫酸与氢氧化钾反应生成硫酸钾和水的事实,写出化学方程式,判断反应类型并分析反应实质。
【解答】解:(1)a点溶液pH大于7,显碱性,在a点的溶液中滴加酚酞溶液,溶液会显红色。此时溶液中存在氢氧化钾与硫酸反应生成的硫酸钾,还有未反应完的氢氧化钾,所以溶液中存在的阴离子有OH﹣、。
(2)b点处溶液pH=7。硫酸与氢氧化钾反应生成硫酸钾和水,化学方程式为2KOH+H2SO4=K2SO4+2H2O;该反应是两种化合物相互交换成分生成另外两种化合物的反应,属于复分解反应;反应的实质是H+和OH﹣结合生成H2O。
(3)c 点溶液pH小于 7,硫酸过量,溶液中溶质为K2SO4、H2SO4。
故答案为:
(1)红;OH﹣、;
(2)=;2KOH+H2SO4=K2SO4+2H2O;复分解;H+和OH﹣结合生成H2O;
(3)K2SO4、H2SO4。
【点评】本题考查酸碱中和反应与pH的相关知识。解题关键在于理解pH与溶液酸碱性的关系,以及酸碱中和反应的原理和实质。通过分析图像数据来解答问题,有助于提升对酸碱反应知识的理解和应用能力。
17.(2025 宣威市校级模拟)小聪利用pH传感器探究稀盐酸和氢氧化钠溶液的反应过程,实验装置如图1。向盛有一定量含有酚酞的X溶液中逐滴加入Y溶液,同时搅拌,测定烧杯中溶液的pH如图2所示。
(1)烧杯中的X溶液是 稀盐酸 。
(2)结合图像分析上述实验,a点溶液的pH < (选填“>”“=”或“<”)7;烧杯中NaCl的质量分数 先增大、后减小 (选填“先增大后减小”或“先减小后增大”)。
(3)写出氢氧化钠与盐酸发生反应的化学方程式为 HCl+NaOH=NaCl+H2O 。
(4)当pH=7时,消耗4%的氢氧化钠溶液10克,则被中和的盐酸溶质质量为 0.365 g。
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】(1)稀盐酸;
(2)<;先增大、后减小;
(3)HCl+NaOH=NaCl+H2O;
(4)0.365。
【分析】(1)根据溶液的pH变化情况来分析;
(2)根据溶液的pH以及化学反应的原理来分析;
(3)根据化学反应的原理来分析;
(4)根据溶液中氢氧化钠的质量,利用化学方程式来分析计算。
【解答】解:(1)由图可知,一开始pH小于7,随着反应的进行,pH逐渐增大至大于7,故该实验是将氢氧化钠溶液滴入稀盐酸中,故烧杯中的X溶液是稀盐酸;
(2)由图可知,a点时,溶液的pH<7;氢氧化钠和稀盐酸反应生成氯化钠和水,反应生成了氯化钠,溶质质量逐渐增加,溶质质量分数逐渐增大,待完全反应后,氯化钠的质量不再变化,继续滴入稀盐酸,溶液质量增加,故溶质质量分数逐渐减小,故烧杯中氯化钠的质量分数先增大、后减小;
(3)氢氧化钠与稀盐酸反应生成氯化钠和水,该反应的化学方程式为:HCl+NaOH=NaCl+H2O;
(4)设被中和的盐酸中溶质质量为x,则:
HCl+NaOH=NaCl+H2O
36.5 40
x 10g×4%
x=0.365g
答:被中和的盐酸溶质质量为0.365g。
故答案为:(1)稀盐酸;
(2)<;先增大、后减小;
(3)HCl+NaOH=NaCl+H2O;
(4)0.365。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
18.(2025 许昌一模)室温时,向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液温度的变化)。
(1)a点溶液中的微粒为 氢离子、硫酸根离子、水分子(或H+、、H2O) 。
(2)b点烧杯内液体的pH = 7(填“>”“=”“<”)。
(3)c点溶液中滴加紫色石蕊溶液,溶液颜色为 蓝色 。
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】(1)氢离子、硫酸根离子、水分子(或H+、、H2O);
(2)=;
(3)蓝色。
【分析】根据向盛有稀H2SO4的烧杯中逐滴加入Ba(OH)2溶液,硫酸与氢氧化钡反应生成硫酸钡沉淀和水,溶液中溶质的质量逐渐减小,二者恰好完全反应后,继续滴加氢氧化钡溶液,溶液变为Ba(OH)2溶液,溶质质量又会逐渐增加,进行分析解答。
【解答】解:(1)向盛有稀H2SO4的烧杯中逐滴加入Ba(OH)2溶液,硫酸与氢氧化钡反应生成硫酸钡沉淀和水,溶液中溶质的质量逐渐减小,a点为稀H2SO4有剩余,a点溶液中的微粒为氢离子、硫酸根离子、水分子(或H+、、H2O)。
(2)b点硫酸与氢氧化钡恰好完全反应,为水,显中性,烧杯内液体的pH=7。
(3)c点溶液为Ba(OH)2溶液,溶液呈碱性,滴加紫色石蕊溶液,溶液为蓝色。
故答案为:
(1)氢离子、硫酸根离子、水分子(或H+、、H2O);
(2)=;
(3)蓝色。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
19.(2025 襄城县模拟)图甲是利用数字化传感器测得的盐酸和氢氧化钠溶液反应时溶液pH的变化图像。
(1)该反应的化学方程式为 HCl+NaOH═NaCl+H2O。 。
(2)当溶液呈中性时,所消耗氢氧化钠溶液的体积是 10 mL。
(3)请在图乙的虚线框内将C点时溶液中的微粒补画完整。
【考点】中和反应相关实验与计算;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】(1)HCl+NaOH=NaCl+H2O;
(2)10;
(3)。
【分析】(1)根据盐酸和氢氧化钠反应生成氯化钠和水,进行分析解答。
(2)根据当溶液呈中性时,溶液的pH=7,进行分析解答。
(3)根据C点时溶液的pH大于7,进行分析解答。
【解答】解:(1)盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式为HCl+NaOH═NaCl+H2O。
(2)当溶液呈中性时,溶液的pH=7,所消耗氢氧化钠溶液的体积是10mL。
(3)C点时溶液的pH大于7,溶液显碱性,氢氧化钠溶液过量,溶液中溶质是氢氧化钠、氯化钠,虚线框内微粒为钠离子、氢氧根离子,其离子符号分别是Na+、OH﹣,即。
故答案为:
(1)HCl+NaOH=NaCl+H2O;
(2)10;
(3)。
【点评】本题难度不是很大,主要考查了中和反应及其应用,明确溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应等是正确解答本题的关键。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
