【中考押题预测】2025年中考化学沪教版(2024)核心考点考前冲刺 配制一定溶质质量分数的氯化钠溶液(含解析)
文档属性
| 名称 | 【中考押题预测】2025年中考化学沪教版(2024)核心考点考前冲刺 配制一定溶质质量分数的氯化钠溶液(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 945.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-17 10:05:01 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
中考核心考点 配制一定溶质质量分数的氯化钠溶液
一.选择题(共7小题)
1.(2025 濮阳一模)实验室用氯化钠配制50g质量分数为6%的氯化钠溶液。下列说法正确的是( )
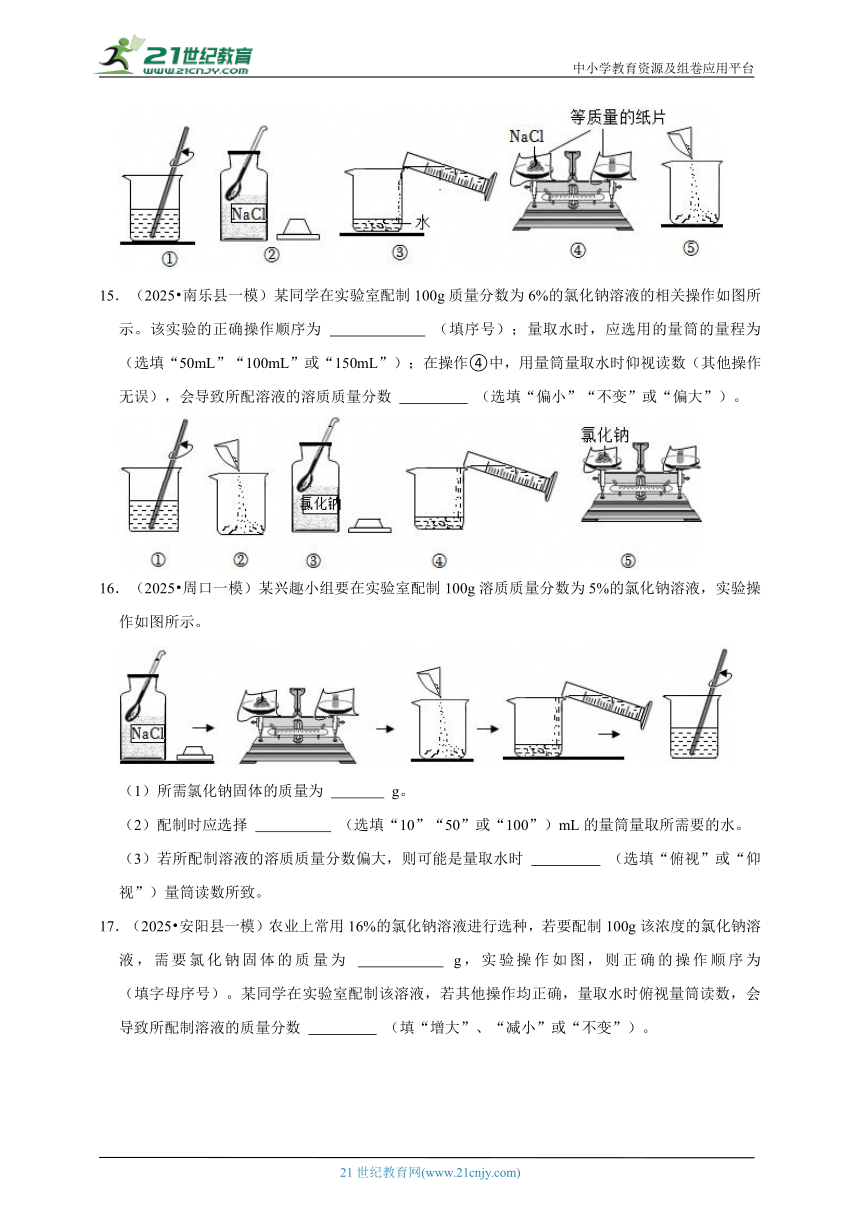
A.所需氯化钠的质量为6g
B.量水时俯视读数会使溶液浓度偏大
C.氯化钠直接放在托盘天平的左盘称量
D.需玻璃仪器有漏斗、量筒等
2.(2025 万柏林区一模)如图是一定溶质质量分数的氯化钠溶液的配制部分操作,其中操作正确的是( )
A.取用 B.称量
C.加入蒸馏水 D.溶解
3.(2025 西城区模拟)配制100g质量分数为15%的NaCl溶液,下列说法不正确的是( )
A.需称量15g氯化钠固体
B.需量取100mL的蒸馏水
C.玻璃棒搅拌可加速溶解
D.取5g该溶液,溶质的质量分数为15%
4.(2025 南关区校级一模)用如表所示浓硫酸配制100g质量分数为9.8%的稀硫酸,下列说法正确的是( )
硫酸分子式:H2SO4 相对分子质量:98 密度:1.84g/mL溶质质量分数:98% 体积:500mL
A.所需浓硫酸的体积为10mL,水为90mL
B.稀释时把浓硫酸倒入盛有水的烧杯中并搅拌
C.稀释后未冷却的稀硫酸立即装入广口瓶
D.量取浓硫酸时俯视读数,稀释后硫酸溶质质量分数偏大
5.(2025 新城区校级模拟)实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致浓度偏小的是( )
①称量的氯化钠固体中含有不溶性杂质
②用量筒量水时仰视刻度
③将水注入烧杯时有水洒出
④将配制好的溶液装入试剂瓶时有少量溅出
A.①② B.③④ C.①③ D.①②③
6.(2025春 临澧县期中)配制50g10%氯化钠溶液,整个操作过程如图所示,下列有关说法正确的是( )
A.步骤④中玻璃棒的作用是引流
B.配制溶液的正确顺序为②①⑤④③
C.通过计算得出需要NaCl固体的质量为5g
D.步骤①的错误操作,肯定会导致所配制的溶液溶质质量分数偏大
7.(2025 沙坪坝区模拟)配制100克溶质质量分数为12%的葡萄糖溶液,下列操作会导致所配溶液的溶质质量分数偏大的是( )
A.用托盘天平称量葡萄糖时,砝码放在左盘
B.用量筒量取水时,俯视读数
C.转移葡萄糖时,纸上有少量残留
D.配好溶液装入试剂瓶时,有少量洒出
二.填空题(共10小题)
8.(2025 郑州二模)将50g溶质质量分数为98%的浓硫酸,稀释为溶质质量分数为20%的稀硫酸用于化学实验。
(1)需要量取水的体积是 mL。
(2)若其他操作正确,量取水时仰视读数,则配制的稀硫酸中溶质质量分数 (填“偏大”“偏小”或“不变”)。
9.(2025 双城区一模)分类、类比是学习化学常用的方法。
(1)在初中化学学习中,我们经常要配制一定溶质质量分数的溶液,但配制时由于错误的操作可能会使所配制溶液的溶质质量分数偏大或偏小。据此将下列操作分类:其中一类的分类标准是① :包括事例为② (填字母)。
A.试剂、砝码左右位置颠倒,且使用了游码 B.称量易潮解的物质(如NaOH)暴露在空气中时间过长 C.用量筒量取溶剂水时,俯视读数 D.往烧杯中加水时有少量水洒出
(2)在金属活动性顺序里,位置越靠后的金属活动性越弱,所形成的金属阳离子氧化性越强,金属单质先与氧化性强的金属离子发生置换反应。据此,将一定量的铁粉放入硝酸铜和硝酸银的混合溶液中,则一定发生反应的化学方程式是① ,过滤,所得滤渣成分可能有② 种情况。
10.(2025 淄川区一模)如表是一瓶生理盐水标签上的部分文字说明,请回答下列问题:
氯化钠注射液 (0.9%生理盐水) [性状]无色透明液体,味咸 [成分]氯化钠、水 [规格]500mL质量分数0.9% [密度]1.0g/cm3
(1)生理盐水的溶剂为 。
(2)该生理盐水具有的物理性质有 (写出一条即可)。
(3)从微观角度看,该生理盐水由 构成(用符号表示)。
(4)若要配制一瓶该生理盐水需 g氯化钠,不需要用到的仪器是 (填序号)。
A.集气瓶
B.烧杯
C.玻璃棒
D.量筒
11.(2025春 洛龙区期中)农业中常用16%的氯化钠溶液来选种,现在实验室配制50g16%的氯化钠溶液,需要称取氯化钠的质量为 g,量取一定量溶剂后,溶解过程中用到的玻璃仪器有 ;若配制溶液的过程中其他操作均正确,量取水时仰视量筒读数,会导致所配制溶液的质量分数 (填“偏大”“偏小”或“不变”)。
12.(2025 淮阴区一模)某同学欲配制60g溶质质量分数为5%的NaCl溶液,准备了如图1实验用品。
(1)该同学按下列实验步骤进行:①计算,②称量,③量取,④ (填步骤名称)。
(2)配制过程还缺少的一种玻璃仪器是 (填名称)。
(3)计算所需NaCI的质量为 g;量取时,应该选择 (填100mL、50mL或10mL)的量筒。
(4)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用 (填仪器名称)滴加蒸馏水至刻度线。
(5)若用如图2观察方式量取水的体积,所配制溶液的溶质质量分数会 (填“偏大”、“偏小”或“无影响”)。
13.(2025 泌阳县一模)实验室用氯化钠固体配制50g质量分数为6%的溶液,实验步骤为计算、量取、溶解;水的密度近似看作1g/cm3,量取水时所选用量筒的规格应为 (填“10mL”“50mL”或“100mL”),若所配制溶液的溶质质量分数偏大,则可能是量取水时 (填“俯视”或“仰视”)量筒读数所致。
14.(2025 上蔡县一模)小郑同学欲配制100g溶质质量分数为12%的氯化钠溶液,图示实验中,正确的操作顺序为 (填序号),写出一种可能导致溶质质量分数小于12%的错误操作 。
15.(2025 南乐县一模)某同学在实验室配制100g质量分数为6%的氯化钠溶液的相关操作如图所示。该实验的正确操作顺序为 (填序号);量取水时,应选用的量筒的量程为 (选填“50mL”“100mL”或“150mL”);在操作④中,用量筒量取水时仰视读数(其他操作无误),会导致所配溶液的溶质质量分数 (选填“偏小”“不变”或“偏大”)。
16.(2025 周口一模)某兴趣小组要在实验室配制100g溶质质量分数为5%的氯化钠溶液,实验操作如图所示。
(1)所需氯化钠固体的质量为 g。
(2)配制时应选择 (选填“10”“50”或“100”)mL的量筒量取所需要的水。
(3)若所配制溶液的溶质质量分数偏大,则可能是量取水时 (选填“俯视”或“仰视”)量筒读数所致。
17.(2025 安阳县一模)农业上常用16%的氯化钠溶液进行选种,若要配制100g该浓度的氯化钠溶液,需要氯化钠固体的质量为 g,实验操作如图,则正确的操作顺序为 (填字母序号)。某同学在实验室配制该溶液,若其他操作均正确,量取水时俯视量筒读数,会导致所配制溶液的质量分数 (填“增大”、“减小”或“不变”)。
中考核心考点 配制一定溶质质量分数的氯化钠溶液
参考答案与试题解析
一.选择题(共7小题)
1.(2025 濮阳一模)实验室用氯化钠配制50g质量分数为6%的氯化钠溶液。下列说法正确的是( )
A.所需氯化钠的质量为6g
B.量水时俯视读数会使溶液浓度偏大
C.氯化钠直接放在托盘天平的左盘称量
D.需玻璃仪器有漏斗、量筒等
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】B
【分析】A、根据溶质质量=溶液质量×溶质的质量分数,进行分析判断。
B、根据用量筒量取水时,俯视液面,读数比实际液体体积大,进行分析判断。
C、根据托盘天平的使用方法,进行分析判断。
D、根据各操作所需要使用的仪器,进行分析判断。
【解答】解:A、溶质质量=溶液质量×溶质的质量分数,配制50g质量分数为6%的氯化钠溶液,需氯化钠的质量为50g×6%=3g,故错误;
B、用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故正确;
C、使用托盘天平,遵循“左物右码”的原则,氯化钠不能直接放在托盘天平的左盘称量,要放在左盘的纸片上称量,故错误;
D、托盘天平用于称取固体氯化钠、量筒与胶头滴管用于准确量取水、烧杯用于完成溶解操作、玻璃棒用于溶解时的搅拌,所需玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管等,无需使用漏斗,故错误;
故选:B。
【点评】本题难度不大,明确配制一定溶质质量分数的溶液主要实验步骤、注意事项等是正确解答本题的关键。
2.(2025 万柏林区一模)如图是一定溶质质量分数的氯化钠溶液的配制部分操作,其中操作正确的是( )
A.取用 B.称量
C.加入蒸馏水 D.溶解
【考点】溶液配制过程中的操作正误的判断.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】A、根据固体试剂的取用方法,进行分析判断。
B、根据托盘天平的使用要遵循“左物右码”的原则,进行分析判断。
C、根据溶解操作的方法,进行分析判断。
D、根据溶解操作的方法,进行分析判断。
【解答】解:A、取用固体粉末状试剂时,瓶塞要倒放,应用药匙取用,图中瓶塞没有倒放,故选项实验操作错误。
B、托盘天平的使用要遵循“左物右码”的原则,图中砝码与试剂的位置放反了,故选项实验操作错误。
C、溶解操作应在烧杯中进行,倾倒水时,量筒要紧挨烧杯口,故选项实验操作错误。
D、溶解操作应在烧杯中进行,用玻璃棒不断搅拌,故选项实验操作正确。
故选:D。
【点评】本题难度不大,明确配制一定溶质质量分数的溶液主要实验步骤、注意事项等是正确解答本题的关键。
3.(2025 西城区模拟)配制100g质量分数为15%的NaCl溶液,下列说法不正确的是( )
A.需称量15g氯化钠固体
B.需量取100mL的蒸馏水
C.玻璃棒搅拌可加速溶解
D.取5g该溶液,溶质的质量分数为15%
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】B
【分析】A、根据溶质质量=溶液质量×溶质的质量分数,进行分析判断。
B、根据溶剂质量=溶液质量﹣溶质质量,进行分析判断。
C、根据玻璃棒搅拌的作用,进行分析判断。
D、根据溶液具有均一性,进行分析判断。
【解答】解:A、配制100g质量分数为15%的NaCl溶液,需要氯化钠的质量=100g×15%=15g,故选项说法正确。
B、溶剂质量=溶液质量﹣溶质质量,所需水的质量=100g﹣15g=85g(合85mL),故选项说法错误。
C、玻璃棒搅拌可加速溶解,故选项说法正确。
D、溶液具有均一性,取5g该溶液,溶质的质量分数为15%,故选项说法正确。
故选:B。
【点评】本题难度不大,明确配制一定溶质质量分数的溶液主要实验步骤、注意事项等是正确解答本题的关键。
4.(2025 南关区校级一模)用如表所示浓硫酸配制100g质量分数为9.8%的稀硫酸,下列说法正确的是( )
硫酸分子式:H2SO4 相对分子质量:98 密度:1.84g/mL溶质质量分数:98% 体积:500mL
A.所需浓硫酸的体积为10mL,水为90mL
B.稀释时把浓硫酸倒入盛有水的烧杯中并搅拌
C.稀释后未冷却的稀硫酸立即装入广口瓶
D.量取浓硫酸时俯视读数,稀释后硫酸溶质质量分数偏大
【考点】浓溶液稀释配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】B
【分析】A、根据溶液稀释前后溶质的质量不变,水的质量=稀溶液的质量﹣浓溶液的质量,进行分析判断。
B、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅),进行分析判断。
C、根据浓硫酸溶于水放热、液体试剂的存放仪器,进行分析判断。
D、根据俯视读数,读数比实际液体体积大,进行分析判断。
【解答】解:A、设需要浓硫酸的体积为x,1.84g/mL×x×98%=100g×9.8%,x≈5.4mL,水的质量为100g﹣1.84g/mL×5.4mL≈90g(合90mL),故选项说法错误。
B、稀释浓硫酸时,要把浓硫酸慢慢地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时散失;一定不能把水注入浓硫酸中,以防止酸液飞溅,故选项说法正确。
C、浓硫酸溶于水放热,稀释后冷却后,稀硫酸可装入细口瓶中,故选项说法错误。
D、用量筒量取浓硫酸时,俯视读数,读数比实际液体体积大,会造成实际量取的浓硫酸的体积偏小,使溶质质量分数偏小,故选项说法错误。
故选:B。
【点评】本题难度不大,明确用浓溶液配制稀溶液配制稀溶液的基本步骤、溶液稀释前后溶质的质量不变等是正确解答本题的关键。
5.(2025 新城区校级模拟)实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致浓度偏小的是( )
①称量的氯化钠固体中含有不溶性杂质
②用量筒量水时仰视刻度
③将水注入烧杯时有水洒出
④将配制好的溶液装入试剂瓶时有少量溅出
A.①② B.③④ C.①③ D.①②③
【考点】溶液配制过程中的误差分析.
【专题】溶液、浊液与溶解度.
【答案】A
【分析】根据溶质质量分数偏小,可能是溶质质量偏小或溶剂质量偏大,可以分析出可能造成这两个方面错误的原因,进行分析解答。
【解答】解:①称量的氯化钠固体中含有不溶性杂质,导致溶质质量偏小,从而导致配制的氯化钠溶液溶质质量分数偏小;
②用量筒量取水时仰视刻度,读数偏小,实际量取水的体积偏大,最终导致配制的氯化钠溶液溶质质量分数偏小;
③将水注入烧杯时有水洒出,会造成实际量取的水的体积偏小,最终导致配制的氯化钠溶液溶质质量分数偏大;
④溶液具有均一性,将配制好的溶液装入试剂瓶时有少量溅出,对溶液中溶质的质量分数没有影响,溶质质量分数不变。
故选:A。
【点评】本题难度不是很大,解答本题可从溶质质量分数的概念入手,与溶质和溶剂的质量有关,分析操作中的错误操作,判断错误操作对溶质、溶剂的影响是正确解答此类题的关键。
6.(2025春 临澧县期中)配制50g10%氯化钠溶液,整个操作过程如图所示,下列有关说法正确的是( )
A.步骤④中玻璃棒的作用是引流
B.配制溶液的正确顺序为②①⑤④③
C.通过计算得出需要NaCl固体的质量为5g
D.步骤①的错误操作,肯定会导致所配制的溶液溶质质量分数偏大
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】C
【分析】A、根据玻璃棒作用分析。
B、配制溶液的正确顺序为计算、称量、量取、溶解。
C、溶质质量=溶液质量×溶质质量分数。
D、根据托盘天平使用方法及溶质质量分数100%分析。
【解答】解:A、步骤④是溶解操作,玻璃棒的作用是搅拌,加速溶解,而不是引流,故A错误。
B、配制溶液的正确顺序为计算、称量、量取、溶解,即②①⑤③④,故B错误。
C、需要NaCl 固体的质量为:50g×10%=5g,故C正确。
D、步骤①中砝码和药品放反了,若使用了游码,会导致称得的氯化钠质量偏小,所配制溶液溶质质量分数偏小;若没有使用游码,则对称量结果无影响,故D错误。
故选:C。
【点评】本题考查了配制一定溶质质量分数的溶液,涉及溶质质量、溶剂质量的计算以及操作步骤和仪器的使用,根据已有知识分析解答。
7.(2025 沙坪坝区模拟)配制100克溶质质量分数为12%的葡萄糖溶液,下列操作会导致所配溶液的溶质质量分数偏大的是( )
A.用托盘天平称量葡萄糖时,砝码放在左盘
B.用量筒量取水时,俯视读数
C.转移葡萄糖时,纸上有少量残留
D.配好溶液装入试剂瓶时,有少量洒出
【考点】溶液配制过程中的误差分析.
【专题】溶液、浊液与溶解度.
【答案】B
【分析】根据溶质质量分数偏大,可能是溶质质量偏大或溶剂质量偏小,可以分析出可能造成这两个方面错误的原因,进行分析判断。
【解答】解:A、用托盘天平称量葡萄糖时,砝码放在左盘,砝码和食盐的位置放反了,会造成实际所取的溶质的质量偏小,使溶质质量分数偏小,故选项错误。
B、用量筒量取水时,俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,使溶质质量分数偏大,故选项正确。
C、转移葡萄糖时,纸上有少量残留,会造成实际所取的溶质的质量偏小,使溶质质量分数偏小,故选项错误。
D、配好溶液装入试剂瓶时,有少量洒出,溶液具有均一性,溶质质量分数不变,故选项错误。
故选:B。
【点评】本题难度不是很大,解答本题可从溶质质量分数的概念入手,与溶质和溶剂的质量有关,分析操作中的错误操作,判断错误操作对溶质、溶剂的影响是正确解答此类题的关键。
二.填空题(共10小题)
8.(2025 郑州二模)将50g溶质质量分数为98%的浓硫酸,稀释为溶质质量分数为20%的稀硫酸用于化学实验。
(1)需要量取水的体积是 195 mL。
(2)若其他操作正确,量取水时仰视读数,则配制的稀硫酸中溶质质量分数 偏小 (填“偏大”“偏小”或“不变”)。
【考点】浓溶液稀释配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】(1)195;
(2)偏小。
【分析】(1)根据溶液稀释前后溶质的质量不变,进行分析解答。
(2)根据用量筒量取水时,仰视读数,读数比实际液体体积小,进行分析解答。
【解答】解:(1)设要加水的质量为x,根据溶液稀释前后溶质的质量不变,则50g×98%=(50g+x)×20%,x=195g(合195mL)。
(2)用量筒量取水时,仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,使溶质质量分数偏小。
故答案为:
(1)195;
(2)偏小。
【点评】本题难度不大,明确用浓溶液配制稀溶液的基本步骤、溶液稀释前后溶质的质量不变等是正确解答本题的关键。
9.(2025 双城区一模)分类、类比是学习化学常用的方法。
(1)在初中化学学习中,我们经常要配制一定溶质质量分数的溶液,但配制时由于错误的操作可能会使所配制溶液的溶质质量分数偏大或偏小。据此将下列操作分类:其中一类的分类标准是① 质量分数偏小 :包括事例为② AB (填字母)。
A.试剂、砝码左右位置颠倒,且使用了游码 B.称量易潮解的物质(如NaOH)暴露在空气中时间过长 C.用量筒量取溶剂水时,俯视读数 D.往烧杯中加水时有少量水洒出
(2)在金属活动性顺序里,位置越靠后的金属活动性越弱,所形成的金属阳离子氧化性越强,金属单质先与氧化性强的金属离子发生置换反应。据此,将一定量的铁粉放入硝酸铜和硝酸银的混合溶液中,则一定发生反应的化学方程式是① Fe+2AgNO3=Fe(NO3)2+2Ag ,过滤,所得滤渣成分可能有② 3 种情况。
【考点】溶液配制过程中的误差分析;金属与盐溶液反应的原理.
【专题】溶液、浊液与溶解度;金属与金属材料.
【答案】(1)质量分数偏小;AB(或质量分数偏大;CD);
(2)①Fe+2AgNO3=Fe(NO3)2+2Ag;②3。
【分析】(1)根据溶质质量分数变小,则可能是溶质质量偏小或溶剂质量偏大进行分析。
(2)根据金属的化学性质分析。
【解答】解:(1)A、试剂、砝码左右位置颠倒,且使用了游码,会使称得试剂质量偏小,导致所配制溶液溶质质量分数偏小。
B、称量易潮解的物质(如NaOH)暴露在空气中时间过长,会使试剂吸收水分且部分变质,称得试剂实际溶质质量偏小,导致所配制溶液溶质质量分数偏小。
C、用量筒量取溶剂水时,俯视读数,会使量取的水的体积偏小,溶剂质量偏小,根据溶质质量分数100%,会导致所配制溶液溶质质量分数偏大。
D、往烧杯中加水时有少量水洒出,会使溶剂质量偏小,导致所配制溶液溶质质量分数偏大。
(2)在金属活动性顺序中,铁>铜>银,所以铁先与硝酸银反应Fe+2AgNO3=Fe(NO3)2+2Ag,当硝酸银完全反应后,若铁还有剩余,再与硝酸铜反应,当铁的量很少,只与部分硝酸银反应时,滤渣只有银;当铁恰好与硝酸银反应完时,滤渣只有银;当铁与硝酸银反应完,又与部分硝酸铜反应时,滤渣有银和铜;当铁过量,将硝酸银和硝酸铜都反应完时,滤渣有银、铜和铁。所以滤渣成分可能有3种情况(只有银;银和铜;银、铜和铁)。
故答案为:(1)质量分数偏小;AB(或质量分数偏大;CD);
(2)①Fe+2AgNO3=Fe(NO3)2+2Ag;②3。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
10.(2025 淄川区一模)如表是一瓶生理盐水标签上的部分文字说明,请回答下列问题:
氯化钠注射液 (0.9%生理盐水) [性状]无色透明液体,味咸 [成分]氯化钠、水 [规格]500mL质量分数0.9% [密度]1.0g/cm3
(1)生理盐水的溶剂为 水 。
(2)该生理盐水具有的物理性质有 无色透明液体(答案不唯一) (写出一条即可)。
(3)从微观角度看,该生理盐水由 H2O、Na+、Cl﹣ 构成(用符号表示)。
(4)若要配制一瓶该生理盐水需 4.5 g氯化钠,不需要用到的仪器是 A (填序号)。
A.集气瓶
B.烧杯
C.玻璃棒
D.量筒
【考点】固体配制一定质量分数溶液;化学性质与物理性质的差别及应用;溶液、溶质和溶剂的相互关系与判断.
【专题】溶液、浊液与溶解度.
【答案】(1)水;
(2)无色透明液体(答案不唯一);
(3)H2O、Na+、Cl﹣;
(4)4.5;A。
【分析】(1)根据生理盐水是氯化钠的水溶液来分析解答;
(2)根据生理盐水具有的物理性质有无色透明液体,味咸,密度1.0g/cm3来分析解答;
(3)根据氯化钠是由钠离子和氯离子构成,水是由水分子构成来分析解答;
(4)根据溶质质量=溶液的体积×溶液密度×溶质质量分数来分析解答;根据配制一瓶生理盐水不需要用到的仪器是集气瓶来分析解答。
【解答】解:(1)生理盐水是氯化钠的水溶液,则生理盐水的溶剂为水;
(2)该生理盐水具有的物理性质有无色透明液体,味咸,密度1.0g/cm3;
(3)生理盐水是氯化钠的水溶液,氯化钠是由钠离子和氯离子构成,水是由水分子构成,则从微观角度看,该生理盐水由H2O、Na+、Cl﹣构成;
(4)若要配制一瓶该生理盐水需氯化钠的质量为500mL×1g/mL×0.9%=4.5g,不需要用到的仪器是集气瓶,故选:A。
故答案为:(1)水;
(2)无色透明液体(答案不唯一);
(3)H2O、Na+、Cl﹣;
(4)4.5;A。
【点评】在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的知识进行分析解答。
11.(2025春 洛龙区期中)农业中常用16%的氯化钠溶液来选种,现在实验室配制50g16%的氯化钠溶液,需要称取氯化钠的质量为 8 g,量取一定量溶剂后,溶解过程中用到的玻璃仪器有 烧杯、玻璃棒 ;若配制溶液的过程中其他操作均正确,量取水时仰视量筒读数,会导致所配制溶液的质量分数 偏小 (填“偏大”“偏小”或“不变”)。
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】8;烧杯、玻璃棒;偏小。
【分析】根据溶质的质量=溶液质量×溶质的质量分数,配制一定溶质质量分数的操作步骤、实验仪器、误差分析等相关知识进行分析。
【解答】解:需要称取氯化钠的质量为50g×16%=8g;量取一定量溶剂后,溶解过程中用到的玻璃仪器有烧杯、玻璃棒;若配制溶液的过程中其他操作均正确,量取水时仰视量筒读数,读数偏小,实际量取水的体积偏大,会导致所配制溶液的质量分数偏小。
故答案为:8;烧杯、玻璃棒;偏小。
【点评】本题难度不大,明确配制一定溶质质量分数的溶液主要实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键。
12.(2025 淮阴区一模)某同学欲配制60g溶质质量分数为5%的NaCl溶液,准备了如图1实验用品。
(1)该同学按下列实验步骤进行:①计算,②称量,③量取,④ 溶解 (填步骤名称)。
(2)配制过程还缺少的一种玻璃仪器是 玻璃棒 (填名称)。
(3)计算所需NaCI的质量为 3 g;量取时,应该选择 100mL (填100mL、50mL或10mL)的量筒。
(4)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用 胶头滴管 (填仪器名称)滴加蒸馏水至刻度线。
(5)若用如图2观察方式量取水的体积,所配制溶液的溶质质量分数会 偏大 (填“偏大”、“偏小”或“无影响”)。
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】(1)溶解;
(2)玻璃棒;
(3)3;100mL;
(4)胶头滴管;
(5)偏大。
【分析】(1)根据配制溶液的步骤来分析;
(2)根据配制溶液所需的仪器来分析;
(3)根据溶质质量、溶剂质量的计算以及量筒的选取原则来分析;
(4)根据量取一定体积液体的操作来分析;
(5)根据俯视读数会使所取水的体积偏小来分析。
【解答】解:(1)该同学按下列实验步骤进行:①计算,②称量,③量取,④溶解;
(2)由图可知,配制过程还缺少的一种玻璃仪器是玻璃棒;
(3)所需NaCl的质量为:60g×5%=3g,所需水的质量为:60g﹣3g=57g,合57mL,量筒应选择一次量取的最小量程,则应该选择100mL的量筒;
(4)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,为提高测量效率和准确度,改用胶头滴管滴加蒸馏水至刻度线;
(5)若用如图观察方式(俯视读数)量取水的体积,则所取水的体积偏小,会导致所配制溶液的溶质质量分数会偏大。
故答案为:
(1)溶解;
(2)玻璃棒;
(3)3;100mL;
(4)胶头滴管;
(5)偏大。
【点评】本题主要考查了溶液的配制,难度不大,根据所学知识,结合题中信息,认真分析即可解答。
13.(2025 泌阳县一模)实验室用氯化钠固体配制50g质量分数为6%的溶液,实验步骤为计算、量取、溶解;水的密度近似看作1g/cm3,量取水时所选用量筒的规格应为 50mL (填“10mL”“50mL”或“100mL”),若所配制溶液的溶质质量分数偏大,则可能是量取水时 俯视 (填“俯视”或“仰视”)量筒读数所致。
【考点】浓溶液稀释配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】50mL;俯视。
【分析】配制一定溶质质量分数的溶液,要计算出溶质的质量,所需水的质量和体积,然后把溶质转移到烧杯中,加水溶解,玻璃棒不断搅拌,得到均一稳定的混合物,据此分析。
【解答】解:配制50g质量分数为6%的溶液,需要溶质质量为50g×6%=3g,溶剂质量为50g﹣3g=47g,需要47mL水,根据量筒选用遵循“大而近”的原则,量取水时应选用50mL量程的量筒;若配制溶液的溶质质量分数偏大,则可能原因为实际量取的水的体积偏小,则可能为量取水时俯视读数。
故答案为:
50mL;俯视。
【点评】解答好这类题目,就必须熟记配制的步骤、所用仪器、有关的误差分析和注意事项等等。
14.(2025 上蔡县一模)小郑同学欲配制100g溶质质量分数为12%的氯化钠溶液,图示实验中,正确的操作顺序为 ②④⑤③① (填序号),写出一种可能导致溶质质量分数小于12%的错误操作 所称取的氯化钠固体不纯 。
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】②④⑤③①;所称取的氯化钠固体不纯。
【分析】根据配制溶质质量分数一定的溶液的基本步骤进行分析;
根据导致溶质质量分数小于12%的原因可能是溶质少了或溶剂多了进行分析。
【解答】解:配制溶液的步骤是计算、称量、量取、溶解,所以上述操作步骤的正确顺序是②④⑤③①;
溶质质量分数偏小的可能原因:氯化钠质量不够或者溶剂水质量偏大;所以可能导致溶质质量分数小于12%的错误操作是:所称取的氯化钠固体不纯。
故答案为:②④⑤③①;所称取的氯化钠固体不纯。
【点评】本题难度不大,明确配制一定溶质质量分数的溶液主要实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键。
15.(2025 南乐县一模)某同学在实验室配制100g质量分数为6%的氯化钠溶液的相关操作如图所示。该实验的正确操作顺序为 ③⑤②④① (填序号);量取水时,应选用的量筒的量程为 100mL (选填“50mL”“100mL”或“150mL”);在操作④中,用量筒量取水时仰视读数(其他操作无误),会导致所配溶液的溶质质量分数 偏小 (选填“偏小”“不变”或“偏大”)。
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】③⑤②④①;100mL;偏小。
【分析】根据配制100g质量分数为6%的氯化钠溶液的实验操作步骤,量筒的选取原则和仰视读数,水的实际体积偏大来分析解答。
【解答】解:配制100g质量分数为6%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠质量,用量筒量取水,最后进行溶解,则该实验的正确操作顺序为③⑤②④①,量取水的体积为100g×(1﹣6%)÷1g/mL=94mL,应选用的量筒的量程为100mL,用量筒量取水时仰视读数(其他操作无误),水的实际体积偏大,会导致会导致所配溶液的溶质质量分数偏小。
【点评】本题难度不大,明确一定溶质质量分数溶液的配制步骤,注意事项是正确解答本题的关键。
16.(2025 周口一模)某兴趣小组要在实验室配制100g溶质质量分数为5%的氯化钠溶液,实验操作如图所示。
(1)所需氯化钠固体的质量为 5 g。
(2)配制时应选择 100 (选填“10”“50”或“100”)mL的量筒量取所需要的水。
(3)若所配制溶液的溶质质量分数偏大,则可能是量取水时 俯视 (选填“俯视”或“仰视”)量筒读数所致。
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】(1)5;
(2)100;
(3)俯视。
【分析】(1)根据溶质质量=溶液质量×溶质的质量分数,进行分析解答。
(2)根据溶剂质量=溶液质量﹣溶质质量,进行分析解答。
(3)根据溶质质量分数偏大,可能是溶剂质量偏小,进行分析解答。
【解答】解:(1)实验室配制100g溶质质量分数为5%的氯化钠溶液,需要氯化钠的质量=100g×5%=5g。
(2)溶剂质量=溶液质量﹣溶质质量,所需溶剂的质量为100g﹣5g=95g(合95mL),量筒量程的选择,应遵循“大而近”的原则,应用规格为100mL的量筒量取水的体积。
(3)用量筒量取水时,俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,使溶质质量分数偏大。用量筒量取水时,仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,使溶质质量分数偏小。
故答案为:
(1)5;
(2)100;
(3)俯视。
【点评】本题难度不大,明确配制一定溶质质量分数的溶液主要实验步骤、注意事项等是正确解答本题的关键。
17.(2025 安阳县一模)农业上常用16%的氯化钠溶液进行选种,若要配制100g该浓度的氯化钠溶液,需要氯化钠固体的质量为 16 g,实验操作如图,则正确的操作顺序为 CBDEA (填字母序号)。某同学在实验室配制该溶液,若其他操作均正确,量取水时俯视量筒读数,会导致所配制溶液的质量分数 增大 (填“增大”、“减小”或“不变”)。
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】16;CBDEA;增大。
【分析】根据已有的溶液配制的知识进行分析解答即可。
【解答】解:配制100g该浓度的氯化钠溶液,氯化钠固体的质量为:100g×16%=16g;根据图示,配制溶液的顺序为CBDEA;量取水时俯视量筒读数,则实际量取的水的体积会减小,故会导致所配制溶液的质量分数增大;
故答案为:16;CBDEA;增大。
【点评】加强对溶液配制的知识的掌握是正确解答本题的关键。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
中考核心考点 配制一定溶质质量分数的氯化钠溶液
一.选择题(共7小题)
1.(2025 濮阳一模)实验室用氯化钠配制50g质量分数为6%的氯化钠溶液。下列说法正确的是( )
A.所需氯化钠的质量为6g
B.量水时俯视读数会使溶液浓度偏大
C.氯化钠直接放在托盘天平的左盘称量
D.需玻璃仪器有漏斗、量筒等
2.(2025 万柏林区一模)如图是一定溶质质量分数的氯化钠溶液的配制部分操作,其中操作正确的是( )
A.取用 B.称量
C.加入蒸馏水 D.溶解
3.(2025 西城区模拟)配制100g质量分数为15%的NaCl溶液,下列说法不正确的是( )
A.需称量15g氯化钠固体
B.需量取100mL的蒸馏水
C.玻璃棒搅拌可加速溶解
D.取5g该溶液,溶质的质量分数为15%
4.(2025 南关区校级一模)用如表所示浓硫酸配制100g质量分数为9.8%的稀硫酸,下列说法正确的是( )
硫酸分子式:H2SO4 相对分子质量:98 密度:1.84g/mL溶质质量分数:98% 体积:500mL
A.所需浓硫酸的体积为10mL,水为90mL
B.稀释时把浓硫酸倒入盛有水的烧杯中并搅拌
C.稀释后未冷却的稀硫酸立即装入广口瓶
D.量取浓硫酸时俯视读数,稀释后硫酸溶质质量分数偏大
5.(2025 新城区校级模拟)实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致浓度偏小的是( )
①称量的氯化钠固体中含有不溶性杂质
②用量筒量水时仰视刻度
③将水注入烧杯时有水洒出
④将配制好的溶液装入试剂瓶时有少量溅出
A.①② B.③④ C.①③ D.①②③
6.(2025春 临澧县期中)配制50g10%氯化钠溶液,整个操作过程如图所示,下列有关说法正确的是( )
A.步骤④中玻璃棒的作用是引流
B.配制溶液的正确顺序为②①⑤④③
C.通过计算得出需要NaCl固体的质量为5g
D.步骤①的错误操作,肯定会导致所配制的溶液溶质质量分数偏大
7.(2025 沙坪坝区模拟)配制100克溶质质量分数为12%的葡萄糖溶液,下列操作会导致所配溶液的溶质质量分数偏大的是( )
A.用托盘天平称量葡萄糖时,砝码放在左盘
B.用量筒量取水时,俯视读数
C.转移葡萄糖时,纸上有少量残留
D.配好溶液装入试剂瓶时,有少量洒出
二.填空题(共10小题)
8.(2025 郑州二模)将50g溶质质量分数为98%的浓硫酸,稀释为溶质质量分数为20%的稀硫酸用于化学实验。
(1)需要量取水的体积是 mL。
(2)若其他操作正确,量取水时仰视读数,则配制的稀硫酸中溶质质量分数 (填“偏大”“偏小”或“不变”)。
9.(2025 双城区一模)分类、类比是学习化学常用的方法。
(1)在初中化学学习中,我们经常要配制一定溶质质量分数的溶液,但配制时由于错误的操作可能会使所配制溶液的溶质质量分数偏大或偏小。据此将下列操作分类:其中一类的分类标准是① :包括事例为② (填字母)。
A.试剂、砝码左右位置颠倒,且使用了游码 B.称量易潮解的物质(如NaOH)暴露在空气中时间过长 C.用量筒量取溶剂水时,俯视读数 D.往烧杯中加水时有少量水洒出
(2)在金属活动性顺序里,位置越靠后的金属活动性越弱,所形成的金属阳离子氧化性越强,金属单质先与氧化性强的金属离子发生置换反应。据此,将一定量的铁粉放入硝酸铜和硝酸银的混合溶液中,则一定发生反应的化学方程式是① ,过滤,所得滤渣成分可能有② 种情况。
10.(2025 淄川区一模)如表是一瓶生理盐水标签上的部分文字说明,请回答下列问题:
氯化钠注射液 (0.9%生理盐水) [性状]无色透明液体,味咸 [成分]氯化钠、水 [规格]500mL质量分数0.9% [密度]1.0g/cm3
(1)生理盐水的溶剂为 。
(2)该生理盐水具有的物理性质有 (写出一条即可)。
(3)从微观角度看,该生理盐水由 构成(用符号表示)。
(4)若要配制一瓶该生理盐水需 g氯化钠,不需要用到的仪器是 (填序号)。
A.集气瓶
B.烧杯
C.玻璃棒
D.量筒
11.(2025春 洛龙区期中)农业中常用16%的氯化钠溶液来选种,现在实验室配制50g16%的氯化钠溶液,需要称取氯化钠的质量为 g,量取一定量溶剂后,溶解过程中用到的玻璃仪器有 ;若配制溶液的过程中其他操作均正确,量取水时仰视量筒读数,会导致所配制溶液的质量分数 (填“偏大”“偏小”或“不变”)。
12.(2025 淮阴区一模)某同学欲配制60g溶质质量分数为5%的NaCl溶液,准备了如图1实验用品。
(1)该同学按下列实验步骤进行:①计算,②称量,③量取,④ (填步骤名称)。
(2)配制过程还缺少的一种玻璃仪器是 (填名称)。
(3)计算所需NaCI的质量为 g;量取时,应该选择 (填100mL、50mL或10mL)的量筒。
(4)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用 (填仪器名称)滴加蒸馏水至刻度线。
(5)若用如图2观察方式量取水的体积,所配制溶液的溶质质量分数会 (填“偏大”、“偏小”或“无影响”)。
13.(2025 泌阳县一模)实验室用氯化钠固体配制50g质量分数为6%的溶液,实验步骤为计算、量取、溶解;水的密度近似看作1g/cm3,量取水时所选用量筒的规格应为 (填“10mL”“50mL”或“100mL”),若所配制溶液的溶质质量分数偏大,则可能是量取水时 (填“俯视”或“仰视”)量筒读数所致。
14.(2025 上蔡县一模)小郑同学欲配制100g溶质质量分数为12%的氯化钠溶液,图示实验中,正确的操作顺序为 (填序号),写出一种可能导致溶质质量分数小于12%的错误操作 。
15.(2025 南乐县一模)某同学在实验室配制100g质量分数为6%的氯化钠溶液的相关操作如图所示。该实验的正确操作顺序为 (填序号);量取水时,应选用的量筒的量程为 (选填“50mL”“100mL”或“150mL”);在操作④中,用量筒量取水时仰视读数(其他操作无误),会导致所配溶液的溶质质量分数 (选填“偏小”“不变”或“偏大”)。
16.(2025 周口一模)某兴趣小组要在实验室配制100g溶质质量分数为5%的氯化钠溶液,实验操作如图所示。
(1)所需氯化钠固体的质量为 g。
(2)配制时应选择 (选填“10”“50”或“100”)mL的量筒量取所需要的水。
(3)若所配制溶液的溶质质量分数偏大,则可能是量取水时 (选填“俯视”或“仰视”)量筒读数所致。
17.(2025 安阳县一模)农业上常用16%的氯化钠溶液进行选种,若要配制100g该浓度的氯化钠溶液,需要氯化钠固体的质量为 g,实验操作如图,则正确的操作顺序为 (填字母序号)。某同学在实验室配制该溶液,若其他操作均正确,量取水时俯视量筒读数,会导致所配制溶液的质量分数 (填“增大”、“减小”或“不变”)。
中考核心考点 配制一定溶质质量分数的氯化钠溶液
参考答案与试题解析
一.选择题(共7小题)
1.(2025 濮阳一模)实验室用氯化钠配制50g质量分数为6%的氯化钠溶液。下列说法正确的是( )
A.所需氯化钠的质量为6g
B.量水时俯视读数会使溶液浓度偏大
C.氯化钠直接放在托盘天平的左盘称量
D.需玻璃仪器有漏斗、量筒等
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】B
【分析】A、根据溶质质量=溶液质量×溶质的质量分数,进行分析判断。
B、根据用量筒量取水时,俯视液面,读数比实际液体体积大,进行分析判断。
C、根据托盘天平的使用方法,进行分析判断。
D、根据各操作所需要使用的仪器,进行分析判断。
【解答】解:A、溶质质量=溶液质量×溶质的质量分数,配制50g质量分数为6%的氯化钠溶液,需氯化钠的质量为50g×6%=3g,故错误;
B、用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故正确;
C、使用托盘天平,遵循“左物右码”的原则,氯化钠不能直接放在托盘天平的左盘称量,要放在左盘的纸片上称量,故错误;
D、托盘天平用于称取固体氯化钠、量筒与胶头滴管用于准确量取水、烧杯用于完成溶解操作、玻璃棒用于溶解时的搅拌,所需玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管等,无需使用漏斗,故错误;
故选:B。
【点评】本题难度不大,明确配制一定溶质质量分数的溶液主要实验步骤、注意事项等是正确解答本题的关键。
2.(2025 万柏林区一模)如图是一定溶质质量分数的氯化钠溶液的配制部分操作,其中操作正确的是( )
A.取用 B.称量
C.加入蒸馏水 D.溶解
【考点】溶液配制过程中的操作正误的判断.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】A、根据固体试剂的取用方法,进行分析判断。
B、根据托盘天平的使用要遵循“左物右码”的原则,进行分析判断。
C、根据溶解操作的方法,进行分析判断。
D、根据溶解操作的方法,进行分析判断。
【解答】解:A、取用固体粉末状试剂时,瓶塞要倒放,应用药匙取用,图中瓶塞没有倒放,故选项实验操作错误。
B、托盘天平的使用要遵循“左物右码”的原则,图中砝码与试剂的位置放反了,故选项实验操作错误。
C、溶解操作应在烧杯中进行,倾倒水时,量筒要紧挨烧杯口,故选项实验操作错误。
D、溶解操作应在烧杯中进行,用玻璃棒不断搅拌,故选项实验操作正确。
故选:D。
【点评】本题难度不大,明确配制一定溶质质量分数的溶液主要实验步骤、注意事项等是正确解答本题的关键。
3.(2025 西城区模拟)配制100g质量分数为15%的NaCl溶液,下列说法不正确的是( )
A.需称量15g氯化钠固体
B.需量取100mL的蒸馏水
C.玻璃棒搅拌可加速溶解
D.取5g该溶液,溶质的质量分数为15%
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】B
【分析】A、根据溶质质量=溶液质量×溶质的质量分数,进行分析判断。
B、根据溶剂质量=溶液质量﹣溶质质量,进行分析判断。
C、根据玻璃棒搅拌的作用,进行分析判断。
D、根据溶液具有均一性,进行分析判断。
【解答】解:A、配制100g质量分数为15%的NaCl溶液,需要氯化钠的质量=100g×15%=15g,故选项说法正确。
B、溶剂质量=溶液质量﹣溶质质量,所需水的质量=100g﹣15g=85g(合85mL),故选项说法错误。
C、玻璃棒搅拌可加速溶解,故选项说法正确。
D、溶液具有均一性,取5g该溶液,溶质的质量分数为15%,故选项说法正确。
故选:B。
【点评】本题难度不大,明确配制一定溶质质量分数的溶液主要实验步骤、注意事项等是正确解答本题的关键。
4.(2025 南关区校级一模)用如表所示浓硫酸配制100g质量分数为9.8%的稀硫酸,下列说法正确的是( )
硫酸分子式:H2SO4 相对分子质量:98 密度:1.84g/mL溶质质量分数:98% 体积:500mL
A.所需浓硫酸的体积为10mL,水为90mL
B.稀释时把浓硫酸倒入盛有水的烧杯中并搅拌
C.稀释后未冷却的稀硫酸立即装入广口瓶
D.量取浓硫酸时俯视读数,稀释后硫酸溶质质量分数偏大
【考点】浓溶液稀释配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】B
【分析】A、根据溶液稀释前后溶质的质量不变,水的质量=稀溶液的质量﹣浓溶液的质量,进行分析判断。
B、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅),进行分析判断。
C、根据浓硫酸溶于水放热、液体试剂的存放仪器,进行分析判断。
D、根据俯视读数,读数比实际液体体积大,进行分析判断。
【解答】解:A、设需要浓硫酸的体积为x,1.84g/mL×x×98%=100g×9.8%,x≈5.4mL,水的质量为100g﹣1.84g/mL×5.4mL≈90g(合90mL),故选项说法错误。
B、稀释浓硫酸时,要把浓硫酸慢慢地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时散失;一定不能把水注入浓硫酸中,以防止酸液飞溅,故选项说法正确。
C、浓硫酸溶于水放热,稀释后冷却后,稀硫酸可装入细口瓶中,故选项说法错误。
D、用量筒量取浓硫酸时,俯视读数,读数比实际液体体积大,会造成实际量取的浓硫酸的体积偏小,使溶质质量分数偏小,故选项说法错误。
故选:B。
【点评】本题难度不大,明确用浓溶液配制稀溶液配制稀溶液的基本步骤、溶液稀释前后溶质的质量不变等是正确解答本题的关键。
5.(2025 新城区校级模拟)实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致浓度偏小的是( )
①称量的氯化钠固体中含有不溶性杂质
②用量筒量水时仰视刻度
③将水注入烧杯时有水洒出
④将配制好的溶液装入试剂瓶时有少量溅出
A.①② B.③④ C.①③ D.①②③
【考点】溶液配制过程中的误差分析.
【专题】溶液、浊液与溶解度.
【答案】A
【分析】根据溶质质量分数偏小,可能是溶质质量偏小或溶剂质量偏大,可以分析出可能造成这两个方面错误的原因,进行分析解答。
【解答】解:①称量的氯化钠固体中含有不溶性杂质,导致溶质质量偏小,从而导致配制的氯化钠溶液溶质质量分数偏小;
②用量筒量取水时仰视刻度,读数偏小,实际量取水的体积偏大,最终导致配制的氯化钠溶液溶质质量分数偏小;
③将水注入烧杯时有水洒出,会造成实际量取的水的体积偏小,最终导致配制的氯化钠溶液溶质质量分数偏大;
④溶液具有均一性,将配制好的溶液装入试剂瓶时有少量溅出,对溶液中溶质的质量分数没有影响,溶质质量分数不变。
故选:A。
【点评】本题难度不是很大,解答本题可从溶质质量分数的概念入手,与溶质和溶剂的质量有关,分析操作中的错误操作,判断错误操作对溶质、溶剂的影响是正确解答此类题的关键。
6.(2025春 临澧县期中)配制50g10%氯化钠溶液,整个操作过程如图所示,下列有关说法正确的是( )
A.步骤④中玻璃棒的作用是引流
B.配制溶液的正确顺序为②①⑤④③
C.通过计算得出需要NaCl固体的质量为5g
D.步骤①的错误操作,肯定会导致所配制的溶液溶质质量分数偏大
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】C
【分析】A、根据玻璃棒作用分析。
B、配制溶液的正确顺序为计算、称量、量取、溶解。
C、溶质质量=溶液质量×溶质质量分数。
D、根据托盘天平使用方法及溶质质量分数100%分析。
【解答】解:A、步骤④是溶解操作,玻璃棒的作用是搅拌,加速溶解,而不是引流,故A错误。
B、配制溶液的正确顺序为计算、称量、量取、溶解,即②①⑤③④,故B错误。
C、需要NaCl 固体的质量为:50g×10%=5g,故C正确。
D、步骤①中砝码和药品放反了,若使用了游码,会导致称得的氯化钠质量偏小,所配制溶液溶质质量分数偏小;若没有使用游码,则对称量结果无影响,故D错误。
故选:C。
【点评】本题考查了配制一定溶质质量分数的溶液,涉及溶质质量、溶剂质量的计算以及操作步骤和仪器的使用,根据已有知识分析解答。
7.(2025 沙坪坝区模拟)配制100克溶质质量分数为12%的葡萄糖溶液,下列操作会导致所配溶液的溶质质量分数偏大的是( )
A.用托盘天平称量葡萄糖时,砝码放在左盘
B.用量筒量取水时,俯视读数
C.转移葡萄糖时,纸上有少量残留
D.配好溶液装入试剂瓶时,有少量洒出
【考点】溶液配制过程中的误差分析.
【专题】溶液、浊液与溶解度.
【答案】B
【分析】根据溶质质量分数偏大,可能是溶质质量偏大或溶剂质量偏小,可以分析出可能造成这两个方面错误的原因,进行分析判断。
【解答】解:A、用托盘天平称量葡萄糖时,砝码放在左盘,砝码和食盐的位置放反了,会造成实际所取的溶质的质量偏小,使溶质质量分数偏小,故选项错误。
B、用量筒量取水时,俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,使溶质质量分数偏大,故选项正确。
C、转移葡萄糖时,纸上有少量残留,会造成实际所取的溶质的质量偏小,使溶质质量分数偏小,故选项错误。
D、配好溶液装入试剂瓶时,有少量洒出,溶液具有均一性,溶质质量分数不变,故选项错误。
故选:B。
【点评】本题难度不是很大,解答本题可从溶质质量分数的概念入手,与溶质和溶剂的质量有关,分析操作中的错误操作,判断错误操作对溶质、溶剂的影响是正确解答此类题的关键。
二.填空题(共10小题)
8.(2025 郑州二模)将50g溶质质量分数为98%的浓硫酸,稀释为溶质质量分数为20%的稀硫酸用于化学实验。
(1)需要量取水的体积是 195 mL。
(2)若其他操作正确,量取水时仰视读数,则配制的稀硫酸中溶质质量分数 偏小 (填“偏大”“偏小”或“不变”)。
【考点】浓溶液稀释配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】(1)195;
(2)偏小。
【分析】(1)根据溶液稀释前后溶质的质量不变,进行分析解答。
(2)根据用量筒量取水时,仰视读数,读数比实际液体体积小,进行分析解答。
【解答】解:(1)设要加水的质量为x,根据溶液稀释前后溶质的质量不变,则50g×98%=(50g+x)×20%,x=195g(合195mL)。
(2)用量筒量取水时,仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,使溶质质量分数偏小。
故答案为:
(1)195;
(2)偏小。
【点评】本题难度不大,明确用浓溶液配制稀溶液的基本步骤、溶液稀释前后溶质的质量不变等是正确解答本题的关键。
9.(2025 双城区一模)分类、类比是学习化学常用的方法。
(1)在初中化学学习中,我们经常要配制一定溶质质量分数的溶液,但配制时由于错误的操作可能会使所配制溶液的溶质质量分数偏大或偏小。据此将下列操作分类:其中一类的分类标准是① 质量分数偏小 :包括事例为② AB (填字母)。
A.试剂、砝码左右位置颠倒,且使用了游码 B.称量易潮解的物质(如NaOH)暴露在空气中时间过长 C.用量筒量取溶剂水时,俯视读数 D.往烧杯中加水时有少量水洒出
(2)在金属活动性顺序里,位置越靠后的金属活动性越弱,所形成的金属阳离子氧化性越强,金属单质先与氧化性强的金属离子发生置换反应。据此,将一定量的铁粉放入硝酸铜和硝酸银的混合溶液中,则一定发生反应的化学方程式是① Fe+2AgNO3=Fe(NO3)2+2Ag ,过滤,所得滤渣成分可能有② 3 种情况。
【考点】溶液配制过程中的误差分析;金属与盐溶液反应的原理.
【专题】溶液、浊液与溶解度;金属与金属材料.
【答案】(1)质量分数偏小;AB(或质量分数偏大;CD);
(2)①Fe+2AgNO3=Fe(NO3)2+2Ag;②3。
【分析】(1)根据溶质质量分数变小,则可能是溶质质量偏小或溶剂质量偏大进行分析。
(2)根据金属的化学性质分析。
【解答】解:(1)A、试剂、砝码左右位置颠倒,且使用了游码,会使称得试剂质量偏小,导致所配制溶液溶质质量分数偏小。
B、称量易潮解的物质(如NaOH)暴露在空气中时间过长,会使试剂吸收水分且部分变质,称得试剂实际溶质质量偏小,导致所配制溶液溶质质量分数偏小。
C、用量筒量取溶剂水时,俯视读数,会使量取的水的体积偏小,溶剂质量偏小,根据溶质质量分数100%,会导致所配制溶液溶质质量分数偏大。
D、往烧杯中加水时有少量水洒出,会使溶剂质量偏小,导致所配制溶液溶质质量分数偏大。
(2)在金属活动性顺序中,铁>铜>银,所以铁先与硝酸银反应Fe+2AgNO3=Fe(NO3)2+2Ag,当硝酸银完全反应后,若铁还有剩余,再与硝酸铜反应,当铁的量很少,只与部分硝酸银反应时,滤渣只有银;当铁恰好与硝酸银反应完时,滤渣只有银;当铁与硝酸银反应完,又与部分硝酸铜反应时,滤渣有银和铜;当铁过量,将硝酸银和硝酸铜都反应完时,滤渣有银、铜和铁。所以滤渣成分可能有3种情况(只有银;银和铜;银、铜和铁)。
故答案为:(1)质量分数偏小;AB(或质量分数偏大;CD);
(2)①Fe+2AgNO3=Fe(NO3)2+2Ag;②3。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
10.(2025 淄川区一模)如表是一瓶生理盐水标签上的部分文字说明,请回答下列问题:
氯化钠注射液 (0.9%生理盐水) [性状]无色透明液体,味咸 [成分]氯化钠、水 [规格]500mL质量分数0.9% [密度]1.0g/cm3
(1)生理盐水的溶剂为 水 。
(2)该生理盐水具有的物理性质有 无色透明液体(答案不唯一) (写出一条即可)。
(3)从微观角度看,该生理盐水由 H2O、Na+、Cl﹣ 构成(用符号表示)。
(4)若要配制一瓶该生理盐水需 4.5 g氯化钠,不需要用到的仪器是 A (填序号)。
A.集气瓶
B.烧杯
C.玻璃棒
D.量筒
【考点】固体配制一定质量分数溶液;化学性质与物理性质的差别及应用;溶液、溶质和溶剂的相互关系与判断.
【专题】溶液、浊液与溶解度.
【答案】(1)水;
(2)无色透明液体(答案不唯一);
(3)H2O、Na+、Cl﹣;
(4)4.5;A。
【分析】(1)根据生理盐水是氯化钠的水溶液来分析解答;
(2)根据生理盐水具有的物理性质有无色透明液体,味咸,密度1.0g/cm3来分析解答;
(3)根据氯化钠是由钠离子和氯离子构成,水是由水分子构成来分析解答;
(4)根据溶质质量=溶液的体积×溶液密度×溶质质量分数来分析解答;根据配制一瓶生理盐水不需要用到的仪器是集气瓶来分析解答。
【解答】解:(1)生理盐水是氯化钠的水溶液,则生理盐水的溶剂为水;
(2)该生理盐水具有的物理性质有无色透明液体,味咸,密度1.0g/cm3;
(3)生理盐水是氯化钠的水溶液,氯化钠是由钠离子和氯离子构成,水是由水分子构成,则从微观角度看,该生理盐水由H2O、Na+、Cl﹣构成;
(4)若要配制一瓶该生理盐水需氯化钠的质量为500mL×1g/mL×0.9%=4.5g,不需要用到的仪器是集气瓶,故选:A。
故答案为:(1)水;
(2)无色透明液体(答案不唯一);
(3)H2O、Na+、Cl﹣;
(4)4.5;A。
【点评】在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的知识进行分析解答。
11.(2025春 洛龙区期中)农业中常用16%的氯化钠溶液来选种,现在实验室配制50g16%的氯化钠溶液,需要称取氯化钠的质量为 8 g,量取一定量溶剂后,溶解过程中用到的玻璃仪器有 烧杯、玻璃棒 ;若配制溶液的过程中其他操作均正确,量取水时仰视量筒读数,会导致所配制溶液的质量分数 偏小 (填“偏大”“偏小”或“不变”)。
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】8;烧杯、玻璃棒;偏小。
【分析】根据溶质的质量=溶液质量×溶质的质量分数,配制一定溶质质量分数的操作步骤、实验仪器、误差分析等相关知识进行分析。
【解答】解:需要称取氯化钠的质量为50g×16%=8g;量取一定量溶剂后,溶解过程中用到的玻璃仪器有烧杯、玻璃棒;若配制溶液的过程中其他操作均正确,量取水时仰视量筒读数,读数偏小,实际量取水的体积偏大,会导致所配制溶液的质量分数偏小。
故答案为:8;烧杯、玻璃棒;偏小。
【点评】本题难度不大,明确配制一定溶质质量分数的溶液主要实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键。
12.(2025 淮阴区一模)某同学欲配制60g溶质质量分数为5%的NaCl溶液,准备了如图1实验用品。
(1)该同学按下列实验步骤进行:①计算,②称量,③量取,④ 溶解 (填步骤名称)。
(2)配制过程还缺少的一种玻璃仪器是 玻璃棒 (填名称)。
(3)计算所需NaCI的质量为 3 g;量取时,应该选择 100mL (填100mL、50mL或10mL)的量筒。
(4)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用 胶头滴管 (填仪器名称)滴加蒸馏水至刻度线。
(5)若用如图2观察方式量取水的体积,所配制溶液的溶质质量分数会 偏大 (填“偏大”、“偏小”或“无影响”)。
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】(1)溶解;
(2)玻璃棒;
(3)3;100mL;
(4)胶头滴管;
(5)偏大。
【分析】(1)根据配制溶液的步骤来分析;
(2)根据配制溶液所需的仪器来分析;
(3)根据溶质质量、溶剂质量的计算以及量筒的选取原则来分析;
(4)根据量取一定体积液体的操作来分析;
(5)根据俯视读数会使所取水的体积偏小来分析。
【解答】解:(1)该同学按下列实验步骤进行:①计算,②称量,③量取,④溶解;
(2)由图可知,配制过程还缺少的一种玻璃仪器是玻璃棒;
(3)所需NaCl的质量为:60g×5%=3g,所需水的质量为:60g﹣3g=57g,合57mL,量筒应选择一次量取的最小量程,则应该选择100mL的量筒;
(4)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,为提高测量效率和准确度,改用胶头滴管滴加蒸馏水至刻度线;
(5)若用如图观察方式(俯视读数)量取水的体积,则所取水的体积偏小,会导致所配制溶液的溶质质量分数会偏大。
故答案为:
(1)溶解;
(2)玻璃棒;
(3)3;100mL;
(4)胶头滴管;
(5)偏大。
【点评】本题主要考查了溶液的配制,难度不大,根据所学知识,结合题中信息,认真分析即可解答。
13.(2025 泌阳县一模)实验室用氯化钠固体配制50g质量分数为6%的溶液,实验步骤为计算、量取、溶解;水的密度近似看作1g/cm3,量取水时所选用量筒的规格应为 50mL (填“10mL”“50mL”或“100mL”),若所配制溶液的溶质质量分数偏大,则可能是量取水时 俯视 (填“俯视”或“仰视”)量筒读数所致。
【考点】浓溶液稀释配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】50mL;俯视。
【分析】配制一定溶质质量分数的溶液,要计算出溶质的质量,所需水的质量和体积,然后把溶质转移到烧杯中,加水溶解,玻璃棒不断搅拌,得到均一稳定的混合物,据此分析。
【解答】解:配制50g质量分数为6%的溶液,需要溶质质量为50g×6%=3g,溶剂质量为50g﹣3g=47g,需要47mL水,根据量筒选用遵循“大而近”的原则,量取水时应选用50mL量程的量筒;若配制溶液的溶质质量分数偏大,则可能原因为实际量取的水的体积偏小,则可能为量取水时俯视读数。
故答案为:
50mL;俯视。
【点评】解答好这类题目,就必须熟记配制的步骤、所用仪器、有关的误差分析和注意事项等等。
14.(2025 上蔡县一模)小郑同学欲配制100g溶质质量分数为12%的氯化钠溶液,图示实验中,正确的操作顺序为 ②④⑤③① (填序号),写出一种可能导致溶质质量分数小于12%的错误操作 所称取的氯化钠固体不纯 。
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】②④⑤③①;所称取的氯化钠固体不纯。
【分析】根据配制溶质质量分数一定的溶液的基本步骤进行分析;
根据导致溶质质量分数小于12%的原因可能是溶质少了或溶剂多了进行分析。
【解答】解:配制溶液的步骤是计算、称量、量取、溶解,所以上述操作步骤的正确顺序是②④⑤③①;
溶质质量分数偏小的可能原因:氯化钠质量不够或者溶剂水质量偏大;所以可能导致溶质质量分数小于12%的错误操作是:所称取的氯化钠固体不纯。
故答案为:②④⑤③①;所称取的氯化钠固体不纯。
【点评】本题难度不大,明确配制一定溶质质量分数的溶液主要实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键。
15.(2025 南乐县一模)某同学在实验室配制100g质量分数为6%的氯化钠溶液的相关操作如图所示。该实验的正确操作顺序为 ③⑤②④① (填序号);量取水时,应选用的量筒的量程为 100mL (选填“50mL”“100mL”或“150mL”);在操作④中,用量筒量取水时仰视读数(其他操作无误),会导致所配溶液的溶质质量分数 偏小 (选填“偏小”“不变”或“偏大”)。
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】③⑤②④①;100mL;偏小。
【分析】根据配制100g质量分数为6%的氯化钠溶液的实验操作步骤,量筒的选取原则和仰视读数,水的实际体积偏大来分析解答。
【解答】解:配制100g质量分数为6%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠质量,用量筒量取水,最后进行溶解,则该实验的正确操作顺序为③⑤②④①,量取水的体积为100g×(1﹣6%)÷1g/mL=94mL,应选用的量筒的量程为100mL,用量筒量取水时仰视读数(其他操作无误),水的实际体积偏大,会导致会导致所配溶液的溶质质量分数偏小。
【点评】本题难度不大,明确一定溶质质量分数溶液的配制步骤,注意事项是正确解答本题的关键。
16.(2025 周口一模)某兴趣小组要在实验室配制100g溶质质量分数为5%的氯化钠溶液,实验操作如图所示。
(1)所需氯化钠固体的质量为 5 g。
(2)配制时应选择 100 (选填“10”“50”或“100”)mL的量筒量取所需要的水。
(3)若所配制溶液的溶质质量分数偏大,则可能是量取水时 俯视 (选填“俯视”或“仰视”)量筒读数所致。
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】(1)5;
(2)100;
(3)俯视。
【分析】(1)根据溶质质量=溶液质量×溶质的质量分数,进行分析解答。
(2)根据溶剂质量=溶液质量﹣溶质质量,进行分析解答。
(3)根据溶质质量分数偏大,可能是溶剂质量偏小,进行分析解答。
【解答】解:(1)实验室配制100g溶质质量分数为5%的氯化钠溶液,需要氯化钠的质量=100g×5%=5g。
(2)溶剂质量=溶液质量﹣溶质质量,所需溶剂的质量为100g﹣5g=95g(合95mL),量筒量程的选择,应遵循“大而近”的原则,应用规格为100mL的量筒量取水的体积。
(3)用量筒量取水时,俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,使溶质质量分数偏大。用量筒量取水时,仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,使溶质质量分数偏小。
故答案为:
(1)5;
(2)100;
(3)俯视。
【点评】本题难度不大,明确配制一定溶质质量分数的溶液主要实验步骤、注意事项等是正确解答本题的关键。
17.(2025 安阳县一模)农业上常用16%的氯化钠溶液进行选种,若要配制100g该浓度的氯化钠溶液,需要氯化钠固体的质量为 16 g,实验操作如图,则正确的操作顺序为 CBDEA (填字母序号)。某同学在实验室配制该溶液,若其他操作均正确,量取水时俯视量筒读数,会导致所配制溶液的质量分数 增大 (填“增大”、“减小”或“不变”)。
【考点】固体配制一定质量分数溶液.
【专题】溶液、浊液与溶解度.
【答案】16;CBDEA;增大。
【分析】根据已有的溶液配制的知识进行分析解答即可。
【解答】解:配制100g该浓度的氯化钠溶液,氯化钠固体的质量为:100g×16%=16g;根据图示,配制溶液的顺序为CBDEA;量取水时俯视量筒读数,则实际量取的水的体积会减小,故会导致所配制溶液的质量分数增大;
故答案为:16;CBDEA;增大。
【点评】加强对溶液配制的知识的掌握是正确解答本题的关键。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
