云南省保山市2023-2024学年高二下学期7月期末检测化学试卷(含答案)
文档属性
| 名称 | 云南省保山市2023-2024学年高二下学期7月期末检测化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-16 17:10:24 | ||
图片预览



文档简介
云南省保山市2023-2024学年高二下学期期末质量监测化学试卷
一、单选题
1.2024年央视春晚首次应用5G-A技术,采用含铝的LED屏,硬科技霸屏。下列有关说法正确的是
A.晚会采用的LED屏,其发光材料是以传统的无机非金属材料为基础,用铝取代部分硅,用氧取代部分氮后所得的陶瓷制作而成
B.舞蹈《瓷影》所诠释的青花瓷,生产的主要原材料为黏土和石灰石
C.5G-A技术中使用二氧化硅制造出的芯片,使得春晚上各种AI技术得以完美体现
D.春晚燃放的烟花涉及焰色试验,它的原理是电子由激发态跃迁到基态时,向外释放能量
2.表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2L中含有的分子数为
B.和充分反应转移电子数为
C.加热条件下71g与足量的铁充分反应,转移电子数为
D.的溶液,含有数目为
3.W、X、Y、Z为原子序数依次增大的短周期主族元素。W和X的单质常温下均为气体,W和X的最外层电子数之和等于Z的最外层电子数;Z的原子序数是Y的原子序数的2倍,Y原子的2p轨道有4个电子。下列叙述正确的是
A.原子半径: B.第一电离能:
C.W、X、Y形成的化合物只含共价键 D.最简单氢化物的键角:
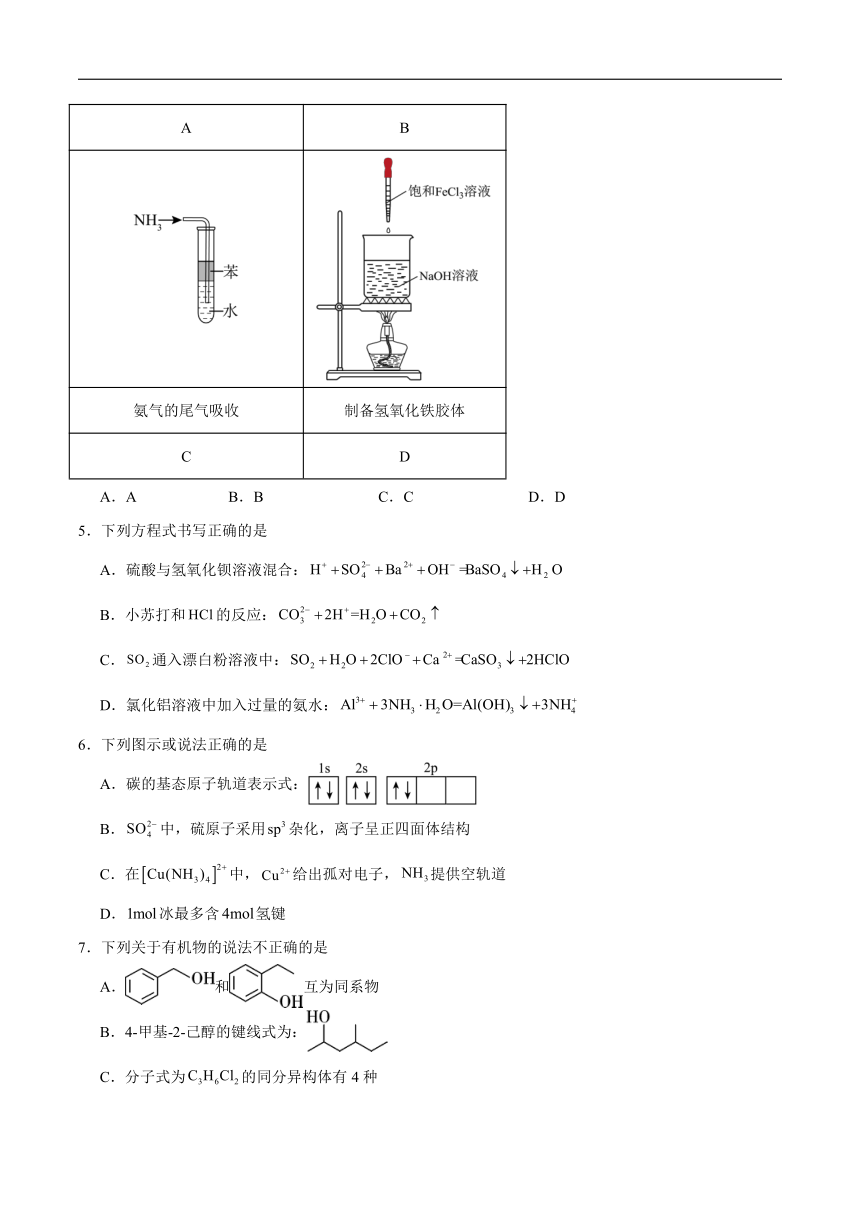
4.下列有关实验装置能够正确完成对应实验的是
检验铜与浓硫酸反应产生的 中和热的测定
A B
氨气的尾气吸收 制备氢氧化铁胶体
C D
A.A B.B C.C D.D
5.下列方程式书写正确的是
A.硫酸与氢氧化钡溶液混合:
B.小苏打和的反应:
C.通入漂白粉溶液中:
D.氯化铝溶液中加入过量的氨水:
6.下列图示或说法正确的是
A.碳的基态原子轨道表示式:
B.中,硫原子采用杂化,离子呈正四面体结构
C.在中,给出孤对电子,提供空轨道
D.冰最多含氢键
7.下列关于有机物的说法不正确的是
A.和互为同系物
B.4-甲基-2-己醇的键线式为:
C.分子式为的同分异构体有4种
D.的核磁共振氢谱有2组峰
8.2023年5月30日,“神舟十六号”载人飞船的成功发射,离不开化学材料的助力。高分子的组成和结构特点决定了高分子的性质,是确定高分子材料合成方法及应用领域的基础。下列关于下图说法错误的是
A.丁腈橡胶没有固定的熔点
B.丁腈橡胶的单体为丙烯腈()和1,3-丁二烯
C.此酚醛树脂受热不能熔融,可用于生产烹饪器具的手柄
D.涤纶吸湿性差的原因是亲水性基团较少
9.下列事实能说明苯酚中羟基活化了苯环的是
A.与丙醇相比,苯酚能与反应
B.与丙烷相比,苯酚能与发生加成反应
C.与丙醇相比,苯酚在水中的溶解度小(常温下)
D.与苯相比,苯酚更易与浓溴水发生取代反应
10.漆油是怒江传统饮食文化中的重要组成部分,如怒江特色——漆油鸡。漆油主要营养成份有漆树苷、不饱和脂肪酸等。漆树苷的结构简式如图所示,下列说法不正确的是
A.该有机物能发生取代反应、加成反应、氧化反应、消去反应
B.该有机物中含有羟基、酯基、醚键、碳碳双键
C.该有机物与浓溴水发生取代反应时最多消耗
D.该有机物与烧碱溶液反应时最多消耗
11.2022年3月,我国科学家在实验室实现到淀粉的全合成,其合成路线如图:
下列有关说法正确的是
A.淀粉酿酒过程中涉及的反应均为水解反应
B.DHA不能使酸性高锰酸钾溶液褪色
C.甲醛与足量银氨溶液发生反应,生成的单质与甲醛的物质的量之比为4:1
D.为加快反应③速率,可采用高温环境进行反应
12.下列实验操作和现象以及所得到的结论均正确的是
选项 实验操作和现象 结论
A 将红热木炭加入浓硝酸中,产生红棕色气体 加热条件下,浓硝酸能氧化碳单质
B 向某溶液中滴加盐酸酸化的溶液,产生白色沉淀 该溶液中一定含有
C 向盛有溶液的试管中滴加几滴氨水,得到深蓝色的透明溶液 和氨水生成了
D 取溶液于试管中,加入溶液,充分反应后滴入5滴15%溶液,溶液变红 与的反应有一定限度
A.A B.B C.C D.D
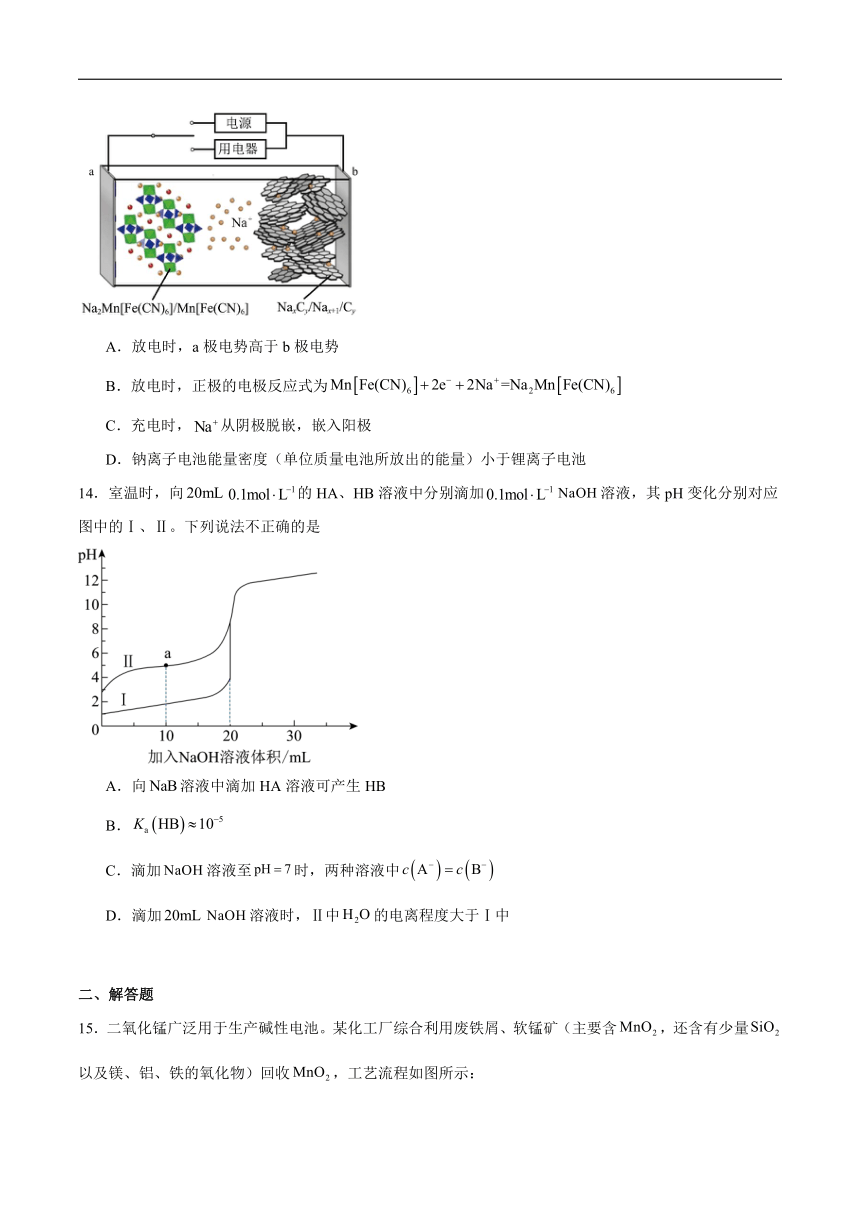
13.2023年星恒电源发布“超钠F1”开启钠电在电动车上产业化元年。如图“超钠F1”二次电池的工作原理是,在充、放电过程中,在两个电极之间往返嵌入和脱嵌。下列说法错误的是
A.放电时,a极电势高于b极电势
B.放电时,正极的电极反应式为
C.充电时,从阴极脱嵌,嵌入阳极
D.钠离子电池能量密度(单位质量电池所放出的能量)小于锂离子电池
14.室温时,向的HA、HB溶液中分别滴加溶液,其pH变化分别对应图中的Ⅰ、Ⅱ。下列说法不正确的是
A.向溶液中滴加HA溶液可产生HB
B.
C.滴加溶液至时,两种溶液中
D.滴加溶液时,Ⅱ中的电离程度大于Ⅰ中
二、解答题
15.二氧化锰广泛用于生产碱性电池。某化工厂综合利用废铁屑、软锰矿(主要含,还含有少量以及镁、铝、铁的氧化物)回收,工艺流程如图所示:
已知常温下,各物质的溶度积如下表所示:
物质
请回答下列问题:
(1)“酸浸”时为了加快酸浸的速率,可以采取的措施是 (至少回答两点)。
(2)酸浸过程中,铁屑被稀硫酸溶解后将还原为。写出该过程第二步的离子方程式: 。
(3)加过氧化氢的目的是 (用一个离子方程式解释)。
(4)当离子浓度时,可视为沉淀完全,则“除铁铝”时应控制 (小数点后保留两位数字)。
(5)写出“转化”时发生的离子方程式: 。
(6)写出基态锰的价电子排布式: 。
(7)氟化钙的晶胞结构如图所示,若晶体密度为,用表示阿伏加德罗常数的值,则晶胞的边长为 cm(用含a、的代数式表示)。
16.2020年9月中国明确提出2030年“碳达峰”与2060年“碳中和”目标,为此科研工作者经过了不懈的努力,研究出了甲醇化的技术,反应方程式如下:
阅读材料回答下列问题:
恒容密闭容器中投入和,在不同条件下达到平衡。设体系中甲醇的物质的量分数为,在下的、在下的如图所示:
(1)写出该反应的平衡常数表达式 。
(2)下列不能说明该反应达平衡的是 (填序号)。
a.单位时间内断裂个碳氧双键,同时形成个氢氢键
b.密度不再改变
c.混合气体压强不变
d.不变
(3)曲线 (填“a”或“b”)代表下的。
(4)该反应正反应为放热反应,理由是 。
(5)下列措施既能加快反应速率,又能提高的是 (填序号)。
a.升高温度 b.分离出水蒸气
c.温度不变缩小容器体积 d.增大的浓度
e.使用催化剂
(6)计算在250℃,下达平衡后,的转化率= 。(保留三位有效数字)
(7)甲醇应用前景广泛,可用于燃料电池。写出甲醇燃料电池在碱性环境下负极发生的电极反应: 。
17.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,俗称“香蕉油”,可用作食品、化妆品香精。实验室制备乙酸异戊酯的反应原理为:
有关数据如下表:
有机物 相对分子质量 密度/() 沸点/℃ 水中溶解性
异戊醇 88 0.8123 131 微溶
乙酸 60 1.0492 118 溶
乙酸异戊酯 130 0.8670 142 难溶
实验步骤:向如图所示的仪器A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。按图示安装带分水器的回流反应装置,并在分水器中预先加入水,使液面略低于分水器的支管口,通入冷凝水,缓慢加热A至130℃,回流1小时。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变。反应液冷却至室温后倒入分液漏斗中,依次用少量水、饱和碳酸钠溶液和水洗涤。分离出的产物加入少量无水固体,静置片刻,过滤除去固体,进行蒸馏纯化,收集140~143℃馏分,得到乙酸异戊酯4.2g。
请回答下列问题:
(1)仪器A的名称是 。
(2)若实验过程中发现忘记加碎瓷片,应进行的操作是 。
(3)洗涤操作中有2次水洗,第一次水洗的作用是 。
(4)分水器中的液体分为两层,上层液体的主要成分为 (填物质名称),结合平衡移动原理解释使用分水器不断分离除去水的目的: 。
(5)实验开始前在分水器中预先加入水,并使液面略低于分水器的支管口,实验过程中保持分水器中水层液面的高度不变,这样做的目的是 。
(6)在制备中会有副反应发生,可能的有机副产物是二异戊醚、 (填写结构简式)。乙酸异戊酯的产率是 (保留3位有效数字)。
18.阿佐塞米(化合物L)是一种可用于治疗心脏、肝脏和肾脏病引起的水肿的药物。L的一种合成路线如图(部分试剂和条件略去)。
已知:①苯胺易被氧化;
②;
③属于邻、对位定位基;属于间位定位基。
回答下列问题:
(1)A→B的反应类型为 ,H中碳原子的杂化方式为 。
(2)C的结构简式为 。
(3)F转化为G后新增官能团名称为 。
(4)由H和I反应生成J的化学方程式为 。
(5)具有相同官能团的B的芳香同分异构体还有 种(不考虑立体异构,填序号)。
a.10 b.12 c.14 d.16
其中核磁共振氢谱显示4组峰,且峰面积比为2:2:1:1的同分异构体结构简式为 。
(6)以为原料合成,设计合成路线 (其他试剂任选)。
参考答案
1.D
2.C
3.B
4.A
5.D
6.B
7.A
8.C
9.D
10.B
11.C
12.D
13.C
14.C
15.(1)适当增大硫酸浓度、搅拌、将反应物粉碎
(2)
(3)
(4)4.67
(5)
(6)
(7)
16.(1)
(2)a b
(3)a
(4)当压强保持不变时,随温度的升高,减小,说明升高温度平衡逆向移动,正反应是放热反应
(5)c
(6)14.8%
(7)
17.(1)三颈烧瓶
(2)停止加热,冷却后补加
(3)除去大部分的乙酸、硫酸
(4) 异戊醇 及时除去反应生成的水,使平衡向生成乙酸异戊酯的方向移动,有利于提高产率
(5)使异戊醇流回三颈烧瓶中,提高原料的利用率
(6) 64.6%
18.(1) 取代反应 sp、
(2)
(3)酰胺基
(4)
(5) d
(6)
一、单选题
1.2024年央视春晚首次应用5G-A技术,采用含铝的LED屏,硬科技霸屏。下列有关说法正确的是
A.晚会采用的LED屏,其发光材料是以传统的无机非金属材料为基础,用铝取代部分硅,用氧取代部分氮后所得的陶瓷制作而成
B.舞蹈《瓷影》所诠释的青花瓷,生产的主要原材料为黏土和石灰石
C.5G-A技术中使用二氧化硅制造出的芯片,使得春晚上各种AI技术得以完美体现
D.春晚燃放的烟花涉及焰色试验,它的原理是电子由激发态跃迁到基态时,向外释放能量
2.表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2L中含有的分子数为
B.和充分反应转移电子数为
C.加热条件下71g与足量的铁充分反应,转移电子数为
D.的溶液,含有数目为
3.W、X、Y、Z为原子序数依次增大的短周期主族元素。W和X的单质常温下均为气体,W和X的最外层电子数之和等于Z的最外层电子数;Z的原子序数是Y的原子序数的2倍,Y原子的2p轨道有4个电子。下列叙述正确的是
A.原子半径: B.第一电离能:
C.W、X、Y形成的化合物只含共价键 D.最简单氢化物的键角:
4.下列有关实验装置能够正确完成对应实验的是
检验铜与浓硫酸反应产生的 中和热的测定
A B
氨气的尾气吸收 制备氢氧化铁胶体
C D
A.A B.B C.C D.D
5.下列方程式书写正确的是
A.硫酸与氢氧化钡溶液混合:
B.小苏打和的反应:
C.通入漂白粉溶液中:
D.氯化铝溶液中加入过量的氨水:
6.下列图示或说法正确的是
A.碳的基态原子轨道表示式:
B.中,硫原子采用杂化,离子呈正四面体结构
C.在中,给出孤对电子,提供空轨道
D.冰最多含氢键
7.下列关于有机物的说法不正确的是
A.和互为同系物
B.4-甲基-2-己醇的键线式为:
C.分子式为的同分异构体有4种
D.的核磁共振氢谱有2组峰
8.2023年5月30日,“神舟十六号”载人飞船的成功发射,离不开化学材料的助力。高分子的组成和结构特点决定了高分子的性质,是确定高分子材料合成方法及应用领域的基础。下列关于下图说法错误的是
A.丁腈橡胶没有固定的熔点
B.丁腈橡胶的单体为丙烯腈()和1,3-丁二烯
C.此酚醛树脂受热不能熔融,可用于生产烹饪器具的手柄
D.涤纶吸湿性差的原因是亲水性基团较少
9.下列事实能说明苯酚中羟基活化了苯环的是
A.与丙醇相比,苯酚能与反应
B.与丙烷相比,苯酚能与发生加成反应
C.与丙醇相比,苯酚在水中的溶解度小(常温下)
D.与苯相比,苯酚更易与浓溴水发生取代反应
10.漆油是怒江传统饮食文化中的重要组成部分,如怒江特色——漆油鸡。漆油主要营养成份有漆树苷、不饱和脂肪酸等。漆树苷的结构简式如图所示,下列说法不正确的是
A.该有机物能发生取代反应、加成反应、氧化反应、消去反应
B.该有机物中含有羟基、酯基、醚键、碳碳双键
C.该有机物与浓溴水发生取代反应时最多消耗
D.该有机物与烧碱溶液反应时最多消耗
11.2022年3月,我国科学家在实验室实现到淀粉的全合成,其合成路线如图:
下列有关说法正确的是
A.淀粉酿酒过程中涉及的反应均为水解反应
B.DHA不能使酸性高锰酸钾溶液褪色
C.甲醛与足量银氨溶液发生反应,生成的单质与甲醛的物质的量之比为4:1
D.为加快反应③速率,可采用高温环境进行反应
12.下列实验操作和现象以及所得到的结论均正确的是
选项 实验操作和现象 结论
A 将红热木炭加入浓硝酸中,产生红棕色气体 加热条件下,浓硝酸能氧化碳单质
B 向某溶液中滴加盐酸酸化的溶液,产生白色沉淀 该溶液中一定含有
C 向盛有溶液的试管中滴加几滴氨水,得到深蓝色的透明溶液 和氨水生成了
D 取溶液于试管中,加入溶液,充分反应后滴入5滴15%溶液,溶液变红 与的反应有一定限度
A.A B.B C.C D.D
13.2023年星恒电源发布“超钠F1”开启钠电在电动车上产业化元年。如图“超钠F1”二次电池的工作原理是,在充、放电过程中,在两个电极之间往返嵌入和脱嵌。下列说法错误的是
A.放电时,a极电势高于b极电势
B.放电时,正极的电极反应式为
C.充电时,从阴极脱嵌,嵌入阳极
D.钠离子电池能量密度(单位质量电池所放出的能量)小于锂离子电池
14.室温时,向的HA、HB溶液中分别滴加溶液,其pH变化分别对应图中的Ⅰ、Ⅱ。下列说法不正确的是
A.向溶液中滴加HA溶液可产生HB
B.
C.滴加溶液至时,两种溶液中
D.滴加溶液时,Ⅱ中的电离程度大于Ⅰ中
二、解答题
15.二氧化锰广泛用于生产碱性电池。某化工厂综合利用废铁屑、软锰矿(主要含,还含有少量以及镁、铝、铁的氧化物)回收,工艺流程如图所示:
已知常温下,各物质的溶度积如下表所示:
物质
请回答下列问题:
(1)“酸浸”时为了加快酸浸的速率,可以采取的措施是 (至少回答两点)。
(2)酸浸过程中,铁屑被稀硫酸溶解后将还原为。写出该过程第二步的离子方程式: 。
(3)加过氧化氢的目的是 (用一个离子方程式解释)。
(4)当离子浓度时,可视为沉淀完全,则“除铁铝”时应控制 (小数点后保留两位数字)。
(5)写出“转化”时发生的离子方程式: 。
(6)写出基态锰的价电子排布式: 。
(7)氟化钙的晶胞结构如图所示,若晶体密度为,用表示阿伏加德罗常数的值,则晶胞的边长为 cm(用含a、的代数式表示)。
16.2020年9月中国明确提出2030年“碳达峰”与2060年“碳中和”目标,为此科研工作者经过了不懈的努力,研究出了甲醇化的技术,反应方程式如下:
阅读材料回答下列问题:
恒容密闭容器中投入和,在不同条件下达到平衡。设体系中甲醇的物质的量分数为,在下的、在下的如图所示:
(1)写出该反应的平衡常数表达式 。
(2)下列不能说明该反应达平衡的是 (填序号)。
a.单位时间内断裂个碳氧双键,同时形成个氢氢键
b.密度不再改变
c.混合气体压强不变
d.不变
(3)曲线 (填“a”或“b”)代表下的。
(4)该反应正反应为放热反应,理由是 。
(5)下列措施既能加快反应速率,又能提高的是 (填序号)。
a.升高温度 b.分离出水蒸气
c.温度不变缩小容器体积 d.增大的浓度
e.使用催化剂
(6)计算在250℃,下达平衡后,的转化率= 。(保留三位有效数字)
(7)甲醇应用前景广泛,可用于燃料电池。写出甲醇燃料电池在碱性环境下负极发生的电极反应: 。
17.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,俗称“香蕉油”,可用作食品、化妆品香精。实验室制备乙酸异戊酯的反应原理为:
有关数据如下表:
有机物 相对分子质量 密度/() 沸点/℃ 水中溶解性
异戊醇 88 0.8123 131 微溶
乙酸 60 1.0492 118 溶
乙酸异戊酯 130 0.8670 142 难溶
实验步骤:向如图所示的仪器A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。按图示安装带分水器的回流反应装置,并在分水器中预先加入水,使液面略低于分水器的支管口,通入冷凝水,缓慢加热A至130℃,回流1小时。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变。反应液冷却至室温后倒入分液漏斗中,依次用少量水、饱和碳酸钠溶液和水洗涤。分离出的产物加入少量无水固体,静置片刻,过滤除去固体,进行蒸馏纯化,收集140~143℃馏分,得到乙酸异戊酯4.2g。
请回答下列问题:
(1)仪器A的名称是 。
(2)若实验过程中发现忘记加碎瓷片,应进行的操作是 。
(3)洗涤操作中有2次水洗,第一次水洗的作用是 。
(4)分水器中的液体分为两层,上层液体的主要成分为 (填物质名称),结合平衡移动原理解释使用分水器不断分离除去水的目的: 。
(5)实验开始前在分水器中预先加入水,并使液面略低于分水器的支管口,实验过程中保持分水器中水层液面的高度不变,这样做的目的是 。
(6)在制备中会有副反应发生,可能的有机副产物是二异戊醚、 (填写结构简式)。乙酸异戊酯的产率是 (保留3位有效数字)。
18.阿佐塞米(化合物L)是一种可用于治疗心脏、肝脏和肾脏病引起的水肿的药物。L的一种合成路线如图(部分试剂和条件略去)。
已知:①苯胺易被氧化;
②;
③属于邻、对位定位基;属于间位定位基。
回答下列问题:
(1)A→B的反应类型为 ,H中碳原子的杂化方式为 。
(2)C的结构简式为 。
(3)F转化为G后新增官能团名称为 。
(4)由H和I反应生成J的化学方程式为 。
(5)具有相同官能团的B的芳香同分异构体还有 种(不考虑立体异构,填序号)。
a.10 b.12 c.14 d.16
其中核磁共振氢谱显示4组峰,且峰面积比为2:2:1:1的同分异构体结构简式为 。
(6)以为原料合成,设计合成路线 (其他试剂任选)。
参考答案
1.D
2.C
3.B
4.A
5.D
6.B
7.A
8.C
9.D
10.B
11.C
12.D
13.C
14.C
15.(1)适当增大硫酸浓度、搅拌、将反应物粉碎
(2)
(3)
(4)4.67
(5)
(6)
(7)
16.(1)
(2)a b
(3)a
(4)当压强保持不变时,随温度的升高,减小,说明升高温度平衡逆向移动,正反应是放热反应
(5)c
(6)14.8%
(7)
17.(1)三颈烧瓶
(2)停止加热,冷却后补加
(3)除去大部分的乙酸、硫酸
(4) 异戊醇 及时除去反应生成的水,使平衡向生成乙酸异戊酯的方向移动,有利于提高产率
(5)使异戊醇流回三颈烧瓶中,提高原料的利用率
(6) 64.6%
18.(1) 取代反应 sp、
(2)
(3)酰胺基
(4)
(5) d
(6)
同课章节目录
