江苏省2024-2025学年高二下学期期末迎考化学试卷(无答案)
文档属性
| 名称 | 江苏省2024-2025学年高二下学期期末迎考化学试卷(无答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 311.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-16 00:00:00 | ||
图片预览


文档简介
绝密★启用前 B卷
江苏省2024~2025学年高二下学期期末迎考卷
化 学
注意事项:
1. 本试卷100分,考试用时75分钟。
2. 答题前,考生务必将班级、姓名、学号写在密封线内。
可能用到的相对原子质量: H—1 C—12 N—14 O—16 Mn—55 Fe—56
一、 单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项最符合题意。
1. 美国于2025年4月2号对我国加征34%的关税,但对部分中国产品如:电脑、手机豁免关税。电脑、手机中含有的芯片中的主要成分为 ( )
A. O B. Si C. SiO2 D. Fe
2. 实验室利用反应2CoCl2+10NH3+2NH4Cl+H2O22[Co(NH3)6]Cl3+2H2O制备三氯化六氨合钴。下列有关说法正确的是 ( )
A. Cl-的结构示意图为 B. H2O2分子中含离子键
C. [Co(NH3)6]Cl3中Co元素的化合价为+3 D. NH3的空间结构为平面三角形
3. 某化学兴趣小组进行SO2相关实验。下列实验装置和操作能达到实验目的的是 ( )
甲 乙 丙 丁
A. 用装置甲制备SO2气体 B. 用装置乙干燥SO2气体
C. 用装置丙验证SO2是酸性氧化物 D. 用装置丁吸收SO2气体
4. 硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]又称莫尔盐,可作为基准物质,用于标定高锰酸钾、重铬酸钾等溶液的浓度。下列说法正确的是 ( )
A. 半径:r(N3-)>r(O2-) B. 电负性:χ(S)>χ(O)
C. 沸点:H2S>H2O D. 第一电离能:I1(N)阅读下列材料,完成5~7题:
地壳中的硫黄矿、硫铁矿和煤等都含有硫元素,这些矿物通过风化分解、燃烧、火山爆发等方式释放出SO2、H2S等气体,这些气体有些进入大气,有些转化为亚硫酸盐、硫酸盐溶入河流或海洋,还有些被土壤中的硫化细菌催化吸收。大气中的SO2还可以被刺槐、臭椿、法国梧桐、榆树、银杏、夹竹桃等植物吸收,而水体中的含硫化合物可被浮游植物吸收。
5. 已知反应:2SO2(g)+O2(g)2SO3(g) ΔH。下列说法正确的是 ( )
A. 该反应的ΔH>0 B. 该反应的平衡常数K=
C. 提高的值,可增大SO2的平衡转化率 D. 使用合适的催化剂可降低反应的焓变
6. 下列化学反应表示正确的是 ( )
A. 单质硫与铁反应:2Fe+3SFe2S3
B. 过量的SO2通入氨水中:SO2+NH3·H2ON+HS
C. 用FeS除去溶液中的CuSO4:Cu2++S2-CuS↓
D. 向NaHSO3溶液中滴入稀硫酸:S+2H+SO2↑+H2O
7. 下列说法正确的是 ( )
A. 自然界硫循环中均发生氧化还原反应
B. S、S中S原子均为sp2杂化
C. H2S氧化为S时,H2S断裂σ键和π键
D. 如图所示,Cu2S晶胞中硫原子的配位数为8
8. 微酸性次氯酸水广泛应用于果蔬、医疗器械等的消毒,具有安全环保的特点。市面上出现一种家用电解装置制备微酸性次氯酸水的电解设备(装置如图所示)。电解过程中,下列说法正确的是( )
A. 电极N上发生还原反应
B. a、b均为阳离子交换膜
C. 电极M的电极反应式:2H++2e-H2↑
D. 反应中每生成1 mol HClO,转移电子数约为2×6.02×1023
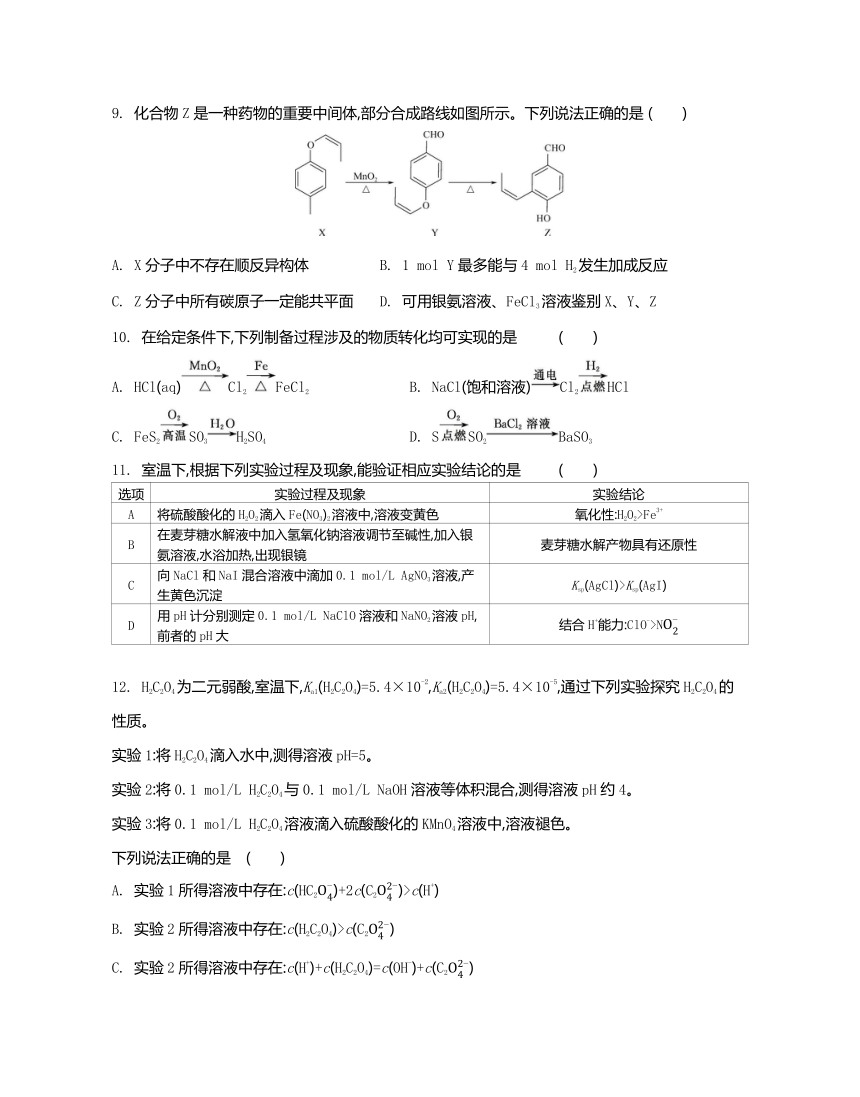
9. 化合物Z是一种药物的重要中间体,部分合成路线如图所示。下列说法正确的是 ( )
A. X分子中不存在顺反异构体 B. 1 mol Y最多能与4 mol H2发生加成反应
C. Z分子中所有碳原子一定能共平面 D. 可用银氨溶液、FeCl3溶液鉴别X、Y、Z
10. 在给定条件下,下列制备过程涉及的物质转化均可实现的是 ( )
A. HCl(aq)Cl2FeCl2 B. NaCl(饱和溶液)Cl2HCl
C. FeS2SO3H2SO4 D. SSO2BaSO3
11. 室温下,根据下列实验过程及现象,能验证相应实验结论的是 ( )
选项 实验过程及现象 实验结论
A 将硫酸酸化的H2O2滴入Fe(NO3)2溶液中,溶液变黄色 氧化性:H2O2>Fe3+
B 在麦芽糖水解液中加入氢氧化钠溶液调节至碱性,加入银氨溶液,水浴加热,出现银镜 麦芽糖水解产物具有还原性
C 向NaCl和NaI混合溶液中滴加0.1 mol/L AgNO3溶液,产生黄色沉淀 Ksp(AgCl)>Ksp(AgI)
D 用pH计分别测定0.1 mol/L NaClO溶液和NaNO2溶液pH,前者的pH大 结合H+能力:ClO->N
12. H2C2O4为二元弱酸,室温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,通过下列实验探究H2C2O4的性质。
实验1:将H2C2O4滴入水中,测得溶液pH=5。
实验2:将0.1 mol/L H2C2O4与0.1 mol/L NaOH溶液等体积混合,测得溶液pH约4。
实验3:将0.1 mol/L H2C2O4溶液滴入硫酸酸化的KMnO4溶液中,溶液褪色。
下列说法正确的是 ( )
A. 实验1所得溶液中存在:c(HC2)+2c(C2)>c(H+)
B. 实验2所得溶液中存在:c(H2C2O4)>c(C2)
C. 实验2所得溶液中存在:c(H+)+c(H2C2O4)=c(OH-)+c(C2)
D. 实验3发生反应的离子方程式:2Mn+5C2+16H+2Mn2++10CO2↑+8H2O
13. CO2催化加氢合成二甲醚可减小温室效应,发生的主要反应如下:
反应Ⅰ. 2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH1=-122.5 kJ/mol
反应Ⅱ. CO2(g)+H2(g)CO(g)+H2O(g) ΔH2
在恒压、n始(CO2)∶n始(H2)=1∶3时,若仅考虑上述反应,平衡时CO2的转化率,CH3OCH3和CO的选择性随温度的变化如图中实线所示。CH3OCH3的选择性=×100%。下列说法正确的是 ( )
A. ΔH2<0
B. 图中曲线b表示平衡时CO选择性随温度的变化
C. 平衡时H2转化率随温度的变化可能如图中虚线所示
D. 高温下使用对反应Ⅰ选择性高的催化剂可提高CH3OCH3的平衡产率
二、 非选择题:共4题,共61分。
14. (15分)一种以软锰矿(主要含MnO2和少量Fe2O3、MgO、CaCO3、SiO2等)和黄铁矿(主要成分为FeS2和少量FeS)为原料制备Mn3O4的流程如图所示:
(1) 酸浸。将软锰矿、黄铁矿与H2SO4溶液混合搅拌,反应过程中铁元素的变化为FeS2Fe2+Fe3+。90 ℃下酸浸,锰元素浸出率及Fe3+、Fe2+的ρ(质量浓度)随时间的变化如图所示。
①FeS被MnO2氧化为S2、Fe3+,FeS和MnO2发生反应的离子方程式为 。
②0~20 min内,ρ(Fe2+)逐渐增大的原因是 。
③80~100 min后,ρ(Fe2+)迅速增大的原因是 。
(2) 除铁。向“酸浸”所得浸出液中加入过量H2O2,调节溶液pH,充分反应后过滤。H2O2的实际用量比理论计算用量大很多,其原因是 。
(3) 制Mn3O4。“除钙、镁”溶液的pH不能太小,否则钙、镁离子的去除率降低,其原因是 。
静置后的滤液中= [已知:Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]。
(4) 测Mn3O4样品纯度。称取1.050 g样品于锥形瓶中,加入25.00 mL 0.200 0 mol/L Na2C2O4溶液和适量稀硫酸,加热。待固体完全溶解后,冷却,用0.010 00 mol/L K2Cr2O7溶液滴定过量的Na2C2O4,消耗K2Cr2O7溶液20.00 mL。不考虑杂质反应,计算样品中Mn3O4的纯度(写出计算过程)。
已知:C2+Mn3O4+H+CO2+Mn2++H2O,C2+Cr2+H+CO2+Cr3++H2O(均未配平)。
15. (15分)有机物H是合成一种降血压药的中间体,其部分合成路线如下:
(1) B分子中的含氧官能团名称为 。
(2) G→H的反应需经历G→X→H的过程,中间体X的分子式为C20H24N2O3。则X→H的反应类型为 。
(3) F的分子式是C10H14O4,其结构简式为 。
(4) C的一种同分异构体同时满足下列条件,其结构简式为 。
碱性条件下水解后酸化,生成X和Y两种有机产物。X分子中有2种不同化学环境的氢原子,能与NaHCO3反应放出气体;Y分子中含有3种不同化学环境的氢原子,Y能与FeCl3溶液发生显色反应。
(5) 已知:。写出以、CH3OH和CH3ONa为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
16. (16分)过氧化钙、过氧化铜可用作化工生产的氧化剂和催化剂。
Ⅰ. 过氧化钙的制备。过氧化钙(CaO2)在室温下稳定。微溶于水,可溶于稀酸生成过氧化氢。实验室制备过氧化钙的流程如图所示:
(1) “抽滤”后得到的滤液的主要成分为 (填化学式)。
(2) “沉淀”反应的离子方程式为 。
(3) CaO2·8H2O转化为CaO2,烘干时需控温135~145 ℃的原因是 。
Ⅱ. 过氧化铜的制备。反应[Cu(NH3)4]2++H2O2+2H2OCuO2↓+2N+2NH3·H2O、Cu(OH)2+H2O2CuO2+2H2O均可用于制备黄褐色固体CuO2。实验装置与实验用到的试剂如图所示。已知:CuO2受热易分解。
(4) [Cu(NH3)4]SO4的制备:向0.5 mol/L CuSO4溶液中滴入0.5 mol/L氨水,写出过程中蓝色沉淀转化为深蓝色溶液的离子方程式: 。
(5) 将三颈烧瓶置于冰水浴的原因为 。
(6) 补充完整由CuCl2制备过氧化铜的实验步骤:5 mL含PVP(稳定剂)的0.01 mmol/L CuCl2水溶液中, ,过滤、洗涤、晾干、称重(须选试剂:0.03 mol/L NaOH溶液、3% H2O2溶液)。
17. (15分)电催化还原CO2是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
(1) 一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示。
图1 图2
①生成CH3CH2OH的电极反应式为 。
②为减少b电极上副产品H2的产生,可采取的措施为 。
③控制电压为1.0 V,电解时转移电子的物质的量为 mol。
(2) 一种铜基复合电极材料Au/Cu2O的制备方法:将一定量Cu2O分散至水与乙醇的混合溶液中,向溶液中逐滴滴加HAuCl4(一种强酸)溶液,搅拌一段时间后离心分离,得Au/Cu2O,溶液变为蓝色。写出该反应的离子方程式: 。
(3) 金属Cu/La复合电极材料电催化还原CO2制备甲醛和乙醇的可能机理如图3所示。研究表明,在不同电极材料上CO2的转化率与温度的关系如图4所示。
图3 图4
①图3中虚线框内X的结构为 。
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原CO2的优点是 。
江苏省2024~2025学年高二下学期期末迎考卷
化 学
注意事项:
1. 本试卷100分,考试用时75分钟。
2. 答题前,考生务必将班级、姓名、学号写在密封线内。
可能用到的相对原子质量: H—1 C—12 N—14 O—16 Mn—55 Fe—56
一、 单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项最符合题意。
1. 美国于2025年4月2号对我国加征34%的关税,但对部分中国产品如:电脑、手机豁免关税。电脑、手机中含有的芯片中的主要成分为 ( )
A. O B. Si C. SiO2 D. Fe
2. 实验室利用反应2CoCl2+10NH3+2NH4Cl+H2O22[Co(NH3)6]Cl3+2H2O制备三氯化六氨合钴。下列有关说法正确的是 ( )
A. Cl-的结构示意图为 B. H2O2分子中含离子键
C. [Co(NH3)6]Cl3中Co元素的化合价为+3 D. NH3的空间结构为平面三角形
3. 某化学兴趣小组进行SO2相关实验。下列实验装置和操作能达到实验目的的是 ( )
甲 乙 丙 丁
A. 用装置甲制备SO2气体 B. 用装置乙干燥SO2气体
C. 用装置丙验证SO2是酸性氧化物 D. 用装置丁吸收SO2气体
4. 硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]又称莫尔盐,可作为基准物质,用于标定高锰酸钾、重铬酸钾等溶液的浓度。下列说法正确的是 ( )
A. 半径:r(N3-)>r(O2-) B. 电负性:χ(S)>χ(O)
C. 沸点:H2S>H2O D. 第一电离能:I1(N)
地壳中的硫黄矿、硫铁矿和煤等都含有硫元素,这些矿物通过风化分解、燃烧、火山爆发等方式释放出SO2、H2S等气体,这些气体有些进入大气,有些转化为亚硫酸盐、硫酸盐溶入河流或海洋,还有些被土壤中的硫化细菌催化吸收。大气中的SO2还可以被刺槐、臭椿、法国梧桐、榆树、银杏、夹竹桃等植物吸收,而水体中的含硫化合物可被浮游植物吸收。
5. 已知反应:2SO2(g)+O2(g)2SO3(g) ΔH。下列说法正确的是 ( )
A. 该反应的ΔH>0 B. 该反应的平衡常数K=
C. 提高的值,可增大SO2的平衡转化率 D. 使用合适的催化剂可降低反应的焓变
6. 下列化学反应表示正确的是 ( )
A. 单质硫与铁反应:2Fe+3SFe2S3
B. 过量的SO2通入氨水中:SO2+NH3·H2ON+HS
C. 用FeS除去溶液中的CuSO4:Cu2++S2-CuS↓
D. 向NaHSO3溶液中滴入稀硫酸:S+2H+SO2↑+H2O
7. 下列说法正确的是 ( )
A. 自然界硫循环中均发生氧化还原反应
B. S、S中S原子均为sp2杂化
C. H2S氧化为S时,H2S断裂σ键和π键
D. 如图所示,Cu2S晶胞中硫原子的配位数为8
8. 微酸性次氯酸水广泛应用于果蔬、医疗器械等的消毒,具有安全环保的特点。市面上出现一种家用电解装置制备微酸性次氯酸水的电解设备(装置如图所示)。电解过程中,下列说法正确的是( )
A. 电极N上发生还原反应
B. a、b均为阳离子交换膜
C. 电极M的电极反应式:2H++2e-H2↑
D. 反应中每生成1 mol HClO,转移电子数约为2×6.02×1023
9. 化合物Z是一种药物的重要中间体,部分合成路线如图所示。下列说法正确的是 ( )
A. X分子中不存在顺反异构体 B. 1 mol Y最多能与4 mol H2发生加成反应
C. Z分子中所有碳原子一定能共平面 D. 可用银氨溶液、FeCl3溶液鉴别X、Y、Z
10. 在给定条件下,下列制备过程涉及的物质转化均可实现的是 ( )
A. HCl(aq)Cl2FeCl2 B. NaCl(饱和溶液)Cl2HCl
C. FeS2SO3H2SO4 D. SSO2BaSO3
11. 室温下,根据下列实验过程及现象,能验证相应实验结论的是 ( )
选项 实验过程及现象 实验结论
A 将硫酸酸化的H2O2滴入Fe(NO3)2溶液中,溶液变黄色 氧化性:H2O2>Fe3+
B 在麦芽糖水解液中加入氢氧化钠溶液调节至碱性,加入银氨溶液,水浴加热,出现银镜 麦芽糖水解产物具有还原性
C 向NaCl和NaI混合溶液中滴加0.1 mol/L AgNO3溶液,产生黄色沉淀 Ksp(AgCl)>Ksp(AgI)
D 用pH计分别测定0.1 mol/L NaClO溶液和NaNO2溶液pH,前者的pH大 结合H+能力:ClO->N
12. H2C2O4为二元弱酸,室温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,通过下列实验探究H2C2O4的性质。
实验1:将H2C2O4滴入水中,测得溶液pH=5。
实验2:将0.1 mol/L H2C2O4与0.1 mol/L NaOH溶液等体积混合,测得溶液pH约4。
实验3:将0.1 mol/L H2C2O4溶液滴入硫酸酸化的KMnO4溶液中,溶液褪色。
下列说法正确的是 ( )
A. 实验1所得溶液中存在:c(HC2)+2c(C2)>c(H+)
B. 实验2所得溶液中存在:c(H2C2O4)>c(C2)
C. 实验2所得溶液中存在:c(H+)+c(H2C2O4)=c(OH-)+c(C2)
D. 实验3发生反应的离子方程式:2Mn+5C2+16H+2Mn2++10CO2↑+8H2O
13. CO2催化加氢合成二甲醚可减小温室效应,发生的主要反应如下:
反应Ⅰ. 2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH1=-122.5 kJ/mol
反应Ⅱ. CO2(g)+H2(g)CO(g)+H2O(g) ΔH2
在恒压、n始(CO2)∶n始(H2)=1∶3时,若仅考虑上述反应,平衡时CO2的转化率,CH3OCH3和CO的选择性随温度的变化如图中实线所示。CH3OCH3的选择性=×100%。下列说法正确的是 ( )
A. ΔH2<0
B. 图中曲线b表示平衡时CO选择性随温度的变化
C. 平衡时H2转化率随温度的变化可能如图中虚线所示
D. 高温下使用对反应Ⅰ选择性高的催化剂可提高CH3OCH3的平衡产率
二、 非选择题:共4题,共61分。
14. (15分)一种以软锰矿(主要含MnO2和少量Fe2O3、MgO、CaCO3、SiO2等)和黄铁矿(主要成分为FeS2和少量FeS)为原料制备Mn3O4的流程如图所示:
(1) 酸浸。将软锰矿、黄铁矿与H2SO4溶液混合搅拌,反应过程中铁元素的变化为FeS2Fe2+Fe3+。90 ℃下酸浸,锰元素浸出率及Fe3+、Fe2+的ρ(质量浓度)随时间的变化如图所示。
①FeS被MnO2氧化为S2、Fe3+,FeS和MnO2发生反应的离子方程式为 。
②0~20 min内,ρ(Fe2+)逐渐增大的原因是 。
③80~100 min后,ρ(Fe2+)迅速增大的原因是 。
(2) 除铁。向“酸浸”所得浸出液中加入过量H2O2,调节溶液pH,充分反应后过滤。H2O2的实际用量比理论计算用量大很多,其原因是 。
(3) 制Mn3O4。“除钙、镁”溶液的pH不能太小,否则钙、镁离子的去除率降低,其原因是 。
静置后的滤液中= [已知:Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]。
(4) 测Mn3O4样品纯度。称取1.050 g样品于锥形瓶中,加入25.00 mL 0.200 0 mol/L Na2C2O4溶液和适量稀硫酸,加热。待固体完全溶解后,冷却,用0.010 00 mol/L K2Cr2O7溶液滴定过量的Na2C2O4,消耗K2Cr2O7溶液20.00 mL。不考虑杂质反应,计算样品中Mn3O4的纯度(写出计算过程)。
已知:C2+Mn3O4+H+CO2+Mn2++H2O,C2+Cr2+H+CO2+Cr3++H2O(均未配平)。
15. (15分)有机物H是合成一种降血压药的中间体,其部分合成路线如下:
(1) B分子中的含氧官能团名称为 。
(2) G→H的反应需经历G→X→H的过程,中间体X的分子式为C20H24N2O3。则X→H的反应类型为 。
(3) F的分子式是C10H14O4,其结构简式为 。
(4) C的一种同分异构体同时满足下列条件,其结构简式为 。
碱性条件下水解后酸化,生成X和Y两种有机产物。X分子中有2种不同化学环境的氢原子,能与NaHCO3反应放出气体;Y分子中含有3种不同化学环境的氢原子,Y能与FeCl3溶液发生显色反应。
(5) 已知:。写出以、CH3OH和CH3ONa为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
16. (16分)过氧化钙、过氧化铜可用作化工生产的氧化剂和催化剂。
Ⅰ. 过氧化钙的制备。过氧化钙(CaO2)在室温下稳定。微溶于水,可溶于稀酸生成过氧化氢。实验室制备过氧化钙的流程如图所示:
(1) “抽滤”后得到的滤液的主要成分为 (填化学式)。
(2) “沉淀”反应的离子方程式为 。
(3) CaO2·8H2O转化为CaO2,烘干时需控温135~145 ℃的原因是 。
Ⅱ. 过氧化铜的制备。反应[Cu(NH3)4]2++H2O2+2H2OCuO2↓+2N+2NH3·H2O、Cu(OH)2+H2O2CuO2+2H2O均可用于制备黄褐色固体CuO2。实验装置与实验用到的试剂如图所示。已知:CuO2受热易分解。
(4) [Cu(NH3)4]SO4的制备:向0.5 mol/L CuSO4溶液中滴入0.5 mol/L氨水,写出过程中蓝色沉淀转化为深蓝色溶液的离子方程式: 。
(5) 将三颈烧瓶置于冰水浴的原因为 。
(6) 补充完整由CuCl2制备过氧化铜的实验步骤:5 mL含PVP(稳定剂)的0.01 mmol/L CuCl2水溶液中, ,过滤、洗涤、晾干、称重(须选试剂:0.03 mol/L NaOH溶液、3% H2O2溶液)。
17. (15分)电催化还原CO2是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
(1) 一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示。
图1 图2
①生成CH3CH2OH的电极反应式为 。
②为减少b电极上副产品H2的产生,可采取的措施为 。
③控制电压为1.0 V,电解时转移电子的物质的量为 mol。
(2) 一种铜基复合电极材料Au/Cu2O的制备方法:将一定量Cu2O分散至水与乙醇的混合溶液中,向溶液中逐滴滴加HAuCl4(一种强酸)溶液,搅拌一段时间后离心分离,得Au/Cu2O,溶液变为蓝色。写出该反应的离子方程式: 。
(3) 金属Cu/La复合电极材料电催化还原CO2制备甲醛和乙醇的可能机理如图3所示。研究表明,在不同电极材料上CO2的转化率与温度的关系如图4所示。
图3 图4
①图3中虚线框内X的结构为 。
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原CO2的优点是 。
同课章节目录
