湖南省常德市汉寿县第一中学2023-2024学年高一下学期7月期末考试化学试卷(含答案)
文档属性
| 名称 | 湖南省常德市汉寿县第一中学2023-2024学年高一下学期7月期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 493.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-17 00:11:59 | ||
图片预览


文档简介
湖南省常德市汉寿县第一中学2023-2024学年高一下学期7月期末考试化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关化学反应的叙述正确的是
A.室温下,在空气中反应生成
B.室温下,与浓溶液反应生成
C.与反应生成
D.与浓反应放出
2.下列关于有机物的化学用语正确的是
A.甲烷的球棍模型 B.羟基的电子式
C.一氯甲烷的电子式为 D.乙烯的结构简式:
3.下列有关有机物的叙述正确的是
A.乙醇()与乙二醇()互为同系物
B.植物油氢化后得人造奶油,人造奶油可以使溴水褪色
C.沸点:新戊烷>异戊烷>丙烷
D.利用油脂在碱性条件下的水解,可以制得肥皂和甘油
4.每年10月23日被誉为“摩尔日”。设NA为阿伏加德罗常数的值,下列说法正确的是
A.将1.7gNH3溶于1L水,形成的溶液中NH3·H2O和的数目之和为0.1NA
B.SiO2与足量的焦炭反应,生成1mol气体时转移的电子数为2NA
C.标准状况下,22.4L己烷中含非极性键的数目为5NA
D.加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数等于0.1NA
5.下列反应对应的离子方程式正确的是
A.84消毒液与洁厕灵混用产生有毒气体:
B.实验室用氨水与氯化铝溶液反应制取:
C.用浓氯化铁溶液制作印刷电路板:
D.用醋酸溶液去除水垢:
6.利用铜-铈氧化物(,Ce是活泼金属)催化氧化除去H2中少量CO的机理如图所示。下列说法错误的是
A.若用参与反应,一段时间后,可能出现在铜-铈氧化物中
B.反应i涉及极性共价键的生成,并且该反应释放能量
C.气体和气体的总能量高于气体的总能量
D.该反应的总反应为
7.莽草酸可用于合成药物达菲,其结构简式如图。下列关于莽草酸的说法正确的是
A.莽草酸分子式为C7H10O
B.莽草酸分子中含有两种官能团
C.一定条件下莽草酸可发生取代、加成、氧化反应
D.1mol莽草酸最多能和4mol NaOH发生中和反应
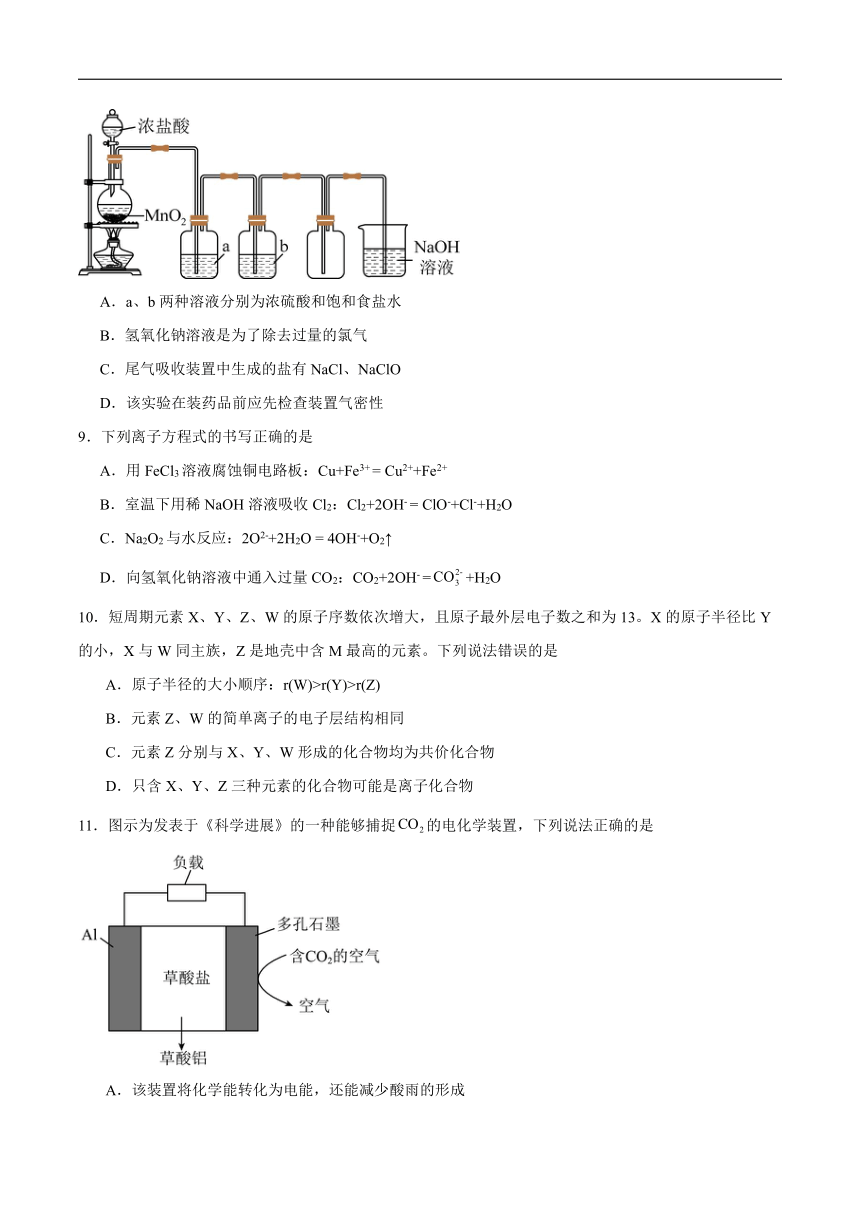
8.实验室制备氯气的转置如图所示,有关实验操作或叙述错误的是
A.a、b两种溶液分别为浓硫酸和饱和食盐水
B.氢氧化钠溶液是为了除去过量的氯气
C.尾气吸收装置中生成的盐有NaCl、NaClO
D.该实验在装药品前应先检查装置气密性
9.下列离子方程式的书写正确的是
A.用FeCl3溶液腐蚀铜电路板:Cu+Fe3+ = Cu2++Fe2+
B.室温下用稀NaOH溶液吸收Cl2:Cl2+2OH- = ClO-+Cl-+H2O
C.Na2O2与水反应:2O2-+2H2O = 4OH-+O2↑
D.向氢氧化钠溶液中通入过量CO2:CO2+2OH- =+H2O
10.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含M最高的元素。下列说法错误的是
A.原子半径的大小顺序:r(W)>r(Y)>r(Z)
B.元素Z、W的简单离子的电子层结构相同
C.元素Z分别与X、Y、W形成的化合物均为共价化合物
D.只含X、Y、Z三种元素的化合物可能是离子化合物
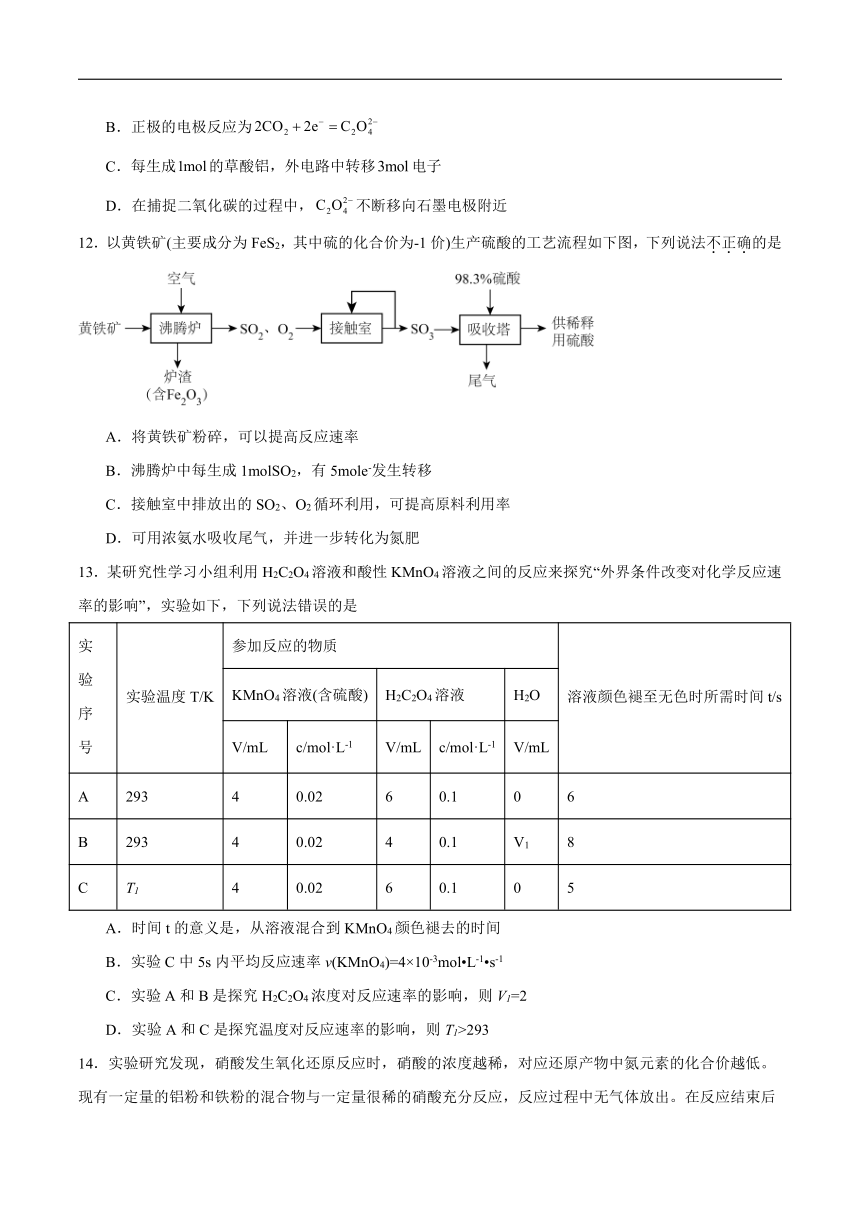
11.图示为发表于《科学进展》的一种能够捕捉的电化学装置,下列说法正确的是
A.该装置将化学能转化为电能,还能减少酸雨的形成
B.正极的电极反应为
C.每生成的草酸铝,外电路中转移电子
D.在捕捉二氧化碳的过程中,不断移向石墨电极附近
12.以黄铁矿(主要成分为FeS2,其中硫的化合价为-1价)生产硫酸的工艺流程如下图,下列说法不正确的是
A.将黄铁矿粉碎,可以提高反应速率
B.沸腾炉中每生成1molSO2,有5mole-发生转移
C.接触室中排放出的SO2、O2循环利用,可提高原料利用率
D.可用浓氨水吸收尾气,并进一步转化为氮肥
13.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下,下列说法错误的是
实验 序号 实验温度T/K 参加反应的物质 溶液颜色褪至无色时所需时间t/s
KMnO4溶液(含硫酸) H2C2O4溶液 H2O
V/mL c/mol·L-1 V/mL c/mol·L-1 V/mL
A 293 4 0.02 6 0.1 0 6
B 293 4 0.02 4 0.1 V1 8
C T1 4 0.02 6 0.1 0 5
A.时间t的意义是,从溶液混合到KMnO4颜色褪去的时间
B.实验C中5s内平均反应速率v(KMnO4)=4×10-3mol L-1 s-1
C.实验A和B是探究H2C2O4浓度对反应速率的影响,则V1=2
D.实验A和C是探究温度对反应速率的影响,则T1>293
14.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5 mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.图中C点对应溶液体积为48 mL
C.原硝酸溶液中含硝酸的物质的量为0.5 mol
D.样品中铝粉和铁粉的物质的量之比5∶3
二、解答题
15.(1)烃是一类重要的有机化合物,其结构与性质密切相关。
①下列有机化合物与甲烷互为同系物的是 (填字母)。
a.乙烯 b.乙烷 c.乙炔
②下列试剂可用于鉴别乙烷和乙烯的是 (填字母)。
a.水 b.四氯化碳 c.酸性KMnO4溶液
③下列有机化合物易溶于水的是 。
a..苯 b.乙烷 c.乙醇
(2) CH2=CH2、 、CH3CH2OH、CH3COOCH2CH3、CH3COOH、葡萄糖,其中:
①能通过化学反应使溴水褪色的是 。
②能发生水解反应的是 。
③能与新制Cu(OH)2悬浊液反应生成砖红色沉淀的是 。
④能与Na2CO3溶液反应有气体生成的是 。
(3)以淀粉为主要原料合成一种具有果香味的物质C合成路线如图所示。
请回答下列问题:
(i) A的结构简式为 ,B分子中的官能团名称为 。
(ii)上述①~⑤的反应中,属于取代反应的有 。(填序号)
(iii) 写出下列转化的化学方程式:
反应① ;
反应⑤ ;
(4)乙烯是石油化工的重要基础原料,工业上可由乙烯与水反应制乙醇,该反应类型为 ,其化学方程式为 ;乙烯还可通过加聚反应获得高分子材料聚乙烯,化学方程式为 。
16.2020年11月24日,长征五号运载火箭搭载嫦娥五号成功发射,开启中国探月新篇章。火箭常用的推进剂燃料有偏二甲肼()、肼()煤油等。
(1)用偏二甲肼()作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
①写出该反应的化学方程式: 。
②反应物的总能量 (填“大于”、“小于”或“等于”)生成物的总能量。
(2)肼在碱性环境下可以形成肼一空气燃料电池,肼被氧化为,该电池负极的反应式为 ,每生成要转移电子的物质的量为 。
(3)肼类推进剂在使用过程中要注意进行环境监测以免造成环境污染。臭氧是理想的烟气脱硝试剂,其脱硝反应为,向甲、乙两个体积均为的恒容密闭容器中均充入和,分别在、温度下,经过一段时间后达到平衡。反应过程中随时间变化情况见下表:
0 3 6 12 24 36
甲容器() 0 0.36 0.60 0.80 0.80 0.80
乙容器() 0 0.30 0.50 0.70 0.85 0.85
①根据表格数据分析,该反应温度T1 T2。(填“”、“”或“”,下同)
②甲容器中,内的平均反应速率 。
③乙容器中平衡转化率为 。
④下列叙述能说明该反应达到化学平衡状态的是 。
a.混合气体的平均相对分子质量不变b.
c. 与的转化率之比不变d. 混合气体密度不变
e. 容器内气体的总压强保持不变
(4)航天煤油是石油经过 炼制的。
17.利用化学原理对工厂排放的废水等进行有效检测与合理处理。某工厂处理含+6价铬的污水工艺的流程如下:
(1)请写出N2H4的电子式 。
(2)下列溶液中,可以代替上述流程中N2H4的是 (填选项序号)。
A.FeSO4溶液 B.浓硝酸 C.酸性KMnO4溶液 D.Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为 。
(4)Cr(OH)3的化学性质与A1(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示为 。
(5)实际工业生产中,有时还可采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子(此时氢离子不参与交换)。常温下,将pH=5的废水经过阳离子交换树脂后,测得溶液中Na+比交换前增加了0.046 g·L-1,则该条件下Cr(OH)3的Ksp的值为 。
(6)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①已知含铬废水中存在着平衡,Cr2O和CrO在溶液中可相互转化,请用离子方程式表示它们之间的转化反应 。
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为 。
三、填空题
18.工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
烧瓶中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入白液体至形成一段液柱,若 ,则整个装置气密性良好。装置D的作用是 。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 (填字母代号)。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是 。
湖南省常德市汉寿县第一中学2023-2024学年高一下学期7月期末考试化学试题参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 B D D B A A C A B C
题号 11 12 13 14
答案 B B B B
15. b c c CH2=CH2 CH3COOCH2CH3 葡萄糖 CH3COOH CH3CHO 羧基 ⑤ +nH2O n CH3COOH+C2H5OHCH3COOC2H5+H2O 加成反应 CH2=CH2+H2OCH3CH2OH nCH2=CH2
16. 大于 a e 分馏
17.(1)
(2)AD
(3)2:3
(4)Cr(OH)3+OH-=[Cr(OH)4]-或Cr(OH)3+OH-=Cr- +2H2O
(5)6.7×10-31
(6) Cr2O+OH-=2 CrO+2H+ BaCrO4
18. 液柱高度保持不变 防止倒吸 NaOH 2:1 c 溶液变澄清
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关化学反应的叙述正确的是
A.室温下,在空气中反应生成
B.室温下,与浓溶液反应生成
C.与反应生成
D.与浓反应放出
2.下列关于有机物的化学用语正确的是
A.甲烷的球棍模型 B.羟基的电子式
C.一氯甲烷的电子式为 D.乙烯的结构简式:
3.下列有关有机物的叙述正确的是
A.乙醇()与乙二醇()互为同系物
B.植物油氢化后得人造奶油,人造奶油可以使溴水褪色
C.沸点:新戊烷>异戊烷>丙烷
D.利用油脂在碱性条件下的水解,可以制得肥皂和甘油
4.每年10月23日被誉为“摩尔日”。设NA为阿伏加德罗常数的值,下列说法正确的是
A.将1.7gNH3溶于1L水,形成的溶液中NH3·H2O和的数目之和为0.1NA
B.SiO2与足量的焦炭反应,生成1mol气体时转移的电子数为2NA
C.标准状况下,22.4L己烷中含非极性键的数目为5NA
D.加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数等于0.1NA
5.下列反应对应的离子方程式正确的是
A.84消毒液与洁厕灵混用产生有毒气体:
B.实验室用氨水与氯化铝溶液反应制取:
C.用浓氯化铁溶液制作印刷电路板:
D.用醋酸溶液去除水垢:
6.利用铜-铈氧化物(,Ce是活泼金属)催化氧化除去H2中少量CO的机理如图所示。下列说法错误的是
A.若用参与反应,一段时间后,可能出现在铜-铈氧化物中
B.反应i涉及极性共价键的生成,并且该反应释放能量
C.气体和气体的总能量高于气体的总能量
D.该反应的总反应为
7.莽草酸可用于合成药物达菲,其结构简式如图。下列关于莽草酸的说法正确的是
A.莽草酸分子式为C7H10O
B.莽草酸分子中含有两种官能团
C.一定条件下莽草酸可发生取代、加成、氧化反应
D.1mol莽草酸最多能和4mol NaOH发生中和反应
8.实验室制备氯气的转置如图所示,有关实验操作或叙述错误的是
A.a、b两种溶液分别为浓硫酸和饱和食盐水
B.氢氧化钠溶液是为了除去过量的氯气
C.尾气吸收装置中生成的盐有NaCl、NaClO
D.该实验在装药品前应先检查装置气密性
9.下列离子方程式的书写正确的是
A.用FeCl3溶液腐蚀铜电路板:Cu+Fe3+ = Cu2++Fe2+
B.室温下用稀NaOH溶液吸收Cl2:Cl2+2OH- = ClO-+Cl-+H2O
C.Na2O2与水反应:2O2-+2H2O = 4OH-+O2↑
D.向氢氧化钠溶液中通入过量CO2:CO2+2OH- =+H2O
10.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含M最高的元素。下列说法错误的是
A.原子半径的大小顺序:r(W)>r(Y)>r(Z)
B.元素Z、W的简单离子的电子层结构相同
C.元素Z分别与X、Y、W形成的化合物均为共价化合物
D.只含X、Y、Z三种元素的化合物可能是离子化合物
11.图示为发表于《科学进展》的一种能够捕捉的电化学装置,下列说法正确的是
A.该装置将化学能转化为电能,还能减少酸雨的形成
B.正极的电极反应为
C.每生成的草酸铝,外电路中转移电子
D.在捕捉二氧化碳的过程中,不断移向石墨电极附近
12.以黄铁矿(主要成分为FeS2,其中硫的化合价为-1价)生产硫酸的工艺流程如下图,下列说法不正确的是
A.将黄铁矿粉碎,可以提高反应速率
B.沸腾炉中每生成1molSO2,有5mole-发生转移
C.接触室中排放出的SO2、O2循环利用,可提高原料利用率
D.可用浓氨水吸收尾气,并进一步转化为氮肥
13.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下,下列说法错误的是
实验 序号 实验温度T/K 参加反应的物质 溶液颜色褪至无色时所需时间t/s
KMnO4溶液(含硫酸) H2C2O4溶液 H2O
V/mL c/mol·L-1 V/mL c/mol·L-1 V/mL
A 293 4 0.02 6 0.1 0 6
B 293 4 0.02 4 0.1 V1 8
C T1 4 0.02 6 0.1 0 5
A.时间t的意义是,从溶液混合到KMnO4颜色褪去的时间
B.实验C中5s内平均反应速率v(KMnO4)=4×10-3mol L-1 s-1
C.实验A和B是探究H2C2O4浓度对反应速率的影响,则V1=2
D.实验A和C是探究温度对反应速率的影响,则T1>293
14.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5 mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.图中C点对应溶液体积为48 mL
C.原硝酸溶液中含硝酸的物质的量为0.5 mol
D.样品中铝粉和铁粉的物质的量之比5∶3
二、解答题
15.(1)烃是一类重要的有机化合物,其结构与性质密切相关。
①下列有机化合物与甲烷互为同系物的是 (填字母)。
a.乙烯 b.乙烷 c.乙炔
②下列试剂可用于鉴别乙烷和乙烯的是 (填字母)。
a.水 b.四氯化碳 c.酸性KMnO4溶液
③下列有机化合物易溶于水的是 。
a..苯 b.乙烷 c.乙醇
(2) CH2=CH2、 、CH3CH2OH、CH3COOCH2CH3、CH3COOH、葡萄糖,其中:
①能通过化学反应使溴水褪色的是 。
②能发生水解反应的是 。
③能与新制Cu(OH)2悬浊液反应生成砖红色沉淀的是 。
④能与Na2CO3溶液反应有气体生成的是 。
(3)以淀粉为主要原料合成一种具有果香味的物质C合成路线如图所示。
请回答下列问题:
(i) A的结构简式为 ,B分子中的官能团名称为 。
(ii)上述①~⑤的反应中,属于取代反应的有 。(填序号)
(iii) 写出下列转化的化学方程式:
反应① ;
反应⑤ ;
(4)乙烯是石油化工的重要基础原料,工业上可由乙烯与水反应制乙醇,该反应类型为 ,其化学方程式为 ;乙烯还可通过加聚反应获得高分子材料聚乙烯,化学方程式为 。
16.2020年11月24日,长征五号运载火箭搭载嫦娥五号成功发射,开启中国探月新篇章。火箭常用的推进剂燃料有偏二甲肼()、肼()煤油等。
(1)用偏二甲肼()作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
①写出该反应的化学方程式: 。
②反应物的总能量 (填“大于”、“小于”或“等于”)生成物的总能量。
(2)肼在碱性环境下可以形成肼一空气燃料电池,肼被氧化为,该电池负极的反应式为 ,每生成要转移电子的物质的量为 。
(3)肼类推进剂在使用过程中要注意进行环境监测以免造成环境污染。臭氧是理想的烟气脱硝试剂,其脱硝反应为,向甲、乙两个体积均为的恒容密闭容器中均充入和,分别在、温度下,经过一段时间后达到平衡。反应过程中随时间变化情况见下表:
0 3 6 12 24 36
甲容器() 0 0.36 0.60 0.80 0.80 0.80
乙容器() 0 0.30 0.50 0.70 0.85 0.85
①根据表格数据分析,该反应温度T1 T2。(填“”、“”或“”,下同)
②甲容器中,内的平均反应速率 。
③乙容器中平衡转化率为 。
④下列叙述能说明该反应达到化学平衡状态的是 。
a.混合气体的平均相对分子质量不变b.
c. 与的转化率之比不变d. 混合气体密度不变
e. 容器内气体的总压强保持不变
(4)航天煤油是石油经过 炼制的。
17.利用化学原理对工厂排放的废水等进行有效检测与合理处理。某工厂处理含+6价铬的污水工艺的流程如下:
(1)请写出N2H4的电子式 。
(2)下列溶液中,可以代替上述流程中N2H4的是 (填选项序号)。
A.FeSO4溶液 B.浓硝酸 C.酸性KMnO4溶液 D.Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为 。
(4)Cr(OH)3的化学性质与A1(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示为 。
(5)实际工业生产中,有时还可采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子(此时氢离子不参与交换)。常温下,将pH=5的废水经过阳离子交换树脂后,测得溶液中Na+比交换前增加了0.046 g·L-1,则该条件下Cr(OH)3的Ksp的值为 。
(6)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①已知含铬废水中存在着平衡,Cr2O和CrO在溶液中可相互转化,请用离子方程式表示它们之间的转化反应 。
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为 。
三、填空题
18.工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
烧瓶中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入白液体至形成一段液柱,若 ,则整个装置气密性良好。装置D的作用是 。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 (填字母代号)。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是 。
湖南省常德市汉寿县第一中学2023-2024学年高一下学期7月期末考试化学试题参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 B D D B A A C A B C
题号 11 12 13 14
答案 B B B B
15. b c c CH2=CH2 CH3COOCH2CH3 葡萄糖 CH3COOH CH3CHO 羧基 ⑤ +nH2O n CH3COOH+C2H5OHCH3COOC2H5+H2O 加成反应 CH2=CH2+H2OCH3CH2OH nCH2=CH2
16. 大于 a e 分馏
17.(1)
(2)AD
(3)2:3
(4)Cr(OH)3+OH-=[Cr(OH)4]-或Cr(OH)3+OH-=Cr- +2H2O
(5)6.7×10-31
(6) Cr2O+OH-=2 CrO+2H+ BaCrO4
18. 液柱高度保持不变 防止倒吸 NaOH 2:1 c 溶液变澄清
同课章节目录
