江苏省苏州市八校2024-2025学年高三下学期三模适应性检测化学试卷
文档属性
| 名称 | 江苏省苏州市八校2024-2025学年高三下学期三模适应性检测化学试卷 | 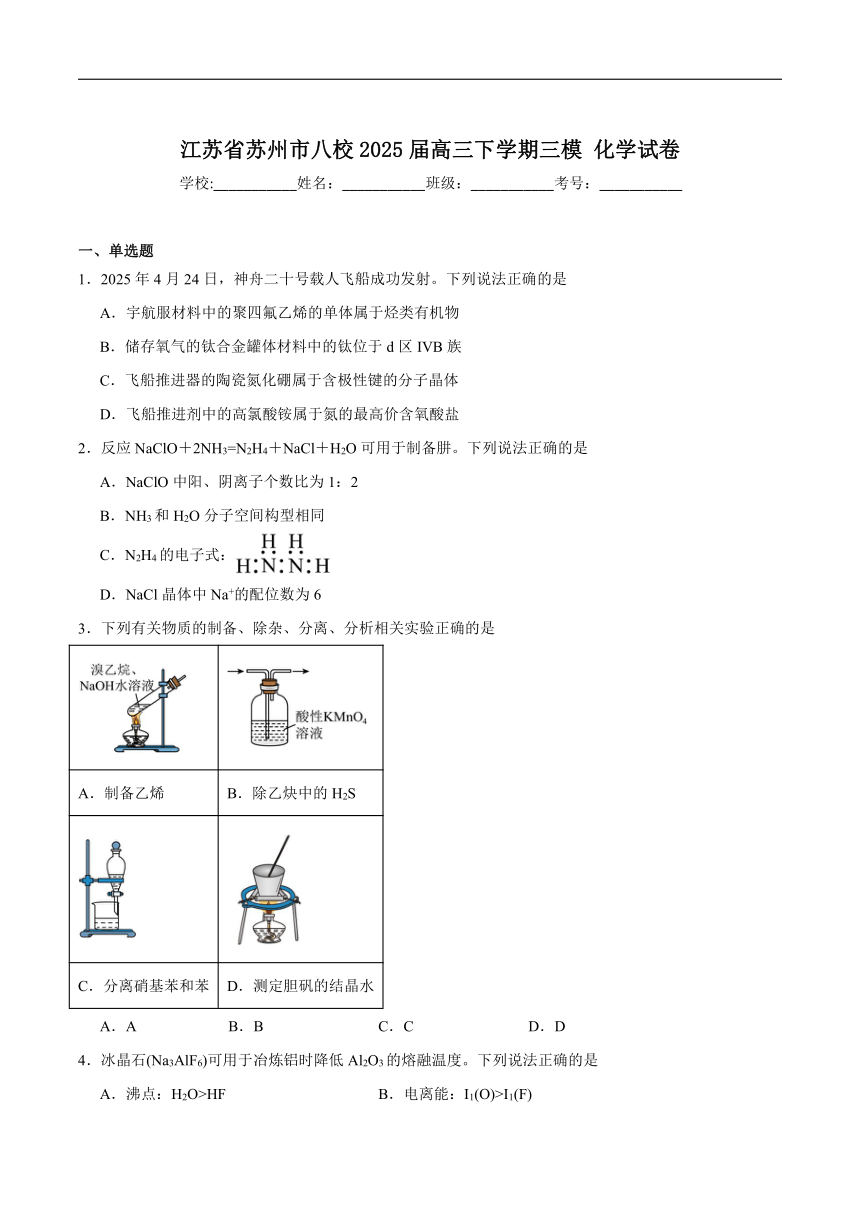 | |
| 格式 | docx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-17 00:14:54 | ||
图片预览




文档简介
江苏省苏州市八校2025届高三下学期三模 化学试卷
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.2025年4月24日,神舟二十号载人飞船成功发射。下列说法正确的是
A.宇航服材料中的聚四氟乙烯的单体属于烃类有机物
B.储存氧气的钛合金罐体材料中的钛位于d区IVB族
C.飞船推进器的陶瓷氮化硼属于含极性键的分子晶体
D.飞船推进剂中的高氯酸铵属于氮的最高价含氧酸盐
2.反应NaClO+2NH3=N2H4+NaCl+H2O可用于制备肼。下列说法正确的是
A.NaClO中阳、阴离子个数比为1:2
B.NH3和H2O分子空间构型相同
C.N2H4的电子式:
D.NaCl晶体中Na+的配位数为6
3.下列有关物质的制备、除杂、分离、分析相关实验正确的是
A.制备乙烯 B.除乙炔中的H2S
C.分离硝基苯和苯 D.测定胆矾的结晶水
A.A B.B C.C D.D
4.冰晶石(Na3AlF6)可用于冶炼铝时降低Al2O3的熔融温度。下列说法正确的是
A.沸点:H2O>HF B.电离能:I1(O)>I1(F)
C.半径:r(Al3+)>r(Na+) D.碱性:Al(OH)3>NaOH
阅读下列材料,完成下面小题。
F2在常温下与Cu反应生成致密的氟化物薄膜,高温时与Na2SO4反应生成硫酰氟(SO2F2)。CaF2与浓硫酸在加热条件下反应可制得HF,常温下测得HF的相对分子质量约为37。SO2通入KClO3酸性溶液中制得黄绿色气体ClO2常用作自来水消毒剂。Cl2和潮湿的Na2CO3反应生成Cl2O。(CN)2具有与卤素单质相似的化学性质。
5.下列说法不正确的是
A.1mol硫酰氟(SO2F2)分子中含4molσ键
B.ClO和Cl2O的中心原子的杂化轨道类型为sp3
C.常温下,氟化氢分子间以配位键结合形成(HF)2
D.(CN)2分子中所有原子最外层均满足8电子结构
6.下列化学反应表示正确的是
A.CaF2与浓硫酸反应:CaF2+H2SO4(浓)CaSO4+2HF↑
B.F2与熔融的Na2SO4反应:F2+Na2SO4=SO2F2+Na2O
C.(CN)2与水反应:(CN)2+H2OH++CN-+HOCN
D.Cl2和潮湿的Na2CO3反应:Cl2++H2O=+Cl-+HClO
7.下列物质性质与用途具有对应关系的是
A.ClO2具有还原性,可用于自来水消毒
B.HF具有弱酸性,可用于蚀刻玻璃
C.SO2具有氧化性,可用于与KClO3反应制ClO2
D.Cu与F2反应生成致密的氟化物薄膜,可用于制作储存F2的容器
8.某无隔膜流动海水电解法制H2的装置如图所示,其中高选择性催化剂PRT可抑制O2产生。下列说法正确的是
A.a是电源的负极
B.电解后海水pH上升
C.理论上转移2mole-生成4gH2
D.阳极发生:Cl-+H2O+2e-=HClO+H+
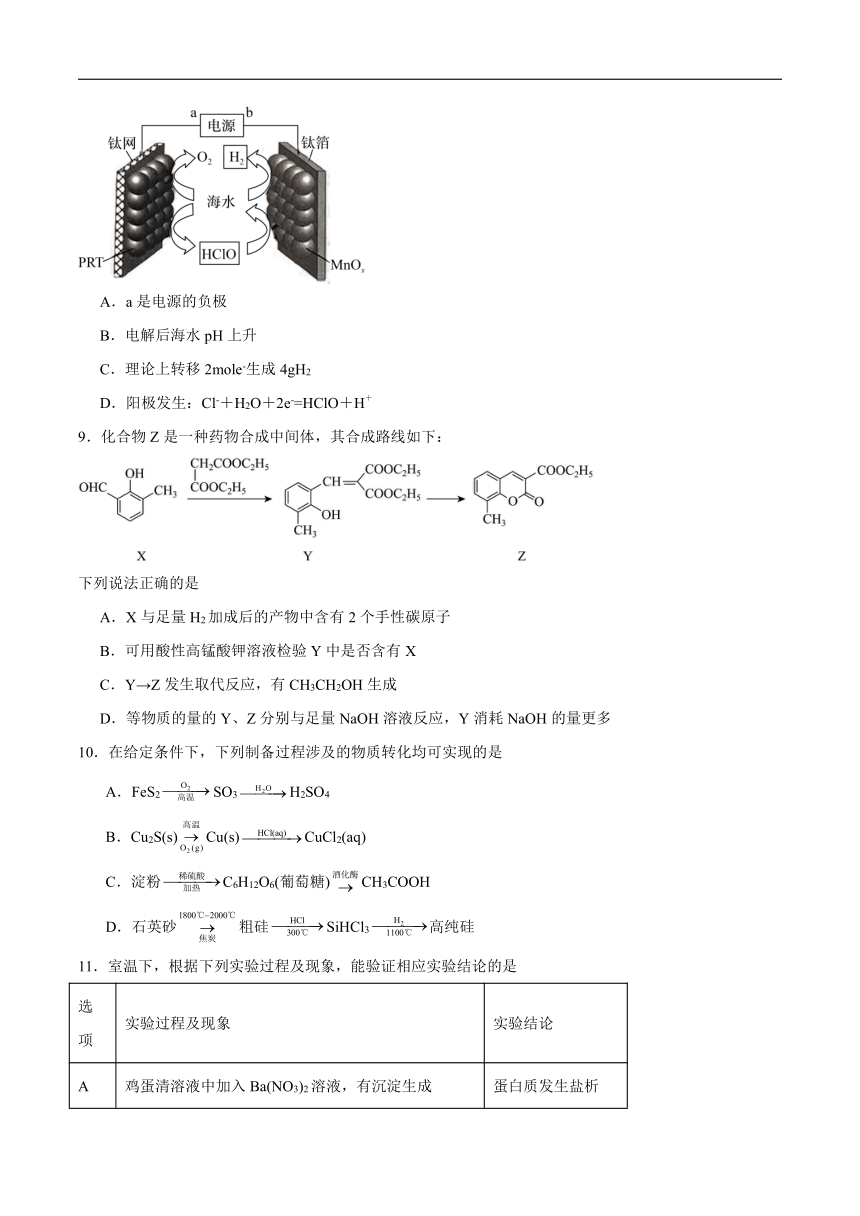
9.化合物Z是一种药物合成中间体,其合成路线如下:
下列说法正确的是
A.X与足量H2加成后的产物中含有2个手性碳原子
B.可用酸性高锰酸钾溶液检验Y中是否含有X
C.Y→Z发生取代反应,有CH3CH2OH生成
D.等物质的量的Y、Z分别与足量NaOH溶液反应,Y消耗NaOH的量更多
10.在给定条件下,下列制备过程涉及的物质转化均可实现的是
A.FeS2SO3H2SO4
B.Cu2S(s)Cu(s)CuCl2(aq)
C.淀粉C6H12O6(葡萄糖)CH3COOH
D.石英砂粗硅SiHCl3高纯硅
11.室温下,根据下列实验过程及现象,能验证相应实验结论的是
选项 实验过程及现象 实验结论
A 鸡蛋清溶液中加入Ba(NO3)2溶液,有沉淀生成 蛋白质发生盐析
B 向盐酸酸化的Fe(NO3)3溶液中加入Cu片,Cu片溶解 氧化性:Fe3+>Cu2+
C 用pH计测量等浓度的CH3COONa和HCOONa溶液的pH,前者大于后者 Kh(CH3COO-)> Kh(HCOO-)
D 取Al与Fe2O3发生铝热反应后的固体,溶于足量稀硫酸,取上层清液,加KSCN溶液后无明显变化,再加入双氧水出现血红色 Fe2O3已完全反应
A.A B.B C.C D.D
12.室温下,通过下列实验探究NaHC2O4的性质。已知:室温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5×10-5,Ksp(CaC2O4)=2.4×10-9。lg2=0.3。
实验1:往20mL0.10mol·L-1NaHC2O4溶液中滴加0.10mol·L-1NaOH溶液。
实验2:往20mL0.10mol·L-1NaHC2O4溶液中滴加0.10mol·L-1CaCl2溶液。
假设溶液混合后体积变化忽略不计。下列说法不正确的是
A.实验1可选用酚酞作指示剂,反应终点为无色变为浅红色
B.实验1中pH=4.3时,溶液中c()C.实验2中V(CaCl2)=10mL时,溶液中c(H+)+c(Na+)>c(Cl-)+c(OH-)
D.实验2中V(CaCl2)=80mL时,溶液中c()约为4.0×10-8mol·L-1
13.甲烷氧化偶联制乙烯过程中的主要反应(忽略其他副反应)为:
①4CH4(g)+O2(g)=2C2H6(g)+2H2O(g) ΔH1=-354kJ·mol-1
②2CH4(g)+O2(g)=C2H4(g)+2H2O(g) ΔH2=-282kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH3=-803kJ·mol-1
将CH4与O2以一定体积比投入反应体系中,维持压强恒定,反应一定时间,测得CH4转化率与C2H6、C2H4、CO2选择性随原料气的n(CH4):n(O2)的变化如图所示。已知:C2H4或C2H6的选择性=×100%。O2的分压p(O2)=p总×,C2H4的生成速率v与O2分压p间的关系为:lgv=lgp+1.1。下列说法不正确的是
A.曲线a表示C2H6选择性随投料比的变化
B.反应④2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g)在任意温度下自发
C.其他条件不变,增大体系压强,产物中H2O的体积分数增大
D.若O2的初始分压为p0,随着反应的进行,当C2H4的生成速率v降低到其初始生成速率v0的时,O2的分压为
二、解答题
14.一种利用铜阳极泥(主要含Cu2Se、Ag2Se等)分离提取铜和硒的流程如下:
已知:①K2S2O82SO +2K+,副反应:SO +SO =S2O
②Ka1(H2SeO3)=3×10-3,Ka2(H2SeO3)=5×10-8
(1)氧化浸取1
控制液固比为20:1,温度为80℃,反应2h,Cu、Se、Ag浸取率随K2S2O8浓度变化如1所示。
①浸取时,SO 将Cu2Se转化为Cu2+和Se.SO 氧化Cu2Se的离子方程式为 。
②当K2S2O8的浓度超过8g·L-1时,Cu元素浸取率迅速下降的原因是 。
(2)氧化浸取2
将H2O2、H2SO4、NaCl溶液按一定比例配成溶液,充分浸泡滤渣,所得滤液中含Se微粒主要为Se(IV)。
①当体系pH=5时,Se(IV)微粒的主要存在形式为 。
②氧化浸取2过程中,随着H2O2量的增加,体系pH明显下降的原因是 。
(3)沉硒
向氧化浸取2的滤液中通入SO2获得单质Se,并测定产品中Se的纯度。
①要获得1molSe理论上需要通入标准状况下SO2的体积为 。
②通过如下步骤测定产品中Se的纯度:取1.6000g产品磨碎,加酸煮沸配成H2SeO3溶液,将溶液转移至250mL容量瓶中。准确量取25.00mL待测液于锥形瓶中,向锥形瓶中加入25.00mL0.0400mol·L-1KMnO4标准溶液,再向锥形瓶中加入0.0500mol·L-1FeSO4标准溶液滴定至紫红色褪去,平行滴定3次,平均消耗FeSO4溶液20.00mL。已知:Se的最高价含氧酸氧化Fe2+速率较慢,滴定过程可忽略此反应。计算产品中Se的纯度 (写出计算过程,计算结果保留两位小数)。
(4)硒氧化铋是一类全新二维半导体芯片材料,硒氧化铋晶胞可以看成带正电的[Bi2O2]层与带负电的[Se]层交替堆叠而成,其结构如图2所示。硒氧化铋的化学式为 。
15.化合物I是一种药物中间体,可由下列路线合成(Ph代表苯基,部分反应条件略去):
已知:RMgX易与含活泼氢化合物(HY)反应:
HY代表H2O、ROH、RNH2、RC≡CH等。
(1)A→B中使用MnO2而不使用KMnO4(H+)的原因是 。
(2)E→F反应中,下列物质不能用作反应溶剂的是 。(填标号)。
a.CH3OCH3 b.CH3CH2OH c. d.CH3COOH
(3)化合物H的分子式为C31H26N2O,则其结构简式为 。
(4)J是相对分子质量比D少14的一种有机物,写出同时满足下列条件的J的一种链状同分异构体的结构简式: 。
①含有1个手性碳原子②含有2个碳碳三键且不含甲基
(5)写出以和CH3Br为原料制备的合成路线流图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) 。
16.利用菱锰矿[主要成分为MnCO3,含CaMg(CO3)2、SiO2等杂质]制备Mn3O4的工艺流程如下:
已知:①MnCO3分解吸热;②锰氨配合物能稳定存在的pH范围为8.2~10.6。
(1)碱浸时,加入质量分数为25%的NaOH溶液并控制温度为85℃。碱浸时发生反应的离子方程式为 。
(2)控制不同温度在N2氛围中焙烧所得产物成分如下表:
温度/℃ 600 700 800
主要成分 MnCO3、CaMg(CO3)2 MnO、CaMg(CO3)2、CaCO3、MgO MnO、CaCO3、MgO
①控制800℃时,CaMg(CO3)2发生反应的化学反应方程式为 。
②在密闭装置中焙烧时,若将N2替换为CO2,MnCO3显著分解的温度从600℃升高至700℃,其原因是 。
(3)浸锰时通常使用氨水-(NH4)2CO3混合溶液,将MnO转化成[Mn(NH3)4]CO3,(NH4)2CO3溶液的作用是 。
(4)沉锰过程中温度对Mn沉淀率和溶液pH的影响如图1所示。随着温度升高,溶液pH降低的原因是 。
(5)制备高纯Mn3O4;已知:①Mn(OH)2比Mn2+更容易被氧化;②体系中不同温度和pH下所得产品的X-射线衍射图(可用于判断某晶态物质是否存在)如图2所示。请补充完整以MnCO3为原料制备Mn3O4的实验方案:将MnCO3固体粉碎, ,干燥[须使用的试剂和仪器:H2SO4溶液、BaCl2溶液、NaOH溶液、O2、水浴锅]。
17.丙烯的制备和应用具有重要意义。
I.丙烯的制备
一种甲烷溴化偶联制丙烯过程中发生的相关反应如下:
反应I:CH4(g)+Br2(g)=CH3Br(g)+HBr(g)
反应Ⅱ:CH3Br(g)+Br2(g)=CH2Br2(g)+HBr(g)
反应Ⅲ:3CH3Br(g)=C3H6(g)+3HBr(g)
(1)将8molCH4和8molBr2通入密闭容器,560℃达平衡时,测得容器中CH4的物质的量为1.6mol、CH3Br的物质的量为5.0mol。此时容器中含碳物质只有CH4、CH3Br和CH2Br2,该温度下反应Ⅱ的平衡常数K= 。
(2)向反应体系中加入少量I2可提高生成CH3Br的选择性。500℃时,分别在有I2和无I2的条件下,将8molCH4和8molBr2,通入密闭容器,溴代甲烷的物质的量随时间的变化关系如图1所示。
①在8~14s之间,有I2和无I2时CH3Br的生成速率之比= 。
②图1中能说明I2提高了CH3Br的选择性的依据是 。
Ⅱ.丙烯的分离
通过C3H8氧化制得的C3H6中通常含有C3H8;由于Cu+的4s轨道与C3H6分子的π键电子形成配位键,通过Cu+修饰的分子筛吸附-脱附可实现C3H6和C3H8混合气的分离。
(3)一定温度和压强下,将C3H6和C3H8等体积混合,以一定流速通过一定质量的Cu+修饰的分子筛,测得两种气体出口浓度(c)与进口浓度(c0)之比随时间变化关系如图2所示。a→b对应的时间段内,C3H8对应的先增大后减小的原因是 。
Ⅲ.丙烯的应用
(4)化合物Z可由丙烯获得,其可能的反应机理如下:
已知:Y→Z过程中,a处碳氧键比b处更易断裂,则Z的结构简式为 。
(5)由丙烯制得的丙烯腈(CH2=CHCN)是一种重要的化工原料。以CH2=CHCN为原料,稀硫酸为电解液,Sn作阴极,通过电解法可制得Sn(CH2CH2CN)4,阴极发生反应的电极方程式为 。
江苏省苏州市八校2025届高三下学期三模 化学试卷参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 B D D A C A D B C D
题号 11 12 13
答案 C B D
14.(1) 4SO +Cu2Se2Cu2++Se+4 SO 比S2O氧化速率更快,K2S2O8浓度超过8g·L-1时,SO 会发生SO +SO =S2O导致浸出速率减慢
(2) HSeO Se被氧化成H2SeO3和H2SeO3被氧化成H2SeO4共同导致溶液酸性增强的影响大于H2O2氧化Ag2Se使酸性减弱的影响
(3) 44.8L 98.75%
(4)Bi2O2Se
15.(1)防止B中的醛基被进一步氧化
(2)bcd
(3)
(4)或
(5)
16.(1)
(2) 将N2替换为CO2,c(CO2)浓度变大,不利于MnCO3的分解,MnCO3分解吸热,温度升高到700℃导致K增大,当Qc(3)(NH4)2CO3能提供铵根离子,促使一水合氨的电离逆向移动,增大溶液中NH3的浓度,且能调节溶液pH在8.2~10.6之间,使锰氨配合物稳定存在
(4)[Mn(NH3)4]CO3分解生成MnCO3和NH3,浓度降低与NH3逸出共同使溶液pH降低
(5)边搅拌边将固体分批加入到H2SO4溶液至不再产生气泡,加入NaOH溶液至生成大量沉淀,用水浴锅控制温度为60℃,持续通入O2,用NaOH溶液调节pH为11,反应一段时间后过滤,用蒸馏水洗涤滤渣至向最后一次洗涤滤液中滴加BaCl2溶液无沉淀
17.(1)10.92
(2) 2:1 5s以后有I2催化的CH2Br2的含量逐渐降低,有I2催化的CH3Br的含量陡然上升
(3)a点后吸附剂不再吸附C3H8,原来被吸附的C3H8被C3H6替代开始脱附,C3H8对应的增大;p点到b点之间,被吸附的C3H8仍在被C3H6替代,由于吸附剂的量一定,速率相对之前有所减小,直至C3H8的浓度减小为原进口浓度(c0)
(4)
(5)Sn+4CH2=CHCN+4e-+4H+=Sn(CH2CH2CN)4
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.2025年4月24日,神舟二十号载人飞船成功发射。下列说法正确的是
A.宇航服材料中的聚四氟乙烯的单体属于烃类有机物
B.储存氧气的钛合金罐体材料中的钛位于d区IVB族
C.飞船推进器的陶瓷氮化硼属于含极性键的分子晶体
D.飞船推进剂中的高氯酸铵属于氮的最高价含氧酸盐
2.反应NaClO+2NH3=N2H4+NaCl+H2O可用于制备肼。下列说法正确的是
A.NaClO中阳、阴离子个数比为1:2
B.NH3和H2O分子空间构型相同
C.N2H4的电子式:
D.NaCl晶体中Na+的配位数为6
3.下列有关物质的制备、除杂、分离、分析相关实验正确的是
A.制备乙烯 B.除乙炔中的H2S
C.分离硝基苯和苯 D.测定胆矾的结晶水
A.A B.B C.C D.D
4.冰晶石(Na3AlF6)可用于冶炼铝时降低Al2O3的熔融温度。下列说法正确的是
A.沸点:H2O>HF B.电离能:I1(O)>I1(F)
C.半径:r(Al3+)>r(Na+) D.碱性:Al(OH)3>NaOH
阅读下列材料,完成下面小题。
F2在常温下与Cu反应生成致密的氟化物薄膜,高温时与Na2SO4反应生成硫酰氟(SO2F2)。CaF2与浓硫酸在加热条件下反应可制得HF,常温下测得HF的相对分子质量约为37。SO2通入KClO3酸性溶液中制得黄绿色气体ClO2常用作自来水消毒剂。Cl2和潮湿的Na2CO3反应生成Cl2O。(CN)2具有与卤素单质相似的化学性质。
5.下列说法不正确的是
A.1mol硫酰氟(SO2F2)分子中含4molσ键
B.ClO和Cl2O的中心原子的杂化轨道类型为sp3
C.常温下,氟化氢分子间以配位键结合形成(HF)2
D.(CN)2分子中所有原子最外层均满足8电子结构
6.下列化学反应表示正确的是
A.CaF2与浓硫酸反应:CaF2+H2SO4(浓)CaSO4+2HF↑
B.F2与熔融的Na2SO4反应:F2+Na2SO4=SO2F2+Na2O
C.(CN)2与水反应:(CN)2+H2OH++CN-+HOCN
D.Cl2和潮湿的Na2CO3反应:Cl2++H2O=+Cl-+HClO
7.下列物质性质与用途具有对应关系的是
A.ClO2具有还原性,可用于自来水消毒
B.HF具有弱酸性,可用于蚀刻玻璃
C.SO2具有氧化性,可用于与KClO3反应制ClO2
D.Cu与F2反应生成致密的氟化物薄膜,可用于制作储存F2的容器
8.某无隔膜流动海水电解法制H2的装置如图所示,其中高选择性催化剂PRT可抑制O2产生。下列说法正确的是
A.a是电源的负极
B.电解后海水pH上升
C.理论上转移2mole-生成4gH2
D.阳极发生:Cl-+H2O+2e-=HClO+H+
9.化合物Z是一种药物合成中间体,其合成路线如下:
下列说法正确的是
A.X与足量H2加成后的产物中含有2个手性碳原子
B.可用酸性高锰酸钾溶液检验Y中是否含有X
C.Y→Z发生取代反应,有CH3CH2OH生成
D.等物质的量的Y、Z分别与足量NaOH溶液反应,Y消耗NaOH的量更多
10.在给定条件下,下列制备过程涉及的物质转化均可实现的是
A.FeS2SO3H2SO4
B.Cu2S(s)Cu(s)CuCl2(aq)
C.淀粉C6H12O6(葡萄糖)CH3COOH
D.石英砂粗硅SiHCl3高纯硅
11.室温下,根据下列实验过程及现象,能验证相应实验结论的是
选项 实验过程及现象 实验结论
A 鸡蛋清溶液中加入Ba(NO3)2溶液,有沉淀生成 蛋白质发生盐析
B 向盐酸酸化的Fe(NO3)3溶液中加入Cu片,Cu片溶解 氧化性:Fe3+>Cu2+
C 用pH计测量等浓度的CH3COONa和HCOONa溶液的pH,前者大于后者 Kh(CH3COO-)> Kh(HCOO-)
D 取Al与Fe2O3发生铝热反应后的固体,溶于足量稀硫酸,取上层清液,加KSCN溶液后无明显变化,再加入双氧水出现血红色 Fe2O3已完全反应
A.A B.B C.C D.D
12.室温下,通过下列实验探究NaHC2O4的性质。已知:室温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5×10-5,Ksp(CaC2O4)=2.4×10-9。lg2=0.3。
实验1:往20mL0.10mol·L-1NaHC2O4溶液中滴加0.10mol·L-1NaOH溶液。
实验2:往20mL0.10mol·L-1NaHC2O4溶液中滴加0.10mol·L-1CaCl2溶液。
假设溶液混合后体积变化忽略不计。下列说法不正确的是
A.实验1可选用酚酞作指示剂,反应终点为无色变为浅红色
B.实验1中pH=4.3时,溶液中c()
D.实验2中V(CaCl2)=80mL时,溶液中c()约为4.0×10-8mol·L-1
13.甲烷氧化偶联制乙烯过程中的主要反应(忽略其他副反应)为:
①4CH4(g)+O2(g)=2C2H6(g)+2H2O(g) ΔH1=-354kJ·mol-1
②2CH4(g)+O2(g)=C2H4(g)+2H2O(g) ΔH2=-282kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH3=-803kJ·mol-1
将CH4与O2以一定体积比投入反应体系中,维持压强恒定,反应一定时间,测得CH4转化率与C2H6、C2H4、CO2选择性随原料气的n(CH4):n(O2)的变化如图所示。已知:C2H4或C2H6的选择性=×100%。O2的分压p(O2)=p总×,C2H4的生成速率v与O2分压p间的关系为:lgv=lgp+1.1。下列说法不正确的是
A.曲线a表示C2H6选择性随投料比的变化
B.反应④2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g)在任意温度下自发
C.其他条件不变,增大体系压强,产物中H2O的体积分数增大
D.若O2的初始分压为p0,随着反应的进行,当C2H4的生成速率v降低到其初始生成速率v0的时,O2的分压为
二、解答题
14.一种利用铜阳极泥(主要含Cu2Se、Ag2Se等)分离提取铜和硒的流程如下:
已知:①K2S2O82SO +2K+,副反应:SO +SO =S2O
②Ka1(H2SeO3)=3×10-3,Ka2(H2SeO3)=5×10-8
(1)氧化浸取1
控制液固比为20:1,温度为80℃,反应2h,Cu、Se、Ag浸取率随K2S2O8浓度变化如1所示。
①浸取时,SO 将Cu2Se转化为Cu2+和Se.SO 氧化Cu2Se的离子方程式为 。
②当K2S2O8的浓度超过8g·L-1时,Cu元素浸取率迅速下降的原因是 。
(2)氧化浸取2
将H2O2、H2SO4、NaCl溶液按一定比例配成溶液,充分浸泡滤渣,所得滤液中含Se微粒主要为Se(IV)。
①当体系pH=5时,Se(IV)微粒的主要存在形式为 。
②氧化浸取2过程中,随着H2O2量的增加,体系pH明显下降的原因是 。
(3)沉硒
向氧化浸取2的滤液中通入SO2获得单质Se,并测定产品中Se的纯度。
①要获得1molSe理论上需要通入标准状况下SO2的体积为 。
②通过如下步骤测定产品中Se的纯度:取1.6000g产品磨碎,加酸煮沸配成H2SeO3溶液,将溶液转移至250mL容量瓶中。准确量取25.00mL待测液于锥形瓶中,向锥形瓶中加入25.00mL0.0400mol·L-1KMnO4标准溶液,再向锥形瓶中加入0.0500mol·L-1FeSO4标准溶液滴定至紫红色褪去,平行滴定3次,平均消耗FeSO4溶液20.00mL。已知:Se的最高价含氧酸氧化Fe2+速率较慢,滴定过程可忽略此反应。计算产品中Se的纯度 (写出计算过程,计算结果保留两位小数)。
(4)硒氧化铋是一类全新二维半导体芯片材料,硒氧化铋晶胞可以看成带正电的[Bi2O2]层与带负电的[Se]层交替堆叠而成,其结构如图2所示。硒氧化铋的化学式为 。
15.化合物I是一种药物中间体,可由下列路线合成(Ph代表苯基,部分反应条件略去):
已知:RMgX易与含活泼氢化合物(HY)反应:
HY代表H2O、ROH、RNH2、RC≡CH等。
(1)A→B中使用MnO2而不使用KMnO4(H+)的原因是 。
(2)E→F反应中,下列物质不能用作反应溶剂的是 。(填标号)。
a.CH3OCH3 b.CH3CH2OH c. d.CH3COOH
(3)化合物H的分子式为C31H26N2O,则其结构简式为 。
(4)J是相对分子质量比D少14的一种有机物,写出同时满足下列条件的J的一种链状同分异构体的结构简式: 。
①含有1个手性碳原子②含有2个碳碳三键且不含甲基
(5)写出以和CH3Br为原料制备的合成路线流图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) 。
16.利用菱锰矿[主要成分为MnCO3,含CaMg(CO3)2、SiO2等杂质]制备Mn3O4的工艺流程如下:
已知:①MnCO3分解吸热;②锰氨配合物能稳定存在的pH范围为8.2~10.6。
(1)碱浸时,加入质量分数为25%的NaOH溶液并控制温度为85℃。碱浸时发生反应的离子方程式为 。
(2)控制不同温度在N2氛围中焙烧所得产物成分如下表:
温度/℃ 600 700 800
主要成分 MnCO3、CaMg(CO3)2 MnO、CaMg(CO3)2、CaCO3、MgO MnO、CaCO3、MgO
①控制800℃时,CaMg(CO3)2发生反应的化学反应方程式为 。
②在密闭装置中焙烧时,若将N2替换为CO2,MnCO3显著分解的温度从600℃升高至700℃,其原因是 。
(3)浸锰时通常使用氨水-(NH4)2CO3混合溶液,将MnO转化成[Mn(NH3)4]CO3,(NH4)2CO3溶液的作用是 。
(4)沉锰过程中温度对Mn沉淀率和溶液pH的影响如图1所示。随着温度升高,溶液pH降低的原因是 。
(5)制备高纯Mn3O4;已知:①Mn(OH)2比Mn2+更容易被氧化;②体系中不同温度和pH下所得产品的X-射线衍射图(可用于判断某晶态物质是否存在)如图2所示。请补充完整以MnCO3为原料制备Mn3O4的实验方案:将MnCO3固体粉碎, ,干燥[须使用的试剂和仪器:H2SO4溶液、BaCl2溶液、NaOH溶液、O2、水浴锅]。
17.丙烯的制备和应用具有重要意义。
I.丙烯的制备
一种甲烷溴化偶联制丙烯过程中发生的相关反应如下:
反应I:CH4(g)+Br2(g)=CH3Br(g)+HBr(g)
反应Ⅱ:CH3Br(g)+Br2(g)=CH2Br2(g)+HBr(g)
反应Ⅲ:3CH3Br(g)=C3H6(g)+3HBr(g)
(1)将8molCH4和8molBr2通入密闭容器,560℃达平衡时,测得容器中CH4的物质的量为1.6mol、CH3Br的物质的量为5.0mol。此时容器中含碳物质只有CH4、CH3Br和CH2Br2,该温度下反应Ⅱ的平衡常数K= 。
(2)向反应体系中加入少量I2可提高生成CH3Br的选择性。500℃时,分别在有I2和无I2的条件下,将8molCH4和8molBr2,通入密闭容器,溴代甲烷的物质的量随时间的变化关系如图1所示。
①在8~14s之间,有I2和无I2时CH3Br的生成速率之比= 。
②图1中能说明I2提高了CH3Br的选择性的依据是 。
Ⅱ.丙烯的分离
通过C3H8氧化制得的C3H6中通常含有C3H8;由于Cu+的4s轨道与C3H6分子的π键电子形成配位键,通过Cu+修饰的分子筛吸附-脱附可实现C3H6和C3H8混合气的分离。
(3)一定温度和压强下,将C3H6和C3H8等体积混合,以一定流速通过一定质量的Cu+修饰的分子筛,测得两种气体出口浓度(c)与进口浓度(c0)之比随时间变化关系如图2所示。a→b对应的时间段内,C3H8对应的先增大后减小的原因是 。
Ⅲ.丙烯的应用
(4)化合物Z可由丙烯获得,其可能的反应机理如下:
已知:Y→Z过程中,a处碳氧键比b处更易断裂,则Z的结构简式为 。
(5)由丙烯制得的丙烯腈(CH2=CHCN)是一种重要的化工原料。以CH2=CHCN为原料,稀硫酸为电解液,Sn作阴极,通过电解法可制得Sn(CH2CH2CN)4,阴极发生反应的电极方程式为 。
江苏省苏州市八校2025届高三下学期三模 化学试卷参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 B D D A C A D B C D
题号 11 12 13
答案 C B D
14.(1) 4SO +Cu2Se2Cu2++Se+4 SO 比S2O氧化速率更快,K2S2O8浓度超过8g·L-1时,SO 会发生SO +SO =S2O导致浸出速率减慢
(2) HSeO Se被氧化成H2SeO3和H2SeO3被氧化成H2SeO4共同导致溶液酸性增强的影响大于H2O2氧化Ag2Se使酸性减弱的影响
(3) 44.8L 98.75%
(4)Bi2O2Se
15.(1)防止B中的醛基被进一步氧化
(2)bcd
(3)
(4)或
(5)
16.(1)
(2) 将N2替换为CO2,c(CO2)浓度变大,不利于MnCO3的分解,MnCO3分解吸热,温度升高到700℃导致K增大,当Qc
(4)[Mn(NH3)4]CO3分解生成MnCO3和NH3,浓度降低与NH3逸出共同使溶液pH降低
(5)边搅拌边将固体分批加入到H2SO4溶液至不再产生气泡,加入NaOH溶液至生成大量沉淀,用水浴锅控制温度为60℃,持续通入O2,用NaOH溶液调节pH为11,反应一段时间后过滤,用蒸馏水洗涤滤渣至向最后一次洗涤滤液中滴加BaCl2溶液无沉淀
17.(1)10.92
(2) 2:1 5s以后有I2催化的CH2Br2的含量逐渐降低,有I2催化的CH3Br的含量陡然上升
(3)a点后吸附剂不再吸附C3H8,原来被吸附的C3H8被C3H6替代开始脱附,C3H8对应的增大;p点到b点之间,被吸附的C3H8仍在被C3H6替代,由于吸附剂的量一定,速率相对之前有所减小,直至C3H8的浓度减小为原进口浓度(c0)
(4)
(5)Sn+4CH2=CHCN+4e-+4H+=Sn(CH2CH2CN)4
同课章节目录
