浙江省北斗星盟2024-2025学年高三下学期适应性考试(三模)化学试卷(含答案
文档属性
| 名称 | 浙江省北斗星盟2024-2025学年高三下学期适应性考试(三模)化学试卷(含答案 |

|
|
| 格式 | docx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-16 00:00:00 | ||
图片预览



文档简介
浙江省北斗星盟2025届高三三模化学试题
一、单选题
1.下列反应的的是
A.铁粉与硫粉反应 B.氯化铵的水解反应
C.软脂酸在人体内的反应 D.双氧水在二氧化锰催化下分解
2.下列关于的说法正确的是
A.可用作电镀铜时的电解液 B.易溶于乙醇
C.能与硫化钠溶液大量共存 D.呈浅蓝色
3.下列化学用语表示正确的是
A.水解的离子反应: B.SO的VSEPR模型:
C.杂化轨道示意图: D.的系统命名:2-羟基丁烷
4.物质的性质决定物质的用途,下列说法不正确的是
A.碳化硅熔点高,故可用作砂纸和砂轮的磨料
B.HF能与反应,故可用氢氟酸溶蚀玻璃生产磨砂玻璃
C.生石灰能与酸性氧化物反应,故煤炭中加入生石灰可减少煤燃烧时产生的
D.过氧乙酸具有强氧化性,故可用来杀菌消毒
5.依据元素周期律下列说法不正确的是
A.元素的电负性: B.碳酸盐的分解温度:
C.氧氢键的极性: D.元素第一电离能:
6.设为阿伏伽德罗常数的值,下列说法正确的是
A.标准状况下,11.2L苯含有的键的数目为
B.含有的离子总数为
C.实验室制时,每生成转移的电子数一定为
D.0.2mol甲酸与0.8mol乙醇在浓硫酸催化下充分反应,生成甲酸乙酯的分子数小于
7.已知甲硅烷能与高锰酸钾溶液发生反应:。下列说法正确的是
A.该反应是在强酸性环境中进行的 B.该反应的现象之一是溶液变成紫红色
C.沸点比低 D.该反应中被还原
8.下列方程式正确的是
A.工业上合成氨:
B.足量酸性高锰酸钾检测空气中的甲醛:
C.用硫化亚铁处理工业废水中的:
D.用白醋除铁锈:
9.关于化学实验和化工生产的安全,下列说法正确的是
A.为加快铁屑在稀硫酸的溶解,采用酒精灯加热比用电热套加热更安全
B.将氨溶于水中制氨水时,为防止倒吸可通过单向阀(如上图)向水中通入氨
C.工业上制HCl是将氯气和氢气混合,在光照条件下发生反应
D.白磷有剧毒,中学化学实验中不可将未用完的白磷放回原试剂瓶
10.某兴趣小组提取玫瑰精油的实验流程如图所示,下列说法不正确的是
已知:玫瑰油中成分有的难溶于水,有的可溶于水;溶于水的成分在无机盐溶液中溶解度小。
A.蒸馏时可能会用到直形冷凝管、温度计、蒸馏烧瓶等玻璃仪器
B.从油水混合物中得到油层可直接分液操作
C.为了提高玫瑰油的产率,需要将玫瑰花瓣捣碎
D.系列操作包括加无水硫酸钠固体干燥、过滤、蒸馏
11.下列说法正确的是
A.相同的条件下,熵值:
B.合成氨反应已达平衡时,分离出氨能使平衡正向移动,反应速率加快,产率增大
C.常温下,向的醋酸溶液中加入盐酸溶液,则醋酸的电离程度减小
D.牺牲阳极法和外加电流法都要采用辅助阳极,辅助阳极发生的电极反应类型不相同
12.以1,2-环氧丙烷和为主要原料生产某种高分子材料的转化原理如下图所示。下列说法不正确的是
A.该转化流程中的两步反应的原子经济性已达最佳
B.甲的同分异构体只有4种(不计立体异构)
C.1mol乙与NaOH溶液反应最多消耗2molNaOH
D.甲、乙、丙三种有机物所含手性碳原子的个数比为1:1:n
13.用惰性电极电解碳酸钠溶液时,阳极无气体产生,但在阳极区检测到新增一种摩尔质量为的含碳元素的带2个单位负电荷的阴离子(碳元素的化合价为+4)。下列叙述正确的是
A.新增的这种阴离子只含有极性键 B.若用铅酸蓄电池作电源,Pb电极与a相接
C.电极B发生的电极反应为 D.其他条件不变,增加电解的电压,阳极区可能产生气体
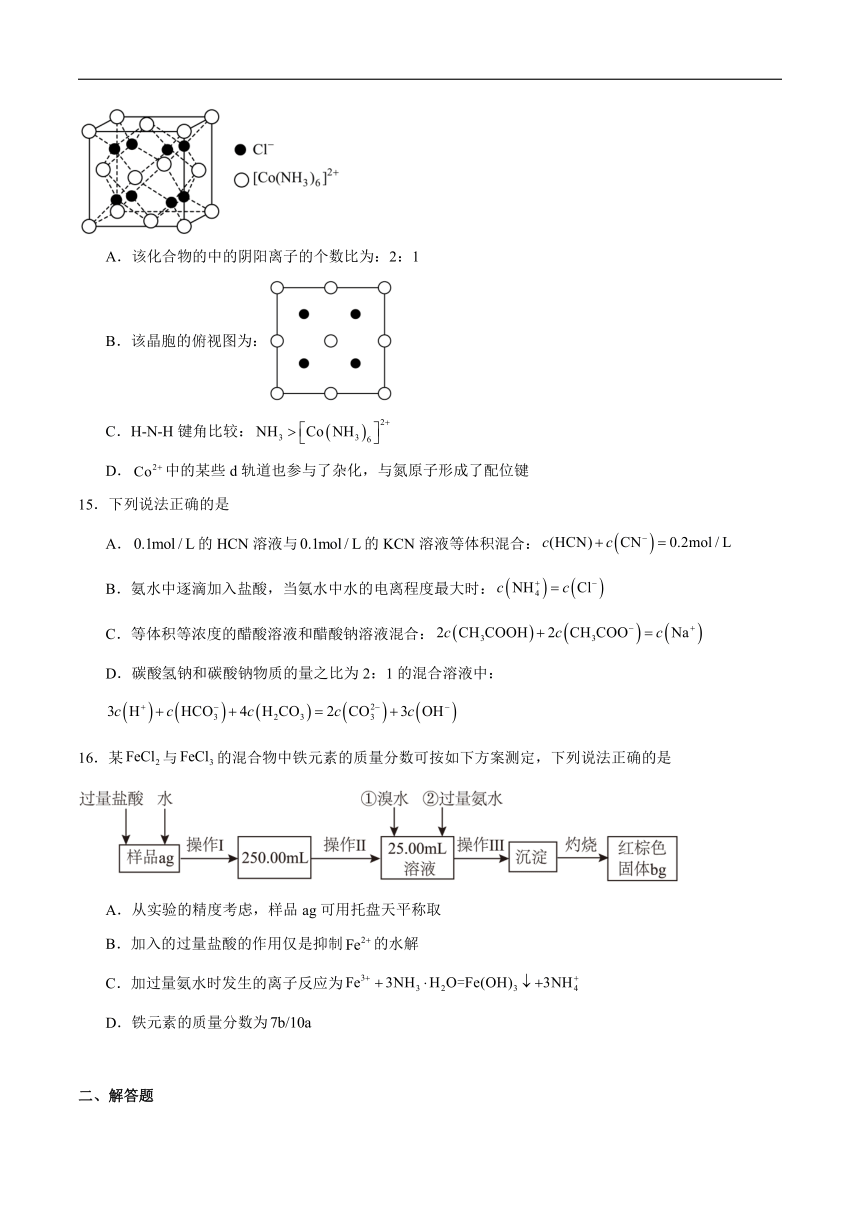
14.某化合物的晶胞如图所示,下列说法不正确的是
A.该化合物的中的阴阳离子的个数比为:2:1
B.该晶胞的俯视图为:
C.H-N-H键角比较:
D.中的某些d轨道也参与了杂化,与氮原子形成了配位键
15.下列说法正确的是
A.的HCN溶液与的KCN溶液等体积混合:
B.氨水中逐滴加入盐酸,当氨水中水的电离程度最大时:
C.等体积等浓度的醋酸溶液和醋酸钠溶液混合:
D.碳酸氢钠和碳酸钠物质的量之比为2:1的混合溶液中:
16.某与的混合物中铁元素的质量分数可按如下方案测定,下列说法正确的是
A.从实验的精度考虑,样品ag可用托盘天平称取
B.加入的过量盐酸的作用仅是抑制的水解
C.加过量氨水时发生的离子反应为
D.铁元素的质量分数为
二、解答题
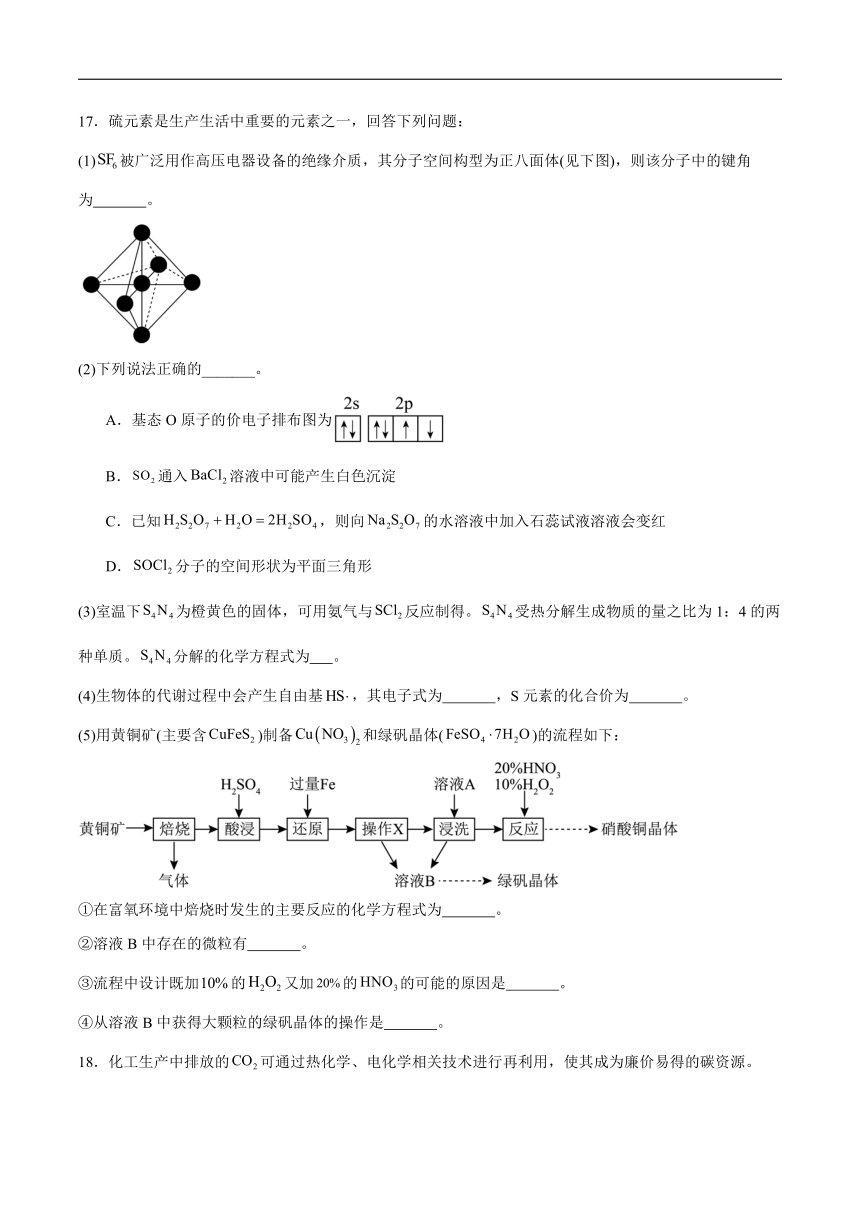
17.硫元素是生产生活中重要的元素之一,回答下列问题:
(1)被广泛用作高压电器设备的绝缘介质,其分子空间构型为正八面体(见下图),则该分子中的键角为 。
(2)下列说法正确的_______。
A.基态O原子的价电子排布图为
B.通入溶液中可能产生白色沉淀
C.已知,则向的水溶液中加入石蕊试液溶液会变红
D.分子的空间形状为平面三角形
(3)室温下为橙黄色的固体,可用氨气与反应制得。受热分解生成物质的量之比为1:4的两种单质。分解的化学方程式为 。
(4)生物体的代谢过程中会产生自由基,其电子式为 ,S元素的化合价为 。
(5)用黄铜矿(主要含)制备和绿矾晶体()的流程如下:
①在富氧环境中焙烧时发生的主要反应的化学方程式为 。
②溶液B中存在的微粒有 。
③流程中设计既加的又加的的可能的原因是 。
④从溶液B中获得大颗粒的绿矾晶体的操作是 。
18.化工生产中排放的可通过热化学、电化学相关技术进行再利用,使其成为廉价易得的碳资源。
已知:I.
Ⅱ.
Ⅲ.
回答下列问题:
(1)若将甲醇设计成如下燃料电池,a、b均为惰性电极,已知a极电势比b极高,则b极的电极反应为 。
(2)的逆反应的活化能为,则正反应活化能为 。
(3)将和按物质的量之比1:3充入恒温恒容密闭容器中,只发生反应I,已知该温度下反应的化学平衡常数。下列事实说明反应正向进行的是_______。
A.气体的密度不变
B.气体的平均摩尔质量变大
C.某时刻容器中,,
D.体系的压强变小
(4)利用作为碳源可以合成丙酸和丙二酸。丙酸的和丙二酸的的大小关系为,理由是 。
(5)一定温度下,在甲、乙两个体积相同的反应容器中分别充入和,发生反应I和Ⅲ,其中一个容器使用水分子膜分离技术,以提高的平衡转化率。实验测得平衡转化率与平衡时压强关系如图所示。(已知:M点甲醇选择性为)
①M点和N点的平衡转化率相等的理由是 。
②该温度下,M点对应的反应Ⅲ平衡常数 。(为用各物质分压表示的平衡常数,分压=总压物质的量分数)
19.是一种微溶于水的浅黄色粉末,其制备的方法之一是用NaClO在强碱性条件下氧化(加热到并保持1h)。某兴趣小组设计如下实验制备铋酸钠(),并测定其纯度。制备实验可能用到的装置图见下。
回答下列问题:
(1)已知a为浓盐酸,则b的化学式可能为 (填两种)。
(2)NaClO在碱性条件下氧化生成的离子方程式为 。
(3)从上面的装置图中,选择合适的装置连接成制备铋酸钠的装置图 。
_____________________
(4)下列说法正确的是 。
A.装置E也常用来除去中的HCl
B.装置C中的NaOH溶液过量时也可能有氯气余下,故实验时也要使用装置F
C.有强氧化性,其一定能氧化
D.与本实验有关的图标为、、、
E.为了控制反应温度,最好用油浴对装置C加热
(5)纯度的测定
①称取制得的铋酸钠样品3.720g,加入足量稀硫酸和足量溶液使其完全反应(溶液呈紫红色,转化为),稀释至100mL,取出20.00mL溶液,然后用溶液进行滴定,消耗溶液。则该样品中纯度为 %。(结果保留两位小数)
②结合上述实验,润洗滴定管的具体操作为 。
20.化合物J是合成某种黄酮类抗菌药物的中间体,其合成路线如下。
已知:①;
②R3-CHO+。
回答下列问题:
(1)C中所含无氧官能团的名称是 。
(2)下列说法正确的是_______。
A.G转化为H的反应类型为还原反应
B.H的分子式为
C.J存在顺反异构体
D.A与足量的氢气加成的产物属于脂肪烃的衍生物
(3)G中除苯环外,无其他环状结构,则G的结构简式为 。
(4)的化学方程式为 。
(5)写出4种满足下列条件的D的同分异构体 。
①红外光谱显示分子中除苯环外,无其他环状结构和碳碳双键,有--原子团
②显示苯环上有2种氢原子
③定量测定表明1mol该物质能与2molNaOH反应
(6)根据以上信息,以和为原料合成,写出合成路线 。(用流程图表示,无机试剂任选)。
参考答案
1.B
2.A
3.C
4.A
5.D
6.D
7.C
8.C
9.B
10.B
11.A
12.B
13.D
14.C
15.D
16.C
17.(1)
(2)BC
(3)
(4) -1
(5) 避免产生氮的氧化物,造成污染 蒸发浓缩、缓慢冷却结晶、过滤、洗涤、干燥
18.(1)
(2)
(3)BD
(4)丙二酸中-COOH使另一个-COOH的O-H键极性增强,酸性增强,易形成离子内氢键,氢离子比丙酸难电离
(5) 减小压强,对反应I平衡左移动,N的压强小,只改变压强时,N点转化率比M点小,但是N点使用了水分子分离膜,会使平衡右移动,转化率增大。在两个因素共同作用下,两点的转化率相等
19.(1)
(2)
(3)
(4)BD
(5) 85.05 从酸式滴定管的上口加入溶液,倾斜着转动滴定管,使溶液润湿滴定管内壁,然后从下口放出,重复次
20.(1)碳溴键
(2)BC
(3)
(4)
(5)、、、
(6)
一、单选题
1.下列反应的的是
A.铁粉与硫粉反应 B.氯化铵的水解反应
C.软脂酸在人体内的反应 D.双氧水在二氧化锰催化下分解
2.下列关于的说法正确的是
A.可用作电镀铜时的电解液 B.易溶于乙醇
C.能与硫化钠溶液大量共存 D.呈浅蓝色
3.下列化学用语表示正确的是
A.水解的离子反应: B.SO的VSEPR模型:
C.杂化轨道示意图: D.的系统命名:2-羟基丁烷
4.物质的性质决定物质的用途,下列说法不正确的是
A.碳化硅熔点高,故可用作砂纸和砂轮的磨料
B.HF能与反应,故可用氢氟酸溶蚀玻璃生产磨砂玻璃
C.生石灰能与酸性氧化物反应,故煤炭中加入生石灰可减少煤燃烧时产生的
D.过氧乙酸具有强氧化性,故可用来杀菌消毒
5.依据元素周期律下列说法不正确的是
A.元素的电负性: B.碳酸盐的分解温度:
C.氧氢键的极性: D.元素第一电离能:
6.设为阿伏伽德罗常数的值,下列说法正确的是
A.标准状况下,11.2L苯含有的键的数目为
B.含有的离子总数为
C.实验室制时,每生成转移的电子数一定为
D.0.2mol甲酸与0.8mol乙醇在浓硫酸催化下充分反应,生成甲酸乙酯的分子数小于
7.已知甲硅烷能与高锰酸钾溶液发生反应:。下列说法正确的是
A.该反应是在强酸性环境中进行的 B.该反应的现象之一是溶液变成紫红色
C.沸点比低 D.该反应中被还原
8.下列方程式正确的是
A.工业上合成氨:
B.足量酸性高锰酸钾检测空气中的甲醛:
C.用硫化亚铁处理工业废水中的:
D.用白醋除铁锈:
9.关于化学实验和化工生产的安全,下列说法正确的是
A.为加快铁屑在稀硫酸的溶解,采用酒精灯加热比用电热套加热更安全
B.将氨溶于水中制氨水时,为防止倒吸可通过单向阀(如上图)向水中通入氨
C.工业上制HCl是将氯气和氢气混合,在光照条件下发生反应
D.白磷有剧毒,中学化学实验中不可将未用完的白磷放回原试剂瓶
10.某兴趣小组提取玫瑰精油的实验流程如图所示,下列说法不正确的是
已知:玫瑰油中成分有的难溶于水,有的可溶于水;溶于水的成分在无机盐溶液中溶解度小。
A.蒸馏时可能会用到直形冷凝管、温度计、蒸馏烧瓶等玻璃仪器
B.从油水混合物中得到油层可直接分液操作
C.为了提高玫瑰油的产率,需要将玫瑰花瓣捣碎
D.系列操作包括加无水硫酸钠固体干燥、过滤、蒸馏
11.下列说法正确的是
A.相同的条件下,熵值:
B.合成氨反应已达平衡时,分离出氨能使平衡正向移动,反应速率加快,产率增大
C.常温下,向的醋酸溶液中加入盐酸溶液,则醋酸的电离程度减小
D.牺牲阳极法和外加电流法都要采用辅助阳极,辅助阳极发生的电极反应类型不相同
12.以1,2-环氧丙烷和为主要原料生产某种高分子材料的转化原理如下图所示。下列说法不正确的是
A.该转化流程中的两步反应的原子经济性已达最佳
B.甲的同分异构体只有4种(不计立体异构)
C.1mol乙与NaOH溶液反应最多消耗2molNaOH
D.甲、乙、丙三种有机物所含手性碳原子的个数比为1:1:n
13.用惰性电极电解碳酸钠溶液时,阳极无气体产生,但在阳极区检测到新增一种摩尔质量为的含碳元素的带2个单位负电荷的阴离子(碳元素的化合价为+4)。下列叙述正确的是
A.新增的这种阴离子只含有极性键 B.若用铅酸蓄电池作电源,Pb电极与a相接
C.电极B发生的电极反应为 D.其他条件不变,增加电解的电压,阳极区可能产生气体
14.某化合物的晶胞如图所示,下列说法不正确的是
A.该化合物的中的阴阳离子的个数比为:2:1
B.该晶胞的俯视图为:
C.H-N-H键角比较:
D.中的某些d轨道也参与了杂化,与氮原子形成了配位键
15.下列说法正确的是
A.的HCN溶液与的KCN溶液等体积混合:
B.氨水中逐滴加入盐酸,当氨水中水的电离程度最大时:
C.等体积等浓度的醋酸溶液和醋酸钠溶液混合:
D.碳酸氢钠和碳酸钠物质的量之比为2:1的混合溶液中:
16.某与的混合物中铁元素的质量分数可按如下方案测定,下列说法正确的是
A.从实验的精度考虑,样品ag可用托盘天平称取
B.加入的过量盐酸的作用仅是抑制的水解
C.加过量氨水时发生的离子反应为
D.铁元素的质量分数为
二、解答题
17.硫元素是生产生活中重要的元素之一,回答下列问题:
(1)被广泛用作高压电器设备的绝缘介质,其分子空间构型为正八面体(见下图),则该分子中的键角为 。
(2)下列说法正确的_______。
A.基态O原子的价电子排布图为
B.通入溶液中可能产生白色沉淀
C.已知,则向的水溶液中加入石蕊试液溶液会变红
D.分子的空间形状为平面三角形
(3)室温下为橙黄色的固体,可用氨气与反应制得。受热分解生成物质的量之比为1:4的两种单质。分解的化学方程式为 。
(4)生物体的代谢过程中会产生自由基,其电子式为 ,S元素的化合价为 。
(5)用黄铜矿(主要含)制备和绿矾晶体()的流程如下:
①在富氧环境中焙烧时发生的主要反应的化学方程式为 。
②溶液B中存在的微粒有 。
③流程中设计既加的又加的的可能的原因是 。
④从溶液B中获得大颗粒的绿矾晶体的操作是 。
18.化工生产中排放的可通过热化学、电化学相关技术进行再利用,使其成为廉价易得的碳资源。
已知:I.
Ⅱ.
Ⅲ.
回答下列问题:
(1)若将甲醇设计成如下燃料电池,a、b均为惰性电极,已知a极电势比b极高,则b极的电极反应为 。
(2)的逆反应的活化能为,则正反应活化能为 。
(3)将和按物质的量之比1:3充入恒温恒容密闭容器中,只发生反应I,已知该温度下反应的化学平衡常数。下列事实说明反应正向进行的是_______。
A.气体的密度不变
B.气体的平均摩尔质量变大
C.某时刻容器中,,
D.体系的压强变小
(4)利用作为碳源可以合成丙酸和丙二酸。丙酸的和丙二酸的的大小关系为,理由是 。
(5)一定温度下,在甲、乙两个体积相同的反应容器中分别充入和,发生反应I和Ⅲ,其中一个容器使用水分子膜分离技术,以提高的平衡转化率。实验测得平衡转化率与平衡时压强关系如图所示。(已知:M点甲醇选择性为)
①M点和N点的平衡转化率相等的理由是 。
②该温度下,M点对应的反应Ⅲ平衡常数 。(为用各物质分压表示的平衡常数,分压=总压物质的量分数)
19.是一种微溶于水的浅黄色粉末,其制备的方法之一是用NaClO在强碱性条件下氧化(加热到并保持1h)。某兴趣小组设计如下实验制备铋酸钠(),并测定其纯度。制备实验可能用到的装置图见下。
回答下列问题:
(1)已知a为浓盐酸,则b的化学式可能为 (填两种)。
(2)NaClO在碱性条件下氧化生成的离子方程式为 。
(3)从上面的装置图中,选择合适的装置连接成制备铋酸钠的装置图 。
_____________________
(4)下列说法正确的是 。
A.装置E也常用来除去中的HCl
B.装置C中的NaOH溶液过量时也可能有氯气余下,故实验时也要使用装置F
C.有强氧化性,其一定能氧化
D.与本实验有关的图标为、、、
E.为了控制反应温度,最好用油浴对装置C加热
(5)纯度的测定
①称取制得的铋酸钠样品3.720g,加入足量稀硫酸和足量溶液使其完全反应(溶液呈紫红色,转化为),稀释至100mL,取出20.00mL溶液,然后用溶液进行滴定,消耗溶液。则该样品中纯度为 %。(结果保留两位小数)
②结合上述实验,润洗滴定管的具体操作为 。
20.化合物J是合成某种黄酮类抗菌药物的中间体,其合成路线如下。
已知:①;
②R3-CHO+。
回答下列问题:
(1)C中所含无氧官能团的名称是 。
(2)下列说法正确的是_______。
A.G转化为H的反应类型为还原反应
B.H的分子式为
C.J存在顺反异构体
D.A与足量的氢气加成的产物属于脂肪烃的衍生物
(3)G中除苯环外,无其他环状结构,则G的结构简式为 。
(4)的化学方程式为 。
(5)写出4种满足下列条件的D的同分异构体 。
①红外光谱显示分子中除苯环外,无其他环状结构和碳碳双键,有--原子团
②显示苯环上有2种氢原子
③定量测定表明1mol该物质能与2molNaOH反应
(6)根据以上信息,以和为原料合成,写出合成路线 。(用流程图表示,无机试剂任选)。
参考答案
1.B
2.A
3.C
4.A
5.D
6.D
7.C
8.C
9.B
10.B
11.A
12.B
13.D
14.C
15.D
16.C
17.(1)
(2)BC
(3)
(4) -1
(5) 避免产生氮的氧化物,造成污染 蒸发浓缩、缓慢冷却结晶、过滤、洗涤、干燥
18.(1)
(2)
(3)BD
(4)丙二酸中-COOH使另一个-COOH的O-H键极性增强,酸性增强,易形成离子内氢键,氢离子比丙酸难电离
(5) 减小压强,对反应I平衡左移动,N的压强小,只改变压强时,N点转化率比M点小,但是N点使用了水分子分离膜,会使平衡右移动,转化率增大。在两个因素共同作用下,两点的转化率相等
19.(1)
(2)
(3)
(4)BD
(5) 85.05 从酸式滴定管的上口加入溶液,倾斜着转动滴定管,使溶液润湿滴定管内壁,然后从下口放出,重复次
20.(1)碳溴键
(2)BC
(3)
(4)
(5)、、、
(6)
同课章节目录
