山东省潍坊市2023-2024学年高一下学期期末考试化学试卷(含答案)
文档属性
| 名称 | 山东省潍坊市2023-2024学年高一下学期期末考试化学试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-17 00:00:00 | ||
图片预览


文档简介
山东省潍坊市2023-2024学年高一下学期期末考试化学试题
一、单选题
1.中华文化源远流长,化学与文化传承密不可分。下列说法错误的是
A.青铜器“越王勾践剑”的主要材质为合金
B.南唐文房三宝之一的“澄心堂纸”主要成分是纤维素
C.非物质文化遗产“皮影戏”中制作皮影的兽皮主要成分是油脂
D.泥土烧制而成的“秦始皇兵马俑”主要成分是硅酸盐
2.下列化学用语或表述正确的是
A.乙烷的比例模型:
B.次氯酸的结构式:
C.水分子的空间结构:直线形
D.中子数为146、质子数为92的铀(U)原子:
3.G是一种常见药物的中间体,结构简式如图所示。下列说法正确的是
A.G的分子式为
B.G的一氯取代物有5种
C.可用酸性高锰酸钾溶液检验G中的碳碳双键
D.1mol G与金属钠反应最多可生成(标准状况)
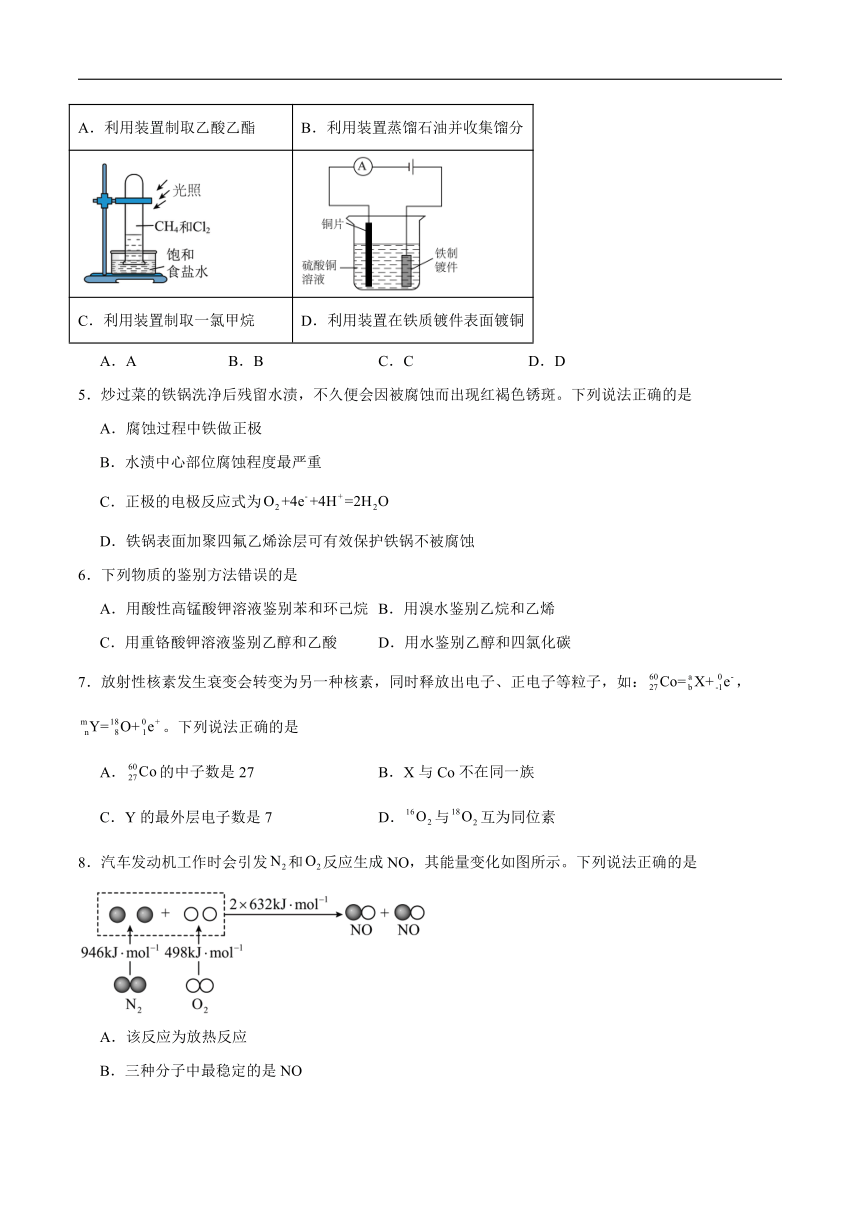
4.利用下列装置能达到实验目的的是
A.利用装置制取乙酸乙酯 B.利用装置蒸馏石油并收集馏分
C.利用装置制取一氯甲烷 D.利用装置在铁质镀件表面镀铜
A.A B.B C.C D.D
5.炒过菜的铁锅洗净后残留水渍,不久便会因被腐蚀而出现红褐色锈斑。下列说法正确的是
A.腐蚀过程中铁做正极
B.水渍中心部位腐蚀程度最严重
C.正极的电极反应式为
D.铁锅表面加聚四氟乙烯涂层可有效保护铁锅不被腐蚀
6.下列物质的鉴别方法错误的是
A.用酸性高锰酸钾溶液鉴别苯和环己烷 B.用溴水鉴别乙烷和乙烯
C.用重铬酸钾溶液鉴别乙醇和乙酸 D.用水鉴别乙醇和四氯化碳
7.放射性核素发生衰变会转变为另一种核素,同时释放出电子、正电子等粒子,如:,。下列说法正确的是
A.的中子数是27 B.X与Co不在同一族
C.Y的最外层电子数是7 D.与互为同位素
8.汽车发动机工作时会引发和反应生成NO,其能量变化如图所示。下列说法正确的是
A.该反应为放热反应
B.三种分子中最稳定的是NO
C.具有的能量为946kJ
D.断裂需吸收的能量是498kJ
9.下列实验操作及结论错误的是
实验 结论
A 室温下,向两支盛有等体积等浓度溶液的试管中,分别加入1mL不同浓度的盐酸,观察产生气泡的快慢 该反应中,其它条件相同时,盐酸浓度越大反应速率越快
B 向量热计中加入的盐酸100mL,匀速搅拌后记录初始温度,迅速加入等浓度等体积的NaOH溶液,记录反应结束温度为 该反应的反应热为:
C 将铁粉与硫粉混合后铺成条状,用灼热的玻璃棒触及一端,混合物红热时移开,反应仍继续进行 该反应为放热反应
D 和中均分别加入NaOH溶液和盐酸,只溶于盐酸,都能溶 Mg的金属性比Al强
A.A B.B C.C D.D
10.制造隐形眼镜的功能高分子M的合成路线如图所示,已知:。下列说法正确的是
A.该路线中发生取代反应的是①②③ B.F与乙醇互为同系物
C.G中所有碳原子在同一平面内 D.H和M具有相同的官能团
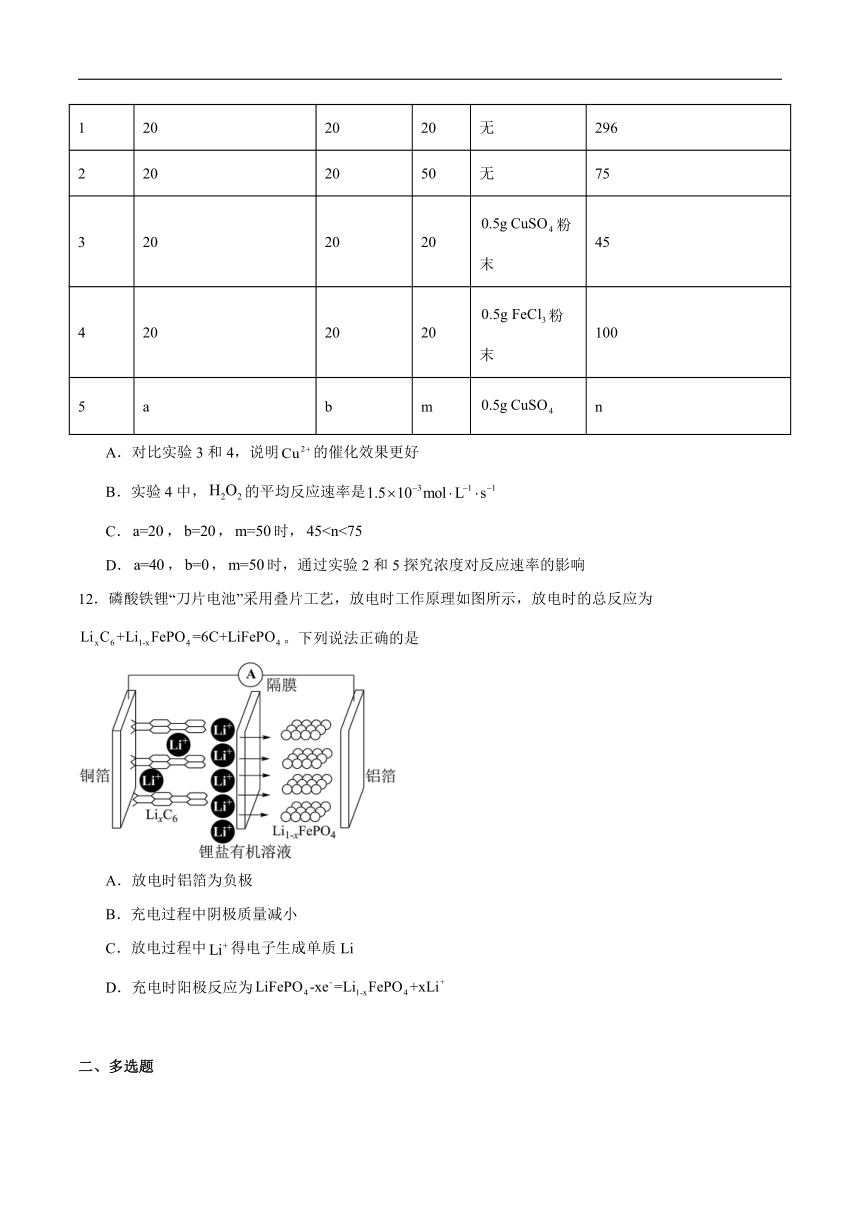
11.某化学兴趣小组探究外界条件对分解速率的影响,忽略过程中溶液体积变化,实验记录如下表。下列说法正确的是
实验序号 溶液体积/mL 加入水体积/mL 温度/℃ 催化剂 收集标准状况所需时间/s
1 20 20 20 无 296
2 20 20 50 无 75
3 20 20 20 粉末 45
4 20 20 20 粉末 100
5 a b m n
A.对比实验3和4,说明的催化效果更好
B.实验4中,的平均反应速率是
C.,,时,
D.,,时,通过实验2和5探究浓度对反应速率的影响
12.磷酸铁锂“刀片电池”采用叠片工艺,放电时工作原理如图所示,放电时的总反应为。下列说法正确的是
A.放电时铝箔为负极
B.充电过程中阴极质量减小
C.放电过程中得电子生成单质Li
D.充电时阳极反应为
二、多选题
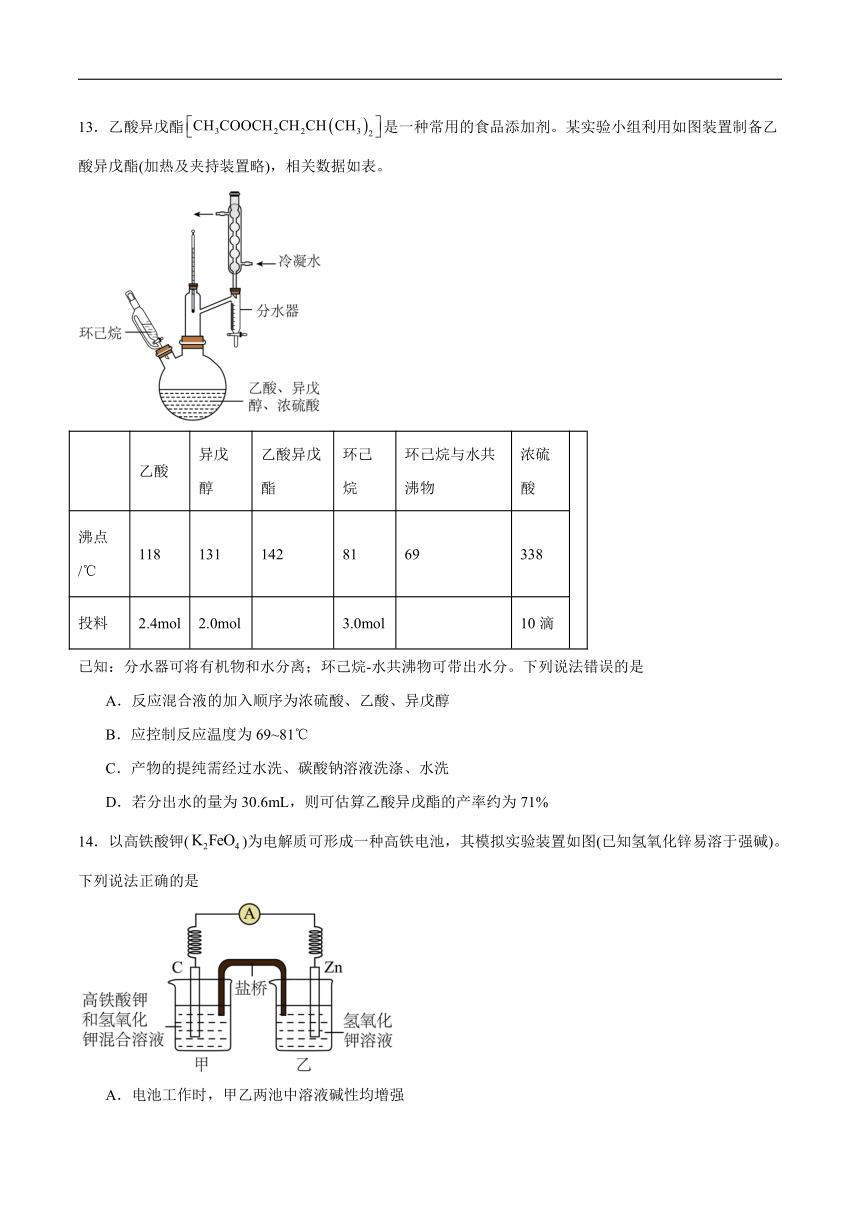
13.乙酸异戊酯是一种常用的食品添加剂。某实验小组利用如图装置制备乙酸异戊酯(加热及夹持装置略),相关数据如表。
乙酸 异戊醇 乙酸异戊酯 环己烷 环己烷与水共沸物 浓硫酸
沸点/℃ 118 131 142 81 69 338
投料 2.4mol 2.0mol 3.0mol 10滴
已知:分水器可将有机物和水分离;环己烷-水共沸物可带出水分。下列说法错误的是
A.反应混合液的加入顺序为浓硫酸、乙酸、异戊醇
B.应控制反应温度为69~81℃
C.产物的提纯需经过水洗、碳酸钠溶液洗涤、水洗
D.若分出水的量为30.6mL,则可估算乙酸异戊酯的产率约为71%
14.以高铁酸钾()为电解质可形成一种高铁电池,其模拟实验装置如图(已知氢氧化锌易溶于强碱)。下列说法正确的是
A.电池工作时,甲乙两池中溶液碱性均增强
B.电池工作时,盐桥中阳离子向甲池移动
C.电路中每转移2mol电子,理论上乙池质量增加65g
D.正极反应为
15.氯化锗用作光导纤维的渗杂剂。实验室模拟以ZnO烟尘(主要成分为、、CaO、FeO)为原料制取氯化锗的流程如图所示(单宁可与生成沉淀)。下列说法错误的是
A.滤渣1的成分为
B.“中和”的目的是除去
C.“灼烧”时需用的硅酸盐仪器有瓷坩埚、泥三角、酒精灯、玻璃棒
D.若用在加热条件下进行“氯化”,方程式为
三、解答题
16.X、Y、Z、W、Q、R为元素周期表中原子序数依次增大的六种短周期主族元素,相关信息如表。
元素编号 元素性质或原子结构
X 元素周期表中原子半径最小的元素
Y 最外层电子数是内层电子数的2倍
Z 简单氢化物能与其最高价氧化物对应的水化物反应生成盐
W 与X同主族
Q 单质是一种淡黄色固体
回答下列问题:
(1)R的简单阴离子结构示意图为 ;Q在周期表中的位置 ;Q与Y形成化合物的电子式为 。
(2)X分别与Q、R形成的简单化合物中,热稳定性较差的是 (写化学式)。
(3)由Z与R组成的化合物A(),各原子最外层均满足8电子稳定结构,与水反应后溶液可用于漂白和杀菌,同时生成一种碱性气体。写出A与水反应的化学方程式 。
(4)下列说法正确的是_______(填标号)。
A.简单离子半径:
B.氧化物对应水化物的酸性:
C.由X与Z、Y与R形成的化合物所含化学键类型相同
D.向2mL单质R的饱和溶液中加入几滴紫色石蕊试剂,溶液显红色
(5)设计实验证明Q元素与R元素非金属性强弱 (可选用试剂:固体,稀盐酸,浓盐酸,溴水,溶液,)。
17.、CO是汽车尾气的主要成分,可利用催化技术将其转化为无害气体,有关反应如下:
反应I:
反应Ⅱ:
回答下列问题:
(1)反应速率方程准确描述了化学反应的速率与参与反应物质浓度的关系。某温度下,测得反应I的速率方程为,k为常数,由此判断其反应机理是(总反应速率取决于慢反应) (填编号)。
反应机理编号 第一步反应 第二步反应
① (快反应) (慢反应)
② (慢反应) (快反应)
向体积不变的密闭容器中通入和1mol CO发生反应I,改变下列条件不能使反应速率增大的是 (填标号)。
A.降低温度 B.通入 C.增大催化剂表面积 D.通入气体He
(2)在2L的密闭容器中,通入2mol NO和1mol CO,发生反应Ⅱ。、温度时,CO的物质的量随时间变化如图所示:
①该反应 0(填“>”或“<”)。
②温度,的反应速率 ;2~4min CO的变化量减小的原因是 。
③温度达平衡时,的体积分数是 (保留三位有效数字)。
④有关该反应,下列说法错误的是 (填标号)。
A.反应过程中,NO和CO的物质的量之比不变,说明反应Ⅱ达到平衡状态
B.混合气体的密度保持不变,说明反应Ⅱ达到平衡状态
C.温度,m点有
D.温度下,增加初始时NO的物质的量,可使平衡时CO的物质的量与温度时相同
18.甲烷和甲醇是常见的有机物,具有广阔的开发应用前景。回答下列问题。
(1)已知:;;则 。
(2)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:
①电极N上发生 (填“氧化”或“还原”)反应。
②电极M上发生反应的电极反应式为 。
③质子交换膜每通过,消耗b气体标准状况下的体积为 L。
(3)某研究小组用甲烷燃料电池作电源,电解含正盐X的废水制得、、和NaOH。工作原理如图:
已知:I.电池中甲烷用量为4.48L(标准状况);Ⅱ.甲、乙、丙三池中溶液体积均为1L且忽略电解过程中体积变化。
回答下列问题:
①电解池中c膜为 (填“阳”或“阴”)离子交换膜;X为 (写化学式)。
②电解结束后,理论上丙池中 。
19.芳香族化合物G是药物中间体,以有机物A为原料制备G的一种合成路线如下:
已知:。
回答下列问题:
(1)A的化学名称为 ,E中含氧官能团的名称为 。
(2)D生成高分子化合物的化学方程式为 。
(3)F→G的化学方程式为 ,反应类型为 。
(4)符合下列条件的G的同分异构体有 种,其结构简式为 (任写一种)。
①属于芳香族化合物且苯环上只有一个取代基
②含3个甲基
③能与饱和溶液反应产生
20.某实验小组为探究铜催化乙醇的反应,设计实验如图所示(夹持及加热装置略)。
已知:①乙醛沸点为21℃,遇希夫试剂显紫红色;
②乙醛与银氨溶液反应可生成醋酸铵和氨气。
回答下列问题:
i.有氧条件下铜的催化:组装仪器并操作如下:①检验装置气密性后,加入所需试剂;②关闭、,打开,通入;③加热B处玻璃管直到铜丝变黑;④……;⑤加热A,一段时间后,铜丝变亮。重复②~⑤步骤反应3min后,E试管中有光亮的银镜出现。
(1)仪器C的名称为 ,操作④是 。
(2)E中发生反应的方程式为 ;装置中存在的缺陷是 。
ii.无氧条件下铜的催化:改进缺陷后继续操作如下:⑥打开、,关闭;⑦……;⑧关闭,加热装置A和B;⑨在F装置的出口处收集气体。现象:铜丝持续保持亮红色,E试管中出现银镜,收集到的气体移近火焰能听到微弱的噗噗声。
(3)操作⑦的目的是 ;B中发生反应的方程式为 。
(4)有同学提出,在有氧条件下也可能发生无氧催化反应,更换F中试剂为希夫试剂,重复②~⑤的操作。测得生成银单质21.6g,C装置增重1.62g,F中无明显变化。则F的作用为 ,乙醇发生有氧催化和无氧催化的比例为 。
参考答案
1.C
2.B
3.D
4.A
5.D
6.A
7.C
8.D
9.B
10.C
11.B
12.D
13.AD
14.BD
15.AB
16.(1) 第三周期第VIA族
(2)H2S
(3)NCl3+3H2O=NH3+3HClO
(4)A
(5)将浓盐酸与固体高锰酸钾反应产生的氯气通入硫化钠溶液,产生黄色沉淀,说明氯元素非金属性强于硫元素
17.(1) ② AD
(2) < 随着反应的进行,反应物浓度减小,反应速率变慢 21.1% BD
18.(1)-334.5
(2) 还原 5.6
(3) 阳 Na2SO4 1.8
19.(1) 苯乙烯 羧基
(2)
(3) 取代反应(或酯化反应)
(4) 4 、、、(任写一种)
20.(1) 球形干燥管 关闭、,打开
(2) 缺少尾气处理装置
(3) 排出装置内的空气
(4) 检验乙醛是否与银氨溶液完全反应 9:1
一、单选题
1.中华文化源远流长,化学与文化传承密不可分。下列说法错误的是
A.青铜器“越王勾践剑”的主要材质为合金
B.南唐文房三宝之一的“澄心堂纸”主要成分是纤维素
C.非物质文化遗产“皮影戏”中制作皮影的兽皮主要成分是油脂
D.泥土烧制而成的“秦始皇兵马俑”主要成分是硅酸盐
2.下列化学用语或表述正确的是
A.乙烷的比例模型:
B.次氯酸的结构式:
C.水分子的空间结构:直线形
D.中子数为146、质子数为92的铀(U)原子:
3.G是一种常见药物的中间体,结构简式如图所示。下列说法正确的是
A.G的分子式为
B.G的一氯取代物有5种
C.可用酸性高锰酸钾溶液检验G中的碳碳双键
D.1mol G与金属钠反应最多可生成(标准状况)
4.利用下列装置能达到实验目的的是
A.利用装置制取乙酸乙酯 B.利用装置蒸馏石油并收集馏分
C.利用装置制取一氯甲烷 D.利用装置在铁质镀件表面镀铜
A.A B.B C.C D.D
5.炒过菜的铁锅洗净后残留水渍,不久便会因被腐蚀而出现红褐色锈斑。下列说法正确的是
A.腐蚀过程中铁做正极
B.水渍中心部位腐蚀程度最严重
C.正极的电极反应式为
D.铁锅表面加聚四氟乙烯涂层可有效保护铁锅不被腐蚀
6.下列物质的鉴别方法错误的是
A.用酸性高锰酸钾溶液鉴别苯和环己烷 B.用溴水鉴别乙烷和乙烯
C.用重铬酸钾溶液鉴别乙醇和乙酸 D.用水鉴别乙醇和四氯化碳
7.放射性核素发生衰变会转变为另一种核素,同时释放出电子、正电子等粒子,如:,。下列说法正确的是
A.的中子数是27 B.X与Co不在同一族
C.Y的最外层电子数是7 D.与互为同位素
8.汽车发动机工作时会引发和反应生成NO,其能量变化如图所示。下列说法正确的是
A.该反应为放热反应
B.三种分子中最稳定的是NO
C.具有的能量为946kJ
D.断裂需吸收的能量是498kJ
9.下列实验操作及结论错误的是
实验 结论
A 室温下,向两支盛有等体积等浓度溶液的试管中,分别加入1mL不同浓度的盐酸,观察产生气泡的快慢 该反应中,其它条件相同时,盐酸浓度越大反应速率越快
B 向量热计中加入的盐酸100mL,匀速搅拌后记录初始温度,迅速加入等浓度等体积的NaOH溶液,记录反应结束温度为 该反应的反应热为:
C 将铁粉与硫粉混合后铺成条状,用灼热的玻璃棒触及一端,混合物红热时移开,反应仍继续进行 该反应为放热反应
D 和中均分别加入NaOH溶液和盐酸,只溶于盐酸,都能溶 Mg的金属性比Al强
A.A B.B C.C D.D
10.制造隐形眼镜的功能高分子M的合成路线如图所示,已知:。下列说法正确的是
A.该路线中发生取代反应的是①②③ B.F与乙醇互为同系物
C.G中所有碳原子在同一平面内 D.H和M具有相同的官能团
11.某化学兴趣小组探究外界条件对分解速率的影响,忽略过程中溶液体积变化,实验记录如下表。下列说法正确的是
实验序号 溶液体积/mL 加入水体积/mL 温度/℃ 催化剂 收集标准状况所需时间/s
1 20 20 20 无 296
2 20 20 50 无 75
3 20 20 20 粉末 45
4 20 20 20 粉末 100
5 a b m n
A.对比实验3和4,说明的催化效果更好
B.实验4中,的平均反应速率是
C.,,时,
D.,,时,通过实验2和5探究浓度对反应速率的影响
12.磷酸铁锂“刀片电池”采用叠片工艺,放电时工作原理如图所示,放电时的总反应为。下列说法正确的是
A.放电时铝箔为负极
B.充电过程中阴极质量减小
C.放电过程中得电子生成单质Li
D.充电时阳极反应为
二、多选题
13.乙酸异戊酯是一种常用的食品添加剂。某实验小组利用如图装置制备乙酸异戊酯(加热及夹持装置略),相关数据如表。
乙酸 异戊醇 乙酸异戊酯 环己烷 环己烷与水共沸物 浓硫酸
沸点/℃ 118 131 142 81 69 338
投料 2.4mol 2.0mol 3.0mol 10滴
已知:分水器可将有机物和水分离;环己烷-水共沸物可带出水分。下列说法错误的是
A.反应混合液的加入顺序为浓硫酸、乙酸、异戊醇
B.应控制反应温度为69~81℃
C.产物的提纯需经过水洗、碳酸钠溶液洗涤、水洗
D.若分出水的量为30.6mL,则可估算乙酸异戊酯的产率约为71%
14.以高铁酸钾()为电解质可形成一种高铁电池,其模拟实验装置如图(已知氢氧化锌易溶于强碱)。下列说法正确的是
A.电池工作时,甲乙两池中溶液碱性均增强
B.电池工作时,盐桥中阳离子向甲池移动
C.电路中每转移2mol电子,理论上乙池质量增加65g
D.正极反应为
15.氯化锗用作光导纤维的渗杂剂。实验室模拟以ZnO烟尘(主要成分为、、CaO、FeO)为原料制取氯化锗的流程如图所示(单宁可与生成沉淀)。下列说法错误的是
A.滤渣1的成分为
B.“中和”的目的是除去
C.“灼烧”时需用的硅酸盐仪器有瓷坩埚、泥三角、酒精灯、玻璃棒
D.若用在加热条件下进行“氯化”,方程式为
三、解答题
16.X、Y、Z、W、Q、R为元素周期表中原子序数依次增大的六种短周期主族元素,相关信息如表。
元素编号 元素性质或原子结构
X 元素周期表中原子半径最小的元素
Y 最外层电子数是内层电子数的2倍
Z 简单氢化物能与其最高价氧化物对应的水化物反应生成盐
W 与X同主族
Q 单质是一种淡黄色固体
回答下列问题:
(1)R的简单阴离子结构示意图为 ;Q在周期表中的位置 ;Q与Y形成化合物的电子式为 。
(2)X分别与Q、R形成的简单化合物中,热稳定性较差的是 (写化学式)。
(3)由Z与R组成的化合物A(),各原子最外层均满足8电子稳定结构,与水反应后溶液可用于漂白和杀菌,同时生成一种碱性气体。写出A与水反应的化学方程式 。
(4)下列说法正确的是_______(填标号)。
A.简单离子半径:
B.氧化物对应水化物的酸性:
C.由X与Z、Y与R形成的化合物所含化学键类型相同
D.向2mL单质R的饱和溶液中加入几滴紫色石蕊试剂,溶液显红色
(5)设计实验证明Q元素与R元素非金属性强弱 (可选用试剂:固体,稀盐酸,浓盐酸,溴水,溶液,)。
17.、CO是汽车尾气的主要成分,可利用催化技术将其转化为无害气体,有关反应如下:
反应I:
反应Ⅱ:
回答下列问题:
(1)反应速率方程准确描述了化学反应的速率与参与反应物质浓度的关系。某温度下,测得反应I的速率方程为,k为常数,由此判断其反应机理是(总反应速率取决于慢反应) (填编号)。
反应机理编号 第一步反应 第二步反应
① (快反应) (慢反应)
② (慢反应) (快反应)
向体积不变的密闭容器中通入和1mol CO发生反应I,改变下列条件不能使反应速率增大的是 (填标号)。
A.降低温度 B.通入 C.增大催化剂表面积 D.通入气体He
(2)在2L的密闭容器中,通入2mol NO和1mol CO,发生反应Ⅱ。、温度时,CO的物质的量随时间变化如图所示:
①该反应 0(填“>”或“<”)。
②温度,的反应速率 ;2~4min CO的变化量减小的原因是 。
③温度达平衡时,的体积分数是 (保留三位有效数字)。
④有关该反应,下列说法错误的是 (填标号)。
A.反应过程中,NO和CO的物质的量之比不变,说明反应Ⅱ达到平衡状态
B.混合气体的密度保持不变,说明反应Ⅱ达到平衡状态
C.温度,m点有
D.温度下,增加初始时NO的物质的量,可使平衡时CO的物质的量与温度时相同
18.甲烷和甲醇是常见的有机物,具有广阔的开发应用前景。回答下列问题。
(1)已知:;;则 。
(2)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:
①电极N上发生 (填“氧化”或“还原”)反应。
②电极M上发生反应的电极反应式为 。
③质子交换膜每通过,消耗b气体标准状况下的体积为 L。
(3)某研究小组用甲烷燃料电池作电源,电解含正盐X的废水制得、、和NaOH。工作原理如图:
已知:I.电池中甲烷用量为4.48L(标准状况);Ⅱ.甲、乙、丙三池中溶液体积均为1L且忽略电解过程中体积变化。
回答下列问题:
①电解池中c膜为 (填“阳”或“阴”)离子交换膜;X为 (写化学式)。
②电解结束后,理论上丙池中 。
19.芳香族化合物G是药物中间体,以有机物A为原料制备G的一种合成路线如下:
已知:。
回答下列问题:
(1)A的化学名称为 ,E中含氧官能团的名称为 。
(2)D生成高分子化合物的化学方程式为 。
(3)F→G的化学方程式为 ,反应类型为 。
(4)符合下列条件的G的同分异构体有 种,其结构简式为 (任写一种)。
①属于芳香族化合物且苯环上只有一个取代基
②含3个甲基
③能与饱和溶液反应产生
20.某实验小组为探究铜催化乙醇的反应,设计实验如图所示(夹持及加热装置略)。
已知:①乙醛沸点为21℃,遇希夫试剂显紫红色;
②乙醛与银氨溶液反应可生成醋酸铵和氨气。
回答下列问题:
i.有氧条件下铜的催化:组装仪器并操作如下:①检验装置气密性后,加入所需试剂;②关闭、,打开,通入;③加热B处玻璃管直到铜丝变黑;④……;⑤加热A,一段时间后,铜丝变亮。重复②~⑤步骤反应3min后,E试管中有光亮的银镜出现。
(1)仪器C的名称为 ,操作④是 。
(2)E中发生反应的方程式为 ;装置中存在的缺陷是 。
ii.无氧条件下铜的催化:改进缺陷后继续操作如下:⑥打开、,关闭;⑦……;⑧关闭,加热装置A和B;⑨在F装置的出口处收集气体。现象:铜丝持续保持亮红色,E试管中出现银镜,收集到的气体移近火焰能听到微弱的噗噗声。
(3)操作⑦的目的是 ;B中发生反应的方程式为 。
(4)有同学提出,在有氧条件下也可能发生无氧催化反应,更换F中试剂为希夫试剂,重复②~⑤的操作。测得生成银单质21.6g,C装置增重1.62g,F中无明显变化。则F的作用为 ,乙醇发生有氧催化和无氧催化的比例为 。
参考答案
1.C
2.B
3.D
4.A
5.D
6.A
7.C
8.D
9.B
10.C
11.B
12.D
13.AD
14.BD
15.AB
16.(1) 第三周期第VIA族
(2)H2S
(3)NCl3+3H2O=NH3+3HClO
(4)A
(5)将浓盐酸与固体高锰酸钾反应产生的氯气通入硫化钠溶液,产生黄色沉淀,说明氯元素非金属性强于硫元素
17.(1) ② AD
(2) < 随着反应的进行,反应物浓度减小,反应速率变慢 21.1% BD
18.(1)-334.5
(2) 还原 5.6
(3) 阳 Na2SO4 1.8
19.(1) 苯乙烯 羧基
(2)
(3) 取代反应(或酯化反应)
(4) 4 、、、(任写一种)
20.(1) 球形干燥管 关闭、,打开
(2) 缺少尾气处理装置
(3) 排出装置内的空气
(4) 检验乙醛是否与银氨溶液完全反应 9:1
同课章节目录
