安徽省马鞍山市2023-2024学年高二下学期期末考试化学试卷(含答案)
文档属性
| 名称 | 安徽省马鞍山市2023-2024学年高二下学期期末考试化学试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1003.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-17 00:00:00 | ||
图片预览



文档简介
安徽省马鞍山市2023-2024学年高二下学期7月期末考试化学试题
一、单选题
1.化学与生活息息相关。下列说法错误的是
A.有机玻璃属于有机合成的高分子材料
B.植物油、棉花和蚕丝均为天然高分子
C.高分子聚合物绝大多数都是绝缘材料
D.研发可降解高分子材料,减少“白色污染”
2.具有还原性,氨气和灼热的氧化铜发生的反应为,下列说法正确的是
A.的VSEPR模型:
B.的电子式:
C.的空间结构:直线形
D.基态原子的价电子轨道表示式:
3.W、X、Y、Z、R为原子序数依次增大的短周期族元素,五种元素组成的某化合物可用于治疗肝昏迷及其他精神疾病,该化合物的结构简式如图所示。下列说法正确的是
A.氢化物的沸点:X<Z B.简单离子半径:Z<R
C.元素电负性:X<Y<Z D.第一电离能:X<Y<Z
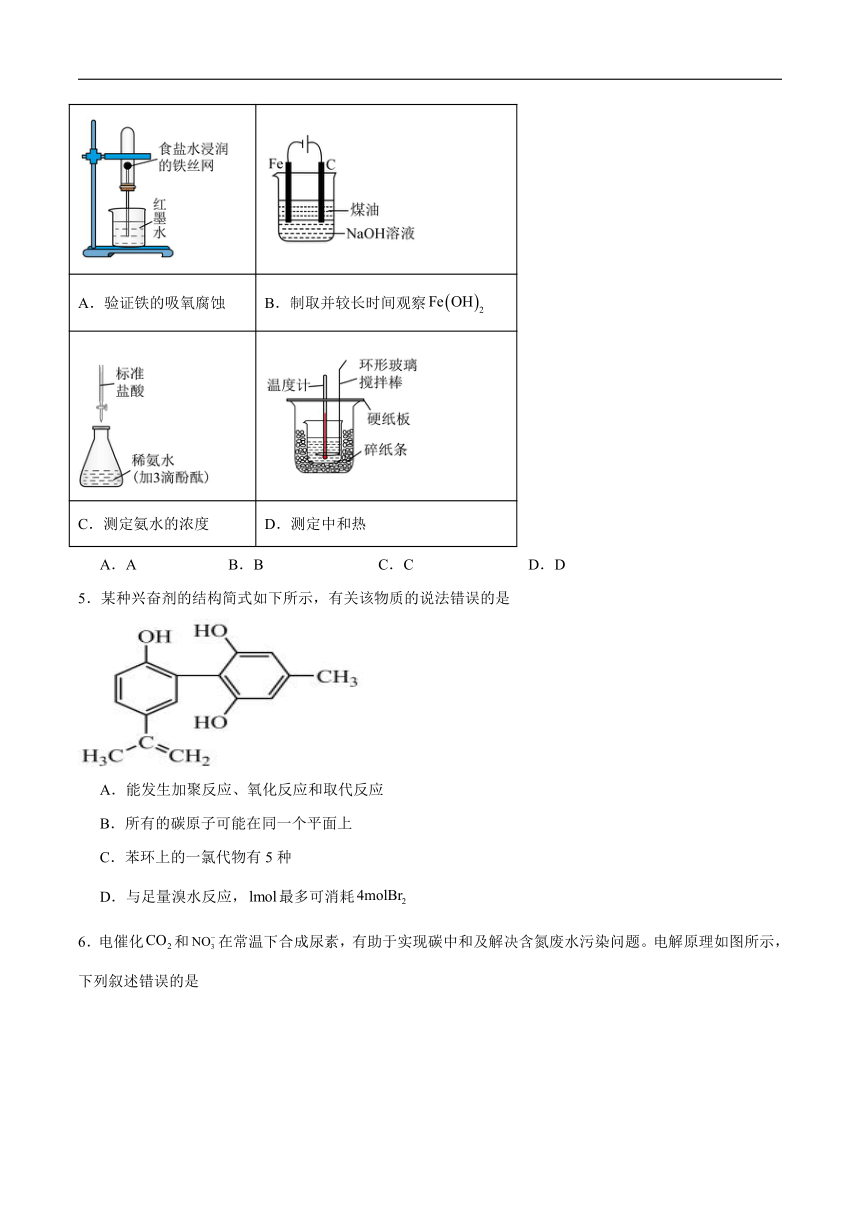
4.下列实验装置(部分夹持装置略)能达到实验目的的是
A.验证铁的吸氧腐蚀 B.制取并较长时间观察
C.测定氨水的浓度 D.测定中和热
A.A B.B C.C D.D
5.某种兴奋剂的结构简式如下所示,有关该物质的说法错误的是
A.能发生加聚反应、氧化反应和取代反应
B.所有的碳原子可能在同一个平面上
C.苯环上的一氯代物有5种
D.与足量溴水反应,最多可消耗
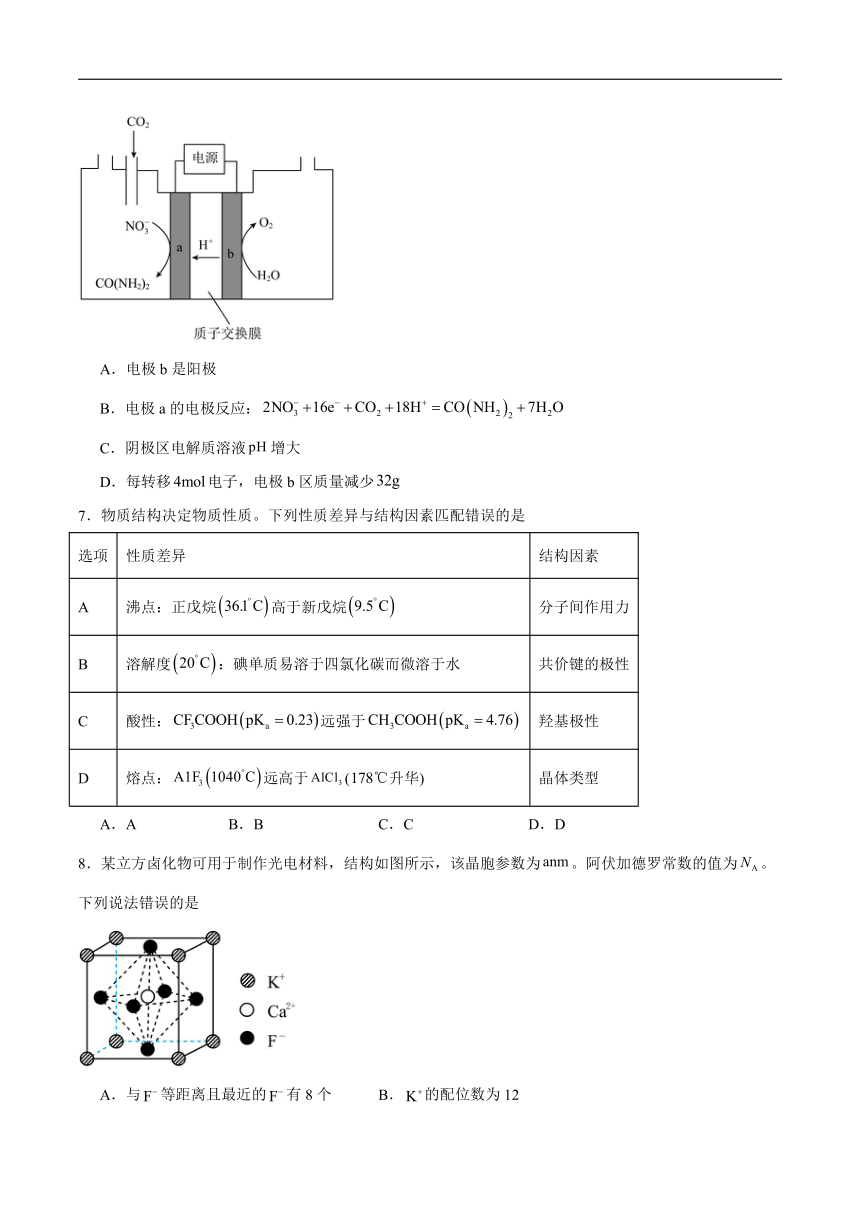
6.电催化和在常温下合成尿素,有助于实现碳中和及解决含氮废水污染问题。电解原理如图所示,下列叙述错误的是
A.电极b是阳极
B.电极a的电极反应:
C.阴极区电解质溶液增大
D.每转移电子,电极b区质量减少
7.物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
选项 性质差异 结构因素
A 沸点:正戊烷高于新戊烷 分子间作用力
B 溶解度:碘单质易溶于四氯化碳而微溶于水 共价键的极性
C 酸性:远强于 羟基极性
D 熔点:远高于(升华) 晶体类型
A.A B.B C.C D.D
8.某立方卤化物可用于制作光电材料,结构如图所示,该晶胞参数为。阿伏加德罗常数的值为。下列说法错误的是
A.与等距离且最近的有8个 B.的配位数为12
C.与的最近距离为 D.晶体密度为
9.由实验操作和现象,可得出相应正确结论的是
选项 实验操作及现象 结论
A 将铁锈溶于浓盐酸,滴入溶液,紫色褪去 铁锈中含有二价铁
B 向溶液中通入,出现黑色沉淀 酸性:
C 乙醇和浓硫酸共热至,将生成的气体通入溴水中,溴水褪色 反应生成了乙烯
D 向溶液中先后滴加2滴和4滴溶液,先生成白色沉淀,后出现黄色沉淀
A.A B.B C.C D.D
10.“碳达峰·碳中和”是我国社会发展重大战略之一,还原是实现“双碳”经济的有效途径之一,主要反应为 ,下列说法正确的是
A.该反应
B.升高温度,正反应速率增大,逆反应速率减小
C.恒温下,减小总压,的平衡转化率增大
D.恒温恒压下,加入催化剂,平衡常数增大
11.铜及其重要化合物在生产中有着重要的应用。与浓硝酸反应可得。在条件下能与氨水反应生成。向稀硫酸中加入,溶液变蓝色并有紫红色固体产生。催化剂是白色难溶于水的化合物,溶于较浓盐酸时生成(强酸)。上述叙述过程涉及的离子方程式,错误的是
A.与浓硝酸反应:
B.溶于稀硫酸:
C.在存在下与氨水反应:
D.溶于较浓盐酸:
12.碳酸锰是合成高纯硫酸锰作的原料,工业上制备碳酸锰的部分工艺如下图所示。下列说法正确的是
A.的溶液中:
B.除杂2所得上层清液中:
C.的溶液中:
D.沉锰后的滤液中:
13.一种用氢气制备的工艺过程简单、能耗低,其反应原理如图所示,已知钯常以正二价形式存在。下列有关说法正确的是
A.的结构式为,是非极性分子
B.反应①②③均为氧化还原反应
C.反应②中有参加反应时,转移电子的物质的量为
D.反应过程中为该反应的催化剂
14.向一恒容密闭容器加入和一定量的,发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法正确的是
A.
B.反应速率:
C.点a、b、c对应的平衡常数:
D.a点和c点对应的的物质的量分数相等
二、解答题
15.草酸是基本有机化工合成原料,广泛用于医药、冶金和化工等部门,其用量随着工业的大力发展不断增加。实验室在硝酸汞催化下,用浓硝酸氧化乙炔制备草酸,主要装置如图:
回答下列问题:
(1)仪器X的名称是 。
(2)多孔球泡的作用 。
(3)实验室制备乙炔常含有杂质,可用盛放 溶液的B装置除去(填试剂名称)。
(4)乙炔通入三颈烧瓶后,观察到有红棕色气体生成,C中反应的化学方程式为 。
(5)初始原料中硝酸的质量分数对草酸产量的影响如下表所示
硝酸的初始质量分数/% 30 40 50 60
每溶液中草酸的含量/g 4.1 6.8 9.3 8.1
请分析硝酸的初始质量分数过高草酸产量下降的原因 。
(6)称取草酸样品,配制成溶液,量取所配制的溶液于锥形瓶中,加入酸性溶液,发生反应:。向充分反应后的溶液中加入溶液至滴定终点;消耗溶液体积为。
上述滴定过程中发生反应的离子方程式为 。原试样中草酸的质量分数为 。
(7)研究表明乙炔也能通过电解法制备草酸,装置如下图所示,则阳极电极反应式为 。
16.是生产多晶硅的副产物,熔点:,沸点:,易水解。利用对废弃的锂电池正极材料进行氯化处理以回收、等金属,工艺路线如下:
回答下列问题:
(1)化合物中钴元素的化合价为 。基态原子的核外电子排布式为 。
(2)焙烧后的烧渣是、和的混合物,“焙烧”时的化学方程式为 。
(3)“焙烧”后剩余的应先除去,原因是 。“沉锂过滤”滤饼3是 (填化学式)。
(4)已知,若“沉钴过滤”时控制为9.5,则溶液中浓度为 。
(5)常温下能与浓盐酸反应生成黄绿色的气体单质,该反应的离子方程式为 。
(6)导致比易水解的因素除了有更多的价层轨道外还有 (填标号)。
a.键极性更大 b.的原子半径更大 c.键键能更大
17.硫酸工业在国民经济中占有重要地位。
I.铅室法使用了大容积铅室制备硫酸(以下),副产物为亚硝基硫酸,主要反应为:
、
其中氧化反应分两步进行,其反应过程能量变化示意图如图。
①
②
(1)决定氧化反应速率的步骤是 (填“①”或“②”)。
(2) (用、、、表示)。
II.接触法制硫酸的关键反应为的催化氧化: 将一定量和气体充入恒容的密闭容器中,控制反应温度为。
(3)下列可以作为反应达到平衡的判据是 。
a.气体的压强不变 b.
c.的百分含量不变 d.容器内气体的密度不变
(4)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是 (填标号)。
(5)下表列出了在不同温度和压强下,反应达到平衡时的转化率。在实际生产中,选定的温度为和常压,原因是 。
温度 平衡时的转化率
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
(6)温度为T时,在容积为的恒容密闭容器中充入和,仅发生反应:,平衡时的物质的量为,则达平衡时二氧化硫的转化率 ,反应的平衡常数 。
18.二酮类化合物在药物领域有广泛用途。某二酮类化合物H合成路线如下:
已知:(为烷烃基)。
回答下列问题:
(1)A生成B的反应类型为 ;D的化学名称为 。
(2)H中含氧官能团的名称为 ,H中的手性碳原子个数为 。
(3)G的结构简式为 。
(4)D的同分异构体中,与其具有相同官能团的有 种(不考虑对应异构),其中核磁共振氢谱有四组峰,峰面积之比为的结构简式为 。
(5)以丙烯和丙酮为含碳原料,利用上述的反应原理,合成化合物(2,3-二甲基-2-丁烯)。
①从丙烯出发,第一步的化学方程式为 (注明反应条件)。
②最后一步反应中,有机反应物为 (写结构简式)。
参考答案
1.B
2.D
3.C
4.A
5.C
6.D
7.B
8.C
9.D
10.C
11.A
12.A
13.D
14.B
15.(1)球形冷凝管(冷凝管)
(2)增大乙炔气体与反应液的接触面积,加快反应速率,使反应更加充分
(3)氢氧化钠(或者硫酸铜)
(4)CHCH+8HNO3(浓)H2C2O4+8NO2↑+4H2O
(5)硝酸浓度过大,剩余的硝酸继续氧化草酸,导致草酸浓度下降
(6) 8H++5Fe2++MnO=5Fe3++Mn2++4H2O 69%(0.69)
(7)CHCH4H2O-8e HOOCCOOH+8H
16.(1) +3 1s22s22p63s23p63d74s2或[Ar]3d74S2
(2)4LiCoO2 + 3SiCl44LiCl + 4CoCl2 + 3SiO2 + O2
(3) SiCl4易水解,形成酸雾 Li2CO3
(4)5.9×10-6
(5)Co3O4 + 8H+ + 2Cl 3Co2+ + Cl2↑+ 4H2O
(6)ab
17.(1)②
(2)E1 + E3-E2-E4
(3)abc
(4)d
(5)450℃、0.1Mpa,平衡时SO2的转化率已经较大,温度过高平衡逆向移动,平衡转化率降低;压强增大,SO2转化率变化不大;但压强越大,对材料的强度和设备要求越高,陈本较高,故选常压
(6) 90 2700
18.(1) 加成反应 2-甲基-2-丁醇
(2) 羰基 2
(3)
(4) 7
(5)
一、单选题
1.化学与生活息息相关。下列说法错误的是
A.有机玻璃属于有机合成的高分子材料
B.植物油、棉花和蚕丝均为天然高分子
C.高分子聚合物绝大多数都是绝缘材料
D.研发可降解高分子材料,减少“白色污染”
2.具有还原性,氨气和灼热的氧化铜发生的反应为,下列说法正确的是
A.的VSEPR模型:
B.的电子式:
C.的空间结构:直线形
D.基态原子的价电子轨道表示式:
3.W、X、Y、Z、R为原子序数依次增大的短周期族元素,五种元素组成的某化合物可用于治疗肝昏迷及其他精神疾病,该化合物的结构简式如图所示。下列说法正确的是
A.氢化物的沸点:X<Z B.简单离子半径:Z<R
C.元素电负性:X<Y<Z D.第一电离能:X<Y<Z
4.下列实验装置(部分夹持装置略)能达到实验目的的是
A.验证铁的吸氧腐蚀 B.制取并较长时间观察
C.测定氨水的浓度 D.测定中和热
A.A B.B C.C D.D
5.某种兴奋剂的结构简式如下所示,有关该物质的说法错误的是
A.能发生加聚反应、氧化反应和取代反应
B.所有的碳原子可能在同一个平面上
C.苯环上的一氯代物有5种
D.与足量溴水反应,最多可消耗
6.电催化和在常温下合成尿素,有助于实现碳中和及解决含氮废水污染问题。电解原理如图所示,下列叙述错误的是
A.电极b是阳极
B.电极a的电极反应:
C.阴极区电解质溶液增大
D.每转移电子,电极b区质量减少
7.物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
选项 性质差异 结构因素
A 沸点:正戊烷高于新戊烷 分子间作用力
B 溶解度:碘单质易溶于四氯化碳而微溶于水 共价键的极性
C 酸性:远强于 羟基极性
D 熔点:远高于(升华) 晶体类型
A.A B.B C.C D.D
8.某立方卤化物可用于制作光电材料,结构如图所示,该晶胞参数为。阿伏加德罗常数的值为。下列说法错误的是
A.与等距离且最近的有8个 B.的配位数为12
C.与的最近距离为 D.晶体密度为
9.由实验操作和现象,可得出相应正确结论的是
选项 实验操作及现象 结论
A 将铁锈溶于浓盐酸,滴入溶液,紫色褪去 铁锈中含有二价铁
B 向溶液中通入,出现黑色沉淀 酸性:
C 乙醇和浓硫酸共热至,将生成的气体通入溴水中,溴水褪色 反应生成了乙烯
D 向溶液中先后滴加2滴和4滴溶液,先生成白色沉淀,后出现黄色沉淀
A.A B.B C.C D.D
10.“碳达峰·碳中和”是我国社会发展重大战略之一,还原是实现“双碳”经济的有效途径之一,主要反应为 ,下列说法正确的是
A.该反应
B.升高温度,正反应速率增大,逆反应速率减小
C.恒温下,减小总压,的平衡转化率增大
D.恒温恒压下,加入催化剂,平衡常数增大
11.铜及其重要化合物在生产中有着重要的应用。与浓硝酸反应可得。在条件下能与氨水反应生成。向稀硫酸中加入,溶液变蓝色并有紫红色固体产生。催化剂是白色难溶于水的化合物,溶于较浓盐酸时生成(强酸)。上述叙述过程涉及的离子方程式,错误的是
A.与浓硝酸反应:
B.溶于稀硫酸:
C.在存在下与氨水反应:
D.溶于较浓盐酸:
12.碳酸锰是合成高纯硫酸锰作的原料,工业上制备碳酸锰的部分工艺如下图所示。下列说法正确的是
A.的溶液中:
B.除杂2所得上层清液中:
C.的溶液中:
D.沉锰后的滤液中:
13.一种用氢气制备的工艺过程简单、能耗低,其反应原理如图所示,已知钯常以正二价形式存在。下列有关说法正确的是
A.的结构式为,是非极性分子
B.反应①②③均为氧化还原反应
C.反应②中有参加反应时,转移电子的物质的量为
D.反应过程中为该反应的催化剂
14.向一恒容密闭容器加入和一定量的,发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法正确的是
A.
B.反应速率:
C.点a、b、c对应的平衡常数:
D.a点和c点对应的的物质的量分数相等
二、解答题
15.草酸是基本有机化工合成原料,广泛用于医药、冶金和化工等部门,其用量随着工业的大力发展不断增加。实验室在硝酸汞催化下,用浓硝酸氧化乙炔制备草酸,主要装置如图:
回答下列问题:
(1)仪器X的名称是 。
(2)多孔球泡的作用 。
(3)实验室制备乙炔常含有杂质,可用盛放 溶液的B装置除去(填试剂名称)。
(4)乙炔通入三颈烧瓶后,观察到有红棕色气体生成,C中反应的化学方程式为 。
(5)初始原料中硝酸的质量分数对草酸产量的影响如下表所示
硝酸的初始质量分数/% 30 40 50 60
每溶液中草酸的含量/g 4.1 6.8 9.3 8.1
请分析硝酸的初始质量分数过高草酸产量下降的原因 。
(6)称取草酸样品,配制成溶液,量取所配制的溶液于锥形瓶中,加入酸性溶液,发生反应:。向充分反应后的溶液中加入溶液至滴定终点;消耗溶液体积为。
上述滴定过程中发生反应的离子方程式为 。原试样中草酸的质量分数为 。
(7)研究表明乙炔也能通过电解法制备草酸,装置如下图所示,则阳极电极反应式为 。
16.是生产多晶硅的副产物,熔点:,沸点:,易水解。利用对废弃的锂电池正极材料进行氯化处理以回收、等金属,工艺路线如下:
回答下列问题:
(1)化合物中钴元素的化合价为 。基态原子的核外电子排布式为 。
(2)焙烧后的烧渣是、和的混合物,“焙烧”时的化学方程式为 。
(3)“焙烧”后剩余的应先除去,原因是 。“沉锂过滤”滤饼3是 (填化学式)。
(4)已知,若“沉钴过滤”时控制为9.5,则溶液中浓度为 。
(5)常温下能与浓盐酸反应生成黄绿色的气体单质,该反应的离子方程式为 。
(6)导致比易水解的因素除了有更多的价层轨道外还有 (填标号)。
a.键极性更大 b.的原子半径更大 c.键键能更大
17.硫酸工业在国民经济中占有重要地位。
I.铅室法使用了大容积铅室制备硫酸(以下),副产物为亚硝基硫酸,主要反应为:
、
其中氧化反应分两步进行,其反应过程能量变化示意图如图。
①
②
(1)决定氧化反应速率的步骤是 (填“①”或“②”)。
(2) (用、、、表示)。
II.接触法制硫酸的关键反应为的催化氧化: 将一定量和气体充入恒容的密闭容器中,控制反应温度为。
(3)下列可以作为反应达到平衡的判据是 。
a.气体的压强不变 b.
c.的百分含量不变 d.容器内气体的密度不变
(4)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是 (填标号)。
(5)下表列出了在不同温度和压强下,反应达到平衡时的转化率。在实际生产中,选定的温度为和常压,原因是 。
温度 平衡时的转化率
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
(6)温度为T时,在容积为的恒容密闭容器中充入和,仅发生反应:,平衡时的物质的量为,则达平衡时二氧化硫的转化率 ,反应的平衡常数 。
18.二酮类化合物在药物领域有广泛用途。某二酮类化合物H合成路线如下:
已知:(为烷烃基)。
回答下列问题:
(1)A生成B的反应类型为 ;D的化学名称为 。
(2)H中含氧官能团的名称为 ,H中的手性碳原子个数为 。
(3)G的结构简式为 。
(4)D的同分异构体中,与其具有相同官能团的有 种(不考虑对应异构),其中核磁共振氢谱有四组峰,峰面积之比为的结构简式为 。
(5)以丙烯和丙酮为含碳原料,利用上述的反应原理,合成化合物(2,3-二甲基-2-丁烯)。
①从丙烯出发,第一步的化学方程式为 (注明反应条件)。
②最后一步反应中,有机反应物为 (写结构简式)。
参考答案
1.B
2.D
3.C
4.A
5.C
6.D
7.B
8.C
9.D
10.C
11.A
12.A
13.D
14.B
15.(1)球形冷凝管(冷凝管)
(2)增大乙炔气体与反应液的接触面积,加快反应速率,使反应更加充分
(3)氢氧化钠(或者硫酸铜)
(4)CHCH+8HNO3(浓)H2C2O4+8NO2↑+4H2O
(5)硝酸浓度过大,剩余的硝酸继续氧化草酸,导致草酸浓度下降
(6) 8H++5Fe2++MnO=5Fe3++Mn2++4H2O 69%(0.69)
(7)CHCH4H2O-8e HOOCCOOH+8H
16.(1) +3 1s22s22p63s23p63d74s2或[Ar]3d74S2
(2)4LiCoO2 + 3SiCl44LiCl + 4CoCl2 + 3SiO2 + O2
(3) SiCl4易水解,形成酸雾 Li2CO3
(4)5.9×10-6
(5)Co3O4 + 8H+ + 2Cl 3Co2+ + Cl2↑+ 4H2O
(6)ab
17.(1)②
(2)E1 + E3-E2-E4
(3)abc
(4)d
(5)450℃、0.1Mpa,平衡时SO2的转化率已经较大,温度过高平衡逆向移动,平衡转化率降低;压强增大,SO2转化率变化不大;但压强越大,对材料的强度和设备要求越高,陈本较高,故选常压
(6) 90 2700
18.(1) 加成反应 2-甲基-2-丁醇
(2) 羰基 2
(3)
(4) 7
(5)
同课章节目录
