第二章 化学反应速率与化学平衡 测试题 (含答案)
文档属性
| 名称 | 第二章 化学反应速率与化学平衡 测试题 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 424.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-18 15:13:21 | ||
图片预览



文档简介
第二章 化学反应速率与化学平衡测试题
一、选择题
1.下列体系加压后,对化学反应速率没有明显影响的是
A.2SO2+O2 2SO3 B.I2(g)+H2 2HI C.CO2+H2O H2CO3 D.H++OH- H2O
2.在容积为1L的密闭容器中,投入1molN2和3molH2分别在以下不同实验条件下进行反应。下列分析正确的是
容器编号 实验条件 平衡时反应中的能量变化
Ⅰ 恒温恒容 放热Q1kJ
Ⅱ 恒温恒压 放热Q2kJ
Ⅲ 恒容绝热 放热Q3kJ
A.平衡常数:Ⅱ>Ⅰ B.NH3体积分数:Ⅲ>Ⅰ
C.放出热量:Q1>Q2 D.N2转化率:Ⅱ>Ⅰ
3.已知: 。下列说法正确的是
A.相同条件下,增大,转化率增大
B.当时,反应达到平衡状态
C.该反应是放热反应,因此一定能自发进行
D.该反应的
4.春晚歌曲《可可托海的牧羊人》讲的是牧羊人与养蜂女的爱情故事,欧曲中唱到“我酿的酒喝不醉我自己……我愿意陪你翻过雪山穿越戈壁……”。下面对歌曲中的化学物质分析不正确的是
A.羊毛的主要成分是蛋白质,蜂蜜的主要成分是糖类,二者都是混合物
B.空气中的水汽凝华为雪花是一个放热过程,也是熵减过程
C.酿酒历史源远流长,粮食酿酒只发生了物理变化
D.戈壁滩是指布满了粗沙、砾石等荒漠地带,工业上可用粗沙生产半导体材料硅
5.一定温度下,某氧化物粉尘与C在一密闭容器中进行反应:,的线性关系如图所示(K为平衡常数,pK=-1gK)。
下列说法正确的是
A.加入一定质量的CO,达到新平衡后,m(C)减小
B.温度在2000K时,CO的平衡浓度是10 mol L 1
C.M点时R的消耗速率大于生成速率
D.恒温恒容下,向密闭容器内加入CO,平衡后CO的浓度增大
6.比较合成氨工业与制硫酸中催化氧化的生产过程,下列说法错误的是
A.都使用了合适的催化剂
B.都选择了较高的温度
C.都按化学方程式中的系数进行投料
D.合成氨工业采用了高压生产条件,的催化氧化采用了常压生产条件
7.某探究小组研究的反应速率与浓度的关系。反应速率可通过测定减半所需时间来确定。在一定温度下,获得如下实验数据。
实验序号 初始浓度 减半所需时间t/min
① 0.10 10.0 5.0 10
② 0.10 10.0 2.5 20
③ 0.20 10.0 5.0 5
④ 0.10 5.0 5.0 5
分析以上数据所得出的结论错误的是
A.增大增大 B.增大不变
C.实验①和②的不相等 D.实验③的为
8.下列说法正确的是
A.凡是放热反应都是自发的,由于吸热反应都是非自发的
B.相同物质的量的同种物质气态时熵值最小,固态时熵值最大
C.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
D.恒温恒压下,△H<0且△S>0的反应一定不能自发进行
9.已知反应CO(g)+H2O(g)CO2(g)+H2(g)ΔH<0,在一定温度的密闭容器中,反应达到平衡时,下列叙述正确的是
A.升高温度,H2的浓度增大
B.增大压强,K增大
C.增大CO浓度,H2O的转化率增大
D.更换高效催化剂,可以使该平衡正向移动
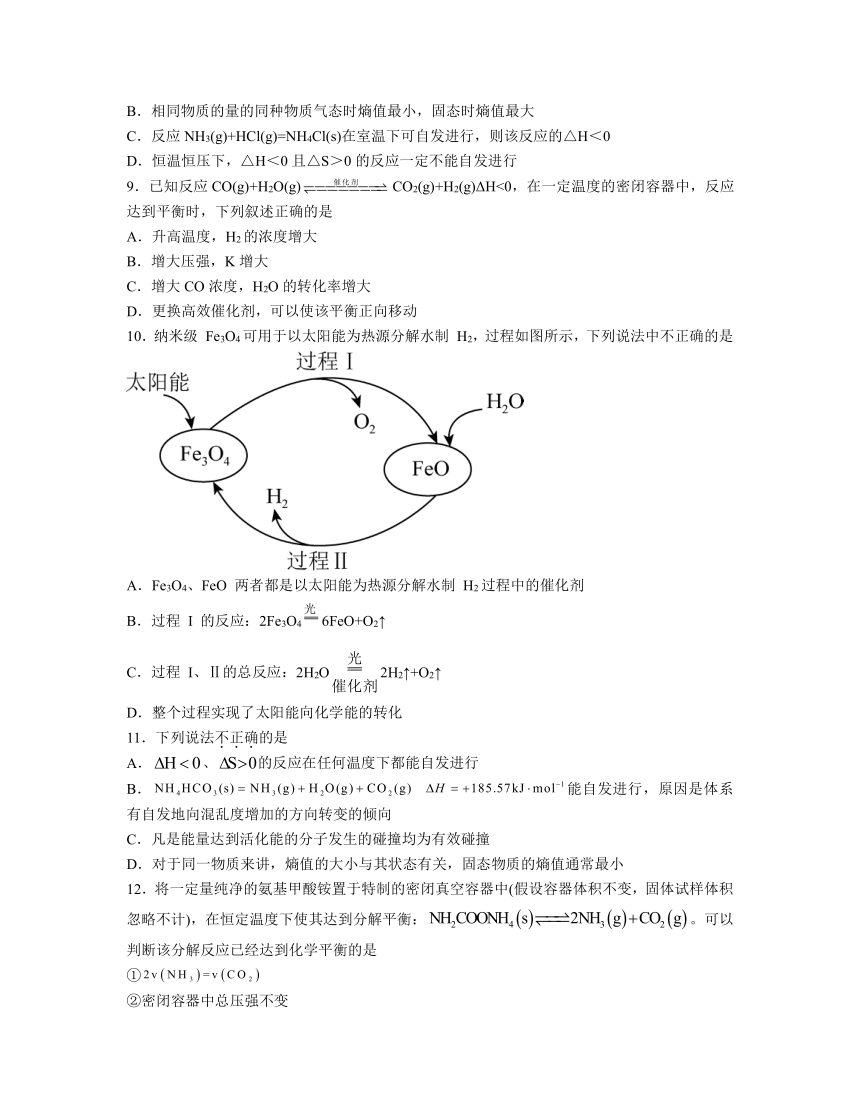
10.纳米级 Fe3O4可用于以太阳能为热源分解水制 H2,过程如图所示,下列说法中不正确的是
A.Fe3O4、FeO 两者都是以太阳能为热源分解水制 H2过程中的催化剂
B.过程 I 的反应:2Fe3O46FeO+O2↑
C.过程 I、Ⅱ的总反应:2H2O2H2↑+O2↑
D.整个过程实现了太阳能向化学能的转化
11.下列说法不正确的是
A.、的反应在任何温度下都能自发进行
B.能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.凡是能量达到活化能的分子发生的碰撞均为有效碰撞
D.对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值通常最小
12.将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:。可以判断该分解反应已经达到化学平衡的是
①
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中氨气的体积分数不变
⑤密闭容器中混合气体的平均相对分子质量不变
A.②③⑤ B.②③ C.②③④ D.①②④
二、非选择题
13.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO+H2C2O4+H+ —Mn2++CO2↑+H2O(未配平)。用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
组别 10%硫酸体积/mL 温度/℃ 其他物质
I 2 mL 20
II 2 mL 20 10滴饱和MnSO4溶液
III 2 mL 30
IV 1 mL 20 1 mL蒸馏水
(1)该反应中氧化剂和还原剂的物质的量之比为_______。
(2)如果研究催化剂对化学反应速率的影响,使用实验_______和_______(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验_______和_______。
(3)对比实验I和IV,可以研究_______对化学反应速率的影响。
14.已知化学反应①:,其平衡常数为;化学反应②:,其平衡常数为,在温度973 K和1173 K情况下,、的值分别如下,请填空:
温度
973 K 1.47 2.38
1173 K 2.15 1.67
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应,该反应的_______0 (填“>”“<”或“=”)。
(2)现有反应③:。写出该反应的平衡常数的表达式:_______。
(3)根据反应①与②可推导出、与之间的关系式_______,据此关系式及上表据,也能推断出反应③是_______(填“吸热”或“放热”)反应。
(4)图甲、图乙分别表示反应③在时刻达到平衡,在时刻因改变某个条件而发生变化的情况:
①图甲时刻改变的条件是_______。
②图乙时刻改变的条件是_______。
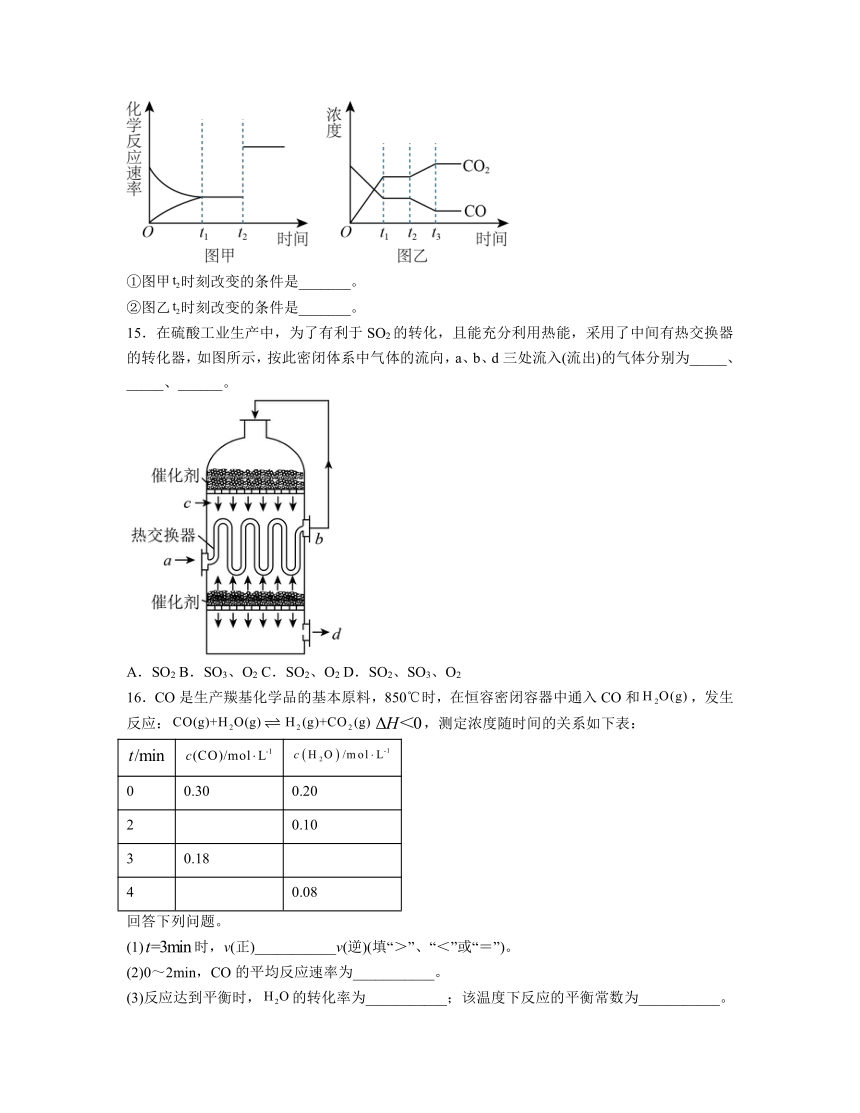
15.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的转化器,如图所示,按此密闭体系中气体的流向,a、b、d三处流入(流出)的气体分别为_____、_____、______。
A.SO2 B.SO3、O2 C.SO2、O2 D.SO2、SO3、O2
16.CO是生产羰基化学品的基本原料,850℃时,在恒容密闭容器中通入CO和,发生反应:,测定浓度随时间的关系如下表:
0 0.30 0.20
2 0.10
3 0.18
4 0.08
回答下列问题。
(1)时,v(正)___________v(逆)(填“>”、“<”或“=”)。
(2)0~2min,CO的平均反应速率为___________。
(3)反应达到平衡时,的转化率为___________;该温度下反应的平衡常数为___________。
(4)850℃时,在体积可变的密闭容器中,以下表中物质不同的起始浓度进行反应,达到平衡时CO的百分含量与原平衡相同的是___________(填字母序号)。
a 2 1 1 1
b 0.6 0.4 0 0
c 0.2 0 0.1 0.1
d 1 1 1 1
17.在100℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s 0 20 40 60 80
n(NO2)/mol 0.40 n1 0.26 n3 n4
n(N2O4)/mol 0.00 0.05 n2 0.08 0.08
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为__________mol·L 1·s 1。
(2)n3________(填“>”“<”或“=”)n4;该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L 1。
(4)上述(3)达到平衡后N2O4的转化率为______________,混合气体的平均摩尔质量为______________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2 N2O4的平衡常数将_______________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将______________(填“向左移动”“向右移动”或“不移动”)。
18.在容积为2L的密闭容器中进行如下反应:A(g)+2B(g) 3C(g)+nD(g),开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,D的化学反应速率v(D)=0.2mol/(L·min)。请回答:
(1)5min末A的物质的量浓度为_______;
(2)前5min内用B表示的化学反应速率v(B)为_______;
(3)前5min内A的转化率为_______;(转化率是指某一反应物的转化百分率)
(4)化学方程式中n的值为_______;
(5)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min) ②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min) ④v(D)=8mol/(L·min)
其中反应速率最快的是_______(填编号)。
19.i.可逆反应 A(g)+B(g) C(g)+D(g)。下列依据能判断该反应达到平衡的是_______________。
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成 C 和 D 的物质的量相等
ii.“碘钟”实验中,3I-+=+2的反应速率可以用与加入的淀粉溶液显蓝色的时间 t 来度量,t 越小,反应速率越大。某探究性学习小组在 20℃进行实验,得到的数据如下表:
实验编号 ① ② ③ ④ ⑤
c(I-)/mol·L-1 0.040 0.080 0.080 0.160 0.120
c()/mol·L-1 0.040 0.040 0.080 0.020 0.040
t/s 88.0 44.0 22.0 44.0 t1
回答下列问题:
(1)该实验的目的是_______________。
(2)显色时间 t1= _________________。
(3)温度对该反应的反应速率的影响符合一般规律,若在 40℃下进行编号③对应浓度的实验, 显色时间 t2 的范围为________________(填字母).
A . <22.0 s B.22.0 s ~ 44.0s C. >44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是_______________________。
20.乙酰苯胺为无色晶体,具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。实验室常用苯胺与乙酸反应制备乙酰苯胺:
+CH3COOH +H2O
相关的文献数据如下:
物质 密度g/ml 熔点℃ 沸点℃ 溶解性
冰醋酸 1.05 16.6 118 易溶于水
苯胺 1.02 -6 184.4 微溶于水,易氧化
乙酰苯胺 1.21 114.3 305 微溶于冷水,易溶于热水
实验流程如下:
据此回答下列问题:
(1)实验装置中仪器a的名称_________,圆底烧瓶中加入少许锌粉目的是_______,锥形瓶中蒸馏物主要成分是_______(填化学式)。
(2)反应需控制温度在105℃左右的原因是_______,判断反应已基本完全的依据是_______。
(3)粗产品中所含有机杂质主要为_______,进一步提纯的实验方法为_______,证明提纯后的产品为乙酰苯胺的简单实验方法为_______。
(4)计算所得到乙酰苯胺的产率是_______。
【参考答案】
一、选择题
1.D
2.D
3.A
4.C
5.B
6.C
7.B
8.C
9.C
10.A
11.C
12.B
二、非选择题
13.(1)2:5
(2) Ⅰ Ⅱ Ⅰ Ⅲ
(3)浓度
14.(1) 吸热 >
(2)
(3) 吸热
(4) 增大压强(或加入催化剂) 移除部分H2(或降低温度)
15. C C D
16. = 0.05mol/(L·min) 60% 1 a、b
17.5×10 3 = 2.8 0.10 60% 57.5 g·mol 1 减小 向左移动
18.5mol/L 0.2mol/(L min) 25% 2 ①
19. C 探究反应物的浓度对反应速率的影响 29.3 A 反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)
20.(1) 冷凝管 防止苯胺被氧化 H2O
(2) 温度过低不能蒸出反应所生成的水;温度过高未反应的乙酸蒸出 锥形瓶中不再有水增加或牛角管管口不再有水珠滴下
(3) 苯胺 重结晶 测产品熔点为114℃
(4)65%
一、选择题
1.下列体系加压后,对化学反应速率没有明显影响的是
A.2SO2+O2 2SO3 B.I2(g)+H2 2HI C.CO2+H2O H2CO3 D.H++OH- H2O
2.在容积为1L的密闭容器中,投入1molN2和3molH2分别在以下不同实验条件下进行反应。下列分析正确的是
容器编号 实验条件 平衡时反应中的能量变化
Ⅰ 恒温恒容 放热Q1kJ
Ⅱ 恒温恒压 放热Q2kJ
Ⅲ 恒容绝热 放热Q3kJ
A.平衡常数:Ⅱ>Ⅰ B.NH3体积分数:Ⅲ>Ⅰ
C.放出热量:Q1>Q2 D.N2转化率:Ⅱ>Ⅰ
3.已知: 。下列说法正确的是
A.相同条件下,增大,转化率增大
B.当时,反应达到平衡状态
C.该反应是放热反应,因此一定能自发进行
D.该反应的
4.春晚歌曲《可可托海的牧羊人》讲的是牧羊人与养蜂女的爱情故事,欧曲中唱到“我酿的酒喝不醉我自己……我愿意陪你翻过雪山穿越戈壁……”。下面对歌曲中的化学物质分析不正确的是
A.羊毛的主要成分是蛋白质,蜂蜜的主要成分是糖类,二者都是混合物
B.空气中的水汽凝华为雪花是一个放热过程,也是熵减过程
C.酿酒历史源远流长,粮食酿酒只发生了物理变化
D.戈壁滩是指布满了粗沙、砾石等荒漠地带,工业上可用粗沙生产半导体材料硅
5.一定温度下,某氧化物粉尘与C在一密闭容器中进行反应:,的线性关系如图所示(K为平衡常数,pK=-1gK)。
下列说法正确的是
A.加入一定质量的CO,达到新平衡后,m(C)减小
B.温度在2000K时,CO的平衡浓度是10 mol L 1
C.M点时R的消耗速率大于生成速率
D.恒温恒容下,向密闭容器内加入CO,平衡后CO的浓度增大
6.比较合成氨工业与制硫酸中催化氧化的生产过程,下列说法错误的是
A.都使用了合适的催化剂
B.都选择了较高的温度
C.都按化学方程式中的系数进行投料
D.合成氨工业采用了高压生产条件,的催化氧化采用了常压生产条件
7.某探究小组研究的反应速率与浓度的关系。反应速率可通过测定减半所需时间来确定。在一定温度下,获得如下实验数据。
实验序号 初始浓度 减半所需时间t/min
① 0.10 10.0 5.0 10
② 0.10 10.0 2.5 20
③ 0.20 10.0 5.0 5
④ 0.10 5.0 5.0 5
分析以上数据所得出的结论错误的是
A.增大增大 B.增大不变
C.实验①和②的不相等 D.实验③的为
8.下列说法正确的是
A.凡是放热反应都是自发的,由于吸热反应都是非自发的
B.相同物质的量的同种物质气态时熵值最小,固态时熵值最大
C.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
D.恒温恒压下,△H<0且△S>0的反应一定不能自发进行
9.已知反应CO(g)+H2O(g)CO2(g)+H2(g)ΔH<0,在一定温度的密闭容器中,反应达到平衡时,下列叙述正确的是
A.升高温度,H2的浓度增大
B.增大压强,K增大
C.增大CO浓度,H2O的转化率增大
D.更换高效催化剂,可以使该平衡正向移动
10.纳米级 Fe3O4可用于以太阳能为热源分解水制 H2,过程如图所示,下列说法中不正确的是
A.Fe3O4、FeO 两者都是以太阳能为热源分解水制 H2过程中的催化剂
B.过程 I 的反应:2Fe3O46FeO+O2↑
C.过程 I、Ⅱ的总反应:2H2O2H2↑+O2↑
D.整个过程实现了太阳能向化学能的转化
11.下列说法不正确的是
A.、的反应在任何温度下都能自发进行
B.能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.凡是能量达到活化能的分子发生的碰撞均为有效碰撞
D.对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值通常最小
12.将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:。可以判断该分解反应已经达到化学平衡的是
①
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中氨气的体积分数不变
⑤密闭容器中混合气体的平均相对分子质量不变
A.②③⑤ B.②③ C.②③④ D.①②④
二、非选择题
13.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO+H2C2O4+H+ —Mn2++CO2↑+H2O(未配平)。用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
组别 10%硫酸体积/mL 温度/℃ 其他物质
I 2 mL 20
II 2 mL 20 10滴饱和MnSO4溶液
III 2 mL 30
IV 1 mL 20 1 mL蒸馏水
(1)该反应中氧化剂和还原剂的物质的量之比为_______。
(2)如果研究催化剂对化学反应速率的影响,使用实验_______和_______(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验_______和_______。
(3)对比实验I和IV,可以研究_______对化学反应速率的影响。
14.已知化学反应①:,其平衡常数为;化学反应②:,其平衡常数为,在温度973 K和1173 K情况下,、的值分别如下,请填空:
温度
973 K 1.47 2.38
1173 K 2.15 1.67
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应,该反应的_______0 (填“>”“<”或“=”)。
(2)现有反应③:。写出该反应的平衡常数的表达式:_______。
(3)根据反应①与②可推导出、与之间的关系式_______,据此关系式及上表据,也能推断出反应③是_______(填“吸热”或“放热”)反应。
(4)图甲、图乙分别表示反应③在时刻达到平衡,在时刻因改变某个条件而发生变化的情况:
①图甲时刻改变的条件是_______。
②图乙时刻改变的条件是_______。
15.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的转化器,如图所示,按此密闭体系中气体的流向,a、b、d三处流入(流出)的气体分别为_____、_____、______。
A.SO2 B.SO3、O2 C.SO2、O2 D.SO2、SO3、O2
16.CO是生产羰基化学品的基本原料,850℃时,在恒容密闭容器中通入CO和,发生反应:,测定浓度随时间的关系如下表:
0 0.30 0.20
2 0.10
3 0.18
4 0.08
回答下列问题。
(1)时,v(正)___________v(逆)(填“>”、“<”或“=”)。
(2)0~2min,CO的平均反应速率为___________。
(3)反应达到平衡时,的转化率为___________;该温度下反应的平衡常数为___________。
(4)850℃时,在体积可变的密闭容器中,以下表中物质不同的起始浓度进行反应,达到平衡时CO的百分含量与原平衡相同的是___________(填字母序号)。
a 2 1 1 1
b 0.6 0.4 0 0
c 0.2 0 0.1 0.1
d 1 1 1 1
17.在100℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s 0 20 40 60 80
n(NO2)/mol 0.40 n1 0.26 n3 n4
n(N2O4)/mol 0.00 0.05 n2 0.08 0.08
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为__________mol·L 1·s 1。
(2)n3________(填“>”“<”或“=”)n4;该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L 1。
(4)上述(3)达到平衡后N2O4的转化率为______________,混合气体的平均摩尔质量为______________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2 N2O4的平衡常数将_______________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将______________(填“向左移动”“向右移动”或“不移动”)。
18.在容积为2L的密闭容器中进行如下反应:A(g)+2B(g) 3C(g)+nD(g),开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,D的化学反应速率v(D)=0.2mol/(L·min)。请回答:
(1)5min末A的物质的量浓度为_______;
(2)前5min内用B表示的化学反应速率v(B)为_______;
(3)前5min内A的转化率为_______;(转化率是指某一反应物的转化百分率)
(4)化学方程式中n的值为_______;
(5)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min) ②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min) ④v(D)=8mol/(L·min)
其中反应速率最快的是_______(填编号)。
19.i.可逆反应 A(g)+B(g) C(g)+D(g)。下列依据能判断该反应达到平衡的是_______________。
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成 C 和 D 的物质的量相等
ii.“碘钟”实验中,3I-+=+2的反应速率可以用与加入的淀粉溶液显蓝色的时间 t 来度量,t 越小,反应速率越大。某探究性学习小组在 20℃进行实验,得到的数据如下表:
实验编号 ① ② ③ ④ ⑤
c(I-)/mol·L-1 0.040 0.080 0.080 0.160 0.120
c()/mol·L-1 0.040 0.040 0.080 0.020 0.040
t/s 88.0 44.0 22.0 44.0 t1
回答下列问题:
(1)该实验的目的是_______________。
(2)显色时间 t1= _________________。
(3)温度对该反应的反应速率的影响符合一般规律,若在 40℃下进行编号③对应浓度的实验, 显色时间 t2 的范围为________________(填字母).
A . <22.0 s B.22.0 s ~ 44.0s C. >44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是_______________________。
20.乙酰苯胺为无色晶体,具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。实验室常用苯胺与乙酸反应制备乙酰苯胺:
+CH3COOH +H2O
相关的文献数据如下:
物质 密度g/ml 熔点℃ 沸点℃ 溶解性
冰醋酸 1.05 16.6 118 易溶于水
苯胺 1.02 -6 184.4 微溶于水,易氧化
乙酰苯胺 1.21 114.3 305 微溶于冷水,易溶于热水
实验流程如下:
据此回答下列问题:
(1)实验装置中仪器a的名称_________,圆底烧瓶中加入少许锌粉目的是_______,锥形瓶中蒸馏物主要成分是_______(填化学式)。
(2)反应需控制温度在105℃左右的原因是_______,判断反应已基本完全的依据是_______。
(3)粗产品中所含有机杂质主要为_______,进一步提纯的实验方法为_______,证明提纯后的产品为乙酰苯胺的简单实验方法为_______。
(4)计算所得到乙酰苯胺的产率是_______。
【参考答案】
一、选择题
1.D
2.D
3.A
4.C
5.B
6.C
7.B
8.C
9.C
10.A
11.C
12.B
二、非选择题
13.(1)2:5
(2) Ⅰ Ⅱ Ⅰ Ⅲ
(3)浓度
14.(1) 吸热 >
(2)
(3) 吸热
(4) 增大压强(或加入催化剂) 移除部分H2(或降低温度)
15. C C D
16. = 0.05mol/(L·min) 60% 1 a、b
17.5×10 3 = 2.8 0.10 60% 57.5 g·mol 1 减小 向左移动
18.5mol/L 0.2mol/(L min) 25% 2 ①
19. C 探究反应物的浓度对反应速率的影响 29.3 A 反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)
20.(1) 冷凝管 防止苯胺被氧化 H2O
(2) 温度过低不能蒸出反应所生成的水;温度过高未反应的乙酸蒸出 锥形瓶中不再有水增加或牛角管管口不再有水珠滴下
(3) 苯胺 重结晶 测产品熔点为114℃
(4)65%
