【大单元教学】2.2 构成物质的微观粒子 课件--科粤版(2024)化学九年级上册
文档属性
| 名称 | 【大单元教学】2.2 构成物质的微观粒子 课件--科粤版(2024)化学九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 18.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 17:06:47 | ||
图片预览








文档简介
(共82张PPT)
第二单元 空气、物质的构成与组成
课题2 构成物质的微观粒子
(科粤版)九年级
上
01
教学目标
内容总览
02
新知导入
03
探究新知
04
课堂练习
05
课堂总结
06
板书设计
教学目标
理解分子、原子、离子的概念,通过实验现象(如香水扩散)认识分子的运动等性质,明确分子由原子构成。
01
02
了解原子的结构,知道原子核、质子、中子、电子的构成及带电情况,掌握相对原子质量的概念及计算方法。
03
掌握离子的形成过程,通过钠与氯气反应的实验,理解原子得失电子形成离子的原理及离子化合物的形成。
新知导入
本节聚焦
分子;原子;原子结构;相对原子质量;离子;微观视角。
问题探讨
新知导入
对于物质构成的问题,许多科学家进行过长期的探索。现代科学已经证实:物质是由分子、原子等微观粒子构成的。下面我们先来认识分子。
模块一 分子是什么
任务二
分子是什么
探究新知
请大家跟我一起做实验吧~
目的 了解在物理变化和化学变化中分子发生的不同改变。
任务二
分子是什么
探究新知
观察活动
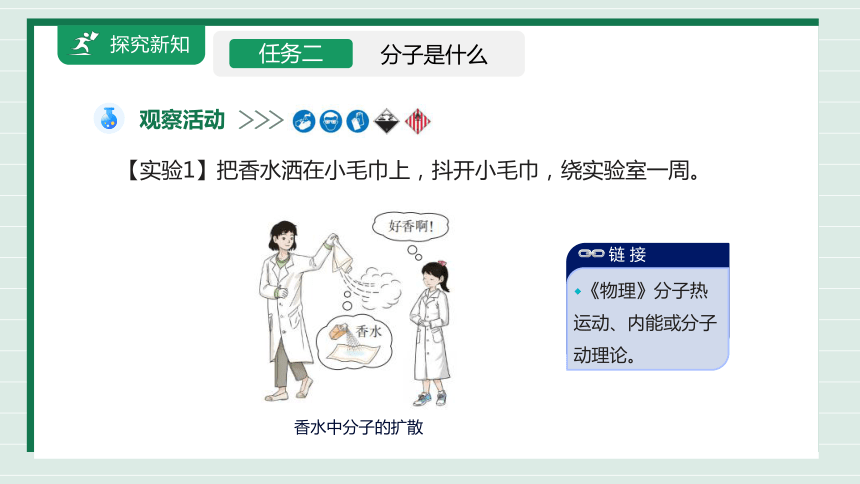
【实验1】把香水洒在小毛巾上,抖开小毛巾,绕实验室一周。
香水中分子的扩散
◆《物理》分子热运动、内能或分子动理论。
链 接
任务二
分子是什么
探究新知
现象:能闻到香水的香味。
问题:为什么我们与小毛巾相隔一段距离,还能闻到香味?
任务二
分子是什么
探究新知
解释: 许多物质由叫作分子的微观粒子构成。在本实验中,所用的香水是由酒精分子和多种香精分子混合在一起构成的。所以,当香水的这些分子通过运动扩散到空气中后,我们就能闻到香水的气味了。
物理变化
任务二
分子是什么
探究新知
观察活动
【实验2】在玻璃管的两端分别放置蘸有浓盐酸和浓氨水的棉花团,塞紧胶塞。
浓盐酸与浓氨水反应
任务二
分子是什么
探究新知
任务二
分子是什么
探究新知
现象:玻璃管内产生大量的白烟。
问题:为什么蘸有浓盐酸和浓氨水的棉花团并没有接触,却会在空中生成浓浓的白烟?
任务二
分子是什么
探究新知
解释:盐酸中挥发出来的氯化氢分子和氨水中挥发出来的氨分子运动到空中相遇,并发生化学变化,生成氯化铵小颗粒,扩散到空中,形成白烟。
任务二
分子是什么
探究新知
讨论:以上两个实验中所发生的变化有什么不同?与同学讨论并填写下表。
问题 实验 1 实验 2
变化中有无新物质生成? 无 有
是物理变化还是化学变化? 物理变化 化学变化
变化中分子本身有无改变 ? 无 有
任务二
分子是什么
探究新知
1. 对比上述两个实验可知:
物理变化中,分子本身不发生改变,仍然保持该物质的化学性质;
化学变化中,分子本身发生改变,生成化学性质与原物质不同的新物质。所以,分子(molecule)是保持物质化学性质的一种微观粒子。
长话短说
任务二
分子是什么
探究新知
分子聚集构成物质
2. 分子是构成物质的一种微观粒子。
不同的分子一定会构成各不相同的物质。
长话短说
任务二
空气有哪些成分
探究新知
从微观的角度区分混合物和纯净物
纯净物:由同种分子构成。
混合物:含有两种或两种以上分子,各种分子相互之间不发生化学反应。
任务二
空气有哪些成分
探究新知
定义:
分子是构成物质的一种微观粒子。
分子本身怎样构成?分子能不能分割?
分子还可以分成更小的微观粒子,这就是原子。
任务二
分子是什么
探究新知
例1、下列物质中,由分子构成的是( )
A. 氯化钠
B. 汞
C. 氧气
D. 金刚石
课堂典例
【答案】C
【解析】A选项氯化钠由钠离子和氯离子构成;B选项汞由汞原子构成;C选项氧气由氧分子构成;D选项金刚石由碳原子构成。
任务二
分子是什么
探究新知
分子具有的特性:
1.分子的质量小,体积小;
2.分子是不断运动的。
3.分子之间有间隔。
湿衣服晾干
例2、下列关于分子的说法正确的是( )
A. 分子是保持物质性质的最小粒子
B. 分子在不停地运动,原子不运动
C. 分子可以再分,原子不能再分
D. 许多物质由分子构成,分子在不断运动扩散
课堂典例
【答案】D
【解析】A选项,分子是保持物质化学性质的最小粒子;B选项,分子和原子都在不停地运动;C选项,在化学变化中分子可分,原子不可分,原子本身还可再分。
模块二 原子是什么
任务三
原子是什么
探究新知
原子的概念最初是由古代哲学家提出的。到了近代,科学家在实验探究的基础上,发展出近代原子学说,并逐渐认清了原子与分子之间的关系。
现在,让我们通过化学变化的实际例子来说明这种关系。
任务三
原子是什么
探究新知
图中是氧化汞受热分解实验的照片。将红色的氧化汞粉末装在试管里加强热,结果红色粉末渐渐变化,试管内壁上出现银光闪闪的水银;同时,还可以收集到能支持燃烧的氧气。可见,氧化汞发生变化了,可用文字表述为:
氧化汞 汞+氧气
(HgO) (Hg) ()
加热
氧化汞受热分解
任务三
原子是什么
探究新知
讨论与交流
1. 在化学变化中,反应物氧化汞分子发生了怎样的变化?构成氧化汞分子的汞原子和氧原子发生了怎样的变化?
2. 反应生成的物质—氧气和汞分别是由什么微观粒子构成的?
任务三
原子是什么
探究新知
1. 在化学变化中,氧化汞分子分解成单个的汞原子和氧原子。构成氧化汞分子的汞原子和氧原子,在反应过程中没有发生变化,它们只是重新组合。因为原子是化学变化中的最小粒子,在化学反应前后原子的种类和数目都不会改变。
2. 反应生成的氧气由氧分子构成,许多氧分子聚集形成氧气;汞由汞原子直接构成 ,大量汞原子聚集成金属汞。
任务三
原子是什么
探究新知
从微观粒子的角度来看,这个变化是怎样发生的呢?请看示意图:
氧化汞分子由氧原子和汞原子构成。图中共有2个氧化汞分子。
在化学变化中,氧化汞分子分解成单个的汞原子和氧原子。图中共有2个汞原子,2个氧原子。
由很多的汞原子直接构成了汞。
两个氧原子结合
成一个氧分子,很多氧分子构成了氧气。
任务三
原子是什么
探究新知
通过上述分析,可以得出以下结论:
(1)在化学变化中,氧化汞分子分解成为汞原子和氧原子。换句话说,氧化汞分子是由汞原子和氧原子构成的。
由此可见:分子由原子构成。
任务三
原子是什么
探究新知
通过上述分析,可以得出以下结论:
(2)有的物质可由原子直接构成,如金属汞是由汞原子直接构成的。
(3)汞原子和氧原子本身在化学变化中没有发生变化,只是组合方式发生改变,它们重新组合后构成新的物质。
金属、稀有气体和多数固态非金属由原子构成
任务三
原子是什么
探究新知
1. 原子(atom)是构成物质的另一种微观粒子。原子构成分子,原子也可直接构成某些物质。
2. 在化学变化中,分子本身发生变化,而原子本身没有发生根本变化,只是重新组合成新分子,构成新物质。所以,原子是化学变化中的最小微观粒子。
长话短说
任务三
原子是什么
探究新知
检查站
学过前面的内容后,你知道空气中物质构成的奥秘了吗?请填写下表。
空气中的物质 构成该物质的分子 构成该分子的原子
氮气() 氮分子 氮原子
氧气() 氧分子 氧原子
二氧化碳() 二氧化碳分子 碳原子和氧原子
水蒸气(O) 水分子 氢原子和氧原子
稀有气体 [ 氦(He)、氖(Ne)、氩(Ar)等 ] 它们由相应的原子直接构成物质
任务三
原子是什么
探究新知
特点:
原子也在不断地运动着。
原子非常小,小到在 1 cm 的长度上可以并排约 1 亿个原子。
利用现代技术仪器观察到原子的图像。
扫描隧道显微镜(STM)观察到的石墨样品在纳米( 察到的石墨样品在纳米(nmnm)尺寸上的 )尺寸上的图像,每个黄色的小点代表一个碳原子
任务三
原子是什么
探究新知
分 子 原 子
概念
本质区别 相同点 联 系 ①都是构成物质的微观粒子,都可以直接构成物质,都能保持各自微观粒子构成的物质的化学性质。
分子是保持物质化学性质的一种微观粒子
原子是化学变化中的最小微观粒子
在化学变化中,分子可以再分,而原子不能再分
分子与原子的区别
②质量和体积都很小,微观粒子间都有间隔,微观粒子都在不断地运动。
分子可分解成原子,原子可重新组合构成分子
任务三
原子是什么
探究新知
原子非常非常小,那么它是不是构成物质世界的最小微观粒子呢?原子内部有什么奥秘呢?为了揭示原子内部的秘密,科学家进行了长期的科学探索。
任务三
原子是什么
探究新知
科学家对原子结构的探究历程
1808年,道尔顿认为原子是一个不可再分的实心球体;
1897年,汤姆孙发现了电子;
1904年,汤姆孙提出了原子的“枣糕模型”;
1911年,卢瑟福提出了有核原子模型;
1913年,玻尔改进了卢瑟福的模型;
现在的原子结构模型——电子云模型比玻尔模型又有很大的改进。
知识视窗
不同时期的原子模型
任务三
原子是什么
探究新知
现代科学已经知道:
1. 原子由原子核(atomic nucleus)和核外运动的电子(electron)构成。
2. 原子核由一定数目的质子(proton) 和 中子(neutron)构成。
3. 每个质子带一个单位正电荷,每个电子带一个单位负电荷,中子不带电(如图 )。
原子结构示意图
任务三
原子是什么
探究新知
讨论与交流
观察下表列出的几种常见原子内部微观粒子的数目,从中你得到什么结论?
原子 原子核 核外 电子数 原子 原子核 核外
电子数
质子数 中子数 质子数 中子数 氢 1 0 1 氧 8 8 8
氦 2 2 2 钠 11 12 11
碳 6 6 6 氯 17 18 17
氮 7 7 7 铁 26 30 26
几种常见原子的构成
任务三
原子是什么
探究新知
结论
1. 质子数与核外电子数关系:在原子中,质子数等于核外电子数 ,原子整体呈电中性。例如氢原子质子数为1,核外电子数也为1;氧原子质子数是8,核外电子数同样是8 。
2. 质子数与中子数关系:质子数不一定等于中子数 。如氢原子质子数为1,中子数为0 ;钠原子质子数是11,中子数为12 。
3. 不同原子区别:不同种类的原子,质子数不同 。氢原子质子数为1 ,氧原子质子数为8 ,这是区分不同原子的重要依据。
任务三
原子是什么
探究新知
通过表分析可知:同一种原子,原子核中的质子数和核外电子数相等。因为它们所带电荷的电量相等且电性相反,故整个原子不显电性。
任务三
原子是什么
探究新知
长话短说
原子
(不显电性)
原子核
(带正电)
核外电子
(带负电)
质子
中子
(每个电子带1个单位
的负电荷)
(不带电)
(每个质子带1个单位的正电荷)
核电荷数=质子数=核外电子数
所带的正电荷数称为核电荷数
任务三
原子是什么
探究新知
知识视窗
原子结构示意图
第一层
第二层
第三层(最外层)
弧线表示
数字1也可以表示
弧线上的数字表示
电子层
各电子层上的电子数
最外层电子数
任务三
原子是什么
探究新知
知识视窗
用原子结构示意图表示原子结构
科学家们为了形象直观、简便地表示原子的内部结构,设计了原子结构示意图(如图)。
原子核外电子排布有如下规律:
1. 原子核外第一层(从离核近的电子层算起)最多排 2 个电子,第二层最多排 8 个电子。
2. 最外层最多不超过8个电子,达到8个电子的惰性状态是稀有气体的稳定结构(第一层 2 个电子为稳定结构),如氦、氖、氩等。
3. 金属原子最外层的电子一般少于 4 个,在反应中较易失去电子,趋向于里层的稳定结构;非金属原子最外层的电子一般多于 4 个,在反应中较易得到电子,趋向于本层的稳定结构。
任务三
原子是什么
探究新知
原子结构示意图
任务三
原子是什么
探究新知
原子的结构特点:
原子很小,原子核更小。
原子核外广阔的空间内做高速运动。
原子核虽然很小,但整个原子的质量几乎都集中在原子核上,这是因为每个质子和中子的质量,都大约等于 1 个氢原子的质量,而电子的质量仅仅约等于质子质量的 1 / 1836。那么,原子的质量又有多大呢?
原子与原子核相对大小的形象比较
任务三
原子是什么
探究新知
原子具有的特性:
1.原子的质量小,体积小;
2.原子在化学变化中不可分,但可重新组合。
原子重新组合
例3、原子是由( )构成的。
A. 质子和电子
B. 质子和中子
C. 原子核和核外电子
D. 中子和电子
课堂典例
【答案】C
【解析】原子由原子核和核外运动的电子构成,原子核由质子和中子构成 。 故本题答案为:C。
例4、下列关于原子结构的说法正确的是( )
A. 原子的质量主要集中在电子上
B. 原子核内质子数一定等于中子数
C. 原子中质子数等于电子数
D. 原子核由质子、中子和电子构成
课堂典例
【答案】C
【解析】A选项,原子的质量主要集中在原子核上;B选项,原子核内质子数不一定等于中子数;D选项,原子核由质子和中子构成。 故本题答案为:C。
模块三 原子的质量有多大
任务四
原子的质量有多大
探究新知
原子虽小,但仍然具有一定的质量,而且各种原子的质量是不相同的。
例如,氢原子的质量只有 1.674× kg;
碳原子的质量只有1.993× kg。
原子的质量非常小
任务四
原子的质量有多大
探究新知
当你看到用千克表示的原子质量后,一定会觉得如此小的数值运算起来太不方便了吧!的确如此。于是,科学家用另一种方法来衡量原子的质量。
任务四
原子的质量有多大
探究新知
科学家的方法是把原子核里含质子、中子各 6 个的碳原子(碳-12)的质量分为 12 等份,则其中一份的质量为:
= =1.661×kg。
以此为准,把其他原子的质量与 1.661×10-27 kg 相比较所得到的比值,称为该原子的相对原子质量。计算公式是:
相对原子质量==
任务四
原子的质量有多大
探究新知
例 氧原子的相对原子质量=≈16.00
为了便于理解,请看图的形象表示:
相对原子质量的标准
任务四
原子的质量有多大
探究新知
讨论与交流
请用上述的方法计算下列三种常见微观粒子的相对原子质量或相对质量。
几种常见微观粒子 质量质量 / kg 相对原子质量 / 相对质量(取整数)
铁原子 9.288× ≈56
质子 1.672 6× ≈1
中子 1.6749× ≈1
任务四
原子的质量有多大
探究新知
构成原子的微观粒子中,与质子、中子相比,电子的质量很小。根据这 些数据,结合表中提供的常见原子的质子数、中子数和核外电子数,你认为相对原子质量的数值与原子的质子数和中子数有什么关系?
因为电子质量相较于质子、中子极小,可忽略不计 ,原子质量几乎全部集中在原子核(由质子和中子构成 )上。质子和中子的相对质量都约为1 ,所以相对原子质量的数值约等于质子数与中子数之和,即
相对原子质量≈质子数 + 中子数
任务四
原子的质量有多大
探究新知
以一种碳原子(碳-12)质量的 1/12 作为标准,把其他原子的质量与这个标准相比较所得到的比值,称为这种原子的相对原子质量。
长话短说
相对原子质量==
≈质子数 + 中子数
任务四
原子的质量有多大
探究新知
检查站
下列说法正确吗?如果有错,应如何改正?
1. 一个碳原子的质量为 1.993×kg,所以碳的相对原子质量为1.993×kg。
2. 氢的相对原子质量为 1,所以氢的原子质量为 1 g。
3. 相对原子质量和原子质量间没有相互关系。
4. 相对原子质量只是一个比值。
任务四
原子的质量有多大
探究新知
检查站
1. 一个碳原子的质量为 1.993×kg,所以碳的相对原子质量为1.993×kg。(×)
分析:相对原子质量是以一种碳原子(碳 - 12)质量的1/12为标准,其他原子的质量跟它相比较所得到的比,单位是“1”,不是“kg” 。碳的相对原子质量是将一个碳原子质量与一个碳 - 12原子质量的1/12相比得到的数值,约为12 。
改正:一个碳原子的质量为1.993×kg ,碳的相对原子质量约为12(单位为“1” ,通常省略不写 )。
任务四
原子的质量有多大
探究新知
检查站
2. 氢的相对原子质量为 1,所以氢的原子质量为1g。(×)
分析:氢的相对原子质量为1 ,表示氢原子质量与一个碳 - 12原子质量的1/12相比的比值为1 ;而氢原子质量是实际质量,单位是kg ,不是g ,且数值远小于1g 。
改正:氢的相对原子质量为1 ,氢原子质量约为1.67×kg 。
任务四
原子的质量有多大
探究新知
检查站
3. 相对原子质量和原子质量间没有相互关系。(×)
分析:相对原子质量是根据原子质量来确定的,原子质量越大,其相对原子质量越大 。相对原子质量=,二者有密切联系。
改正:相对原子质量是根据原子质量,以一种碳原子(碳 - 12)质量的1/12为标准进行计算得到的比值,二者有密切关系 。
任务四
原子的质量有多大
探究新知
检查站
4. 相对原子质量只是一个比值。(√)
相对原子质量是以一种碳原子(碳 - 12)质量的1/12为标准,其他原子的质量跟它相比较所得到的比,是一个比值 ,单位是“1” 。
例5、 相对原子质量的标准是( )
A. 一个碳原子的质量
B. 一个碳 - 12原子质量的1/12
C. 一个氢原子的质量
D. 一个氧原子质量的1/16
课堂典例
【答案】B
【解析】相对原子质量是以一种碳原子(碳 - 12)质量的1/12为标准,其他原子的质量跟它相比较所得到的比。所以选B。
任务四
原子的质量有多大
探究新知
知识视窗
张青莲院士的贡献
中国科学院院士张青莲教授(1908—2006)是无机化学领域的杰出专家。他对原子量(又称相对原子质量)的测定做出了卓越贡献,于 1983 年当选为国际纯粹与应用化学联合会原子量与同位素丰度委员会衔称委员。他主持测定的铟、铱、锑、铕、铈、铒、锗、锌、钐、镝等原子量新值被采用为国际新标准。
张青莲
模块四 离子怎样形成
任务五
离子怎样形成
探究新知
你已经知道,原子不显电性。在化学变化中,一些原子容易失去电子,而另一些原子则容易得到电子,当原子得到或失去核外电子从而带上电荷以后,便转变成离子(ion)。
任务五
离子怎样形成
探究新知
让我们来观察一个有核外电子得失,从而使原子变成离子的化学反应, 那就是金属钠与氯气的反应。
目的 观察钠在氯气中燃烧
任务五
离子怎样形成
探究新知
观察活动
【实验】把装满氯气的集气瓶倒扣于加热至熔化的金属钠上,你观察到什么现象?
钠在氯气中燃烧
任务五
离子怎样形成
探究新知
现象:加热至熔化的钠在氯气中剧烈燃烧,产生黄色火焰,集气瓶内生成大量白烟 。
结论:实验中生成的白烟实际上是一种白色的固体小颗粒,它的化学名称叫氯化钠,就是我们日常生活中用到的食盐的主要成分。
任务五
离子怎样形成
探究新知
钠原子与氯原子是怎样生成氯化钠的呢?
任务五
离子怎样形成
探究新知
当点燃的钠与氯气相遇时,氯气的分子()分成单个的氯原子(Cl),与钠原子(Na)发生了下述变化:
如图,钠原子失去1个电子,变成带1个单位正电荷的钠离子(像这样带正电的原子叫阳离子),氯原子则得到1个电子,变成带1个单位负电荷的氯离子 (,像这样带负电的原子叫阴离子),阴、阳离子相互作用结合成氯化钠(NaCl)。生成的氯化钠是由数目极多的钠离子和氯离子相互结合而构成的物质。像氯化钠这样的物质,是由离子构成的。由此可见:离子也是构成物质的一种微观粒子。
任务五
离子怎样形成
探究新知
任务五
离子怎样形成
探究新知
物质是由微观粒子构成的
我们可以从分子、原子等微观视角认识物质。
长话短说
课堂总结
例6、 下列关于离子的说法正确的是( )
A. 离子都是带电的原子
B. 原子得到电子形成阳离子
C. 离子中质子数一定不等于电子数
D. 氯化钠由氯化钠离子构成
课堂典例
【答案】C
【解析】A选项,离子是带电的原子或原子团;B选项,原子得到电子形成阴离子;D选项,氯化钠由钠离子和氯离子构成。
所以选C。
板书设计
构成物质的微观粒子
1. 分子 构成:许多物质由分子构成。
性质:分子在不断运动;分子间有间隔。
实验:香水扩散、浓盐酸与浓氨水反应。
2. 原子 构成:由原子核和核外电子构成,原子核由质子和中子构成。
性质:原子质量小;原子在化学变化中不可分,但可重新组合。
实验:氧化汞受热分解。
3. 原子的 表示方法:相对原子质量(以碳 - 12原子质量的1/12为标准)。
质量 计算公式:相对原子质量=原子的实际质量÷(碳-12原子质量×1/12)
4. 离子 形成:原子得失电子形成离子。
分类:阳离子(失去电子)、阴离子(得到电子)。
实例:钠与氯气反应,钠原子失电子成钠离子,氯原子得电子成氯离子。
模块五 练习与实践
1、下列关于原子结构的说法正确的是( )
A. 原子的质量主要集中在电子上
B. 原子核内质子数一定等于中子数
C. 原子中质子数等于电子数
D. 原子核由质子、中子和电子构成
课堂典例
【答案】C
【解析】A选项,原子的质量主要集中在原子核上;B选项,原子核内质子数不一定等于中子数;D选项,原子核由质子和中子构成。故选C。
2、某原子的原子核内有11个质子和12个中子,该原子的核外电子数为( )
A. 1
B. 11
C. 12
D. 23
【答案】B
【解析】在原子中,质子数 = 核外电子数,已知该原子核内有11个质子,所以核外电子数为11。故选B。
分层作业
3、已知碳 -12原子的质量为akg,某原子的质量为bkg,则该原子的相对原子质量为( )
A. b/a
B. a/b
C. 12b/a
D. 12a/b
课堂典例
【答案】C
【解析】根据相对原子质量的定义,该原子的相对原子质量 = = = 12b/a。 故选C。
https://www.21cnjy.com/help/help_extract.php
让备课更有效
www.21cnjy.com
Thanks!
第二单元 空气、物质的构成与组成
课题2 构成物质的微观粒子
(科粤版)九年级
上
01
教学目标
内容总览
02
新知导入
03
探究新知
04
课堂练习
05
课堂总结
06
板书设计
教学目标
理解分子、原子、离子的概念,通过实验现象(如香水扩散)认识分子的运动等性质,明确分子由原子构成。
01
02
了解原子的结构,知道原子核、质子、中子、电子的构成及带电情况,掌握相对原子质量的概念及计算方法。
03
掌握离子的形成过程,通过钠与氯气反应的实验,理解原子得失电子形成离子的原理及离子化合物的形成。
新知导入
本节聚焦
分子;原子;原子结构;相对原子质量;离子;微观视角。
问题探讨
新知导入
对于物质构成的问题,许多科学家进行过长期的探索。现代科学已经证实:物质是由分子、原子等微观粒子构成的。下面我们先来认识分子。
模块一 分子是什么
任务二
分子是什么
探究新知
请大家跟我一起做实验吧~
目的 了解在物理变化和化学变化中分子发生的不同改变。
任务二
分子是什么
探究新知
观察活动
【实验1】把香水洒在小毛巾上,抖开小毛巾,绕实验室一周。
香水中分子的扩散
◆《物理》分子热运动、内能或分子动理论。
链 接
任务二
分子是什么
探究新知
现象:能闻到香水的香味。
问题:为什么我们与小毛巾相隔一段距离,还能闻到香味?
任务二
分子是什么
探究新知
解释: 许多物质由叫作分子的微观粒子构成。在本实验中,所用的香水是由酒精分子和多种香精分子混合在一起构成的。所以,当香水的这些分子通过运动扩散到空气中后,我们就能闻到香水的气味了。
物理变化
任务二
分子是什么
探究新知
观察活动
【实验2】在玻璃管的两端分别放置蘸有浓盐酸和浓氨水的棉花团,塞紧胶塞。
浓盐酸与浓氨水反应
任务二
分子是什么
探究新知
任务二
分子是什么
探究新知
现象:玻璃管内产生大量的白烟。
问题:为什么蘸有浓盐酸和浓氨水的棉花团并没有接触,却会在空中生成浓浓的白烟?
任务二
分子是什么
探究新知
解释:盐酸中挥发出来的氯化氢分子和氨水中挥发出来的氨分子运动到空中相遇,并发生化学变化,生成氯化铵小颗粒,扩散到空中,形成白烟。
任务二
分子是什么
探究新知
讨论:以上两个实验中所发生的变化有什么不同?与同学讨论并填写下表。
问题 实验 1 实验 2
变化中有无新物质生成? 无 有
是物理变化还是化学变化? 物理变化 化学变化
变化中分子本身有无改变 ? 无 有
任务二
分子是什么
探究新知
1. 对比上述两个实验可知:
物理变化中,分子本身不发生改变,仍然保持该物质的化学性质;
化学变化中,分子本身发生改变,生成化学性质与原物质不同的新物质。所以,分子(molecule)是保持物质化学性质的一种微观粒子。
长话短说
任务二
分子是什么
探究新知
分子聚集构成物质
2. 分子是构成物质的一种微观粒子。
不同的分子一定会构成各不相同的物质。
长话短说
任务二
空气有哪些成分
探究新知
从微观的角度区分混合物和纯净物
纯净物:由同种分子构成。
混合物:含有两种或两种以上分子,各种分子相互之间不发生化学反应。
任务二
空气有哪些成分
探究新知
定义:
分子是构成物质的一种微观粒子。
分子本身怎样构成?分子能不能分割?
分子还可以分成更小的微观粒子,这就是原子。
任务二
分子是什么
探究新知
例1、下列物质中,由分子构成的是( )
A. 氯化钠
B. 汞
C. 氧气
D. 金刚石
课堂典例
【答案】C
【解析】A选项氯化钠由钠离子和氯离子构成;B选项汞由汞原子构成;C选项氧气由氧分子构成;D选项金刚石由碳原子构成。
任务二
分子是什么
探究新知
分子具有的特性:
1.分子的质量小,体积小;
2.分子是不断运动的。
3.分子之间有间隔。
湿衣服晾干
例2、下列关于分子的说法正确的是( )
A. 分子是保持物质性质的最小粒子
B. 分子在不停地运动,原子不运动
C. 分子可以再分,原子不能再分
D. 许多物质由分子构成,分子在不断运动扩散
课堂典例
【答案】D
【解析】A选项,分子是保持物质化学性质的最小粒子;B选项,分子和原子都在不停地运动;C选项,在化学变化中分子可分,原子不可分,原子本身还可再分。
模块二 原子是什么
任务三
原子是什么
探究新知
原子的概念最初是由古代哲学家提出的。到了近代,科学家在实验探究的基础上,发展出近代原子学说,并逐渐认清了原子与分子之间的关系。
现在,让我们通过化学变化的实际例子来说明这种关系。
任务三
原子是什么
探究新知
图中是氧化汞受热分解实验的照片。将红色的氧化汞粉末装在试管里加强热,结果红色粉末渐渐变化,试管内壁上出现银光闪闪的水银;同时,还可以收集到能支持燃烧的氧气。可见,氧化汞发生变化了,可用文字表述为:
氧化汞 汞+氧气
(HgO) (Hg) ()
加热
氧化汞受热分解
任务三
原子是什么
探究新知
讨论与交流
1. 在化学变化中,反应物氧化汞分子发生了怎样的变化?构成氧化汞分子的汞原子和氧原子发生了怎样的变化?
2. 反应生成的物质—氧气和汞分别是由什么微观粒子构成的?
任务三
原子是什么
探究新知
1. 在化学变化中,氧化汞分子分解成单个的汞原子和氧原子。构成氧化汞分子的汞原子和氧原子,在反应过程中没有发生变化,它们只是重新组合。因为原子是化学变化中的最小粒子,在化学反应前后原子的种类和数目都不会改变。
2. 反应生成的氧气由氧分子构成,许多氧分子聚集形成氧气;汞由汞原子直接构成 ,大量汞原子聚集成金属汞。
任务三
原子是什么
探究新知
从微观粒子的角度来看,这个变化是怎样发生的呢?请看示意图:
氧化汞分子由氧原子和汞原子构成。图中共有2个氧化汞分子。
在化学变化中,氧化汞分子分解成单个的汞原子和氧原子。图中共有2个汞原子,2个氧原子。
由很多的汞原子直接构成了汞。
两个氧原子结合
成一个氧分子,很多氧分子构成了氧气。
任务三
原子是什么
探究新知
通过上述分析,可以得出以下结论:
(1)在化学变化中,氧化汞分子分解成为汞原子和氧原子。换句话说,氧化汞分子是由汞原子和氧原子构成的。
由此可见:分子由原子构成。
任务三
原子是什么
探究新知
通过上述分析,可以得出以下结论:
(2)有的物质可由原子直接构成,如金属汞是由汞原子直接构成的。
(3)汞原子和氧原子本身在化学变化中没有发生变化,只是组合方式发生改变,它们重新组合后构成新的物质。
金属、稀有气体和多数固态非金属由原子构成
任务三
原子是什么
探究新知
1. 原子(atom)是构成物质的另一种微观粒子。原子构成分子,原子也可直接构成某些物质。
2. 在化学变化中,分子本身发生变化,而原子本身没有发生根本变化,只是重新组合成新分子,构成新物质。所以,原子是化学变化中的最小微观粒子。
长话短说
任务三
原子是什么
探究新知
检查站
学过前面的内容后,你知道空气中物质构成的奥秘了吗?请填写下表。
空气中的物质 构成该物质的分子 构成该分子的原子
氮气() 氮分子 氮原子
氧气() 氧分子 氧原子
二氧化碳() 二氧化碳分子 碳原子和氧原子
水蒸气(O) 水分子 氢原子和氧原子
稀有气体 [ 氦(He)、氖(Ne)、氩(Ar)等 ] 它们由相应的原子直接构成物质
任务三
原子是什么
探究新知
特点:
原子也在不断地运动着。
原子非常小,小到在 1 cm 的长度上可以并排约 1 亿个原子。
利用现代技术仪器观察到原子的图像。
扫描隧道显微镜(STM)观察到的石墨样品在纳米( 察到的石墨样品在纳米(nmnm)尺寸上的 )尺寸上的图像,每个黄色的小点代表一个碳原子
任务三
原子是什么
探究新知
分 子 原 子
概念
本质区别 相同点 联 系 ①都是构成物质的微观粒子,都可以直接构成物质,都能保持各自微观粒子构成的物质的化学性质。
分子是保持物质化学性质的一种微观粒子
原子是化学变化中的最小微观粒子
在化学变化中,分子可以再分,而原子不能再分
分子与原子的区别
②质量和体积都很小,微观粒子间都有间隔,微观粒子都在不断地运动。
分子可分解成原子,原子可重新组合构成分子
任务三
原子是什么
探究新知
原子非常非常小,那么它是不是构成物质世界的最小微观粒子呢?原子内部有什么奥秘呢?为了揭示原子内部的秘密,科学家进行了长期的科学探索。
任务三
原子是什么
探究新知
科学家对原子结构的探究历程
1808年,道尔顿认为原子是一个不可再分的实心球体;
1897年,汤姆孙发现了电子;
1904年,汤姆孙提出了原子的“枣糕模型”;
1911年,卢瑟福提出了有核原子模型;
1913年,玻尔改进了卢瑟福的模型;
现在的原子结构模型——电子云模型比玻尔模型又有很大的改进。
知识视窗
不同时期的原子模型
任务三
原子是什么
探究新知
现代科学已经知道:
1. 原子由原子核(atomic nucleus)和核外运动的电子(electron)构成。
2. 原子核由一定数目的质子(proton) 和 中子(neutron)构成。
3. 每个质子带一个单位正电荷,每个电子带一个单位负电荷,中子不带电(如图 )。
原子结构示意图
任务三
原子是什么
探究新知
讨论与交流
观察下表列出的几种常见原子内部微观粒子的数目,从中你得到什么结论?
原子 原子核 核外 电子数 原子 原子核 核外
电子数
质子数 中子数 质子数 中子数 氢 1 0 1 氧 8 8 8
氦 2 2 2 钠 11 12 11
碳 6 6 6 氯 17 18 17
氮 7 7 7 铁 26 30 26
几种常见原子的构成
任务三
原子是什么
探究新知
结论
1. 质子数与核外电子数关系:在原子中,质子数等于核外电子数 ,原子整体呈电中性。例如氢原子质子数为1,核外电子数也为1;氧原子质子数是8,核外电子数同样是8 。
2. 质子数与中子数关系:质子数不一定等于中子数 。如氢原子质子数为1,中子数为0 ;钠原子质子数是11,中子数为12 。
3. 不同原子区别:不同种类的原子,质子数不同 。氢原子质子数为1 ,氧原子质子数为8 ,这是区分不同原子的重要依据。
任务三
原子是什么
探究新知
通过表分析可知:同一种原子,原子核中的质子数和核外电子数相等。因为它们所带电荷的电量相等且电性相反,故整个原子不显电性。
任务三
原子是什么
探究新知
长话短说
原子
(不显电性)
原子核
(带正电)
核外电子
(带负电)
质子
中子
(每个电子带1个单位
的负电荷)
(不带电)
(每个质子带1个单位的正电荷)
核电荷数=质子数=核外电子数
所带的正电荷数称为核电荷数
任务三
原子是什么
探究新知
知识视窗
原子结构示意图
第一层
第二层
第三层(最外层)
弧线表示
数字1也可以表示
弧线上的数字表示
电子层
各电子层上的电子数
最外层电子数
任务三
原子是什么
探究新知
知识视窗
用原子结构示意图表示原子结构
科学家们为了形象直观、简便地表示原子的内部结构,设计了原子结构示意图(如图)。
原子核外电子排布有如下规律:
1. 原子核外第一层(从离核近的电子层算起)最多排 2 个电子,第二层最多排 8 个电子。
2. 最外层最多不超过8个电子,达到8个电子的惰性状态是稀有气体的稳定结构(第一层 2 个电子为稳定结构),如氦、氖、氩等。
3. 金属原子最外层的电子一般少于 4 个,在反应中较易失去电子,趋向于里层的稳定结构;非金属原子最外层的电子一般多于 4 个,在反应中较易得到电子,趋向于本层的稳定结构。
任务三
原子是什么
探究新知
原子结构示意图
任务三
原子是什么
探究新知
原子的结构特点:
原子很小,原子核更小。
原子核外广阔的空间内做高速运动。
原子核虽然很小,但整个原子的质量几乎都集中在原子核上,这是因为每个质子和中子的质量,都大约等于 1 个氢原子的质量,而电子的质量仅仅约等于质子质量的 1 / 1836。那么,原子的质量又有多大呢?
原子与原子核相对大小的形象比较
任务三
原子是什么
探究新知
原子具有的特性:
1.原子的质量小,体积小;
2.原子在化学变化中不可分,但可重新组合。
原子重新组合
例3、原子是由( )构成的。
A. 质子和电子
B. 质子和中子
C. 原子核和核外电子
D. 中子和电子
课堂典例
【答案】C
【解析】原子由原子核和核外运动的电子构成,原子核由质子和中子构成 。 故本题答案为:C。
例4、下列关于原子结构的说法正确的是( )
A. 原子的质量主要集中在电子上
B. 原子核内质子数一定等于中子数
C. 原子中质子数等于电子数
D. 原子核由质子、中子和电子构成
课堂典例
【答案】C
【解析】A选项,原子的质量主要集中在原子核上;B选项,原子核内质子数不一定等于中子数;D选项,原子核由质子和中子构成。 故本题答案为:C。
模块三 原子的质量有多大
任务四
原子的质量有多大
探究新知
原子虽小,但仍然具有一定的质量,而且各种原子的质量是不相同的。
例如,氢原子的质量只有 1.674× kg;
碳原子的质量只有1.993× kg。
原子的质量非常小
任务四
原子的质量有多大
探究新知
当你看到用千克表示的原子质量后,一定会觉得如此小的数值运算起来太不方便了吧!的确如此。于是,科学家用另一种方法来衡量原子的质量。
任务四
原子的质量有多大
探究新知
科学家的方法是把原子核里含质子、中子各 6 个的碳原子(碳-12)的质量分为 12 等份,则其中一份的质量为:
= =1.661×kg。
以此为准,把其他原子的质量与 1.661×10-27 kg 相比较所得到的比值,称为该原子的相对原子质量。计算公式是:
相对原子质量==
任务四
原子的质量有多大
探究新知
例 氧原子的相对原子质量=≈16.00
为了便于理解,请看图的形象表示:
相对原子质量的标准
任务四
原子的质量有多大
探究新知
讨论与交流
请用上述的方法计算下列三种常见微观粒子的相对原子质量或相对质量。
几种常见微观粒子 质量质量 / kg 相对原子质量 / 相对质量(取整数)
铁原子 9.288× ≈56
质子 1.672 6× ≈1
中子 1.6749× ≈1
任务四
原子的质量有多大
探究新知
构成原子的微观粒子中,与质子、中子相比,电子的质量很小。根据这 些数据,结合表中提供的常见原子的质子数、中子数和核外电子数,你认为相对原子质量的数值与原子的质子数和中子数有什么关系?
因为电子质量相较于质子、中子极小,可忽略不计 ,原子质量几乎全部集中在原子核(由质子和中子构成 )上。质子和中子的相对质量都约为1 ,所以相对原子质量的数值约等于质子数与中子数之和,即
相对原子质量≈质子数 + 中子数
任务四
原子的质量有多大
探究新知
以一种碳原子(碳-12)质量的 1/12 作为标准,把其他原子的质量与这个标准相比较所得到的比值,称为这种原子的相对原子质量。
长话短说
相对原子质量==
≈质子数 + 中子数
任务四
原子的质量有多大
探究新知
检查站
下列说法正确吗?如果有错,应如何改正?
1. 一个碳原子的质量为 1.993×kg,所以碳的相对原子质量为1.993×kg。
2. 氢的相对原子质量为 1,所以氢的原子质量为 1 g。
3. 相对原子质量和原子质量间没有相互关系。
4. 相对原子质量只是一个比值。
任务四
原子的质量有多大
探究新知
检查站
1. 一个碳原子的质量为 1.993×kg,所以碳的相对原子质量为1.993×kg。(×)
分析:相对原子质量是以一种碳原子(碳 - 12)质量的1/12为标准,其他原子的质量跟它相比较所得到的比,单位是“1”,不是“kg” 。碳的相对原子质量是将一个碳原子质量与一个碳 - 12原子质量的1/12相比得到的数值,约为12 。
改正:一个碳原子的质量为1.993×kg ,碳的相对原子质量约为12(单位为“1” ,通常省略不写 )。
任务四
原子的质量有多大
探究新知
检查站
2. 氢的相对原子质量为 1,所以氢的原子质量为1g。(×)
分析:氢的相对原子质量为1 ,表示氢原子质量与一个碳 - 12原子质量的1/12相比的比值为1 ;而氢原子质量是实际质量,单位是kg ,不是g ,且数值远小于1g 。
改正:氢的相对原子质量为1 ,氢原子质量约为1.67×kg 。
任务四
原子的质量有多大
探究新知
检查站
3. 相对原子质量和原子质量间没有相互关系。(×)
分析:相对原子质量是根据原子质量来确定的,原子质量越大,其相对原子质量越大 。相对原子质量=,二者有密切联系。
改正:相对原子质量是根据原子质量,以一种碳原子(碳 - 12)质量的1/12为标准进行计算得到的比值,二者有密切关系 。
任务四
原子的质量有多大
探究新知
检查站
4. 相对原子质量只是一个比值。(√)
相对原子质量是以一种碳原子(碳 - 12)质量的1/12为标准,其他原子的质量跟它相比较所得到的比,是一个比值 ,单位是“1” 。
例5、 相对原子质量的标准是( )
A. 一个碳原子的质量
B. 一个碳 - 12原子质量的1/12
C. 一个氢原子的质量
D. 一个氧原子质量的1/16
课堂典例
【答案】B
【解析】相对原子质量是以一种碳原子(碳 - 12)质量的1/12为标准,其他原子的质量跟它相比较所得到的比。所以选B。
任务四
原子的质量有多大
探究新知
知识视窗
张青莲院士的贡献
中国科学院院士张青莲教授(1908—2006)是无机化学领域的杰出专家。他对原子量(又称相对原子质量)的测定做出了卓越贡献,于 1983 年当选为国际纯粹与应用化学联合会原子量与同位素丰度委员会衔称委员。他主持测定的铟、铱、锑、铕、铈、铒、锗、锌、钐、镝等原子量新值被采用为国际新标准。
张青莲
模块四 离子怎样形成
任务五
离子怎样形成
探究新知
你已经知道,原子不显电性。在化学变化中,一些原子容易失去电子,而另一些原子则容易得到电子,当原子得到或失去核外电子从而带上电荷以后,便转变成离子(ion)。
任务五
离子怎样形成
探究新知
让我们来观察一个有核外电子得失,从而使原子变成离子的化学反应, 那就是金属钠与氯气的反应。
目的 观察钠在氯气中燃烧
任务五
离子怎样形成
探究新知
观察活动
【实验】把装满氯气的集气瓶倒扣于加热至熔化的金属钠上,你观察到什么现象?
钠在氯气中燃烧
任务五
离子怎样形成
探究新知
现象:加热至熔化的钠在氯气中剧烈燃烧,产生黄色火焰,集气瓶内生成大量白烟 。
结论:实验中生成的白烟实际上是一种白色的固体小颗粒,它的化学名称叫氯化钠,就是我们日常生活中用到的食盐的主要成分。
任务五
离子怎样形成
探究新知
钠原子与氯原子是怎样生成氯化钠的呢?
任务五
离子怎样形成
探究新知
当点燃的钠与氯气相遇时,氯气的分子()分成单个的氯原子(Cl),与钠原子(Na)发生了下述变化:
如图,钠原子失去1个电子,变成带1个单位正电荷的钠离子(像这样带正电的原子叫阳离子),氯原子则得到1个电子,变成带1个单位负电荷的氯离子 (,像这样带负电的原子叫阴离子),阴、阳离子相互作用结合成氯化钠(NaCl)。生成的氯化钠是由数目极多的钠离子和氯离子相互结合而构成的物质。像氯化钠这样的物质,是由离子构成的。由此可见:离子也是构成物质的一种微观粒子。
任务五
离子怎样形成
探究新知
任务五
离子怎样形成
探究新知
物质是由微观粒子构成的
我们可以从分子、原子等微观视角认识物质。
长话短说
课堂总结
例6、 下列关于离子的说法正确的是( )
A. 离子都是带电的原子
B. 原子得到电子形成阳离子
C. 离子中质子数一定不等于电子数
D. 氯化钠由氯化钠离子构成
课堂典例
【答案】C
【解析】A选项,离子是带电的原子或原子团;B选项,原子得到电子形成阴离子;D选项,氯化钠由钠离子和氯离子构成。
所以选C。
板书设计
构成物质的微观粒子
1. 分子 构成:许多物质由分子构成。
性质:分子在不断运动;分子间有间隔。
实验:香水扩散、浓盐酸与浓氨水反应。
2. 原子 构成:由原子核和核外电子构成,原子核由质子和中子构成。
性质:原子质量小;原子在化学变化中不可分,但可重新组合。
实验:氧化汞受热分解。
3. 原子的 表示方法:相对原子质量(以碳 - 12原子质量的1/12为标准)。
质量 计算公式:相对原子质量=原子的实际质量÷(碳-12原子质量×1/12)
4. 离子 形成:原子得失电子形成离子。
分类:阳离子(失去电子)、阴离子(得到电子)。
实例:钠与氯气反应,钠原子失电子成钠离子,氯原子得电子成氯离子。
模块五 练习与实践
1、下列关于原子结构的说法正确的是( )
A. 原子的质量主要集中在电子上
B. 原子核内质子数一定等于中子数
C. 原子中质子数等于电子数
D. 原子核由质子、中子和电子构成
课堂典例
【答案】C
【解析】A选项,原子的质量主要集中在原子核上;B选项,原子核内质子数不一定等于中子数;D选项,原子核由质子和中子构成。故选C。
2、某原子的原子核内有11个质子和12个中子,该原子的核外电子数为( )
A. 1
B. 11
C. 12
D. 23
【答案】B
【解析】在原子中,质子数 = 核外电子数,已知该原子核内有11个质子,所以核外电子数为11。故选B。
分层作业
3、已知碳 -12原子的质量为akg,某原子的质量为bkg,则该原子的相对原子质量为( )
A. b/a
B. a/b
C. 12b/a
D. 12a/b
课堂典例
【答案】C
【解析】根据相对原子质量的定义,该原子的相对原子质量 = = = 12b/a。 故选C。
https://www.21cnjy.com/help/help_extract.php
让备课更有效
www.21cnjy.com
Thanks!
同课章节目录
