浙江省精诚联盟2024-2025学年高三下学期5月适应性联考化学试卷(含答案)
文档属性
| 名称 | 浙江省精诚联盟2024-2025学年高三下学期5月适应性联考化学试卷(含答案) | 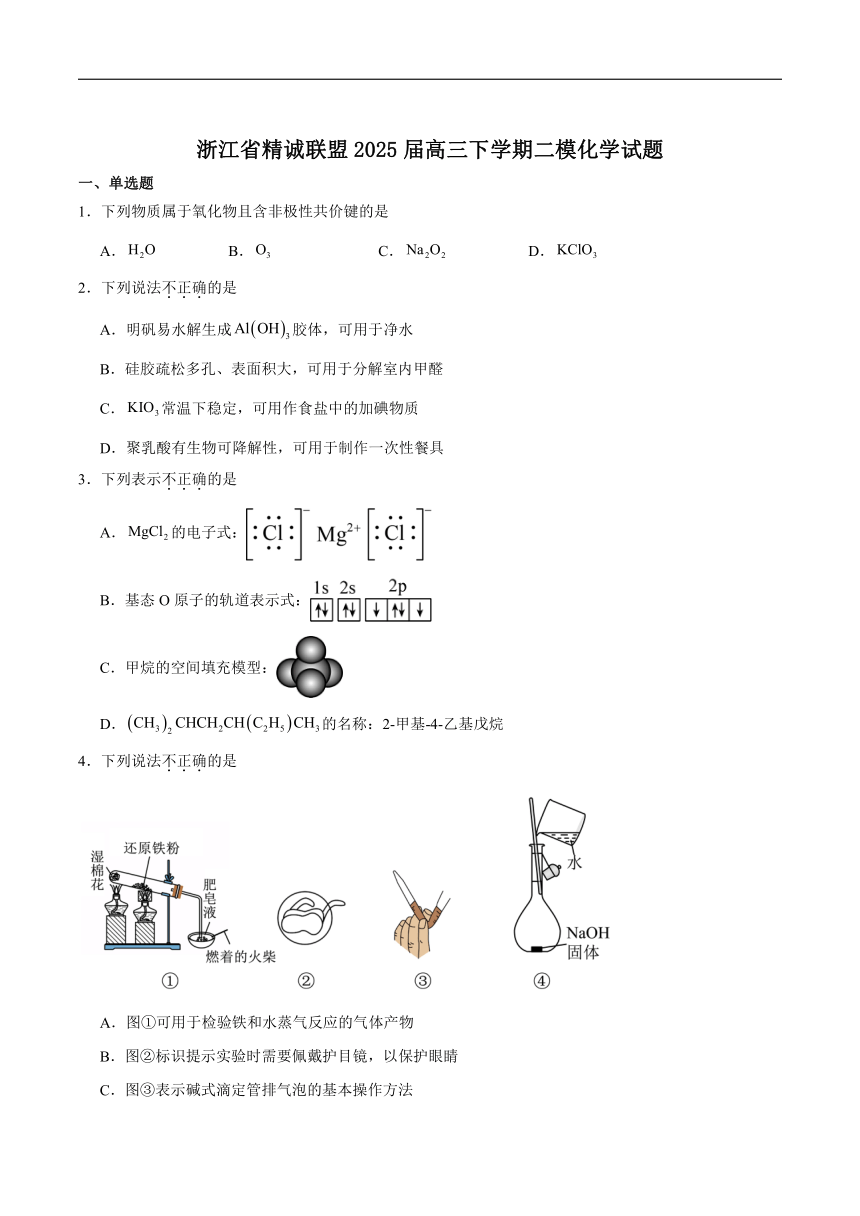 | |
| 格式 | docx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-17 22:48:19 | ||
图片预览




文档简介
浙江省精诚联盟2025届高三下学期二模化学试题
一、单选题
1.下列物质属于氧化物且含非极性共价键的是
A. B. C. D.
2.下列说法不正确的是
A.明矾易水解生成胶体,可用于净水
B.硅胶疏松多孔、表面积大,可用于分解室内甲醛
C.常温下稳定,可用作食盐中的加碘物质
D.聚乳酸有生物可降解性,可用于制作一次性餐具
3.下列表示不正确的是
A.的电子式:
B.基态O原子的轨道表示式:
C.甲烷的空间填充模型:
D.的名称:2-甲基-4-乙基戊烷
4.下列说法不正确的是
A.图①可用于检验铁和水蒸气反应的气体产物
B.图②标识提示实验时需要佩戴护目镜,以保护眼睛
C.图③表示碱式滴定管排气泡的基本操作方法
D.图④可用于实验室配制一定物质的量浓度的溶液
5.化学与人类社会息息相关。下列说法不正确的是
A.石油通过裂化和裂解,可由链状烃转化为苯、甲苯等环状烃
B.烟花的色彩五彩斑斓,是利用了钠、铜、钾等金属元素的焰色
C.油脂能水解,与氢氧化钠溶液共热可制备甘油和高级脂肪酸钠
D.制备银、汞的单质,可以采用直接加热分解氧化银、氧化汞的方式
6.金属铜与浓盐酸共热时可得到亚铜合三氯酸。下列说法不正确的是
A.中Cu的化合价+1 B.既是氧化产物,又是还原产物
C.HCl在反应中表现了氧化性和酸性 D.可能是一种弱酸,不存在离子键
7.下列结构或性质内容不能说明对应用途的是
A.氮气中氮氮三键的键能大,可用作保护气
B.维生素C具有还原性,可用作食品抗氧化剂
C.单晶硅为空间网状结构,可用作信息工业的半导体材料
D.羧基属于亲水基,接入纤维素等高分子材料能提高其吸水性能
8.下列方程式不正确的是
A.苯酚钠溶液通少量后变浑浊:
B.含少量的乙炔气体通入溶液:
C.向AgCl悬浊液中加入浓的KI溶液:
D.足量通入溶有的饱和食盐水:
9.为阿伏加德罗常数的值,下列说法不正确的是
A.4.6g金属钠与足量的水反应,转移的电子总数为
B.标准状况下,中含有键的数目为
C.溶液中和的总数小于
D.常温常压下,3.0g含甲醛的甲酸甲酯中含有的原子总数为
10.乙酰水杨酸()是阿司匹林片的有效成分。某化学小组设计了如下实验方案:
下列说法不正确的是
A.现象Ⅰ和现象2对应溶液的颜色是红色、紫色
B.操作Ⅰ使用研钵研碎样品,有助于加速样品的溶解
C.操作Ⅱ中稀硫酸可促进酯基的水解,本实验中不宜用溶液替代
D.操作Ⅲ是为了中和产物的羧基以及过量的硫酸,否则不易检出酚羟基
11.X、Y、Z、W、M、N为原子序数依次增大的前四周期元素,其中X与M、Z与N均位于同一主族,X和Y的原子序数之和等于的核外电子总数,化合物可用作化学电源的电解质。下列叙述正确的是
A.电负性:Y>Z>X B.键角:
C.气态氢化物的稳定性:Z>W>N D.第一电离能:Y>X>M
12.库伦仪可根据电路中消耗的电量来测定工业废气中含量,装置如图。测定前电解质溶液中与的比值保持恒定,电解池不工作;通入一定量待测气,其中溶解并还原,库伦仪便立即工作至与比值重新恢复到原定值。下列说法不正确的是
A.a电极连接直流电源的正极
B.库伦仪工作时,b电极上有气泡生成
C.若废气中含有等氧化性气体,会导致测定结果偏高
D.发生反应的离子方程式为
13.某化合物的化学式为,下列说法不正确的是
A.晶体类型为离子晶体
B.该化合物的阴离子中含有极性共价键
C.该化合物可能与发生非氧化还原反应
D.该化合物加入到含少量石蕊的水中时有气泡生成,溶液会变蓝
14.在一定条件下,化合物A可转变为己内酰胺E,该反应的主要途径如下:
下列说法不正确的是
A.化合物A存在杂化的碳原子 B.化合物B为该反应的催化剂
C.化合物C与D互为同分异构体 D.化合物E可发生氧化、水解和缩聚反应
15.25℃时,,。将等体积、浓度均为溶液与新制溶液混合,无明显现象;再滴加过量溶液,振荡,出现白色沉淀。下列说法不正确的是
A.饱和溶液中
B.
C.
D.白色沉淀的主要成因是
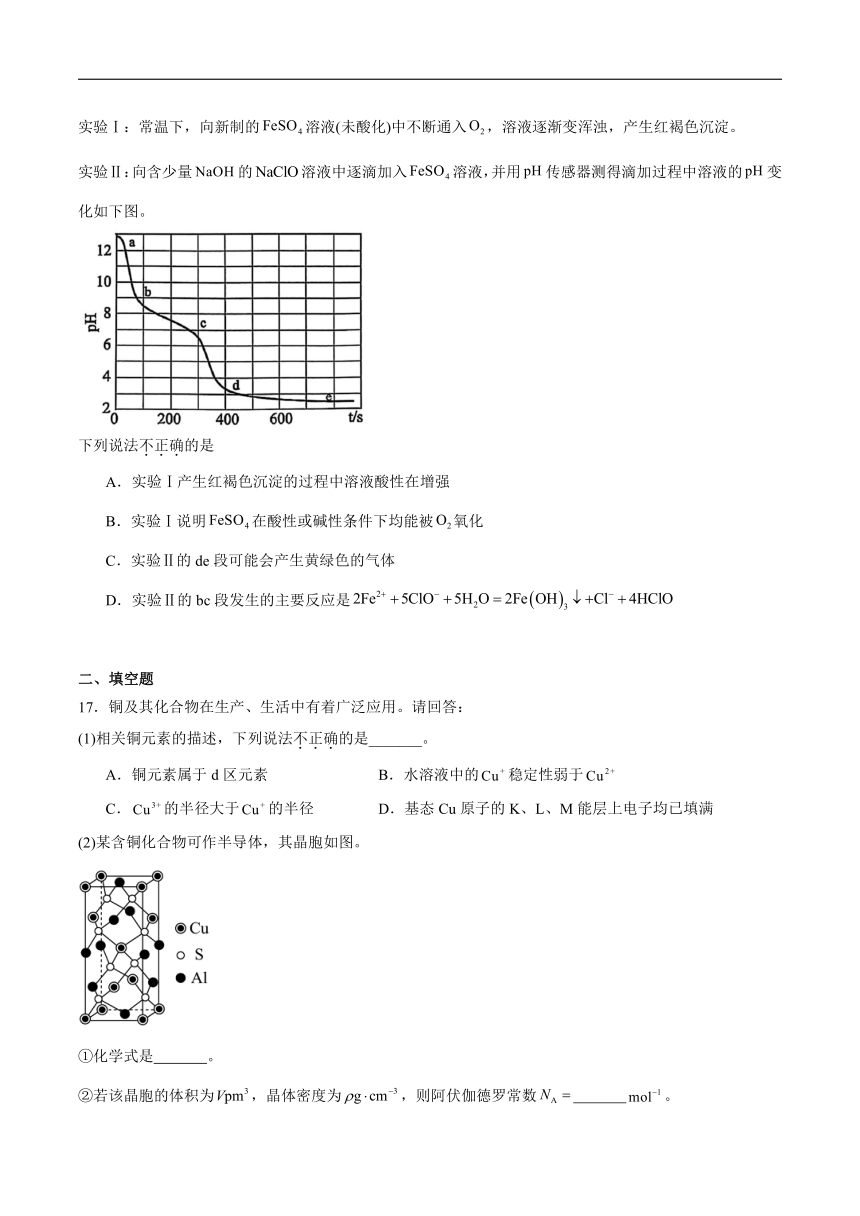
16.某兴趣小组为探究溶液的化学性质,设计如下实验:
实验Ⅰ:常温下,向新制的溶液(未酸化)中不断通入,溶液逐渐变浑浊,产生红褐色沉淀。
实验Ⅱ:向含少量的溶液中逐滴加入溶液,并用传感器测得滴加过程中溶液的变化如下图。
下列说法不正确的是
A.实验Ⅰ产生红褐色沉淀的过程中溶液酸性在增强
B.实验Ⅰ说明在酸性或碱性条件下均能被氧化
C.实验Ⅱ的de段可能会产生黄绿色的气体
D.实验Ⅱ的bc段发生的主要反应是
二、填空题
17.铜及其化合物在生产、生活中有着广泛应用。请回答:
(1)相关铜元素的描述,下列说法不正确的是_______。
A.铜元素属于d区元素 B.水溶液中的稳定性弱于
C.的半径大于的半径 D.基态Cu原子的K、L、M能层上电子均已填满
(2)某含铜化合物可作半导体,其晶胞如图。
①化学式是 。
②若该晶胞的体积为,晶体密度为,则阿伏伽德罗常数 。
③少量该化合物溶于,能明显增强HF溶液酸性,原因是 [已知]。
(3)兴趣小组对某铜铅灰(主要成分为及其硫酸盐)进行资源回收利用,设计了以下流程:
①溶液A是 ,操作B是 ,操作E是 。
②“充分反应”过程涉及的氧化还原反应的化学方程式是 。
③溶液D中通入,可生成沉淀,该转化反应中体现的性质是 。
三、解答题
18.氢是清洁能源,氢能的利用包括了制氢、储氢和用氢等环节。请回答:
(1)氢化铝钾()水解制氢:。
该反应自发进行的条件是 。
(2)我国的制氢总量位居世界首位,工业上甲烷水蒸气重整制氢的反应为:
(ⅰ);(ⅱ)。
①可改变平衡转化率的因素是 。
A.升高温度 B.增大投料比
C.加入催化剂 D.加入三苄胺
②室温下,用溶液吸收该重整气中的,当溶液中时,溶液 [已知]。
③在T℃、恒定压强p条件下,向反应体系中按比例投料,达到平衡时的转化率为x,且,则反应(ⅱ)的平衡常数 (用含x的式子表示)。
(3)储氢:;。一定温度下,若向溶液中分别通入,相同时间时测得溶液中浓度随温度的变化如图。试分析,温度70℃~90℃间溶液中浓度会下降且低于溶液的原因是 。
(4)利用燃料电池产生电能是氢能高效利用的途径之一、某熔融碳酸盐介质的氢氧燃料电池的工作原理如图2所示,其负极上的电极反应式是 。
19.氮化钡()是医药和材料科学的重要中间体。某实验小组利用如图装置(部分固定装置略)进行制备:
已知:①制备原理为:;
②氮化钡为黄色固体,沸点1000℃,极易与水反应生成氨气和氢氧化钡。
请回答:
(1)仪器X的名称是 ,其中可用的固体中性干燥剂是 (填1种)。
(2)有同学认为虚线框内的装置Y部分需要改进,理由是 。
(3)下列有关说法正确的是_______。
A.相比于其他液体,用Hg液封不易引起倒吸
B.镍舟可用铂舟或瓷舟等替换
C.浓除干燥作用外,也可用来观察并调控鼓入的速率
D.该实验反应完全时,反应物金属光泽消失,并由银白色转变为黄色
(4)制备氮化钡的所有操作具体如下,请排序: 。
⑦→_______→_______→_______→_______→_______→_______→⑧(填序号)。
①通入 ②关闭管式炉并冷却至室温
③停止通入 ④打开
⑤填装试剂与药品 ⑥加热管式炉
⑦装置连接并检查气密性 ⑧关闭
(5)利用化学方法定性检验反应后固体中的氮化钡,实验方案为 。
(6)用天平称量反应前后玻璃管中固体的质量,实际增重值总是大于理论值,可能的原因是 。
20.贝利司他(商品名Beleodaq)是一种抗T细胞淋巴瘤药物。某研究小组按以下路线合成该化合物(部分反应条件及试剂已简化):
已知:
请回答:
(1)化合物A中的官能团名称是 。
(2)化合物B的结构简式是 。
(3)下列说法正确的是_______。
A.化合物X的碱性比氨气强
B.化合物F既可与酸反应又可与碱反应
C.①②③④的主要有机反应类型均是取代反应
D.贝利司他可形成分子间氢键
(4)D+X→E的化学方程式是 。
(5)化合物C可由Y()直接制备。写出4个同时符合下列条件的化合物Y的同分异构体的结构简式 。
①能与银氨溶液反应生成光亮银镜的芳香族化合物;
②核磁共振氢谱表明:分子中有3种不同化学环境的氢原子。
(6)以化合物A、乙醇和甲醇为有机原料,设计化合物Y的合成路线(用流程图表示,无机试剂任选) 。
参考答案
1.C
2.B
3.D
4.D
5.A
6.B
7.C
8.A
9.C
10.D
11.D
12.C
13.B
14.D
15.A
16.B
17.(1)AC
(2) 能与等形成配离子,从而促进HF的电离
(3) 过滤 结晶、过滤、洗涤、干燥 还原性和酸性
18.(1)任意温度
(2) ABD 9.7
(3)温度高于70℃后溶液中分解;分解后溶液中比溶液小,反应速率较慢
(4)
19.(1) 球形干燥管 等
(2)Hg极易挥发,敞口实验会污染环境
(3)ACD
(4)⑤④①⑥②③
(5)取少量固体样品,加蒸馏水,在试管口放一张润湿的试纸,若变蓝则说明含氮化钡
(6)中含有少量,导致产物中混入BaO、等;称量操作动作过慢,导致产物部分水解
20.(1)醛基
(2)
(3)BCD
(4)
(5)、、、、
(6)
一、单选题
1.下列物质属于氧化物且含非极性共价键的是
A. B. C. D.
2.下列说法不正确的是
A.明矾易水解生成胶体,可用于净水
B.硅胶疏松多孔、表面积大,可用于分解室内甲醛
C.常温下稳定,可用作食盐中的加碘物质
D.聚乳酸有生物可降解性,可用于制作一次性餐具
3.下列表示不正确的是
A.的电子式:
B.基态O原子的轨道表示式:
C.甲烷的空间填充模型:
D.的名称:2-甲基-4-乙基戊烷
4.下列说法不正确的是
A.图①可用于检验铁和水蒸气反应的气体产物
B.图②标识提示实验时需要佩戴护目镜,以保护眼睛
C.图③表示碱式滴定管排气泡的基本操作方法
D.图④可用于实验室配制一定物质的量浓度的溶液
5.化学与人类社会息息相关。下列说法不正确的是
A.石油通过裂化和裂解,可由链状烃转化为苯、甲苯等环状烃
B.烟花的色彩五彩斑斓,是利用了钠、铜、钾等金属元素的焰色
C.油脂能水解,与氢氧化钠溶液共热可制备甘油和高级脂肪酸钠
D.制备银、汞的单质,可以采用直接加热分解氧化银、氧化汞的方式
6.金属铜与浓盐酸共热时可得到亚铜合三氯酸。下列说法不正确的是
A.中Cu的化合价+1 B.既是氧化产物,又是还原产物
C.HCl在反应中表现了氧化性和酸性 D.可能是一种弱酸,不存在离子键
7.下列结构或性质内容不能说明对应用途的是
A.氮气中氮氮三键的键能大,可用作保护气
B.维生素C具有还原性,可用作食品抗氧化剂
C.单晶硅为空间网状结构,可用作信息工业的半导体材料
D.羧基属于亲水基,接入纤维素等高分子材料能提高其吸水性能
8.下列方程式不正确的是
A.苯酚钠溶液通少量后变浑浊:
B.含少量的乙炔气体通入溶液:
C.向AgCl悬浊液中加入浓的KI溶液:
D.足量通入溶有的饱和食盐水:
9.为阿伏加德罗常数的值,下列说法不正确的是
A.4.6g金属钠与足量的水反应,转移的电子总数为
B.标准状况下,中含有键的数目为
C.溶液中和的总数小于
D.常温常压下,3.0g含甲醛的甲酸甲酯中含有的原子总数为
10.乙酰水杨酸()是阿司匹林片的有效成分。某化学小组设计了如下实验方案:
下列说法不正确的是
A.现象Ⅰ和现象2对应溶液的颜色是红色、紫色
B.操作Ⅰ使用研钵研碎样品,有助于加速样品的溶解
C.操作Ⅱ中稀硫酸可促进酯基的水解,本实验中不宜用溶液替代
D.操作Ⅲ是为了中和产物的羧基以及过量的硫酸,否则不易检出酚羟基
11.X、Y、Z、W、M、N为原子序数依次增大的前四周期元素,其中X与M、Z与N均位于同一主族,X和Y的原子序数之和等于的核外电子总数,化合物可用作化学电源的电解质。下列叙述正确的是
A.电负性:Y>Z>X B.键角:
C.气态氢化物的稳定性:Z>W>N D.第一电离能:Y>X>M
12.库伦仪可根据电路中消耗的电量来测定工业废气中含量,装置如图。测定前电解质溶液中与的比值保持恒定,电解池不工作;通入一定量待测气,其中溶解并还原,库伦仪便立即工作至与比值重新恢复到原定值。下列说法不正确的是
A.a电极连接直流电源的正极
B.库伦仪工作时,b电极上有气泡生成
C.若废气中含有等氧化性气体,会导致测定结果偏高
D.发生反应的离子方程式为
13.某化合物的化学式为,下列说法不正确的是
A.晶体类型为离子晶体
B.该化合物的阴离子中含有极性共价键
C.该化合物可能与发生非氧化还原反应
D.该化合物加入到含少量石蕊的水中时有气泡生成,溶液会变蓝
14.在一定条件下,化合物A可转变为己内酰胺E,该反应的主要途径如下:
下列说法不正确的是
A.化合物A存在杂化的碳原子 B.化合物B为该反应的催化剂
C.化合物C与D互为同分异构体 D.化合物E可发生氧化、水解和缩聚反应
15.25℃时,,。将等体积、浓度均为溶液与新制溶液混合,无明显现象;再滴加过量溶液,振荡,出现白色沉淀。下列说法不正确的是
A.饱和溶液中
B.
C.
D.白色沉淀的主要成因是
16.某兴趣小组为探究溶液的化学性质,设计如下实验:
实验Ⅰ:常温下,向新制的溶液(未酸化)中不断通入,溶液逐渐变浑浊,产生红褐色沉淀。
实验Ⅱ:向含少量的溶液中逐滴加入溶液,并用传感器测得滴加过程中溶液的变化如下图。
下列说法不正确的是
A.实验Ⅰ产生红褐色沉淀的过程中溶液酸性在增强
B.实验Ⅰ说明在酸性或碱性条件下均能被氧化
C.实验Ⅱ的de段可能会产生黄绿色的气体
D.实验Ⅱ的bc段发生的主要反应是
二、填空题
17.铜及其化合物在生产、生活中有着广泛应用。请回答:
(1)相关铜元素的描述,下列说法不正确的是_______。
A.铜元素属于d区元素 B.水溶液中的稳定性弱于
C.的半径大于的半径 D.基态Cu原子的K、L、M能层上电子均已填满
(2)某含铜化合物可作半导体,其晶胞如图。
①化学式是 。
②若该晶胞的体积为,晶体密度为,则阿伏伽德罗常数 。
③少量该化合物溶于,能明显增强HF溶液酸性,原因是 [已知]。
(3)兴趣小组对某铜铅灰(主要成分为及其硫酸盐)进行资源回收利用,设计了以下流程:
①溶液A是 ,操作B是 ,操作E是 。
②“充分反应”过程涉及的氧化还原反应的化学方程式是 。
③溶液D中通入,可生成沉淀,该转化反应中体现的性质是 。
三、解答题
18.氢是清洁能源,氢能的利用包括了制氢、储氢和用氢等环节。请回答:
(1)氢化铝钾()水解制氢:。
该反应自发进行的条件是 。
(2)我国的制氢总量位居世界首位,工业上甲烷水蒸气重整制氢的反应为:
(ⅰ);(ⅱ)。
①可改变平衡转化率的因素是 。
A.升高温度 B.增大投料比
C.加入催化剂 D.加入三苄胺
②室温下,用溶液吸收该重整气中的,当溶液中时,溶液 [已知]。
③在T℃、恒定压强p条件下,向反应体系中按比例投料,达到平衡时的转化率为x,且,则反应(ⅱ)的平衡常数 (用含x的式子表示)。
(3)储氢:;。一定温度下,若向溶液中分别通入,相同时间时测得溶液中浓度随温度的变化如图。试分析,温度70℃~90℃间溶液中浓度会下降且低于溶液的原因是 。
(4)利用燃料电池产生电能是氢能高效利用的途径之一、某熔融碳酸盐介质的氢氧燃料电池的工作原理如图2所示,其负极上的电极反应式是 。
19.氮化钡()是医药和材料科学的重要中间体。某实验小组利用如图装置(部分固定装置略)进行制备:
已知:①制备原理为:;
②氮化钡为黄色固体,沸点1000℃,极易与水反应生成氨气和氢氧化钡。
请回答:
(1)仪器X的名称是 ,其中可用的固体中性干燥剂是 (填1种)。
(2)有同学认为虚线框内的装置Y部分需要改进,理由是 。
(3)下列有关说法正确的是_______。
A.相比于其他液体,用Hg液封不易引起倒吸
B.镍舟可用铂舟或瓷舟等替换
C.浓除干燥作用外,也可用来观察并调控鼓入的速率
D.该实验反应完全时,反应物金属光泽消失,并由银白色转变为黄色
(4)制备氮化钡的所有操作具体如下,请排序: 。
⑦→_______→_______→_______→_______→_______→_______→⑧(填序号)。
①通入 ②关闭管式炉并冷却至室温
③停止通入 ④打开
⑤填装试剂与药品 ⑥加热管式炉
⑦装置连接并检查气密性 ⑧关闭
(5)利用化学方法定性检验反应后固体中的氮化钡,实验方案为 。
(6)用天平称量反应前后玻璃管中固体的质量,实际增重值总是大于理论值,可能的原因是 。
20.贝利司他(商品名Beleodaq)是一种抗T细胞淋巴瘤药物。某研究小组按以下路线合成该化合物(部分反应条件及试剂已简化):
已知:
请回答:
(1)化合物A中的官能团名称是 。
(2)化合物B的结构简式是 。
(3)下列说法正确的是_______。
A.化合物X的碱性比氨气强
B.化合物F既可与酸反应又可与碱反应
C.①②③④的主要有机反应类型均是取代反应
D.贝利司他可形成分子间氢键
(4)D+X→E的化学方程式是 。
(5)化合物C可由Y()直接制备。写出4个同时符合下列条件的化合物Y的同分异构体的结构简式 。
①能与银氨溶液反应生成光亮银镜的芳香族化合物;
②核磁共振氢谱表明:分子中有3种不同化学环境的氢原子。
(6)以化合物A、乙醇和甲醇为有机原料,设计化合物Y的合成路线(用流程图表示,无机试剂任选) 。
参考答案
1.C
2.B
3.D
4.D
5.A
6.B
7.C
8.A
9.C
10.D
11.D
12.C
13.B
14.D
15.A
16.B
17.(1)AC
(2) 能与等形成配离子,从而促进HF的电离
(3) 过滤 结晶、过滤、洗涤、干燥 还原性和酸性
18.(1)任意温度
(2) ABD 9.7
(3)温度高于70℃后溶液中分解;分解后溶液中比溶液小,反应速率较慢
(4)
19.(1) 球形干燥管 等
(2)Hg极易挥发,敞口实验会污染环境
(3)ACD
(4)⑤④①⑥②③
(5)取少量固体样品,加蒸馏水,在试管口放一张润湿的试纸,若变蓝则说明含氮化钡
(6)中含有少量,导致产物中混入BaO、等;称量操作动作过慢,导致产物部分水解
20.(1)醛基
(2)
(3)BCD
(4)
(5)、、、、
(6)
同课章节目录
