(网络参考版)云南省2025年高考真题化学试卷(无答案)
文档属性
| 名称 | (网络参考版)云南省2025年高考真题化学试卷(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-18 13:56:30 | ||
图片预览

文档简介
2025年普通高中学业水平选择性考试 云南卷
化学
注意事项:
1.答卷前,考生务必用黑色碳素笔将自己的姓名、准考证号、考场号、座位号填写在答题卡上,并认真核准条形码上的姓名、准考证号、考场号、座位号及科目,在规定的位置贴好条形码。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,用黑色碳素笔将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 F 19 Na 23 S 32 Cl 35.5 Mn 55 Fe 56 Cu 64 Sb 122
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.画中有“化”,多彩中华。下列叙述正确的是( )
A.岩彩壁画颜料所用贝壳粉,主要成分属于硅酸盐
B.油画颜料调和剂所用核桃油,属于有机高分子
C.竹胎漆画颜料赭石的主要成分氧化铁,耐酸、碱
D.水墨画墨汁的主要成分碳,常温不易被氧化
2.下列化学用语或图示表示正确的是( )
A.的VSEPR模型:
B.的电子式:
C.Cl的原子结构示意图:
D.溶于水的电离方程式:
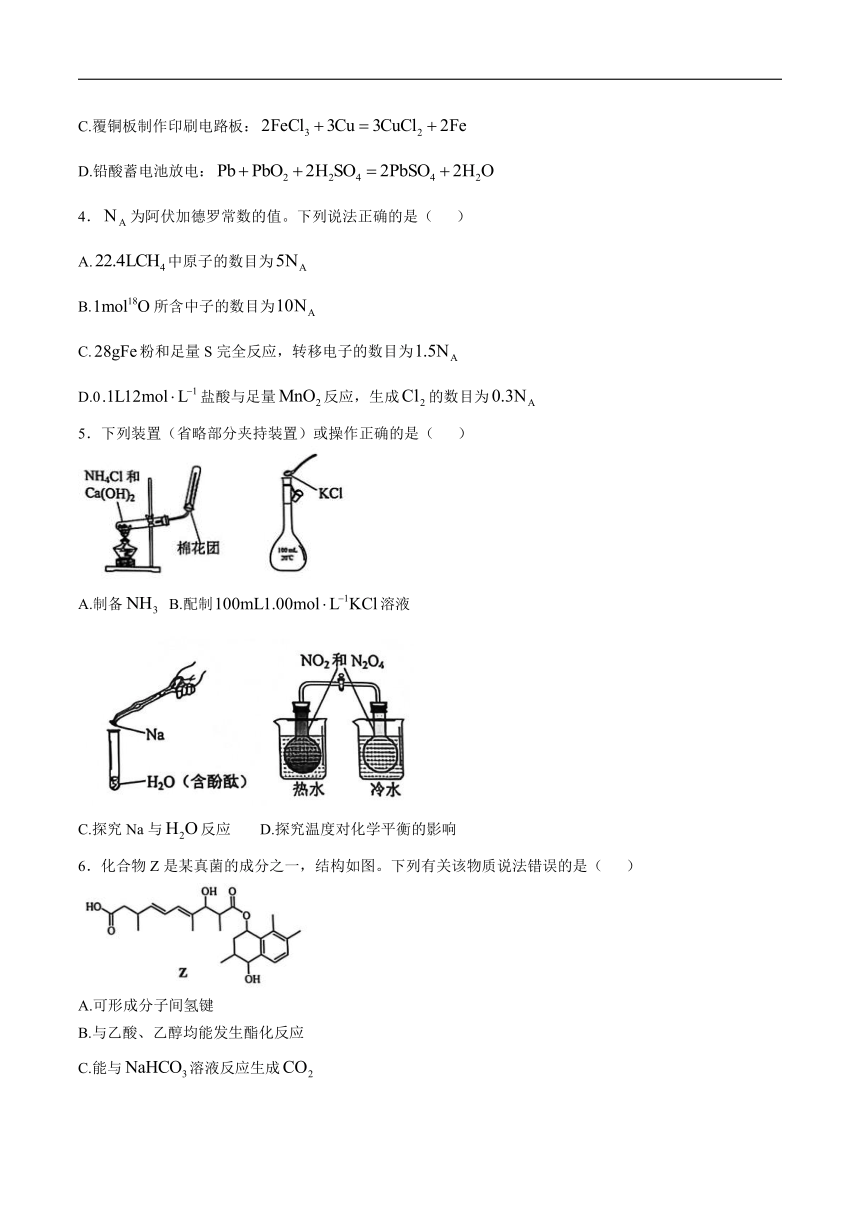
3.下列化学方程式错误的是( )
A.煤制水煤气:
B.供氧:
C.覆铜板制作印刷电路板:
D.铅酸蓄电池放电:
4.为阿伏加德罗常数的值。下列说法正确的是( )
A.中原子的数目为
B.所含中子的数目为
C.粉和足量S完全反应,转移电子的数目为
D.0盐酸与足量反应,生成的数目为
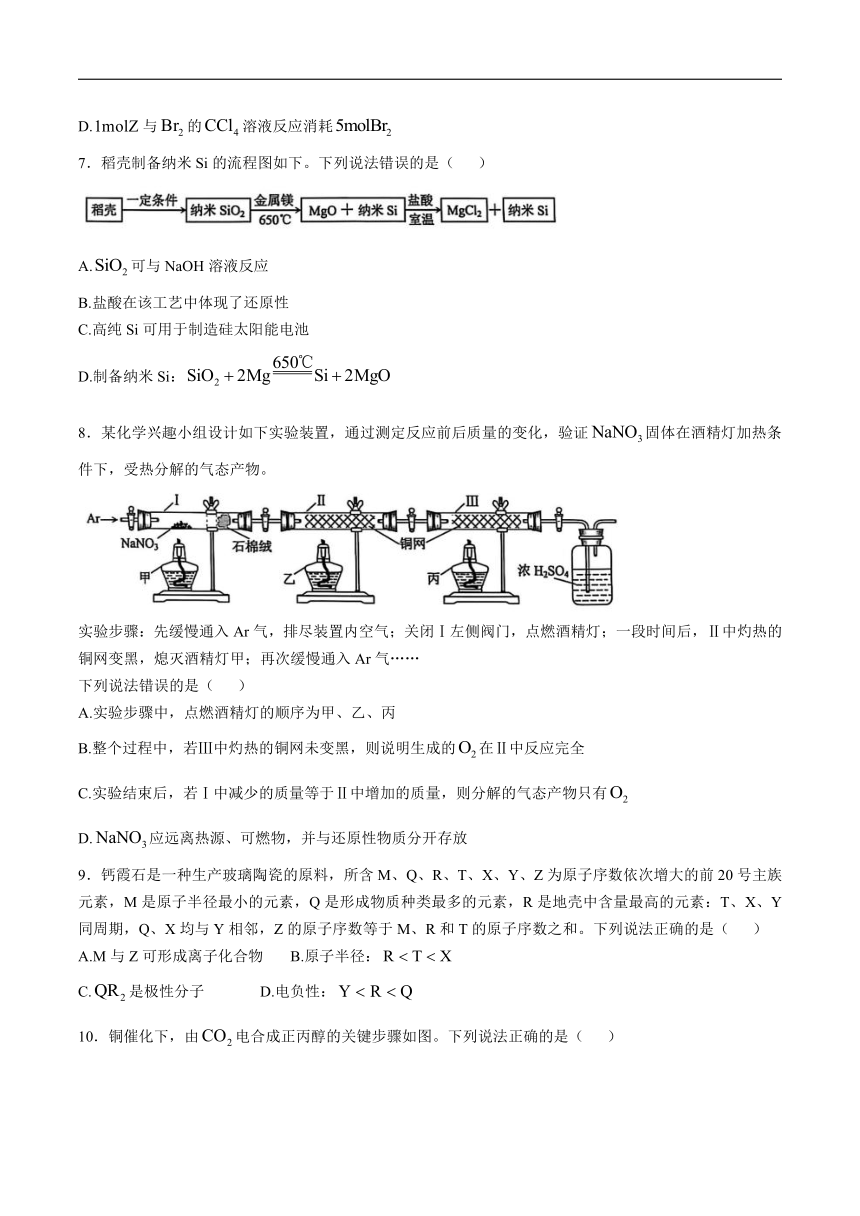
5.下列装置(省略部分夹持装置)或操作正确的是( )
A.制备 B.配制溶液
C.探究Na与反应 D.探究温度对化学平衡的影响
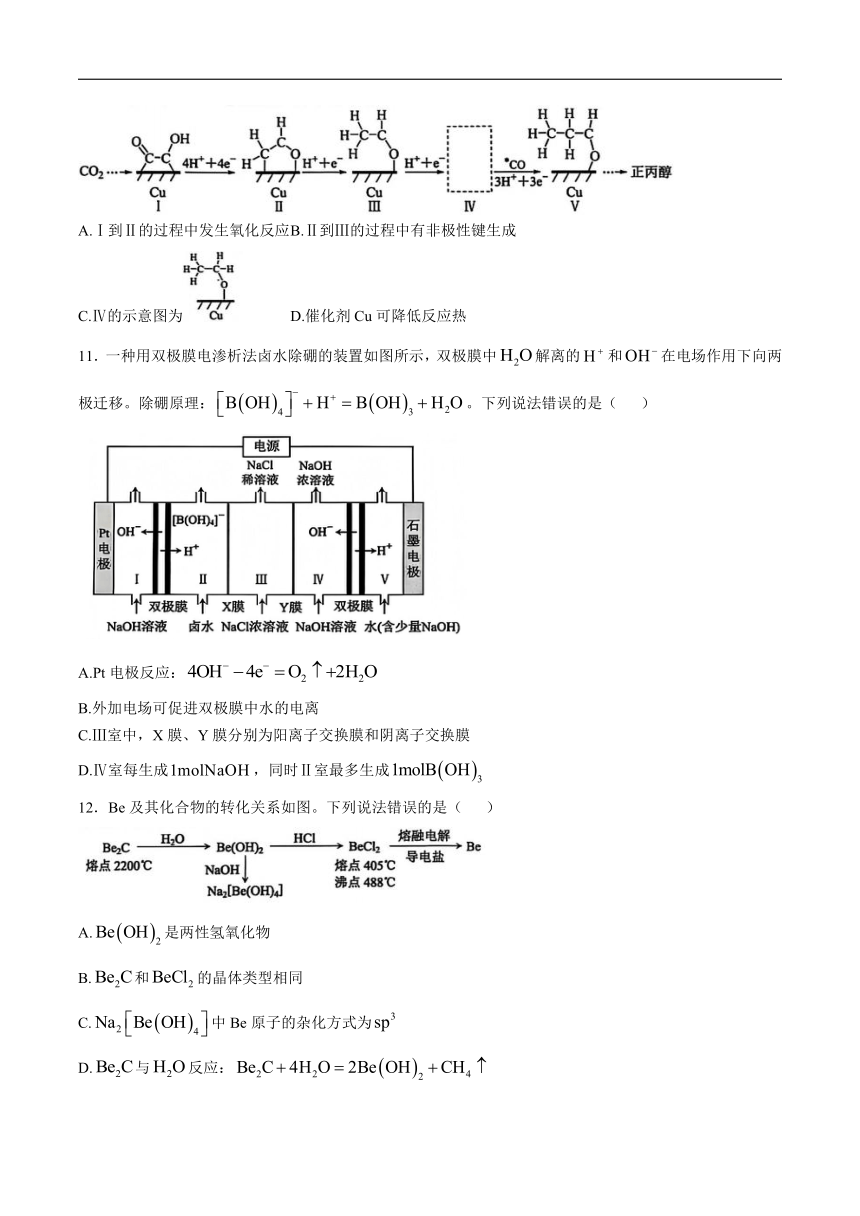
6.化合物Z是某真菌的成分之一,结构如图。下列有关该物质说法错误的是( )
A.可形成分子间氢键
B.与乙酸、乙醇均能发生酯化反应
C.能与溶液反应生成
D.与的溶液反应消耗
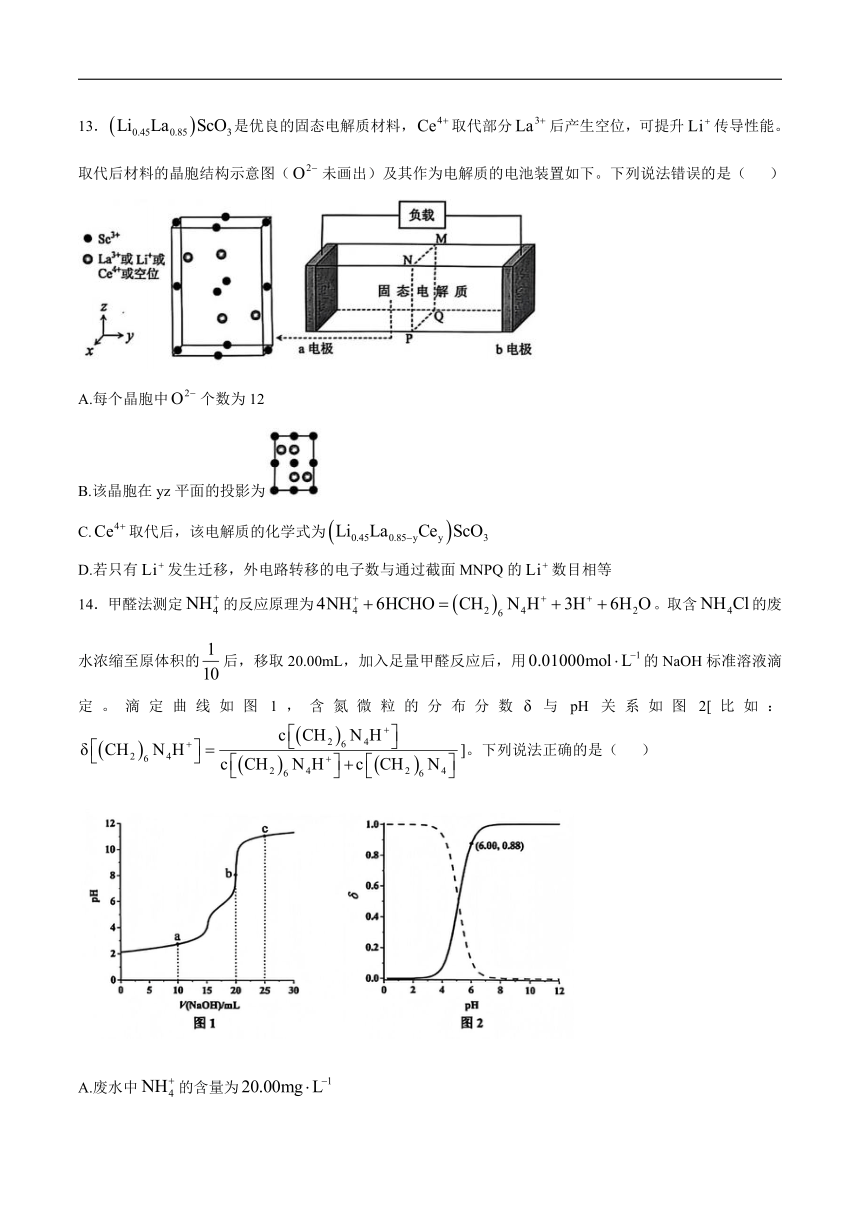
7.稻壳制备纳米Si的流程图如下。下列说法错误的是( )
A.可与NaOH溶液反应
B.盐酸在该工艺中体现了还原性
C.高纯Si可用于制造硅太阳能电池
D.制备纳米Si:
8.某化学兴趣小组设计如下实验装置,通过测定反应前后质量的变化,验证固体在酒精灯加热条件下,受热分解的气态产物。
实验步骤:先缓慢通入Ar气,排尽装置内空气;关闭Ⅰ左侧阀门,点燃酒精灯;一段时间后,Ⅱ中灼热的铜网变黑,熄灭酒精灯甲;再次缓慢通入Ar气……
下列说法错误的是( )
A.实验步骤中,点燃酒精灯的顺序为甲、乙、丙
B.整个过程中,若Ⅲ中灼热的铜网未变黑,则说明生成的在Ⅱ中反应完全
C.实验结束后,若Ⅰ中减少的质量等于Ⅱ中增加的质量,则分解的气态产物只有
D.应远离热源、可燃物,并与还原性物质分开存放
9.钙霞石是一种生产玻璃陶瓷的原料,所含M、Q、R、T、X、Y、Z为原子序数依次增大的前20号主族元素,M是原子半径最小的元素,Q是形成物质种类最多的元素,R是地壳中含量最高的元素:T、X、Y同周期,Q、X均与Y相邻,Z的原子序数等于M、R和T的原子序数之和。下列说法正确的是( )
A.M与Z可形成离子化合物 B.原子半径:
C.是极性分子 D.电负性:
10.铜催化下,由电合成正丙醇的关键步骤如图。下列说法正确的是( )
A.Ⅰ到Ⅱ的过程中发生氧化反应 B.Ⅱ到Ⅲ的过程中有非极性键生成
C.Ⅳ的示意图为 D.催化剂Cu可降低反应热
11.一种用双极膜电渗析法卤水除硼的装置如图所示,双极膜中解离的和在电场作用下向两极迁移。除硼原理:。下列说法错误的是( )
A.Pt电极反应:
B.外加电场可促进双极膜中水的电离
C.Ⅲ室中,X膜、Y膜分别为阳离子交换膜和阴离子交换膜
D.Ⅳ室每生成,同时Ⅱ室最多生成
12.Be及其化合物的转化关系如图。下列说法错误的是( )
A.是两性氢氧化物
B.和的晶体类型相同
C.中Be原子的杂化方式为
D.与反应:
13.是优良的固态电解质材料,取代部分后产生空位,可提升传导性能。取代后材料的晶胞结构示意图(未画出)及其作为电解质的电池装置如下。下列说法错误的是( )
A.每个晶胞中个数为12
B.该晶胞在yz平面的投影为
C.取代后,该电解质的化学式为
D.若只有发生迁移,外电路转移的电子数与通过截面MNPQ的数目相等
14.甲醛法测定的反应原理为。取含的废水浓缩至原体积的后,移取20.00mL,加入足量甲醛反应后,用的NaOH标准溶液滴定。滴定曲线如图1,含氮微粒的分布分数与pH关系如图2[比如:]。下列说法正确的是( )
A.废水中的含量为
B.c点:
C.a点:
D.的平衡常数
二、非选择题:本题共4小题,共58分。
15.(14分)从褐铁矿型金-银矿(含Au、Ag、、、CuO、等)中提取Au、Ag,并回收其它有价金属的一种工艺如下:
已知:①金-银矿中Cu、Mn元素的含量分别为0.19%、2.35%。
②25℃时,的为。
回答下列问题:
(1)基态Cu原子的价层电子排布式为______。
(2)“还原酸浸”时,反应的离子方程式为______。
(3)“浸金银”时,Au溶解涉及的主要反应如下:
①
②
上述过程中的催化剂为______。
(4)“沉铜”前,“滤液1”多次循环的目的为______。
(5)根据“还原酸浸”“氧化”,推断的氧化性由强到弱的顺序为______。
(6)25℃“沉铁”后,调节“滤液4”的pH至8.0,无析出,则______。
(7)一种锑锰合金的立方晶胞结构如图。
①该晶胞中,每个Sb周围与它最近且相等距离的Mn有______个。
②为阿伏加德罗常数的值,晶胞边长为anm,则晶体的密度为______(列出计算式即可)。
16.(14分)三氟甲基亚磺酸锂是我国科学家通过人工智能设计开发的一种锂离子电池补锂剂,其合成原理如下:
实验步骤如下:
Ⅰ.向A中加入和20.0mL蒸馏水,搅拌下逐滴加入2.1mL(3.3g)三氟甲磺酰氯,有气泡产生(装置如右图,夹持及加热装置省略)。80℃下反应3h后,减压蒸除溶剂得浅黄色固体。
Ⅱ.向上述所得固体中加入10.0mL四氢呋喃(THF),充分搅拌后,加入无水,振荡,抽滤、洗涤。将所得滤液减压蒸除THF,得黏稠状固体。加入适量乙醇进行重结晶。
Ⅲ.将所得三氟甲基亚磺酸钠和3.0mLTHF加入圆底烧瓶中,搅拌溶解后逐滴加入足量浓盐酸,析出白色固体。抽滤、洗涤。
Ⅳ.将滤液转入圆底烧瓶中,加入2.0mL蒸馏水和过量LiOH。室温搅拌反应1h后,减压蒸除溶剂,得粗产品。加入适量乙醇进行重结晶,得产品1.1g。
已知:THF是一种有机溶剂,与水任意比互溶。
回答下列问题:
(1)仪器A的名称为______,冷凝管中冷却水应从______(填“b”或“c”)口通入。
(2)步骤Ⅰ反应中有气泡产生,其主要成分为______。
(3)步骤Ⅱ中第一次洗涤的目的是______。
(4)步骤Ⅲ中发生反应的化学方程式为______,判断加入浓盐酸已足量的方法为______。
(5)步骤Ⅳ中加入蒸馏水的作用是______。
(6)三氟甲基亚磺酸锂的产率为______(列出计算式即可)。
17.(15分)我国科学家研发出一种乙醇(沸点78.5℃)绿色制氢新途径,并实现高附加值乙酸(沸点118℃)的生产,主要反应为
Ⅰ.
Ⅱ.
回答下列问题:
(1)乙醇可由秸秆生产,主要过程为
秸秆纤维素______乙醇
(2)对于反应Ⅰ:
①已知 则______。
②一定温度下,下列叙述能说明恒容密闭容器中反应达到平衡状态的是______(填标号)。
A.容器内的压强不再变化
B.混合气体的密度不再变化
C.的体积分数不再变化
D.单位时间内生成,同时消耗
③反应后从混合气体分离得到,最适宜的方法为______。
(3)恒压100kPa下,向密闭容器中按投料,产氢速率和产物的选择性随温度变化关系如图1,关键步骤中间体的能量变化如图2。
[比如:乙酸选择性]
①由图1可知,反应Ⅰ最适宜的温度为270℃,原因为______。
②由图中信息可知,乙酸可能是______(填“产物1”“产物2”或“产物3”)。
③270℃时,若该密闭容器中只发生反应Ⅰ、Ⅱ,平衡时乙醇的转化率为90%,乙酸的选择性为80%,则______,平衡常数______(列出计算式即可;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
18.(15分)化合物L是某中药的活性成分。一种合成路线如下(略去部分试剂与反应条件,忽略立体化学)。
已知:在Ru(Ⅱ)的催化下,端烯烃和生烯烃复分解反应得到产物。
回答下列问题:
(1)A中含氧官能团的名称为______。
(2)对比C和D的结构,可以推知C和D的______(填标号)不相同。
a.分子式 b.质谱图中的碎片峰 c.官能团
(3)D→F中另一产物的化学名称为______。
(4)E发生加聚反应,产物的结构简式为______。
(5)F→G的反应类型为______。
(6)羰基具有较强的极性。I→J经历了加成和消去的过程,其中间体的结构简式为______(填标号)。
a. b. c. d.
(7)的化学方程式为______。
(8)写出一种满足下列条件的L的同分异构体的结构简式______(不考虑立体异构)。
①能与发生显色反应;1mol该物质与足量NaOH溶液反应,消耗3molNaOH。
②核磁共振氢谱显示6组峰,且峰面积比为。
③含有酯基和氨基(或取代的氨基,,和可以是H或烃基)。
化学
注意事项:
1.答卷前,考生务必用黑色碳素笔将自己的姓名、准考证号、考场号、座位号填写在答题卡上,并认真核准条形码上的姓名、准考证号、考场号、座位号及科目,在规定的位置贴好条形码。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,用黑色碳素笔将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 F 19 Na 23 S 32 Cl 35.5 Mn 55 Fe 56 Cu 64 Sb 122
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.画中有“化”,多彩中华。下列叙述正确的是( )
A.岩彩壁画颜料所用贝壳粉,主要成分属于硅酸盐
B.油画颜料调和剂所用核桃油,属于有机高分子
C.竹胎漆画颜料赭石的主要成分氧化铁,耐酸、碱
D.水墨画墨汁的主要成分碳,常温不易被氧化
2.下列化学用语或图示表示正确的是( )
A.的VSEPR模型:
B.的电子式:
C.Cl的原子结构示意图:
D.溶于水的电离方程式:
3.下列化学方程式错误的是( )
A.煤制水煤气:
B.供氧:
C.覆铜板制作印刷电路板:
D.铅酸蓄电池放电:
4.为阿伏加德罗常数的值。下列说法正确的是( )
A.中原子的数目为
B.所含中子的数目为
C.粉和足量S完全反应,转移电子的数目为
D.0盐酸与足量反应,生成的数目为
5.下列装置(省略部分夹持装置)或操作正确的是( )
A.制备 B.配制溶液
C.探究Na与反应 D.探究温度对化学平衡的影响
6.化合物Z是某真菌的成分之一,结构如图。下列有关该物质说法错误的是( )
A.可形成分子间氢键
B.与乙酸、乙醇均能发生酯化反应
C.能与溶液反应生成
D.与的溶液反应消耗
7.稻壳制备纳米Si的流程图如下。下列说法错误的是( )
A.可与NaOH溶液反应
B.盐酸在该工艺中体现了还原性
C.高纯Si可用于制造硅太阳能电池
D.制备纳米Si:
8.某化学兴趣小组设计如下实验装置,通过测定反应前后质量的变化,验证固体在酒精灯加热条件下,受热分解的气态产物。
实验步骤:先缓慢通入Ar气,排尽装置内空气;关闭Ⅰ左侧阀门,点燃酒精灯;一段时间后,Ⅱ中灼热的铜网变黑,熄灭酒精灯甲;再次缓慢通入Ar气……
下列说法错误的是( )
A.实验步骤中,点燃酒精灯的顺序为甲、乙、丙
B.整个过程中,若Ⅲ中灼热的铜网未变黑,则说明生成的在Ⅱ中反应完全
C.实验结束后,若Ⅰ中减少的质量等于Ⅱ中增加的质量,则分解的气态产物只有
D.应远离热源、可燃物,并与还原性物质分开存放
9.钙霞石是一种生产玻璃陶瓷的原料,所含M、Q、R、T、X、Y、Z为原子序数依次增大的前20号主族元素,M是原子半径最小的元素,Q是形成物质种类最多的元素,R是地壳中含量最高的元素:T、X、Y同周期,Q、X均与Y相邻,Z的原子序数等于M、R和T的原子序数之和。下列说法正确的是( )
A.M与Z可形成离子化合物 B.原子半径:
C.是极性分子 D.电负性:
10.铜催化下,由电合成正丙醇的关键步骤如图。下列说法正确的是( )
A.Ⅰ到Ⅱ的过程中发生氧化反应 B.Ⅱ到Ⅲ的过程中有非极性键生成
C.Ⅳ的示意图为 D.催化剂Cu可降低反应热
11.一种用双极膜电渗析法卤水除硼的装置如图所示,双极膜中解离的和在电场作用下向两极迁移。除硼原理:。下列说法错误的是( )
A.Pt电极反应:
B.外加电场可促进双极膜中水的电离
C.Ⅲ室中,X膜、Y膜分别为阳离子交换膜和阴离子交换膜
D.Ⅳ室每生成,同时Ⅱ室最多生成
12.Be及其化合物的转化关系如图。下列说法错误的是( )
A.是两性氢氧化物
B.和的晶体类型相同
C.中Be原子的杂化方式为
D.与反应:
13.是优良的固态电解质材料,取代部分后产生空位,可提升传导性能。取代后材料的晶胞结构示意图(未画出)及其作为电解质的电池装置如下。下列说法错误的是( )
A.每个晶胞中个数为12
B.该晶胞在yz平面的投影为
C.取代后,该电解质的化学式为
D.若只有发生迁移,外电路转移的电子数与通过截面MNPQ的数目相等
14.甲醛法测定的反应原理为。取含的废水浓缩至原体积的后,移取20.00mL,加入足量甲醛反应后,用的NaOH标准溶液滴定。滴定曲线如图1,含氮微粒的分布分数与pH关系如图2[比如:]。下列说法正确的是( )
A.废水中的含量为
B.c点:
C.a点:
D.的平衡常数
二、非选择题:本题共4小题,共58分。
15.(14分)从褐铁矿型金-银矿(含Au、Ag、、、CuO、等)中提取Au、Ag,并回收其它有价金属的一种工艺如下:
已知:①金-银矿中Cu、Mn元素的含量分别为0.19%、2.35%。
②25℃时,的为。
回答下列问题:
(1)基态Cu原子的价层电子排布式为______。
(2)“还原酸浸”时,反应的离子方程式为______。
(3)“浸金银”时,Au溶解涉及的主要反应如下:
①
②
上述过程中的催化剂为______。
(4)“沉铜”前,“滤液1”多次循环的目的为______。
(5)根据“还原酸浸”“氧化”,推断的氧化性由强到弱的顺序为______。
(6)25℃“沉铁”后,调节“滤液4”的pH至8.0,无析出,则______。
(7)一种锑锰合金的立方晶胞结构如图。
①该晶胞中,每个Sb周围与它最近且相等距离的Mn有______个。
②为阿伏加德罗常数的值,晶胞边长为anm,则晶体的密度为______(列出计算式即可)。
16.(14分)三氟甲基亚磺酸锂是我国科学家通过人工智能设计开发的一种锂离子电池补锂剂,其合成原理如下:
实验步骤如下:
Ⅰ.向A中加入和20.0mL蒸馏水,搅拌下逐滴加入2.1mL(3.3g)三氟甲磺酰氯,有气泡产生(装置如右图,夹持及加热装置省略)。80℃下反应3h后,减压蒸除溶剂得浅黄色固体。
Ⅱ.向上述所得固体中加入10.0mL四氢呋喃(THF),充分搅拌后,加入无水,振荡,抽滤、洗涤。将所得滤液减压蒸除THF,得黏稠状固体。加入适量乙醇进行重结晶。
Ⅲ.将所得三氟甲基亚磺酸钠和3.0mLTHF加入圆底烧瓶中,搅拌溶解后逐滴加入足量浓盐酸,析出白色固体。抽滤、洗涤。
Ⅳ.将滤液转入圆底烧瓶中,加入2.0mL蒸馏水和过量LiOH。室温搅拌反应1h后,减压蒸除溶剂,得粗产品。加入适量乙醇进行重结晶,得产品1.1g。
已知:THF是一种有机溶剂,与水任意比互溶。
回答下列问题:
(1)仪器A的名称为______,冷凝管中冷却水应从______(填“b”或“c”)口通入。
(2)步骤Ⅰ反应中有气泡产生,其主要成分为______。
(3)步骤Ⅱ中第一次洗涤的目的是______。
(4)步骤Ⅲ中发生反应的化学方程式为______,判断加入浓盐酸已足量的方法为______。
(5)步骤Ⅳ中加入蒸馏水的作用是______。
(6)三氟甲基亚磺酸锂的产率为______(列出计算式即可)。
17.(15分)我国科学家研发出一种乙醇(沸点78.5℃)绿色制氢新途径,并实现高附加值乙酸(沸点118℃)的生产,主要反应为
Ⅰ.
Ⅱ.
回答下列问题:
(1)乙醇可由秸秆生产,主要过程为
秸秆纤维素______乙醇
(2)对于反应Ⅰ:
①已知 则______。
②一定温度下,下列叙述能说明恒容密闭容器中反应达到平衡状态的是______(填标号)。
A.容器内的压强不再变化
B.混合气体的密度不再变化
C.的体积分数不再变化
D.单位时间内生成,同时消耗
③反应后从混合气体分离得到,最适宜的方法为______。
(3)恒压100kPa下,向密闭容器中按投料,产氢速率和产物的选择性随温度变化关系如图1,关键步骤中间体的能量变化如图2。
[比如:乙酸选择性]
①由图1可知,反应Ⅰ最适宜的温度为270℃,原因为______。
②由图中信息可知,乙酸可能是______(填“产物1”“产物2”或“产物3”)。
③270℃时,若该密闭容器中只发生反应Ⅰ、Ⅱ,平衡时乙醇的转化率为90%,乙酸的选择性为80%,则______,平衡常数______(列出计算式即可;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
18.(15分)化合物L是某中药的活性成分。一种合成路线如下(略去部分试剂与反应条件,忽略立体化学)。
已知:在Ru(Ⅱ)的催化下,端烯烃和生烯烃复分解反应得到产物。
回答下列问题:
(1)A中含氧官能团的名称为______。
(2)对比C和D的结构,可以推知C和D的______(填标号)不相同。
a.分子式 b.质谱图中的碎片峰 c.官能团
(3)D→F中另一产物的化学名称为______。
(4)E发生加聚反应,产物的结构简式为______。
(5)F→G的反应类型为______。
(6)羰基具有较强的极性。I→J经历了加成和消去的过程,其中间体的结构简式为______(填标号)。
a. b. c. d.
(7)的化学方程式为______。
(8)写出一种满足下列条件的L的同分异构体的结构简式______(不考虑立体异构)。
①能与发生显色反应;1mol该物质与足量NaOH溶液反应,消耗3molNaOH。
②核磁共振氢谱显示6组峰,且峰面积比为。
③含有酯基和氨基(或取代的氨基,,和可以是H或烃基)。
同课章节目录
