上学期高一化学人教版(2019)必修第一册1.3氧化还原反应(共30张PPT)
文档属性
| 名称 | 上学期高一化学人教版(2019)必修第一册1.3氧化还原反应(共30张PPT) |
|
|
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-22 00:00:00 | ||
图片预览









文档简介
(共30张PPT)
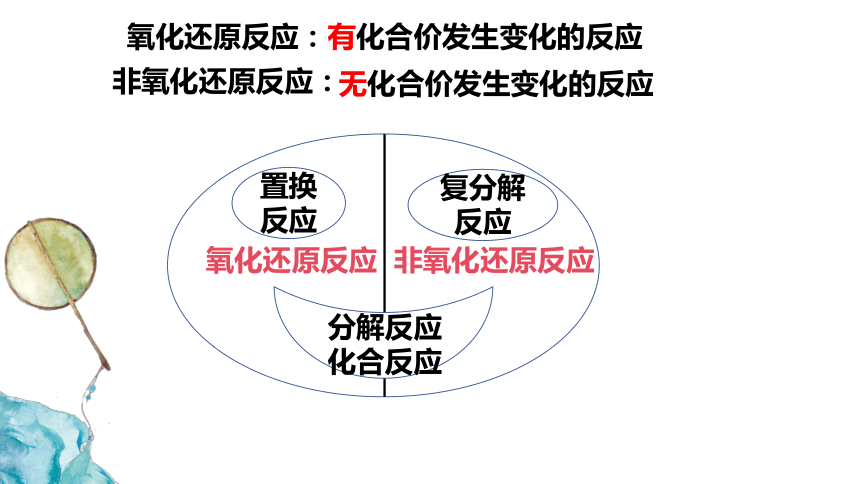
Cl
Na
得到电子化合价降低
失去电子化合价升高
氧化还原反应电子得失过程
拉瓦锡 Lavoisier
弗兰克兰 Frankland
汤姆森 J.J.Thomson
鲍林 Linus Carl Pauling
氧化还原反应相关理论的发展历程
氧化还原反应
请在此处输入相关文字内容,操作方法:鼠标全选此段文字,直接输入文本即可替换,文字格式不会发生改变。
学
习
目
标
1.了解有些化学反应中存在着化合价的变化,建立起氧化还原的概念;
2.能用化合价升降的观点理解氧化还原反应,理解氧化还原反应的实质是电子转移(得失或偏离)。
shinneliu
4mins阅读课本p20-21内容,并完成思考与讨论(p20)的内容:
2CuO + C ==2Cu +CO2
高温
氧化反应
得到氧的反应
还原反应
失去氧的反应
同一反应,一种物质得氧,必然有一种物质失氧!
氧化反应和还原反应在一个反应中同时发生!
自学指导一
shinneliu
2CuO + C = 2Cu +CO2
高温
Fe2O3 + 3CO = 2Fe +3CO2
高温
H2O + C = H2 + CO
高温
CuO + H2 = 2Cu +H2O
WO3 + 3H2 = W +3H2O
高温
讨论并标出:得氧和失氧元素的化合价变化
+2 0 0 +4
+3 +2 0 +4
+1 0 0 +2
+2 0 0 +1
+6 0 0 +1
失氧
化合价降低
发生还原反应
得氧
化合价升高
发生氧化反应
Zn + H2SO4 = ZnSO4 +H2↑
讨论并标出:变价元素的化合价?
MnO2 + 4HCl (浓) = MnCl2 +2H2O +Cl2↑
0 +2 +2 0
+4 -1 +2 -1 0
化合价变化是氧化还原反应的重要特征!
化合价降低,
发生还原反应
化合价升高,
发生氧化反应
1.用化合价升降的观点去判断下面的反应哪些是氧化还原反应
①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
②2KClO32KCl+3O2↑
③H2+ Cl2 = 2HCl
④NaCl固+H2SO4浓NaHSO4+HCl
⑤CaCO3高温CaO+CO2
⑥CaO+CO2=CaCO3
MnO2
+4
-1
+2
0
+5
-1
0
0
0
+1
-1
课堂练习
点燃
√
√
√
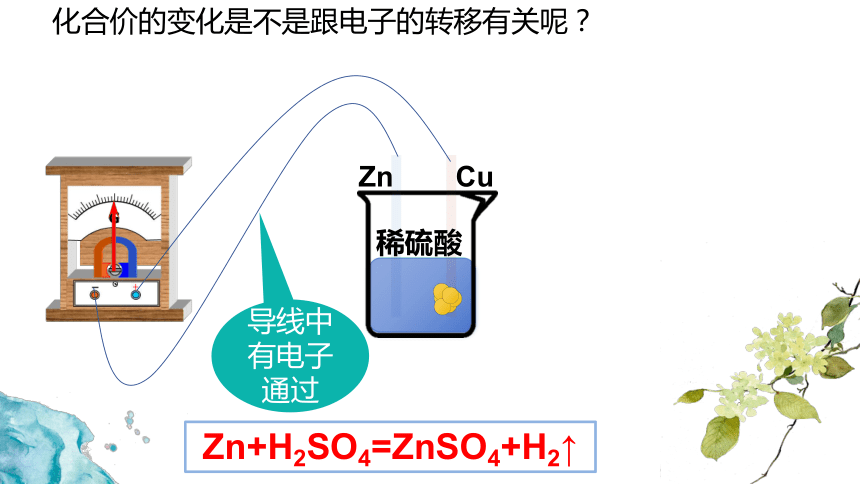
氧化还原反应:
有化合价发生变化的反应
非氧化还原反应:
无化合价发生变化的反应
氧化还原反应
非氧化还原反应
置换反应
复分解反应
分解反应
化合反应
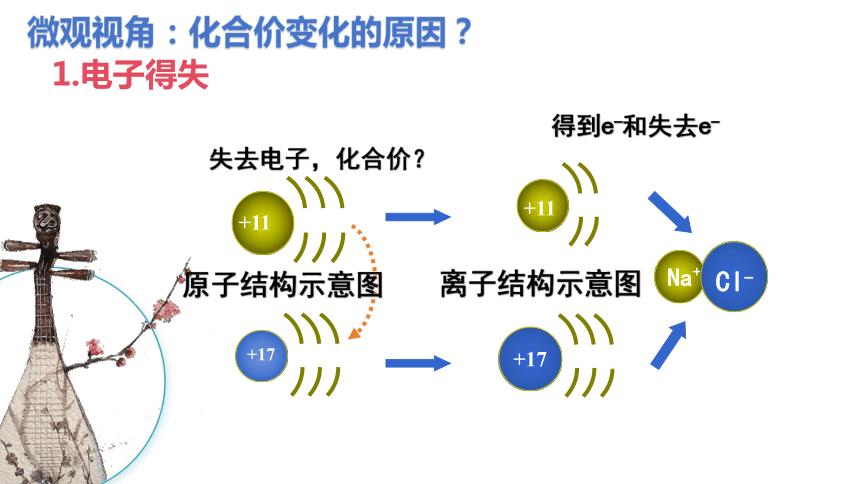
Cu
Zn
稀硫酸
化合价的变化是不是跟电子的转移有关呢?
导线中有电子通过
Zn+H2SO4=ZnSO4+H2↑
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
+17
8
8
2
Na+
Cl-
原子结构示意图
离子结构示意图
失去电子,化合价?
得到电子,化合价?
得到e-和失去e-
升高
降低
微观视角:化合价变化的原因?
1.电子得失
shinneliu
失2e-,化合价升高,
被氧化
得2e-,化合价降低,
被还原
2Na+Cl2 === 2Na Cl
0
0
+1 -1
还原反应
用双线桥表示化合价的变化
氧化反应
升失氧
降得还
H2+Cl2=2HCl 的形成过程:
2.共用电子对偏移
共用电子对的偏移
shinneliu
氧化还原的本质:
电子转移
电子得失
共用电子对偏移
得到
失去
偏离
偏向
共用电子对偏移
得到
失去
偏离
偏向
氧化还原反应
1.定义:
凡是有电子转移的化学反应,叫氧化还原反应
2.特征:
反应前后化合价发生变化(也是判断依据)
3.实质:
电子发生转移(得失或偏移)
有电子转移的化学反应都是氧化还原反应
知识点回顾
学
习
目
标
1.氧化还原反应的分析方法-----双线桥和单线桥
4mins阅读课本p22-23内容,回答以下题目:
1.什么是还原剂?什么是氧化剂?
2.用双线桥表示下列氧化还原反应,并指出那种元素被氧化(发生氧化反应);那种元素被还原(发生还原发应)
自学指导二
2Al+3H2SO4=Al2(SO4)3 +3H2↑
一、氧化还原反应得失电子的表示方法——双线桥法
例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑
1.正确判断各反应物、生成物各元素的化合价及其变化。
0 +1 +3 0
步骤:
2.两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。
3.电子符号用“e-”来表示。
4.得失电子总数表示:原子个数 × 每个原子得失电子数。
化合价升高,失2 ×3e-
化合价降低,得3 ×2e-
注意:反应中失去电子的总数等于得到电子的总数
二、氧化还原反应得失电子的表示方法——单线桥法
单线桥法的基本写法思路:
1.标价态——正确注明氧化还原反应中同一元素的化合价,判断其升、降,确定电子转移数目连单线——连接方程式左边得、失电子的元素,箭头指向得电子的元素
2.注得失——标出得失电子的总数目
注意事项:
Ⅰ.单线桥表示反应物中变价元素原子得失电子的情况;
Ⅱ.不需标明“得”或“失”,只标明电子转移数目;
Ⅲ.箭头标明电子转移的方向;
Ⅳ.单线桥箭头从失电子的元素原子指向得电子的元素原子。
(1)Fe+CuSO4=FeSO4+Cu
2e-
用单线桥法标注下列反应的电子得失
(2)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
6e-
(3)3S+6KOH=2K2S+K2SO3+3H2O
6e-
课堂练习
(4)2H2S + SO2 = 3S + 2H2O
4e-
(5)KClO3 + 6HCl = KCl + 3Cl2 ↑ + H2O
5e-
课堂练习
(2) 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
MnO2 + 4HCl(浓) MnCl2 + Cl2 ↑ + 2H2O
(1)
(3) 3Cl2 + 6KOH == 5KCl + KClO3 + 3H2O
(4)NO + NO2 + 2NaOH = 2NaNO2 + H2O
常见的氧化剂和还原剂
常见的氧化剂
部分非金属单质:
具有高价态元素的化合物:
某些金属性较弱的高价态离子:
过氧化物:
O2,Cl2等
浓硫酸,HNO3,KMnO4
MnO2,KClO3,K2Cr2O4
Fe3+,Ag+,Pb4+,
Cu2+
Na2O2,H2O2等
常见的还原剂
活泼的金属单质:
某些非金属单质:
非金属阴离子和氯化物:
变价元素的较低价态化合物:
Al、Zn、Fe等
C、H2等
Cl-、Br-、I-、HI、NH3、H2S
CO、SO2、H2SO3、
Na2SO3、FeSO4
氧化性和还原性的比较
2.特殊形式氧化还原反应方法及注意点
(1)某一元素部分发生氧化还原反应
MnO2 + 4HCl(浓) MnCl2 + Cl2 ↑ + 2H2O
+4 -1 +2 -1 0
失去2e-
得到12e-
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
0 +5 +2 +5 +2
得到23e-
失去32e-
算系数先找产物
(产物中发生化合价
变化的原子数好找)
失去15e-
(2)用双线桥表示歧化反应电子转移方法。
歧化反应:同一物质中同种元素的价态一部分升高、一部分降低的反应,称歧化反应。
3Cl2 + 6KOH == 5KCl + KClO3 + 3H2O
得到5e-
Cl2在此反应中起到什么作用?氧化剂和还原剂的物质的量之比为?
失去1e-
(1) Cl2 + H2O HCl + HClO
得到1e-
(2) 3S + 6KOH = 2K2S + K2SO3 + 3H2O
失去14e-
得到22e-
课堂练习
(3)用双线桥表示归中反应电子转移方法。
归中反应:同种元素不同价态之间发生反应,元素由高价态与低价态反应生成中间价态的物质,称归中反应。
NO + NO2 + 2NaOH = 2NaNO2 + H2O
失去1e-
得到1e-
NaNO2在此反应中为?氧化产物和还原产物的物质的量之比?
氧化产物是由什么物质而来?还原产物呢?
归中反应先找反应物
(氧化产物和还原产物
为同一物质,很难找其系数)
(1)2H2S + SO2 = 3S + 2H2O
失去22e-
得到14e-
得到15e-
失去5e-
(2)KClO3 + 5KCl +3H2SO4= 3K2SO4 + 3Cl2↑+ 3H2O
课堂练习
即同种元素不同价态之间,相邻价态不反应,发生反应时化合价向中间靠拢,但不交叉。
最低价
中间价
中间价
最高价
正确
最低价
中间价
中间价
最高价
正确
最低价
中间价
中间价
最高价
正确
最低价
中间价
中间价
最高价
错误
只靠近
不交叉
相邻价态不反应
tips:归中律
H2S + H2 SO4 (浓)= S↓ + SO2 + 2H2O
-2
+6
0
+4
失去2 -
得到2 -
H2S + H2 SO4 (浓)= S↓ + SO2 + 2H2O
-2
+6
0
+4
失去6 -
得到6 -
√
X
课堂练习:判断正误
Cl
Na
得到电子化合价降低
失去电子化合价升高
氧化还原反应电子得失过程
拉瓦锡 Lavoisier
弗兰克兰 Frankland
汤姆森 J.J.Thomson
鲍林 Linus Carl Pauling
氧化还原反应相关理论的发展历程
氧化还原反应
请在此处输入相关文字内容,操作方法:鼠标全选此段文字,直接输入文本即可替换,文字格式不会发生改变。
学
习
目
标
1.了解有些化学反应中存在着化合价的变化,建立起氧化还原的概念;
2.能用化合价升降的观点理解氧化还原反应,理解氧化还原反应的实质是电子转移(得失或偏离)。
shinneliu
4mins阅读课本p20-21内容,并完成思考与讨论(p20)的内容:
2CuO + C ==2Cu +CO2
高温
氧化反应
得到氧的反应
还原反应
失去氧的反应
同一反应,一种物质得氧,必然有一种物质失氧!
氧化反应和还原反应在一个反应中同时发生!
自学指导一
shinneliu
2CuO + C = 2Cu +CO2
高温
Fe2O3 + 3CO = 2Fe +3CO2
高温
H2O + C = H2 + CO
高温
CuO + H2 = 2Cu +H2O
WO3 + 3H2 = W +3H2O
高温
讨论并标出:得氧和失氧元素的化合价变化
+2 0 0 +4
+3 +2 0 +4
+1 0 0 +2
+2 0 0 +1
+6 0 0 +1
失氧
化合价降低
发生还原反应
得氧
化合价升高
发生氧化反应
Zn + H2SO4 = ZnSO4 +H2↑
讨论并标出:变价元素的化合价?
MnO2 + 4HCl (浓) = MnCl2 +2H2O +Cl2↑
0 +2 +2 0
+4 -1 +2 -1 0
化合价变化是氧化还原反应的重要特征!
化合价降低,
发生还原反应
化合价升高,
发生氧化反应
1.用化合价升降的观点去判断下面的反应哪些是氧化还原反应
①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
②2KClO32KCl+3O2↑
③H2+ Cl2 = 2HCl
④NaCl固+H2SO4浓NaHSO4+HCl
⑤CaCO3高温CaO+CO2
⑥CaO+CO2=CaCO3
MnO2
+4
-1
+2
0
+5
-1
0
0
0
+1
-1
课堂练习
点燃
√
√
√
氧化还原反应:
有化合价发生变化的反应
非氧化还原反应:
无化合价发生变化的反应
氧化还原反应
非氧化还原反应
置换反应
复分解反应
分解反应
化合反应
Cu
Zn
稀硫酸
化合价的变化是不是跟电子的转移有关呢?
导线中有电子通过
Zn+H2SO4=ZnSO4+H2↑
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
+17
8
8
2
Na+
Cl-
原子结构示意图
离子结构示意图
失去电子,化合价?
得到电子,化合价?
得到e-和失去e-
升高
降低
微观视角:化合价变化的原因?
1.电子得失
shinneliu
失2e-,化合价升高,
被氧化
得2e-,化合价降低,
被还原
2Na+Cl2 === 2Na Cl
0
0
+1 -1
还原反应
用双线桥表示化合价的变化
氧化反应
升失氧
降得还
H2+Cl2=2HCl 的形成过程:
2.共用电子对偏移
共用电子对的偏移
shinneliu
氧化还原的本质:
电子转移
电子得失
共用电子对偏移
得到
失去
偏离
偏向
共用电子对偏移
得到
失去
偏离
偏向
氧化还原反应
1.定义:
凡是有电子转移的化学反应,叫氧化还原反应
2.特征:
反应前后化合价发生变化(也是判断依据)
3.实质:
电子发生转移(得失或偏移)
有电子转移的化学反应都是氧化还原反应
知识点回顾
学
习
目
标
1.氧化还原反应的分析方法-----双线桥和单线桥
4mins阅读课本p22-23内容,回答以下题目:
1.什么是还原剂?什么是氧化剂?
2.用双线桥表示下列氧化还原反应,并指出那种元素被氧化(发生氧化反应);那种元素被还原(发生还原发应)
自学指导二
2Al+3H2SO4=Al2(SO4)3 +3H2↑
一、氧化还原反应得失电子的表示方法——双线桥法
例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑
1.正确判断各反应物、生成物各元素的化合价及其变化。
0 +1 +3 0
步骤:
2.两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。
3.电子符号用“e-”来表示。
4.得失电子总数表示:原子个数 × 每个原子得失电子数。
化合价升高,失2 ×3e-
化合价降低,得3 ×2e-
注意:反应中失去电子的总数等于得到电子的总数
二、氧化还原反应得失电子的表示方法——单线桥法
单线桥法的基本写法思路:
1.标价态——正确注明氧化还原反应中同一元素的化合价,判断其升、降,确定电子转移数目连单线——连接方程式左边得、失电子的元素,箭头指向得电子的元素
2.注得失——标出得失电子的总数目
注意事项:
Ⅰ.单线桥表示反应物中变价元素原子得失电子的情况;
Ⅱ.不需标明“得”或“失”,只标明电子转移数目;
Ⅲ.箭头标明电子转移的方向;
Ⅳ.单线桥箭头从失电子的元素原子指向得电子的元素原子。
(1)Fe+CuSO4=FeSO4+Cu
2e-
用单线桥法标注下列反应的电子得失
(2)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
6e-
(3)3S+6KOH=2K2S+K2SO3+3H2O
6e-
课堂练习
(4)2H2S + SO2 = 3S + 2H2O
4e-
(5)KClO3 + 6HCl = KCl + 3Cl2 ↑ + H2O
5e-
课堂练习
(2) 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
MnO2 + 4HCl(浓) MnCl2 + Cl2 ↑ + 2H2O
(1)
(3) 3Cl2 + 6KOH == 5KCl + KClO3 + 3H2O
(4)NO + NO2 + 2NaOH = 2NaNO2 + H2O
常见的氧化剂和还原剂
常见的氧化剂
部分非金属单质:
具有高价态元素的化合物:
某些金属性较弱的高价态离子:
过氧化物:
O2,Cl2等
浓硫酸,HNO3,KMnO4
MnO2,KClO3,K2Cr2O4
Fe3+,Ag+,Pb4+,
Cu2+
Na2O2,H2O2等
常见的还原剂
活泼的金属单质:
某些非金属单质:
非金属阴离子和氯化物:
变价元素的较低价态化合物:
Al、Zn、Fe等
C、H2等
Cl-、Br-、I-、HI、NH3、H2S
CO、SO2、H2SO3、
Na2SO3、FeSO4
氧化性和还原性的比较
2.特殊形式氧化还原反应方法及注意点
(1)某一元素部分发生氧化还原反应
MnO2 + 4HCl(浓) MnCl2 + Cl2 ↑ + 2H2O
+4 -1 +2 -1 0
失去2e-
得到12e-
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
0 +5 +2 +5 +2
得到23e-
失去32e-
算系数先找产物
(产物中发生化合价
变化的原子数好找)
失去15e-
(2)用双线桥表示歧化反应电子转移方法。
歧化反应:同一物质中同种元素的价态一部分升高、一部分降低的反应,称歧化反应。
3Cl2 + 6KOH == 5KCl + KClO3 + 3H2O
得到5e-
Cl2在此反应中起到什么作用?氧化剂和还原剂的物质的量之比为?
失去1e-
(1) Cl2 + H2O HCl + HClO
得到1e-
(2) 3S + 6KOH = 2K2S + K2SO3 + 3H2O
失去14e-
得到22e-
课堂练习
(3)用双线桥表示归中反应电子转移方法。
归中反应:同种元素不同价态之间发生反应,元素由高价态与低价态反应生成中间价态的物质,称归中反应。
NO + NO2 + 2NaOH = 2NaNO2 + H2O
失去1e-
得到1e-
NaNO2在此反应中为?氧化产物和还原产物的物质的量之比?
氧化产物是由什么物质而来?还原产物呢?
归中反应先找反应物
(氧化产物和还原产物
为同一物质,很难找其系数)
(1)2H2S + SO2 = 3S + 2H2O
失去22e-
得到14e-
得到15e-
失去5e-
(2)KClO3 + 5KCl +3H2SO4= 3K2SO4 + 3Cl2↑+ 3H2O
课堂练习
即同种元素不同价态之间,相邻价态不反应,发生反应时化合价向中间靠拢,但不交叉。
最低价
中间价
中间价
最高价
正确
最低价
中间价
中间价
最高价
正确
最低价
中间价
中间价
最高价
正确
最低价
中间价
中间价
最高价
错误
只靠近
不交叉
相邻价态不反应
tips:归中律
H2S + H2 SO4 (浓)= S↓ + SO2 + 2H2O
-2
+6
0
+4
失去2 -
得到2 -
H2S + H2 SO4 (浓)= S↓ + SO2 + 2H2O
-2
+6
0
+4
失去6 -
得到6 -
√
X
课堂练习:判断正误
