上学期高一化学人教版(2019)必修第一册2.1第2课时 氧化钠和过氧化钠(共27张PPT)
文档属性
| 名称 | 上学期高一化学人教版(2019)必修第一册2.1第2课时 氧化钠和过氧化钠(共27张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 551.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-22 18:41:07 | ||
图片预览







文档简介
(共27张PPT)
第一节 钠及其化合物
第二章 海水中的重要元素—— 钠和氯
第2课时 氧化钠和过氧化钠
素养目标
1.通过实验探究认识氧化钠、过氧化钠的化学性质,掌握钠的氧化物的用途,培养科学探究意识。
2.能从物质组成和化合价的角度认识氧化钠、过氧化钠的性质及物质的分类,培养宏观辨识与微观探析意识。
3.能通过过氧化钠与水及二氧化碳的反应,推理分析在反应中质量、体积的变化及电子转移情况,培养学生的证据意识。
【知识铺垫】
1.一小块钠在空气中放置生成的一系列产物有Na2O、NaOH、Na2CO3·10H2O、Na2CO3。
2.钠在空气中燃烧的化学方程式为2Na+O2 Na2O2。
3.在Na2O和Na2O2中,钠元素的化合价都是+1价,而氧元素的化合价分别是
-2价和-1价。
素养初探
【必备知识】
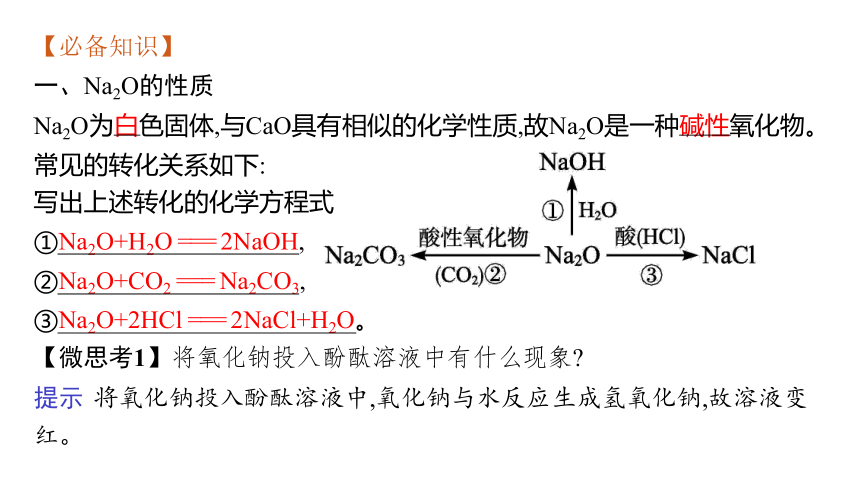
一、Na2O的性质
Na2O为白色固体,与CaO具有相似的化学性质,故Na2O是一种碱性氧化物。常见的转化关系如下:
写出上述转化的化学方程式
①Na2O+H2O === 2NaOH,
②Na2O+CO2 === Na2CO3,
③Na2O+2HCl === 2NaCl+H2O。
【微思考1】将氧化钠投入酚酞溶液中有什么现象
提示 将氧化钠投入酚酞溶液中,氧化钠与水反应生成氢氧化钠,故溶液变红。
二、Na2O2的性质与应用
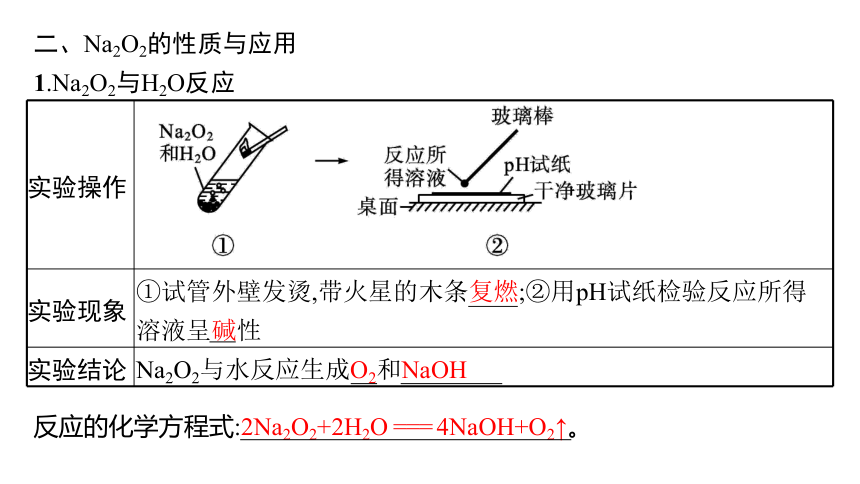
1.Na2O2与H2O反应
实验操作
实验现象 ①试管外壁发烫,带火星的木条复燃;②用pH试纸检验反应所得溶液呈碱性
实验结论 Na2O2与水反应生成O2和NaOH
反应的化学方程式:2Na2O2+2H2O === 4NaOH+O2↑。
2.Na2O2与CO2反应
反应的化学方程式:2Na2O2+2CO2 === 2Na2CO3+O2。
【微思考2】氧化钠属于碱性氧化物,过氧化钠是否也是碱性氧化物
提示 过氧化钠不属于碱性氧化物,因其与酸反应时除生成盐和水之外,还生成氧气,不符合碱性氧化物的定义。
3.用途
Na2O2可在呼吸面具或潜水艇中作O2的来源,作供氧剂。
【情境链接】魔术——吹气点火
某班级的晚会上,化学老师表演了一个魔术——吹气生火。老师将一小团棉花放在石棉网上,通过细管用嘴向棉花团内慢慢地、连续地吹气,一会棉花燃烧起来。
表演完后,老师说棉花中包有过氧化钠固体。请思考该魔术的实验原理是什么
提示 原理为:过氧化钠能与二氧化碳、水蒸气反应产生氧气并放出大量的热,使棉花燃烧。
【自我小测】
1.判断正误:
(1)Na2O与Na2O2均为碱性氧化物。( )
提示 ×。Na2O2与酸反应生成盐、水和氧气,故不为碱性氧化物。
(2)Na2O与Na2O2中氧的化合价分别为-2和-1。( )
提示 √。
(3)Na2O和Na2O2与水反应均为化合反应。( )
提示 ×。Na2O2和水反应生成氢氧化钠与氧气,不属于化合反应。
(4)Na2O2与CO2反应时,CO2为还原剂。( )
提示 ×。Na2O2与CO2反应时,Na2O2既是氧化剂又是还原剂。
2.氧化钠与过氧化钠的共同之处是( )
A.都是淡黄色固体
B.都能与水作用生成碱
C.都能与二氧化碳反应生成氧气
D.氧元素的化合价都是-2价
B
新知 氧化钠和过氧化钠的性质
【问题探究】
某同学设计了一个“滴水点火,水火相容”的魔术实验,他用脱脂棉包住一些过氧化钠粉末放在石棉网上,向脱脂棉上滴几滴蒸馏水,结果脱脂棉竟然剧烈燃烧起来。
(1)写出上述魔术的反应的化学方程式。反应中的氧化剂、还原剂分别是什么
提示 2Na2O2+2H2O === 4NaOH+O2↑。反应中的氧化剂、还原剂都是Na2O2。
(2)脱脂棉剧烈燃烧的原因是什么
提示 反应放热和生成O2,使脱脂棉在O2中达到着火点而燃烧。
素养提升
(3)上述反应中Na2O2表现什么性质
提示 Na2O2中氧元素的化合价一部分由-1价升高到0价,一部分由-1价降低到-2价,表现氧化性和还原性。
(4)魔术前后固体的质量如何变化
提示 增大。反应前后2个Na2O2生成4个NaOH,质量增加。
【深化拓展】
1.Na2O2与Na2O的比较
名称 氧化钠 过氧化钠
化学式 Na2O Na2O2
颜色、状态 白色固体 淡黄色固体
氧元素化合价 -2价 -1价
物质类别 碱性氧化物 过氧化物
生成条件 常温下金属钠在空气中被氧化 在空气中点燃或加热金属钠
名称 氧化钠 过氧化钠
稳定性 不稳定,易转化成Na2O2 较稳定
与H2O反应 Na2O+H2O===2NaOH 2Na2O2+2H2O===4NaOH+O2↑
与CO2反应 Na2O+CO2===Na2CO3 2Na2O2+2CO2===2Na2CO3+O2
与盐酸反应 Na2O+2HCl===2NaCl+H2O 2Na2O2+4HCl===4NaCl+2H2O+O2↑
主要用途 制备氢氧化钠 做强氧化剂、漂白剂、供氧剂等
2.Na2O2强氧化性的表现
3.Na2O2与CO2、H2O反应的量的关系
(1)分子数的关系。
无论是CO2或H2O的单一物质还是两者的混合物,通过足量的Na2O2时,放出O2的分子数与CO2或H2O或CO2和H2O的混合物的分子数之比均为1∶2。
(2)电子转移关系。
当Na2O2与CO2或H2O反应时,每生成1个O2分子均转移2个电子,且在反应中Na2O2既是氧化剂又是还原剂。
(3)固体质量关系。
分析反应的化学方程式,可得下列关系式:
①与CO2反应时,固体增加的质量等于与消耗的CO2等分子数的CO的质量。
②与H2O反应时,固体增加的质量等于与消耗的H2O等分子数的H2的质量。
【素能应用】
例 下列关于Na2O2的叙述中正确的是( )
A.Na2O2是淡黄色固体,久置于空气中变成Na2O
B.Na2O2与水的反应中,Na2O2只做氧化剂
C.Na2O2属于碱性氧化物
D.Na2O2与CO2或H2O反应后,固体质量都将增大
D
变式训练1将16 g甲烷(CH4)在64 g氧气中完全燃烧后的产物全部通入足量的过氧化钠中,充分反应后,固体增加的质量为( )
A.48 g B.16 g
C.80 g D.32 g
D
变式训练2对于反应:2Na2O2+2H2O === 4NaOH+O2↑,下列说法中正确的是( )
A.Na2O2是氧化剂,H2O是还原剂
B.当2分子H2O参加反应时,生成1分子O2
C.当生成1分子O2时,转移的电子数为4
D.每有18 g H2O与足量Na2O2反应,则固体增重4 g
B
素养脉络
1.下列金属化合物中最方便用于潜水艇舱内供氧的是( )
A.KMnO4 B.KClO3
C.KNO3 D.Na2O2
素养巩固
D
2.下列关于钠及其化合物的叙述正确的是( )
A.Na2O和Na2O2都能与CO2反应,且产物相同
B.用钠与空气反应制纯净的Na2O2,空气必须经过固体NaOH处理后,才能与钠反应
C.Na、Na2O、Na2O2都具有强还原性
D.在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2
B
3.过氧化钠具有强氧化性,可用作漂白剂。向紫色石蕊溶液中加入过量Na2O2粉末振荡,可观察到的现象是( )
A.溶液仍为紫色
B.最终溶液褪色,而无其他现象
C.溶液最终变蓝色
D.溶液中有气泡产生,溶液最终变为无色
D
4.(2021河南洛阳高一期中)下列反应中,Na2O2只表现出氧化性的是( )
A.2Na2O2+2H2O === 4NaOH+O2↑
B.2Na2O2+2H2SO4 === 2Na2SO4+2H2O+O2↑
C.Na2O2+SO2 === Na2SO4
D.5Na2O2+2KMnO4+8H2SO4 === 5Na2SO4+K2SO4+2MnSO4+5O2↑+8H2O
C
5.为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、不会在空气中燃烧的气体,但能使带火星的木条复燃。
(1)A是 。
(2)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是 。
(3)若C是一种黑色粉末,则B物质是 ,C物质的作用是 。
(4)洗气瓶中装的试剂D是 ,其作用是 。所制得的气体用 法收集。
答案 (1)O2
(2)2Na2O2+2H2O === 4NaOH+O2↑
(3)H2O2 催化剂
(4)浓硫酸 除去O2中的水蒸气 向上排空气
再 见
第一节 钠及其化合物
第二章 海水中的重要元素—— 钠和氯
第2课时 氧化钠和过氧化钠
素养目标
1.通过实验探究认识氧化钠、过氧化钠的化学性质,掌握钠的氧化物的用途,培养科学探究意识。
2.能从物质组成和化合价的角度认识氧化钠、过氧化钠的性质及物质的分类,培养宏观辨识与微观探析意识。
3.能通过过氧化钠与水及二氧化碳的反应,推理分析在反应中质量、体积的变化及电子转移情况,培养学生的证据意识。
【知识铺垫】
1.一小块钠在空气中放置生成的一系列产物有Na2O、NaOH、Na2CO3·10H2O、Na2CO3。
2.钠在空气中燃烧的化学方程式为2Na+O2 Na2O2。
3.在Na2O和Na2O2中,钠元素的化合价都是+1价,而氧元素的化合价分别是
-2价和-1价。
素养初探
【必备知识】
一、Na2O的性质
Na2O为白色固体,与CaO具有相似的化学性质,故Na2O是一种碱性氧化物。常见的转化关系如下:
写出上述转化的化学方程式
①Na2O+H2O === 2NaOH,
②Na2O+CO2 === Na2CO3,
③Na2O+2HCl === 2NaCl+H2O。
【微思考1】将氧化钠投入酚酞溶液中有什么现象
提示 将氧化钠投入酚酞溶液中,氧化钠与水反应生成氢氧化钠,故溶液变红。
二、Na2O2的性质与应用
1.Na2O2与H2O反应
实验操作
实验现象 ①试管外壁发烫,带火星的木条复燃;②用pH试纸检验反应所得溶液呈碱性
实验结论 Na2O2与水反应生成O2和NaOH
反应的化学方程式:2Na2O2+2H2O === 4NaOH+O2↑。
2.Na2O2与CO2反应
反应的化学方程式:2Na2O2+2CO2 === 2Na2CO3+O2。
【微思考2】氧化钠属于碱性氧化物,过氧化钠是否也是碱性氧化物
提示 过氧化钠不属于碱性氧化物,因其与酸反应时除生成盐和水之外,还生成氧气,不符合碱性氧化物的定义。
3.用途
Na2O2可在呼吸面具或潜水艇中作O2的来源,作供氧剂。
【情境链接】魔术——吹气点火
某班级的晚会上,化学老师表演了一个魔术——吹气生火。老师将一小团棉花放在石棉网上,通过细管用嘴向棉花团内慢慢地、连续地吹气,一会棉花燃烧起来。
表演完后,老师说棉花中包有过氧化钠固体。请思考该魔术的实验原理是什么
提示 原理为:过氧化钠能与二氧化碳、水蒸气反应产生氧气并放出大量的热,使棉花燃烧。
【自我小测】
1.判断正误:
(1)Na2O与Na2O2均为碱性氧化物。( )
提示 ×。Na2O2与酸反应生成盐、水和氧气,故不为碱性氧化物。
(2)Na2O与Na2O2中氧的化合价分别为-2和-1。( )
提示 √。
(3)Na2O和Na2O2与水反应均为化合反应。( )
提示 ×。Na2O2和水反应生成氢氧化钠与氧气,不属于化合反应。
(4)Na2O2与CO2反应时,CO2为还原剂。( )
提示 ×。Na2O2与CO2反应时,Na2O2既是氧化剂又是还原剂。
2.氧化钠与过氧化钠的共同之处是( )
A.都是淡黄色固体
B.都能与水作用生成碱
C.都能与二氧化碳反应生成氧气
D.氧元素的化合价都是-2价
B
新知 氧化钠和过氧化钠的性质
【问题探究】
某同学设计了一个“滴水点火,水火相容”的魔术实验,他用脱脂棉包住一些过氧化钠粉末放在石棉网上,向脱脂棉上滴几滴蒸馏水,结果脱脂棉竟然剧烈燃烧起来。
(1)写出上述魔术的反应的化学方程式。反应中的氧化剂、还原剂分别是什么
提示 2Na2O2+2H2O === 4NaOH+O2↑。反应中的氧化剂、还原剂都是Na2O2。
(2)脱脂棉剧烈燃烧的原因是什么
提示 反应放热和生成O2,使脱脂棉在O2中达到着火点而燃烧。
素养提升
(3)上述反应中Na2O2表现什么性质
提示 Na2O2中氧元素的化合价一部分由-1价升高到0价,一部分由-1价降低到-2价,表现氧化性和还原性。
(4)魔术前后固体的质量如何变化
提示 增大。反应前后2个Na2O2生成4个NaOH,质量增加。
【深化拓展】
1.Na2O2与Na2O的比较
名称 氧化钠 过氧化钠
化学式 Na2O Na2O2
颜色、状态 白色固体 淡黄色固体
氧元素化合价 -2价 -1价
物质类别 碱性氧化物 过氧化物
生成条件 常温下金属钠在空气中被氧化 在空气中点燃或加热金属钠
名称 氧化钠 过氧化钠
稳定性 不稳定,易转化成Na2O2 较稳定
与H2O反应 Na2O+H2O===2NaOH 2Na2O2+2H2O===4NaOH+O2↑
与CO2反应 Na2O+CO2===Na2CO3 2Na2O2+2CO2===2Na2CO3+O2
与盐酸反应 Na2O+2HCl===2NaCl+H2O 2Na2O2+4HCl===4NaCl+2H2O+O2↑
主要用途 制备氢氧化钠 做强氧化剂、漂白剂、供氧剂等
2.Na2O2强氧化性的表现
3.Na2O2与CO2、H2O反应的量的关系
(1)分子数的关系。
无论是CO2或H2O的单一物质还是两者的混合物,通过足量的Na2O2时,放出O2的分子数与CO2或H2O或CO2和H2O的混合物的分子数之比均为1∶2。
(2)电子转移关系。
当Na2O2与CO2或H2O反应时,每生成1个O2分子均转移2个电子,且在反应中Na2O2既是氧化剂又是还原剂。
(3)固体质量关系。
分析反应的化学方程式,可得下列关系式:
①与CO2反应时,固体增加的质量等于与消耗的CO2等分子数的CO的质量。
②与H2O反应时,固体增加的质量等于与消耗的H2O等分子数的H2的质量。
【素能应用】
例 下列关于Na2O2的叙述中正确的是( )
A.Na2O2是淡黄色固体,久置于空气中变成Na2O
B.Na2O2与水的反应中,Na2O2只做氧化剂
C.Na2O2属于碱性氧化物
D.Na2O2与CO2或H2O反应后,固体质量都将增大
D
变式训练1将16 g甲烷(CH4)在64 g氧气中完全燃烧后的产物全部通入足量的过氧化钠中,充分反应后,固体增加的质量为( )
A.48 g B.16 g
C.80 g D.32 g
D
变式训练2对于反应:2Na2O2+2H2O === 4NaOH+O2↑,下列说法中正确的是( )
A.Na2O2是氧化剂,H2O是还原剂
B.当2分子H2O参加反应时,生成1分子O2
C.当生成1分子O2时,转移的电子数为4
D.每有18 g H2O与足量Na2O2反应,则固体增重4 g
B
素养脉络
1.下列金属化合物中最方便用于潜水艇舱内供氧的是( )
A.KMnO4 B.KClO3
C.KNO3 D.Na2O2
素养巩固
D
2.下列关于钠及其化合物的叙述正确的是( )
A.Na2O和Na2O2都能与CO2反应,且产物相同
B.用钠与空气反应制纯净的Na2O2,空气必须经过固体NaOH处理后,才能与钠反应
C.Na、Na2O、Na2O2都具有强还原性
D.在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2
B
3.过氧化钠具有强氧化性,可用作漂白剂。向紫色石蕊溶液中加入过量Na2O2粉末振荡,可观察到的现象是( )
A.溶液仍为紫色
B.最终溶液褪色,而无其他现象
C.溶液最终变蓝色
D.溶液中有气泡产生,溶液最终变为无色
D
4.(2021河南洛阳高一期中)下列反应中,Na2O2只表现出氧化性的是( )
A.2Na2O2+2H2O === 4NaOH+O2↑
B.2Na2O2+2H2SO4 === 2Na2SO4+2H2O+O2↑
C.Na2O2+SO2 === Na2SO4
D.5Na2O2+2KMnO4+8H2SO4 === 5Na2SO4+K2SO4+2MnSO4+5O2↑+8H2O
C
5.为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、不会在空气中燃烧的气体,但能使带火星的木条复燃。
(1)A是 。
(2)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是 。
(3)若C是一种黑色粉末,则B物质是 ,C物质的作用是 。
(4)洗气瓶中装的试剂D是 ,其作用是 。所制得的气体用 法收集。
答案 (1)O2
(2)2Na2O2+2H2O === 4NaOH+O2↑
(3)H2O2 催化剂
(4)浓硫酸 除去O2中的水蒸气 向上排空气
再 见
