上学期高一化学人教版(2019)必修第一册4.1原子结构(共31张PPT)
文档属性
| 名称 | 上学期高一化学人教版(2019)必修第一册4.1原子结构(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-22 18:42:25 | ||
图片预览











文档简介
(共31张PPT)
第一节 原子结构与元素周期表
第1课时 原 子 结 构
物质结构 元素周期律
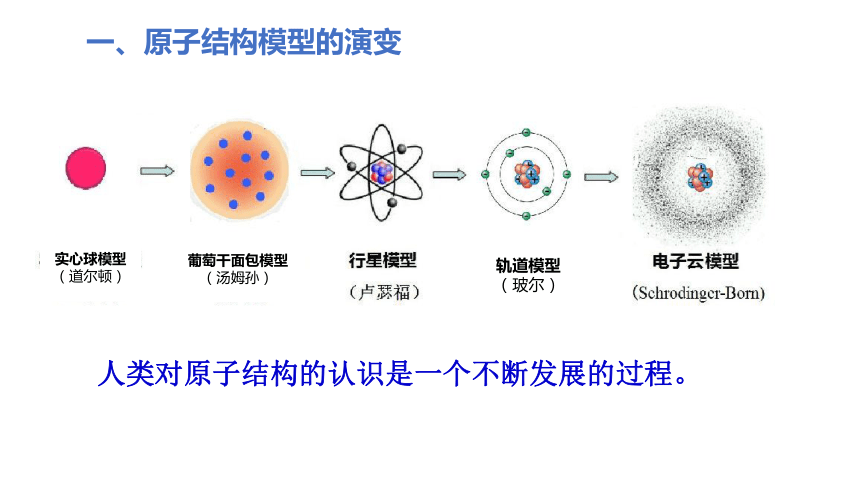
实心球模型
道尔顿模型(1803年):原子是构成物质的基本粒子,他们是坚实的、不可再分的实心球。
一、原子结构模型的演变
1897年,汤姆生发现原子中存在电子。正电荷均匀地分布在原子之中,电子则散布在正电荷之中。
葡萄干面包式模型
汤姆生是最早发现电子的科学家。
α粒子散射实验
如何解释这个现象呢?
金箔
荧光屏
狭缝
α粒子
发射源
1911年,卢瑟福根据ɑ粒子散射实验,提出了带核的原子结构模型(行星模型)。原子由原子核和核外电子构成,原子核带正电,位于原子中心,电子带负电,在原子核的周围高速运转,就像行星环绕太阳运转一样。
核式结构模型
(行星模型)
1913年,玻尔在研究氢原子光谱时,引入了量子论观点,提出了新的原子结构模型(轨道模型):原子核外电子在一系列稳定的轨道上运动;每个轨道都具有一个确定的能量值;核外电子在这些稳定的轨道上运动时,处于稳定状态。
20世纪初,科学家揭示了微观世界波粒二象性的规律,认识到原子核外电子的运动不遵循经典力学的原理,必须用量子力学模型描述原子核外电子的运动。从而提出了现代的原子结构模型(即电子云模型,电子绕核运动形成一个带负电荷的云团)
轨道模型
(玻尔)
实心球模型
(道尔顿)
葡萄干面包模型
(汤姆孙)
人类对原子结构的认识是一个不断发展的过程。
一、原子结构模型的演变
原子虽小,但可再分
1、原子结构
二、原子的构成
核电荷数=核内质子数=核外电子数=原子序数
原子
原子核
核外电子:带负电
质子:
中子:
带正电
不带电
(电中性)
2、质量关系
质子:一个质子的相对质量是1.007,近似整数值为1
中子:一个中子的相对质量是1.008, 近似整数值是1
电子:一个电子的相对质量是1/1836,可忽略。
可知:原子的质量主要集中在原子核上。
(1)概念:质子和中子的相对质量都近似为1,忽略电子
的质量,将原子核内所有_____和_____的相对质量取近
似整数值相加,所得的数值叫做质量数。
(2)关系:质量数(A)=____________________
质量数
质子
中子
质子数(Z)+中子数(N)
原子的质量数近似等于原子的相对原子质量
(1)某种硫原子的中子数是18,则其质量数是34。( )
巧判断:
(2)质量数就是相对原子质量。 ( )
√
×
X
A
Z
——元素符号
质量数 ——
核电荷数 ——
(质子数)
练一练:请用AZX表示上表O、Na、Cl原子的组成。
3、原子的表示方法
A——代表质量数;
Z——代表核电荷数;
c——代表离子所带的电荷数;
d——代表化合价;
e——代表一个分子中的原子个数;
A
Z
+
d
X
c+
-
-
e
-
-
O
8
16
2
2-
- 1
4、构成原子的微粒之间的数量关系
核电荷数=质子数=核外电子数=原子序数
质量数(A)=质子数(Z)+中子数(N)
1.原子 :核电荷数=质子数=核外电子数=原子序数
2. 阳离子 :核外电子数=质子数-电荷数
3. 阴离子 : 核外电子数=质子数+电荷数
请指出Al、Al3+ 、 O2-中所含的质子数和电子数。
2.已知A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,与它们对应的原子的核电荷数由大到小的顺序是 。
练习
E、D、C、B、A
1.现有bXn-和aYm+两种离子,它们的电子数相同,则 a 与下列式子有相等关系的是( )
(A)b-m-n (B) b+m+n
(C)b-m+n (D) b+m-n
B
粒子符号 质子数 电子数
S2-
NH4+
OH-
3、填表
16
18
11
10
9
10
电子层
概念:在多电子原子里,把电子运动的_________的区域
简化为_____________,称作电子层。
能量不同
不连续的壳层
不同电子层的表示及能量关系
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由___到___ 能量高低 由___到___ 近
远
低
高
三、核外电子排布
洋葱是我们非常熟悉的一种蔬菜,洋葱切开后,我们会看到里面一层一层地呈现,电子层模型就类似于切开的洋葱。请思考:
情境思考:
(1)原子核周围是否真实存在这样的壳层
提示:电子层不是真实存在的,是科学家为了表达形象,根据电子经常出现的区域而设想的结构模型。
(2)电子在原子核外是否沿固定轨迹做高速旋转
提示:电子在某一区域内做无规则运动。
① 能量最低原理
电子总是尽量先排在能量最低的电子层里,
然后排在能量逐步升高的电子层里。如:先排K层,排满K层后再排L层,排满L层后再排M层,……
电子分层排布
稀有气体元素原子电子层排布
核电荷数 元素名称 元素符号 各电子层的电子数 K L M N O P 最外层电子数
2 氦 He
10 氖 Ne 2
18 氩 Ar 2 8
36 氪 Kr 2 8 8
54 氙 Xe 2 8 18 8
86 氡 Rn 2 8 18 18 8
各层最多电子数
8
8
18
18
32
2
2
8
18
32
?
?
原子核外电子排布
思考:K、L、M、N
电子层最多可容纳的电子数依次是多少?
与电子层数n之间有何关系?
电子层 K L M N …
电子层上最多
容纳的电子数
2
8
18
32 …
2×12 2×22 2×32 2×42 …
②电子层最多容纳的电子数为2n2个。
电子排布规律
稀有气体元素原子电子层排布
核电荷数 元素名称 元素符号 各电子层的电子数 K L M N O P 最外层电子数
2 氦 He
10 氖 Ne 2
18 氩 Ar 2 8
36 氪 Kr 2 8 8
54 氙 Xe 2 8 18 8
86 氡 Rn 2 8 18 18 8
各层最多电子数
2
8
8
18
18
32
2
8
8
8
8
8
2
8
18
32
?
?
③最外层最多只能容纳 8个电子(K层为最外层时不能超过2个)
次外层最多只能容纳18个电子
原子核外电子的排布
分层排布
1.能量最低原理
2.每层最多容纳电子数目是2n2
3.最外层电子数目不超过8个
(K层为最外层时不超过2个)
次外层电子数目不超过18个
【小结】
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
+
12
第1层
第2层
第3层
2
8
2
原子核
质子数
该电子层上的电子
电子层
原子核
原子核带正电
质子数
四、原子结构示意图
1.依据原子核外电子的排布规律,请完成S、Al、K 、O原子结构示意图.
课堂练习
根据原子光谱和理论分析
核电荷数为1~20的元素原子核外电子层排布
Ca
K
请画出Al3+、S2—离子结构示意图 。
请写出硫化铝的化学式 。
Al2S3
前20号元素中,次外层电子数等于最外层电子数的元素是 。
讨论 可能情形一
电子层数 2
次外层电子数 2
最外层电子数 2
元素符号 Be
Be、Ar
挑战题
可能情形二
3
8
8
Ar
1H的中子数为0,该原子失去电子即为质子
1
非金属元素的最外层电子数都大于3
稀有气体元素原子的最外层电子数都是8
原子最外层只有1个电子的元素一定是金属元素
是非判断题
H例外,最外层只有1个电子
He例外,最外层只有2个电子
H是非金属
1.下列原子结构示意图中,正确的是: ( )
2.某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为: ( )
A.14 B.15 C.16 D.17
A.
B.
C.
D.
B
A
练习
3.已知最外层电子数相等的元素原子具有相似化学性质。下列原子中,与氧元素原子的化学性质相似的是( )
A. Ne B. Mg C. S D. C
C
第一节 原子结构与元素周期表
第1课时 原 子 结 构
物质结构 元素周期律
实心球模型
道尔顿模型(1803年):原子是构成物质的基本粒子,他们是坚实的、不可再分的实心球。
一、原子结构模型的演变
1897年,汤姆生发现原子中存在电子。正电荷均匀地分布在原子之中,电子则散布在正电荷之中。
葡萄干面包式模型
汤姆生是最早发现电子的科学家。
α粒子散射实验
如何解释这个现象呢?
金箔
荧光屏
狭缝
α粒子
发射源
1911年,卢瑟福根据ɑ粒子散射实验,提出了带核的原子结构模型(行星模型)。原子由原子核和核外电子构成,原子核带正电,位于原子中心,电子带负电,在原子核的周围高速运转,就像行星环绕太阳运转一样。
核式结构模型
(行星模型)
1913年,玻尔在研究氢原子光谱时,引入了量子论观点,提出了新的原子结构模型(轨道模型):原子核外电子在一系列稳定的轨道上运动;每个轨道都具有一个确定的能量值;核外电子在这些稳定的轨道上运动时,处于稳定状态。
20世纪初,科学家揭示了微观世界波粒二象性的规律,认识到原子核外电子的运动不遵循经典力学的原理,必须用量子力学模型描述原子核外电子的运动。从而提出了现代的原子结构模型(即电子云模型,电子绕核运动形成一个带负电荷的云团)
轨道模型
(玻尔)
实心球模型
(道尔顿)
葡萄干面包模型
(汤姆孙)
人类对原子结构的认识是一个不断发展的过程。
一、原子结构模型的演变
原子虽小,但可再分
1、原子结构
二、原子的构成
核电荷数=核内质子数=核外电子数=原子序数
原子
原子核
核外电子:带负电
质子:
中子:
带正电
不带电
(电中性)
2、质量关系
质子:一个质子的相对质量是1.007,近似整数值为1
中子:一个中子的相对质量是1.008, 近似整数值是1
电子:一个电子的相对质量是1/1836,可忽略。
可知:原子的质量主要集中在原子核上。
(1)概念:质子和中子的相对质量都近似为1,忽略电子
的质量,将原子核内所有_____和_____的相对质量取近
似整数值相加,所得的数值叫做质量数。
(2)关系:质量数(A)=____________________
质量数
质子
中子
质子数(Z)+中子数(N)
原子的质量数近似等于原子的相对原子质量
(1)某种硫原子的中子数是18,则其质量数是34。( )
巧判断:
(2)质量数就是相对原子质量。 ( )
√
×
X
A
Z
——元素符号
质量数 ——
核电荷数 ——
(质子数)
练一练:请用AZX表示上表O、Na、Cl原子的组成。
3、原子的表示方法
A——代表质量数;
Z——代表核电荷数;
c——代表离子所带的电荷数;
d——代表化合价;
e——代表一个分子中的原子个数;
A
Z
+
d
X
c+
-
-
e
-
-
O
8
16
2
2-
- 1
4、构成原子的微粒之间的数量关系
核电荷数=质子数=核外电子数=原子序数
质量数(A)=质子数(Z)+中子数(N)
1.原子 :核电荷数=质子数=核外电子数=原子序数
2. 阳离子 :核外电子数=质子数-电荷数
3. 阴离子 : 核外电子数=质子数+电荷数
请指出Al、Al3+ 、 O2-中所含的质子数和电子数。
2.已知A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,与它们对应的原子的核电荷数由大到小的顺序是 。
练习
E、D、C、B、A
1.现有bXn-和aYm+两种离子,它们的电子数相同,则 a 与下列式子有相等关系的是( )
(A)b-m-n (B) b+m+n
(C)b-m+n (D) b+m-n
B
粒子符号 质子数 电子数
S2-
NH4+
OH-
3、填表
16
18
11
10
9
10
电子层
概念:在多电子原子里,把电子运动的_________的区域
简化为_____________,称作电子层。
能量不同
不连续的壳层
不同电子层的表示及能量关系
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由___到___ 能量高低 由___到___ 近
远
低
高
三、核外电子排布
洋葱是我们非常熟悉的一种蔬菜,洋葱切开后,我们会看到里面一层一层地呈现,电子层模型就类似于切开的洋葱。请思考:
情境思考:
(1)原子核周围是否真实存在这样的壳层
提示:电子层不是真实存在的,是科学家为了表达形象,根据电子经常出现的区域而设想的结构模型。
(2)电子在原子核外是否沿固定轨迹做高速旋转
提示:电子在某一区域内做无规则运动。
① 能量最低原理
电子总是尽量先排在能量最低的电子层里,
然后排在能量逐步升高的电子层里。如:先排K层,排满K层后再排L层,排满L层后再排M层,……
电子分层排布
稀有气体元素原子电子层排布
核电荷数 元素名称 元素符号 各电子层的电子数 K L M N O P 最外层电子数
2 氦 He
10 氖 Ne 2
18 氩 Ar 2 8
36 氪 Kr 2 8 8
54 氙 Xe 2 8 18 8
86 氡 Rn 2 8 18 18 8
各层最多电子数
8
8
18
18
32
2
2
8
18
32
?
?
原子核外电子排布
思考:K、L、M、N
电子层最多可容纳的电子数依次是多少?
与电子层数n之间有何关系?
电子层 K L M N …
电子层上最多
容纳的电子数
2
8
18
32 …
2×12 2×22 2×32 2×42 …
②电子层最多容纳的电子数为2n2个。
电子排布规律
稀有气体元素原子电子层排布
核电荷数 元素名称 元素符号 各电子层的电子数 K L M N O P 最外层电子数
2 氦 He
10 氖 Ne 2
18 氩 Ar 2 8
36 氪 Kr 2 8 8
54 氙 Xe 2 8 18 8
86 氡 Rn 2 8 18 18 8
各层最多电子数
2
8
8
18
18
32
2
8
8
8
8
8
2
8
18
32
?
?
③最外层最多只能容纳 8个电子(K层为最外层时不能超过2个)
次外层最多只能容纳18个电子
原子核外电子的排布
分层排布
1.能量最低原理
2.每层最多容纳电子数目是2n2
3.最外层电子数目不超过8个
(K层为最外层时不超过2个)
次外层电子数目不超过18个
【小结】
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
+
12
第1层
第2层
第3层
2
8
2
原子核
质子数
该电子层上的电子
电子层
原子核
原子核带正电
质子数
四、原子结构示意图
1.依据原子核外电子的排布规律,请完成S、Al、K 、O原子结构示意图.
课堂练习
根据原子光谱和理论分析
核电荷数为1~20的元素原子核外电子层排布
Ca
K
请画出Al3+、S2—离子结构示意图 。
请写出硫化铝的化学式 。
Al2S3
前20号元素中,次外层电子数等于最外层电子数的元素是 。
讨论 可能情形一
电子层数 2
次外层电子数 2
最外层电子数 2
元素符号 Be
Be、Ar
挑战题
可能情形二
3
8
8
Ar
1H的中子数为0,该原子失去电子即为质子
1
非金属元素的最外层电子数都大于3
稀有气体元素原子的最外层电子数都是8
原子最外层只有1个电子的元素一定是金属元素
是非判断题
H例外,最外层只有1个电子
He例外,最外层只有2个电子
H是非金属
1.下列原子结构示意图中,正确的是: ( )
2.某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为: ( )
A.14 B.15 C.16 D.17
A.
B.
C.
D.
B
A
练习
3.已知最外层电子数相等的元素原子具有相似化学性质。下列原子中,与氧元素原子的化学性质相似的是( )
A. Ne B. Mg C. S D. C
C
