上学期高一化学人教版(2019)必修第一册4.2.1元素性质的周期性变化规律(共26张PPT)
文档属性
| 名称 | 上学期高一化学人教版(2019)必修第一册4.2.1元素性质的周期性变化规律(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 696.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-22 18:43:14 | ||
图片预览



文档简介
(共26张PPT)
第一节
原子结构与元素周期表
第二节
元素周期律
第四章
铁 金属材料
第三节
化学键
CONTENTS
本节内容
元素金属性和非金属性的强弱比较
1~18号元素性质的周期性变化规律
二
一
同周期元素金属性和非金属性的递变规律
三
第二节 原子结构与元素周期表
第1课时 元素性质的周期性变化规律
课堂讲解
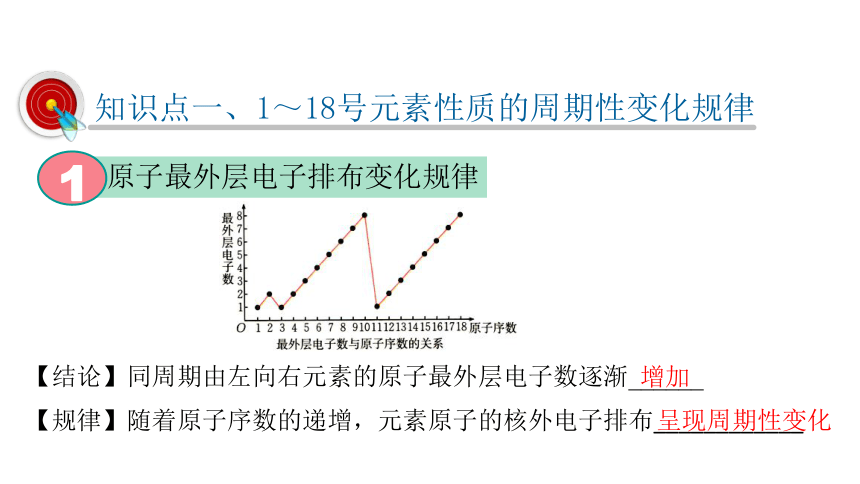
知识点一、1~18号元素性质的周期性变化规律
原子最外层电子排布变化规律
1
【结论】同周期由左向右元素的原子最外层电子数逐渐______
呈现周期性变化
增加
【规律】随着原子序数的递增,元素原子的核外电子排布____________
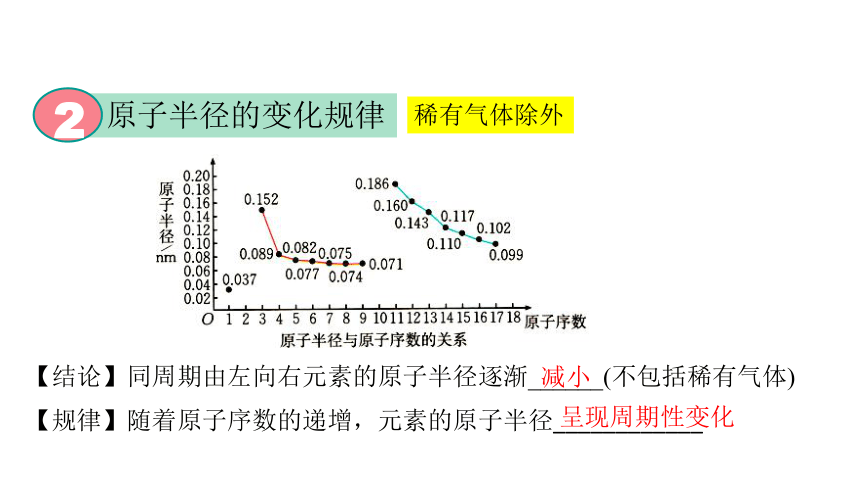
原子半径的变化规律
2
课堂讲解
稀有气体除外
【结论】同周期由左向右元素的原子半径逐渐______(不包括稀有气体)
呈现周期性变化
减小
【规律】随着原子序数的递增,元素的原子半径____________
课堂讲解
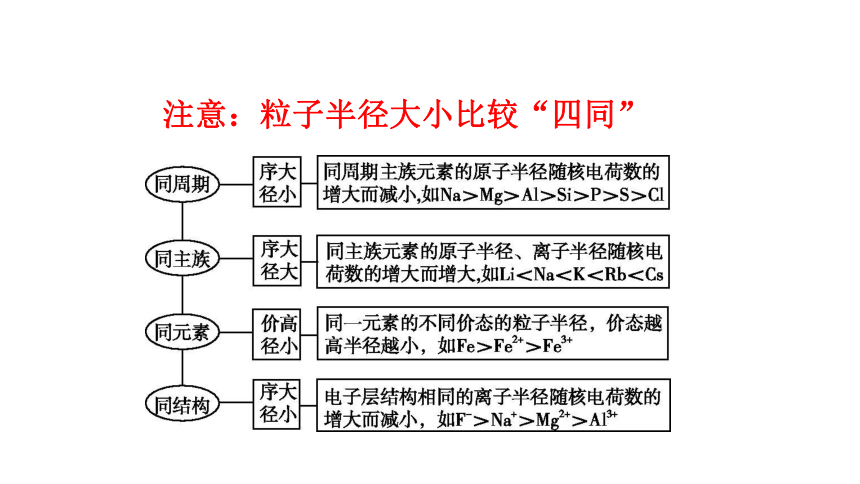
注意:粒子半径大小比较“四同”
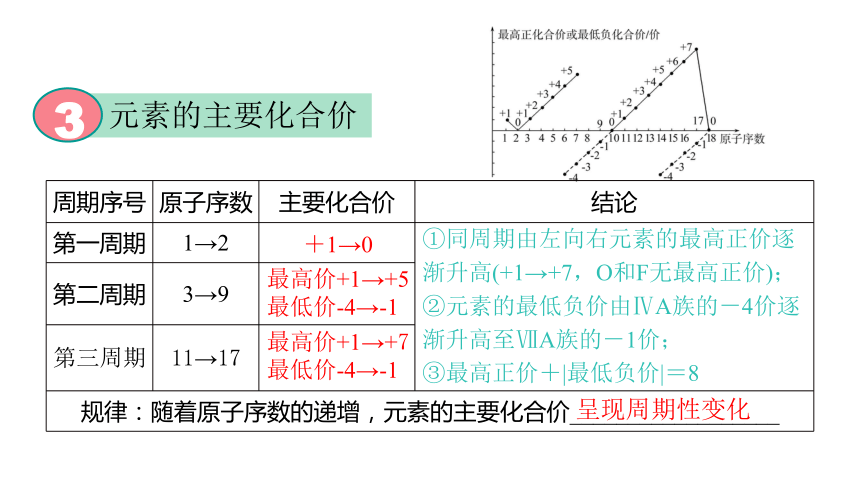
元素的主要化合价
3
课堂讲解
周期序号 原子序数 主要化合价 结论
第一周期 1→2
第二周期 3→9 第三周期 11→17 规律:随着原子序数的递增,元素的主要化合价__________________ +1→0
最高价+1→+5
最低价-4→-1
最高价+1→+7
最低价-4→-1
①同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价);
②元素的最低负价由ⅣA族的-4价逐渐升高至ⅦA族的-1价;
③最高正价+|最低负价|=8
呈现周期性变化
【例1】判断正误
(1)第二周期元素从左至右,最高正价从+1递增到+7( )
(2)原子半径最小的元素是氢元素( )
(3)同周期元素最外层电子数都是从1递增到8( )
(4)氢元素除了有+1价外,也可以有-1价,如NaH( )
课堂练习
√
√
×
×
【例2】下图表示1~18号元素原子结构或性质随核电荷数递增的变化。该图中纵坐标表示( )
A.电子层数 B.最外层电子数 C.最高化合价 D.原子半径
B
课堂练习
【例3】下列各组粒子中,粒子半径按由大到小顺序排列的是( )A.O、Cl、S、P B.Al3+、Mg2+、Ca2+、Ba2+C.K+、Mg2+、Al3+、H+ D.Li、Na、K、Cs
课堂练习
C
【例4】某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为( )A.H2RO3 B.H2RO4 C.HRO3 D.H3RO4
B
课堂练习
【例5】34号元素硒(Se)被国内外医药界和营养学界尊称为“生命的火种”,享有“长寿元素”“抗癌之王”“心脏守护神”“天然解毒剂”等美誉,其原子结构示意图为 。
(1)推断该元素在周期表中的位置:_______________。
(2)按要求写化学式:①气态氢化物为______;②最高价氧化物对应的水化物为________。
(3)推测35Br的最高正化合价和最低负化合价的数值分别是___、____,原子半径的大小关系为:r(Se)___r(Br)(填“>”或“<”)。
第四周期ⅥA族
H2Se
H2SeO4
+7
-1
>
二、元素金属性和非金属性的强弱比较
元素金属性强弱的比较
1
课堂讲解
(1)单质与水(或酸)反应置换出氢越容易,金属性越强
(2)元素最高价氧化物对应的水化物碱性越强,金属性越强
(3)元素原子对应的阳离子氧化性越强,金属性越弱
(4)金属间的置换反应,被置换出的金属元素的金属性较弱。
元素非金属性强弱的比较
2
课堂讲解
(1)单质与氢气反应越容易,非金属性越强
(2)气态氢化物的稳定性越强,非金属性越强
(3)最高价氧化物对应的水化物酸性越强,非金属性越强
(4)元素原子对应的阴离子或氢化物还原性越强,非金属性越弱
(5)单质间的置换反应,被置换出的非金属元素的非金属性较弱
(6)单质氧化性越强,非金属性一般越强。
三、同周期元素金属性和非金属性的递变规律
课堂讲解
以第三周期元素为例探究元素性质的递变规律。
第三周期元素电子层数_____,由左向右元素的原子最外层电子数逐渐_____,原子半径依次_____,失电子的能力依次_____,得电子的能力依次_____,预测它们的金属性依次_____,非金属性依次_____。
相同
增加
减小
减弱
增强
减弱
增强
钠、镁、铝元素金属性的递变规律
1
课堂讲解
(1)钠、镁元素金属性强弱的实验探究
①原理:金属与水反应置换出H2的难易
②实验操作:
③现象:加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为_____色。
④结论:镁与_______几乎不反应,能与热水反应,反应的化学方程式为______________________________。
结合前面所学钠与水的反应,可得出金属性:Na___Mg
粉红
冷水
>
Al Mg
原理 实验操作
(2)镁、铝元素金属性强弱的实验探究
最高价氧化物对应水化物的碱性强弱
课堂讲解
沉淀溶 解情况 沉淀________ 沉淀________ 沉淀_____ 沉淀_______
相关反应的化学方程式 ________________________ ________________________ ______________________________
实验结论 金属性:Mg___Al 逐渐溶解
逐渐溶解
溶解
不溶解
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
Mg(OH)2+2HCl=MgCl2 +2H2O
>
课堂讲解
(3)钠、镁、铝的最高价氧化物对应水化物的碱性
NaOH Mg(OH)2 Al(OH)3
分类
碱性强弱 NaOH___Mg(OH)2___Al(OH)3 结论 金属性:Na___Mg___Al 两性氢氧化物
>
>
>
>
强碱
中强碱
课堂讲解
硅、磷、硫、氯的非金属性的递变规律
2
课堂讲解
Si P S Cl
最高价氧化物对应水化物的酸性 H2SiO3 _____ H3PO4 _______ H2SO4 _____ HClO4
_____
酸性:_____________________________ 结论 Si、P、S、Cl的非金属性逐渐_____ HClO4>H2SO4>H3PO4>H2SiO3
增强
弱酸
强酸
中强酸
强酸
同周期元素性质递变规律
3
课堂讲解
同一周期从左到右,元素金属性逐渐_____,非金属性逐渐_____
减弱
增强
元素周期律
4
(1)内容:元素的性质随着_________的递增而呈周期性的变化。
(2)实质:元素性质的周期性变化是原子的____________的周期性变化的必然结果。
核外电子排布
原子序数
课堂练习
【例6】判断正误。
(1)Al(OH)3是两性氢氧化物,与氨水、盐酸均可反应( )
(2)盐酸可以与Na2CO3溶液反应生成CO2,可由此推出非金属性Cl>C( )
(3)第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性( )
(4)第二周期元素从左至右金属性逐渐减弱,非金属性逐渐增强( )
×
√
×
×
课堂练习
【例7】除第一周期外,下列关于同周期主族元素的变化规律的叙述中不正确的是( )
A.从左到右,原子半径逐渐减小
B.从左到右,单质的氧化性逐渐减弱,还原性逐渐增强
C.从左到右,元素最高价氧化物对应水化物碱性逐渐减弱,酸性逐渐增强
D.从左到右,元素最高正化合价从+1递变到+7(氧、氟除外),最低负化合价从-4递变到-1
B
【例8】同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )A.最高价含氧酸的酸性:H3ZO4>H2YO4>HXO4B.非金属性:X>Y>ZC.气态氢化物的稳定性按X、Y、Z顺序逐渐增强D.元素的最低负化合价的绝对值按X、Y、Z顺序逐渐减小
课堂练习
B
【例9】短周期元素 W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为 21,下列关系正确的是( )
A.W、X、Y和Z均为非金属元素
B.氧化物对应水化物的酸性:Z>W
C.氢化物稳定性:WD.简单离子的半径:Y>X
W X
Y Z
课堂练习
C
课堂练习
【例10】在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是______(填元素符号,下同)。
(2)金属性最强的元素是______。
(3)最高价氧化物对应水化物酸性最强的是________(填化学式,下同)。
(4)最不稳定的气态氢化物是______。
(5)最高价氧化物对应水化物碱性最强的是________。
(6)氧化物中具有两性的是________。
Cl
Na
HClO4
SiH4
NaOH
Al2O3
【例11】元素A原子获得2个电子或元素B原子失去1个电子后形成的离子都与OH-具有相同的电子数,则:(1)A是________,B是________。(2)离子半径大小:A2-____(填“>”“<”或“=”)B+。(3)在由两种元素形成的化合物中,标出它们的化合价___________,并写出与水反应生成O2的化学方程式__________________________。
课堂练习
氧(或O)
钠(或Na)
>
2Na2O2+2H2O===4NaOH+O2↑
课堂小结
元素周期律
第一节
原子结构与元素周期表
第二节
元素周期律
第四章
铁 金属材料
第三节
化学键
CONTENTS
本节内容
元素金属性和非金属性的强弱比较
1~18号元素性质的周期性变化规律
二
一
同周期元素金属性和非金属性的递变规律
三
第二节 原子结构与元素周期表
第1课时 元素性质的周期性变化规律
课堂讲解
知识点一、1~18号元素性质的周期性变化规律
原子最外层电子排布变化规律
1
【结论】同周期由左向右元素的原子最外层电子数逐渐______
呈现周期性变化
增加
【规律】随着原子序数的递增,元素原子的核外电子排布____________
原子半径的变化规律
2
课堂讲解
稀有气体除外
【结论】同周期由左向右元素的原子半径逐渐______(不包括稀有气体)
呈现周期性变化
减小
【规律】随着原子序数的递增,元素的原子半径____________
课堂讲解
注意:粒子半径大小比较“四同”
元素的主要化合价
3
课堂讲解
周期序号 原子序数 主要化合价 结论
第一周期 1→2
第二周期 3→9 第三周期 11→17 规律:随着原子序数的递增,元素的主要化合价__________________ +1→0
最高价+1→+5
最低价-4→-1
最高价+1→+7
最低价-4→-1
①同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价);
②元素的最低负价由ⅣA族的-4价逐渐升高至ⅦA族的-1价;
③最高正价+|最低负价|=8
呈现周期性变化
【例1】判断正误
(1)第二周期元素从左至右,最高正价从+1递增到+7( )
(2)原子半径最小的元素是氢元素( )
(3)同周期元素最外层电子数都是从1递增到8( )
(4)氢元素除了有+1价外,也可以有-1价,如NaH( )
课堂练习
√
√
×
×
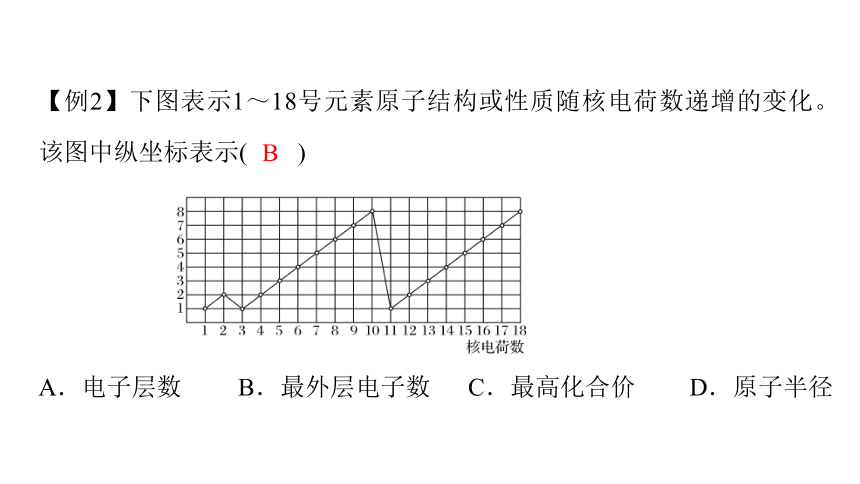
【例2】下图表示1~18号元素原子结构或性质随核电荷数递增的变化。该图中纵坐标表示( )
A.电子层数 B.最外层电子数 C.最高化合价 D.原子半径
B
课堂练习
【例3】下列各组粒子中,粒子半径按由大到小顺序排列的是( )A.O、Cl、S、P B.Al3+、Mg2+、Ca2+、Ba2+C.K+、Mg2+、Al3+、H+ D.Li、Na、K、Cs
课堂练习
C
【例4】某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为( )A.H2RO3 B.H2RO4 C.HRO3 D.H3RO4
B
课堂练习
【例5】34号元素硒(Se)被国内外医药界和营养学界尊称为“生命的火种”,享有“长寿元素”“抗癌之王”“心脏守护神”“天然解毒剂”等美誉,其原子结构示意图为 。
(1)推断该元素在周期表中的位置:_______________。
(2)按要求写化学式:①气态氢化物为______;②最高价氧化物对应的水化物为________。
(3)推测35Br的最高正化合价和最低负化合价的数值分别是___、____,原子半径的大小关系为:r(Se)___r(Br)(填“>”或“<”)。
第四周期ⅥA族
H2Se
H2SeO4
+7
-1
>
二、元素金属性和非金属性的强弱比较
元素金属性强弱的比较
1
课堂讲解
(1)单质与水(或酸)反应置换出氢越容易,金属性越强
(2)元素最高价氧化物对应的水化物碱性越强,金属性越强
(3)元素原子对应的阳离子氧化性越强,金属性越弱
(4)金属间的置换反应,被置换出的金属元素的金属性较弱。
元素非金属性强弱的比较
2
课堂讲解
(1)单质与氢气反应越容易,非金属性越强
(2)气态氢化物的稳定性越强,非金属性越强
(3)最高价氧化物对应的水化物酸性越强,非金属性越强
(4)元素原子对应的阴离子或氢化物还原性越强,非金属性越弱
(5)单质间的置换反应,被置换出的非金属元素的非金属性较弱
(6)单质氧化性越强,非金属性一般越强。
三、同周期元素金属性和非金属性的递变规律
课堂讲解
以第三周期元素为例探究元素性质的递变规律。
第三周期元素电子层数_____,由左向右元素的原子最外层电子数逐渐_____,原子半径依次_____,失电子的能力依次_____,得电子的能力依次_____,预测它们的金属性依次_____,非金属性依次_____。
相同
增加
减小
减弱
增强
减弱
增强
钠、镁、铝元素金属性的递变规律
1
课堂讲解
(1)钠、镁元素金属性强弱的实验探究
①原理:金属与水反应置换出H2的难易
②实验操作:
③现象:加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为_____色。
④结论:镁与_______几乎不反应,能与热水反应,反应的化学方程式为______________________________。
结合前面所学钠与水的反应,可得出金属性:Na___Mg
粉红
冷水
>
Al Mg
原理 实验操作
(2)镁、铝元素金属性强弱的实验探究
最高价氧化物对应水化物的碱性强弱
课堂讲解
沉淀溶 解情况 沉淀________ 沉淀________ 沉淀_____ 沉淀_______
相关反应的化学方程式 ________________________ ________________________ ______________________________
实验结论 金属性:Mg___Al 逐渐溶解
逐渐溶解
溶解
不溶解
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
Mg(OH)2+2HCl=MgCl2 +2H2O
>
课堂讲解
(3)钠、镁、铝的最高价氧化物对应水化物的碱性
NaOH Mg(OH)2 Al(OH)3
分类
碱性强弱 NaOH___Mg(OH)2___Al(OH)3 结论 金属性:Na___Mg___Al 两性氢氧化物
>
>
>
>
强碱
中强碱
课堂讲解
硅、磷、硫、氯的非金属性的递变规律
2
课堂讲解
Si P S Cl
最高价氧化物对应水化物的酸性 H2SiO3 _____ H3PO4 _______ H2SO4 _____ HClO4
_____
酸性:_____________________________ 结论 Si、P、S、Cl的非金属性逐渐_____ HClO4>H2SO4>H3PO4>H2SiO3
增强
弱酸
强酸
中强酸
强酸
同周期元素性质递变规律
3
课堂讲解
同一周期从左到右,元素金属性逐渐_____,非金属性逐渐_____
减弱
增强
元素周期律
4
(1)内容:元素的性质随着_________的递增而呈周期性的变化。
(2)实质:元素性质的周期性变化是原子的____________的周期性变化的必然结果。
核外电子排布
原子序数
课堂练习
【例6】判断正误。
(1)Al(OH)3是两性氢氧化物,与氨水、盐酸均可反应( )
(2)盐酸可以与Na2CO3溶液反应生成CO2,可由此推出非金属性Cl>C( )
(3)第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性( )
(4)第二周期元素从左至右金属性逐渐减弱,非金属性逐渐增强( )
×
√
×
×
课堂练习
【例7】除第一周期外,下列关于同周期主族元素的变化规律的叙述中不正确的是( )
A.从左到右,原子半径逐渐减小
B.从左到右,单质的氧化性逐渐减弱,还原性逐渐增强
C.从左到右,元素最高价氧化物对应水化物碱性逐渐减弱,酸性逐渐增强
D.从左到右,元素最高正化合价从+1递变到+7(氧、氟除外),最低负化合价从-4递变到-1
B
【例8】同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )A.最高价含氧酸的酸性:H3ZO4>H2YO4>HXO4B.非金属性:X>Y>ZC.气态氢化物的稳定性按X、Y、Z顺序逐渐增强D.元素的最低负化合价的绝对值按X、Y、Z顺序逐渐减小
课堂练习
B
【例9】短周期元素 W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为 21,下列关系正确的是( )
A.W、X、Y和Z均为非金属元素
B.氧化物对应水化物的酸性:Z>W
C.氢化物稳定性:W
W X
Y Z
课堂练习
C
课堂练习
【例10】在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是______(填元素符号,下同)。
(2)金属性最强的元素是______。
(3)最高价氧化物对应水化物酸性最强的是________(填化学式,下同)。
(4)最不稳定的气态氢化物是______。
(5)最高价氧化物对应水化物碱性最强的是________。
(6)氧化物中具有两性的是________。
Cl
Na
HClO4
SiH4
NaOH
Al2O3
【例11】元素A原子获得2个电子或元素B原子失去1个电子后形成的离子都与OH-具有相同的电子数,则:(1)A是________,B是________。(2)离子半径大小:A2-____(填“>”“<”或“=”)B+。(3)在由两种元素形成的化合物中,标出它们的化合价___________,并写出与水反应生成O2的化学方程式__________________________。
课堂练习
氧(或O)
钠(或Na)
>
2Na2O2+2H2O===4NaOH+O2↑
课堂小结
元素周期律
