上学期高一化学人教版(2019)必修第一册4.3 课时2 共价键(共25张PPT)
文档属性
| 名称 | 上学期高一化学人教版(2019)必修第一册4.3 课时2 共价键(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-22 18:45:29 | ||
图片预览





文档简介
(共25张PPT)
第三节 化学键
共价键
理解共价键的概念,初步掌握共价键的形成;了解共价键的实质及共价键的极性,可简单归纳出共价键的形成条件。
能较为熟练地用电子式表示简单共价分子的形成过程和分子结构。
理解极性键、非极性键的概念。
了解化学键的概念和化学反应的本质。
物 质 的 分 子 式
H2Cl2
H3O
H3
N2H3
CO3
×
×
×
×
×
CO2
HCl
NH3
H2
H2O
→
→
→
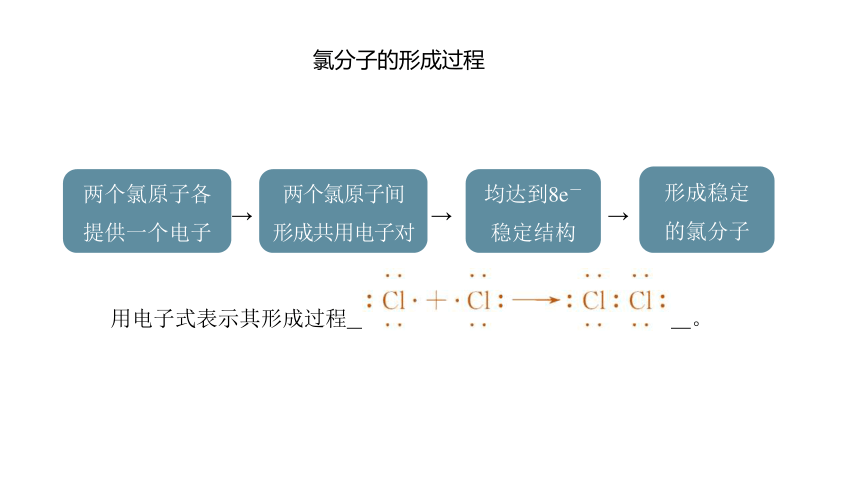
用电子式表示其形成过程 。
氯分子的形成过程
两个氯原子各
提供一个电子
两个氯原子间
形成共用电子对
均达到8e-
稳定结构
形成稳定
的氯分子
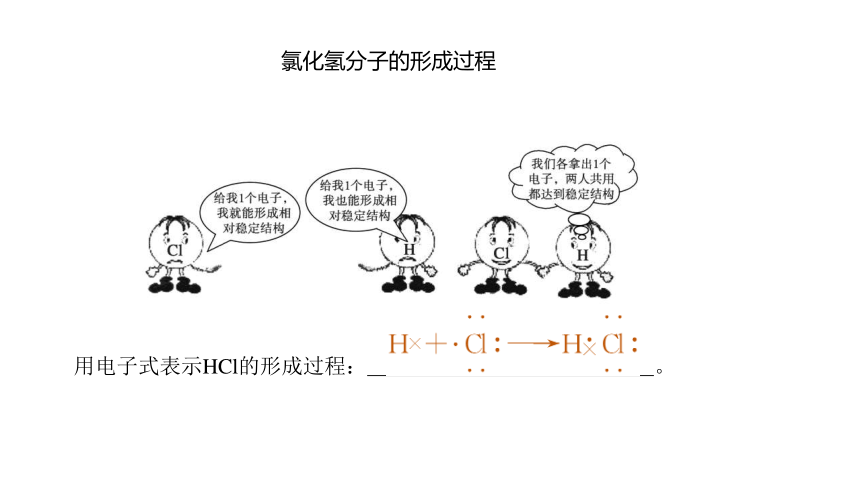
用电子式表示HCl的形成过程: 。
氯化氢分子的形成过程
原子间通过共用电子对所形成的相互作用
1. 概念
成键微粒
成键本质
原 子
共用电子对
2. 共价键的成键特点
成键条件
一般由非金属元素形成
一、共价键
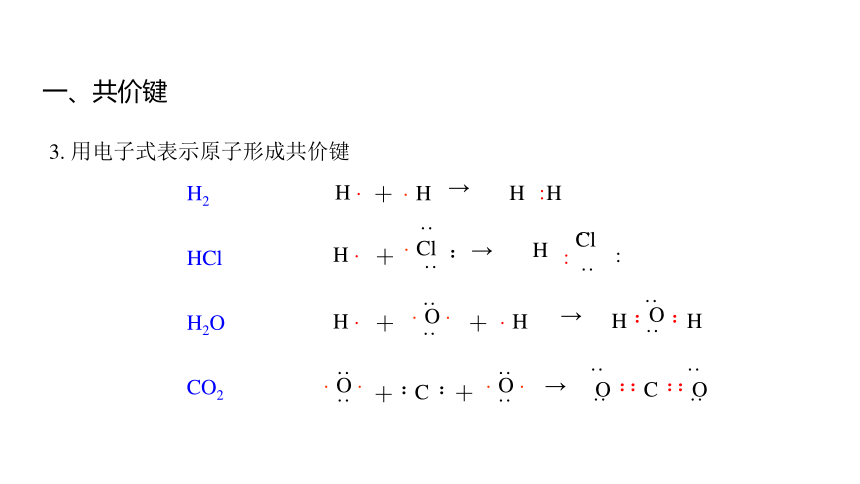
3. 用电子式表示原子形成共价键
HCl
H2O
H2
CO2
H ·
· H
+
→
H H
··
··
· Cl
··
:
H ·
+
→
··
··
Cl
H
··
··
··
· O ·
··
H ·
+
· H
+
··
→
O
··
H
H
:
:
··
··
+
· O ·
··
+
:
C
:
· O ·
··
→
C
:
:
O
··
··
O
··
··
:
:
一、共价键
4. 共价化合物
(1) 概念
(2) 常见共价化合物
(3) 概念辨析
②含有共价键的化合物不一定是共价化合物
NaOH 、 Na2O2 、 NH4Cl 、NH4NO3
如:HCl、 CO2 、NH3
以共用电子对形成分子的化合物
非金属氧化物
非金属氢化物
酸
大多数有机化合物
①共价化合物中肯定含有共价键
③离子化合物中也可能含有共价键
一、共价键
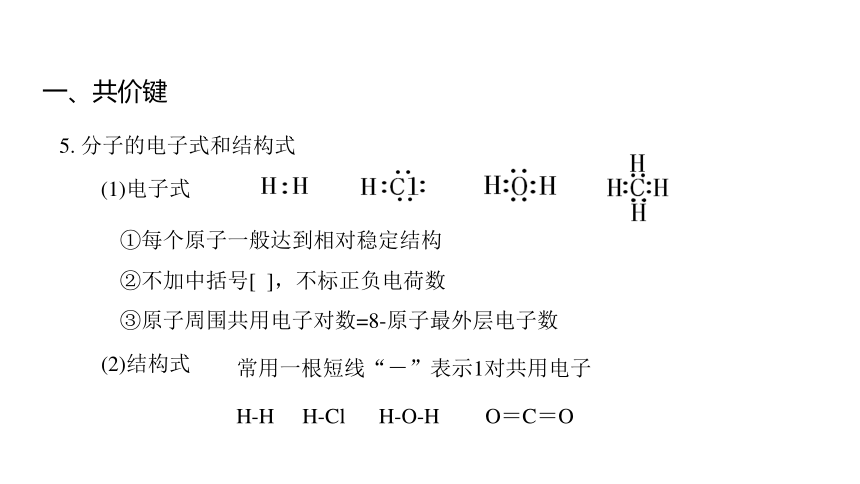
(1)电子式
①每个原子一般达到相对稳定结构
②不加中括号[ ],不标正负电荷数
③原子周围共用电子对数=8-原子最外层电子数
(2)结构式
常用一根短线“-”表示1对共用电子
H-O-H
H-H
H-Cl
O=C=O
5. 分子的电子式和结构式
一、共价键
氯气
写出下列物质的电子式和结构式
溴化氢
过氧化氢
甲烷
氮气
Cl Cl
:
:
:
:
:
:
:
…
N N
··
…
··
Cl-Cl
H-Br
N≡N
H-C-H
H
H
-
-
H-O-O-H
﹕
H Br
﹕
﹕
﹕
H
H C H
H
﹕
﹕
﹕
﹕
﹕
﹕
H O O H
﹕
﹕
﹕
﹕
﹕
一、共价键
H2
以共价键形成的分子及其结构
HCl
H2O
CH4
CO2
H-Cl
H-O-H
H-H
分子
电子式
分子结构模型
结构式
O=C=O
﹕
﹕
O C O
﹕
﹕
﹕
﹕
﹕
﹕
6. 共价键的分类
非极性键:
极性键:
Cl
··
··
H
··
··
成键原子相同
成键原子不同
共用电子对偏向吸引电子能力强的一方
共用电子对不偏向任何一个原子
H
··
H
电子对不偏移
电子对偏向Cl
一、共价键
指出下列物质中的共价键类型:
O2
CH4
CO2
H2O2
Na2O2
NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键
非极性键
非极性键
极性键
一、共价键
1. 化学键
2. 化学键的分类
离子键
共价键
非极性键
极性键
相邻的原子之间强烈的相互作用
(1)分类
(2)区别
二、化学键
离 子 键 共 价 键
成键微粒
成键方式
表示方法
成键元素
存在
Cl
··
··
H
··
··
[ Cl ]-
··
··
:
:
Na+
阴、阳离子
原 子
得失电子
共用电子对
活泼金属与活泼非金属
同种或不同种非金属元素
离子化合物中
非金属单质、共价化合物、
部分离子化合物中
二、化学键
→
→
→
→
共价键
非极性
共价键
极性
共价键
同种非金属元素的原子间
不同种非金属元素的原子间
共用电子对不偏移,成键原子不显电性。如:
H H
··
共用电子对偏向吸引电子能力强的一方,如:
Cl
··
··
··
H
··
二、化学键
离子化合物 共价化合物
物质的类别
③活泼金属氧化物
⑤绝大多数有机物
①强碱
②绝大多数盐
①酸
②弱碱
③气态氢化物
④非金属氧化物
二、化学键
(1)有的全是离子键(如NaCl、CaCl2 )
(2)有的既有离子键又有共价键( NH4Cl、 NaOH、Na2SO4 等 )
既有离子键又有极性共价键-----NaOH
既有离子键又有非极性共价键-----Na2O2
1. 稀有气体原子(分子)之间没有化学键
2. 共价型分子里的化学键都是共价键
3. 离子化合物里的化学键:
二、化学键
(1)含有共价键的分子不一定是共价化合物。例如H2、O2等单质。
(3) 共价化合物中一定不含离子键。
(2)含有共价键的化合物不一定是共价化合物。例如NaOH、Na2O2。
(5)离子化合物中肯定含有离子键,可能含有共价键。
(4) 共价化合物中肯定含有共价键。
二、化学键
1. 化学键
2. 化学键的分类
相邻的原子之间强烈的相互作用
3. 化学反应的实质
化学键先破后立的过程
Cl2+2H2 === 2HCl
点燃
化学键破坏
化学键形成
AgNO3 + NaCl = AgCl ↓ + NaNO3
离子键破坏
离子键形成
二、化学键
(2)主要特征:
分子间作用力
(1)概念:
①分子间作用力比化学键弱得多
②由分子构成的物质,其熔点、沸点、溶解度等物理性质主要由分子间作用力大小决定
分子间作用力
氢键
(1)氢键:
(2)特征:
分子之间存在一种把分子聚集在一起的作用力,叫做分子间作用力,又称范德华力。
也是一种分子间作用力,比化学键弱,比范德华力强。
使物质的熔点和沸点升高。
分子间作用力
氢键
1. 关于共价键的说法正确的是( )
A.金属原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同原子之间形成
D.稀有气体分子中只存在共价键
B
A.②③④⑦ B.②③⑤⑧
C.②④⑤⑥ D.①③⑤⑧
2. 关于化学键的下列叙述中,正确的是( )
①化学键只存在于分子之间 ②化学键只存在于相邻原子或离子之间
③离子键是一种静电作用 ④化学键是相邻原子之间强烈的相互吸引
⑤离子化合物可能含共价键 ⑥共价化合物可能含离子键 ⑦金属和非金属只能形成离子键 ⑧两个非金属和非金属原子间只能形成共价键
B
3. 下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
A.液溴和苯分别受热变为气体
B.干冰和氯化铵分别受热变为气体
C.食盐和冰的熔化
D.食盐和葡萄糖分别溶解在水中
A
4. 下列化学用语中,正确的是( )
A.次氯酸的结构式:H—O—Cl
B.氮气的电子式:
C.CO2分子的电子式:O = C = O
D.用电子式表示氯化氢分子的形成过程:
A
第三节 化学键
共价键
理解共价键的概念,初步掌握共价键的形成;了解共价键的实质及共价键的极性,可简单归纳出共价键的形成条件。
能较为熟练地用电子式表示简单共价分子的形成过程和分子结构。
理解极性键、非极性键的概念。
了解化学键的概念和化学反应的本质。
物 质 的 分 子 式
H2Cl2
H3O
H3
N2H3
CO3
×
×
×
×
×
CO2
HCl
NH3
H2
H2O
→
→
→
用电子式表示其形成过程 。
氯分子的形成过程
两个氯原子各
提供一个电子
两个氯原子间
形成共用电子对
均达到8e-
稳定结构
形成稳定
的氯分子
用电子式表示HCl的形成过程: 。
氯化氢分子的形成过程
原子间通过共用电子对所形成的相互作用
1. 概念
成键微粒
成键本质
原 子
共用电子对
2. 共价键的成键特点
成键条件
一般由非金属元素形成
一、共价键
3. 用电子式表示原子形成共价键
HCl
H2O
H2
CO2
H ·
· H
+
→
H H
··
··
· Cl
··
:
H ·
+
→
··
··
Cl
H
··
··
··
· O ·
··
H ·
+
· H
+
··
→
O
··
H
H
:
:
··
··
+
· O ·
··
+
:
C
:
· O ·
··
→
C
:
:
O
··
··
O
··
··
:
:
一、共价键
4. 共价化合物
(1) 概念
(2) 常见共价化合物
(3) 概念辨析
②含有共价键的化合物不一定是共价化合物
NaOH 、 Na2O2 、 NH4Cl 、NH4NO3
如:HCl、 CO2 、NH3
以共用电子对形成分子的化合物
非金属氧化物
非金属氢化物
酸
大多数有机化合物
①共价化合物中肯定含有共价键
③离子化合物中也可能含有共价键
一、共价键
(1)电子式
①每个原子一般达到相对稳定结构
②不加中括号[ ],不标正负电荷数
③原子周围共用电子对数=8-原子最外层电子数
(2)结构式
常用一根短线“-”表示1对共用电子
H-O-H
H-H
H-Cl
O=C=O
5. 分子的电子式和结构式
一、共价键
氯气
写出下列物质的电子式和结构式
溴化氢
过氧化氢
甲烷
氮气
Cl Cl
:
:
:
:
:
:
:
…
N N
··
…
··
Cl-Cl
H-Br
N≡N
H-C-H
H
H
-
-
H-O-O-H
﹕
H Br
﹕
﹕
﹕
H
H C H
H
﹕
﹕
﹕
﹕
﹕
﹕
H O O H
﹕
﹕
﹕
﹕
﹕
一、共价键
H2
以共价键形成的分子及其结构
HCl
H2O
CH4
CO2
H-Cl
H-O-H
H-H
分子
电子式
分子结构模型
结构式
O=C=O
﹕
﹕
O C O
﹕
﹕
﹕
﹕
﹕
﹕
6. 共价键的分类
非极性键:
极性键:
Cl
··
··
H
··
··
成键原子相同
成键原子不同
共用电子对偏向吸引电子能力强的一方
共用电子对不偏向任何一个原子
H
··
H
电子对不偏移
电子对偏向Cl
一、共价键
指出下列物质中的共价键类型:
O2
CH4
CO2
H2O2
Na2O2
NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键
非极性键
非极性键
极性键
一、共价键
1. 化学键
2. 化学键的分类
离子键
共价键
非极性键
极性键
相邻的原子之间强烈的相互作用
(1)分类
(2)区别
二、化学键
离 子 键 共 价 键
成键微粒
成键方式
表示方法
成键元素
存在
Cl
··
··
H
··
··
[ Cl ]-
··
··
:
:
Na+
阴、阳离子
原 子
得失电子
共用电子对
活泼金属与活泼非金属
同种或不同种非金属元素
离子化合物中
非金属单质、共价化合物、
部分离子化合物中
二、化学键
→
→
→
→
共价键
非极性
共价键
极性
共价键
同种非金属元素的原子间
不同种非金属元素的原子间
共用电子对不偏移,成键原子不显电性。如:
H H
··
共用电子对偏向吸引电子能力强的一方,如:
Cl
··
··
··
H
··
二、化学键
离子化合物 共价化合物
物质的类别
③活泼金属氧化物
⑤绝大多数有机物
①强碱
②绝大多数盐
①酸
②弱碱
③气态氢化物
④非金属氧化物
二、化学键
(1)有的全是离子键(如NaCl、CaCl2 )
(2)有的既有离子键又有共价键( NH4Cl、 NaOH、Na2SO4 等 )
既有离子键又有极性共价键-----NaOH
既有离子键又有非极性共价键-----Na2O2
1. 稀有气体原子(分子)之间没有化学键
2. 共价型分子里的化学键都是共价键
3. 离子化合物里的化学键:
二、化学键
(1)含有共价键的分子不一定是共价化合物。例如H2、O2等单质。
(3) 共价化合物中一定不含离子键。
(2)含有共价键的化合物不一定是共价化合物。例如NaOH、Na2O2。
(5)离子化合物中肯定含有离子键,可能含有共价键。
(4) 共价化合物中肯定含有共价键。
二、化学键
1. 化学键
2. 化学键的分类
相邻的原子之间强烈的相互作用
3. 化学反应的实质
化学键先破后立的过程
Cl2+2H2 === 2HCl
点燃
化学键破坏
化学键形成
AgNO3 + NaCl = AgCl ↓ + NaNO3
离子键破坏
离子键形成
二、化学键
(2)主要特征:
分子间作用力
(1)概念:
①分子间作用力比化学键弱得多
②由分子构成的物质,其熔点、沸点、溶解度等物理性质主要由分子间作用力大小决定
分子间作用力
氢键
(1)氢键:
(2)特征:
分子之间存在一种把分子聚集在一起的作用力,叫做分子间作用力,又称范德华力。
也是一种分子间作用力,比化学键弱,比范德华力强。
使物质的熔点和沸点升高。
分子间作用力
氢键
1. 关于共价键的说法正确的是( )
A.金属原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同原子之间形成
D.稀有气体分子中只存在共价键
B
A.②③④⑦ B.②③⑤⑧
C.②④⑤⑥ D.①③⑤⑧
2. 关于化学键的下列叙述中,正确的是( )
①化学键只存在于分子之间 ②化学键只存在于相邻原子或离子之间
③离子键是一种静电作用 ④化学键是相邻原子之间强烈的相互吸引
⑤离子化合物可能含共价键 ⑥共价化合物可能含离子键 ⑦金属和非金属只能形成离子键 ⑧两个非金属和非金属原子间只能形成共价键
B
3. 下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
A.液溴和苯分别受热变为气体
B.干冰和氯化铵分别受热变为气体
C.食盐和冰的熔化
D.食盐和葡萄糖分别溶解在水中
A
4. 下列化学用语中,正确的是( )
A.次氯酸的结构式:H—O—Cl
B.氮气的电子式:
C.CO2分子的电子式:O = C = O
D.用电子式表示氯化氢分子的形成过程:
A
