专题2研究物质的基本方法期末章节复习练--苏教版化学必修第一册(含解析)
文档属性
| 名称 | 专题2研究物质的基本方法期末章节复习练--苏教版化学必修第一册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 709.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-20 15:40:56 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
专题2研究物质的基本方法
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.标准状况下,11.2L HCl气体溶于水中得到500mL盐酸,其密度为,则所得盐酸的物质的量浓度为
A. B. C. D.无法确定
2.据科学家预测,月球的土壤中吸附着数百万吨的He,每百吨He核聚变所释放出的能量相当于目前人类一年消耗的能量。以下关于3He的说法正确的是( )
A.是4He的同素异形体 B.比4He少一个电子
C.是4He的同位素 D.比4He少一个质子
3.某一元酸在1mol/L的溶液中电离度为0.001%,则该溶液的导电能力接近于
A.1mol/L 的NaOH溶液 B.纯水
C.10-6mol/L的NaOH D.10-5mol/L的NaCl
4.门捷列夫曾预测镓、钪、锗元素的存在及性质,莫塞莱也曾预测一种“类锰”元素。放射性元素锝(),其单质是从核燃料裂变产物中提取的,它的一种核素在临床医学诊断中应用很广。下列说法正确的是
A.元素是第四周期元素
B.用D核轰击钼()靶也能得到,此过程属于化学变化
C.、、三种核素,物理性质与化学性质几乎相同
D.的质子数与中子数之差为12
5.阳台上无土种植的花花草草需要使用含的植物营养液,现用代替进行配制,则需要三种固体的质量分别为
A.;;
B.;;
C.;;
D.;;
6.为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是
选项 被提纯的物质(杂质) 除杂试剂 分离方法
A NH3(H2O) 碱石灰 洗气
B H2O(Br2) CCl4 萃取、分液
C KCl固体(I2) KOH溶液 加热
D MgCl2溶液(FeCl2) NaOH溶液 过滤
A.A B.B C.C D.D
7.下列做法错误但没有危险的是 ( )
A.制乙酸乙酯时,把乙醇和乙酸依次加入浓硫酸中
B.制乙烯时,为防止暴沸,往热反应液中加入沸石
C.进行H2还原CuO的实验时, 先加热CuO后通入H2
D.进行硫酸铜晶体含水量测定实验时,加热后的坩埚冷却过程未放入干燥器
8.一种原子的核内有6个质子和6个中子,另一种原子的核内有6个质子和7个中子,则它们不同的是
A.核电荷数 B.核外电子数 C.原子的质量 D.元素的种类
二、填空题
9.某同学用容量瓶配制溶液,加水时不慎超过了刻度线,他(她)把液体倒出一些,重新加水至刻度线。这样做会造成什么结果?
10.误差分析的思维流程
误差的引入
操作不当 药品中含有杂质 定量仪器使用不当
牢记:,分析m和V的变化
(1)从改变溶质物质的量角度分析产生的误差(用“偏大”“偏小”或“无影响”填空)。
①配制450mL0.1mol/L的NaOH溶液,用托盘天平称取NaOH固体1.8g: 。
②配制500mL0.1mol/L的硫酸铜溶液,用托盘天平称取胆矾8.0g: 。
③配制NaOH溶液,用托盘天平称量NaOH时,托盘天平的两个托盘上放两张质量相等的纸片,其他操作均正确: 。
④配制一定物质的量浓度的NaOH溶液,需称量溶质4.4g,称量时物码放置颠倒: 。
⑤配制一定物质的量浓度的稀H2SO4溶液时,用量筒量取浓硫酸时,仰视读数: 。
⑥定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线: 。
⑦配制一定物质的量浓度溶液时,烧杯及玻璃棒未洗涤: 。
(2)从改变溶液体积角度分析产生的误差(用“偏大”“偏小”或“无影响”填空)。
①配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容: 。
②定容摇匀后,发现液面下降,继续加水至刻度线: 。
③定容时仰视刻度线 。
④定容摇匀后少量溶液外流: 。
⑤容量瓶中原有少量蒸馏水: 。
11.通过对近代化学发展的里程碑的学习,我们体会到化学是在原子、分子水平上研究物质的自然科学,请把重大成果与发现者连起来。
①道尔顿a.提出化学元素的概念
②波义耳b.建立氧化学说
③拉瓦锡c.提出原子论
④门捷列夫d.发现元素周期律
⑤阿伏加德罗e.分子学说
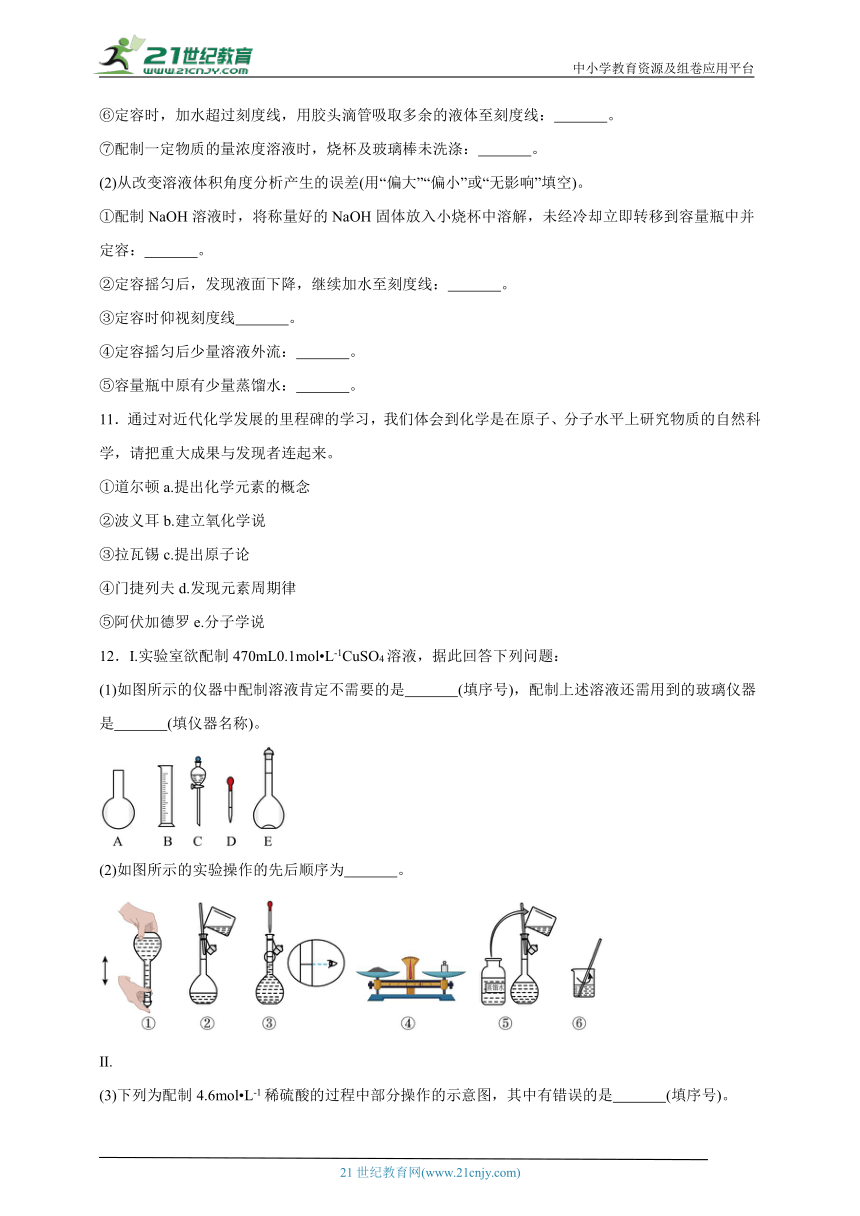
12.I.实验室欲配制470mL0.1mol L-1CuSO4溶液,据此回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)如图所示的实验操作的先后顺序为 。
II.
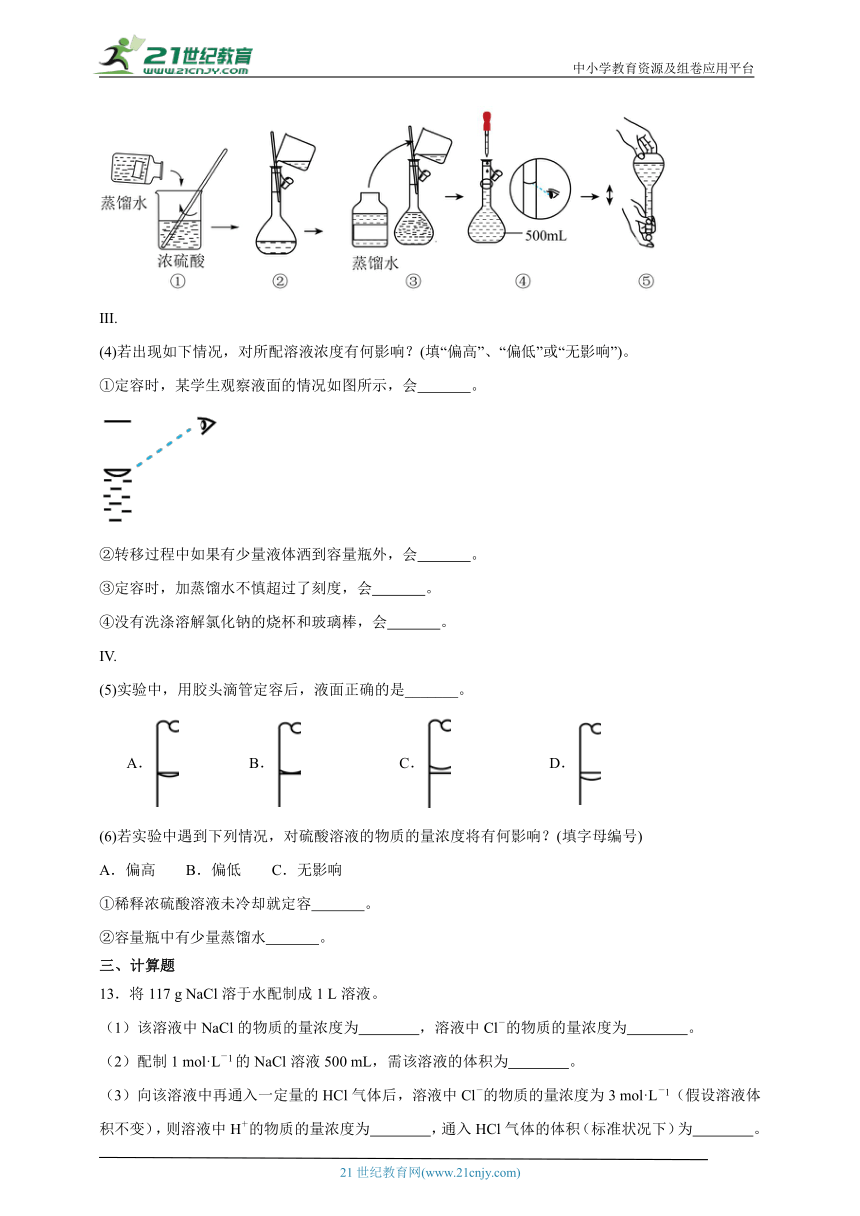
(3)下列为配制4.6mol L-1稀硫酸的过程中部分操作的示意图,其中有错误的是 (填序号)。
III.
(4)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”、“偏低”或“无影响”)。
①定容时,某学生观察液面的情况如图所示,会 。
②转移过程中如果有少量液体洒到容量瓶外,会 。
③定容时,加蒸馏水不慎超过了刻度,会 。
④没有洗涤溶解氯化钠的烧杯和玻璃棒,会 。
IV.
(5)实验中,用胶头滴管定容后,液面正确的是_______。
A. B. C. D.
(6)若实验中遇到下列情况,对硫酸溶液的物质的量浓度将有何影响?(填字母编号)
A.偏高 B.偏低 C.无影响
①稀释浓硫酸溶液未冷却就定容 。
②容量瓶中有少量蒸馏水 。
三、计算题
13.将117 g NaCl溶于水配制成1 L溶液。
(1)该溶液中NaCl的物质的量浓度为 ,溶液中Cl-的物质的量浓度为 。
(2)配制1 mol·L-1的NaCl溶液500 mL,需该溶液的体积为 。
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3 mol·L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为 ,通入HCl气体的体积(标准状况下)为 。
四、解答题
14.某课外兴趣小组需要的溶液,请回答下列问题:
(1)配制溶液所需仪器及药品:
应称取的质量为 应选用容量瓶的规格为 需要的玻璃仪器有容量瓶、烧杯、 及玻璃棒
(2)配制时,其正确的操作顺序是 (用序号表示,每个操作只能用一次)。
A将已冷却的溶液沿玻璃棒注入容量瓶中
B用托盘天平准确称量所需的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(必要时可加热)
C用适量水洗涤烧杯2~3次,洗涤液均注入容量瓶中,振荡
D改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
E将容量瓶盖紧,振荡,摇匀
F继续往容量瓶内小心加水,直到液面接近刻度线处
(3)若出现如下情况,判断对所配溶液浓度的影响:没有进行操作 (填“偏高”“偏低”或“无影响”,下同);配制溶液时,容量瓶未干燥 ;定容时俯视刻度线 。
(4)在实验操作的摇匀过程中,不慎洒出几滴,此时应采取的措施是 。
15.实验室配制0.1mol·L-1的BaCl2溶液可分两个阶段进行。
第一阶段:用托盘天平称取5.2g无水BaCl2晶体。
第二阶段:溶解配制0.1mol·L-1的BaCl2溶液。
第一阶段操作有如下几步:A.将游码拨至0.2g处;B.将游码拨至“0”处;C.在天平两边的托盘上各放一张干净的等质量的滤纸,调节天平两边的螺母使天平平衡;D.取走药品,将砝码放回砝码盒内;E.往左盘内逐步添加晶体至天平平衡;F.在右盘上放置5g砝码。
(1)其正确的操作顺序是(填标号):B→( )→( )→A→( )→( )→( )。
(2)在E操作中,只缺少量晶体时,其操作方法是 。
(3)第二阶段操作,应先将5.2gBaCl2加适量蒸馏水溶解,溶解过程中使用的主要仪器有 、 。然后将溶液转入 中,再经 、 、 后即可得到0.1mol·L-1BaCl2溶液。
(4)下列操作使配制的BaCl2溶液浓度偏低的有 (填字母序号)。
A.将砝码放在左盘上,BaCl2放在右盘上进行称量
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
16.海洋植物如海带,海藻中含有丰富的碘元素,主要以碘化物的形式存在。有一化学课外小组以海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(使碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘。
(1)灼烧海带时需要用到的实验仪器是 (填序号)。
A.烧杯 B.坩埚 C.蒸发皿 D.铁架台(带铁圈) E.酒精灯 F.干燥器
(2)指出提取碘的过程中有关实验操作的名称:a ,c 。
(3)操作b中充入适量的目的是 。
(4)操作c中所用的有机试剂可以是 (只填一种),简述理由: 。
(5)操作c可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈上
B.把50 mL碘水和15 mL有机溶剂[(4)中所选择的]加入分液漏斗中,并盖好玻璃塞
C.检验分液漏斗是否漏液
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收溶液
F.从分液漏斗上口倒出上层液体
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准
H.静置、分层
①上述正确的操作顺序是 。(填字母编号);
②上述G操作的目的是 ;
③最后碘的有机溶液是通过 (填“漏斗上口”或“漏斗下口”)获得。
(6)请给出一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
《专题2研究物质的基本方法》参考答案
题号 1 2 3 4 5 6 7 8
答案 B C D D A B D C
1.B
【详解】标况下,0.5molHCl气体溶于水中得到500mL盐酸,,故选B。
2.C
【详解】A. 同素异形体是指同种元素形成的结构不同单质,He与4He互为同位素,故A错误;
B. 二者质子数相同为2,则电子数相同,故B错误;
C. 二者为质子数相同,中子数不同的原子,互为同位素,故C正确;
D. 二者质子数相同,故D错误。
故选:C。
3.D
【分析】该温度下,溶液中c(H+) = 1mol/L×0.001 %=10-5 mol/L,溶液导电能力与自由移动离子浓度成正比,如果溶液导电能力接近,则溶液中离子浓度接近,据此分析解答。
【详解】该温度下,溶液中c(H+) = 1mol/L×0.001% = 10-5 mol/L,溶液导电能力与自由移动离子浓度成正比,如果溶液导电能力接近,则溶液中离子浓度接近,所以只要给予的选项中离子浓度接近10-5 mol/L即可,
A. 1 mol/L的NaOH溶液中离子浓度为1 mol/L>10-5 mol/L,所以该溶液导电能力大于该一元酸溶液,故A项错误;
B. 纯水中离子浓度为10-7 mol/L<10-5 mol/L,则水的导电能力小于该一元酸,故B项错误;
C. 10-6 mol/L的NaOH离子浓度为10-6 mol/L<10-5 mol/L,则水的导电能力小于该一元酸,故C项错误;
D. 10-5 mol/L的NaCl中离子浓度10-5 mol/L,接近于该一元酸溶液中离子浓度,所以其导电能力接近,故D项正确;
答案选D。
4.D
【详解】A.元素电子排布为[Kr]4d55s2,为第五周期元素,A项错误;
B.原子核内发生的变化不属于化学变化,B项错误;
C.同位素的物理性质不同,如密度,C项错误;
D.的质子数为43,中子数为98-43=55,二者之差为12,D项正确;
答案选D。
5.A
【详解】已知营养液中含有、、,根据元素守恒,,根据“唯一”优先考虑原则,需要,再由或守恒,确定需,则;;。故选A。
6.B
【详解】A.将混有少量水蒸气的氨气直接通过足量碱石灰,碱石灰吸收了混合气体中的水,得到干燥的纯净的氨气,不需要进行洗气操作,故A错误;
B.溴在四氯化碳中的溶解度大于在水中的溶解度,四氯化碳和水不互溶,且萃取剂和碘不反应,可以采用萃取分液方法进行分离提纯,故B正确;
C.由于KOH与I2反应生成的KI无法从KCl中除去,引入了新的杂质,故C错误;
D.氯化镁溶液中含有氯化亚铁,加入氢氧化钠溶液,可以与两种物质反应,也除去了氯化镁,不能达到除去杂质的目的,故D错误;
故选B。
7.D
【详解】A.乙醇和乙酸加入浓硫酸中,相当于水加入浓硫酸中,液体暴沸易喷出伤人,A不合题意;
B.往热反应液中加入沸石,液体受热不均,易喷出伤人,B不合题意;
C.先加热CuO后通入H2,会引起H2与空气混合点燃而发生爆炸,C不合题意;
D.坩埚冷却过程未放入干燥器,会造成无水硫酸铜吸水而生成水合硫酸铜,但不会产生危险,D符合题意;
故选D。
【点睛】制乙烯时,反应液中应加入沸石,以防液体在加热过程中产生暴沸。若加热过程中才发现忘记加入沸石,应立即停止加热,待液体冷却到室温后,才能往反应液中加入沸石。
8.C
【详解】一种原子的核内有6个质子和6个中子,另一种原子的核内有6个质子和7个中子,可知二者质子数相同,中子数不同。由于质子数等于核电荷数等于原子核外电子数。质子数相同的原子属于同一元素。由于原子的质量主要集中在原子核上,二者的质子数相同,中子数不同,因此二者的质量不相同,故合理选项是C。
9.所得溶液的浓度偏低
【详解】因为倒出的溶液中含有溶质,再重新加水至刻度线,溶液的总体积没有变化,但容量瓶中的溶质的物质的量减少了,故所得溶液的浓度就会偏低。
10.(1) 偏小 偏小 偏小 偏小 偏大 偏小 偏小
(2) 偏大 偏小 偏小 无影响 无影响
【详解】(1)①配制450mL0.1mol/L的NaOH溶液,使用的容量瓶为500mL容量瓶,应该称量的NaOH的质量为:0.1mol/L×0.5L×40g/mol=2.0g,故用托盘天平称取NaOH固体1.8g,将导致所配溶液的浓度偏小,故答案为:偏小;
②配制500mL0.1mol/L的硫酸铜溶液,使用的容量瓶为500mL容量瓶,应该称量的胆矾的质量为:0.1mol/L×0.5L×250g/mol=12.5g,故用托盘天平称取胆矾8.0g,将导致所配溶液的浓度偏小,故答案为:偏小;
③配制NaOH溶液,用托盘天平称量NaOH时,托盘天平的两个托盘上放两张质量相等的纸片,其他操作均正确,由于NaOH具有很强的吸水性,实际称量出的NaOH质量偏小,所配溶液浓度偏小,故答案为:偏小;
④配制一定物质的量浓度的NaOH溶液,需称量溶质4.4g,称量时物码放置颠倒,实际称量到的NaOH质量只有4.0-0.4=3.6g,故所配溶液浓度偏小,故答案为:偏小;
⑤配制一定物质的量浓度的稀H2SO4溶液时,用量筒量取浓硫酸时,仰视读数,所量浓硫酸的体积偏大,所配溶液浓度偏大,故答案为:偏大;
⑥定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线,将带走部分溶质,所配溶液浓度偏小,故答案为:偏小;
⑦配制一定物质的量浓度溶液时,烧杯及玻璃棒未洗涤,导致溶质的量偏小,所配溶液浓度偏小,故答案为:偏小;
(2)①由于液体的膨胀速率大于固体的膨胀速率,配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容,则将导致溶液体积偏小,所配溶液浓度偏大,故答案为:偏大;
②定容摇匀后,发现液面下降,此为正常现象,若继续加水至刻度线,将导致溶液体积偏大,所配溶液浓度偏小,故答案为:偏小;
③定容时仰视刻度线,将导致溶液体积偏大,所配溶液浓度偏小,故答案为:偏小;
④定容摇匀后少量溶液外流,外流的溶液浓度与容量瓶中溶液浓度相同,则容量瓶中溶液浓度不变,只是体积偏小,故答案为:无影响;
⑤容量瓶中原有少量蒸馏水,对溶液体积无影响,对所配溶液浓度无影响,故答案为:无影响。
11. ①—c ②—a ③—b ④—d ⑤—e
【详解】道尔顿提出了原子学说;阿伏加德罗提出分子学说;波义耳提出了化学元素的概念;拉瓦锡建立了燃烧现象的氧化学说;门捷列夫发现了元素周期律;故答案为:①—c;②—a;③—b;④—d;⑤—e。
12.(1) AC 烧杯、玻璃棒
(2)④⑥②⑤③①
(3)①④
(4) 偏高 偏低 偏低 偏低
(5)B
(6) A C
【详解】(1)配制该溶液的步骤有:计算、称量、溶解(并冷却)、移液、洗涤、定容、摇匀,配制溶液肯定不需要的是烧瓶、分液漏斗,选AC;配制上述溶液还需用到的玻璃仪器是烧杯、玻璃棒;
(2)配制该溶液的步骤有:计算、称量、溶解(并冷却)、移液、洗涤、定容、摇匀,实验操作的先后顺序为④⑥②⑤③①;
(3)步骤①为浓硫酸稀释,应将浓硫酸沿烧杯壁缓慢加入到水中,并不断搅拌,①错误;②为移液,②正确;③为洗涤烧杯和玻璃棒,并向容量瓶中加水,③正确;④定容时,眼睛平视刻度线,④错误;⑤为摇匀溶液,⑤正确,故填①④;
(4)根据c=分析错误操作对所配溶液浓度的影响:
①定容时,俯视观察液面,加入的水不到刻度线,溶液体积偏小,则所配溶液浓度偏高;
②转移过程中如果有少量液体洒到容量瓶外,溶质物质的量偏小,则所配溶液浓度偏低;
③定容时,加蒸馏水不慎超过了刻度,溶液体积偏大,则所配溶液浓度偏低;
④没有洗涤溶解氯化钠的烧杯和玻璃棒,溶质物质的量偏小,则所配溶液浓度偏低。
(5)因为表面张力的存在导致液面表面呈凹形或凸形,一般的液面呈凹形,所以定容后,只有液面凹液面的最低处和容量瓶刻度线相切时,溶液的体积才正好等于容量瓶的容积,答案选B;
(6)①稀释浓硫酸溶液未冷却就定容,所配溶液的体积偏小,浓度偏高,答案选A;
②容量瓶中有少量蒸馏水,因后续实验要加蒸馏水,故对实验无影响,答案选C。
13. 2 mol·L-1 2 mol·L-1 0.25 L 1 mol·L-1 22.4 L
【分析】n(NaCl)===2mol,根据c=计算浓度,同时回答问题。
【详解】(1)由分析可知c===2mol/L;c(Cl-)= c(NaCl)= 2mol/L;
(2)根据稀释定律有V浓===0.25L;
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3 mol/L,那么溶液中HCl的浓度为3mol/L-2mol/L=1mol/L,溶液中H+的物质的量浓度为1mol/L;溶液为1L,通入HCl气体的物质的量为1mol/L×1L=1mol,标准状况下的体积为1mol×22.4L/mol=22.4L。
14. 26.5 250 胶头滴管 B、A、C、F、D、E 偏低 无影响 偏高 重新配制
【详解】(1)配制的溶液,应选择的容量瓶,需要溶质的质量为;配制一定物质的量浓度的溶液需要的仪器有托盘天平、烧杯、玻璃棒、容量瓶、胶头滴管等;
(2)配制一定物质的量浓度溶液的一般步骤为:计算、称量或量取、溶解、移液、洗涤、定容、摇匀等,所以正确的操作顺序为B、A、C、F、D、E;
(3)没有进行洗涤操作,导致部分溶质损耗,溶质的物质的量偏小,根据可知,溶液浓度偏低;配制溶液时,容量瓶未干燥,对溶质的物质的量和溶液体积都不产生影响,对溶液浓度无影响;定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
(4)在实验操作的摇匀过程中,不慎洒出几滴,导致实验失败且无法补救,需要重新配制。
15. CFEDB 应轻拍手腕,小心振动药匙加入药品,使天平平衡 烧杯 玻璃棒 250mL容量瓶 洗涤 定容 摇匀 AC
【分析】配制一定物质的量浓度的溶液,所需的步骤有计算、称量、溶解(冷却)、转移、洗涤、定容、摇匀、装瓶贴签。
【详解】(1)使用托盘天平的步骤为调零→放砝码→调游码→加物品→取物品→取砝码→游码回零,所以正确的操作顺序为BCFAEDB;
(2)只缺少量晶体时,应轻拍手腕,小心振动药匙加入药品,使天平平衡;
(3)溶解需要在烧杯中进行,并用玻璃棒搅拌,加速溶解;5.2g BaCl2的物质的量为=0.025mol,体积V===0.25L=250mL,故选用250mL容量瓶,即溶解后将溶液转入250mL容量瓶;根据分析,转移至250mL容量瓶后,需经过洗涤、定容、摇匀等步骤;
(4)误差分析根据c==,由m、V的大小判断。
A.将砝码放错位置后,由于需要使用游码,游码为0.2g,所以称得的BaCl2为5.2g-2×0.2g =4.8g,所得溶液浓度偏低;
B.由于定容时需要向容量瓶中加水,故容量瓶内有少量蒸馏水不影响浓度;
C.摇匀后有少量液体残留在刻线上方,只许等待片刻液体流下即可,再加水会增大溶液体积,所得溶液浓度偏低;
D.不振荡,溶液浓度不均匀,待溶质充分扩散后即可达到所配浓度;
故选AC。
16. BDE 过滤 萃取、分液 使I-转化为I2 CCl4(答案合理即可) CCl4不溶于水,且溶解碘的能力强于水(与前一问照应) CBDAHGEF 保持分液漏斗内外压力平衡,使液体易于流下 漏斗下口[与(4)照应] 取少量提取碘后的水溶液于试管中,加入淀粉溶液,溶液不变蓝,说明没有I2剩余,反之则有I2剩余
【分析】将海带灰悬浊液过滤可得固体残渣和含有I-的溶液,然后向溶液中通入适量Cl2,发生反应:Cl2+2I-=I2+2Cl-,然后向其中加入有机溶剂进行萃取,经分液后单质I2进入有机溶剂,然后蒸发结晶可得I2的晶体,据此分析解答。
【详解】(1)灼烧固体海带时用坩埚,在带铁圈的铁架台(或三脚架和泥三角)放置坩埚,用酒精灯进行加热,所以灼烧海带时需要用到的实验仪器是坩埚、带铁圈的铁架台、酒精灯,合理选项是BDE。
(2)根据图示可知,提取碘的过程中有关实验操作的名称,a是过滤;c是萃取、分液;
(3)操作b中充入适量Cl2,可发生反应:Cl2+2I-=I2+2Cl-,使I-转化为I2,若Cl2过量,I2会被过量的Cl2氧化产生更高价态的碘的化合物;
(4)操作c是萃取、分液,其中所用的有机试剂可以是CCl4,CCl4作萃取剂的选取标准:溶质在CCl4中的溶解度大于水,溶质和萃取剂CCl4不反应,CCl4和水互不相溶。四氯化碳符合萃取剂的选取标准,所以可以用四氯化碳作萃取剂;
(5)①萃取分液的操作步骤是:检验分液漏斗是否漏液;把50 mL碘水和15 mL有机溶剂[(4)中所选择的]加入分液漏斗中,并盖好玻璃塞;倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;把盛有溶液的分液漏斗放在铁架台的铁圈上;静置、分层;将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;旋开活塞,用烧杯接收溶液;从分液漏斗上口倒出上层液体,故操作步骤用字母顺序表示为CBDAHGEF;
②在上述中G操作的目的是保持分液漏斗内外压力平衡,使液体易于流下;
③由于I2的CCl4溶液的密度比水大,所以分液后在下层,所以最后碘的有机溶液是通过漏斗下口获得;
(6)可根据I2遇淀粉溶液变为蓝色检验。检验方法是:取少量提取碘后的水溶液于试管中,向其中滴加几滴淀粉溶液,若溶液变为蓝色,说明还有单质碘;若溶液不变蓝色,说明提取碘后的溶液中无I2单质。
【点睛】本题考查了海水资源的综合利用。涉及仪器的使用、实验操作步骤、物质的检验等。把握实验流程,弄清每一步操作的目的、发生的反应、分离混合物方法与物质性质的关系是解题关键。注意(5)操作c的萃取、分液中实验操作步骤的先后顺序的判断。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
专题2研究物质的基本方法
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.标准状况下,11.2L HCl气体溶于水中得到500mL盐酸,其密度为,则所得盐酸的物质的量浓度为
A. B. C. D.无法确定
2.据科学家预测,月球的土壤中吸附着数百万吨的He,每百吨He核聚变所释放出的能量相当于目前人类一年消耗的能量。以下关于3He的说法正确的是( )
A.是4He的同素异形体 B.比4He少一个电子
C.是4He的同位素 D.比4He少一个质子
3.某一元酸在1mol/L的溶液中电离度为0.001%,则该溶液的导电能力接近于
A.1mol/L 的NaOH溶液 B.纯水
C.10-6mol/L的NaOH D.10-5mol/L的NaCl
4.门捷列夫曾预测镓、钪、锗元素的存在及性质,莫塞莱也曾预测一种“类锰”元素。放射性元素锝(),其单质是从核燃料裂变产物中提取的,它的一种核素在临床医学诊断中应用很广。下列说法正确的是
A.元素是第四周期元素
B.用D核轰击钼()靶也能得到,此过程属于化学变化
C.、、三种核素,物理性质与化学性质几乎相同
D.的质子数与中子数之差为12
5.阳台上无土种植的花花草草需要使用含的植物营养液,现用代替进行配制,则需要三种固体的质量分别为
A.;;
B.;;
C.;;
D.;;
6.为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是
选项 被提纯的物质(杂质) 除杂试剂 分离方法
A NH3(H2O) 碱石灰 洗气
B H2O(Br2) CCl4 萃取、分液
C KCl固体(I2) KOH溶液 加热
D MgCl2溶液(FeCl2) NaOH溶液 过滤
A.A B.B C.C D.D
7.下列做法错误但没有危险的是 ( )
A.制乙酸乙酯时,把乙醇和乙酸依次加入浓硫酸中
B.制乙烯时,为防止暴沸,往热反应液中加入沸石
C.进行H2还原CuO的实验时, 先加热CuO后通入H2
D.进行硫酸铜晶体含水量测定实验时,加热后的坩埚冷却过程未放入干燥器
8.一种原子的核内有6个质子和6个中子,另一种原子的核内有6个质子和7个中子,则它们不同的是
A.核电荷数 B.核外电子数 C.原子的质量 D.元素的种类
二、填空题
9.某同学用容量瓶配制溶液,加水时不慎超过了刻度线,他(她)把液体倒出一些,重新加水至刻度线。这样做会造成什么结果?
10.误差分析的思维流程
误差的引入
操作不当 药品中含有杂质 定量仪器使用不当
牢记:,分析m和V的变化
(1)从改变溶质物质的量角度分析产生的误差(用“偏大”“偏小”或“无影响”填空)。
①配制450mL0.1mol/L的NaOH溶液,用托盘天平称取NaOH固体1.8g: 。
②配制500mL0.1mol/L的硫酸铜溶液,用托盘天平称取胆矾8.0g: 。
③配制NaOH溶液,用托盘天平称量NaOH时,托盘天平的两个托盘上放两张质量相等的纸片,其他操作均正确: 。
④配制一定物质的量浓度的NaOH溶液,需称量溶质4.4g,称量时物码放置颠倒: 。
⑤配制一定物质的量浓度的稀H2SO4溶液时,用量筒量取浓硫酸时,仰视读数: 。
⑥定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线: 。
⑦配制一定物质的量浓度溶液时,烧杯及玻璃棒未洗涤: 。
(2)从改变溶液体积角度分析产生的误差(用“偏大”“偏小”或“无影响”填空)。
①配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容: 。
②定容摇匀后,发现液面下降,继续加水至刻度线: 。
③定容时仰视刻度线 。
④定容摇匀后少量溶液外流: 。
⑤容量瓶中原有少量蒸馏水: 。
11.通过对近代化学发展的里程碑的学习,我们体会到化学是在原子、分子水平上研究物质的自然科学,请把重大成果与发现者连起来。
①道尔顿a.提出化学元素的概念
②波义耳b.建立氧化学说
③拉瓦锡c.提出原子论
④门捷列夫d.发现元素周期律
⑤阿伏加德罗e.分子学说
12.I.实验室欲配制470mL0.1mol L-1CuSO4溶液,据此回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)如图所示的实验操作的先后顺序为 。
II.
(3)下列为配制4.6mol L-1稀硫酸的过程中部分操作的示意图,其中有错误的是 (填序号)。
III.
(4)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”、“偏低”或“无影响”)。
①定容时,某学生观察液面的情况如图所示,会 。
②转移过程中如果有少量液体洒到容量瓶外,会 。
③定容时,加蒸馏水不慎超过了刻度,会 。
④没有洗涤溶解氯化钠的烧杯和玻璃棒,会 。
IV.
(5)实验中,用胶头滴管定容后,液面正确的是_______。
A. B. C. D.
(6)若实验中遇到下列情况,对硫酸溶液的物质的量浓度将有何影响?(填字母编号)
A.偏高 B.偏低 C.无影响
①稀释浓硫酸溶液未冷却就定容 。
②容量瓶中有少量蒸馏水 。
三、计算题
13.将117 g NaCl溶于水配制成1 L溶液。
(1)该溶液中NaCl的物质的量浓度为 ,溶液中Cl-的物质的量浓度为 。
(2)配制1 mol·L-1的NaCl溶液500 mL,需该溶液的体积为 。
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3 mol·L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为 ,通入HCl气体的体积(标准状况下)为 。
四、解答题
14.某课外兴趣小组需要的溶液,请回答下列问题:
(1)配制溶液所需仪器及药品:
应称取的质量为 应选用容量瓶的规格为 需要的玻璃仪器有容量瓶、烧杯、 及玻璃棒
(2)配制时,其正确的操作顺序是 (用序号表示,每个操作只能用一次)。
A将已冷却的溶液沿玻璃棒注入容量瓶中
B用托盘天平准确称量所需的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(必要时可加热)
C用适量水洗涤烧杯2~3次,洗涤液均注入容量瓶中,振荡
D改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
E将容量瓶盖紧,振荡,摇匀
F继续往容量瓶内小心加水,直到液面接近刻度线处
(3)若出现如下情况,判断对所配溶液浓度的影响:没有进行操作 (填“偏高”“偏低”或“无影响”,下同);配制溶液时,容量瓶未干燥 ;定容时俯视刻度线 。
(4)在实验操作的摇匀过程中,不慎洒出几滴,此时应采取的措施是 。
15.实验室配制0.1mol·L-1的BaCl2溶液可分两个阶段进行。
第一阶段:用托盘天平称取5.2g无水BaCl2晶体。
第二阶段:溶解配制0.1mol·L-1的BaCl2溶液。
第一阶段操作有如下几步:A.将游码拨至0.2g处;B.将游码拨至“0”处;C.在天平两边的托盘上各放一张干净的等质量的滤纸,调节天平两边的螺母使天平平衡;D.取走药品,将砝码放回砝码盒内;E.往左盘内逐步添加晶体至天平平衡;F.在右盘上放置5g砝码。
(1)其正确的操作顺序是(填标号):B→( )→( )→A→( )→( )→( )。
(2)在E操作中,只缺少量晶体时,其操作方法是 。
(3)第二阶段操作,应先将5.2gBaCl2加适量蒸馏水溶解,溶解过程中使用的主要仪器有 、 。然后将溶液转入 中,再经 、 、 后即可得到0.1mol·L-1BaCl2溶液。
(4)下列操作使配制的BaCl2溶液浓度偏低的有 (填字母序号)。
A.将砝码放在左盘上,BaCl2放在右盘上进行称量
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
16.海洋植物如海带,海藻中含有丰富的碘元素,主要以碘化物的形式存在。有一化学课外小组以海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(使碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘。
(1)灼烧海带时需要用到的实验仪器是 (填序号)。
A.烧杯 B.坩埚 C.蒸发皿 D.铁架台(带铁圈) E.酒精灯 F.干燥器
(2)指出提取碘的过程中有关实验操作的名称:a ,c 。
(3)操作b中充入适量的目的是 。
(4)操作c中所用的有机试剂可以是 (只填一种),简述理由: 。
(5)操作c可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈上
B.把50 mL碘水和15 mL有机溶剂[(4)中所选择的]加入分液漏斗中,并盖好玻璃塞
C.检验分液漏斗是否漏液
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收溶液
F.从分液漏斗上口倒出上层液体
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准
H.静置、分层
①上述正确的操作顺序是 。(填字母编号);
②上述G操作的目的是 ;
③最后碘的有机溶液是通过 (填“漏斗上口”或“漏斗下口”)获得。
(6)请给出一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
《专题2研究物质的基本方法》参考答案
题号 1 2 3 4 5 6 7 8
答案 B C D D A B D C
1.B
【详解】标况下,0.5molHCl气体溶于水中得到500mL盐酸,,故选B。
2.C
【详解】A. 同素异形体是指同种元素形成的结构不同单质,He与4He互为同位素,故A错误;
B. 二者质子数相同为2,则电子数相同,故B错误;
C. 二者为质子数相同,中子数不同的原子,互为同位素,故C正确;
D. 二者质子数相同,故D错误。
故选:C。
3.D
【分析】该温度下,溶液中c(H+) = 1mol/L×0.001 %=10-5 mol/L,溶液导电能力与自由移动离子浓度成正比,如果溶液导电能力接近,则溶液中离子浓度接近,据此分析解答。
【详解】该温度下,溶液中c(H+) = 1mol/L×0.001% = 10-5 mol/L,溶液导电能力与自由移动离子浓度成正比,如果溶液导电能力接近,则溶液中离子浓度接近,所以只要给予的选项中离子浓度接近10-5 mol/L即可,
A. 1 mol/L的NaOH溶液中离子浓度为1 mol/L>10-5 mol/L,所以该溶液导电能力大于该一元酸溶液,故A项错误;
B. 纯水中离子浓度为10-7 mol/L<10-5 mol/L,则水的导电能力小于该一元酸,故B项错误;
C. 10-6 mol/L的NaOH离子浓度为10-6 mol/L<10-5 mol/L,则水的导电能力小于该一元酸,故C项错误;
D. 10-5 mol/L的NaCl中离子浓度10-5 mol/L,接近于该一元酸溶液中离子浓度,所以其导电能力接近,故D项正确;
答案选D。
4.D
【详解】A.元素电子排布为[Kr]4d55s2,为第五周期元素,A项错误;
B.原子核内发生的变化不属于化学变化,B项错误;
C.同位素的物理性质不同,如密度,C项错误;
D.的质子数为43,中子数为98-43=55,二者之差为12,D项正确;
答案选D。
5.A
【详解】已知营养液中含有、、,根据元素守恒,,根据“唯一”优先考虑原则,需要,再由或守恒,确定需,则;;。故选A。
6.B
【详解】A.将混有少量水蒸气的氨气直接通过足量碱石灰,碱石灰吸收了混合气体中的水,得到干燥的纯净的氨气,不需要进行洗气操作,故A错误;
B.溴在四氯化碳中的溶解度大于在水中的溶解度,四氯化碳和水不互溶,且萃取剂和碘不反应,可以采用萃取分液方法进行分离提纯,故B正确;
C.由于KOH与I2反应生成的KI无法从KCl中除去,引入了新的杂质,故C错误;
D.氯化镁溶液中含有氯化亚铁,加入氢氧化钠溶液,可以与两种物质反应,也除去了氯化镁,不能达到除去杂质的目的,故D错误;
故选B。
7.D
【详解】A.乙醇和乙酸加入浓硫酸中,相当于水加入浓硫酸中,液体暴沸易喷出伤人,A不合题意;
B.往热反应液中加入沸石,液体受热不均,易喷出伤人,B不合题意;
C.先加热CuO后通入H2,会引起H2与空气混合点燃而发生爆炸,C不合题意;
D.坩埚冷却过程未放入干燥器,会造成无水硫酸铜吸水而生成水合硫酸铜,但不会产生危险,D符合题意;
故选D。
【点睛】制乙烯时,反应液中应加入沸石,以防液体在加热过程中产生暴沸。若加热过程中才发现忘记加入沸石,应立即停止加热,待液体冷却到室温后,才能往反应液中加入沸石。
8.C
【详解】一种原子的核内有6个质子和6个中子,另一种原子的核内有6个质子和7个中子,可知二者质子数相同,中子数不同。由于质子数等于核电荷数等于原子核外电子数。质子数相同的原子属于同一元素。由于原子的质量主要集中在原子核上,二者的质子数相同,中子数不同,因此二者的质量不相同,故合理选项是C。
9.所得溶液的浓度偏低
【详解】因为倒出的溶液中含有溶质,再重新加水至刻度线,溶液的总体积没有变化,但容量瓶中的溶质的物质的量减少了,故所得溶液的浓度就会偏低。
10.(1) 偏小 偏小 偏小 偏小 偏大 偏小 偏小
(2) 偏大 偏小 偏小 无影响 无影响
【详解】(1)①配制450mL0.1mol/L的NaOH溶液,使用的容量瓶为500mL容量瓶,应该称量的NaOH的质量为:0.1mol/L×0.5L×40g/mol=2.0g,故用托盘天平称取NaOH固体1.8g,将导致所配溶液的浓度偏小,故答案为:偏小;
②配制500mL0.1mol/L的硫酸铜溶液,使用的容量瓶为500mL容量瓶,应该称量的胆矾的质量为:0.1mol/L×0.5L×250g/mol=12.5g,故用托盘天平称取胆矾8.0g,将导致所配溶液的浓度偏小,故答案为:偏小;
③配制NaOH溶液,用托盘天平称量NaOH时,托盘天平的两个托盘上放两张质量相等的纸片,其他操作均正确,由于NaOH具有很强的吸水性,实际称量出的NaOH质量偏小,所配溶液浓度偏小,故答案为:偏小;
④配制一定物质的量浓度的NaOH溶液,需称量溶质4.4g,称量时物码放置颠倒,实际称量到的NaOH质量只有4.0-0.4=3.6g,故所配溶液浓度偏小,故答案为:偏小;
⑤配制一定物质的量浓度的稀H2SO4溶液时,用量筒量取浓硫酸时,仰视读数,所量浓硫酸的体积偏大,所配溶液浓度偏大,故答案为:偏大;
⑥定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线,将带走部分溶质,所配溶液浓度偏小,故答案为:偏小;
⑦配制一定物质的量浓度溶液时,烧杯及玻璃棒未洗涤,导致溶质的量偏小,所配溶液浓度偏小,故答案为:偏小;
(2)①由于液体的膨胀速率大于固体的膨胀速率,配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容,则将导致溶液体积偏小,所配溶液浓度偏大,故答案为:偏大;
②定容摇匀后,发现液面下降,此为正常现象,若继续加水至刻度线,将导致溶液体积偏大,所配溶液浓度偏小,故答案为:偏小;
③定容时仰视刻度线,将导致溶液体积偏大,所配溶液浓度偏小,故答案为:偏小;
④定容摇匀后少量溶液外流,外流的溶液浓度与容量瓶中溶液浓度相同,则容量瓶中溶液浓度不变,只是体积偏小,故答案为:无影响;
⑤容量瓶中原有少量蒸馏水,对溶液体积无影响,对所配溶液浓度无影响,故答案为:无影响。
11. ①—c ②—a ③—b ④—d ⑤—e
【详解】道尔顿提出了原子学说;阿伏加德罗提出分子学说;波义耳提出了化学元素的概念;拉瓦锡建立了燃烧现象的氧化学说;门捷列夫发现了元素周期律;故答案为:①—c;②—a;③—b;④—d;⑤—e。
12.(1) AC 烧杯、玻璃棒
(2)④⑥②⑤③①
(3)①④
(4) 偏高 偏低 偏低 偏低
(5)B
(6) A C
【详解】(1)配制该溶液的步骤有:计算、称量、溶解(并冷却)、移液、洗涤、定容、摇匀,配制溶液肯定不需要的是烧瓶、分液漏斗,选AC;配制上述溶液还需用到的玻璃仪器是烧杯、玻璃棒;
(2)配制该溶液的步骤有:计算、称量、溶解(并冷却)、移液、洗涤、定容、摇匀,实验操作的先后顺序为④⑥②⑤③①;
(3)步骤①为浓硫酸稀释,应将浓硫酸沿烧杯壁缓慢加入到水中,并不断搅拌,①错误;②为移液,②正确;③为洗涤烧杯和玻璃棒,并向容量瓶中加水,③正确;④定容时,眼睛平视刻度线,④错误;⑤为摇匀溶液,⑤正确,故填①④;
(4)根据c=分析错误操作对所配溶液浓度的影响:
①定容时,俯视观察液面,加入的水不到刻度线,溶液体积偏小,则所配溶液浓度偏高;
②转移过程中如果有少量液体洒到容量瓶外,溶质物质的量偏小,则所配溶液浓度偏低;
③定容时,加蒸馏水不慎超过了刻度,溶液体积偏大,则所配溶液浓度偏低;
④没有洗涤溶解氯化钠的烧杯和玻璃棒,溶质物质的量偏小,则所配溶液浓度偏低。
(5)因为表面张力的存在导致液面表面呈凹形或凸形,一般的液面呈凹形,所以定容后,只有液面凹液面的最低处和容量瓶刻度线相切时,溶液的体积才正好等于容量瓶的容积,答案选B;
(6)①稀释浓硫酸溶液未冷却就定容,所配溶液的体积偏小,浓度偏高,答案选A;
②容量瓶中有少量蒸馏水,因后续实验要加蒸馏水,故对实验无影响,答案选C。
13. 2 mol·L-1 2 mol·L-1 0.25 L 1 mol·L-1 22.4 L
【分析】n(NaCl)===2mol,根据c=计算浓度,同时回答问题。
【详解】(1)由分析可知c===2mol/L;c(Cl-)= c(NaCl)= 2mol/L;
(2)根据稀释定律有V浓===0.25L;
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3 mol/L,那么溶液中HCl的浓度为3mol/L-2mol/L=1mol/L,溶液中H+的物质的量浓度为1mol/L;溶液为1L,通入HCl气体的物质的量为1mol/L×1L=1mol,标准状况下的体积为1mol×22.4L/mol=22.4L。
14. 26.5 250 胶头滴管 B、A、C、F、D、E 偏低 无影响 偏高 重新配制
【详解】(1)配制的溶液,应选择的容量瓶,需要溶质的质量为;配制一定物质的量浓度的溶液需要的仪器有托盘天平、烧杯、玻璃棒、容量瓶、胶头滴管等;
(2)配制一定物质的量浓度溶液的一般步骤为:计算、称量或量取、溶解、移液、洗涤、定容、摇匀等,所以正确的操作顺序为B、A、C、F、D、E;
(3)没有进行洗涤操作,导致部分溶质损耗,溶质的物质的量偏小,根据可知,溶液浓度偏低;配制溶液时,容量瓶未干燥,对溶质的物质的量和溶液体积都不产生影响,对溶液浓度无影响;定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
(4)在实验操作的摇匀过程中,不慎洒出几滴,导致实验失败且无法补救,需要重新配制。
15. CFEDB 应轻拍手腕,小心振动药匙加入药品,使天平平衡 烧杯 玻璃棒 250mL容量瓶 洗涤 定容 摇匀 AC
【分析】配制一定物质的量浓度的溶液,所需的步骤有计算、称量、溶解(冷却)、转移、洗涤、定容、摇匀、装瓶贴签。
【详解】(1)使用托盘天平的步骤为调零→放砝码→调游码→加物品→取物品→取砝码→游码回零,所以正确的操作顺序为BCFAEDB;
(2)只缺少量晶体时,应轻拍手腕,小心振动药匙加入药品,使天平平衡;
(3)溶解需要在烧杯中进行,并用玻璃棒搅拌,加速溶解;5.2g BaCl2的物质的量为=0.025mol,体积V===0.25L=250mL,故选用250mL容量瓶,即溶解后将溶液转入250mL容量瓶;根据分析,转移至250mL容量瓶后,需经过洗涤、定容、摇匀等步骤;
(4)误差分析根据c==,由m、V的大小判断。
A.将砝码放错位置后,由于需要使用游码,游码为0.2g,所以称得的BaCl2为5.2g-2×0.2g =4.8g,所得溶液浓度偏低;
B.由于定容时需要向容量瓶中加水,故容量瓶内有少量蒸馏水不影响浓度;
C.摇匀后有少量液体残留在刻线上方,只许等待片刻液体流下即可,再加水会增大溶液体积,所得溶液浓度偏低;
D.不振荡,溶液浓度不均匀,待溶质充分扩散后即可达到所配浓度;
故选AC。
16. BDE 过滤 萃取、分液 使I-转化为I2 CCl4(答案合理即可) CCl4不溶于水,且溶解碘的能力强于水(与前一问照应) CBDAHGEF 保持分液漏斗内外压力平衡,使液体易于流下 漏斗下口[与(4)照应] 取少量提取碘后的水溶液于试管中,加入淀粉溶液,溶液不变蓝,说明没有I2剩余,反之则有I2剩余
【分析】将海带灰悬浊液过滤可得固体残渣和含有I-的溶液,然后向溶液中通入适量Cl2,发生反应:Cl2+2I-=I2+2Cl-,然后向其中加入有机溶剂进行萃取,经分液后单质I2进入有机溶剂,然后蒸发结晶可得I2的晶体,据此分析解答。
【详解】(1)灼烧固体海带时用坩埚,在带铁圈的铁架台(或三脚架和泥三角)放置坩埚,用酒精灯进行加热,所以灼烧海带时需要用到的实验仪器是坩埚、带铁圈的铁架台、酒精灯,合理选项是BDE。
(2)根据图示可知,提取碘的过程中有关实验操作的名称,a是过滤;c是萃取、分液;
(3)操作b中充入适量Cl2,可发生反应:Cl2+2I-=I2+2Cl-,使I-转化为I2,若Cl2过量,I2会被过量的Cl2氧化产生更高价态的碘的化合物;
(4)操作c是萃取、分液,其中所用的有机试剂可以是CCl4,CCl4作萃取剂的选取标准:溶质在CCl4中的溶解度大于水,溶质和萃取剂CCl4不反应,CCl4和水互不相溶。四氯化碳符合萃取剂的选取标准,所以可以用四氯化碳作萃取剂;
(5)①萃取分液的操作步骤是:检验分液漏斗是否漏液;把50 mL碘水和15 mL有机溶剂[(4)中所选择的]加入分液漏斗中,并盖好玻璃塞;倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;把盛有溶液的分液漏斗放在铁架台的铁圈上;静置、分层;将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;旋开活塞,用烧杯接收溶液;从分液漏斗上口倒出上层液体,故操作步骤用字母顺序表示为CBDAHGEF;
②在上述中G操作的目的是保持分液漏斗内外压力平衡,使液体易于流下;
③由于I2的CCl4溶液的密度比水大,所以分液后在下层,所以最后碘的有机溶液是通过漏斗下口获得;
(6)可根据I2遇淀粉溶液变为蓝色检验。检验方法是:取少量提取碘后的水溶液于试管中,向其中滴加几滴淀粉溶液,若溶液变为蓝色,说明还有单质碘;若溶液不变蓝色,说明提取碘后的溶液中无I2单质。
【点睛】本题考查了海水资源的综合利用。涉及仪器的使用、实验操作步骤、物质的检验等。把握实验流程,弄清每一步操作的目的、发生的反应、分离混合物方法与物质性质的关系是解题关键。注意(5)操作c的萃取、分液中实验操作步骤的先后顺序的判断。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
