河北省新乐市第一中学高中化学必修二课件:1.3 化学键 (共17张PPT)
文档属性
| 名称 | 河北省新乐市第一中学高中化学必修二课件:1.3 化学键 (共17张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 354.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-26 13:20:35 | ||
图片预览

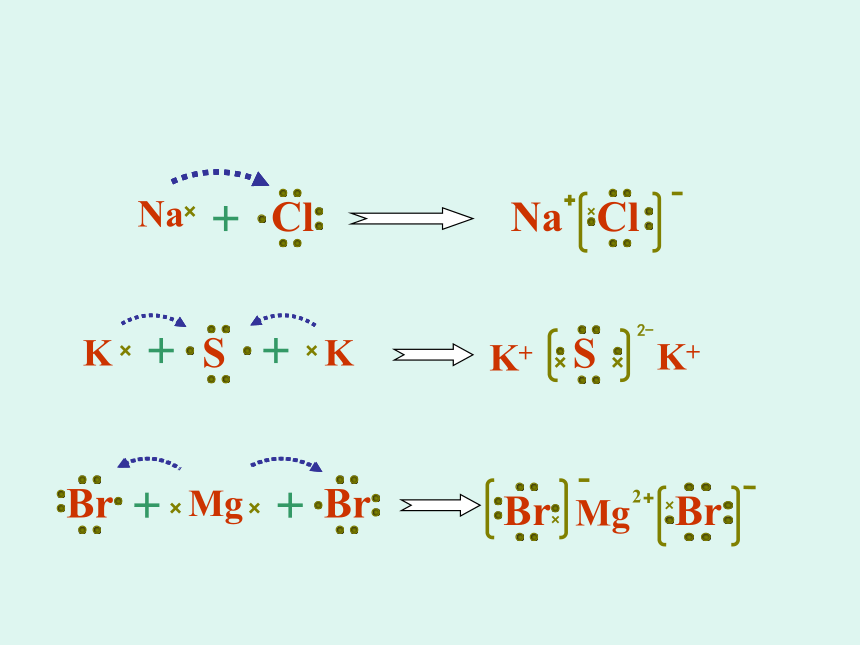


文档简介
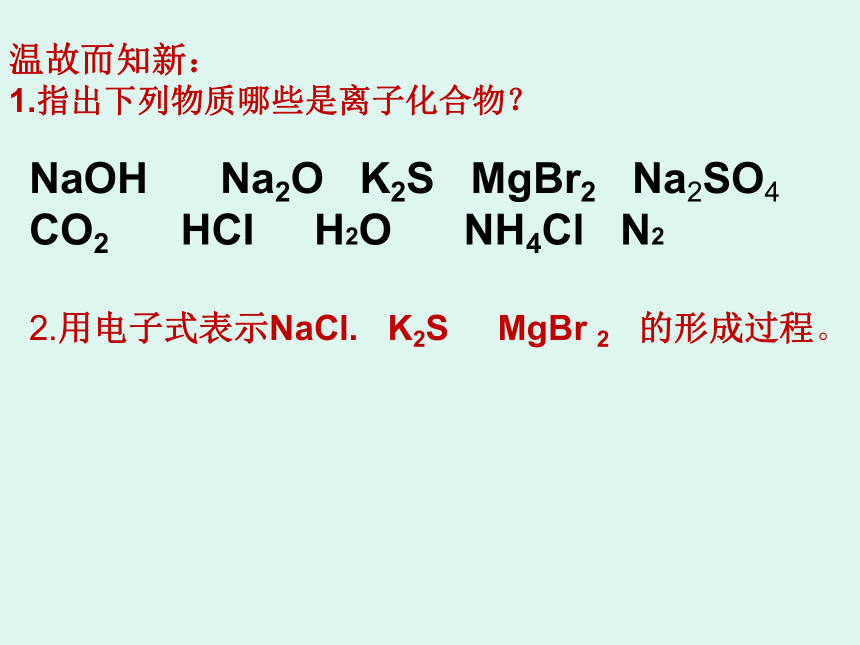
课件17张PPT。第二课时第三节 化 学 键NaOH Na2O K2S MgBr2 Na2SO4
CO2 HCI H2O NH4Cl N2 温故而知新:
1.指出下列物质哪些是离子化合物?2.用电子式表示NaCl. K2S MgBr 2 的形成过程。写出Cl,H,Ne原子的电子式。
小组讨论:
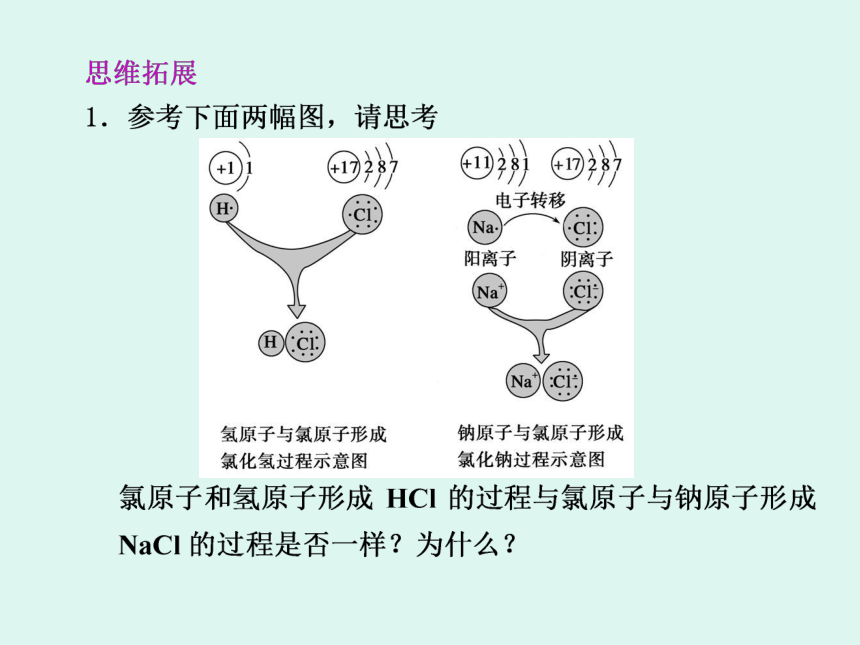
1个氢分子为什么是由2个氢原子组成?
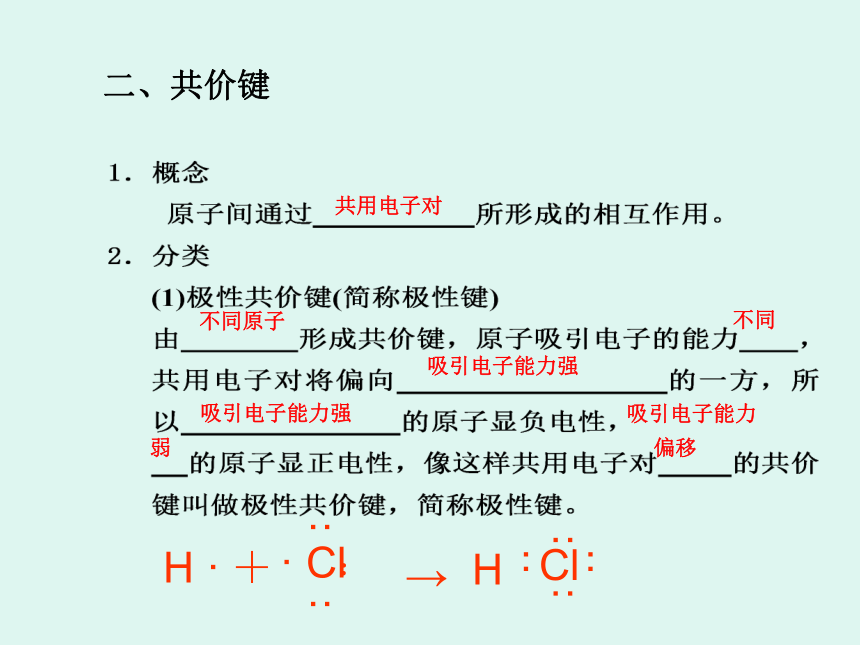
这两个氢原子靠什么作用结合在一起?是离子键吗?稀有气体为什么是单原子分子而不是双原子分子?氯气为什么是双原子分子而不是三原子分子? 氢分子的形成: H · 氯化氢分子的形成:· H+→H ·+→ 共用电子对 不同原子 不同 吸引电子能力强 吸引电子能力强 吸引电子能力 弱 偏移 二、共价键H ·+→同种原子 相同 不偏向 不显 H ·+H ·→3、成键的本质一般是同种或不同种非金属元素
如:H2 HCl
或某些不活泼金属与非金属之间 如:AlCl3原子间通过共用电子对形成的相互作用①成键元素:
②本质:
注意:用电子式表示共用电子对形成的分子时,不标 [ ] 和电荷,箭头。 1、下列分子的电子式书写正确的是( ) C 碘 → 练习2、用电子式表示下列共价分子的形成 过程 二氧化碳 氨 硫化氢→→→通过共用电子对形成分子的化合物。判断 1.共价化合物中一定只含有共价键( )
2.含有共价键的化合物不一定是共价化合物( )
3.离子化合物中也可能含有共价键( )例:HCl H2O CO2 CH4 NH3 5、共价化合物如:NaOH、Na2O2 等存在广泛存在于非金属单质,以及复杂离子或离子化合物中对对对3.下列物质中属于共价化合物的是( )
A.Na2O2 B.NaHSO4 C. HNO3 D.I2
4.下列物质中,具有非极性键的离子化合物是( )
A.H2O2 B.MgF C.NaOH D.Na2O2
DC静电 电子 对 得失 电子对 阴、阳离子 原子 非金属 金属 非金属 作业:试写出下列物质的电子式CH4 NH3 H2O2
NH4+ OH- CO2
CCl4 Na2O2 NH4Cl
NaOH Mg(OH)2 NaCl
Na2S MgS N2
MgCl2祝同学们学习进步
再见
CO2 HCI H2O NH4Cl N2 温故而知新:
1.指出下列物质哪些是离子化合物?2.用电子式表示NaCl. K2S MgBr 2 的形成过程。写出Cl,H,Ne原子的电子式。
小组讨论:
1个氢分子为什么是由2个氢原子组成?
这两个氢原子靠什么作用结合在一起?是离子键吗?稀有气体为什么是单原子分子而不是双原子分子?氯气为什么是双原子分子而不是三原子分子? 氢分子的形成: H · 氯化氢分子的形成:· H+→H ·+→ 共用电子对 不同原子 不同 吸引电子能力强 吸引电子能力强 吸引电子能力 弱 偏移 二、共价键H ·+→同种原子 相同 不偏向 不显 H ·+H ·→3、成键的本质一般是同种或不同种非金属元素
如:H2 HCl
或某些不活泼金属与非金属之间 如:AlCl3原子间通过共用电子对形成的相互作用①成键元素:
②本质:
注意:用电子式表示共用电子对形成的分子时,不标 [ ] 和电荷,箭头。 1、下列分子的电子式书写正确的是( ) C 碘 → 练习2、用电子式表示下列共价分子的形成 过程 二氧化碳 氨 硫化氢→→→通过共用电子对形成分子的化合物。判断 1.共价化合物中一定只含有共价键( )
2.含有共价键的化合物不一定是共价化合物( )
3.离子化合物中也可能含有共价键( )例:HCl H2O CO2 CH4 NH3 5、共价化合物如:NaOH、Na2O2 等存在广泛存在于非金属单质,以及复杂离子或离子化合物中对对对3.下列物质中属于共价化合物的是( )
A.Na2O2 B.NaHSO4 C. HNO3 D.I2
4.下列物质中,具有非极性键的离子化合物是( )
A.H2O2 B.MgF C.NaOH D.Na2O2
DC静电 电子 对 得失 电子对 阴、阳离子 原子 非金属 金属 非金属 作业:试写出下列物质的电子式CH4 NH3 H2O2
NH4+ OH- CO2
CCl4 Na2O2 NH4Cl
NaOH Mg(OH)2 NaCl
Na2S MgS N2
MgCl2祝同学们学习进步
再见
