期中复习 第2课时(第2章)科学浙教版(2024)七年级下册(课件 80张PPT)
文档属性
| 名称 | 期中复习 第2课时(第2章)科学浙教版(2024)七年级下册(课件 80张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 20.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-06-21 21:28:19 | ||
图片预览







文档简介
(共80张PPT)
科学浙教版(2024)七年级下册
第二章小节 新课标要求 评价方向
第1节 走进微观世界 1.6物质由微观粒子构成 物质由分子、原子等微观粒子构成,能够运用分子热运动、分子间作用力(引力和斥力)以及分子间空隙解释生活中的常见现象。能够通过模型认简单分子的结构。能够通过实验(如电解水)探究物质的元素组成。
了解原子结构(质子、中子、电子)及原子模型的发展历程(如道尔顿实心球模型、卢瑟福核式模型等),知道原子可以得失电子形成离子(如Na 、Cl )。能够依据质子数区分不同元素,理解同位素(如氢的三种同位素:氕、氘、氚)的异同。
能够正确书写常见物质的化学式(如H O、CO 、NaCl),并根据元素化合价(如氧通常为-2价、氢为+1价)判断化学式的正误。掌握相对原子质量和相对分子质量,并能运用这些知识解决实际问题。
第2节 建构分子模型 1.6物质由微观粒子构成 第3节 建构原子模型 1.5物质由元素组成 1.6物质由微观粒子构成 第4节 探究物质组成的奥秘 1.5物质由元素组成 第5节 用化学式表示物质 1.5物质由元素组成 1.6物质由微观粒子构成
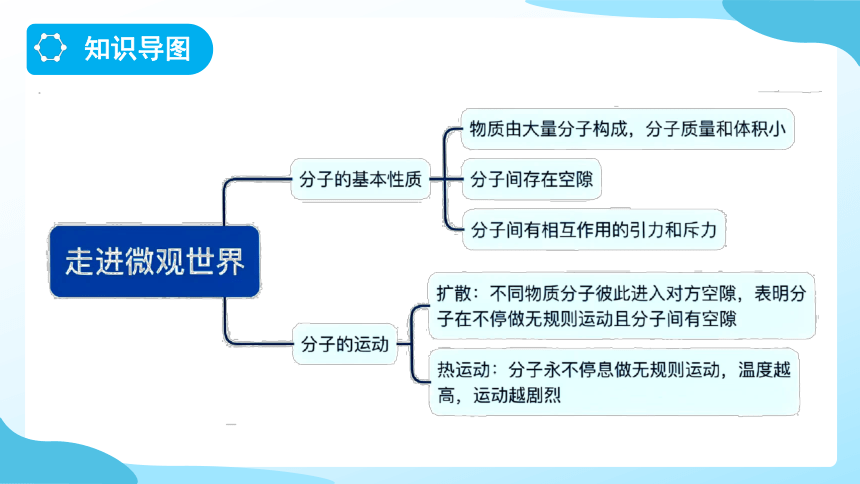
1.构成物质的粒子之间都有一定的空隙。
2.不同物质粒子间的空隙大小不同。
在固体和液体中,粒子之间空隙比较小;在气体中,粒子之间空隙比较大。
气体往往比较容易被压缩;
固体和液体不易被压缩。
总结
1.扩散现象
不同的物质在互相接触时彼此进入对方的现象。
2.扩散现象表明
构成物质的分子都在不停地做无规则运动。
温度越高,分子无规则运动越剧烈。
3.热运动
分子永不停息的无规则运动叫作热运动。
总结
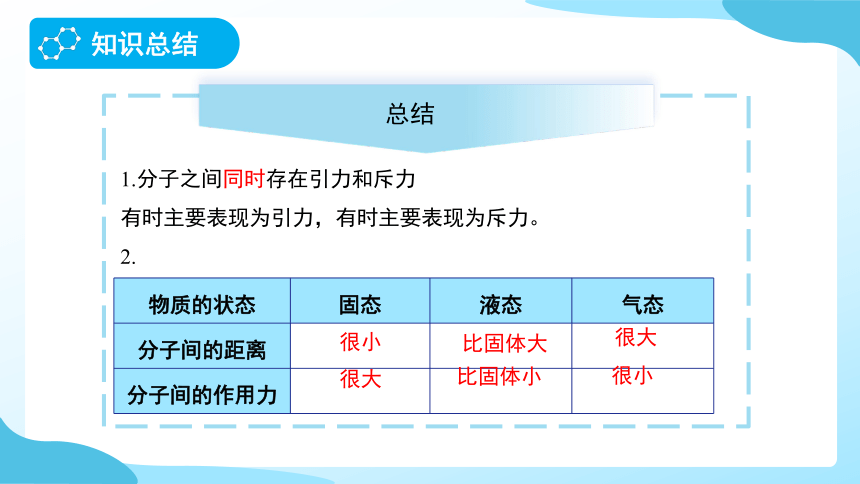
1.分子之间同时存在引力和斥力
有时主要表现为引力,有时主要表现为斥力。
2.
总结
物质的状态 固态 液态 气态
分子间的距离
分子间的作用力
很小
很大
比固体大
比固体小
很大
很小
模型的分类:
物体的复制品:地球仪、航模等;
公式:S=vt等;
图:心电图、路程—时间图等;
表:日程表、课程表等;
计算机图像:Flash动画等;
复杂对象、过程的示意:日食、月食等。
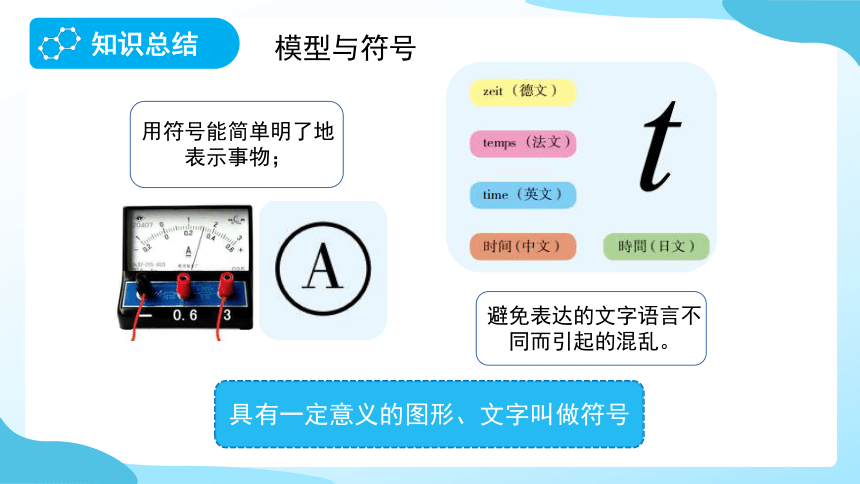
具有一定意义的图形、文字叫做符号
用符号能简单明了地表示事物;
避免表达的文字语言不同而引起的混乱。
模型与符号
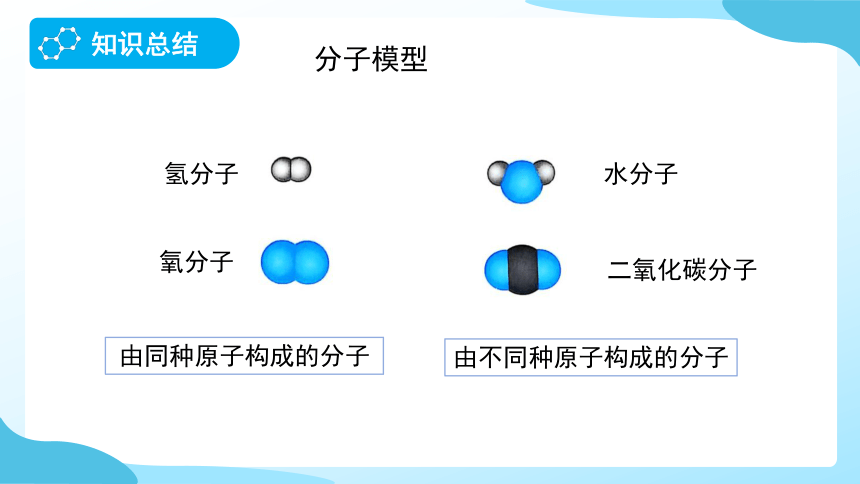
氧分子
氢分子
由同种原子构成的分子
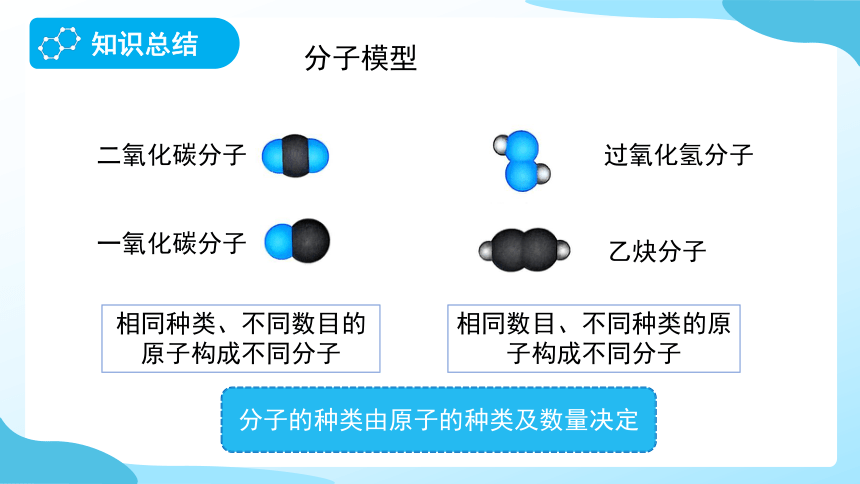
二氧化碳分子
水分子
由不同种原子构成的分子
分子模型
一氧化碳分子
二氧化碳分子
相同种类、不同数目的原子构成不同分子
乙炔分子
过氧化氢分子
相同数目、不同种类的原子构成不同分子
分子的种类由原子的种类及数量决定
分子模型
水
通直流电
氢气
+ 氧气
实验说明水分子由两种、不同的更小
的原子构成,水由氢、氧组成。
水
分
子
氢
分子
氧分子
正氧负氢
氢二氧一
氢气
氧气
1个水分子由2个氢原子和1个氧原子构成
水分子分解为氢原子和氧原子
2个氢原子结合成1个氢分子
2个氧原子结合成1个氧分子
原子
每个质子带1个单位正电荷
不带电
质子
中子
原子核
核外电子
每个电子带1个单位负电荷
电中性
核电荷数 = 质子数 = 核外电子数
0.25
原子的构成示意图
定义:以一种碳原子质量的1/12为标准。
碳-12原子,它质量的1/12约等于1.66×10-27kg
碳-12原子
碳-12原子的1/12
质量约等于1.66×10-27kg
其他原子的质量与它相比较所得到的比,作为这种原子的相对原子质量。
氧
氧的相对原子质量是16
0.25
失去1个电子
+11
质子数>电子数
Na+
+11
质子数=电子数
Na
0.25
+17
质子数=电子数
Cl
+17
质子数<电子数
Cl-
阳离子
阴离子
NaCl
静电作用
Cl-
Na+
得到1个电子
带电的微粒称为离子。
1.离子的定义:
1.离子的分类:
离子
阳离子
阴离子
带正电的离子,Na+
带电的微粒
带负电的离子,Cl-
均达到稳定结构。
2.离子的分类:
阳离子:带正电荷的微粒。(质子数>电子数)
阴离子:带负电荷的微粒。(质子数<电子数)
离子也是构成物质的微观粒子(例如氯化钠)
1.元素的定义
科学上把质子数(即核电荷数)相同的一类原子的总称为元素。
质子数(即核电荷数)决定元素种类。
2.对元素的理解
对一类原子的理解:核电荷数(即质子数)相同。
核电荷数(即质子数)相同,核外电子数不同的原子和离子。如钠原子和钠离子都属于钠元素。
氕
氘
氚
原子核内的质子数相同,中子数不相同的同类原子互为同位素原子。
H
1
1
H
2
1
H
3
1
把质子数和中子数的总数标出以示区别,如氢有以下三种同位素。
氕
氘
氚
质子数+中子数
没有中子
也有表示为:碳-14(C-14)、碳-13(C-13)、碳-12(C-12)。
地壳中含量前五位的元素:
氧、硅、铝、铁、钙
硅 26.30%
氧 48.60%
铝7.73%
铁4.75%
钙3.45%
钠2.74%
钾2.47%
镁2.00%
其他1.20%
氢0.76%
地壳
地壳中所含元素的含量(质量)
氧、碳、氢
人体中所含元素的含量(质量)
氧65%
碳18%
氢10%
其他7%
人体
人体中含量前三位的元素:
Ca
O
C
H
N
P
K
S
Na
Mg
Cl
Fe
Zn
I
Se
空气里含量前两位元素
海水中含量前四位元素
氮、氧
氧、氢、
氯、钠
空气
海水
部分元素符号有三种意义
②表示一个铁原子
①表示铁元素
Fe
③表示铁这种物质
②表示一个碳原子
①表示碳元素
C
③表示碳这种物质
Cu、Fe、Hg等金属元素、C、P、S、Si等部分固态非金属元素、
具有三种意义的元素符号有:
He、Ne、Ar等稀有气体元素。
1、横行(周期):共有____横行,每一个横行叫作一个周期,共____周期。
2、纵列(族):_____纵列,每一个纵列叫作一个族(8、9、10三个纵列共同组成一个族),共______族。
7个
7个
16个
18个
A—主族
B—副族
宏观
表示该物质;
表示该物质由什么元素组成;
微观:
表示该物质的一个原子;
Cu
铜
铜是由铜元素组成
一个铜原子
由原子构成的物质
1
化学式的意义
由分子构成的物质
微观
意义
表示物质的一个分子
表示物质一个分子的构成情况
表示一种物质
表示一种物质的元素组成
宏观
意义
2
化学式的意义
表示1个水分子由2个氢原子和1个氧原子构成
表示1个水分子
表示水这种物质
表示水由氢元素和氧元素组成
H2O
宏观
微观
表示二氧化碳由碳元素和氧元素组成
表示二氧化碳这种物质
表示1个二氧化碳分子
表示1个二氧化碳分子由1个碳原子和2个氧原子构成
CO2
宏观
微观
H2
2H
2H2
2个氢原子
氢气
氢气由氢元素组成
一个氢分子
一个氢分子由2个氢原子构成
2个氢分子
H
H
H
H
H
H
H
H
H
注意:元素符号或化学式前有系数,表示只有微观意义
氢元素
1个氢原子
H
(1)元素化合价有正价、负价。
金属元素与非金属元素化合时,金属元素显正价,非金属元素显负价。
在化合物里,氧元素通常显-2价,氢元素通常显+1价;
+1
-1
+1
-2
HCl H2O
NaCl MgCl2
+1
-1
+2
-1
(2)化合物中,正、负化合价的代数和为0。
如MgCl2中各元素化合价为:(+1)x2+(-2)= 0
化合价的一般规律
(3)一些元素在不同物质中可显不同的化合价。
+2
-2
+4
-2
+2
-2
-2
+3
CO
FeO Fe2O3
CO2
(4)在单质中,元素的化合价为0。
Fe O2
0
0
化合价的一般规律
H2O的相对分子质量 = 1×2+16×1=18
[回顾] H2O的意义
[分析]真实质量
[类比]相对分子质量
化学式中各原子的相对原子质量的总和,就是相对分子质量(符号为Mr)。
计算相对分子质量
1个水分子是由2个氢原子和1个氧原子构成的。
1个水分子的质量=2个氢原子的质量+1个氧原子的质量。
1个水分子的相对分子质量=2个氢原子的相对原子质量+1个氧原子的相对原子质量。
根据化学式计算相对分子质量时注意:
1.正确书写化学式含义;
2.准确理解化学式中数字的含义;
3.“元素之间”用“+”号,“元素与对应右下角数字之间”用“×”号;
4.单位是1,不是“g”。
计算相对分子质量
【计算】二氧化碳(CO2)中碳元素(C)和氧元素(O)的质量比。
(C-12 O-16)
各元素之间的质量比=各原子的相对原子质量总和之比
计算物质组成元素的质量比
m(C) : m(O) = 12×1 : ( 16×2 ) = 12 : 32 = 3 : 8
如:C6H12O6中各元素的质量比:
m(C): m(H) : m(O) = 6 : 12 : 6 = 1 : 2 : 1
m(C) :m(H) : m(O) = ( 6×12 ) : ( 12×1 ) : ( 6×16 ) = 6 : 1 : 8
1.元素质量比 ≠ 原子个数比;
2.注意合并相同元素的原子个数,不要漏掉。
Ca(OH)2 NH4NO3
注意:①看清各元素质量比的顺序;
②结果约简成最简整数比;
③区分元素质量比与原子个数比。
计算物质组成元素的质量比
(H-1 C-12 N-14 O-16)
计算:Ca(OH)2、H2O2 、NH4NO3 中各元素的质量比。
Ca(OH)2中钙、氧、氢元素的质量比
H2O2中氢、氧元素的质量比
NH4NO3中氮、氢、氧元素的质量比
计算物质组成元素的质量比
= 40: ( 16×2 ) : ( 1×2 )
= 20 : 16 : 1
= ( 14×2 ) : ( 1×4 ) : ( 16×3 )
= 7 : 1 : 12
= ( 1×2 ) : ( 16×2 ) = 1 : 16
某元素的质量分数,就是该元素的质量与组成物质的元素总质量之比,可根据化学式计算。
某元素的质量分数=
该元素的相对原子质量×原子个数
该化合物的相对分子质量
×100%
计算物质中某元素的质量分数
通过计算判断图中氮元素的含量是否能符合实际?
解:(NH4)2SO4的相对分子质量
=(14+1×4)× 2+ 32 + 16 × 4 = 132
氮元素的质量分数
= × 100% = 21.2%
∵ 21.2% > 20.5%
∴ 符合实际
答:图中氮元素的含量能符合实际。
计算物质中某元素的质量分数
(14×2)
132
练习一 计算NH4NO3中氮元素的质量分数。
步骤1: NH4NO3的相对分子质量
步骤2: NH4NO3中氮元素的质量分数
计算物质中某元素的质量分数
= 14 x 2 + 1 × 4 + 16 × 3 = 80
(H-1 N-14 O-16)
=
N 元素的相对原子质量 × N 原子个数
NH4NO3 的相对分子质量
×100%
14×2
80
=
=
35%
×100%
练习一 计算NH4NO3中氮元素的质量分数。
步骤1: NH4NO3的相对分子质量
步骤2: NH4NO3中氮元素的质量分数
计算物质中某元素的质量分数
= 14 x 2 + 1 × 4 + 16 × 3 = 80
(H-1 N-14 O-16)
=
N 元素的相对原子质量 × N 原子个数
NH4NO3 的相对分子质量
×100%
14×2
80
=
=
35%
×100%
易错1 误以为物质都是由分子构成的。
物质不都是由分子构成的。分子只是构成物质的一种微观粒子,除分子外,构成物质的微观粒子还有原子和离子等。
易错归纳|错题加练
下列说法中,正确的是( )
A.同种原子中,质子数等于中子数
B.在化学变化中,原子的核外电子数可能发生变化C.NaCl由氯化钠分子构成
D.不同元素的本质区别是相对原子质量不同
B
易错2 易将机械运动和分子热运动混淆。
分子永不停息地做无规则运动与外力作用下的机械运动是不同的。机械运动是宏观物体的运动,用肉眼可以直接看到(如灰尘飞舞、柳絮漫天飞等),而分子运动不能用肉眼直接看到。
化学教会我们从微观角度去认识宏观现象。下列对生活中现象的解释不合理的是( )
A.春天公园里柳絮纷飞,因为分子在不停地运动
B.氮气不如氧气活泼,说明不同分子化学性质不同
C.水烧开后易把壶盖顶起,因为温度升高,分子间间隔增大
D.一滴水大约有1.6×1021个水分子,说明分子的体积很小
A
易错归纳|错题加练
易错3 误认为所有的原子核内都有中子。
大多数原子的原子核是由质子和中子构成的,也有部分原子的原子核内无中子,如普通氢原子的原子核内无中子。
下列有关分子、原子、离子的说法中,正确的是( )
A.分子、原子和离子都可以直接构成物质
B.原子都是由质子、中子、核外电子构成的
C.带正电荷的微粒一定是阳离子
D.分子由原子构成,分子比原子大
A
易错归纳|错题加练
易错4 原子中各粒子之间的关系混淆不清。
在原子中,质子数 = 核电荷数 = 核外电子数,相对原子质量≈质子数 + 中子数,质子数不一定等于中子数。
我国南海海底蕴藏着丰富的锰结核——含有锰、铁、铜等金属的矿物。已知锰原子的核内质子数为25,相对原子质量为55,则锰原子的核外电子数为( )
A.55 B.30 C.25 D.80
C
易错归纳|错题加练
易错5 误认为原子是化学变化中的最小粒子,所以不能再分
原子是化学变化中最小的粒子,在化学变化中不能再分,但不能在没有限定条件下说不能再分。
下列有关分子、原子说法错误的是( )
A.分子可以再分,原子不能再分
B.氧气由氧分子构成
C.同种分子构成纯净物,不同种分子构成混合物
D.原子可构成物质
A
易错归纳|错题加练
易错6 误认为认为分子是由原子构成的,所以分子一定比原子大,分子重,原子轻
分子与构成这种分子的原子相比,分子大原子小。但不是所有的分子都比原子大,如汞原子就比氢分子大得多。
有关分子、原子的说法正确的是( )
A.分子是保持物质性质的最小微粒
B.原子是化学变化中的最小微粒
C.化学变化中分子、原子均可分
D.分子质量一定大于原子质量
B
易错归纳|错题加练
易错6 误认为由同种元素组成的物质一定是单质
只含有一种元素的物质,可能是单质,也可能是混合物
推理是化学学习的一种方法,以下推理正确的是( )
A.单质中只含有一种元素,因此只含有一种元素的纯净物一定是单质
B.分子、原子可以构成物质,所以物质一定是由分子、原子构成的
C.Na+、Cl-的最外层电子数均为8,则最外层电子数为8的粒子都是离子
D.原子核是由质子和中子构成的,故所有的原子都有质子和中子
A
易错归纳|错题加练
模型1 相对分子质量的计算
在化合物Am Bn 中,它的相对分子质量 = A 的相对原子质量 ×m + B 的相对原子质量 ×n
模型2 元素质量比的计算
在化合物Am Bn 中,A、B 两元素的质量比为(A 的相对原子质量 ×m):(B 的相对原子质量 ×n)
模型3 计算单一物质中某元素的质量分数
在化合物Am Bn 中,A 元素的质量分数 =(A 的相对原子质量 ×m)/(A 的相对原子质量 ×m + B 的相对原子质量 ×n)×100%。
模型4 确定物质的化学式
技能演练
在M、N两种元素组成的化合物中,M和N的质量比是3:1,又知M和N的相对原子质量之比是12:1,则下列式子中能够表示此化合物化学式的是( )
A.MN4 B.MN3 C.MND.M2N
A
模型5 混合物中元素质量分数的计算
方法1
极端假设
将混合物的组成假设为多种极端情况,并针对各种极端情况进行计算分析,从而得出正确的判断。
一定量的木炭在盛有氮气和氧气混合气体的密闭容器中充分燃烧后生成CO和CO2,且测得反应后所得CO、CO2、N2的混合气体中碳元素的质量分数为24%,则其中氮气的质量分数可能为( )
A.10% B.30% C.50% D.70%
B
技能演练
模型5 混合物中元素质量分数的计算
方法2
中值假设
中值假设就是把混合物中某纯净物的量值假设为中间值,以中间值为参照,进行分析、推理,从而巧妙解题。
仅含氧化铁(Fe2O3)和氧化亚铁(FeO)的混合物中,铁元素的质量分数为73.1%,则混合物中氧化铁的质量分数为( )
A.30% B.40% C.50% D.60%
D
技能演练
模型5 混合物中元素质量分数的计算
方法3
等效假设
等效假设就是在不改变纯净物相对分子质量的前提下,通过变换化学式,把复杂混合物的组成假设为若干个简单、理想的组成,使复杂问题简单化,从而迅速解题。
已知在NaHS、NaHSO3和MgSO4组成的混合物中硫元素的质量分数为a%,则混合物中氧元素的质量分数为____________。
1-1.75a%
技能演练
模型5 混合物中元素质量分数的计算
方法4
赋值假设
赋值假设就是在有关化学式的无数据计算、以比值形式作已知条件或求比值的问题中,赋予某些特定对象具体的量值,化抽象为具体,以使问题顺利解决。
青少年应“珍爱生命,远离毒品”。海洛因是一种常用的毒品,其元素的质量分数分别为:C:68.29%H:6.23%O:21.68%,其余为氮。若已知其相对分子质量不超过400,则一个海洛因分子中氮原子个数为( )
A.4 B.3 C.2 D.1
D
技能演练
模型5 混合物中元素质量分数的计算
方法5
巧用定比
利用混合物中元素的比例一定,可轻松解出剩余元素的质量分数
FeSO4和Fe2(SO4)3的混合物,其中Fe的质量分数是31%,则混合物中氧元素的质量分数是 .
46%
技能演练
模型5 混合物中元素质量分数的计算
方法6
化合价法
化合价法就是根据化合价和为零列出方程求解。
Na2S、NaBr的混合物中,钠的质量分数为37%,求Br的质量分数 .
46.6%
技能演练
模型5 混合物中元素质量分数的计算
方法7
单独分析
单独分析就是单独分析混合物中每种化合物中所求元素的质量分数,对比总的质量分数(一般会凑好,其中一个化合物的质量分数等于总的质量分数),简化计算,得出结论。
科学浙教版(2024)七年级下册
第二章小节 新课标要求 评价方向
第1节 走进微观世界 1.6物质由微观粒子构成 物质由分子、原子等微观粒子构成,能够运用分子热运动、分子间作用力(引力和斥力)以及分子间空隙解释生活中的常见现象。能够通过模型认简单分子的结构。能够通过实验(如电解水)探究物质的元素组成。
了解原子结构(质子、中子、电子)及原子模型的发展历程(如道尔顿实心球模型、卢瑟福核式模型等),知道原子可以得失电子形成离子(如Na 、Cl )。能够依据质子数区分不同元素,理解同位素(如氢的三种同位素:氕、氘、氚)的异同。
能够正确书写常见物质的化学式(如H O、CO 、NaCl),并根据元素化合价(如氧通常为-2价、氢为+1价)判断化学式的正误。掌握相对原子质量和相对分子质量,并能运用这些知识解决实际问题。
第2节 建构分子模型 1.6物质由微观粒子构成 第3节 建构原子模型 1.5物质由元素组成 1.6物质由微观粒子构成 第4节 探究物质组成的奥秘 1.5物质由元素组成 第5节 用化学式表示物质 1.5物质由元素组成 1.6物质由微观粒子构成
1.构成物质的粒子之间都有一定的空隙。
2.不同物质粒子间的空隙大小不同。
在固体和液体中,粒子之间空隙比较小;在气体中,粒子之间空隙比较大。
气体往往比较容易被压缩;
固体和液体不易被压缩。
总结
1.扩散现象
不同的物质在互相接触时彼此进入对方的现象。
2.扩散现象表明
构成物质的分子都在不停地做无规则运动。
温度越高,分子无规则运动越剧烈。
3.热运动
分子永不停息的无规则运动叫作热运动。
总结
1.分子之间同时存在引力和斥力
有时主要表现为引力,有时主要表现为斥力。
2.
总结
物质的状态 固态 液态 气态
分子间的距离
分子间的作用力
很小
很大
比固体大
比固体小
很大
很小
模型的分类:
物体的复制品:地球仪、航模等;
公式:S=vt等;
图:心电图、路程—时间图等;
表:日程表、课程表等;
计算机图像:Flash动画等;
复杂对象、过程的示意:日食、月食等。
具有一定意义的图形、文字叫做符号
用符号能简单明了地表示事物;
避免表达的文字语言不同而引起的混乱。
模型与符号
氧分子
氢分子
由同种原子构成的分子
二氧化碳分子
水分子
由不同种原子构成的分子
分子模型
一氧化碳分子
二氧化碳分子
相同种类、不同数目的原子构成不同分子
乙炔分子
过氧化氢分子
相同数目、不同种类的原子构成不同分子
分子的种类由原子的种类及数量决定
分子模型
水
通直流电
氢气
+ 氧气
实验说明水分子由两种、不同的更小
的原子构成,水由氢、氧组成。
水
分
子
氢
分子
氧分子
正氧负氢
氢二氧一
氢气
氧气
1个水分子由2个氢原子和1个氧原子构成
水分子分解为氢原子和氧原子
2个氢原子结合成1个氢分子
2个氧原子结合成1个氧分子
原子
每个质子带1个单位正电荷
不带电
质子
中子
原子核
核外电子
每个电子带1个单位负电荷
电中性
核电荷数 = 质子数 = 核外电子数
0.25
原子的构成示意图
定义:以一种碳原子质量的1/12为标准。
碳-12原子,它质量的1/12约等于1.66×10-27kg
碳-12原子
碳-12原子的1/12
质量约等于1.66×10-27kg
其他原子的质量与它相比较所得到的比,作为这种原子的相对原子质量。
氧
氧的相对原子质量是16
0.25
失去1个电子
+11
质子数>电子数
Na+
+11
质子数=电子数
Na
0.25
+17
质子数=电子数
Cl
+17
质子数<电子数
Cl-
阳离子
阴离子
NaCl
静电作用
Cl-
Na+
得到1个电子
带电的微粒称为离子。
1.离子的定义:
1.离子的分类:
离子
阳离子
阴离子
带正电的离子,Na+
带电的微粒
带负电的离子,Cl-
均达到稳定结构。
2.离子的分类:
阳离子:带正电荷的微粒。(质子数>电子数)
阴离子:带负电荷的微粒。(质子数<电子数)
离子也是构成物质的微观粒子(例如氯化钠)
1.元素的定义
科学上把质子数(即核电荷数)相同的一类原子的总称为元素。
质子数(即核电荷数)决定元素种类。
2.对元素的理解
对一类原子的理解:核电荷数(即质子数)相同。
核电荷数(即质子数)相同,核外电子数不同的原子和离子。如钠原子和钠离子都属于钠元素。
氕
氘
氚
原子核内的质子数相同,中子数不相同的同类原子互为同位素原子。
H
1
1
H
2
1
H
3
1
把质子数和中子数的总数标出以示区别,如氢有以下三种同位素。
氕
氘
氚
质子数+中子数
没有中子
也有表示为:碳-14(C-14)、碳-13(C-13)、碳-12(C-12)。
地壳中含量前五位的元素:
氧、硅、铝、铁、钙
硅 26.30%
氧 48.60%
铝7.73%
铁4.75%
钙3.45%
钠2.74%
钾2.47%
镁2.00%
其他1.20%
氢0.76%
地壳
地壳中所含元素的含量(质量)
氧、碳、氢
人体中所含元素的含量(质量)
氧65%
碳18%
氢10%
其他7%
人体
人体中含量前三位的元素:
Ca
O
C
H
N
P
K
S
Na
Mg
Cl
Fe
Zn
I
Se
空气里含量前两位元素
海水中含量前四位元素
氮、氧
氧、氢、
氯、钠
空气
海水
部分元素符号有三种意义
②表示一个铁原子
①表示铁元素
Fe
③表示铁这种物质
②表示一个碳原子
①表示碳元素
C
③表示碳这种物质
Cu、Fe、Hg等金属元素、C、P、S、Si等部分固态非金属元素、
具有三种意义的元素符号有:
He、Ne、Ar等稀有气体元素。
1、横行(周期):共有____横行,每一个横行叫作一个周期,共____周期。
2、纵列(族):_____纵列,每一个纵列叫作一个族(8、9、10三个纵列共同组成一个族),共______族。
7个
7个
16个
18个
A—主族
B—副族
宏观
表示该物质;
表示该物质由什么元素组成;
微观:
表示该物质的一个原子;
Cu
铜
铜是由铜元素组成
一个铜原子
由原子构成的物质
1
化学式的意义
由分子构成的物质
微观
意义
表示物质的一个分子
表示物质一个分子的构成情况
表示一种物质
表示一种物质的元素组成
宏观
意义
2
化学式的意义
表示1个水分子由2个氢原子和1个氧原子构成
表示1个水分子
表示水这种物质
表示水由氢元素和氧元素组成
H2O
宏观
微观
表示二氧化碳由碳元素和氧元素组成
表示二氧化碳这种物质
表示1个二氧化碳分子
表示1个二氧化碳分子由1个碳原子和2个氧原子构成
CO2
宏观
微观
H2
2H
2H2
2个氢原子
氢气
氢气由氢元素组成
一个氢分子
一个氢分子由2个氢原子构成
2个氢分子
H
H
H
H
H
H
H
H
H
注意:元素符号或化学式前有系数,表示只有微观意义
氢元素
1个氢原子
H
(1)元素化合价有正价、负价。
金属元素与非金属元素化合时,金属元素显正价,非金属元素显负价。
在化合物里,氧元素通常显-2价,氢元素通常显+1价;
+1
-1
+1
-2
HCl H2O
NaCl MgCl2
+1
-1
+2
-1
(2)化合物中,正、负化合价的代数和为0。
如MgCl2中各元素化合价为:(+1)x2+(-2)= 0
化合价的一般规律
(3)一些元素在不同物质中可显不同的化合价。
+2
-2
+4
-2
+2
-2
-2
+3
CO
FeO Fe2O3
CO2
(4)在单质中,元素的化合价为0。
Fe O2
0
0
化合价的一般规律
H2O的相对分子质量 = 1×2+16×1=18
[回顾] H2O的意义
[分析]真实质量
[类比]相对分子质量
化学式中各原子的相对原子质量的总和,就是相对分子质量(符号为Mr)。
计算相对分子质量
1个水分子是由2个氢原子和1个氧原子构成的。
1个水分子的质量=2个氢原子的质量+1个氧原子的质量。
1个水分子的相对分子质量=2个氢原子的相对原子质量+1个氧原子的相对原子质量。
根据化学式计算相对分子质量时注意:
1.正确书写化学式含义;
2.准确理解化学式中数字的含义;
3.“元素之间”用“+”号,“元素与对应右下角数字之间”用“×”号;
4.单位是1,不是“g”。
计算相对分子质量
【计算】二氧化碳(CO2)中碳元素(C)和氧元素(O)的质量比。
(C-12 O-16)
各元素之间的质量比=各原子的相对原子质量总和之比
计算物质组成元素的质量比
m(C) : m(O) = 12×1 : ( 16×2 ) = 12 : 32 = 3 : 8
如:C6H12O6中各元素的质量比:
m(C): m(H) : m(O) = 6 : 12 : 6 = 1 : 2 : 1
m(C) :m(H) : m(O) = ( 6×12 ) : ( 12×1 ) : ( 6×16 ) = 6 : 1 : 8
1.元素质量比 ≠ 原子个数比;
2.注意合并相同元素的原子个数,不要漏掉。
Ca(OH)2 NH4NO3
注意:①看清各元素质量比的顺序;
②结果约简成最简整数比;
③区分元素质量比与原子个数比。
计算物质组成元素的质量比
(H-1 C-12 N-14 O-16)
计算:Ca(OH)2、H2O2 、NH4NO3 中各元素的质量比。
Ca(OH)2中钙、氧、氢元素的质量比
H2O2中氢、氧元素的质量比
NH4NO3中氮、氢、氧元素的质量比
计算物质组成元素的质量比
= 40: ( 16×2 ) : ( 1×2 )
= 20 : 16 : 1
= ( 14×2 ) : ( 1×4 ) : ( 16×3 )
= 7 : 1 : 12
= ( 1×2 ) : ( 16×2 ) = 1 : 16
某元素的质量分数,就是该元素的质量与组成物质的元素总质量之比,可根据化学式计算。
某元素的质量分数=
该元素的相对原子质量×原子个数
该化合物的相对分子质量
×100%
计算物质中某元素的质量分数
通过计算判断图中氮元素的含量是否能符合实际?
解:(NH4)2SO4的相对分子质量
=(14+1×4)× 2+ 32 + 16 × 4 = 132
氮元素的质量分数
= × 100% = 21.2%
∵ 21.2% > 20.5%
∴ 符合实际
答:图中氮元素的含量能符合实际。
计算物质中某元素的质量分数
(14×2)
132
练习一 计算NH4NO3中氮元素的质量分数。
步骤1: NH4NO3的相对分子质量
步骤2: NH4NO3中氮元素的质量分数
计算物质中某元素的质量分数
= 14 x 2 + 1 × 4 + 16 × 3 = 80
(H-1 N-14 O-16)
=
N 元素的相对原子质量 × N 原子个数
NH4NO3 的相对分子质量
×100%
14×2
80
=
=
35%
×100%
练习一 计算NH4NO3中氮元素的质量分数。
步骤1: NH4NO3的相对分子质量
步骤2: NH4NO3中氮元素的质量分数
计算物质中某元素的质量分数
= 14 x 2 + 1 × 4 + 16 × 3 = 80
(H-1 N-14 O-16)
=
N 元素的相对原子质量 × N 原子个数
NH4NO3 的相对分子质量
×100%
14×2
80
=
=
35%
×100%
易错1 误以为物质都是由分子构成的。
物质不都是由分子构成的。分子只是构成物质的一种微观粒子,除分子外,构成物质的微观粒子还有原子和离子等。
易错归纳|错题加练
下列说法中,正确的是( )
A.同种原子中,质子数等于中子数
B.在化学变化中,原子的核外电子数可能发生变化C.NaCl由氯化钠分子构成
D.不同元素的本质区别是相对原子质量不同
B
易错2 易将机械运动和分子热运动混淆。
分子永不停息地做无规则运动与外力作用下的机械运动是不同的。机械运动是宏观物体的运动,用肉眼可以直接看到(如灰尘飞舞、柳絮漫天飞等),而分子运动不能用肉眼直接看到。
化学教会我们从微观角度去认识宏观现象。下列对生活中现象的解释不合理的是( )
A.春天公园里柳絮纷飞,因为分子在不停地运动
B.氮气不如氧气活泼,说明不同分子化学性质不同
C.水烧开后易把壶盖顶起,因为温度升高,分子间间隔增大
D.一滴水大约有1.6×1021个水分子,说明分子的体积很小
A
易错归纳|错题加练
易错3 误认为所有的原子核内都有中子。
大多数原子的原子核是由质子和中子构成的,也有部分原子的原子核内无中子,如普通氢原子的原子核内无中子。
下列有关分子、原子、离子的说法中,正确的是( )
A.分子、原子和离子都可以直接构成物质
B.原子都是由质子、中子、核外电子构成的
C.带正电荷的微粒一定是阳离子
D.分子由原子构成,分子比原子大
A
易错归纳|错题加练
易错4 原子中各粒子之间的关系混淆不清。
在原子中,质子数 = 核电荷数 = 核外电子数,相对原子质量≈质子数 + 中子数,质子数不一定等于中子数。
我国南海海底蕴藏着丰富的锰结核——含有锰、铁、铜等金属的矿物。已知锰原子的核内质子数为25,相对原子质量为55,则锰原子的核外电子数为( )
A.55 B.30 C.25 D.80
C
易错归纳|错题加练
易错5 误认为原子是化学变化中的最小粒子,所以不能再分
原子是化学变化中最小的粒子,在化学变化中不能再分,但不能在没有限定条件下说不能再分。
下列有关分子、原子说法错误的是( )
A.分子可以再分,原子不能再分
B.氧气由氧分子构成
C.同种分子构成纯净物,不同种分子构成混合物
D.原子可构成物质
A
易错归纳|错题加练
易错6 误认为认为分子是由原子构成的,所以分子一定比原子大,分子重,原子轻
分子与构成这种分子的原子相比,分子大原子小。但不是所有的分子都比原子大,如汞原子就比氢分子大得多。
有关分子、原子的说法正确的是( )
A.分子是保持物质性质的最小微粒
B.原子是化学变化中的最小微粒
C.化学变化中分子、原子均可分
D.分子质量一定大于原子质量
B
易错归纳|错题加练
易错6 误认为由同种元素组成的物质一定是单质
只含有一种元素的物质,可能是单质,也可能是混合物
推理是化学学习的一种方法,以下推理正确的是( )
A.单质中只含有一种元素,因此只含有一种元素的纯净物一定是单质
B.分子、原子可以构成物质,所以物质一定是由分子、原子构成的
C.Na+、Cl-的最外层电子数均为8,则最外层电子数为8的粒子都是离子
D.原子核是由质子和中子构成的,故所有的原子都有质子和中子
A
易错归纳|错题加练
模型1 相对分子质量的计算
在化合物Am Bn 中,它的相对分子质量 = A 的相对原子质量 ×m + B 的相对原子质量 ×n
模型2 元素质量比的计算
在化合物Am Bn 中,A、B 两元素的质量比为(A 的相对原子质量 ×m):(B 的相对原子质量 ×n)
模型3 计算单一物质中某元素的质量分数
在化合物Am Bn 中,A 元素的质量分数 =(A 的相对原子质量 ×m)/(A 的相对原子质量 ×m + B 的相对原子质量 ×n)×100%。
模型4 确定物质的化学式
技能演练
在M、N两种元素组成的化合物中,M和N的质量比是3:1,又知M和N的相对原子质量之比是12:1,则下列式子中能够表示此化合物化学式的是( )
A.MN4 B.MN3 C.MND.M2N
A
模型5 混合物中元素质量分数的计算
方法1
极端假设
将混合物的组成假设为多种极端情况,并针对各种极端情况进行计算分析,从而得出正确的判断。
一定量的木炭在盛有氮气和氧气混合气体的密闭容器中充分燃烧后生成CO和CO2,且测得反应后所得CO、CO2、N2的混合气体中碳元素的质量分数为24%,则其中氮气的质量分数可能为( )
A.10% B.30% C.50% D.70%
B
技能演练
模型5 混合物中元素质量分数的计算
方法2
中值假设
中值假设就是把混合物中某纯净物的量值假设为中间值,以中间值为参照,进行分析、推理,从而巧妙解题。
仅含氧化铁(Fe2O3)和氧化亚铁(FeO)的混合物中,铁元素的质量分数为73.1%,则混合物中氧化铁的质量分数为( )
A.30% B.40% C.50% D.60%
D
技能演练
模型5 混合物中元素质量分数的计算
方法3
等效假设
等效假设就是在不改变纯净物相对分子质量的前提下,通过变换化学式,把复杂混合物的组成假设为若干个简单、理想的组成,使复杂问题简单化,从而迅速解题。
已知在NaHS、NaHSO3和MgSO4组成的混合物中硫元素的质量分数为a%,则混合物中氧元素的质量分数为____________。
1-1.75a%
技能演练
模型5 混合物中元素质量分数的计算
方法4
赋值假设
赋值假设就是在有关化学式的无数据计算、以比值形式作已知条件或求比值的问题中,赋予某些特定对象具体的量值,化抽象为具体,以使问题顺利解决。
青少年应“珍爱生命,远离毒品”。海洛因是一种常用的毒品,其元素的质量分数分别为:C:68.29%H:6.23%O:21.68%,其余为氮。若已知其相对分子质量不超过400,则一个海洛因分子中氮原子个数为( )
A.4 B.3 C.2 D.1
D
技能演练
模型5 混合物中元素质量分数的计算
方法5
巧用定比
利用混合物中元素的比例一定,可轻松解出剩余元素的质量分数
FeSO4和Fe2(SO4)3的混合物,其中Fe的质量分数是31%,则混合物中氧元素的质量分数是 .
46%
技能演练
模型5 混合物中元素质量分数的计算
方法6
化合价法
化合价法就是根据化合价和为零列出方程求解。
Na2S、NaBr的混合物中,钠的质量分数为37%,求Br的质量分数 .
46.6%
技能演练
模型5 混合物中元素质量分数的计算
方法7
单独分析
单独分析就是单独分析混合物中每种化合物中所求元素的质量分数,对比总的质量分数(一般会凑好,其中一个化合物的质量分数等于总的质量分数),简化计算,得出结论。
同课章节目录
