高考化学一轮复习第八章水溶液中的离子平衡第27讲水的电离和溶液的pH课件(共58张PPT)
文档属性
| 名称 | 高考化学一轮复习第八章水溶液中的离子平衡第27讲水的电离和溶液的pH课件(共58张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 8.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-22 18:49:11 | ||
图片预览









文档简介
(共58张PPT)
第八章 水溶液中的离子平衡
第27讲 水的电离和溶液的pH
复习要点 1.了解水的电离、离子积常数(Kw)。2.了解溶液pH的含义及其测定方法,能进行pH的简单计算。
第*页
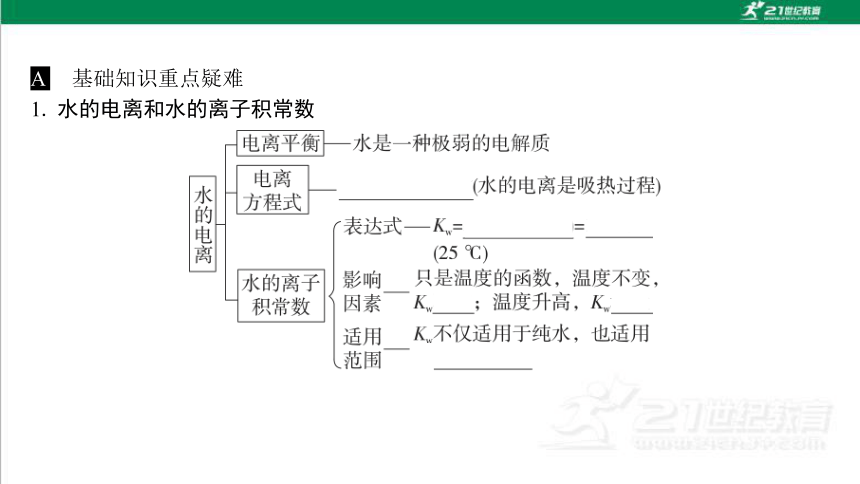
考点1 水的电离和水的离子积常数
1. 水的电离和水的离子积常数
A 基础知识重点疑难
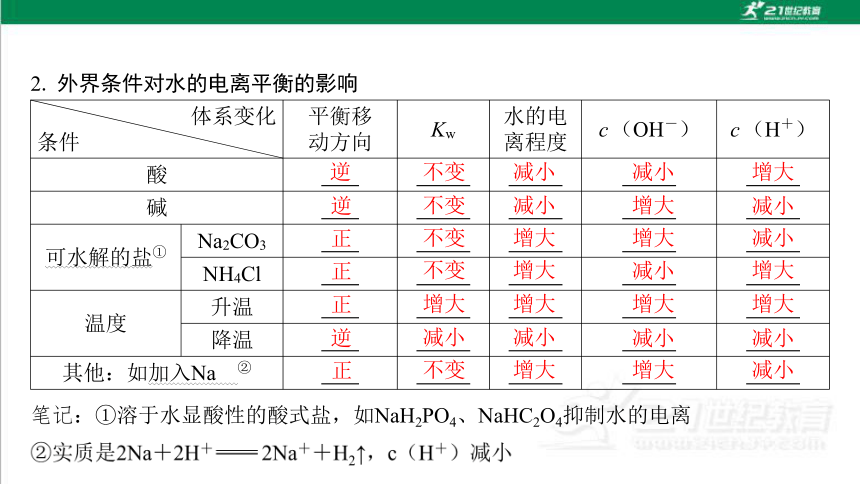
2. 外界条件对水的电离平衡的影响
体系变化
条件 平衡移
动方向 Kw 水的电
离程度 c(OH-) c(H+)
酸 逆 不 变 减小 减小 增大
碱 逆 不 变 减小 增大 减小
可水解的盐① Na2CO3 正 不 变 增大 增大 减小
NH4Cl 正 不 变 增大 减小 增大
温度 升温 正 增 大 增大 增大 增大
降温 逆 减 小 减小 减小 减小
其他:如加入Na ② 正 不 变 增大 增大 减小
逆
不变
减小
减小
增大
逆
不变
减小
增大
减小
正
不变
增大
增大
减小
正
不变
增大
减小
增大
正
增大
增大
增大
增大
逆
减小
减小
减小
减小
正
不变
增大
增大
减小
笔记:①溶于水显酸性的酸式盐,如NaH2PO4、NaHC2O4抑制水的电离
B 题组集训提升能力
题组一 与水电离相关的图像
A. T1<T2
B. 一定温度下,改变水溶液中c(H+)或c(OH-),Kw不会发生变化
C. T2时,c(H+)为1×10-2 mol·L-1的HCl溶液中,水电离出的c水(H+)=1×10-10 mol·L-1
D. 将T1温度下0.1 mol·L-1的盐酸稀释,溶液中所有离子的浓度均相应减小
D
解题感悟
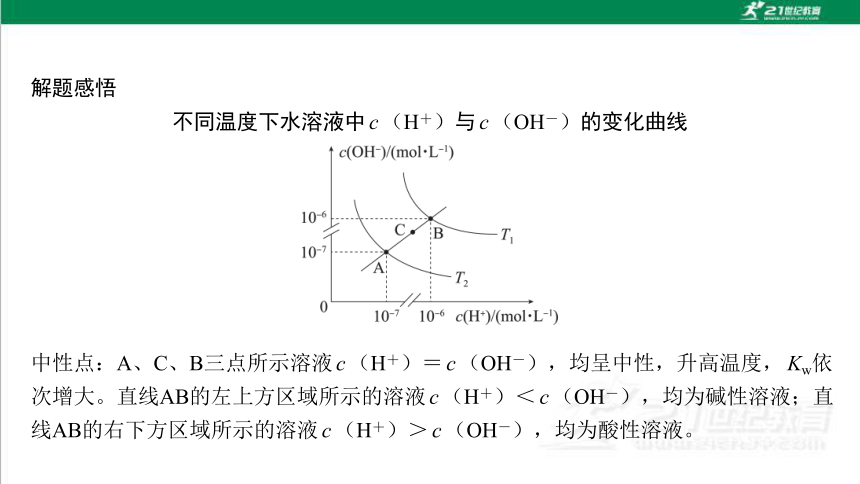
不同温度下水溶液中c(H+)与c(OH-)的变化曲线
中性点:A、C、B三点所示溶液c(H+)=c(OH-),均呈中性,升高温度,Kw依次增大。直线AB的左上方区域所示的溶液c(H+)<c(OH-),均为碱性溶液;直线AB的右下方区域所示的溶液c(H+)>c(OH-),均为酸性溶液。
A. 滴定终点时宜选择甲基橙作指示剂
B. 在a、b、d、f 4点中水的电离程度最大的点是f点
C. e点溶液中:c(HSCH2COO-)=c(Na+)>c(H+)=c(OH-)
D
解题感悟
滴定过程中c水(H+)或c水(OH-)的变化曲线
以25 ℃时,盐酸滴定20 mL 0.1 mol·L-1氨水过程中由水电离出的氢离子浓度[c水(H+)]随加入盐酸体积的变化关系图为例进行分析:
(1)a点为起点:溶质为NH3·H2O,溶液呈碱性,pH>7,抑制水的电离。
(2)b点为中性点:溶质为NH4Cl和NH3·H2O,NH3·H2O抑制水电离的程度与NH4Cl水解促进水电离的程度相等,此时溶液pH=7。
(3)c点为恰好完全反应点:酸与碱恰好完全中和,溶质为NH4Cl,
促进水的电离。
(4)d点为过量点:溶质是NH4Cl和HCl,NH4Cl水解促进水电离
的程度与HCl抑制水电离的程度相等,c水(H+)=10-7 mol·L-1,
但此时溶液的pH<7。
解题感悟
(5)根据初始溶液的c水(H+),还可计算NH3·H2O的电离平衡常数:
A. 该溶液可能呈中性
C. 该溶液的pH一定为4
D. 该溶液中水的电离受到抑制
D
4. 室温下,计算下列溶液中水电离出的c水(H+)。
1×10-12 mol·L-1
1×10-10 mol·L-1
1×10-10 mol·L-1
1×10-4 mol·L-1
1×10-4 mol·L-1
解题感悟
水电离出的c(H+)或c(OH-)的计算(25 ℃)
(1)溶质为酸的溶液
c(OH-)溶液=c(OH-)水=c(H+)水
c(H+)溶液=c(H+)酸+c(H+)水
(3)盐溶液
①水解呈酸性的盐溶液
c(H+)溶液=c(H+)水=c(OH-)水
c(OH-)溶液<c(OH-)水
②水解呈碱性的盐溶液
c(OH-)溶液=c(OH-)水=c(H+)水
c(H+)溶液<c(H+)水
③中性盐溶液
c(H+)溶液=c(H+)水=c(OH-)水=c(OH-)溶液
第*页
考点2 溶液的酸碱性与pH
A 基础知识重点疑难
1. 溶液的酸碱性(25 ℃时)
溶液的酸
碱性 c(H+)与c(OH-)比较 c(H+)大小 pH
酸性溶液 c(H+) > c(OH-) c(H+)>1×10-7 mol·L-1 < 7
中性溶液 c(H+) = c(OH-) c(H+)=1×10-7 mol·L-1 = 7
碱性溶液 c(H+) < c(OH-) c(H+)<1×10-7 mol·L-1 > 7
笔记:(2022福建)测定溶液pH应在相同温度下测定(√)
>
<
=
=
<
>
洁净干燥的玻璃棒
3. 溶液pH的计算
(1)总体原则
①若溶液为酸性,先求c(H+),再求pH=-lg c(H+)。
②若溶液为碱性,先求c(OH-),再求c(H+)=Kw /c(OH-),最后求pH。
笔记:关注温度,温度不同,Kw不同
(2)单一溶液的pH计算
①强酸溶液:如HnA,设浓度为c mol·L-1,c(H+)=nc mol·L-1,pH=-lg c(H+)=-lg (nc)。
(3)混合溶液pH的计算类型
①两种强酸混合:直接求出c混(H+),再据此求pH。c混(H+)①= 。
③强酸、强碱混合:先判断哪种物质过量,再由下式求出溶液中H+或OH-的浓度,最后求pH。
笔记:①实质是列n(H+)守恒
②近似计算V混=V1+V2
4. 酸、碱溶液混合后酸碱性的判断规律
(1)等浓度等体积的一元酸与一元碱混合的溶液——“谁强显谁性,同强显中性”。
笔记:二者恰好反应,生成的盐水解
(2)室温下c酸(H+)=c碱(OH-),即pH之和等于14时,一强一弱等体积混合——“谁弱谁过量,谁弱显谁性”。
(3)已知强酸和强碱的pH,等体积混合(25 ℃时):①pH之和等于14,呈中性;②pH之和小于14,呈酸性;③pH之和大于14,呈碱性。
5. 强酸(碱)与弱酸(碱)的比较
(1)相同物质的量浓度、相同体积的一元强酸与一元弱酸①的比较
比较项目
酸 c(H+) pH 中和碱
的能力② 与足量Zn反应产生H2的量③ 开始与金属
反应的速率④
一元强酸 大 小 相同 相同 大
一元弱酸 小 大 小
③取决于n(酸)
④取决于c(H+)
(2)相同pH、相同体积的一元强酸与一元弱酸的比较
比较项目
酸 c(H+) c(酸) 中和碱
的能力 与足量Zn反应产生H2的量 开始与金属
反应的速率
一元强酸 相同 小 小 少 相同
一元弱酸 大 大 多
笔记:由于弱酸电离产生H+,过程中与金属反应的速率弱酸大于强酸
(3)图像法理解一强一弱的稀释规律
①相同体积、相同浓度的盐酸、醋酸①
②
加水稀释相同的倍数,醋酸的pH大
加水稀释到相同的pH,盐酸加入的水多
②相同体积、相同pH的盐酸、醋酸
加水稀释相同的倍数,盐酸的pH大③
加水稀释到相同的pH,醋酸加入的水多
笔记:①(2022浙江1月)H2A为二元弱酸,取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1(×)
②酸稀释pH接近7,不能等于7或大于7
③定量规律:强酸每稀释10倍,pH增加1,但pH<7;弱酸每稀释10倍,pH变化小于1,且pH<7
A
2. 判断常温下,两种溶液混合后的酸碱性(在括号中填“酸性”“碱性”或“中性”)。
中性
碱性
酸性
中性
酸性
碱性
酸性
碱性
解题感悟
常见的溶液酸碱性判断的三大误区
(1)含有H+的溶液一定显酸性,含有OH-的溶液一定显碱性(×);任何水溶液中均含有H+、OH-,而溶液的酸碱性由c(H+)与c(OH-)的相对大小决定(√)。
(2)pH<7的溶液一定显酸性,pH>7的溶液一定显碱性(×);利用pH与7的相对大小来判断溶液的酸碱性时,注意须在温度为25 ℃的条件下(√)。
(3)使酚酞显无色的溶液呈酸性,使甲基橙显黄色的溶液呈碱性(×);指示剂的显色均有特定的pH范围,常温下,pH<8.2的溶液中滴入酚酞均显无色,pH>4.4的溶液中滴入甲基橙均显黄色(√)。
2
11
5
9.7
2
解析:(1)c(H2SO4)=0.005 mol·L-1,c(H+)=2×c(H2SO4)=0.01 mol·L-1,pH=2。
(3)pH=2的盐酸加水稀释到1 000倍,所得溶液的pH=5。
A. 醋酸溶液的物质的量浓度小于盐酸
B. 将醋酸溶液稀释至原体积的10倍,所得溶液pH<4
C. c(Cl-)=c(CH3COOH)+c(CH3COO-)
D. 相同体积的两种酸,分别与足量镁条反应,盐酸产生的气体多
B
A. 曲线Ⅱ为氢氟酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗氢氟酸的体积较小
C. b点溶液中水的电离程度比c点溶液中水的电离程度小
D
题组四 图像法理解强弱稀释规律
解题感悟
酸、碱溶液加水稀释到体积为原来的10n倍时pH的变化
溶液 稀释前溶液pH 稀释后溶液pH
酸 强酸 pH=a pH=a+n
弱酸 a<pH<a+n
碱 强碱 pH=b pH=b-n
弱碱 b-n<pH<b
注:常温下,任何酸或碱溶液无限稀释时,溶液的pH都不可能大于7或小于7,只能接近7,表中a+n<7,b-n>7。
B
A. HX、HY都是弱酸,且HX的酸性比HY的弱
B. 常温下,由水电离出的c(H+)·c(OH-):a<b
C. 相同温度下,电离常数Ka(HX):a>b
第*页
限时跟踪检测
A. 加入电解质一定会破坏水的电离平衡,加入酸和碱通常都会抑制水的电离
B. 水的电离和电解都需要电
C. 氢氧化钠溶液显碱性,故水电离出的c水(H+)≠c水(OH-)
D. 升高温度一定使水的离子积增大
解析:加入电解质不一定会破坏水的电离平衡,加入强酸强碱盐对水的电离没有影响,选项A错误;水的电离不需要通电,选项B错误;氢氧化钠溶液中c(H+)≠c(OH-),但水电离出的c水(H+)=c水(OH-),选项C错误;水电离是吸热过程,升高温度一定使水的离子积增大,选项D正确。
D
1
2
3
4
5
6
7
8
9
10
11
A. 该溶液的溶质可能是NaHSO4
B. 向该溶液中加入铝粉,可能产生H2
C. 下列离子在该溶液中一定能大量共存:Cl-、K+、Cu2+
D. 向该溶液中加入NaHCO3,一定有化学反应发生
C
1
2
3
4
5
6
7
8
9
10
11
A. 各点的温度高低顺序:Z>Y>X
B. M区域内任意点都是碱溶于水所得的溶液
C. 常温下,向纯水中加入少量金属Na,可使X点溶液变为Y点溶液
D. XZ线上的任意点一定表示的是纯水
C
1
2
3
4
5
6
7
8
9
10
11
解析:温度升高促进水的电离,其电离常数只受温度的影响,由题图可知,两条曲线是反比例曲线,曲线上的横纵坐标c(H+)·c(OH-)为定值,X和Y点的温度相同,各点的温度高低顺序:Z>Y=X,A错误;由题图得M区域内c(H+)<c(OH-),溶液呈碱性,但不一定是碱溶液,也可能是Na2CO3等溶于水所得的碱性溶液,B错误;常温下,向纯水中加入少量金属Na,消耗水电离出的H+,促进了水的电离,使水中的c(OH-)>c(H+),可使X点溶液变为Y点,C正确;pH=-lg c(H+),XZ线上任意点的c(H+)=c(OH-),且从X到Z,H+和OH-浓度在同等程度增大,所以此时肯定是中性溶液,但不一定是纯水,也可能是NaCl等盐溶于水所得的中性溶液,D错误。
1
2
3
4
5
6
7
8
9
10
11
A. pH相同的NaOH溶液与Ba(OH)2溶液以任意体积比混合,pH不变
B. 浓度均为0.1 mol·L-1的NaOH溶液与Ba(OH)2溶液等体积混合,pH不变
C. 常温下,pH=2的溶液与pH=12的溶液等体积混合后,混合溶液的pH不一定等于7
D. 常温下,0.05 mol·L-1的硫酸与0.05 mol·L-1的氢氧化钠溶液等体积混合后,溶液pH<7
B
解析:两种溶液都是强碱,两溶液的pH相同,混合后c(OH-)不变,pH不会变化,A正确;NaOH是一元强碱,Ba(OH)2是二元强碱,混合后c(OH-)变化,pH变化,B错误;混合溶液的酸碱性取决于酸碱的强弱,pH=2的溶液与pH=12的溶液等体积混合后,若是强酸、强碱,则pH=7,若强酸、弱碱,则弱碱过量,pH>7,若是弱酸、强碱,则弱酸过量,pH<7,C正确;硫酸为二元酸,氢氧化钠为一元碱,两溶液浓度相同,等体积混合后硫酸过量,溶液pH<7,D正确。
1
2
3
4
5
6
7
8
9
10
11
A. 若a=b且c(X-)>c(Y-),则酸性:HX>HY
B. 若a>b且c(X-)=c(Y-),则酸性:HX>HY
C. 若a<b且两者pH相同,则HY一定是弱酸
D. 若向HX溶液中加入等浓度、等体积的NaOH溶液,所得溶液pH>7,则HX为弱酸
B
解析:若a=b且c(X-)>c(Y-),说明电离程度:HX>HY,则酸性:HX>HY,A正确;若a>b且c(X-)=c(Y-),说明电离程度:HX<HY,则酸性:HX<HY,B错误;若a<b且两者pH相同,说明电离出的氢离子浓度相等,则HY一定是弱酸,C正确;若向HX溶液中加入等浓度、等体积的NaOH溶液,所得溶液pH>7,说明X-水解,则HX为弱酸,D正确。
1
2
3
4
5
6
7
8
9
10
11
图1 图2
D
A. 图1表示相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图1中,中和等体积的两种酸,消耗等浓度的NaOH溶液体积V(Ⅰ)>V(Ⅱ)
C. 图2中纯水仅升高温度,就可以从a点变到c点
D. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
1
2
3
4
5
6
7
8
9
10
11
解析:在题图1中,盐酸与醋酸的pH相同,加水稀释相同的倍数后,盐酸溶液的pH变化大,所以Ⅰ为盐酸,Ⅱ为醋酸,且b点溶液的导电性比a点弱,A错误;因为盐酸和醋酸的pH相同,所以醋酸溶液的浓度大,中和等体积的两种酸,消耗等浓度的NaOH溶液体积:V(Ⅰ)<V(Ⅱ),B错误;题图2中纯水仅升高温度,c(H+)、c(OH-)同等程度增大且相等,不可能从a点变到c点,C错误;题图2中在b点对应温度下,Kw=10-12,pH=2的H2SO4中c(H+)=10-2 mol·L-1,pH=10的NaOH溶液中c(OH-)=10-2 mol·L-1,二者等体积混合后,刚好完全反应,溶液显中性,D正确。
1
2
3
4
5
6
7
8
9
10
11
A. 盐酸与NaOH溶液的浓度相等
B. B点和D点水的电离程度相同
C. 将滴加NaOH溶液改为滴加氨水,该图曲线不变
D. 升高温度,滴定过程中pOH+pH>14
B
1
2
3
4
5
6
7
8
9
10
11
解析:由题图可知,未滴加NaOH溶液时盐酸的pH=0,则c(H+)=1 mol·L-1,即c(HCl)=1 mol·L-1,最终溶液的pH=14,则c(OH-)=1 mol·L-1,由于最终所得溶液是NaCl和NaOH的混合溶液,相当于对原NaOH溶液进行稀释,故原NaOH溶液的c(NaOH)>1 mol·L-1,A项错误;B点、D点水的电离均受到抑制,且由水电离出的c(H+)=c(OH-)=10-10 mol·L-1,B项正确;若将滴加NaOH溶液改为滴加氨水,由于NH3·H2O为弱碱,而饱和氨水的pH约为12,故最终所得溶液pH不可能为14,C项错误;升高温度,水的离子积Kw增大,即c(H+)·c(OH-)>10-14,pH=-lg c(H+),pOH=-lg c(OH-),故pOH+pH<14,D项错误。
1
2
3
4
5
6
7
8
9
10
11
A. 常温下,Ka(HA)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 溶液的导电性逐渐增强
B
解析:由起点溶液中-lg c水(H+)=12可知,酸电离产生的c(H+)=10-2 mol·L-1,故Ka(HA)=10-4,故A正确;从题图中可知,HA是弱酸,曲线的最高点溶液的溶质为NaA,b点溶液的溶质是NaA和NaOH,溶液呈碱性,pH>7,故B错误;a点到b点,发生酸碱中和反应生成可水解的盐,然后碱过量,所以水的电离程度先增大后减小,故C正确;不断加入NaOH溶液,溶液中的离子总浓度不断增大,溶液的导电性逐渐增强,故D正确。
1
2
3
4
5
6
7
8
9
10
11
甲 乙
B
A. c0、V0均不能确定其数值大小
B. 电离常数Kb(MOH)≈1.1×10-3
C. x点处两种溶液中水的电离程度不相等
1
2
3
4
5
6
7
8
9
10
11
A. 10 ℃升温到25 ℃时,断键吸热和分子间氢键断裂吸热导致醋酸电离程度增加
B. 30 ℃后升温,形成水合离子的过程放热导致醋酸的电离程度减小
C. 23 ℃时,保持温度不变向1 mol·L-1醋酸溶液中加入少量pH=2.65的盐酸,pH不变
D. 33 ℃时,醋酸电离平衡常数的数量级为10-5
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
11. 某温度下的水溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1。x与y的关系如图所示:
10-12
高于
10
8
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
第八章 水溶液中的离子平衡
第27讲 水的电离和溶液的pH
复习要点 1.了解水的电离、离子积常数(Kw)。2.了解溶液pH的含义及其测定方法,能进行pH的简单计算。
第*页
考点1 水的电离和水的离子积常数
1. 水的电离和水的离子积常数
A 基础知识重点疑难
2. 外界条件对水的电离平衡的影响
体系变化
条件 平衡移
动方向 Kw 水的电
离程度 c(OH-) c(H+)
酸 逆 不 变 减小 减小 增大
碱 逆 不 变 减小 增大 减小
可水解的盐① Na2CO3 正 不 变 增大 增大 减小
NH4Cl 正 不 变 增大 减小 增大
温度 升温 正 增 大 增大 增大 增大
降温 逆 减 小 减小 减小 减小
其他:如加入Na ② 正 不 变 增大 增大 减小
逆
不变
减小
减小
增大
逆
不变
减小
增大
减小
正
不变
增大
增大
减小
正
不变
增大
减小
增大
正
增大
增大
增大
增大
逆
减小
减小
减小
减小
正
不变
增大
增大
减小
笔记:①溶于水显酸性的酸式盐,如NaH2PO4、NaHC2O4抑制水的电离
B 题组集训提升能力
题组一 与水电离相关的图像
A. T1<T2
B. 一定温度下,改变水溶液中c(H+)或c(OH-),Kw不会发生变化
C. T2时,c(H+)为1×10-2 mol·L-1的HCl溶液中,水电离出的c水(H+)=1×10-10 mol·L-1
D. 将T1温度下0.1 mol·L-1的盐酸稀释,溶液中所有离子的浓度均相应减小
D
解题感悟
不同温度下水溶液中c(H+)与c(OH-)的变化曲线
中性点:A、C、B三点所示溶液c(H+)=c(OH-),均呈中性,升高温度,Kw依次增大。直线AB的左上方区域所示的溶液c(H+)<c(OH-),均为碱性溶液;直线AB的右下方区域所示的溶液c(H+)>c(OH-),均为酸性溶液。
A. 滴定终点时宜选择甲基橙作指示剂
B. 在a、b、d、f 4点中水的电离程度最大的点是f点
C. e点溶液中:c(HSCH2COO-)=c(Na+)>c(H+)=c(OH-)
D
解题感悟
滴定过程中c水(H+)或c水(OH-)的变化曲线
以25 ℃时,盐酸滴定20 mL 0.1 mol·L-1氨水过程中由水电离出的氢离子浓度[c水(H+)]随加入盐酸体积的变化关系图为例进行分析:
(1)a点为起点:溶质为NH3·H2O,溶液呈碱性,pH>7,抑制水的电离。
(2)b点为中性点:溶质为NH4Cl和NH3·H2O,NH3·H2O抑制水电离的程度与NH4Cl水解促进水电离的程度相等,此时溶液pH=7。
(3)c点为恰好完全反应点:酸与碱恰好完全中和,溶质为NH4Cl,
促进水的电离。
(4)d点为过量点:溶质是NH4Cl和HCl,NH4Cl水解促进水电离
的程度与HCl抑制水电离的程度相等,c水(H+)=10-7 mol·L-1,
但此时溶液的pH<7。
解题感悟
(5)根据初始溶液的c水(H+),还可计算NH3·H2O的电离平衡常数:
A. 该溶液可能呈中性
C. 该溶液的pH一定为4
D. 该溶液中水的电离受到抑制
D
4. 室温下,计算下列溶液中水电离出的c水(H+)。
1×10-12 mol·L-1
1×10-10 mol·L-1
1×10-10 mol·L-1
1×10-4 mol·L-1
1×10-4 mol·L-1
解题感悟
水电离出的c(H+)或c(OH-)的计算(25 ℃)
(1)溶质为酸的溶液
c(OH-)溶液=c(OH-)水=c(H+)水
c(H+)溶液=c(H+)酸+c(H+)水
(3)盐溶液
①水解呈酸性的盐溶液
c(H+)溶液=c(H+)水=c(OH-)水
c(OH-)溶液<c(OH-)水
②水解呈碱性的盐溶液
c(OH-)溶液=c(OH-)水=c(H+)水
c(H+)溶液<c(H+)水
③中性盐溶液
c(H+)溶液=c(H+)水=c(OH-)水=c(OH-)溶液
第*页
考点2 溶液的酸碱性与pH
A 基础知识重点疑难
1. 溶液的酸碱性(25 ℃时)
溶液的酸
碱性 c(H+)与c(OH-)比较 c(H+)大小 pH
酸性溶液 c(H+) > c(OH-) c(H+)>1×10-7 mol·L-1 < 7
中性溶液 c(H+) = c(OH-) c(H+)=1×10-7 mol·L-1 = 7
碱性溶液 c(H+) < c(OH-) c(H+)<1×10-7 mol·L-1 > 7
笔记:(2022福建)测定溶液pH应在相同温度下测定(√)
>
<
=
=
<
>
洁净干燥的玻璃棒
3. 溶液pH的计算
(1)总体原则
①若溶液为酸性,先求c(H+),再求pH=-lg c(H+)。
②若溶液为碱性,先求c(OH-),再求c(H+)=Kw /c(OH-),最后求pH。
笔记:关注温度,温度不同,Kw不同
(2)单一溶液的pH计算
①强酸溶液:如HnA,设浓度为c mol·L-1,c(H+)=nc mol·L-1,pH=-lg c(H+)=-lg (nc)。
(3)混合溶液pH的计算类型
①两种强酸混合:直接求出c混(H+),再据此求pH。c混(H+)①= 。
③强酸、强碱混合:先判断哪种物质过量,再由下式求出溶液中H+或OH-的浓度,最后求pH。
笔记:①实质是列n(H+)守恒
②近似计算V混=V1+V2
4. 酸、碱溶液混合后酸碱性的判断规律
(1)等浓度等体积的一元酸与一元碱混合的溶液——“谁强显谁性,同强显中性”。
笔记:二者恰好反应,生成的盐水解
(2)室温下c酸(H+)=c碱(OH-),即pH之和等于14时,一强一弱等体积混合——“谁弱谁过量,谁弱显谁性”。
(3)已知强酸和强碱的pH,等体积混合(25 ℃时):①pH之和等于14,呈中性;②pH之和小于14,呈酸性;③pH之和大于14,呈碱性。
5. 强酸(碱)与弱酸(碱)的比较
(1)相同物质的量浓度、相同体积的一元强酸与一元弱酸①的比较
比较项目
酸 c(H+) pH 中和碱
的能力② 与足量Zn反应产生H2的量③ 开始与金属
反应的速率④
一元强酸 大 小 相同 相同 大
一元弱酸 小 大 小
③取决于n(酸)
④取决于c(H+)
(2)相同pH、相同体积的一元强酸与一元弱酸的比较
比较项目
酸 c(H+) c(酸) 中和碱
的能力 与足量Zn反应产生H2的量 开始与金属
反应的速率
一元强酸 相同 小 小 少 相同
一元弱酸 大 大 多
笔记:由于弱酸电离产生H+,过程中与金属反应的速率弱酸大于强酸
(3)图像法理解一强一弱的稀释规律
①相同体积、相同浓度的盐酸、醋酸①
②
加水稀释相同的倍数,醋酸的pH大
加水稀释到相同的pH,盐酸加入的水多
②相同体积、相同pH的盐酸、醋酸
加水稀释相同的倍数,盐酸的pH大③
加水稀释到相同的pH,醋酸加入的水多
笔记:①(2022浙江1月)H2A为二元弱酸,取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1(×)
②酸稀释pH接近7,不能等于7或大于7
③定量规律:强酸每稀释10倍,pH增加1,但pH<7;弱酸每稀释10倍,pH变化小于1,且pH<7
A
2. 判断常温下,两种溶液混合后的酸碱性(在括号中填“酸性”“碱性”或“中性”)。
中性
碱性
酸性
中性
酸性
碱性
酸性
碱性
解题感悟
常见的溶液酸碱性判断的三大误区
(1)含有H+的溶液一定显酸性,含有OH-的溶液一定显碱性(×);任何水溶液中均含有H+、OH-,而溶液的酸碱性由c(H+)与c(OH-)的相对大小决定(√)。
(2)pH<7的溶液一定显酸性,pH>7的溶液一定显碱性(×);利用pH与7的相对大小来判断溶液的酸碱性时,注意须在温度为25 ℃的条件下(√)。
(3)使酚酞显无色的溶液呈酸性,使甲基橙显黄色的溶液呈碱性(×);指示剂的显色均有特定的pH范围,常温下,pH<8.2的溶液中滴入酚酞均显无色,pH>4.4的溶液中滴入甲基橙均显黄色(√)。
2
11
5
9.7
2
解析:(1)c(H2SO4)=0.005 mol·L-1,c(H+)=2×c(H2SO4)=0.01 mol·L-1,pH=2。
(3)pH=2的盐酸加水稀释到1 000倍,所得溶液的pH=5。
A. 醋酸溶液的物质的量浓度小于盐酸
B. 将醋酸溶液稀释至原体积的10倍,所得溶液pH<4
C. c(Cl-)=c(CH3COOH)+c(CH3COO-)
D. 相同体积的两种酸,分别与足量镁条反应,盐酸产生的气体多
B
A. 曲线Ⅱ为氢氟酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗氢氟酸的体积较小
C. b点溶液中水的电离程度比c点溶液中水的电离程度小
D
题组四 图像法理解强弱稀释规律
解题感悟
酸、碱溶液加水稀释到体积为原来的10n倍时pH的变化
溶液 稀释前溶液pH 稀释后溶液pH
酸 强酸 pH=a pH=a+n
弱酸 a<pH<a+n
碱 强碱 pH=b pH=b-n
弱碱 b-n<pH<b
注:常温下,任何酸或碱溶液无限稀释时,溶液的pH都不可能大于7或小于7,只能接近7,表中a+n<7,b-n>7。
B
A. HX、HY都是弱酸,且HX的酸性比HY的弱
B. 常温下,由水电离出的c(H+)·c(OH-):a<b
C. 相同温度下,电离常数Ka(HX):a>b
第*页
限时跟踪检测
A. 加入电解质一定会破坏水的电离平衡,加入酸和碱通常都会抑制水的电离
B. 水的电离和电解都需要电
C. 氢氧化钠溶液显碱性,故水电离出的c水(H+)≠c水(OH-)
D. 升高温度一定使水的离子积增大
解析:加入电解质不一定会破坏水的电离平衡,加入强酸强碱盐对水的电离没有影响,选项A错误;水的电离不需要通电,选项B错误;氢氧化钠溶液中c(H+)≠c(OH-),但水电离出的c水(H+)=c水(OH-),选项C错误;水电离是吸热过程,升高温度一定使水的离子积增大,选项D正确。
D
1
2
3
4
5
6
7
8
9
10
11
A. 该溶液的溶质可能是NaHSO4
B. 向该溶液中加入铝粉,可能产生H2
C. 下列离子在该溶液中一定能大量共存:Cl-、K+、Cu2+
D. 向该溶液中加入NaHCO3,一定有化学反应发生
C
1
2
3
4
5
6
7
8
9
10
11
A. 各点的温度高低顺序:Z>Y>X
B. M区域内任意点都是碱溶于水所得的溶液
C. 常温下,向纯水中加入少量金属Na,可使X点溶液变为Y点溶液
D. XZ线上的任意点一定表示的是纯水
C
1
2
3
4
5
6
7
8
9
10
11
解析:温度升高促进水的电离,其电离常数只受温度的影响,由题图可知,两条曲线是反比例曲线,曲线上的横纵坐标c(H+)·c(OH-)为定值,X和Y点的温度相同,各点的温度高低顺序:Z>Y=X,A错误;由题图得M区域内c(H+)<c(OH-),溶液呈碱性,但不一定是碱溶液,也可能是Na2CO3等溶于水所得的碱性溶液,B错误;常温下,向纯水中加入少量金属Na,消耗水电离出的H+,促进了水的电离,使水中的c(OH-)>c(H+),可使X点溶液变为Y点,C正确;pH=-lg c(H+),XZ线上任意点的c(H+)=c(OH-),且从X到Z,H+和OH-浓度在同等程度增大,所以此时肯定是中性溶液,但不一定是纯水,也可能是NaCl等盐溶于水所得的中性溶液,D错误。
1
2
3
4
5
6
7
8
9
10
11
A. pH相同的NaOH溶液与Ba(OH)2溶液以任意体积比混合,pH不变
B. 浓度均为0.1 mol·L-1的NaOH溶液与Ba(OH)2溶液等体积混合,pH不变
C. 常温下,pH=2的溶液与pH=12的溶液等体积混合后,混合溶液的pH不一定等于7
D. 常温下,0.05 mol·L-1的硫酸与0.05 mol·L-1的氢氧化钠溶液等体积混合后,溶液pH<7
B
解析:两种溶液都是强碱,两溶液的pH相同,混合后c(OH-)不变,pH不会变化,A正确;NaOH是一元强碱,Ba(OH)2是二元强碱,混合后c(OH-)变化,pH变化,B错误;混合溶液的酸碱性取决于酸碱的强弱,pH=2的溶液与pH=12的溶液等体积混合后,若是强酸、强碱,则pH=7,若强酸、弱碱,则弱碱过量,pH>7,若是弱酸、强碱,则弱酸过量,pH<7,C正确;硫酸为二元酸,氢氧化钠为一元碱,两溶液浓度相同,等体积混合后硫酸过量,溶液pH<7,D正确。
1
2
3
4
5
6
7
8
9
10
11
A. 若a=b且c(X-)>c(Y-),则酸性:HX>HY
B. 若a>b且c(X-)=c(Y-),则酸性:HX>HY
C. 若a<b且两者pH相同,则HY一定是弱酸
D. 若向HX溶液中加入等浓度、等体积的NaOH溶液,所得溶液pH>7,则HX为弱酸
B
解析:若a=b且c(X-)>c(Y-),说明电离程度:HX>HY,则酸性:HX>HY,A正确;若a>b且c(X-)=c(Y-),说明电离程度:HX<HY,则酸性:HX<HY,B错误;若a<b且两者pH相同,说明电离出的氢离子浓度相等,则HY一定是弱酸,C正确;若向HX溶液中加入等浓度、等体积的NaOH溶液,所得溶液pH>7,说明X-水解,则HX为弱酸,D正确。
1
2
3
4
5
6
7
8
9
10
11
图1 图2
D
A. 图1表示相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图1中,中和等体积的两种酸,消耗等浓度的NaOH溶液体积V(Ⅰ)>V(Ⅱ)
C. 图2中纯水仅升高温度,就可以从a点变到c点
D. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
1
2
3
4
5
6
7
8
9
10
11
解析:在题图1中,盐酸与醋酸的pH相同,加水稀释相同的倍数后,盐酸溶液的pH变化大,所以Ⅰ为盐酸,Ⅱ为醋酸,且b点溶液的导电性比a点弱,A错误;因为盐酸和醋酸的pH相同,所以醋酸溶液的浓度大,中和等体积的两种酸,消耗等浓度的NaOH溶液体积:V(Ⅰ)<V(Ⅱ),B错误;题图2中纯水仅升高温度,c(H+)、c(OH-)同等程度增大且相等,不可能从a点变到c点,C错误;题图2中在b点对应温度下,Kw=10-12,pH=2的H2SO4中c(H+)=10-2 mol·L-1,pH=10的NaOH溶液中c(OH-)=10-2 mol·L-1,二者等体积混合后,刚好完全反应,溶液显中性,D正确。
1
2
3
4
5
6
7
8
9
10
11
A. 盐酸与NaOH溶液的浓度相等
B. B点和D点水的电离程度相同
C. 将滴加NaOH溶液改为滴加氨水,该图曲线不变
D. 升高温度,滴定过程中pOH+pH>14
B
1
2
3
4
5
6
7
8
9
10
11
解析:由题图可知,未滴加NaOH溶液时盐酸的pH=0,则c(H+)=1 mol·L-1,即c(HCl)=1 mol·L-1,最终溶液的pH=14,则c(OH-)=1 mol·L-1,由于最终所得溶液是NaCl和NaOH的混合溶液,相当于对原NaOH溶液进行稀释,故原NaOH溶液的c(NaOH)>1 mol·L-1,A项错误;B点、D点水的电离均受到抑制,且由水电离出的c(H+)=c(OH-)=10-10 mol·L-1,B项正确;若将滴加NaOH溶液改为滴加氨水,由于NH3·H2O为弱碱,而饱和氨水的pH约为12,故最终所得溶液pH不可能为14,C项错误;升高温度,水的离子积Kw增大,即c(H+)·c(OH-)>10-14,pH=-lg c(H+),pOH=-lg c(OH-),故pOH+pH<14,D项错误。
1
2
3
4
5
6
7
8
9
10
11
A. 常温下,Ka(HA)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 溶液的导电性逐渐增强
B
解析:由起点溶液中-lg c水(H+)=12可知,酸电离产生的c(H+)=10-2 mol·L-1,故Ka(HA)=10-4,故A正确;从题图中可知,HA是弱酸,曲线的最高点溶液的溶质为NaA,b点溶液的溶质是NaA和NaOH,溶液呈碱性,pH>7,故B错误;a点到b点,发生酸碱中和反应生成可水解的盐,然后碱过量,所以水的电离程度先增大后减小,故C正确;不断加入NaOH溶液,溶液中的离子总浓度不断增大,溶液的导电性逐渐增强,故D正确。
1
2
3
4
5
6
7
8
9
10
11
甲 乙
B
A. c0、V0均不能确定其数值大小
B. 电离常数Kb(MOH)≈1.1×10-3
C. x点处两种溶液中水的电离程度不相等
1
2
3
4
5
6
7
8
9
10
11
A. 10 ℃升温到25 ℃时,断键吸热和分子间氢键断裂吸热导致醋酸电离程度增加
B. 30 ℃后升温,形成水合离子的过程放热导致醋酸的电离程度减小
C. 23 ℃时,保持温度不变向1 mol·L-1醋酸溶液中加入少量pH=2.65的盐酸,pH不变
D. 33 ℃时,醋酸电离平衡常数的数量级为10-5
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
11. 某温度下的水溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1。x与y的关系如图所示:
10-12
高于
10
8
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
同课章节目录
