人教版高中化学选择性必修1第二章化学反应速率与化学平衡第二节化学平衡第1课时化学平衡状态课件(共61张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第二章化学反应速率与化学平衡第二节化学平衡第1课时化学平衡状态课件(共61张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 7.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-25 17:10:05 | ||
图片预览










文档简介
(共61张PPT)
第二章 化学反应速率与化学平衡
第二节 化学平衡
第1课时 化学平衡状态
【学习目标】 1.知道化学平衡是一种动态平衡,理解并会判断化学反应的平衡状 态。2.认识化学平衡常数是表明化学反应限度的一个特征值,知道化学平衡常数的含 义并能进行有关计算。3.了解浓度商和化学平衡常数的相对大小以及与反应方向间的 联系。4.能根据温度、浓度、压强对化学平衡的影响,推测平衡移动的方向。
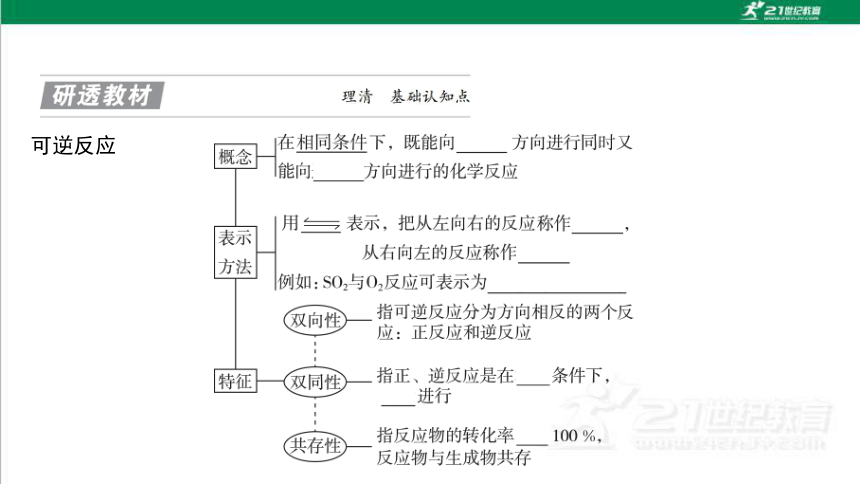
一、可逆反应
可逆反应
【判断】
×
×
×
√
×
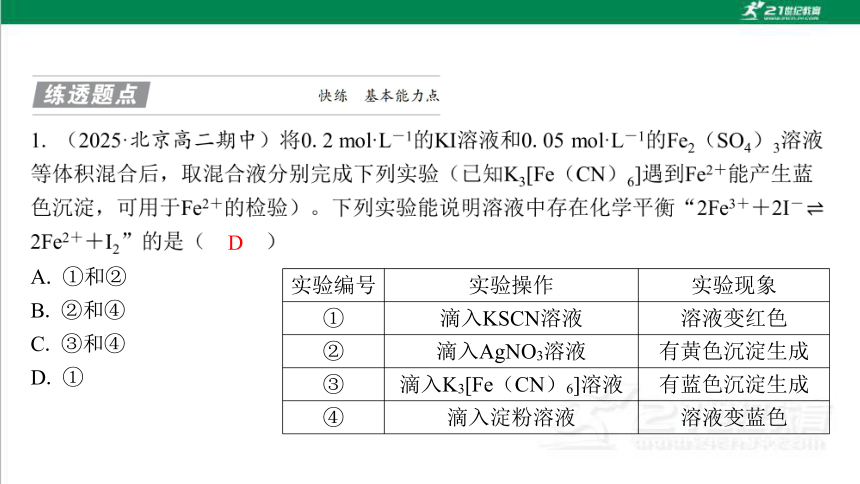
实验编号 实验操作 实验现象
① 滴入KSCN溶液 溶液变红色
② 滴入AgNO3溶液 有黄色沉淀生成
③ 滴入K3[Fe(CN)6]溶液 有蓝色沉淀生成
④ 滴入淀粉溶液 溶液变蓝色
D
A. ①和②
B. ②和④
C. ③和④
D. ①
题后归纳
实验证明某反应为可逆反应的方法
(1)检验出某种生成物。
(2)检验量少的反应物是否有剩余。
A. SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B. SO2为0.25 mol·L-1
C. SO3为0.4 mol·L-1
D. SO2、SO3均为0.15 mol·L-1
B
解析:SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,SO2和O2的浓度 变化分别为0.2 mol·L-1、0.1 mol·L-1,需要消耗三氧化硫的浓度为0.2 mol·L-1,由 于该反应为可逆反应,实际变化浓度应小于三氧化硫的原有浓度0.2 mol·L-1,所以 达到平衡时SO2的浓度小于0.4 mol·L-1,O2的浓度小于0.2 mol·L-1,故A错误;SO2 的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度 变化为0.2 mol·L-1,实际变化为0.05 mol·L-1,故B正确;SO3的浓度增大,说明该 反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度变化为0.2 mol·L-1,实际变化应小于该值,故C错误;反应物、生成物的浓度不可能同时减 小,故D错误。
二、化学平衡状态
1. 化学平衡状态的建立
N2与H2反应
反应开始时
反应物浓度最大,v正最 ,生成物浓度为0,v逆为
大
0
反应进行时
反应物浓度逐渐减小→v正逐渐 ,生成物浓度由0逐渐增大→v逆从0逐 渐
达到平衡时
v正=v逆,反应混合物中各组分的浓度均不再改变
v-t图像
减小
增大
N2与H2反应
NH3的分解反应
反应开始时
生成物浓度最大,v逆最 ,反应物浓度为0,v正为
反应进行时
生成物浓度逐渐减小→v逆逐渐 ,反应物浓度由0逐渐增大→v正从0逐 渐
大
0
减小
增大
达到平衡时
v正=v逆,反应混合物中各组分的浓度均不再改变
v-t图像
2. 化学平衡状态
(1)化学平衡状态的概念
在一定条件下的可逆反应体系中,当正、逆反应的速率 时,反应物和生成物 的浓度均 ,这表明该反应中物质的转化达到了“限度”,这时的状态称 为化学平衡状态,简称化学平衡。
(2)化学平衡状态的特征
化学平衡状态的特征可以概括为逆、等、动、定、变。
①逆:研究对象是 反应。
②等:化学平衡的条件是v正和v逆 。
③动:化学平衡是一种 平衡,达到化学平衡状态时反应并未停止。
④定:当可逆反应达到平衡时,各组分的含量(或浓度) 。
⑤变:若外界条件改变,化学平衡可能发生 。
相等
保持不变
可逆
相等
动态
保持不变
移动
【判断】
×
×
√
×
t/s 0 2 4 6 8
n(Cl2)/mol 0 0.30 0.39 0.40 0.40
A. 6 s之后反应达到平衡状态,容器内的压强不再随时间而改变
B. 6 s时,反应停止,不再进行
C. 8 s时,反应容器中各物质的浓度已不再发生变化
D. 生成Cl2的平均反应速率:v(0~2 s)>v(2~4 s)
B
解析:6 s后氯气的物质的量不再改变,化学反应达到平衡状态,容器内气体总物质的 量保持不变,因而压强不再随时间而改变,A正确;6 s时处于平衡状态,反应不会停 止,仍在进行,B错误;8 s时已是平衡状态,反应容器中各物质的浓度不再发生变 化,C正确;0~2 s生成氯气0.30 mol,2~4 s生成氯气0.09 mol,可知0~2 s内生成 Cl2的平均反应速率大,D正确。
A. t1时刻,反应逆向进行
B. t2时刻,正反应速率大于逆反应速率
C. t3时刻,达到反应进行的限度
D. t4时刻,反应处于平衡状态,反应停止
解析:t1时刻,v(正)>v(逆),反应正向进行,A错误;t2时刻,v(正)>v (逆),B正确;t3时刻,v(正)>v(逆),没有达到反应进行的限度,C错误; t4时刻,v(正)=v(逆),反应达到平衡状态,但v(正)=v(逆)≠0,反应没 有停止,D错误。
B
三、化学平衡状态的判断
1. 简单判据
(1)“等”
正反应速率与逆反应速率相等,即v正=v逆。
①同一种物质:该物质的生成速率等于它的消耗速率。
②不同的物质:反应速率之比等于化学方程式中各物质的 之比,但必 须是 的速率。
化学计量数
正、逆反应
(2)“定”
反应体系中各组分的质量、物质的量、浓度、百分含量(质量分数、物质的量分数、 气体的体积分数等)保持不变。
2. “复杂”判据——“变量不变”时达到平衡
当反应过程中变化的量不再改变时,化学反应达到平衡状态,即反应前后始终不变的 量不能作为判据。
在恒温恒容条件下,下列三个可逆反应的某些“量”不再随时间改变时,判断是否一 定达到了平衡状态。
项目
混合气体的总质量 m总
混合气体的总物质 的量n总
混合气体的密度ρ
体系的压强p
混合气体的颜色
不一定
不一定
是
是
不一定
是
不一定
不一定
是
是
不一定
是
是
不一定
是
是
【思考交流】
化学反应 是否平衡(填“平衡”或 “不一定平衡”)
混合物体
系中各成
分的含量 各物质的物质的量或物质的量分数一定
各物质的质量或质量分数一定
各气体的体积或体积分数一定
总体积、总压强、总物质的量一定
正、逆反
应速率之
间的关系 单位时间内消耗了m mol A,同时也生成了 m mol A
平衡
平衡
平衡
不一定平衡
平衡
化学反应 是否平衡(填“平衡”或 “不一定平衡”)
正、逆反
应速率之
间的关系 单位时间内消耗了n mol B,同时也消耗了p mol C
v(A)∶v(B)∶v(C)∶v(D)= m∶n∶p∶q
单位时间内生成了n mol B,同时也消耗了q mol D
压强 其他条件一定、总压强一定,且m+n≠p +q
平衡
不一定平衡
不一定平衡
平衡
化学反应 是否平衡(填“平衡”或 “不一定平衡”)
压强 其他条件一定、总压强一定,且m+n=p+q
混合气体的平均相对分子质量 平均相对分子质量一定,且m+n≠p+q
平均相对分子质量一定,且m+n=p+q
温度 任何化学反应都伴随着能量变化,当绝热 体系温度一定时
气体
密度(ρ) 只有气体参加的反应,密度保持不变(恒 容密闭容器中)
不一定平衡
平衡
不一定平衡
平衡
不一定平衡
化学反应 是否平衡(填“平衡”或 “不一定平衡”)
气体
密度(ρ) m+n≠p+q时,密度保持不变(恒压容 器中)
m+n=p+q时,密度保持不变(恒压容 器中)
颜色 反应体系内有色物质的颜色稳定不变(其 他条件不变)
平衡
不一定平衡
平衡
B
A. ③④⑤ B. ②③④
C. ①②③④ D. ①②③④⑤
解析:如果该反应是一个反应前后气体体积不变的可逆反应,则体系的压强始终不 变,所以不能根据压强不再变化判断反应是否达到平衡状态,故①错误;D是固体, 反应前后混合气体的质量不等,容器的容积不变,若体系的密度不变,说明混合气体 的总质量不再变化,此时反应达到平衡状态,故②正确;各组分的物质的量浓度不再 改变,该反应达到平衡状态,故③正确;反应到达平衡状态时各组分的物质的量不再 改变,各组分的质量分数不再改变,此时反应达到平衡状态,故④正确;物质的量之 比n(A)∶n(B)∶n(C)∶n(D)=m∶n∶p∶q,无法确定v正=v逆,故不 能判断是否达到平衡状态,故⑤错误。故选B。
题后归纳
化学平衡状态判断要注意“两个关注”
(1)关注化学反应
①关注反应条件,是恒温恒容、恒温恒压,还是绝热恒容容器。
②关注反应特点,是等体积反应,还是非等体积反应。
③关注特殊情况,是否有固体参加或生成,或固体的分解反应。
2. 有下列两个可逆反应:
以上两个反应过程中,有下列情况:
①同一物质正反应速率等于逆反应速率 ②混合气体的颜色不再改变 ③混合气体的 密度不再改变 ④混合气体的压强不再改变 ⑤混合气体的平均相对分子质量不再改 变 ⑥对于反应1,单位时间内生成n mol O2的同时生成2n mol NO2 ⑦对于反应2, 用H2、I2和HI表示的反应速率之比为1∶1∶2
(1)上述情况中,能作为反应1达到平衡状态标志的是 。
①②④⑤⑥
(2)上述情况中,能作为反应2达到平衡状态标志的是 。
①②
题后归纳
几种特殊反应的平衡依据
(1)量比不变型
①反应物或生成物的量比不变,不一定达到平衡状态。
②反应物和生成物的量比不变,一定达到平衡状态。
(2)量相等型
①反应物和生成物的量相等,不一定达平衡状态。
②反应物和反应物的量相等,不一定达平衡状态。
③量不变≠量相等≠量或量比等于某一具体的数。
课时作业(八) 化学平衡状态
[对点训练]
题组一 可逆反应及特征
A. ①③ B. ②④ C. ① D. ②③
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. c1∶c2=3∶1
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等
D. 0<c1<0.14 mol·L-1
解析:X、Y的平衡浓度之比为1∶3,转化浓度之比也为1∶3,故c1∶c2=1∶3,X、 Y的转化率相等,A、C不正确;平衡时v生成(Y)表示逆反应速率,v生成(Z)表示 正反应速率,v生成(Y)∶v生成(Z)=3∶2,B不正确;由可逆反应的特点可知0< c1<0.14 mol·L-1,D正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
题组二 平衡状态的建立及特征
A. 达到平衡状态时,正、逆反应速率相等
B. 达到平衡状态时,SO2和O2的浓度都为0
C. 若起始时加入2 mol SO2和1 mol O2,则达平衡时放出的热量为196.6 kJ
D. 若反应达到平衡状态后,2 min时生成a mol SO3,则4 min时生成2a mol SO3
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:该反应为可逆反应,达到平衡状态时,反应物不能完全转化为生成物,所以 SO2和O2的浓度不等于0,B错误;因为该反应是可逆反应,所以消耗的SO2的物质的 量小于2 mol、消耗O2的物质的量小于1 mol,放出的热量小于196.6 kJ,C错误;反应 达到平衡状态时,各物质的物质的量不变,2~4 min三氧化硫的物质的量不变,为a mol,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. 正反应速率a点比b点小
B. t0 min时该反应停止
C. t0 min时,c(Z)=0.75 mol·L-1
D. 当密闭容器中的压强不再变化时,该可逆反应达到了化 学平衡状态
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 容器内的压强不再变化
B. 混合气体总的物质的量不再变化
C. Z的生成速率与Z的分解速率相等
D. 单位时间内消耗a mol X,同时生成3a mol Z
C
1
2
3
4
5
6
7
8
9
10
11
12
解析:由于该反应前后气体的物质的量保持不变,故容器内的压强不再变化不能说明 反应达到化学平衡状态,A、B不符合题意;Z的生成速率与Z的分解速率相等,即 正、逆反应速率相等,达到化学平衡状态,C符合题意;单位时间内消耗a mol X,同 时生成3a mol Z,都表示正反应速率,不能说明反应达到平衡状态,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
A. ①② B. ②④ C. ③④ D. ①④
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:反应混合物的质量始终保持不变,恒压条件下,容积会发生变化,气体密度保 持不变时,说明达到平衡状态,①正确;ΔH是恒量,不能作为判断平衡状态的标 志,②错误;该反应是充入1 mol N2O4,正反应速率应是逐渐减小直至不变,③曲线 趋势不正确,③错误;N2O4的转化率先增大,后保持不变,说明达到平衡状态,④正 确;故选D。
1
2
3
4
5
6
7
8
9
10
11
12
①混合气体的密度不变 ②容器内气体的压强不变
③混合气体的平均摩尔质量不变
④B的物质的量浓度不变 ⑤v正(C)=v逆(D)
⑥2v正(B)=v逆(D)
A. ①③④⑤ B. ①④⑤⑥
C. ①②③④⑤ D. ④⑤
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:容积恒定条件下:气体质量为变量,混合气体的密度不变,说明反应达 平衡状态,故①正确;反应前后气体分子总数相等,容器内气体的压强始终不 变,容器内压强不变不能说明反应已达平衡,故②错误;气体质量、混合气体 的平均摩尔质量会随着反应而变,混合气体的平均相对分子质量不变,说明反 应已达平衡,故③正确;B的物质的量浓度不变,说明B的物质的量不变,达平 衡状态,故④正确;v正(C)=v逆(D)能表示正、逆方向反应速率,且速率比 等于化学计量数之比,说明正反应和逆反应速率相等,反应达平衡状态,故⑤ 正确;2v正(B)=v逆(D),未达平衡状态,当v正(B)=2v逆(D)时,能表 示正、逆方向反应速率,且速率之比等于化学计量数之比,才说明正反应和逆 反应速率相等,反应达平衡状态,故⑥错误;故选A。
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
反应时间/s 0 60 70 80 90 100 110
CO2浓度
(mol/L) 0.00 0.20 0.26 0.30 0.32 0.33 0.33
A. 90 s时,反应的速率:v(正)>v(逆)
B. 用v(CO2)表示的速率:60~70 s>70~80 s
C. 100 s时,反应速率:2v正(NO)=v逆(CO2)
D. 混合气体的压强不再变化,该反应一定达到了平衡状态
C
1
2
3
4
5
6
7
8
9
10
11
12
解析:从90 s到100 s,CO2的浓度继续增大,说明90 s时反应未达到平衡状态,反应仍 向正向进行,则v(正)>v(逆),A项正确;在60~70 s内,Δc(CO2)=0.06 mol·L-1,在70~80 s内,Δc(CO2)=0.04 mol·L-1,说明在相同时间内,反应速率 逐渐减小,B项正确;在100 s时反应达到平衡状态,则v正(NO)=2v逆(CO2),C 项错误;因为容器为绝热恒容密闭容器,虽然反应前后气体的物质的量相等,但随着 反应的进行,温度改变,压强仍是变量,当混合气体的压强不再随时间变化而变化, 该反应达到了平衡状态,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
10. (2025·湖北黄冈中学高二调研)在1 L恒温恒容的密闭容器中投入一定量N2O5, 发生反应:
A. ①②③⑤ B. ②③④⑥
C. ①③⑤⑥ D. ②③④⑤
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. 在化学反应的研究和实际应用中,人们除了选择合适的化学反应以实现新期待的 物质转化或能量转化,还要关注化学反应进行的快慢和程度,以提高生产效率。
时间/s 0 1 2 3 4 5
c(NO)/(10-4 mol·L-1) 10.0 4.50 2.50 1.50 1.00 1.00
c(CO)/(10-3 mol·L-1) 3.60 3.05 2.85 2.75 2.70 2.70
前2 s内的平均反应速率v(N2)= ,从表格看,已达化 学平衡的时间段为 。
1.875×10-4 mol·L-1·s-1
4~5 s
1
2
3
4
5
6
7
8
9
10
11
12
a.t1时,反应未达到平衡,NO2的浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质的浓度不再变化
d.t2~t3,各物质的浓度相等
aceg
e.0~t2,N2O4的浓度增大
f.反应过程中气体的颜色不变
g.建立平衡过程中,混合气体的平均相对分子质量增大
1
2
3
4
5
6
7
8
9
10
11
12
A. 3v正(N2)=v正(H2)
B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)
D. v正(N2)=3v逆(H2)
正反应速率与逆反
应速率相等
C
1
2
3
4
5
6
7
8
9
10
11
12
(2)在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量 恒定不变:
a.各物质的浓度不变
b.平衡混合物中各组分的物质的量分数或质量分数不变
c.容器内气体压强不变
d.容器内气体密度不变
e.容器内气体颜色不变
abc
abe
abce
1
2
3
4
5
6
7
8
9
10
11
12
第二章 化学反应速率与化学平衡
第二节 化学平衡
第1课时 化学平衡状态
【学习目标】 1.知道化学平衡是一种动态平衡,理解并会判断化学反应的平衡状 态。2.认识化学平衡常数是表明化学反应限度的一个特征值,知道化学平衡常数的含 义并能进行有关计算。3.了解浓度商和化学平衡常数的相对大小以及与反应方向间的 联系。4.能根据温度、浓度、压强对化学平衡的影响,推测平衡移动的方向。
一、可逆反应
可逆反应
【判断】
×
×
×
√
×
实验编号 实验操作 实验现象
① 滴入KSCN溶液 溶液变红色
② 滴入AgNO3溶液 有黄色沉淀生成
③ 滴入K3[Fe(CN)6]溶液 有蓝色沉淀生成
④ 滴入淀粉溶液 溶液变蓝色
D
A. ①和②
B. ②和④
C. ③和④
D. ①
题后归纳
实验证明某反应为可逆反应的方法
(1)检验出某种生成物。
(2)检验量少的反应物是否有剩余。
A. SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B. SO2为0.25 mol·L-1
C. SO3为0.4 mol·L-1
D. SO2、SO3均为0.15 mol·L-1
B
解析:SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,SO2和O2的浓度 变化分别为0.2 mol·L-1、0.1 mol·L-1,需要消耗三氧化硫的浓度为0.2 mol·L-1,由 于该反应为可逆反应,实际变化浓度应小于三氧化硫的原有浓度0.2 mol·L-1,所以 达到平衡时SO2的浓度小于0.4 mol·L-1,O2的浓度小于0.2 mol·L-1,故A错误;SO2 的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度 变化为0.2 mol·L-1,实际变化为0.05 mol·L-1,故B正确;SO3的浓度增大,说明该 反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度变化为0.2 mol·L-1,实际变化应小于该值,故C错误;反应物、生成物的浓度不可能同时减 小,故D错误。
二、化学平衡状态
1. 化学平衡状态的建立
N2与H2反应
反应开始时
反应物浓度最大,v正最 ,生成物浓度为0,v逆为
大
0
反应进行时
反应物浓度逐渐减小→v正逐渐 ,生成物浓度由0逐渐增大→v逆从0逐 渐
达到平衡时
v正=v逆,反应混合物中各组分的浓度均不再改变
v-t图像
减小
增大
N2与H2反应
NH3的分解反应
反应开始时
生成物浓度最大,v逆最 ,反应物浓度为0,v正为
反应进行时
生成物浓度逐渐减小→v逆逐渐 ,反应物浓度由0逐渐增大→v正从0逐 渐
大
0
减小
增大
达到平衡时
v正=v逆,反应混合物中各组分的浓度均不再改变
v-t图像
2. 化学平衡状态
(1)化学平衡状态的概念
在一定条件下的可逆反应体系中,当正、逆反应的速率 时,反应物和生成物 的浓度均 ,这表明该反应中物质的转化达到了“限度”,这时的状态称 为化学平衡状态,简称化学平衡。
(2)化学平衡状态的特征
化学平衡状态的特征可以概括为逆、等、动、定、变。
①逆:研究对象是 反应。
②等:化学平衡的条件是v正和v逆 。
③动:化学平衡是一种 平衡,达到化学平衡状态时反应并未停止。
④定:当可逆反应达到平衡时,各组分的含量(或浓度) 。
⑤变:若外界条件改变,化学平衡可能发生 。
相等
保持不变
可逆
相等
动态
保持不变
移动
【判断】
×
×
√
×
t/s 0 2 4 6 8
n(Cl2)/mol 0 0.30 0.39 0.40 0.40
A. 6 s之后反应达到平衡状态,容器内的压强不再随时间而改变
B. 6 s时,反应停止,不再进行
C. 8 s时,反应容器中各物质的浓度已不再发生变化
D. 生成Cl2的平均反应速率:v(0~2 s)>v(2~4 s)
B
解析:6 s后氯气的物质的量不再改变,化学反应达到平衡状态,容器内气体总物质的 量保持不变,因而压强不再随时间而改变,A正确;6 s时处于平衡状态,反应不会停 止,仍在进行,B错误;8 s时已是平衡状态,反应容器中各物质的浓度不再发生变 化,C正确;0~2 s生成氯气0.30 mol,2~4 s生成氯气0.09 mol,可知0~2 s内生成 Cl2的平均反应速率大,D正确。
A. t1时刻,反应逆向进行
B. t2时刻,正反应速率大于逆反应速率
C. t3时刻,达到反应进行的限度
D. t4时刻,反应处于平衡状态,反应停止
解析:t1时刻,v(正)>v(逆),反应正向进行,A错误;t2时刻,v(正)>v (逆),B正确;t3时刻,v(正)>v(逆),没有达到反应进行的限度,C错误; t4时刻,v(正)=v(逆),反应达到平衡状态,但v(正)=v(逆)≠0,反应没 有停止,D错误。
B
三、化学平衡状态的判断
1. 简单判据
(1)“等”
正反应速率与逆反应速率相等,即v正=v逆。
①同一种物质:该物质的生成速率等于它的消耗速率。
②不同的物质:反应速率之比等于化学方程式中各物质的 之比,但必 须是 的速率。
化学计量数
正、逆反应
(2)“定”
反应体系中各组分的质量、物质的量、浓度、百分含量(质量分数、物质的量分数、 气体的体积分数等)保持不变。
2. “复杂”判据——“变量不变”时达到平衡
当反应过程中变化的量不再改变时,化学反应达到平衡状态,即反应前后始终不变的 量不能作为判据。
在恒温恒容条件下,下列三个可逆反应的某些“量”不再随时间改变时,判断是否一 定达到了平衡状态。
项目
混合气体的总质量 m总
混合气体的总物质 的量n总
混合气体的密度ρ
体系的压强p
混合气体的颜色
不一定
不一定
是
是
不一定
是
不一定
不一定
是
是
不一定
是
是
不一定
是
是
【思考交流】
化学反应 是否平衡(填“平衡”或 “不一定平衡”)
混合物体
系中各成
分的含量 各物质的物质的量或物质的量分数一定
各物质的质量或质量分数一定
各气体的体积或体积分数一定
总体积、总压强、总物质的量一定
正、逆反
应速率之
间的关系 单位时间内消耗了m mol A,同时也生成了 m mol A
平衡
平衡
平衡
不一定平衡
平衡
化学反应 是否平衡(填“平衡”或 “不一定平衡”)
正、逆反
应速率之
间的关系 单位时间内消耗了n mol B,同时也消耗了p mol C
v(A)∶v(B)∶v(C)∶v(D)= m∶n∶p∶q
单位时间内生成了n mol B,同时也消耗了q mol D
压强 其他条件一定、总压强一定,且m+n≠p +q
平衡
不一定平衡
不一定平衡
平衡
化学反应 是否平衡(填“平衡”或 “不一定平衡”)
压强 其他条件一定、总压强一定,且m+n=p+q
混合气体的平均相对分子质量 平均相对分子质量一定,且m+n≠p+q
平均相对分子质量一定,且m+n=p+q
温度 任何化学反应都伴随着能量变化,当绝热 体系温度一定时
气体
密度(ρ) 只有气体参加的反应,密度保持不变(恒 容密闭容器中)
不一定平衡
平衡
不一定平衡
平衡
不一定平衡
化学反应 是否平衡(填“平衡”或 “不一定平衡”)
气体
密度(ρ) m+n≠p+q时,密度保持不变(恒压容 器中)
m+n=p+q时,密度保持不变(恒压容 器中)
颜色 反应体系内有色物质的颜色稳定不变(其 他条件不变)
平衡
不一定平衡
平衡
B
A. ③④⑤ B. ②③④
C. ①②③④ D. ①②③④⑤
解析:如果该反应是一个反应前后气体体积不变的可逆反应,则体系的压强始终不 变,所以不能根据压强不再变化判断反应是否达到平衡状态,故①错误;D是固体, 反应前后混合气体的质量不等,容器的容积不变,若体系的密度不变,说明混合气体 的总质量不再变化,此时反应达到平衡状态,故②正确;各组分的物质的量浓度不再 改变,该反应达到平衡状态,故③正确;反应到达平衡状态时各组分的物质的量不再 改变,各组分的质量分数不再改变,此时反应达到平衡状态,故④正确;物质的量之 比n(A)∶n(B)∶n(C)∶n(D)=m∶n∶p∶q,无法确定v正=v逆,故不 能判断是否达到平衡状态,故⑤错误。故选B。
题后归纳
化学平衡状态判断要注意“两个关注”
(1)关注化学反应
①关注反应条件,是恒温恒容、恒温恒压,还是绝热恒容容器。
②关注反应特点,是等体积反应,还是非等体积反应。
③关注特殊情况,是否有固体参加或生成,或固体的分解反应。
2. 有下列两个可逆反应:
以上两个反应过程中,有下列情况:
①同一物质正反应速率等于逆反应速率 ②混合气体的颜色不再改变 ③混合气体的 密度不再改变 ④混合气体的压强不再改变 ⑤混合气体的平均相对分子质量不再改 变 ⑥对于反应1,单位时间内生成n mol O2的同时生成2n mol NO2 ⑦对于反应2, 用H2、I2和HI表示的反应速率之比为1∶1∶2
(1)上述情况中,能作为反应1达到平衡状态标志的是 。
①②④⑤⑥
(2)上述情况中,能作为反应2达到平衡状态标志的是 。
①②
题后归纳
几种特殊反应的平衡依据
(1)量比不变型
①反应物或生成物的量比不变,不一定达到平衡状态。
②反应物和生成物的量比不变,一定达到平衡状态。
(2)量相等型
①反应物和生成物的量相等,不一定达平衡状态。
②反应物和反应物的量相等,不一定达平衡状态。
③量不变≠量相等≠量或量比等于某一具体的数。
课时作业(八) 化学平衡状态
[对点训练]
题组一 可逆反应及特征
A. ①③ B. ②④ C. ① D. ②③
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. c1∶c2=3∶1
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等
D. 0<c1<0.14 mol·L-1
解析:X、Y的平衡浓度之比为1∶3,转化浓度之比也为1∶3,故c1∶c2=1∶3,X、 Y的转化率相等,A、C不正确;平衡时v生成(Y)表示逆反应速率,v生成(Z)表示 正反应速率,v生成(Y)∶v生成(Z)=3∶2,B不正确;由可逆反应的特点可知0< c1<0.14 mol·L-1,D正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
题组二 平衡状态的建立及特征
A. 达到平衡状态时,正、逆反应速率相等
B. 达到平衡状态时,SO2和O2的浓度都为0
C. 若起始时加入2 mol SO2和1 mol O2,则达平衡时放出的热量为196.6 kJ
D. 若反应达到平衡状态后,2 min时生成a mol SO3,则4 min时生成2a mol SO3
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:该反应为可逆反应,达到平衡状态时,反应物不能完全转化为生成物,所以 SO2和O2的浓度不等于0,B错误;因为该反应是可逆反应,所以消耗的SO2的物质的 量小于2 mol、消耗O2的物质的量小于1 mol,放出的热量小于196.6 kJ,C错误;反应 达到平衡状态时,各物质的物质的量不变,2~4 min三氧化硫的物质的量不变,为a mol,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. 正反应速率a点比b点小
B. t0 min时该反应停止
C. t0 min时,c(Z)=0.75 mol·L-1
D. 当密闭容器中的压强不再变化时,该可逆反应达到了化 学平衡状态
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 容器内的压强不再变化
B. 混合气体总的物质的量不再变化
C. Z的生成速率与Z的分解速率相等
D. 单位时间内消耗a mol X,同时生成3a mol Z
C
1
2
3
4
5
6
7
8
9
10
11
12
解析:由于该反应前后气体的物质的量保持不变,故容器内的压强不再变化不能说明 反应达到化学平衡状态,A、B不符合题意;Z的生成速率与Z的分解速率相等,即 正、逆反应速率相等,达到化学平衡状态,C符合题意;单位时间内消耗a mol X,同 时生成3a mol Z,都表示正反应速率,不能说明反应达到平衡状态,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
A. ①② B. ②④ C. ③④ D. ①④
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:反应混合物的质量始终保持不变,恒压条件下,容积会发生变化,气体密度保 持不变时,说明达到平衡状态,①正确;ΔH是恒量,不能作为判断平衡状态的标 志,②错误;该反应是充入1 mol N2O4,正反应速率应是逐渐减小直至不变,③曲线 趋势不正确,③错误;N2O4的转化率先增大,后保持不变,说明达到平衡状态,④正 确;故选D。
1
2
3
4
5
6
7
8
9
10
11
12
①混合气体的密度不变 ②容器内气体的压强不变
③混合气体的平均摩尔质量不变
④B的物质的量浓度不变 ⑤v正(C)=v逆(D)
⑥2v正(B)=v逆(D)
A. ①③④⑤ B. ①④⑤⑥
C. ①②③④⑤ D. ④⑤
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:容积恒定条件下:气体质量为变量,混合气体的密度不变,说明反应达 平衡状态,故①正确;反应前后气体分子总数相等,容器内气体的压强始终不 变,容器内压强不变不能说明反应已达平衡,故②错误;气体质量、混合气体 的平均摩尔质量会随着反应而变,混合气体的平均相对分子质量不变,说明反 应已达平衡,故③正确;B的物质的量浓度不变,说明B的物质的量不变,达平 衡状态,故④正确;v正(C)=v逆(D)能表示正、逆方向反应速率,且速率比 等于化学计量数之比,说明正反应和逆反应速率相等,反应达平衡状态,故⑤ 正确;2v正(B)=v逆(D),未达平衡状态,当v正(B)=2v逆(D)时,能表 示正、逆方向反应速率,且速率之比等于化学计量数之比,才说明正反应和逆 反应速率相等,反应达平衡状态,故⑥错误;故选A。
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
反应时间/s 0 60 70 80 90 100 110
CO2浓度
(mol/L) 0.00 0.20 0.26 0.30 0.32 0.33 0.33
A. 90 s时,反应的速率:v(正)>v(逆)
B. 用v(CO2)表示的速率:60~70 s>70~80 s
C. 100 s时,反应速率:2v正(NO)=v逆(CO2)
D. 混合气体的压强不再变化,该反应一定达到了平衡状态
C
1
2
3
4
5
6
7
8
9
10
11
12
解析:从90 s到100 s,CO2的浓度继续增大,说明90 s时反应未达到平衡状态,反应仍 向正向进行,则v(正)>v(逆),A项正确;在60~70 s内,Δc(CO2)=0.06 mol·L-1,在70~80 s内,Δc(CO2)=0.04 mol·L-1,说明在相同时间内,反应速率 逐渐减小,B项正确;在100 s时反应达到平衡状态,则v正(NO)=2v逆(CO2),C 项错误;因为容器为绝热恒容密闭容器,虽然反应前后气体的物质的量相等,但随着 反应的进行,温度改变,压强仍是变量,当混合气体的压强不再随时间变化而变化, 该反应达到了平衡状态,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
10. (2025·湖北黄冈中学高二调研)在1 L恒温恒容的密闭容器中投入一定量N2O5, 发生反应:
A. ①②③⑤ B. ②③④⑥
C. ①③⑤⑥ D. ②③④⑤
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. 在化学反应的研究和实际应用中,人们除了选择合适的化学反应以实现新期待的 物质转化或能量转化,还要关注化学反应进行的快慢和程度,以提高生产效率。
时间/s 0 1 2 3 4 5
c(NO)/(10-4 mol·L-1) 10.0 4.50 2.50 1.50 1.00 1.00
c(CO)/(10-3 mol·L-1) 3.60 3.05 2.85 2.75 2.70 2.70
前2 s内的平均反应速率v(N2)= ,从表格看,已达化 学平衡的时间段为 。
1.875×10-4 mol·L-1·s-1
4~5 s
1
2
3
4
5
6
7
8
9
10
11
12
a.t1时,反应未达到平衡,NO2的浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质的浓度不再变化
d.t2~t3,各物质的浓度相等
aceg
e.0~t2,N2O4的浓度增大
f.反应过程中气体的颜色不变
g.建立平衡过程中,混合气体的平均相对分子质量增大
1
2
3
4
5
6
7
8
9
10
11
12
A. 3v正(N2)=v正(H2)
B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)
D. v正(N2)=3v逆(H2)
正反应速率与逆反
应速率相等
C
1
2
3
4
5
6
7
8
9
10
11
12
(2)在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量 恒定不变:
a.各物质的浓度不变
b.平衡混合物中各组分的物质的量分数或质量分数不变
c.容器内气体压强不变
d.容器内气体密度不变
e.容器内气体颜色不变
abc
abe
abce
1
2
3
4
5
6
7
8
9
10
11
12
