人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第二节水的电离和溶液的pH第1课时水的电离课件(共47张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第二节水的电离和溶液的pH第1课时水的电离课件(共47张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-25 00:00:00 | ||
图片预览









文档简介
(共47张PPT)
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第1课时 水的电离
【学习目标】 1.认识水的电离,了解水的离子积常数。2.认识溶液的酸碱性及 pH,掌握测量溶液pH、酸碱中和滴定的方法。3.能进行溶液pH的简单计算,能用实 例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
一、水的电离
1. 水的电离
2. 水的离子积常数
概念 当水的电离达到平衡时, 是一个常数,这 个常数叫做水的离子积常数,简称 ,记作Kw
表达式 ,25 ℃时,Kw=
影响
因素 只与 有关,升高温度Kw ,与溶液的酸碱性
适用
范围 适用于 和稀的
电离产物H+和OH-浓度之积
水的离子积
Kw=c(H+)·c(OH-)
1.0×10-14
温度
增大
无关
纯水
电解质溶液
3. 外界条件对水电离平衡的影响
(1)温度:温度升高, 水的电离,Kw 。
(2)酸、碱 水的电离,Kw 。
(3)外加能与H+、OH-反应的物质,会促进水的电离,Kw不变。
促进
增大
抑制
不变
【思考交流】
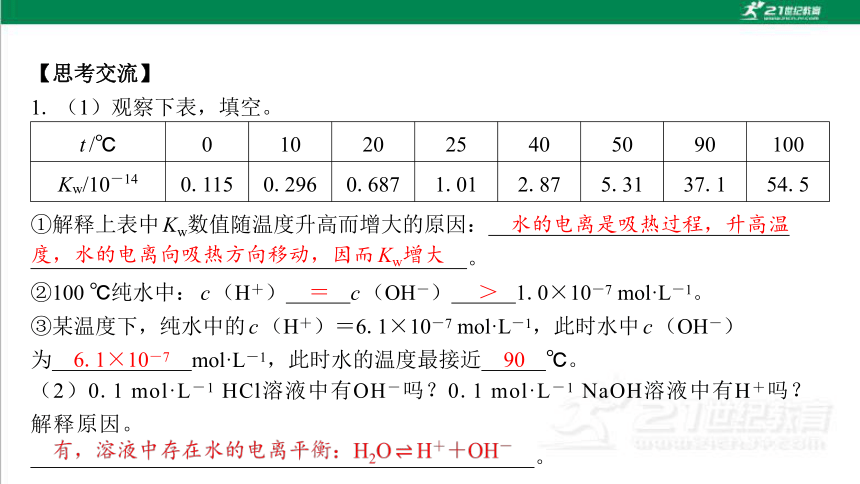
1. (1)观察下表,填空。
t/℃ 0 10 20 25 40 50 90 100
Kw/10-14 0.115 0.296 0.687 1.01 2.87 5.31 37.1 54.5
②100 ℃纯水中:c(H+) c(OH-) 1.0×10-7 mol·L-1。
③某温度下,纯水中的c(H+)=6.1×10-7 mol·L-1,此时水中c(OH-) 为 mol·L-1,此时水的温度最接近 ℃。
水的电离是吸热过程,升高温
度,水的电离向吸热方向移动,因而Kw增大
=
>
6.1×10-7
90
(2)0.1 mol·L-1 HCl溶液中有OH-吗?0.1 mol·L-1 NaOH溶液中有H+吗? 解释原因。
。
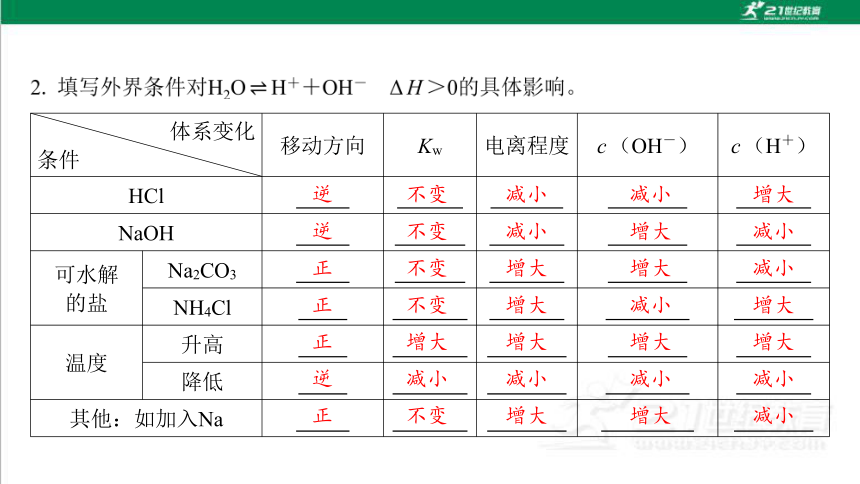
体系变化
条件 移动方向 Kw 电离程度 c(OH-) c(H+)
HCl
NaOH
可水解
的盐 Na2CO3
NH4Cl
温度 升高
降低
其他:如加入Na
逆
不变
减小
减小
增大
逆
不变
减小
增大
减小
正
不变
增大
增大
减小
正
不变
增大
减小
增大
正
增大
增大
增大
增大
逆
减小
减小
减小
减小
正
不变
增大
增大
减小
A. 向水中加入稀NaOH溶液,平衡逆向移动,c(OH-)降低
B. 向水中加入少量硫酸氢钠固体,c(H+)增大,Kw不变
C. 降低温度,使平衡向右移动,c(H+)增大,溶液呈酸性
D. 将水加热,Kw增大,pH不变
解析:加入NaOH溶液,c(OH-)增大,A错误;加入NaHSO4固体,在水溶液中 NaHSO4电离出H+,c(H+)增大,平衡逆向移动,Kw不变,B正确;降低温度,平 衡向左移动,c(H+)减小,溶液仍然呈中性,C错误;加热,促进水的电离,Kw增 大,c(H+)增大,pH应变小,D错误。
B
A. 该溶液可能呈中性
C. 该溶液的pH可能为4,也可能为10
D. 该溶液中水的电离受到促进
C
D
二、Kw的应用
1. 同一曲线上任意点的Kw都 ,即c(H+)·c(OH-) ,如Kw (A) Kw(D)。
2. 曲线外任意点与曲线上任意点的Kw不同、温度不同,如Kw(A) Kw(C)
Kw(B)。
相同
相同
=
<
<
3. 实现曲线上点之间的转化需保持温度不变,改变溶液的酸碱性;实现曲线上点与 曲线外点之间的转化必须改变温度。
A. 纯水仅升高温度,可从a点变到c点
B. 水的电离常数Kw数值大小关系为d>c>b
C. a点温度下,向水中加入1 mol/L硫酸,促进水的电离
D. c点pH=6,溶液为酸性
D
2. (2025·甘肃兰州一中高二期中)在水的电离平衡中,c(H+)和c(OH-)的关 系如图所示。
(1)下列说法正确的是 (填字母)。
a.图中A、B、D三点处Kw的大小关系:B>A=D
b.在T1温度下,向水中加入少量的NaOH可实现由A点向D点移动
c.AB线上任意点的溶液均呈中性
d.图中温度T1>T2
解析:(1)题图中A、B、D三点处Kw的大小分别为1×10-14、1×10-12、1×10- 14,Kw的大小关系:B>A=D,a正确;在T1温度下,A点向D点移动,c(H+)变 大,向水中加入少量的NaOH会使c(H+)变小,b错误;AB线上任意点的溶液中c (H+)=c(OH-),溶液均呈中性,c正确;水电离是吸热反应,温度越高,Kw越 大,B点的Kw大于A点的Kw,则题图中温度T1<T2,d错误。
ac
(2)T1温度下,氢离子浓度为0.01 mol·L-1的HCl溶液和氢氧根离子浓度为0.001 mol·L-1的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1 (填 “>”“=”或“<”)α2。
<
1×10-10 mol·L-1
1×10-10 mol·L-1
题后归纳
25 ℃时,由水电离出的c水(H+)或
c水(OH-)的5种类型的计算方法
(2)酸的溶液:H+来源于酸电离和水电离,而OH-只来源于水电离,故有c水 (OH-)=c水(H+)=c溶液(OH-)。
(3)碱的溶液:OH-来源于碱电离和水电离,而H+只来源于水电离,故有c水 (H+)=c水(OH-)=c溶液(H+)。
课时作业(十七) 水的电离
[对点训练]
题组一 水的电离与Kw
A. 水的电离过程需要通电
B. 加入电解质一定会破坏水的电离平衡
C. 水的离子积仅适用于纯水
D. 升高温度,纯水中c(OH-)增大
解析:水的电离不需要通电,故A错误;加入电解质不一定会破坏水的电离平衡,如 向水中加入强酸强碱盐氯化钠或硫酸钠等,水的电离平衡不移动,故B错误;水的离 子积适用于稀的电解质溶液及纯水,故C错误;水的电离是吸热过程,温度升高,水 的电离平衡向右移动,氢氧根离子浓度增大,故D正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 因为水的离子积常数的表达式是Kw=c(H+)·c(OH-),所以Kw随溶液中c (H+)和c(OH-)的变化而变化
B. 水的离子积常数Kw与水的电离平衡常数K电离是同一个物理量
C. 水的离子积常数是温度的函数,随着温度的变化而变化
D. 水的离子积常数Kw与水的电离平衡常数K电离是两个没有任何关系的物理量
解析:水的离子积常数的表达式是Kw=c(H+)·c(OH-),但是Kw是温度的函 数,不随溶液中c(H+)和c(OH-)的变化而变化,A错误,C正确;水的离子积 常数Kw=K电离·c(H2O),B、D错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
题组二 影响水的电离平衡的因素
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)减小
B. 向水中加入少量NaHSO4固体,c(H+ )增大,Kw 不变
C. 将水加热,平衡逆向移动,c(H+)减小
D. 将水加热,Kw增大,c(H+)减小
解析:向水中加入稀氨水,c(OH-)增大,水的电离平衡逆向移动,故A错误;Kw 只与温度有关,向水中加入少量NaHSO4固体,c(H+)增大,Kw不变,故B正确; 水的电离过程吸热,将水加热,水的电离平衡正向移动,Kw增大,c(H+)增大, 故C、D错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. ③>②>① B. ②>③>①
C. ①>②>③ D. ③>①>②
解析:NaOH、H2SO4抑制水的电离,NaCl不影响水的电离平衡,H2SO4为二元强酸, 相同物质的量浓度时,H2SO4电离产生的c(H+)大于NaOH电离产生的c(OH-),
对水的抑制程度更大,故水的电离程度按由大到小的顺序为①>②>③。
C
1
2
3
4
5
6
7
8
9
10
11
12
题组三 水的离子积常数的应用
A. 1∶10∶104∶105
B. 1∶5∶(5×109)∶(5×108)
C. 1∶20∶1010∶109
D. 1∶10∶104∶109
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:①pH=0的H2SO4溶液中c(H+)=1 mol·L-1,c(OH-)=10-14 mol·L-1, H2SO4抑制H2O的电离,则由H2O电离出的c(H+)=10-14 mol·L-1;②0.05 mol·L- 1的Ba(OH)2溶液中c(OH-)=0.1 mol·L-1,c(H+)=10-13 mol·L-1,Ba (OH)2 抑制H2O的电离,则由H2O电离出的c(H+)=10-13mol·L-1;③pH=10的 氨水,抑制H2O的电离,由H2O电离出的c(H+)=1×10-10 mol·L-1;④pH=5的 H2SO3溶液,由H2O电离出的c(H+)=10-9 mol·L-1。等体积的4种溶液中发生电离 的H2O的物质的量之比等于H2O电离产生的H+的物质的量浓度之比,其比为10- 14∶10-13∶10-10∶10-9=1∶10∶104∶105。
1
2
3
4
5
6
7
8
9
10
11
12
A. b点温度高于25 ℃
B. 向水中通入氨气,由水电离出的c(H+)减小
C. 仅升高温度,可从b点变为a点
D. b点所处温度下,0.1 mol·L-1 KOH溶液的pH=13
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:由题图可知,b点对应的pOH=pH=6.5,则有c(H+)=c(OH-)=10-6.5 mol·L-1,Kw=c(H+)·c(OH-)=10-6.5×10-6.5=1×10-13>Kw(25 ℃),故 b点温度高于25 ℃,A正确;向水中通入氨气,c(OH-)增大,抑制了水的电离, 则由水电离出的c(H+)减小,B正确;升高温度,水的电离平衡正向移动,
c(H+)、c(OH-)均增大,则pH、pOH均减小,且二者相等,故升高温度,可从b点变为a点,C正确;b点对应的Kw=1×10-13,0.1 mol·L-1 KOH溶液中c(H+)= 1×10-12 mol·L-1,则溶液的pH=12,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
A. T>25 ℃
B. 该溶液中由水电离出来的c(H+)=1.0×10-11 mol·L-1
C. 该溶液中c(OH-)=1.0×10-11 mol·L-1
D. 加入NaHSO4后水的电离程度增大
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 100 ℃时,Kw=10-12,此温度下pH=7的溶液一定呈中性
B. 常温下0.1 mol·L-1的NaHSO4溶液中水电离出c(H+)=0.1 mol·L-1
C. 25 ℃时,0.01 mol·L-1的烧碱溶液,水电离出的c(H+)=1×10-12 mol·L-1
D. 常温下,由水电离出的c(H+)=1×10-12 mol·L-1的溶液一定呈碱性
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. d点对应的溶液中可能大量存在:Na+、K+、ClO-、Cl-
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:d点时Kw=1×10-12,氢离子浓度为10-7 mol·L-1,氢氧根离子浓度为10-5 mol·L-1,此时溶液呈碱性,碱性溶液中Na+、K+、ClO-、Cl-相互之间不反应,能 大量共存,A项正确;b点溶液中氢离子浓度为10-6 mol·L-1,氢氧根离子浓度为10-8 mol·L-1,溶液呈酸性,酸性条件下,亚铁离子、氢离子、硝酸根离子能发生氧化还 原反应,不能大量共存,B项错误;c点对应的溶液中氢离子浓度等于氢氧根离子浓 度,溶液呈中性,溶液中钡离子与硫酸根离子反应生成硫酸钡沉淀而不能大量共存, C项错误;a点对应的溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性,中性溶液 中碳酸根离子与氢离子发生复分解反应而不能大量共存,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. A点温度大于25 ℃,B点温度为25 ℃
B. B点pH=6,溶液为酸性
C. A点温度下,在水中加入少量的盐可能抑制水的电离
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. (2025·四川攀枝花高二期中)(1)在不同温度下的水溶液中离子浓度曲线如图 所示。
①图中五点Kw间的关系是 (以A、B、C、D、E表示)。
②C点溶液呈 性(填“酸”“中”或“碱”)。
③将D点变为E点,采取的措施是 。
B>C>A=D=E
中
向溶液中滴加碱溶液
1
2
3
4
5
6
7
8
9
10
11
12
解析:(1)①水的电离为吸热过程,温度越高,越促进水的电离,Kw越大,由题图 可知温度B>C>A=D=E,则Kw:B>C>A=D=E;②C点与A点、B点在同一直线 上,由A点、B点数据可知,该线上氢离子浓度等于氢氧根离子浓度,溶液呈中性; ③D点变为E点,c(H+)减小,c(OH-)增大,而温度不变,因此可采取的措施 是向溶液中滴加碱溶液实现;
1
2
3
4
5
6
7
8
9
10
11
12
(2)下表是不同温度下水的离子积数据:
温度/℃ 25 t1 t2
水的离子积常数 1×10-14 Kw 1×10-12
回答下列问题:
>
水的
电离是吸热过程,升高温度,平衡向电离方向移动,c(H+)、c(OH-)均增
大,Kw增大
2.4×10-7
5.76×10-9
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 向水中加入NaHSO4固体
B. 向水中加入少量Na
C. 加热至100 ℃
D. 向水中加入NaCl固体
解析:(3)向水中加入NaHSO4固体,c(H+)增大,平衡左移,溶液呈酸性,A正 确;向水中加入Na会消耗H+,促进水的电离,但溶液呈碱性,B错误;加热至100 ℃,促进水的电离,溶液仍呈中性,C错误;向水中加入NaCl固体,不影响水的电 离,溶液呈中性,D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
12. (1)T ℃时,水的Kw=1×10-13,则该温度 (填“>”“<”或 “=”)25 ℃,其理由是 。
解析:(1)升高温度,促进水的电离,Kw增大,由于Kw=1×10-13>1×10-14,因 此该温度大于25 ℃。
(2)在(1)中所述温度下,c(H+)=1×10-7 mol·L-1的溶液呈 (填 “酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由水电离出的c (OH-)= mol·L-1。
>
升高温度,促进水的电离,Kw增大
碱性
1×10-7
1
2
3
4
5
6
7
8
9
10
11
12
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 (填“向 左”“向右”或“不”,下同)移动。在新制氯水中加入少量NaCl固体,水的电离平 衡 移动。
(4)25 ℃时,pH=4的盐酸中水的电离程度 (填“大于”“小于”或“等 于”)pH=10的Ba(OH)2溶液中水的电离程度。
向右
向右
等于
1
2
3
4
5
6
7
8
9
10
11
12
(5)0.1 mol·L-1乙酸(甲,Ka=1.75×10-5)和0.1 mol·L-1氯乙酸(乙,Ka= 1.4×10-3)的水溶液,下列可以表示两溶液中由水电离出的c(H+)与加入水的体 积(V)之间关系的是 (填字母)。
c
1
2
3
4
5
6
7
8
9
10
11
12
解析:(5)乙酸的Ka小于氯乙酸的Ka,所以0.1 mol·L-1乙酸溶液中的c(H+)小于 0.1 mol·L-1氯乙酸溶液中的c(H+),故水的电离程度:0.1 mol·L-1的乙酸溶液 (甲)大于0.1 mol·L-1的氯乙酸溶液(乙),加水稀释,两溶液中的c(H+)均减 小,水的电离程度均增大,故选c。
1
2
3
4
5
6
7
8
9
10
11
12
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第1课时 水的电离
【学习目标】 1.认识水的电离,了解水的离子积常数。2.认识溶液的酸碱性及 pH,掌握测量溶液pH、酸碱中和滴定的方法。3.能进行溶液pH的简单计算,能用实 例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
一、水的电离
1. 水的电离
2. 水的离子积常数
概念 当水的电离达到平衡时, 是一个常数,这 个常数叫做水的离子积常数,简称 ,记作Kw
表达式 ,25 ℃时,Kw=
影响
因素 只与 有关,升高温度Kw ,与溶液的酸碱性
适用
范围 适用于 和稀的
电离产物H+和OH-浓度之积
水的离子积
Kw=c(H+)·c(OH-)
1.0×10-14
温度
增大
无关
纯水
电解质溶液
3. 外界条件对水电离平衡的影响
(1)温度:温度升高, 水的电离,Kw 。
(2)酸、碱 水的电离,Kw 。
(3)外加能与H+、OH-反应的物质,会促进水的电离,Kw不变。
促进
增大
抑制
不变
【思考交流】
1. (1)观察下表,填空。
t/℃ 0 10 20 25 40 50 90 100
Kw/10-14 0.115 0.296 0.687 1.01 2.87 5.31 37.1 54.5
②100 ℃纯水中:c(H+) c(OH-) 1.0×10-7 mol·L-1。
③某温度下,纯水中的c(H+)=6.1×10-7 mol·L-1,此时水中c(OH-) 为 mol·L-1,此时水的温度最接近 ℃。
水的电离是吸热过程,升高温
度,水的电离向吸热方向移动,因而Kw增大
=
>
6.1×10-7
90
(2)0.1 mol·L-1 HCl溶液中有OH-吗?0.1 mol·L-1 NaOH溶液中有H+吗? 解释原因。
。
体系变化
条件 移动方向 Kw 电离程度 c(OH-) c(H+)
HCl
NaOH
可水解
的盐 Na2CO3
NH4Cl
温度 升高
降低
其他:如加入Na
逆
不变
减小
减小
增大
逆
不变
减小
增大
减小
正
不变
增大
增大
减小
正
不变
增大
减小
增大
正
增大
增大
增大
增大
逆
减小
减小
减小
减小
正
不变
增大
增大
减小
A. 向水中加入稀NaOH溶液,平衡逆向移动,c(OH-)降低
B. 向水中加入少量硫酸氢钠固体,c(H+)增大,Kw不变
C. 降低温度,使平衡向右移动,c(H+)增大,溶液呈酸性
D. 将水加热,Kw增大,pH不变
解析:加入NaOH溶液,c(OH-)增大,A错误;加入NaHSO4固体,在水溶液中 NaHSO4电离出H+,c(H+)增大,平衡逆向移动,Kw不变,B正确;降低温度,平 衡向左移动,c(H+)减小,溶液仍然呈中性,C错误;加热,促进水的电离,Kw增 大,c(H+)增大,pH应变小,D错误。
B
A. 该溶液可能呈中性
C. 该溶液的pH可能为4,也可能为10
D. 该溶液中水的电离受到促进
C
D
二、Kw的应用
1. 同一曲线上任意点的Kw都 ,即c(H+)·c(OH-) ,如Kw (A) Kw(D)。
2. 曲线外任意点与曲线上任意点的Kw不同、温度不同,如Kw(A) Kw(C)
Kw(B)。
相同
相同
=
<
<
3. 实现曲线上点之间的转化需保持温度不变,改变溶液的酸碱性;实现曲线上点与 曲线外点之间的转化必须改变温度。
A. 纯水仅升高温度,可从a点变到c点
B. 水的电离常数Kw数值大小关系为d>c>b
C. a点温度下,向水中加入1 mol/L硫酸,促进水的电离
D. c点pH=6,溶液为酸性
D
2. (2025·甘肃兰州一中高二期中)在水的电离平衡中,c(H+)和c(OH-)的关 系如图所示。
(1)下列说法正确的是 (填字母)。
a.图中A、B、D三点处Kw的大小关系:B>A=D
b.在T1温度下,向水中加入少量的NaOH可实现由A点向D点移动
c.AB线上任意点的溶液均呈中性
d.图中温度T1>T2
解析:(1)题图中A、B、D三点处Kw的大小分别为1×10-14、1×10-12、1×10- 14,Kw的大小关系:B>A=D,a正确;在T1温度下,A点向D点移动,c(H+)变 大,向水中加入少量的NaOH会使c(H+)变小,b错误;AB线上任意点的溶液中c (H+)=c(OH-),溶液均呈中性,c正确;水电离是吸热反应,温度越高,Kw越 大,B点的Kw大于A点的Kw,则题图中温度T1<T2,d错误。
ac
(2)T1温度下,氢离子浓度为0.01 mol·L-1的HCl溶液和氢氧根离子浓度为0.001 mol·L-1的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1 (填 “>”“=”或“<”)α2。
<
1×10-10 mol·L-1
1×10-10 mol·L-1
题后归纳
25 ℃时,由水电离出的c水(H+)或
c水(OH-)的5种类型的计算方法
(2)酸的溶液:H+来源于酸电离和水电离,而OH-只来源于水电离,故有c水 (OH-)=c水(H+)=c溶液(OH-)。
(3)碱的溶液:OH-来源于碱电离和水电离,而H+只来源于水电离,故有c水 (H+)=c水(OH-)=c溶液(H+)。
课时作业(十七) 水的电离
[对点训练]
题组一 水的电离与Kw
A. 水的电离过程需要通电
B. 加入电解质一定会破坏水的电离平衡
C. 水的离子积仅适用于纯水
D. 升高温度,纯水中c(OH-)增大
解析:水的电离不需要通电,故A错误;加入电解质不一定会破坏水的电离平衡,如 向水中加入强酸强碱盐氯化钠或硫酸钠等,水的电离平衡不移动,故B错误;水的离 子积适用于稀的电解质溶液及纯水,故C错误;水的电离是吸热过程,温度升高,水 的电离平衡向右移动,氢氧根离子浓度增大,故D正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 因为水的离子积常数的表达式是Kw=c(H+)·c(OH-),所以Kw随溶液中c (H+)和c(OH-)的变化而变化
B. 水的离子积常数Kw与水的电离平衡常数K电离是同一个物理量
C. 水的离子积常数是温度的函数,随着温度的变化而变化
D. 水的离子积常数Kw与水的电离平衡常数K电离是两个没有任何关系的物理量
解析:水的离子积常数的表达式是Kw=c(H+)·c(OH-),但是Kw是温度的函 数,不随溶液中c(H+)和c(OH-)的变化而变化,A错误,C正确;水的离子积 常数Kw=K电离·c(H2O),B、D错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
题组二 影响水的电离平衡的因素
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)减小
B. 向水中加入少量NaHSO4固体,c(H+ )增大,Kw 不变
C. 将水加热,平衡逆向移动,c(H+)减小
D. 将水加热,Kw增大,c(H+)减小
解析:向水中加入稀氨水,c(OH-)增大,水的电离平衡逆向移动,故A错误;Kw 只与温度有关,向水中加入少量NaHSO4固体,c(H+)增大,Kw不变,故B正确; 水的电离过程吸热,将水加热,水的电离平衡正向移动,Kw增大,c(H+)增大, 故C、D错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. ③>②>① B. ②>③>①
C. ①>②>③ D. ③>①>②
解析:NaOH、H2SO4抑制水的电离,NaCl不影响水的电离平衡,H2SO4为二元强酸, 相同物质的量浓度时,H2SO4电离产生的c(H+)大于NaOH电离产生的c(OH-),
对水的抑制程度更大,故水的电离程度按由大到小的顺序为①>②>③。
C
1
2
3
4
5
6
7
8
9
10
11
12
题组三 水的离子积常数的应用
A. 1∶10∶104∶105
B. 1∶5∶(5×109)∶(5×108)
C. 1∶20∶1010∶109
D. 1∶10∶104∶109
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:①pH=0的H2SO4溶液中c(H+)=1 mol·L-1,c(OH-)=10-14 mol·L-1, H2SO4抑制H2O的电离,则由H2O电离出的c(H+)=10-14 mol·L-1;②0.05 mol·L- 1的Ba(OH)2溶液中c(OH-)=0.1 mol·L-1,c(H+)=10-13 mol·L-1,Ba (OH)2 抑制H2O的电离,则由H2O电离出的c(H+)=10-13mol·L-1;③pH=10的 氨水,抑制H2O的电离,由H2O电离出的c(H+)=1×10-10 mol·L-1;④pH=5的 H2SO3溶液,由H2O电离出的c(H+)=10-9 mol·L-1。等体积的4种溶液中发生电离 的H2O的物质的量之比等于H2O电离产生的H+的物质的量浓度之比,其比为10- 14∶10-13∶10-10∶10-9=1∶10∶104∶105。
1
2
3
4
5
6
7
8
9
10
11
12
A. b点温度高于25 ℃
B. 向水中通入氨气,由水电离出的c(H+)减小
C. 仅升高温度,可从b点变为a点
D. b点所处温度下,0.1 mol·L-1 KOH溶液的pH=13
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:由题图可知,b点对应的pOH=pH=6.5,则有c(H+)=c(OH-)=10-6.5 mol·L-1,Kw=c(H+)·c(OH-)=10-6.5×10-6.5=1×10-13>Kw(25 ℃),故 b点温度高于25 ℃,A正确;向水中通入氨气,c(OH-)增大,抑制了水的电离, 则由水电离出的c(H+)减小,B正确;升高温度,水的电离平衡正向移动,
c(H+)、c(OH-)均增大,则pH、pOH均减小,且二者相等,故升高温度,可从b点变为a点,C正确;b点对应的Kw=1×10-13,0.1 mol·L-1 KOH溶液中c(H+)= 1×10-12 mol·L-1,则溶液的pH=12,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
A. T>25 ℃
B. 该溶液中由水电离出来的c(H+)=1.0×10-11 mol·L-1
C. 该溶液中c(OH-)=1.0×10-11 mol·L-1
D. 加入NaHSO4后水的电离程度增大
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 100 ℃时,Kw=10-12,此温度下pH=7的溶液一定呈中性
B. 常温下0.1 mol·L-1的NaHSO4溶液中水电离出c(H+)=0.1 mol·L-1
C. 25 ℃时,0.01 mol·L-1的烧碱溶液,水电离出的c(H+)=1×10-12 mol·L-1
D. 常温下,由水电离出的c(H+)=1×10-12 mol·L-1的溶液一定呈碱性
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. d点对应的溶液中可能大量存在:Na+、K+、ClO-、Cl-
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:d点时Kw=1×10-12,氢离子浓度为10-7 mol·L-1,氢氧根离子浓度为10-5 mol·L-1,此时溶液呈碱性,碱性溶液中Na+、K+、ClO-、Cl-相互之间不反应,能 大量共存,A项正确;b点溶液中氢离子浓度为10-6 mol·L-1,氢氧根离子浓度为10-8 mol·L-1,溶液呈酸性,酸性条件下,亚铁离子、氢离子、硝酸根离子能发生氧化还 原反应,不能大量共存,B项错误;c点对应的溶液中氢离子浓度等于氢氧根离子浓 度,溶液呈中性,溶液中钡离子与硫酸根离子反应生成硫酸钡沉淀而不能大量共存, C项错误;a点对应的溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性,中性溶液 中碳酸根离子与氢离子发生复分解反应而不能大量共存,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. A点温度大于25 ℃,B点温度为25 ℃
B. B点pH=6,溶液为酸性
C. A点温度下,在水中加入少量的盐可能抑制水的电离
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. (2025·四川攀枝花高二期中)(1)在不同温度下的水溶液中离子浓度曲线如图 所示。
①图中五点Kw间的关系是 (以A、B、C、D、E表示)。
②C点溶液呈 性(填“酸”“中”或“碱”)。
③将D点变为E点,采取的措施是 。
B>C>A=D=E
中
向溶液中滴加碱溶液
1
2
3
4
5
6
7
8
9
10
11
12
解析:(1)①水的电离为吸热过程,温度越高,越促进水的电离,Kw越大,由题图 可知温度B>C>A=D=E,则Kw:B>C>A=D=E;②C点与A点、B点在同一直线 上,由A点、B点数据可知,该线上氢离子浓度等于氢氧根离子浓度,溶液呈中性; ③D点变为E点,c(H+)减小,c(OH-)增大,而温度不变,因此可采取的措施 是向溶液中滴加碱溶液实现;
1
2
3
4
5
6
7
8
9
10
11
12
(2)下表是不同温度下水的离子积数据:
温度/℃ 25 t1 t2
水的离子积常数 1×10-14 Kw 1×10-12
回答下列问题:
>
水的
电离是吸热过程,升高温度,平衡向电离方向移动,c(H+)、c(OH-)均增
大,Kw增大
2.4×10-7
5.76×10-9
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 向水中加入NaHSO4固体
B. 向水中加入少量Na
C. 加热至100 ℃
D. 向水中加入NaCl固体
解析:(3)向水中加入NaHSO4固体,c(H+)增大,平衡左移,溶液呈酸性,A正 确;向水中加入Na会消耗H+,促进水的电离,但溶液呈碱性,B错误;加热至100 ℃,促进水的电离,溶液仍呈中性,C错误;向水中加入NaCl固体,不影响水的电 离,溶液呈中性,D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
12. (1)T ℃时,水的Kw=1×10-13,则该温度 (填“>”“<”或 “=”)25 ℃,其理由是 。
解析:(1)升高温度,促进水的电离,Kw增大,由于Kw=1×10-13>1×10-14,因 此该温度大于25 ℃。
(2)在(1)中所述温度下,c(H+)=1×10-7 mol·L-1的溶液呈 (填 “酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由水电离出的c (OH-)= mol·L-1。
>
升高温度,促进水的电离,Kw增大
碱性
1×10-7
1
2
3
4
5
6
7
8
9
10
11
12
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 (填“向 左”“向右”或“不”,下同)移动。在新制氯水中加入少量NaCl固体,水的电离平 衡 移动。
(4)25 ℃时,pH=4的盐酸中水的电离程度 (填“大于”“小于”或“等 于”)pH=10的Ba(OH)2溶液中水的电离程度。
向右
向右
等于
1
2
3
4
5
6
7
8
9
10
11
12
(5)0.1 mol·L-1乙酸(甲,Ka=1.75×10-5)和0.1 mol·L-1氯乙酸(乙,Ka= 1.4×10-3)的水溶液,下列可以表示两溶液中由水电离出的c(H+)与加入水的体 积(V)之间关系的是 (填字母)。
c
1
2
3
4
5
6
7
8
9
10
11
12
解析:(5)乙酸的Ka小于氯乙酸的Ka,所以0.1 mol·L-1乙酸溶液中的c(H+)小于 0.1 mol·L-1氯乙酸溶液中的c(H+),故水的电离程度:0.1 mol·L-1的乙酸溶液 (甲)大于0.1 mol·L-1的氯乙酸溶液(乙),加水稀释,两溶液中的c(H+)均减 小,水的电离程度均增大,故选c。
1
2
3
4
5
6
7
8
9
10
11
12
