人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第二节水的电离和溶液的pH第2课时溶液的酸碱性与pH课件(共68张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第二节水的电离和溶液的pH第2课时溶液的酸碱性与pH课件(共68张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 7.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-25 17:17:25 | ||
图片预览











文档简介
(共68张PPT)
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第2课时 溶液的酸碱性与pH
一、溶液的酸碱性与pH
H+
OH-
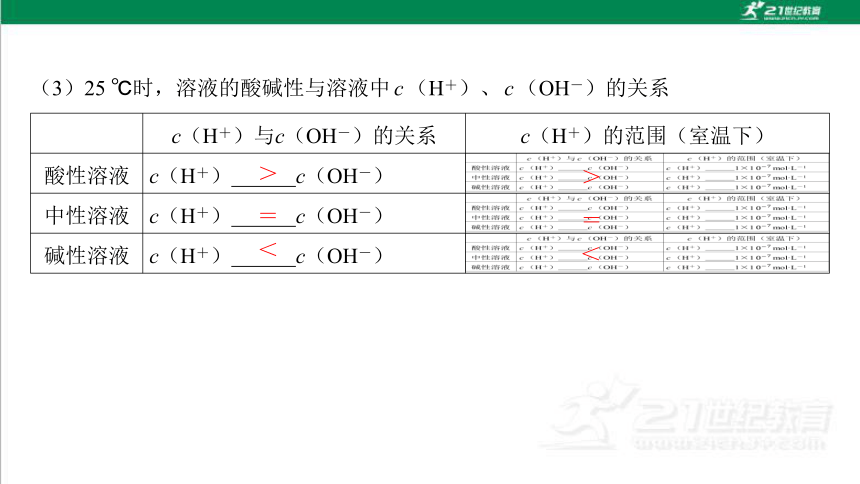
(3)25 ℃时,溶液的酸碱性与溶液中c(H+)、c(OH-)的关系
c(H+)与c(OH-)的关系 c(H+)的范围(室温下)
酸性溶液 c(H+) c(OH-)
中性溶液 c(H+) c(OH-)
碱性溶液 c(H+) c(OH-)
>
>
=
=
<
<
2. 溶液的酸碱性与pH
(1)pH
(2)溶液的酸碱性与pH的关系(常温下)
(3)溶液酸碱性的测定方法
①酸碱指示剂法
指示剂 pH变色范围 酸色 中间色 碱色
甲基橙 色
pH<3.1 橙色 色
pH>4.4
石蕊 色
pH<5.0 紫色 色
pH>8.0
酚酞 无色
pH<8.2 浅红色 色
pH>10.0
3.1~4.4
红
黄
5.0~8.0
红
蓝
8.2~10.0
红
玻璃片或表面皿上
标准比色卡
【特别提醒】
(1)pH=7的溶液不一定呈中性。只有在常温下pH=7的溶液才呈中性,当在100 ℃ 时,水的离子积常数为1×10-12,此时pH=6的溶液为中性溶液,pH>6时为碱性溶 液,pH<6时为酸性溶液。
(2)使用pH试纸测溶液pH时,若先用蒸馏水润湿,测量结果不一定偏小。若先用蒸 馏水润湿,相当于将待测液稀释了,若待测液为碱性溶液,则所测结果偏小;若待测 液为酸性溶液,则所测结果偏大;若待测液为中性溶液,则所测结果没有误差。
(4)pH的应用
①在医学上,血液的pH是诊断疾病的一个重要参数。
②在日常生活中,人们洗发时用的护发素具有调节头发pH使之达到适宜的酸碱度的 功能。
③在环保领域,酸性或碱性废水的处理常常利用中和反应。
④在农业生产中,调节土壤的pH,使土壤更适宜农作物生长。
⑤在科学实验和工业生产中,溶液pH的控制常常是影响实验结果或产品质量、产量 的一个重要因素。
√
×
×
×
×
B. 25 ℃时,使石蕊试液呈紫色的溶液
C. pH=7的溶液
D. 酸与碱恰好完全反应生成的溶液
A
A. 测得某浓度的NaClO溶液的pH为10
B. 常温下用广泛pH试纸测得NH4Cl溶液pH约为4.1
C. 用湿润的pH试纸测pH相同的盐酸和CH3COOH溶液的pH,误差较大的是盐酸
D. 在试管内放入少量溶液并煮沸,把pH试纸放在试管口观察其颜色并与标准比色卡 比较
C
解析:NaClO溶液具有漂白性,会将pH试纸漂白,故不能用pH试纸测定其pH,故A 错误;广泛pH试纸测定的溶液的pH的数值为整数,故B错误;稀释时,醋酸还会继续 电离出氢离子,故稀释pH相同的盐酸和醋酸时,醋酸的氢离子浓度变化小,pH变化 小,故用湿润的pH试纸测pH相同的盐酸和醋酸的pH,误差较大的是盐酸,故C正 确;在试管内放入少量溶液并煮沸,把pH试纸放在试管口,无法测定溶液的pH,故 D错误。
A. a=b
B. 混合溶液的pH=7
D. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
C
二、pH的计算
(2)混合溶液pH的计算
①强酸溶液与强酸溶液混合
强酸溶液与强酸溶液等体积混合,若pH差值≥2,混合后pH=pH小+0.3。
②强碱溶液与强碱溶液混合
强碱溶液与强碱溶液等体积混合,若pH差值≥2,混合后pH=pH大-0.3。
(3)强酸溶液与强碱溶液混合
常温下,若恰好完全反应,溶液呈中性,pH=7;
酸过量:
pH=-lg c混(H+);
碱过量:
1. (1)在25 ℃时,有pH为x的盐酸和pH为y的NaOH溶液,取Vx L该盐酸同该NaOH 溶液中和,需Vy L NaOH溶液。回答下列问题:
1
10x+y-14
>
(2)25 ℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混 合,恰好中和,且已知:Va<Vb和a=0.5b。请回答下列问题:
③a的取值范围是 。
否
a=3时,b=6,溶液
呈酸性与题意的强碱溶液不符合
否
a=5时,b=10,满
14>1,从而可推出Va>Vb与题意Va<Vb不符合
2. 计算25 ℃时下列溶液的pH。
(1)0.005 mol·L-1的H2SO4溶液的pH= 。
解析:(1)c(H2SO4)=0.005 mol·L-1,c(H+)=0.01 mol·L-1,pH=2。
(2)0.001 mol·L-1的NaOH溶液的pH= 。
2
11
(3)将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合,混合溶液的 pH≈ (已知:lg 2=0.3)。
(4)0.015 mol·L-1的硫酸与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH = 。
9.7
2
题后归纳
三、溶液稀释和混合pH的变化
1. 酸碱溶液混合后酸碱性的判断规律
(1)等浓度等体积的一元酸与一元碱混合的溶液——“谁强显谁性,同强显中 性”。
(2)室温下c酸(H+)=c碱(OH-),即pH之和等于14时,一强一弱等体积混合— —“谁弱谁过量,谁弱显谁性”。
(3)已知强酸和强碱的pH,等体积混合(25 ℃时):
①pH之和等于14,呈中性;
②pH之和小于14,呈酸性;
③pH之和大于14,呈碱性。
2. 溶液稀释后pH变化规律
(1)酸、碱溶液稀释时pH的计算
溶液 酸(pH=a) 碱(pH=b)
弱酸 强酸 弱碱 强碱
稀释10n倍 pH<a+n<7 pH=a+n<7 pH>b-n>7 pH=b-n>7
无限稀释 此时考虑水的电离,pH只能接近7 (略小于7) 此时考虑水的电离,pH只能接近7 (略大于7)
(2)酸、碱溶液稀释时pH的变化图像
①等体积、等浓度的盐酸、醋酸
加水稀释相同的倍数,醋酸的 pH 加水稀释到相同的pH, 加入的水多
大
盐酸
②相同体积、相同pH的盐酸、醋酸
加水稀释相同的倍数,盐酸的 pH 加水稀释到相同的pH, 加入的水多
大
醋酸
③pH与稀释倍数的线性关系
HY为 酸,HX为 酸;
a、b两点的溶液中:
c(X-) c(Y-);
水的电离程度: MOH为 碱,ROH为 碱;
起始时,c(ROH) c(MOH);
水的电离程度:
强
弱
=
d>c>a=b
强
弱
>
a>b
A. 稀释前,两种碱溶液中溶质的物质的量浓度一定相等
B. 稀释后,X溶液的碱性比Y溶液的碱性强
C. 完全中和X、Y溶液时,消耗同浓度盐酸的体积VX>VY
D. 若8<a<10,则X、Y都是弱碱
D
解析:X、Y溶液的pH随溶液体积变化的程度不同,所以X、Y溶液的碱性强弱程度不 同,稀释前,两种pH相等的碱溶液中,溶质的物质的量浓度一定不相等,故A错误; 稀释相同倍数后,X溶液的pH比Y溶液的小,即X溶液的碱性比Y溶液的碱性弱,故B 错误;X溶液的pH随溶液稀释变化快,所以X的碱性比Y的强,起始时X、Y溶液的pH 相等,则X溶液的溶质浓度小于Y溶液的溶质浓度,完全中和等体积pH=10的X、Y溶 液时,消耗同浓度盐酸的体积VX<VY,故C错误;X的碱性比Y的强,若X为强碱, 则a=8,若8<a<10,则X、Y都是弱碱,故D正确。
A. 将1 L 0.1 mol·L-1的Ba(OH)2溶液加水到体积为2 L,pH=13
A
A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
D. 恰好中和pH均为2、体积均为V0的三种酸溶液,消耗的NaOH溶液一样多
D
课时作业(十八) 溶液的酸碱性与pH
[对点训练]
题组一 溶液酸碱性的判断
A. 常温下,溶液pH越小,酸性越强,反之,碱性越强
B. pH<7的溶液,可能呈酸性
C. 当溶液中的c(H+)或c(OH-)较小时,用pH表示其酸碱性更为方便
D. 把pH试纸直接插入待测溶液中,测其pH
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:A项,因为pH=-lg c(H+),所以pH越小,c(H+)越大,酸性越强,pH 越大,c(H+)越小,则c(OH-)越大,碱性越强,正确;B项,在室温下,pH< 7的溶液呈酸性,正确;C项,当c(H+)或c(OH-)小于1 mol·L-1时,使用pH表 示其酸碱性更为方便,正确;D项,用pH试纸测溶液pH时,不能把pH试纸直接插入 待测溶液中测pH,正确的做法为取一小片pH试纸,放在干燥、洁净的表面皿或玻璃 片上,用玻璃棒蘸取待测液点于试纸中央,然后与标准比色卡对照读取数据,错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. pH=7的溶液一定呈中性
B. 常温下由水电离的c(OH-)为1×10-8 mol·L-1的溶液一定呈酸性
C. c(H+)<c(OH-)的溶液一定呈碱性
D. c(OH-)=1×10-6 mol·L-1的溶液一定呈碱性
C
1
2
3
4
5
6
7
8
9
10
11
12
解析:pH=7的溶液不一定呈中性,如100 ℃时,水的离子积常数约为10-12,pH=7 时溶液呈碱性,A错误;酸或碱均抑制水的电离,常温下由水电离出来的c(OH-) 为1×10-8 mol·L-1,说明该溶液中水的电离受到抑制,则该溶液可能呈酸性或碱 性,B错误;溶液的酸碱性取决于c(H+)与c(OH-)的相对大小,c(H+)<c (OH-)的溶液一定呈碱性,C正确;c(OH-)=1×10-6 mol·L-1的溶液不一定呈 碱性,如100 ℃时,水的离子积常数约为10-12,c(H+)=c(OH-)=1×10-6 mol·L-1的溶液呈中性,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组二 pH计算
A. 0.05 mol/L H2SO4溶液的pH=1
B. 0.001 mol/L NaOH溶液的pH=11
C. 0.005 mol/L H2SO4溶液与0.01 mol/L NaOH溶液等体积混合,混合溶液的pH为5, 溶液显酸性
D. 完全中和50 mL pH=3的H2SO4溶液,需要50 mL pH=11的NaOH溶液
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 95 ℃纯水的pH<7,说明加热可导致水呈酸性
B. pH=3的醋酸溶液,稀释至10倍后pH>4
C. pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
D. 0.02 mol/L的盐酸与等体积水混合后pH=2
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组三 溶液稀释的规律
A. pH=3的醋酸溶液稀释100倍,pH=5
B. pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol·L-1
C. 将1 L 0.1 mol·L-1的Ba(OH)2溶液稀释为2 L,pH=13
D. pH=8的NaOH溶液稀释100倍,其pH=6
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. a点的c平(HA)大于b点的c平(HB)
D. 水的电离程度:a点溶液大于b点溶液
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:pH相同的酸,稀释相同倍数时,酸性强的酸的pH变化大,酸性较弱的酸的pH 变化小,据此得出酸性:HA>HB,A错误;在这两种酸溶液中,c(H+)≈c(A-),c(H+)≈c(B-),而a点的c(H+)小于b点的c(H+),故a点的c(A-)小于
b点的c(B-),即a点的离子浓度小于b点的离子浓度,故a点的导电能力小于b点的
导电能力,B错误;在稀释前两种酸的pH相同,而两种酸的酸性:HA>HB,故在
稀释前两种酸溶液的浓度:c(HA)<c(HB),故将溶液稀释相同倍数时,酸的
浓度仍有:c(HA)<c(HB),故a点的c平(HA)小于b点的c平(HB),C错误;
b点溶液c(H+)更大,对水的电离抑制更大,则水的电离程度:a点溶液大于b点溶液,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
A. 重水和水两种液体,D2O的电离度大于H2O的
B. 中性D2O的pD<7
C. 1 L含0.01 mol DCl的重水溶液,其pD=2
D. NH4Cl溶于D2O中生成的一水合氨和水合氢离子的化学式分别为NH3·D2O和HD2O+
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 常温时,某物质的溶液中由水电离出的c(H+)=1×10-9 mol/L,则该溶液一定 显酸性
B. 某温度时水的离子积常数Kw=10-13,若将此温度下pH=11的NaOH溶液a L与pH =1的稀硫酸b L混合,若所得混合液pH=2,则a∶b=9∶2
C. 一定温度下,pH=a的氨水,稀释10倍后,其pH=b,则a=b+1
D. 常温下,同pH的硫酸和醋酸溶液中和同浓度同体积的氢氧化钠溶液,消耗酸的体 积:硫酸<醋酸
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 曲线Ⅰ表示NaOH溶液
B. 未稀释前,c(Na+)=c(M+)>c(MOH)
C. a、c两点溶液的离子总浓度相同
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(1)加水稀释过程中,醋酸的电离平衡向 (填“正”或“逆”)方向移动, 原醋酸溶液中水的电离平衡向 (填“正”或“逆”)方向移动。
解析:(1)由弱电解质稀释规律“越稀越电离”可知,加水稀释过程中醋酸电离平 衡正向移动;加水稀释溶液酸性减弱,对水的电离抑制减弱,所以原醋酸溶液中水的 电离平衡正向移动。
(2)a、b、c三点溶液的导电能力强弱关系为 。
解析:(2)电解质溶液导电能力与溶液中离子所带电荷数和离子浓度有关,HCl和 醋酸均是一元酸且a和b点氢离子浓度相等,同时大于c点氢离子浓度,结合电荷守恒 可知a、b、c三点溶液的导电能力强弱关系为a=b>c。
正
正
a=b>c
1
2
3
4
5
6
7
8
9
10
11
12
(3)用等浓度的NaOH溶液和a、b处溶液完全反应,消耗NaOH溶液的体积大小关系 为Va (填“>”“<”或“=”)Vb。
解析:(3)醋酸是弱电解质,不完全电离,a点和b点氢离子浓度相等,但b点醋酸总 浓度大于HCl的,则用等浓度的NaOH溶液和a、b处溶液完全反应,消耗NaOH溶液的 体积大小关系为Va<Vb。
(4)t ℃,蒸馏水的pH=6.5,则Kw= 。该温度下,将pH=3的盐酸与pH =10的NaOH溶液等体积混合,所得溶液的pH= 。
解析:(4)t ℃,蒸馏水的pH=6.5,即蒸馏水中氢离子和氢氧根离子浓度均为10- 6.5 mol/L,则Kw=10-13;pH=3的盐酸中氢离子浓度为10-3 mol/L,结合Kw=10-13 可知,pH=10的NaOH溶液中氢氧根离子浓度为10-3 mol/L,所以二者等体积混合后 溶液呈中性,即所得溶液的pH=6.5。
<
10-13
6.5
1
2
3
4
5
6
7
8
9
10
11
12
Ⅱ.已知常温下几种酸的电离平衡常数如表所示:
化学式 HClO H2CO3
电离平衡常数 Ka=4.0×10-8 Ka1=4.5×10-7,
Ka2=4.7×10-11
1
2
3
4
5
6
7
8
9
10
11
12
12. T ℃下的某溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与 y的关系如图所示。请回答下列问题:
(1)此温度下,水的离子积Kw= ,则T (填“>”“<”或 “=”)25。
解析:(1)此温度下,水的离子积Kw=c(H+)·c(OH-)=10-x·10-y=10-12·100=1×10-12>1×10-14,升温促进水的电离,则T>25。
1×10-12
>
1
2
3
4
5
6
7
8
9
10
11
12
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部 分pH如表所示:
实验序号 Ba(OH)2溶液的体积/mL 盐酸的体积/mL 溶液的pH
① 22.00 0.00 8
② 22.00 18.00 7
③ 22.00 22.00 6
假设溶液混合前后的体积变化忽略不计,则a= ,实验②中由水电离产生的c (OH-)= mol·L-1。
4
1×10-7
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(3)在此温度下,将0.1 mol·L-1 NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下 表中甲、乙、丙、丁不同方式混合:
甲 乙 丙 丁
0.1 mol·L-1 Ba(OH)2溶液体积/mL 10 10 10 10
0.1 mol·L-1 NaHSO4溶液体积/mL 5 10 15 20
中
BaSO4↓+H2O
11
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(4)在25 ℃下,将a mol·L-1 NaCN溶液(显碱性)与0.01 mol·L-1盐酸等体积混 合,反应后测得溶液pH=7,则a (填“>”“<”或“=”)0.01;用含a 的代数式表示HCN的电离常数Ka= 。
>
(100a-1)×10-7
1
2
3
4
5
6
7
8
9
10
11
12
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第2课时 溶液的酸碱性与pH
一、溶液的酸碱性与pH
H+
OH-
(3)25 ℃时,溶液的酸碱性与溶液中c(H+)、c(OH-)的关系
c(H+)与c(OH-)的关系 c(H+)的范围(室温下)
酸性溶液 c(H+) c(OH-)
中性溶液 c(H+) c(OH-)
碱性溶液 c(H+) c(OH-)
>
>
=
=
<
<
2. 溶液的酸碱性与pH
(1)pH
(2)溶液的酸碱性与pH的关系(常温下)
(3)溶液酸碱性的测定方法
①酸碱指示剂法
指示剂 pH变色范围 酸色 中间色 碱色
甲基橙 色
pH<3.1 橙色 色
pH>4.4
石蕊 色
pH<5.0 紫色 色
pH>8.0
酚酞 无色
pH<8.2 浅红色 色
pH>10.0
3.1~4.4
红
黄
5.0~8.0
红
蓝
8.2~10.0
红
玻璃片或表面皿上
标准比色卡
【特别提醒】
(1)pH=7的溶液不一定呈中性。只有在常温下pH=7的溶液才呈中性,当在100 ℃ 时,水的离子积常数为1×10-12,此时pH=6的溶液为中性溶液,pH>6时为碱性溶 液,pH<6时为酸性溶液。
(2)使用pH试纸测溶液pH时,若先用蒸馏水润湿,测量结果不一定偏小。若先用蒸 馏水润湿,相当于将待测液稀释了,若待测液为碱性溶液,则所测结果偏小;若待测 液为酸性溶液,则所测结果偏大;若待测液为中性溶液,则所测结果没有误差。
(4)pH的应用
①在医学上,血液的pH是诊断疾病的一个重要参数。
②在日常生活中,人们洗发时用的护发素具有调节头发pH使之达到适宜的酸碱度的 功能。
③在环保领域,酸性或碱性废水的处理常常利用中和反应。
④在农业生产中,调节土壤的pH,使土壤更适宜农作物生长。
⑤在科学实验和工业生产中,溶液pH的控制常常是影响实验结果或产品质量、产量 的一个重要因素。
√
×
×
×
×
B. 25 ℃时,使石蕊试液呈紫色的溶液
C. pH=7的溶液
D. 酸与碱恰好完全反应生成的溶液
A
A. 测得某浓度的NaClO溶液的pH为10
B. 常温下用广泛pH试纸测得NH4Cl溶液pH约为4.1
C. 用湿润的pH试纸测pH相同的盐酸和CH3COOH溶液的pH,误差较大的是盐酸
D. 在试管内放入少量溶液并煮沸,把pH试纸放在试管口观察其颜色并与标准比色卡 比较
C
解析:NaClO溶液具有漂白性,会将pH试纸漂白,故不能用pH试纸测定其pH,故A 错误;广泛pH试纸测定的溶液的pH的数值为整数,故B错误;稀释时,醋酸还会继续 电离出氢离子,故稀释pH相同的盐酸和醋酸时,醋酸的氢离子浓度变化小,pH变化 小,故用湿润的pH试纸测pH相同的盐酸和醋酸的pH,误差较大的是盐酸,故C正 确;在试管内放入少量溶液并煮沸,把pH试纸放在试管口,无法测定溶液的pH,故 D错误。
A. a=b
B. 混合溶液的pH=7
D. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
C
二、pH的计算
(2)混合溶液pH的计算
①强酸溶液与强酸溶液混合
强酸溶液与强酸溶液等体积混合,若pH差值≥2,混合后pH=pH小+0.3。
②强碱溶液与强碱溶液混合
强碱溶液与强碱溶液等体积混合,若pH差值≥2,混合后pH=pH大-0.3。
(3)强酸溶液与强碱溶液混合
常温下,若恰好完全反应,溶液呈中性,pH=7;
酸过量:
pH=-lg c混(H+);
碱过量:
1. (1)在25 ℃时,有pH为x的盐酸和pH为y的NaOH溶液,取Vx L该盐酸同该NaOH 溶液中和,需Vy L NaOH溶液。回答下列问题:
1
10x+y-14
>
(2)25 ℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混 合,恰好中和,且已知:Va<Vb和a=0.5b。请回答下列问题:
③a的取值范围是 。
否
a=3时,b=6,溶液
呈酸性与题意的强碱溶液不符合
否
a=5时,b=10,满
14>1,从而可推出Va>Vb与题意Va<Vb不符合
2. 计算25 ℃时下列溶液的pH。
(1)0.005 mol·L-1的H2SO4溶液的pH= 。
解析:(1)c(H2SO4)=0.005 mol·L-1,c(H+)=0.01 mol·L-1,pH=2。
(2)0.001 mol·L-1的NaOH溶液的pH= 。
2
11
(3)将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合,混合溶液的 pH≈ (已知:lg 2=0.3)。
(4)0.015 mol·L-1的硫酸与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH = 。
9.7
2
题后归纳
三、溶液稀释和混合pH的变化
1. 酸碱溶液混合后酸碱性的判断规律
(1)等浓度等体积的一元酸与一元碱混合的溶液——“谁强显谁性,同强显中 性”。
(2)室温下c酸(H+)=c碱(OH-),即pH之和等于14时,一强一弱等体积混合— —“谁弱谁过量,谁弱显谁性”。
(3)已知强酸和强碱的pH,等体积混合(25 ℃时):
①pH之和等于14,呈中性;
②pH之和小于14,呈酸性;
③pH之和大于14,呈碱性。
2. 溶液稀释后pH变化规律
(1)酸、碱溶液稀释时pH的计算
溶液 酸(pH=a) 碱(pH=b)
弱酸 强酸 弱碱 强碱
稀释10n倍 pH<a+n<7 pH=a+n<7 pH>b-n>7 pH=b-n>7
无限稀释 此时考虑水的电离,pH只能接近7 (略小于7) 此时考虑水的电离,pH只能接近7 (略大于7)
(2)酸、碱溶液稀释时pH的变化图像
①等体积、等浓度的盐酸、醋酸
加水稀释相同的倍数,醋酸的 pH 加水稀释到相同的pH, 加入的水多
大
盐酸
②相同体积、相同pH的盐酸、醋酸
加水稀释相同的倍数,盐酸的 pH 加水稀释到相同的pH, 加入的水多
大
醋酸
③pH与稀释倍数的线性关系
HY为 酸,HX为 酸;
a、b两点的溶液中:
c(X-) c(Y-);
水的电离程度: MOH为 碱,ROH为 碱;
起始时,c(ROH) c(MOH);
水的电离程度:
强
弱
=
d>c>a=b
强
弱
>
a>b
A. 稀释前,两种碱溶液中溶质的物质的量浓度一定相等
B. 稀释后,X溶液的碱性比Y溶液的碱性强
C. 完全中和X、Y溶液时,消耗同浓度盐酸的体积VX>VY
D. 若8<a<10,则X、Y都是弱碱
D
解析:X、Y溶液的pH随溶液体积变化的程度不同,所以X、Y溶液的碱性强弱程度不 同,稀释前,两种pH相等的碱溶液中,溶质的物质的量浓度一定不相等,故A错误; 稀释相同倍数后,X溶液的pH比Y溶液的小,即X溶液的碱性比Y溶液的碱性弱,故B 错误;X溶液的pH随溶液稀释变化快,所以X的碱性比Y的强,起始时X、Y溶液的pH 相等,则X溶液的溶质浓度小于Y溶液的溶质浓度,完全中和等体积pH=10的X、Y溶 液时,消耗同浓度盐酸的体积VX<VY,故C错误;X的碱性比Y的强,若X为强碱, 则a=8,若8<a<10,则X、Y都是弱碱,故D正确。
A. 将1 L 0.1 mol·L-1的Ba(OH)2溶液加水到体积为2 L,pH=13
A
A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
D. 恰好中和pH均为2、体积均为V0的三种酸溶液,消耗的NaOH溶液一样多
D
课时作业(十八) 溶液的酸碱性与pH
[对点训练]
题组一 溶液酸碱性的判断
A. 常温下,溶液pH越小,酸性越强,反之,碱性越强
B. pH<7的溶液,可能呈酸性
C. 当溶液中的c(H+)或c(OH-)较小时,用pH表示其酸碱性更为方便
D. 把pH试纸直接插入待测溶液中,测其pH
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:A项,因为pH=-lg c(H+),所以pH越小,c(H+)越大,酸性越强,pH 越大,c(H+)越小,则c(OH-)越大,碱性越强,正确;B项,在室温下,pH< 7的溶液呈酸性,正确;C项,当c(H+)或c(OH-)小于1 mol·L-1时,使用pH表 示其酸碱性更为方便,正确;D项,用pH试纸测溶液pH时,不能把pH试纸直接插入 待测溶液中测pH,正确的做法为取一小片pH试纸,放在干燥、洁净的表面皿或玻璃 片上,用玻璃棒蘸取待测液点于试纸中央,然后与标准比色卡对照读取数据,错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. pH=7的溶液一定呈中性
B. 常温下由水电离的c(OH-)为1×10-8 mol·L-1的溶液一定呈酸性
C. c(H+)<c(OH-)的溶液一定呈碱性
D. c(OH-)=1×10-6 mol·L-1的溶液一定呈碱性
C
1
2
3
4
5
6
7
8
9
10
11
12
解析:pH=7的溶液不一定呈中性,如100 ℃时,水的离子积常数约为10-12,pH=7 时溶液呈碱性,A错误;酸或碱均抑制水的电离,常温下由水电离出来的c(OH-) 为1×10-8 mol·L-1,说明该溶液中水的电离受到抑制,则该溶液可能呈酸性或碱 性,B错误;溶液的酸碱性取决于c(H+)与c(OH-)的相对大小,c(H+)<c (OH-)的溶液一定呈碱性,C正确;c(OH-)=1×10-6 mol·L-1的溶液不一定呈 碱性,如100 ℃时,水的离子积常数约为10-12,c(H+)=c(OH-)=1×10-6 mol·L-1的溶液呈中性,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组二 pH计算
A. 0.05 mol/L H2SO4溶液的pH=1
B. 0.001 mol/L NaOH溶液的pH=11
C. 0.005 mol/L H2SO4溶液与0.01 mol/L NaOH溶液等体积混合,混合溶液的pH为5, 溶液显酸性
D. 完全中和50 mL pH=3的H2SO4溶液,需要50 mL pH=11的NaOH溶液
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 95 ℃纯水的pH<7,说明加热可导致水呈酸性
B. pH=3的醋酸溶液,稀释至10倍后pH>4
C. pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
D. 0.02 mol/L的盐酸与等体积水混合后pH=2
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组三 溶液稀释的规律
A. pH=3的醋酸溶液稀释100倍,pH=5
B. pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol·L-1
C. 将1 L 0.1 mol·L-1的Ba(OH)2溶液稀释为2 L,pH=13
D. pH=8的NaOH溶液稀释100倍,其pH=6
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. a点的c平(HA)大于b点的c平(HB)
D. 水的电离程度:a点溶液大于b点溶液
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:pH相同的酸,稀释相同倍数时,酸性强的酸的pH变化大,酸性较弱的酸的pH 变化小,据此得出酸性:HA>HB,A错误;在这两种酸溶液中,c(H+)≈c(A-),c(H+)≈c(B-),而a点的c(H+)小于b点的c(H+),故a点的c(A-)小于
b点的c(B-),即a点的离子浓度小于b点的离子浓度,故a点的导电能力小于b点的
导电能力,B错误;在稀释前两种酸的pH相同,而两种酸的酸性:HA>HB,故在
稀释前两种酸溶液的浓度:c(HA)<c(HB),故将溶液稀释相同倍数时,酸的
浓度仍有:c(HA)<c(HB),故a点的c平(HA)小于b点的c平(HB),C错误;
b点溶液c(H+)更大,对水的电离抑制更大,则水的电离程度:a点溶液大于b点溶液,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
A. 重水和水两种液体,D2O的电离度大于H2O的
B. 中性D2O的pD<7
C. 1 L含0.01 mol DCl的重水溶液,其pD=2
D. NH4Cl溶于D2O中生成的一水合氨和水合氢离子的化学式分别为NH3·D2O和HD2O+
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 常温时,某物质的溶液中由水电离出的c(H+)=1×10-9 mol/L,则该溶液一定 显酸性
B. 某温度时水的离子积常数Kw=10-13,若将此温度下pH=11的NaOH溶液a L与pH =1的稀硫酸b L混合,若所得混合液pH=2,则a∶b=9∶2
C. 一定温度下,pH=a的氨水,稀释10倍后,其pH=b,则a=b+1
D. 常温下,同pH的硫酸和醋酸溶液中和同浓度同体积的氢氧化钠溶液,消耗酸的体 积:硫酸<醋酸
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 曲线Ⅰ表示NaOH溶液
B. 未稀释前,c(Na+)=c(M+)>c(MOH)
C. a、c两点溶液的离子总浓度相同
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(1)加水稀释过程中,醋酸的电离平衡向 (填“正”或“逆”)方向移动, 原醋酸溶液中水的电离平衡向 (填“正”或“逆”)方向移动。
解析:(1)由弱电解质稀释规律“越稀越电离”可知,加水稀释过程中醋酸电离平 衡正向移动;加水稀释溶液酸性减弱,对水的电离抑制减弱,所以原醋酸溶液中水的 电离平衡正向移动。
(2)a、b、c三点溶液的导电能力强弱关系为 。
解析:(2)电解质溶液导电能力与溶液中离子所带电荷数和离子浓度有关,HCl和 醋酸均是一元酸且a和b点氢离子浓度相等,同时大于c点氢离子浓度,结合电荷守恒 可知a、b、c三点溶液的导电能力强弱关系为a=b>c。
正
正
a=b>c
1
2
3
4
5
6
7
8
9
10
11
12
(3)用等浓度的NaOH溶液和a、b处溶液完全反应,消耗NaOH溶液的体积大小关系 为Va (填“>”“<”或“=”)Vb。
解析:(3)醋酸是弱电解质,不完全电离,a点和b点氢离子浓度相等,但b点醋酸总 浓度大于HCl的,则用等浓度的NaOH溶液和a、b处溶液完全反应,消耗NaOH溶液的 体积大小关系为Va<Vb。
(4)t ℃,蒸馏水的pH=6.5,则Kw= 。该温度下,将pH=3的盐酸与pH =10的NaOH溶液等体积混合,所得溶液的pH= 。
解析:(4)t ℃,蒸馏水的pH=6.5,即蒸馏水中氢离子和氢氧根离子浓度均为10- 6.5 mol/L,则Kw=10-13;pH=3的盐酸中氢离子浓度为10-3 mol/L,结合Kw=10-13 可知,pH=10的NaOH溶液中氢氧根离子浓度为10-3 mol/L,所以二者等体积混合后 溶液呈中性,即所得溶液的pH=6.5。
<
10-13
6.5
1
2
3
4
5
6
7
8
9
10
11
12
Ⅱ.已知常温下几种酸的电离平衡常数如表所示:
化学式 HClO H2CO3
电离平衡常数 Ka=4.0×10-8 Ka1=4.5×10-7,
Ka2=4.7×10-11
1
2
3
4
5
6
7
8
9
10
11
12
12. T ℃下的某溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与 y的关系如图所示。请回答下列问题:
(1)此温度下,水的离子积Kw= ,则T (填“>”“<”或 “=”)25。
解析:(1)此温度下,水的离子积Kw=c(H+)·c(OH-)=10-x·10-y=10-12·100=1×10-12>1×10-14,升温促进水的电离,则T>25。
1×10-12
>
1
2
3
4
5
6
7
8
9
10
11
12
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部 分pH如表所示:
实验序号 Ba(OH)2溶液的体积/mL 盐酸的体积/mL 溶液的pH
① 22.00 0.00 8
② 22.00 18.00 7
③ 22.00 22.00 6
假设溶液混合前后的体积变化忽略不计,则a= ,实验②中由水电离产生的c (OH-)= mol·L-1。
4
1×10-7
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(3)在此温度下,将0.1 mol·L-1 NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下 表中甲、乙、丙、丁不同方式混合:
甲 乙 丙 丁
0.1 mol·L-1 Ba(OH)2溶液体积/mL 10 10 10 10
0.1 mol·L-1 NaHSO4溶液体积/mL 5 10 15 20
中
BaSO4↓+H2O
11
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(4)在25 ℃下,将a mol·L-1 NaCN溶液(显碱性)与0.01 mol·L-1盐酸等体积混 合,反应后测得溶液pH=7,则a (填“>”“<”或“=”)0.01;用含a 的代数式表示HCN的电离常数Ka= 。
>
(100a-1)×10-7
1
2
3
4
5
6
7
8
9
10
11
12
