人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第四节沉淀溶解平衡第1课时难溶电解质的沉淀溶解平衡课件(共58张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第四节沉淀溶解平衡第1课时难溶电解质的沉淀溶解平衡课件(共58张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 6.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-25 17:19:46 | ||
图片预览











文档简介
(共58张PPT)
第三章 水溶液中的离子反应与平衡
第四节 沉淀溶解平衡
第1课时 难溶电解质的沉淀溶解平衡
【学习目标】 1.知道沉淀溶解平衡的概念及其影响因素。2.明确溶度积和离子积的 关系,学会判断溶液中难溶电解质的沉淀或溶解情况。3.能用平衡移动原理解释沉淀 的溶解与生成、沉淀转化的实质。4.学会用沉淀溶解平衡的移动解决生产、生活中的 问题。
一、难溶电解质的沉淀溶解平衡
1. 生成难溶电解质的离子反应的限度
(1)25 ℃时,溶解性与溶解度的关系
(2)反应完全的标志
一般情况下,化学上通常认为残留在溶液中的离子浓度小于 mol·L-1时, 生成沉淀的反应就进行完全了。
1×10-5
2. 沉淀溶解平衡(以AgCl为例分析)
(1)沉淀溶解平衡建立
AgCl在溶液中存在下述两个过程:一方面,在水分子作用下,少量Ag+和Cl-脱离 AgCl的表面进入水中,即 过程;另一方面,溶液中的Ag+和Cl-受AgCl表面 阴、阳离子的吸引,回到AgCl的表面析出,即 过程。在一定温度下,当沉 淀和溶解的速率相等时,达到平衡状态,得到AgCl的 。
溶解
沉淀
饱和溶液
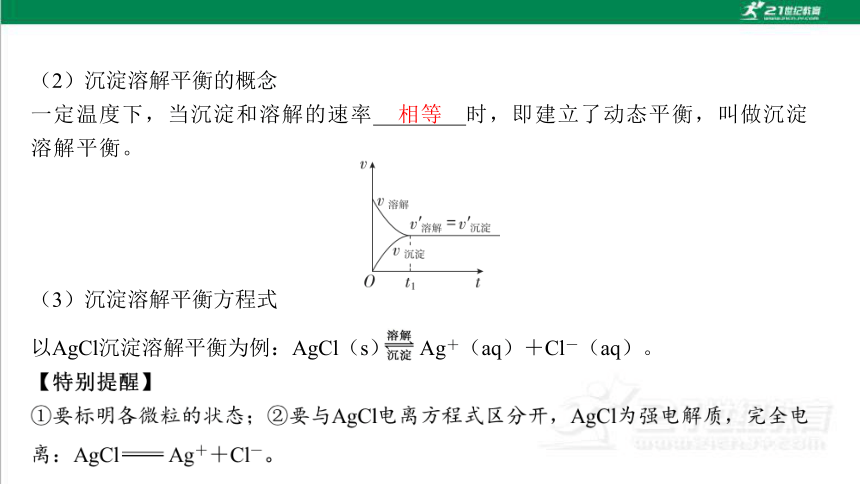
(2)沉淀溶解平衡的概念
一定温度下,当沉淀和溶解的速率 时,即建立了动态平衡,叫做沉淀 溶解平衡。
(3)沉淀溶解平衡方程式
以AgCl沉淀溶解平衡为例:AgCl(s) Ag+(aq)+Cl-(aq)。
相等
3. 沉淀溶解平衡的影响因素
内
因 难溶电解质本身的性质。不存在绝对不溶的物质;同是微溶物质,溶解度差别 也很大;易溶物质的饱和溶液也存在沉淀溶解平衡
外
因 温度 升高温度,多数平衡向沉淀溶解的方向移动;少数平衡向生成沉淀的 方向移动,如Ca(OH)2的沉淀溶解平衡
浓度 加水稀释,平衡向沉淀溶解的方向移动
同离子
效应 向平衡体系中加入与难溶电解质中相同的离子,平衡向生成沉淀的方 向移动
其他 向平衡体系中加入可与体系中某些离子反应生成更难溶的物质或气体 的离子时,平衡向沉淀溶解的方向移动
外界条件 移动
方向 平衡后
c(Ag+) 平衡后
c(Cl-) Ksp
升高温度
加水稀释
加入少量AgNO3
通入HCl
通入H2S
正向
增大
增大
增大
正向
不变
不变
不变
逆向
增大
减小
不变
逆向
减小
增大
不变
正向
减小
增大
不变
【判断】
×
×
√
×
×
√
×
①升高温度,平衡逆向移动
②向溶液中加入少量碳酸钠粉末能增大钙离子浓度
③恒温下向溶液中加入CaO,溶液的pH升高
④加热溶液,溶液的pH升高
⑤向溶液中加入Na2CO3溶液,其中固体质量增加
⑥向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
A
A. 仅①⑤ B. 仅①⑤⑥
C. 仅②③⑤ D. 仅①②⑤⑥
D
A. ①>②>⑤>④>③
B. ④>③>⑤>②>①
C. ④>⑤>②>①>③
D. ④>①>③>②>⑤
解析:①20 mL 0.01 mol·L-1 HCl溶液中,c(Cl-)=0.01 mol·L-1;②30 mL 0.02 mol·L-1 CaCl2溶液中,c(Cl-)=0.02 mol·L-1×2=0.04 mol·L-1;③40 mL 0.02 mol·L-1 AgNO3溶液中,c(Ag+)=0.02 mol·L-1;⑤50 mL 0.05 mol·L-1 KCl溶液 中,c(Cl-)=0.05 mol·L-1。可见上述溶液中离子浓度由小到大的顺序为④<①< ③<②<⑤,则AgCl的溶解度由大到小的排列顺序是④>①>③>②>⑤,故合理 选项是D。
二、溶度积常数
1. 概念
难溶电解质的沉淀溶解平衡也存在 ,称为 ,简称溶度 积,符号为 。
2. 表达式
Ksp= 。
Ksp= 。
平衡常数
溶度积常数
Ksp
cm(An+)·cn(Bm-)
c(Fe3+)·c3(OH-)
3. Ksp的意义
Ksp可以反映难溶电解质在水中的 能力。当化学式所表示的组成中阴、阳离 子个数比相同时,如AgCl、AgBr、AgI,Ksp越大的难溶电解质在水中的溶解能力 越 ,一般溶解度也越 ;但阴、阳离子个数比不相同时,如AgI与 Ag2CrO4,Ksp大的难溶电解质的溶解度不一定大。
4. Ksp的影响因素
溶解
强
大
温度
浓
度
吸热
溶解
增大
5. 应用——溶度积规则
通过比较溶度积与溶液的离子积[符号为Q,如对于Ag2S溶液来说,任意时刻的Q= c2(Ag+)·c(S2-)]的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成 或溶解:
(1)Q>Ksp,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。
(2)Q=Ksp,溶液饱和,沉淀与溶解处于平衡状态。
(3)Q<Ksp,溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解 直至溶液饱和。
6. 溶度积常数计算的几种类型
考查角度 计算技巧
判断沉淀的生成或沉 淀是否完全 ①把离子浓度数据代入Q表达式得Q值,若Q>Ksp,则有 沉淀生成;②利用Ksp的数值计算某一离子浓度,若该离子 浓度小于10-5 mol·L-1,则该离子沉淀完全
常温下,计算氢氧化 物沉淀开始和沉淀完 全时溶液的pH ①根据氢氧化物的Ksp,先计算初始浓度溶液中的
c(OH-),再求得溶液的pH;②金属阳离子沉淀完全时的离子浓度小于或等于10-5 mol·L-1,依据Ksp可计算金属阳离子沉淀完全时溶液中的c(OH-),进而求得pH
考查角度 计算技巧
计算沉淀转化反应的平衡常数,并判断沉淀转化的程度 依据沉淀的转化反应和Ksp,计算该反应的平衡常数,K值越大,转化反应越易进行,转化程度越大
沉淀先后的计算与判断 ①沉淀类型相同,则Ksp小的化合物先沉淀;②沉淀类型不同,则需要根据Ksp计算出沉淀时的离子浓度,离子浓度小的先沉淀
【判断】
×
×
×
×
√
1. (2025·内江第六中学高二校考)相关物质的溶度积常数见下表(25 ℃):
物质 Mg(OH)2 CH3COOAg AgCl Ag2CrO4
Ksp 1.1×10-11 2.3×10-3 1.8×10-10 1.9×10-12
A. 浓度均为0.2 mol/L的AgNO3溶液和CH3COONa溶液等体积混合一定产生 CH3COOAg沉淀
B. 在其他条件不变的情况下,向饱和AgCl溶液中加入NaCl溶液,Ksp(AgCl)不变
C. 0.11 mol/L的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D. 将0.001 mol/L的AgNO3溶液滴入0.001 mol/L的KCl和0.001 mol/L的K2CrO4混合溶 液中,先产生Ag2CrO4沉淀
D
2. 常温下,Ksp=c(Cu2+)·c2(OH-)=2×10-20,计算有关Cu2+沉淀的pH。
(1)某CuSO4溶液中c(Cu2+)=0.02 mol·L-1,如果生成Cu(OH)2沉淀,应调整 溶液的pH,使之大于 。
5
(2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分 之一),则应向溶液中加入NaOH溶液,使溶液的pH为 。
6
5×10-7
4.25 ℃时,在1.00 L 0.03 mol·L-1 AgNO3溶液中加入0.50 L 0.06 mol·L-1的CaCl2溶 液,能否生成AgCl沉淀?(已知:AgCl的Ksp=1.8×10-10)
答案:见解析
6. Ksp(CaCO3)=2.8×10-9、Ksp(CaSO4)=9.1×10-6,溶解能力:CaSO4大于 CaCO3。请用数据说明溶解能力小的CaCO3能否转化为溶解能力大的CaSO4?
答案:见解析
课时作业(二十四)
难溶电解质的沉淀溶解平衡
[对点训练]
题组一 沉淀溶解平衡及影响因素
A. 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
B. 沉淀溶解平衡是可逆的
C. 在平衡状态时v溶解=v沉淀=0
D. 达到沉淀溶解平衡的溶液不一定是饱和溶液
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等,如 AgCl溶于盐酸,Ag+和Cl-浓度不相等,A错误;沉淀溶解平衡为可逆反应,改变条 件时沉淀溶解平衡发生移动,B正确;沉淀溶解平衡为动态平衡,在平衡状态时v溶解 =v沉淀≠0,C错误;达到沉淀溶解平衡的溶液,溶质不能再溶解,则一定是饱和溶 液,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B. AgCl难溶于水,溶液中没有Ag+和Cl-
C. 在AgCl的澄清饱和溶液中,只要向其中加入NaCl溶液,一定会有沉淀生成
D. 向含有AgCl沉淀的悬浊液中加入NaCl固体,AgCl的溶解度增大
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 纯水
B. 2 mol/L Na2SO4溶液
C. 0.1 mol/L BaCl2溶液
D. 1 mol/L H2SO4溶液
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 加MgCl2固体 B. 加HCl气体
C. 加少量水 D. 加NaOH固体
解析:加MgCl2固体,c(Mg2+)增大,平衡逆向移动,Mg(OH)2增多,A错误; 加HCl气体,氢氧根离子被消耗,平衡正向移动,c(Mg2+)增大,Mg(OH)2减 少,B错误;加少量水,平衡正向移动,Mg(OH)2减少,但温度不变,溶度积不 变,c(Mg2+)不变,C正确;加NaOH固体,平衡逆向移动,c(Mg2+)减小,Mg (OH)2增多,D错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
题组二 溶度积及其应用
A. 向AgCl饱和溶液中加入盐酸,Ksp值变大
B. AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C. 温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀 析出
D. Ksp(AgI)<Ksp(AgCl),所以S(AgI)<S(AgCl)
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:Ksp只与温度有关,加盐酸时温度不变,则Ksp不变,A项错误;混合后可能Ag+或Cl-有剩余,因此不一定有c(Ag+)=c(Cl-),B项错误;Q=Ksp时达到溶 解平衡,没有AgCl沉淀析出,C项错误;比较物质的溶解度大小时,要注意物质的类 型相同且化学式中阴、阳离子的个数比相同,溶度积越小,其溶解度也越小,如果不 同,则不能直接利用溶度积的大小来比较其溶解性,需转化为溶解度进行比较,否则 容易误判,由于AgI、AgCl的类型相同,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 25 ℃时,CuS的溶解度大于ZnS的溶解度
B. 25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
C. 向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 较先出现的沉淀是Mg(OH)2
B. 两种离子开始沉淀时,Cu2+所需溶液的pH较大
C. 当两种沉淀共存时,说明溶液中完全不存在Cu2+、Mg2+
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
8. (2025·菏泽第一中学高二校考)25 ℃时有关物质的颜色和溶度积(Ksp)如 下表:
物质 AgCl AgBr AgI Ag2S
颜色 白 浅黄 黄 黑
Ksp 1.8×10-10 7.7×10-13 1.5×10-16 1.8×10-50
D
A. 向AgCl的白色悬浊液中加入0.1 mol·L-1KI溶液,有黄色沉淀产生
B. 在100 mL 1.8×10-6 mol·L-1NaCl溶液中,加入1 mL 1×10-3 mol·L-1AgNO3溶 液,不能产生白色沉淀
C. 25 ℃,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同
D. 25 ℃时,AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度相同
1
2
3
4
5
6
7
8
9
10
11
12
解析:对于相同类型的难溶性盐,一般情况下,溶度积大的沉淀较易转化成溶度积小 的沉淀,溶度积:AgI<AgBr<AgCl,所以在AgCl悬浊液中加入KI溶液,会有AgI生 成,即有黄色沉淀产生,故A正确;加入1 mL 1×10-3 mol·L-1 AgNO3溶液,c(Cl -)可认为保持不变,即c(Cl-)=1.8×10-6 mol·L-1,而AgNO3溶液相当于稀释 至100倍,故c(Ag+)=1×10-5 mol·L-1,c(Cl-)·c(Ag+)=1.8×10-11<Ksp (AgCl),故没有沉淀生成,故B正确;溶度积只与温度有关,所以25 ℃时,AgCl 固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同,故C正确;由表中数据 可知,溶度积最大的是AgCl,其溶解度也最大,所以AgCl饱和溶液中c(Ag+)最 大,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. 向5 mL 1.5×10-5 mol/L CrCl3溶液中,加入等体积、等浓度的NaOH溶液,能观察 到沉淀的产生
B. 向 Cr(OH)3的悬浊液中加入NH4Cl(s),Cr(OH)3(s)的质量减小
D. 25 ℃时,将CrCl3溶液的pH调至5时,可认为溶液中的铬元素已基本沉淀完全(当 溶液中c(Cr3+)≤10-5 mol/L时,可视作该离子沉淀完全)
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
C. 加入AgNO3溶液时首先生成AgCl沉淀
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. 已知25 ℃时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,Ksp (AgI)=8.5×10-17。
(1)25 ℃时,氯化银的饱和溶液中,c(Cl-)= ,向其中 加入NaCl固体,沉淀溶解平衡 (填“左移”“右移”或“不移动”),溶度 积常数 (填“变大”“变小”或“不变”)。
1.3×10-5 mol·L-1
左移
不变
1
2
3
4
5
6
7
8
9
10
11
12
(2)25 ℃时,氯化银的饱和溶液和铬酸银的饱和溶液中,Ag+浓度大小顺序 为 ,由此可得出 更难溶。
Ag2CrO4>AgCl
AgCl
1
2
3
4
5
6
7
8
9
10
11
12
(3)将等体积的4×10-3mol·L-1的AgNO3溶液和4×10-3 mol·L-1的K2CrO4溶液混 合 (填“有”或“没有”)Ag2CrO4沉淀产生。
有
1
2
3
4
5
6
7
8
9
10
11
12
4.96×10-6
是
1
2
3
4
5
6
7
8
9
10
11
12
(2)25 ℃时,Mg(OH)2饱和溶液的pH等于 。(已知Ksp[Mg(OH)2]= 4.0×10-12,lg 5=0.7)
10.3
1
2
3
4
5
6
7
8
9
10
11
12
4.7×10-7
1
2
3
4
5
6
7
8
9
10
11
12
AgCl
1.9×10-5
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
第三章 水溶液中的离子反应与平衡
第四节 沉淀溶解平衡
第1课时 难溶电解质的沉淀溶解平衡
【学习目标】 1.知道沉淀溶解平衡的概念及其影响因素。2.明确溶度积和离子积的 关系,学会判断溶液中难溶电解质的沉淀或溶解情况。3.能用平衡移动原理解释沉淀 的溶解与生成、沉淀转化的实质。4.学会用沉淀溶解平衡的移动解决生产、生活中的 问题。
一、难溶电解质的沉淀溶解平衡
1. 生成难溶电解质的离子反应的限度
(1)25 ℃时,溶解性与溶解度的关系
(2)反应完全的标志
一般情况下,化学上通常认为残留在溶液中的离子浓度小于 mol·L-1时, 生成沉淀的反应就进行完全了。
1×10-5
2. 沉淀溶解平衡(以AgCl为例分析)
(1)沉淀溶解平衡建立
AgCl在溶液中存在下述两个过程:一方面,在水分子作用下,少量Ag+和Cl-脱离 AgCl的表面进入水中,即 过程;另一方面,溶液中的Ag+和Cl-受AgCl表面 阴、阳离子的吸引,回到AgCl的表面析出,即 过程。在一定温度下,当沉 淀和溶解的速率相等时,达到平衡状态,得到AgCl的 。
溶解
沉淀
饱和溶液
(2)沉淀溶解平衡的概念
一定温度下,当沉淀和溶解的速率 时,即建立了动态平衡,叫做沉淀 溶解平衡。
(3)沉淀溶解平衡方程式
以AgCl沉淀溶解平衡为例:AgCl(s) Ag+(aq)+Cl-(aq)。
相等
3. 沉淀溶解平衡的影响因素
内
因 难溶电解质本身的性质。不存在绝对不溶的物质;同是微溶物质,溶解度差别 也很大;易溶物质的饱和溶液也存在沉淀溶解平衡
外
因 温度 升高温度,多数平衡向沉淀溶解的方向移动;少数平衡向生成沉淀的 方向移动,如Ca(OH)2的沉淀溶解平衡
浓度 加水稀释,平衡向沉淀溶解的方向移动
同离子
效应 向平衡体系中加入与难溶电解质中相同的离子,平衡向生成沉淀的方 向移动
其他 向平衡体系中加入可与体系中某些离子反应生成更难溶的物质或气体 的离子时,平衡向沉淀溶解的方向移动
外界条件 移动
方向 平衡后
c(Ag+) 平衡后
c(Cl-) Ksp
升高温度
加水稀释
加入少量AgNO3
通入HCl
通入H2S
正向
增大
增大
增大
正向
不变
不变
不变
逆向
增大
减小
不变
逆向
减小
增大
不变
正向
减小
增大
不变
【判断】
×
×
√
×
×
√
×
①升高温度,平衡逆向移动
②向溶液中加入少量碳酸钠粉末能增大钙离子浓度
③恒温下向溶液中加入CaO,溶液的pH升高
④加热溶液,溶液的pH升高
⑤向溶液中加入Na2CO3溶液,其中固体质量增加
⑥向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
A
A. 仅①⑤ B. 仅①⑤⑥
C. 仅②③⑤ D. 仅①②⑤⑥
D
A. ①>②>⑤>④>③
B. ④>③>⑤>②>①
C. ④>⑤>②>①>③
D. ④>①>③>②>⑤
解析:①20 mL 0.01 mol·L-1 HCl溶液中,c(Cl-)=0.01 mol·L-1;②30 mL 0.02 mol·L-1 CaCl2溶液中,c(Cl-)=0.02 mol·L-1×2=0.04 mol·L-1;③40 mL 0.02 mol·L-1 AgNO3溶液中,c(Ag+)=0.02 mol·L-1;⑤50 mL 0.05 mol·L-1 KCl溶液 中,c(Cl-)=0.05 mol·L-1。可见上述溶液中离子浓度由小到大的顺序为④<①< ③<②<⑤,则AgCl的溶解度由大到小的排列顺序是④>①>③>②>⑤,故合理 选项是D。
二、溶度积常数
1. 概念
难溶电解质的沉淀溶解平衡也存在 ,称为 ,简称溶度 积,符号为 。
2. 表达式
Ksp= 。
Ksp= 。
平衡常数
溶度积常数
Ksp
cm(An+)·cn(Bm-)
c(Fe3+)·c3(OH-)
3. Ksp的意义
Ksp可以反映难溶电解质在水中的 能力。当化学式所表示的组成中阴、阳离 子个数比相同时,如AgCl、AgBr、AgI,Ksp越大的难溶电解质在水中的溶解能力 越 ,一般溶解度也越 ;但阴、阳离子个数比不相同时,如AgI与 Ag2CrO4,Ksp大的难溶电解质的溶解度不一定大。
4. Ksp的影响因素
溶解
强
大
温度
浓
度
吸热
溶解
增大
5. 应用——溶度积规则
通过比较溶度积与溶液的离子积[符号为Q,如对于Ag2S溶液来说,任意时刻的Q= c2(Ag+)·c(S2-)]的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成 或溶解:
(1)Q>Ksp,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。
(2)Q=Ksp,溶液饱和,沉淀与溶解处于平衡状态。
(3)Q<Ksp,溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解 直至溶液饱和。
6. 溶度积常数计算的几种类型
考查角度 计算技巧
判断沉淀的生成或沉 淀是否完全 ①把离子浓度数据代入Q表达式得Q值,若Q>Ksp,则有 沉淀生成;②利用Ksp的数值计算某一离子浓度,若该离子 浓度小于10-5 mol·L-1,则该离子沉淀完全
常温下,计算氢氧化 物沉淀开始和沉淀完 全时溶液的pH ①根据氢氧化物的Ksp,先计算初始浓度溶液中的
c(OH-),再求得溶液的pH;②金属阳离子沉淀完全时的离子浓度小于或等于10-5 mol·L-1,依据Ksp可计算金属阳离子沉淀完全时溶液中的c(OH-),进而求得pH
考查角度 计算技巧
计算沉淀转化反应的平衡常数,并判断沉淀转化的程度 依据沉淀的转化反应和Ksp,计算该反应的平衡常数,K值越大,转化反应越易进行,转化程度越大
沉淀先后的计算与判断 ①沉淀类型相同,则Ksp小的化合物先沉淀;②沉淀类型不同,则需要根据Ksp计算出沉淀时的离子浓度,离子浓度小的先沉淀
【判断】
×
×
×
×
√
1. (2025·内江第六中学高二校考)相关物质的溶度积常数见下表(25 ℃):
物质 Mg(OH)2 CH3COOAg AgCl Ag2CrO4
Ksp 1.1×10-11 2.3×10-3 1.8×10-10 1.9×10-12
A. 浓度均为0.2 mol/L的AgNO3溶液和CH3COONa溶液等体积混合一定产生 CH3COOAg沉淀
B. 在其他条件不变的情况下,向饱和AgCl溶液中加入NaCl溶液,Ksp(AgCl)不变
C. 0.11 mol/L的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D. 将0.001 mol/L的AgNO3溶液滴入0.001 mol/L的KCl和0.001 mol/L的K2CrO4混合溶 液中,先产生Ag2CrO4沉淀
D
2. 常温下,Ksp=c(Cu2+)·c2(OH-)=2×10-20,计算有关Cu2+沉淀的pH。
(1)某CuSO4溶液中c(Cu2+)=0.02 mol·L-1,如果生成Cu(OH)2沉淀,应调整 溶液的pH,使之大于 。
5
(2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分 之一),则应向溶液中加入NaOH溶液,使溶液的pH为 。
6
5×10-7
4.25 ℃时,在1.00 L 0.03 mol·L-1 AgNO3溶液中加入0.50 L 0.06 mol·L-1的CaCl2溶 液,能否生成AgCl沉淀?(已知:AgCl的Ksp=1.8×10-10)
答案:见解析
6. Ksp(CaCO3)=2.8×10-9、Ksp(CaSO4)=9.1×10-6,溶解能力:CaSO4大于 CaCO3。请用数据说明溶解能力小的CaCO3能否转化为溶解能力大的CaSO4?
答案:见解析
课时作业(二十四)
难溶电解质的沉淀溶解平衡
[对点训练]
题组一 沉淀溶解平衡及影响因素
A. 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
B. 沉淀溶解平衡是可逆的
C. 在平衡状态时v溶解=v沉淀=0
D. 达到沉淀溶解平衡的溶液不一定是饱和溶液
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等,如 AgCl溶于盐酸,Ag+和Cl-浓度不相等,A错误;沉淀溶解平衡为可逆反应,改变条 件时沉淀溶解平衡发生移动,B正确;沉淀溶解平衡为动态平衡,在平衡状态时v溶解 =v沉淀≠0,C错误;达到沉淀溶解平衡的溶液,溶质不能再溶解,则一定是饱和溶 液,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B. AgCl难溶于水,溶液中没有Ag+和Cl-
C. 在AgCl的澄清饱和溶液中,只要向其中加入NaCl溶液,一定会有沉淀生成
D. 向含有AgCl沉淀的悬浊液中加入NaCl固体,AgCl的溶解度增大
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 纯水
B. 2 mol/L Na2SO4溶液
C. 0.1 mol/L BaCl2溶液
D. 1 mol/L H2SO4溶液
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 加MgCl2固体 B. 加HCl气体
C. 加少量水 D. 加NaOH固体
解析:加MgCl2固体,c(Mg2+)增大,平衡逆向移动,Mg(OH)2增多,A错误; 加HCl气体,氢氧根离子被消耗,平衡正向移动,c(Mg2+)增大,Mg(OH)2减 少,B错误;加少量水,平衡正向移动,Mg(OH)2减少,但温度不变,溶度积不 变,c(Mg2+)不变,C正确;加NaOH固体,平衡逆向移动,c(Mg2+)减小,Mg (OH)2增多,D错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
题组二 溶度积及其应用
A. 向AgCl饱和溶液中加入盐酸,Ksp值变大
B. AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C. 温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀 析出
D. Ksp(AgI)<Ksp(AgCl),所以S(AgI)<S(AgCl)
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:Ksp只与温度有关,加盐酸时温度不变,则Ksp不变,A项错误;混合后可能Ag+或Cl-有剩余,因此不一定有c(Ag+)=c(Cl-),B项错误;Q=Ksp时达到溶 解平衡,没有AgCl沉淀析出,C项错误;比较物质的溶解度大小时,要注意物质的类 型相同且化学式中阴、阳离子的个数比相同,溶度积越小,其溶解度也越小,如果不 同,则不能直接利用溶度积的大小来比较其溶解性,需转化为溶解度进行比较,否则 容易误判,由于AgI、AgCl的类型相同,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 25 ℃时,CuS的溶解度大于ZnS的溶解度
B. 25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
C. 向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 较先出现的沉淀是Mg(OH)2
B. 两种离子开始沉淀时,Cu2+所需溶液的pH较大
C. 当两种沉淀共存时,说明溶液中完全不存在Cu2+、Mg2+
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
8. (2025·菏泽第一中学高二校考)25 ℃时有关物质的颜色和溶度积(Ksp)如 下表:
物质 AgCl AgBr AgI Ag2S
颜色 白 浅黄 黄 黑
Ksp 1.8×10-10 7.7×10-13 1.5×10-16 1.8×10-50
D
A. 向AgCl的白色悬浊液中加入0.1 mol·L-1KI溶液,有黄色沉淀产生
B. 在100 mL 1.8×10-6 mol·L-1NaCl溶液中,加入1 mL 1×10-3 mol·L-1AgNO3溶 液,不能产生白色沉淀
C. 25 ℃,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同
D. 25 ℃时,AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度相同
1
2
3
4
5
6
7
8
9
10
11
12
解析:对于相同类型的难溶性盐,一般情况下,溶度积大的沉淀较易转化成溶度积小 的沉淀,溶度积:AgI<AgBr<AgCl,所以在AgCl悬浊液中加入KI溶液,会有AgI生 成,即有黄色沉淀产生,故A正确;加入1 mL 1×10-3 mol·L-1 AgNO3溶液,c(Cl -)可认为保持不变,即c(Cl-)=1.8×10-6 mol·L-1,而AgNO3溶液相当于稀释 至100倍,故c(Ag+)=1×10-5 mol·L-1,c(Cl-)·c(Ag+)=1.8×10-11<Ksp (AgCl),故没有沉淀生成,故B正确;溶度积只与温度有关,所以25 ℃时,AgCl 固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同,故C正确;由表中数据 可知,溶度积最大的是AgCl,其溶解度也最大,所以AgCl饱和溶液中c(Ag+)最 大,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. 向5 mL 1.5×10-5 mol/L CrCl3溶液中,加入等体积、等浓度的NaOH溶液,能观察 到沉淀的产生
B. 向 Cr(OH)3的悬浊液中加入NH4Cl(s),Cr(OH)3(s)的质量减小
D. 25 ℃时,将CrCl3溶液的pH调至5时,可认为溶液中的铬元素已基本沉淀完全(当 溶液中c(Cr3+)≤10-5 mol/L时,可视作该离子沉淀完全)
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
C. 加入AgNO3溶液时首先生成AgCl沉淀
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. 已知25 ℃时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,Ksp (AgI)=8.5×10-17。
(1)25 ℃时,氯化银的饱和溶液中,c(Cl-)= ,向其中 加入NaCl固体,沉淀溶解平衡 (填“左移”“右移”或“不移动”),溶度 积常数 (填“变大”“变小”或“不变”)。
1.3×10-5 mol·L-1
左移
不变
1
2
3
4
5
6
7
8
9
10
11
12
(2)25 ℃时,氯化银的饱和溶液和铬酸银的饱和溶液中,Ag+浓度大小顺序 为 ,由此可得出 更难溶。
Ag2CrO4>AgCl
AgCl
1
2
3
4
5
6
7
8
9
10
11
12
(3)将等体积的4×10-3mol·L-1的AgNO3溶液和4×10-3 mol·L-1的K2CrO4溶液混 合 (填“有”或“没有”)Ag2CrO4沉淀产生。
有
1
2
3
4
5
6
7
8
9
10
11
12
4.96×10-6
是
1
2
3
4
5
6
7
8
9
10
11
12
(2)25 ℃时,Mg(OH)2饱和溶液的pH等于 。(已知Ksp[Mg(OH)2]= 4.0×10-12,lg 5=0.7)
10.3
1
2
3
4
5
6
7
8
9
10
11
12
4.7×10-7
1
2
3
4
5
6
7
8
9
10
11
12
AgCl
1.9×10-5
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
