人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第三节盐类的水解第2课时影响盐类水解的主要因素盐类水解的应用课件(共76张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第三节盐类的水解第2课时影响盐类水解的主要因素盐类水解的应用课件(共76张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 11.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-25 17:20:45 | ||
图片预览










文档简介
(共76张PPT)
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
第2课时 影响盐类水解的主要因素 盐类水解的应用
一、影响盐类水解的主要因素
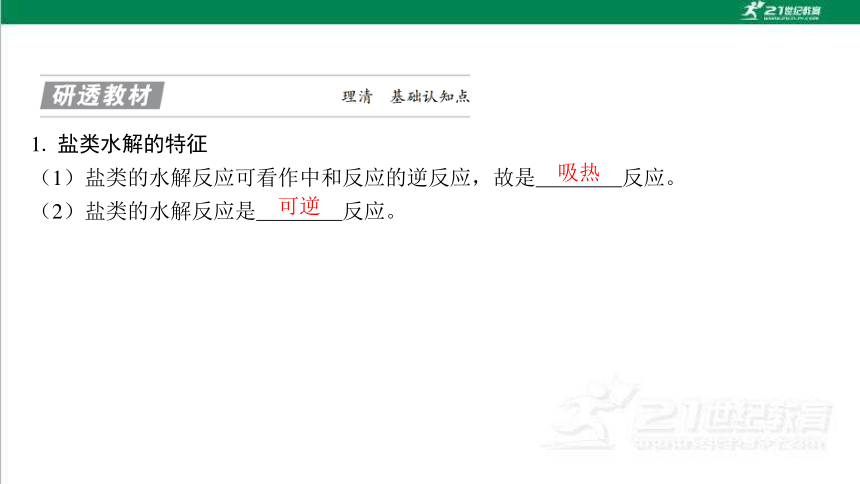
1. 盐类水解的特征
(1)盐类的水解反应可看作中和反应的逆反应,故是 反应。
(2)盐类的水解反应是 反应。
吸热
可逆
2. 实验探究反应条件对盐类水解平衡的影响
影响因素 实验步骤 实验现象 解释
盐的浓度 加入FeCl3晶 体,再测溶液的 pH 溶液颜色 变 ,pH 加入FeCl3晶体,c(Fe3+)增 大,水解平衡向 方 向移动
深
变
小
正反应
影响因素 实验步骤 实验现象 解释
溶液的
酸碱度 加盐酸后,测 溶液的pH 溶液颜色变 , pH 加入盐酸,c(H+)增大,水 解平衡向 方向移 动,但c(H+)仍比原平衡中 c(H+)大
加入少量 NaOH溶液 产生 色沉淀 加入氢氧化钠后,OH-消耗
H+,c(H+)减小,水解平衡向 方向移动
温度 升高温度 溶液颜色变 , pH 水解反应为吸热反应,升高温 度,水解平衡向 方 向移动
浅
变小
逆反应
红褐
正反应
深
变小
正反应
3. 影响盐类水解平衡的因素
(1)内因
①主要因素是盐本身的性质,组成盐的酸根离子对应的酸越弱或阳离子对应的碱越 弱,水解程度就越大(越弱越水解)。
例如,酸性:HF>CH3COOH,则水解程度:NaF<CH3COONa。
②多元弱酸正盐的水解,水解反应第一步远远大于第二步,原因是正盐阴离子与H+ 结合能力比酸式盐阴离子结合能力强并且第一步水解产生的OH-对第二步水解有抑制 作用。例如,Na2CO3溶液中
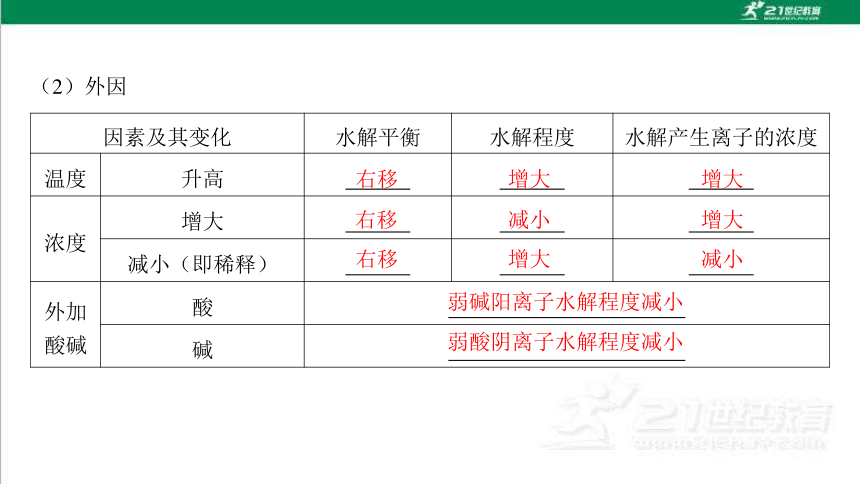
(2)外因
因素及其变化 水解平衡 水解程度 水解产生离子的浓度
温度 升高
浓度 增大
减小(即稀释)
外加
酸碱 酸
碱
右移
增大
增大
右移
减小
增大
右移
增大
减小
弱碱阳离子水解程度减小
弱酸阴离子水解程度减小
【判断】
×
×
√
×
×
√
A. 随温度升高,纯水中c(H+)>c(OH-)
B. 随温度升高,CH3COONa溶液的c(OH-)减小
C. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
D. 温度升高至60 ℃,CH3COONa溶液中由水电离出的
c(OH-)是10-5.1 mol·L-1
D
A. 稀释溶液,水解平衡常数增大
B. 加入CuSO4固体,HS-浓度减小
D. 加入NaOH固体,溶液pH减小
B
3. 如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放 置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体, 烧杯②中不加任何物质。
CH3COOH+OH-,使溶液显碱性
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述 正确的是 。
A. 水解反应为放热反应
B. 水解反应为吸热反应
C. NH4NO3晶体溶于水时放出热量
D. NH4NO3晶体溶于水时吸收热量
(3)分别向浓度均为0.01 mol·L-1 CH3COONa溶液中分别加入NaOH固体、Na2CO3 固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为 、 、
(填“向左”“向右”或“不移动”)。
BD
向左
向左
向右
二、盐的水解常数及应用
1. 盐的水解常数
(1)水解常数(Kh)与电离常数的定量关系
(2)结论归纳
①Ka·Kh=Kw或Kb·Kh=Kw;
2. 盐的水解常数(Kh)的应用
A. 25 ℃时,CN-的水解常数Kh(CN-)≈2.04×10-4
C. 同浓度的CH3COONa溶液和NaCN溶液中,CH3COONa溶液的离子总浓度较小
D. 若加水稀释醋酸钠溶液,溶液中所有离子浓度均减小
B
9
2.36×10-5
1×10-12
增大
3. 磷酸是三元弱酸,常温下三级电离常数分别是Ka1=7.1×10-3,Ka2=6.2×10- 8,Ka3=4.5×10-13,回答下列问题:
(2)常温下,NaH2PO4的水溶液pH (填“>”“<”或“=”)7。
③
<②<①
<
碱
Na2HPO4溶液显碱性
三、盐类水解的应用
1. 在化学实验中的应用
应用 举例
判断溶液的酸碱性 (谁强显谁性,同 强显中性) FeCl3溶液显酸性,原因是
判断酸性强弱 相同浓度的NaX、NaY、NaZ溶液的pH分别为8、9、10,则酸 性:
配制或贮存易
水解的盐溶液 配制CuSO4溶液时,加入少量 ,抑制Cu2+水解;贮 存Na2CO3溶液不能用 玻璃塞
胶体的制取 制取Fe(OH)3胶体的离子反应:
HX>HY>HZ
H2SO4
磨口
(OH)3(胶体)+3H+
应用 举例
制备无水盐 将挥发性酸的弱碱盐如AlCl3、FeCl3溶液蒸干时,在通HCl的 气流中加热蒸干
判断离子是否共存
判断中和反应至
中性的试剂用量 如NH3·H2O与HCl反应至中性时, 过量, CH3COOH与NaOH反应至中性时, 过量
制备无机化合物 如用TiCl4制备TiO2,其反应的化学方程式为 ,加入大量的水,同时加 热,促使水解趋于完全,所得TiO2·xH2O经焙烧得到TiO2
NH3·H2O
CH3COOH
TiCl4+(x+
2. 在生产、生活中的应用
泡沫灭火
器原理 泡沫灭火器中药品成分为NaHCO3与Al2(SO4)3,发生的反应为
作净水剂 明矾可作净水剂,原理为
化肥的使用 铵态氮肥与草木灰 混合施用
除锈剂
热纯碱去
污能力强 加热,促进Na2CO3的水解,使c(OH-)增大,去污能力增强
不能
NH3·H2O+H+
3. 盐溶液蒸干灼烧后所得产物的判断
(1)盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如CuSO4(aq)蒸干得 CuSO4(s)。
(2)盐溶液水解生成易挥发性酸时,蒸干灼烧后一般得到对应的氧化物,如AlCl3 (aq)蒸干得到Al(OH)3,灼烧得到Al2O3。
(3)考虑盐受热时是否分解。
原物质 蒸干灼烧后固体物质
Ca(HCO3)2 CaCO3或CaO
NaHCO3 Na2CO3
KMnO4 K2MnO4和MnO2
NH4Cl 分解为NH3和HCl,无固体物质存在
(4)还原性盐在蒸干时会被O2氧化。如Na2SO3(aq)蒸干得Na2SO4(s)。
【判断】
×
×
×
√
×
×
×
①NH4Cl与ZnCl2溶液可作焊接金属的除锈剂
②NaHCO3与Al2(SO4)3两种溶液可作灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
D
A. ①②③ B. ②③④
C. ①④⑤ D. ①②③④⑤
①CuSO4 ②FeSO4 ③Ca(HCO3)2 ④NH4HCO3 ⑤KMnO4 ⑥FeCl3
A. 全部 B. 仅①②
C. 仅①⑤ D. 仅①
D
解析:CuSO4在水溶液中水解生成氢氧化铜和硫酸,硫酸是难挥发性酸,故加热蒸干 至质量不再减少时,能得到较纯净的原溶质,故①符合;FeSO4具有还原性,加热蒸 干时Fe2+被氧化为Fe3+,故②不符合;Ca(HCO3)2受热分解生成碳酸钙、二氧化碳 和水,加热蒸干至质量不再减少时,能得到较纯净的碳酸钙,故③不符合; NH4HCO3受热分解生成NH3、H2O和CO2,得不到原溶质,故④不符合;KMnO4加热 到质量不变时分解生成锰酸钾、二氧化锰和氧气,得不到原溶质,故⑤不符合; FeCl3溶液水解生成氢氧化铁和氯化氢,加热时,氯化氢挥发,促进FeCl3水解得到氢 氧化铁,得不到原溶质,故⑥不符合。故选D。
(用化学方程式表示并配以必要的文字说明,下同)。
Al2O3
在
移,HCl挥发,使平衡进一步向右移动得到Al(OH)3,在灼烧时发生反应2Al
低,水解平衡右移,使Mg粉不断溶解
不
能。应在HCl气流中加热蒸发
(4)向Na2SO3溶液中滴加酚酞,溶液变为红色,若再向该溶液中滴入过量的BaCl2溶 液,现象是 ,
产生白色沉淀,且溶液红色褪去
去
题后归纳
利用平衡移动原理解释问题的思维模板
(1)解答此类题的思维过程
①找出存在的平衡体系(即可逆反应或可逆过程)。
②找出影响平衡的条件。
③判断平衡移动的方向。
④分析平衡移动的结果及移动结果与所解答问题的联系。
(2)答题模板
……存在……平衡,……(条件)……(变化),使平衡向……(方向)移 动,……(结论)。
课时作业(二十二)
影响盐类水解的主要因素 盐类水解的应用
[对点训练]
题组一 影响盐类水解的因素
A. FeCl3溶液显黄色,没有 Fe(OH)3存在
B. 稀释过程中 FeCl3水解程度增大,c(H+)增大
D. 较浓盐酸可有效抑制Fe3+水解
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
B. 通入CO2,或者加入少量氯化铵溶液,溶液pH均减小
C. 升高温度,红色变深,平衡常数增大
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组二 盐类水解的应用
A. Al2S3不能通过水溶液的离子反应来制备
B. 将Al粉投入NaHSO4溶液中有气泡产生
C. 可用MgO除去MgCl2溶液中混有的FeCl3杂质
D. 加热蒸干FeCl3溶液得到FeCl3固体需要在HCl气流中进行
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 利用热的饱和Na2CO3溶液清洗餐具的油污
B. 草木灰与铵态氮肥混合施用后会降低肥效
C. 高铁酸钾可用于自来水的消毒杀菌
D. 在干燥的HCl气流中加热MgCl2·6H2O,可以获得无水MgCl2
解析:Na2CO3的水解是吸热反应,加热可以促进盐的水解,用Na2CO3溶液清洗油污 时,加热可以增强去污效果,与盐类水解有关,A不符合题意;铵态氮肥水解呈酸 性,而草木灰水解呈碱性,铵态氮肥与草木灰混施可降低肥效,与盐类水解有关,B 不符合题意;高铁酸钾可用于自来水的消毒杀菌,是由于其具有强氧化性,与盐类水 解无关,C符合题意;MgCl2·6H2O加热时发生水解,生成氢氧化镁和HCl,在干燥的 HCl气流中加热MgCl2·6H2O,可以抑制其水解,与盐类水解有关,D不符合题意。
C
1
2
3
4
5
6
7
8
9
10
11
12
题组三 盐类水解常数及其应用
A. 0.01 mol·L-1 NaClO溶液中,c(Na+)=c(HClO)+c(ClO-)
B. NaClO溶液长期露置在空气中,释放O2,漂白能力减弱
C. 等浓度的HClO与NaClO溶液等体积混合后溶液显碱性
D. 25 ℃,pH=6.0的NaClO和HClO的混合溶液中,c(HClO)>c(Na+)>c (ClO-)
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
C. 水的电离程度:c>b>a>d
D. 25 ℃时 ,NH4Cl水解平衡常数为(q-1)×10-7 (用q表示)
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
A. a点→b点→c点,Na2CO3的水解程度逐渐增大
B. b点开始,随温度升高,碳酸钠溶液pH逐渐降低,因此碳酸根水解是放热过程
C. 100 ℃时,纯水的pH=6,c点溶液中c(OH-)约为10-0.3 mol·L-1
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂;
②NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂;
③草木灰(主要成分K2CO3)与铵态氮肥不能混合施用;
④实验室中盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞;
⑤加热蒸干CuCl2溶液并灼烧,可以得到CuO固体;
⑥要除去FeCl3溶液中混有的Fe2+,可通入氧化剂Cl2;
⑦热纯碱溶液洗涤油污的能力比冷纯碱溶液强;
⑧误将钡盐[ BaCl2、Ba(NO3)2]当作食盐食用后,常用0.5%的Na2SO4溶液解毒;
⑨石灰岩(喀斯特地貌)溶洞的形成;
⑩BaCO3不能作“钡餐”,而BaSO4可以。
C
A. 4 B. 5 C. 6 D. 7
1
2
3
4
5
6
7
8
9
10
11
12
解析:NH4Cl与ZnCl2溶液都是强酸弱碱盐,水解使溶液显弱酸性,因此可作焊接金属 时的除锈剂,与盐的水解有关,①符合题意;NaHCO3是强碱弱酸盐,水解使溶液显 碱性,Al2(SO4)3是强酸弱碱盐,水解使溶液显酸性,当两种溶液混合时,水解反 应相互促进,会产生Al(OH)3沉淀、CO2气体,它们不支持燃烧,能够隔绝空气, 因此可作泡沫灭火剂,与盐的水解反应有关,②符合题意;草木灰(主要成分K2CO3)水解使溶液显碱性,当其与铵态氮肥混合,会发生反应产生NH3逸出,导致肥效降低,因此二者不能混合施用,与盐的水解反应有关,③符合题意;Na2CO3溶液水解显碱性,能够与玻璃中的SiO2发生反应,产生的物质Na2SiO3会将试剂瓶与玻璃塞粘在一起,因此实验室中盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞,与盐的水解反应有关,④符合题意; CuCl2是强酸弱碱盐,在溶液中CuCl2发生水解反应产生Cu(OH)2、HCl,加热溶液,水解产生的HCl挥发逸出,当蒸干CuCl2溶液时并灼烧,产生的固体Cu(OH)2分解产生CuO,因此最终可以得到CuO固体,与盐的水解反应有关,
1
2
3
4
5
6
7
8
9
10
11
12
⑤符合题意;Fe2+具有还原性,与Cl2会发生反应产生FeCl3,达到除杂目的,故要除去FeCl3溶液中混有的Fe2+,可通入氧化剂Cl2,与盐的水解反应无关,⑥不符合题意;碱性溶液能够与油脂发生反应产生可溶性物质,因而可去除油污,纯碱是碳酸钠,属于强碱弱酸盐,水解使溶液显碱性,盐水解反应是吸热反应,升高温度,盐水解程度增大,盐溶液碱性增强,因而热纯碱溶液洗涤油污的能力比冷纯碱溶液强,与盐的水解反应有关,⑦符合题意;误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用后,常用0.5%的Na2SO4溶液解毒,是由于它们会发生复分解反应产生既不溶于水,也不溶于酸的BaSO4沉淀,与盐的水解反应无关,⑧不符合题意;石灰岩(喀斯特地貌)溶洞的形成是由于CaCO3与水中的CO2、H2O发生反应,产生可溶性Ca(HCO3)2随流水被冲走形成溶洞,与盐的水解反应无关,⑨不符合题意;BaCO3不能作“钡餐”,而BaSO4可以,是由于BaCO3不溶于水,但能够溶于盐酸,而BaSO4既不溶于水,也不溶于酸,因此BaCO3不能作“钡餐”,而BaSO4可以,与盐的水解反应无关,⑩不符合题意。故选C。
1
2
3
4
5
6
7
8
9
10
11
12
A. 该水解常数表达式为:
B. 加水稀释,平衡右移,溶液颜色变浅
C. 滴加浓盐酸,平衡左移,溶液绿色加深
D. 升高温度,硝酸亚铁水解程度增大
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
选项 实验目的 实验内容
A 制备无水MgCl2固体 在蒸发皿中将MgCl2溶液蒸干
B 证明Na2CO3溶液中存在水解平衡 向含有酚酞的Na2CO3溶液中加入少量 CaCl2固体,溶液红色变浅
C 证明CH3COOH是弱电解质 用pH计分别测量醋酸和盐酸的pH,醋 酸的pH大
D 证明CH3COOH酸性强于HClO 室温下,用pH试纸测定浓度为0.1 mol·L-1 NaClO溶液和0.1 mol·L-1 CH3COONa溶液的pH
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
>
1
2
3
4
5
6
7
8
9
10
11
12
(2)常温下,HCOOH电离常数Ka为 ,CH3COONa水解常数 Kh为 。
10-3.75或1.8×10-4
10-9.25
1
2
3
4
5
6
7
8
9
10
11
12
(3)常温下,加水稀释0.1 mol·L-1 HCOONa溶液,下列“物理量”始终增大的 是 (填字母)。
A. Kw
C. c(OH-)
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(4)等体积等物质的量浓度的①HCOONa溶液和②CH3COONa溶液中离子总数: ① (填“>”“<”或“=”)②。
解析:(4)根据电荷守恒,甲酸钠、乙酸钠溶液中总离子浓度均为2c(Na+)+2c (H+),甲酸钠水解程度小于乙酸钠,即乙酸根离子结合氢离子能力比甲酸根离子 强,则甲酸钠溶液中的氢氧根浓度小,氢离子浓度大,故离子总数:①>②。
(5)常温下,用HCOOH溶液吸收氨气得到含1.0 mol·L-1 HCOOH和0.18 mol·L-1 HCOONH4的混合溶液,该溶液pH约为 。
>
3
1
2
3
4
5
6
7
8
9
10
11
12
12. (2025·陕西省宝鸡市长岭中学高二阶段练习)Ⅰ.25 ℃时,NaOH和Na2CO3两溶液 的pH均为11。
(1)两溶液中,由水电离的c(OH-)分别是:NaOH溶液中 ; Na2CO3溶液中 。
10-11 mol·L-1
10-3 mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
(2)各取10 mL上述两种溶液,分别加水稀释到100 mL,pH变化较大的是
(填化学式)溶液。
NaOH
1
2
3
4
5
6
7
8
9
10
11
12
向纯
碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白
1
2
3
4
5
6
7
8
9
10
11
12
Ⅱ.现有25 ℃时0.1 mol·L-1的氨水溶液。
<
1
2
3
4
5
6
7
8
9
10
11
12
0.5a
1
2
3
4
5
6
7
8
9
10
11
12
c(Na+)>c(OH-)>c(H+)
1
2
3
4
5
6
7
8
9
10
11
12
Ⅲ.盐类水解在实验室和生产、生活中有广泛的应用。
酸
Ag++
抑制Ag+
水解
1
2
3
4
5
6
7
8
9
10
11
12
(8)FeCl3净水的原理是 (用离子方程 式表示)。
(9)泡沫灭火器内装有NaHCO3饱和溶液和Al2(SO4)3溶液,当意外失火时,使泡 沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关 的离子方程式为
。
1
2
3
4
5
6
7
8
9
10
11
12
>
1
2
3
4
5
6
7
8
9
10
11
12
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
第2课时 影响盐类水解的主要因素 盐类水解的应用
一、影响盐类水解的主要因素
1. 盐类水解的特征
(1)盐类的水解反应可看作中和反应的逆反应,故是 反应。
(2)盐类的水解反应是 反应。
吸热
可逆
2. 实验探究反应条件对盐类水解平衡的影响
影响因素 实验步骤 实验现象 解释
盐的浓度 加入FeCl3晶 体,再测溶液的 pH 溶液颜色 变 ,pH 加入FeCl3晶体,c(Fe3+)增 大,水解平衡向 方 向移动
深
变
小
正反应
影响因素 实验步骤 实验现象 解释
溶液的
酸碱度 加盐酸后,测 溶液的pH 溶液颜色变 , pH 加入盐酸,c(H+)增大,水 解平衡向 方向移 动,但c(H+)仍比原平衡中 c(H+)大
加入少量 NaOH溶液 产生 色沉淀 加入氢氧化钠后,OH-消耗
H+,c(H+)减小,水解平衡向 方向移动
温度 升高温度 溶液颜色变 , pH 水解反应为吸热反应,升高温 度,水解平衡向 方 向移动
浅
变小
逆反应
红褐
正反应
深
变小
正反应
3. 影响盐类水解平衡的因素
(1)内因
①主要因素是盐本身的性质,组成盐的酸根离子对应的酸越弱或阳离子对应的碱越 弱,水解程度就越大(越弱越水解)。
例如,酸性:HF>CH3COOH,则水解程度:NaF<CH3COONa。
②多元弱酸正盐的水解,水解反应第一步远远大于第二步,原因是正盐阴离子与H+ 结合能力比酸式盐阴离子结合能力强并且第一步水解产生的OH-对第二步水解有抑制 作用。例如,Na2CO3溶液中
(2)外因
因素及其变化 水解平衡 水解程度 水解产生离子的浓度
温度 升高
浓度 增大
减小(即稀释)
外加
酸碱 酸
碱
右移
增大
增大
右移
减小
增大
右移
增大
减小
弱碱阳离子水解程度减小
弱酸阴离子水解程度减小
【判断】
×
×
√
×
×
√
A. 随温度升高,纯水中c(H+)>c(OH-)
B. 随温度升高,CH3COONa溶液的c(OH-)减小
C. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
D. 温度升高至60 ℃,CH3COONa溶液中由水电离出的
c(OH-)是10-5.1 mol·L-1
D
A. 稀释溶液,水解平衡常数增大
B. 加入CuSO4固体,HS-浓度减小
D. 加入NaOH固体,溶液pH减小
B
3. 如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放 置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体, 烧杯②中不加任何物质。
CH3COOH+OH-,使溶液显碱性
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述 正确的是 。
A. 水解反应为放热反应
B. 水解反应为吸热反应
C. NH4NO3晶体溶于水时放出热量
D. NH4NO3晶体溶于水时吸收热量
(3)分别向浓度均为0.01 mol·L-1 CH3COONa溶液中分别加入NaOH固体、Na2CO3 固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为 、 、
(填“向左”“向右”或“不移动”)。
BD
向左
向左
向右
二、盐的水解常数及应用
1. 盐的水解常数
(1)水解常数(Kh)与电离常数的定量关系
(2)结论归纳
①Ka·Kh=Kw或Kb·Kh=Kw;
2. 盐的水解常数(Kh)的应用
A. 25 ℃时,CN-的水解常数Kh(CN-)≈2.04×10-4
C. 同浓度的CH3COONa溶液和NaCN溶液中,CH3COONa溶液的离子总浓度较小
D. 若加水稀释醋酸钠溶液,溶液中所有离子浓度均减小
B
9
2.36×10-5
1×10-12
增大
3. 磷酸是三元弱酸,常温下三级电离常数分别是Ka1=7.1×10-3,Ka2=6.2×10- 8,Ka3=4.5×10-13,回答下列问题:
(2)常温下,NaH2PO4的水溶液pH (填“>”“<”或“=”)7。
③
<②<①
<
碱
Na2HPO4溶液显碱性
三、盐类水解的应用
1. 在化学实验中的应用
应用 举例
判断溶液的酸碱性 (谁强显谁性,同 强显中性) FeCl3溶液显酸性,原因是
判断酸性强弱 相同浓度的NaX、NaY、NaZ溶液的pH分别为8、9、10,则酸 性:
配制或贮存易
水解的盐溶液 配制CuSO4溶液时,加入少量 ,抑制Cu2+水解;贮 存Na2CO3溶液不能用 玻璃塞
胶体的制取 制取Fe(OH)3胶体的离子反应:
HX>HY>HZ
H2SO4
磨口
(OH)3(胶体)+3H+
应用 举例
制备无水盐 将挥发性酸的弱碱盐如AlCl3、FeCl3溶液蒸干时,在通HCl的 气流中加热蒸干
判断离子是否共存
判断中和反应至
中性的试剂用量 如NH3·H2O与HCl反应至中性时, 过量, CH3COOH与NaOH反应至中性时, 过量
制备无机化合物 如用TiCl4制备TiO2,其反应的化学方程式为 ,加入大量的水,同时加 热,促使水解趋于完全,所得TiO2·xH2O经焙烧得到TiO2
NH3·H2O
CH3COOH
TiCl4+(x+
2. 在生产、生活中的应用
泡沫灭火
器原理 泡沫灭火器中药品成分为NaHCO3与Al2(SO4)3,发生的反应为
作净水剂 明矾可作净水剂,原理为
化肥的使用 铵态氮肥与草木灰 混合施用
除锈剂
热纯碱去
污能力强 加热,促进Na2CO3的水解,使c(OH-)增大,去污能力增强
不能
NH3·H2O+H+
3. 盐溶液蒸干灼烧后所得产物的判断
(1)盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如CuSO4(aq)蒸干得 CuSO4(s)。
(2)盐溶液水解生成易挥发性酸时,蒸干灼烧后一般得到对应的氧化物,如AlCl3 (aq)蒸干得到Al(OH)3,灼烧得到Al2O3。
(3)考虑盐受热时是否分解。
原物质 蒸干灼烧后固体物质
Ca(HCO3)2 CaCO3或CaO
NaHCO3 Na2CO3
KMnO4 K2MnO4和MnO2
NH4Cl 分解为NH3和HCl,无固体物质存在
(4)还原性盐在蒸干时会被O2氧化。如Na2SO3(aq)蒸干得Na2SO4(s)。
【判断】
×
×
×
√
×
×
×
①NH4Cl与ZnCl2溶液可作焊接金属的除锈剂
②NaHCO3与Al2(SO4)3两种溶液可作灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
D
A. ①②③ B. ②③④
C. ①④⑤ D. ①②③④⑤
①CuSO4 ②FeSO4 ③Ca(HCO3)2 ④NH4HCO3 ⑤KMnO4 ⑥FeCl3
A. 全部 B. 仅①②
C. 仅①⑤ D. 仅①
D
解析:CuSO4在水溶液中水解生成氢氧化铜和硫酸,硫酸是难挥发性酸,故加热蒸干 至质量不再减少时,能得到较纯净的原溶质,故①符合;FeSO4具有还原性,加热蒸 干时Fe2+被氧化为Fe3+,故②不符合;Ca(HCO3)2受热分解生成碳酸钙、二氧化碳 和水,加热蒸干至质量不再减少时,能得到较纯净的碳酸钙,故③不符合; NH4HCO3受热分解生成NH3、H2O和CO2,得不到原溶质,故④不符合;KMnO4加热 到质量不变时分解生成锰酸钾、二氧化锰和氧气,得不到原溶质,故⑤不符合; FeCl3溶液水解生成氢氧化铁和氯化氢,加热时,氯化氢挥发,促进FeCl3水解得到氢 氧化铁,得不到原溶质,故⑥不符合。故选D。
(用化学方程式表示并配以必要的文字说明,下同)。
Al2O3
在
移,HCl挥发,使平衡进一步向右移动得到Al(OH)3,在灼烧时发生反应2Al
低,水解平衡右移,使Mg粉不断溶解
不
能。应在HCl气流中加热蒸发
(4)向Na2SO3溶液中滴加酚酞,溶液变为红色,若再向该溶液中滴入过量的BaCl2溶 液,现象是 ,
产生白色沉淀,且溶液红色褪去
去
题后归纳
利用平衡移动原理解释问题的思维模板
(1)解答此类题的思维过程
①找出存在的平衡体系(即可逆反应或可逆过程)。
②找出影响平衡的条件。
③判断平衡移动的方向。
④分析平衡移动的结果及移动结果与所解答问题的联系。
(2)答题模板
……存在……平衡,……(条件)……(变化),使平衡向……(方向)移 动,……(结论)。
课时作业(二十二)
影响盐类水解的主要因素 盐类水解的应用
[对点训练]
题组一 影响盐类水解的因素
A. FeCl3溶液显黄色,没有 Fe(OH)3存在
B. 稀释过程中 FeCl3水解程度增大,c(H+)增大
D. 较浓盐酸可有效抑制Fe3+水解
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
B. 通入CO2,或者加入少量氯化铵溶液,溶液pH均减小
C. 升高温度,红色变深,平衡常数增大
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组二 盐类水解的应用
A. Al2S3不能通过水溶液的离子反应来制备
B. 将Al粉投入NaHSO4溶液中有气泡产生
C. 可用MgO除去MgCl2溶液中混有的FeCl3杂质
D. 加热蒸干FeCl3溶液得到FeCl3固体需要在HCl气流中进行
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 利用热的饱和Na2CO3溶液清洗餐具的油污
B. 草木灰与铵态氮肥混合施用后会降低肥效
C. 高铁酸钾可用于自来水的消毒杀菌
D. 在干燥的HCl气流中加热MgCl2·6H2O,可以获得无水MgCl2
解析:Na2CO3的水解是吸热反应,加热可以促进盐的水解,用Na2CO3溶液清洗油污 时,加热可以增强去污效果,与盐类水解有关,A不符合题意;铵态氮肥水解呈酸 性,而草木灰水解呈碱性,铵态氮肥与草木灰混施可降低肥效,与盐类水解有关,B 不符合题意;高铁酸钾可用于自来水的消毒杀菌,是由于其具有强氧化性,与盐类水 解无关,C符合题意;MgCl2·6H2O加热时发生水解,生成氢氧化镁和HCl,在干燥的 HCl气流中加热MgCl2·6H2O,可以抑制其水解,与盐类水解有关,D不符合题意。
C
1
2
3
4
5
6
7
8
9
10
11
12
题组三 盐类水解常数及其应用
A. 0.01 mol·L-1 NaClO溶液中,c(Na+)=c(HClO)+c(ClO-)
B. NaClO溶液长期露置在空气中,释放O2,漂白能力减弱
C. 等浓度的HClO与NaClO溶液等体积混合后溶液显碱性
D. 25 ℃,pH=6.0的NaClO和HClO的混合溶液中,c(HClO)>c(Na+)>c (ClO-)
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
C. 水的电离程度:c>b>a>d
D. 25 ℃时 ,NH4Cl水解平衡常数为(q-1)×10-7 (用q表示)
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
A. a点→b点→c点,Na2CO3的水解程度逐渐增大
B. b点开始,随温度升高,碳酸钠溶液pH逐渐降低,因此碳酸根水解是放热过程
C. 100 ℃时,纯水的pH=6,c点溶液中c(OH-)约为10-0.3 mol·L-1
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂;
②NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂;
③草木灰(主要成分K2CO3)与铵态氮肥不能混合施用;
④实验室中盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞;
⑤加热蒸干CuCl2溶液并灼烧,可以得到CuO固体;
⑥要除去FeCl3溶液中混有的Fe2+,可通入氧化剂Cl2;
⑦热纯碱溶液洗涤油污的能力比冷纯碱溶液强;
⑧误将钡盐[ BaCl2、Ba(NO3)2]当作食盐食用后,常用0.5%的Na2SO4溶液解毒;
⑨石灰岩(喀斯特地貌)溶洞的形成;
⑩BaCO3不能作“钡餐”,而BaSO4可以。
C
A. 4 B. 5 C. 6 D. 7
1
2
3
4
5
6
7
8
9
10
11
12
解析:NH4Cl与ZnCl2溶液都是强酸弱碱盐,水解使溶液显弱酸性,因此可作焊接金属 时的除锈剂,与盐的水解有关,①符合题意;NaHCO3是强碱弱酸盐,水解使溶液显 碱性,Al2(SO4)3是强酸弱碱盐,水解使溶液显酸性,当两种溶液混合时,水解反 应相互促进,会产生Al(OH)3沉淀、CO2气体,它们不支持燃烧,能够隔绝空气, 因此可作泡沫灭火剂,与盐的水解反应有关,②符合题意;草木灰(主要成分K2CO3)水解使溶液显碱性,当其与铵态氮肥混合,会发生反应产生NH3逸出,导致肥效降低,因此二者不能混合施用,与盐的水解反应有关,③符合题意;Na2CO3溶液水解显碱性,能够与玻璃中的SiO2发生反应,产生的物质Na2SiO3会将试剂瓶与玻璃塞粘在一起,因此实验室中盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞,与盐的水解反应有关,④符合题意; CuCl2是强酸弱碱盐,在溶液中CuCl2发生水解反应产生Cu(OH)2、HCl,加热溶液,水解产生的HCl挥发逸出,当蒸干CuCl2溶液时并灼烧,产生的固体Cu(OH)2分解产生CuO,因此最终可以得到CuO固体,与盐的水解反应有关,
1
2
3
4
5
6
7
8
9
10
11
12
⑤符合题意;Fe2+具有还原性,与Cl2会发生反应产生FeCl3,达到除杂目的,故要除去FeCl3溶液中混有的Fe2+,可通入氧化剂Cl2,与盐的水解反应无关,⑥不符合题意;碱性溶液能够与油脂发生反应产生可溶性物质,因而可去除油污,纯碱是碳酸钠,属于强碱弱酸盐,水解使溶液显碱性,盐水解反应是吸热反应,升高温度,盐水解程度增大,盐溶液碱性增强,因而热纯碱溶液洗涤油污的能力比冷纯碱溶液强,与盐的水解反应有关,⑦符合题意;误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用后,常用0.5%的Na2SO4溶液解毒,是由于它们会发生复分解反应产生既不溶于水,也不溶于酸的BaSO4沉淀,与盐的水解反应无关,⑧不符合题意;石灰岩(喀斯特地貌)溶洞的形成是由于CaCO3与水中的CO2、H2O发生反应,产生可溶性Ca(HCO3)2随流水被冲走形成溶洞,与盐的水解反应无关,⑨不符合题意;BaCO3不能作“钡餐”,而BaSO4可以,是由于BaCO3不溶于水,但能够溶于盐酸,而BaSO4既不溶于水,也不溶于酸,因此BaCO3不能作“钡餐”,而BaSO4可以,与盐的水解反应无关,⑩不符合题意。故选C。
1
2
3
4
5
6
7
8
9
10
11
12
A. 该水解常数表达式为:
B. 加水稀释,平衡右移,溶液颜色变浅
C. 滴加浓盐酸,平衡左移,溶液绿色加深
D. 升高温度,硝酸亚铁水解程度增大
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
选项 实验目的 实验内容
A 制备无水MgCl2固体 在蒸发皿中将MgCl2溶液蒸干
B 证明Na2CO3溶液中存在水解平衡 向含有酚酞的Na2CO3溶液中加入少量 CaCl2固体,溶液红色变浅
C 证明CH3COOH是弱电解质 用pH计分别测量醋酸和盐酸的pH,醋 酸的pH大
D 证明CH3COOH酸性强于HClO 室温下,用pH试纸测定浓度为0.1 mol·L-1 NaClO溶液和0.1 mol·L-1 CH3COONa溶液的pH
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
>
1
2
3
4
5
6
7
8
9
10
11
12
(2)常温下,HCOOH电离常数Ka为 ,CH3COONa水解常数 Kh为 。
10-3.75或1.8×10-4
10-9.25
1
2
3
4
5
6
7
8
9
10
11
12
(3)常温下,加水稀释0.1 mol·L-1 HCOONa溶液,下列“物理量”始终增大的 是 (填字母)。
A. Kw
C. c(OH-)
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(4)等体积等物质的量浓度的①HCOONa溶液和②CH3COONa溶液中离子总数: ① (填“>”“<”或“=”)②。
解析:(4)根据电荷守恒,甲酸钠、乙酸钠溶液中总离子浓度均为2c(Na+)+2c (H+),甲酸钠水解程度小于乙酸钠,即乙酸根离子结合氢离子能力比甲酸根离子 强,则甲酸钠溶液中的氢氧根浓度小,氢离子浓度大,故离子总数:①>②。
(5)常温下,用HCOOH溶液吸收氨气得到含1.0 mol·L-1 HCOOH和0.18 mol·L-1 HCOONH4的混合溶液,该溶液pH约为 。
>
3
1
2
3
4
5
6
7
8
9
10
11
12
12. (2025·陕西省宝鸡市长岭中学高二阶段练习)Ⅰ.25 ℃时,NaOH和Na2CO3两溶液 的pH均为11。
(1)两溶液中,由水电离的c(OH-)分别是:NaOH溶液中 ; Na2CO3溶液中 。
10-11 mol·L-1
10-3 mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
(2)各取10 mL上述两种溶液,分别加水稀释到100 mL,pH变化较大的是
(填化学式)溶液。
NaOH
1
2
3
4
5
6
7
8
9
10
11
12
向纯
碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白
1
2
3
4
5
6
7
8
9
10
11
12
Ⅱ.现有25 ℃时0.1 mol·L-1的氨水溶液。
<
1
2
3
4
5
6
7
8
9
10
11
12
0.5a
1
2
3
4
5
6
7
8
9
10
11
12
c(Na+)>c(OH-)>c(H+)
1
2
3
4
5
6
7
8
9
10
11
12
Ⅲ.盐类水解在实验室和生产、生活中有广泛的应用。
酸
Ag++
抑制Ag+
水解
1
2
3
4
5
6
7
8
9
10
11
12
(8)FeCl3净水的原理是 (用离子方程 式表示)。
(9)泡沫灭火器内装有NaHCO3饱和溶液和Al2(SO4)3溶液,当意外失火时,使泡 沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关 的离子方程式为
。
1
2
3
4
5
6
7
8
9
10
11
12
>
1
2
3
4
5
6
7
8
9
10
11
12
