人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第一节电离平衡第1课时强电解质和弱电解质弱电解质的电离平衡课件(共54张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第一节电离平衡第1课时强电解质和弱电解质弱电解质的电离平衡课件(共54张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-25 00:00:00 | ||
图片预览










文档简介
(共54张PPT)
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
第1课时 强电解质和弱电解质 弱电解质的电离平衡
【学习目标】 1.从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、性 质和反应。2.理解强电解质、弱电解质的概念。3.认识弱电解质在水溶液中存在电离 平衡,了解电离平衡常数的含义。
一、强电解质和弱电解质
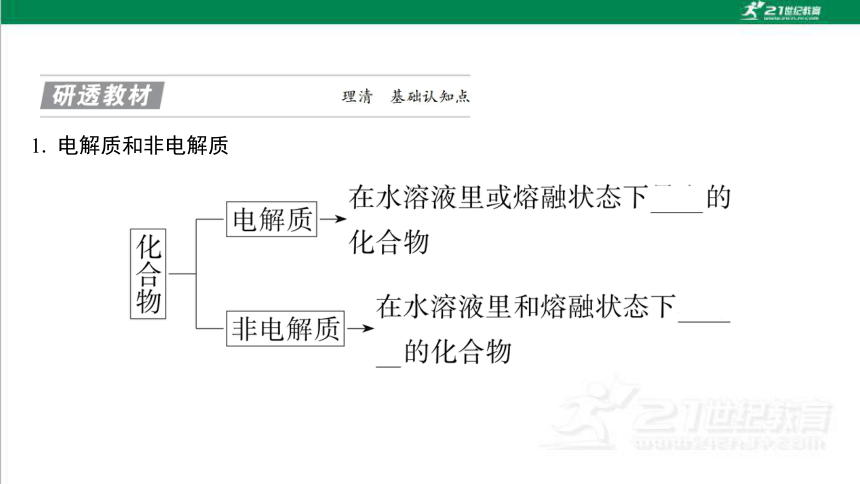
1. 电解质和非电解质
2. 强电解质与弱电解质的比较
(1)实验探究——盐酸和醋酸的电离程度
取相同体积、0.1 mol·L-1的盐酸和醋酸,比较它们pH的大小,试验其导电能力,并 分别与等量镁条反应。观察、比较并记录现象。
酸 0.1 mol·L-1盐酸 0.1 mol·L-1醋酸
pH
导电能力
与镁条 反应 现象 反应剧烈,产生气泡 反应缓慢,产生气泡
结论 镁条与盐酸反应快,表明盐酸中c(H+)较大,说明盐酸的电离程 度 醋酸的电离程度
小
大
强
弱
大于
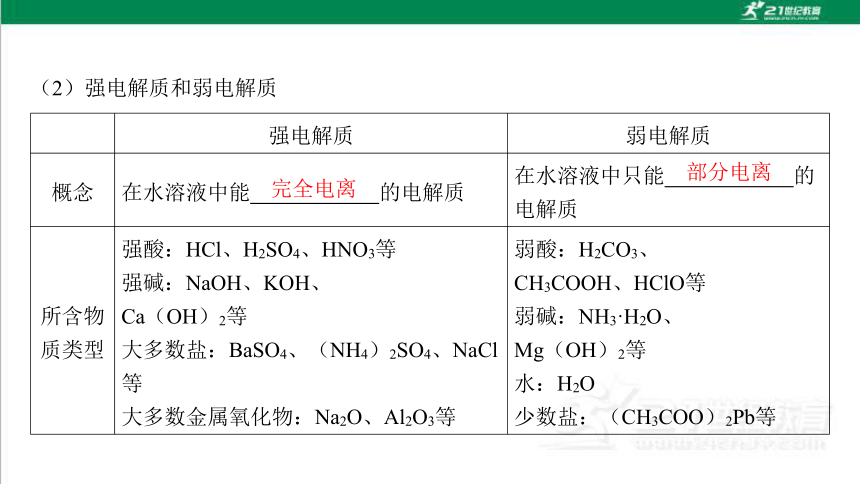
(2)强电解质和弱电解质
强电解质 弱电解质
概念 在水溶液中能 的电解质 在水溶液中只能 的 电解质
所含物
质类型 强酸:HCl、H2SO4、HNO3等
强碱:NaOH、KOH、
Ca(OH)2等
大多数盐:BaSO4、(NH4)2SO4、NaCl 等
大多数金属氧化物:Na2O、Al2O3等 弱酸:H2CO3、
CH3COOH、HClO等
弱碱:NH3·H2O、
Mg(OH)2等
水:H2O
少数盐:(CH3COO)2Pb等
完全电离
部分电离
强电解质 弱电解质
相同点 都能电离、都是 、都是
不同点 电离程度 ,溶质存在形式
电离
方程式
电解质
化合物
不同
不同
3. 电解质电离的表示方法——电离方程式
②多元弱酸分步电离(其中以第一步电离为主),必须分步写出,不可合并,如 H2CO3:
。
(3)酸式盐
②弱酸的酸式盐、酸式酸根不拆,如NaHCO3在水溶液中的电离方程式 为 。
Fe
【判断】
×
×
×
√
×
×
×
A. 弱电解质在溶液中部分电离,存在电离平衡
B. 在溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
C. 弱电解质的溶液中,溶质分子浓度大于其电离出的离子浓度
D. 纯净的强电解质在液态时,有的导电,有的不导电
B
解析:强电解质在溶液中完全电离,不存在电离平衡,弱电解质在溶液中部分 电离,存在电离平衡,A正确;强电解质和弱电解质是根据电解质在溶液中的电 离程度区分的,而溶液导电能力取决于溶液中自由移动离子的浓度及离子所带 电荷数,所以,强电解质的导电能力不一定强,弱电解质的导电能力也不一定 弱,B错误;弱电解质在溶液中不能完全电离,溶质分子浓度大于其电离出的离 子浓度,C正确;若强电解质是离子化合物,其液态时导电,若强电解质是共价 化合物,其液态时不导电,D正确。
2. ①NaCl溶液,②熔融的NaCl,③NaCl固体,④盐酸,⑤硫酸,⑥CaCO3,⑦Cl2, ⑧SO2,⑨NH3,⑩冰醋酸, NH3·H2O。根据上述物质回答下列问题:
(1)属于电解质的有 (填序号,下同)。
(2)属于非电解质的有 。
(3)属于强电解质的有 。
(4)属于弱电解质的有 。
(5)能导电的有 。
②③⑤⑥⑩
⑧⑨
②③⑤⑥
⑩
①②④
3. 写出下列各组物质的电离方程式。
二、弱电解质的电离平衡
1. 弱电解质的电离平衡
(1)电离平衡的建立:在一定条件下(如温度、浓度等),溶液中弱电解质分子电 离成离子的速率和离子结合成分子的速率相等时,电离达到平衡状态。如图所示:
电离
的速率和离子结合为分子的速率
2. 影响电离平衡的外界条件
影响因素 原因分析 电离平衡移动方向 电离程度变化
温度 电离是吸热的 升高温度,正向移动 变大
改变弱
电解质
浓度 加水稀释 正向移动 变大
增大弱电解
质的浓度 正向移动 变小
同离子效应 增大了生成的离子的浓度 逆向移动 变小
化学反应 减小了生成的离子的浓度 正向移动 变大
改变条件 电离平衡移动方向 n(H+) c(H+) 导电能力
加水稀释
加入少量
冰醋酸
通入HCl(g)
加NaOH(s)
加入CH3COONa(s)
升高温度
向右
增大
减小
减弱
向右
增大
增大
增强
向左
增大
增大
增强
向右
减小
减小
增强
向左
减小
减小
增强
向右
增大
增大
增强
3. 电解质溶液的导电能力
(1)电解质导电的条件:电解质的导电条件是在水溶液中或高温熔融状态,共价化 合物只能在 中导电,离子化合物在 中均可导电。
(2)电解质溶液的导电能力:取决于溶液中自由移动离子的浓度和离子所带电荷 数,自由移动离子的浓度越 、离子所带电荷数越 ,导电能力越强。
水溶液
熔融状态和溶液
大
多
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥MgSO4固体
A. ①②③⑤ B. ③⑥
C. ③ D. ③④
C
①加大理石;②加少量浓醋酸;③加少量CH3COONa;④加少量浓盐酸;⑤加水;⑥ 加热
A. ①③⑥ B. ①③⑤⑥
C. ①②③⑥ D. ①②④⑥
B
3. 某化学小组在一定温度下,将冰醋酸加水稀释,溶液的导电能力I随加入水的体积 V变化的曲线如图所示。
O点冰醋酸中没有水,冰醋酸未电离,无离子
存在
增大
加水稀释,醋酸的电离平衡向右移动,n(H+)增大,但溶液体积增
大的程度没有n(H+)增大的程度大,因而c(H+)增大
减小
加水稀释,醋酸的电离平衡向右移动,n(H+)增大,但溶液体积增
大的程度更大,因而c(H+)减小
课堂强研习 合作学习 精研重难
课时作业(十五) 强电解质和弱电解质 弱电解质的电离平衡
[对点训练]
题组一 电解质及其分类和电离
A. Cu能导电,Cu为电解质
B. 强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
C. 电解质溶液之所以导电,是因为电流通过时,电解质发生了电离
D. 二氧化碳的水溶液能导电,但CO2属于非电解质
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:电解质应为化合物,故A错误;未指明酸的浓度的大小,无法确定溶液中氢离 子浓度大小,故B错误;电解质溶液之所以导电,是因为电解质溶于水后电离产生可 自由移动的离子,从而使溶液导电,故C错误;二氧化碳的水溶液能导电,是因为二 氧化碳与水反应生成弱电解质碳酸,碳酸电离产生氢离子、碳酸氢根离子等而使溶液 导电,并非二氧化碳本身电离,所以二氧化碳属于非电解质,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
C
1
2
3
4
5
6
7
8
9
10
11
12
选项 A B C D
强电解质 Ba(OH)2 BaSO4 HF HClO4
弱电解质 HI NH3·H2O Fe(OH)3 HClO
非电解质 SO2 乙醇 NH3 Cl2
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 自来水
B. 0.5 mol·L-1盐酸
C. 0.5 mol·L-1氨水
D. 0.5 mol·L-1硝酸钠溶液
B
1
2
3
4
5
6
7
8
9
10
11
12
A. ab段,溶液导电能力减弱是由于溶液中离子数目基本不变,溶 液体积增大,离子浓度减小
C. cd段,由于CH3COOH是弱酸,溶液中离子个数减少,故溶液导电能力下降
D. d点以后,随着CH3COOH溶液的滴加,溶液导电能力不可能增强
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组三 弱电解质的电离平衡及移动
A. 加水,平衡向右移动,溶液中氢离子浓度增大
B. 通入过量SO2气体,平衡向左移动,溶液pH增大
C. 滴加新制氯水,平衡向左移动,溶液pH减小
D. 加入少量硫酸铜固体(忽略溶液体积变化),溶液中所有离子浓度都减小
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. H3BO3为一元弱酸
B. 加水时,平衡正向移动,导电能力增强
C. 向硼酸溶液中加入少量冰醋酸,平衡逆向移动,溶液的酸性增强
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
B. 随着水的加入,溶液中的导电离子数目逐渐减小
C. 随着水的加入,溶液的pH逐渐减小
D. 向a点对应的体系中加入CH3COONa固体,醋酸的电离平衡逆向 移动,溶液的导电性减弱
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 原HCOOH溶液的浓度为0.001 mol·L-1
B. HCOOH的电离程度增大,溶液中所有离子的浓度均减小
C. 加水稀释至100 mL时,HCOOH溶液的pH<4
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. NaHCO3属于强电解质,H2CO3属于弱电解质
B. NaHCO3属于酸式盐,NaHCO3溶液呈酸性
C. 当体系中增加少量强酸时,平衡正向移动而消耗H+
D. 当体系中增加少量强碱时,平衡逆向移动而消耗OH-
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 适当升高温度 B. 加入NH4Cl固体
C. 通入NH3 D. 加入少量浓盐酸
BD
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(2)一定温度下,现有a.盐酸,b.硫酸,c.醋酸三种酸。
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的 量由大到小的顺序是 (用a、b、c表示,下同)。
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的 体积由大到小的顺序是 。
③当三者c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若 产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 。
b>a=c
c>a=b
a=b=c
1
2
3
4
5
6
7
8
9
10
11
12
解析:(2)①中和1 mol H2SO4消耗2 mol NaOH,中和1 mol盐酸或醋酸,均消耗1 mol NaOH,当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH 的物质的量由大到小的顺序是b>a=c;②硫酸和盐酸为强酸,完全电离,醋酸为弱 酸,只发生了部分的电离,当三者c(H+)相同且体积也相同时,说明醋酸的浓度远 远大于硫酸和盐酸,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序 是c>a=b;③当三者c(H+)相同、体积相同时,若产生相同体积的H2(相同状 况),由于开始时c(H+)相同,则开始时反应速率的大小关系为a=b=c。
1
2
3
4
5
6
7
8
9
10
11
12
(3)将0.1 mol/L的CH3COOH溶液加水稀释,下列有关稀释后CH3COOH溶液的说法 正确的是 (填字母)。
A. 电离程度增大
B. 溶液中离子总数增多
C. 溶液导电能力增强
D. 溶液中醋酸分子增多
AB
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
12. 在一定温度下,对冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积 V变化的曲线如图所示。
请回答下列问题:
(1)a、b、c三点对应的溶液中,c(H+)由小到大的顺序为 (用a、 b、c表示)。
(2)a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是 (填 “a”“b”或“c”)。
c<a<b
c
1
2
3
4
5
6
7
8
9
10
11
12
(3)若使c点对应的溶液中c(CH3COO-)增大,则下列措施中,可行的 是 (填字母,下同)。
A. 加热
B. 加入NaOH稀溶液
C. 加入K2CO3固体
D. 加水
E. 加入CH3COONa固体
F. 加入锌粒
ACEF
1
2
3
4
5
6
7
8
9
10
11
12
(4)在稀释过程中,随着醋酸浓度的减小,下列始终保持增大趋势的是 。
A. c(H+)
B. n(H+)
C. CH3COOH分子数
BD
1
2
3
4
5
6
7
8
9
10
11
12
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
第1课时 强电解质和弱电解质 弱电解质的电离平衡
【学习目标】 1.从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、性 质和反应。2.理解强电解质、弱电解质的概念。3.认识弱电解质在水溶液中存在电离 平衡,了解电离平衡常数的含义。
一、强电解质和弱电解质
1. 电解质和非电解质
2. 强电解质与弱电解质的比较
(1)实验探究——盐酸和醋酸的电离程度
取相同体积、0.1 mol·L-1的盐酸和醋酸,比较它们pH的大小,试验其导电能力,并 分别与等量镁条反应。观察、比较并记录现象。
酸 0.1 mol·L-1盐酸 0.1 mol·L-1醋酸
pH
导电能力
与镁条 反应 现象 反应剧烈,产生气泡 反应缓慢,产生气泡
结论 镁条与盐酸反应快,表明盐酸中c(H+)较大,说明盐酸的电离程 度 醋酸的电离程度
小
大
强
弱
大于
(2)强电解质和弱电解质
强电解质 弱电解质
概念 在水溶液中能 的电解质 在水溶液中只能 的 电解质
所含物
质类型 强酸:HCl、H2SO4、HNO3等
强碱:NaOH、KOH、
Ca(OH)2等
大多数盐:BaSO4、(NH4)2SO4、NaCl 等
大多数金属氧化物:Na2O、Al2O3等 弱酸:H2CO3、
CH3COOH、HClO等
弱碱:NH3·H2O、
Mg(OH)2等
水:H2O
少数盐:(CH3COO)2Pb等
完全电离
部分电离
强电解质 弱电解质
相同点 都能电离、都是 、都是
不同点 电离程度 ,溶质存在形式
电离
方程式
电解质
化合物
不同
不同
3. 电解质电离的表示方法——电离方程式
②多元弱酸分步电离(其中以第一步电离为主),必须分步写出,不可合并,如 H2CO3:
。
(3)酸式盐
②弱酸的酸式盐、酸式酸根不拆,如NaHCO3在水溶液中的电离方程式 为 。
Fe
【判断】
×
×
×
√
×
×
×
A. 弱电解质在溶液中部分电离,存在电离平衡
B. 在溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
C. 弱电解质的溶液中,溶质分子浓度大于其电离出的离子浓度
D. 纯净的强电解质在液态时,有的导电,有的不导电
B
解析:强电解质在溶液中完全电离,不存在电离平衡,弱电解质在溶液中部分 电离,存在电离平衡,A正确;强电解质和弱电解质是根据电解质在溶液中的电 离程度区分的,而溶液导电能力取决于溶液中自由移动离子的浓度及离子所带 电荷数,所以,强电解质的导电能力不一定强,弱电解质的导电能力也不一定 弱,B错误;弱电解质在溶液中不能完全电离,溶质分子浓度大于其电离出的离 子浓度,C正确;若强电解质是离子化合物,其液态时导电,若强电解质是共价 化合物,其液态时不导电,D正确。
2. ①NaCl溶液,②熔融的NaCl,③NaCl固体,④盐酸,⑤硫酸,⑥CaCO3,⑦Cl2, ⑧SO2,⑨NH3,⑩冰醋酸, NH3·H2O。根据上述物质回答下列问题:
(1)属于电解质的有 (填序号,下同)。
(2)属于非电解质的有 。
(3)属于强电解质的有 。
(4)属于弱电解质的有 。
(5)能导电的有 。
②③⑤⑥⑩
⑧⑨
②③⑤⑥
⑩
①②④
3. 写出下列各组物质的电离方程式。
二、弱电解质的电离平衡
1. 弱电解质的电离平衡
(1)电离平衡的建立:在一定条件下(如温度、浓度等),溶液中弱电解质分子电 离成离子的速率和离子结合成分子的速率相等时,电离达到平衡状态。如图所示:
电离
的速率和离子结合为分子的速率
2. 影响电离平衡的外界条件
影响因素 原因分析 电离平衡移动方向 电离程度变化
温度 电离是吸热的 升高温度,正向移动 变大
改变弱
电解质
浓度 加水稀释 正向移动 变大
增大弱电解
质的浓度 正向移动 变小
同离子效应 增大了生成的离子的浓度 逆向移动 变小
化学反应 减小了生成的离子的浓度 正向移动 变大
改变条件 电离平衡移动方向 n(H+) c(H+) 导电能力
加水稀释
加入少量
冰醋酸
通入HCl(g)
加NaOH(s)
加入CH3COONa(s)
升高温度
向右
增大
减小
减弱
向右
增大
增大
增强
向左
增大
增大
增强
向右
减小
减小
增强
向左
减小
减小
增强
向右
增大
增大
增强
3. 电解质溶液的导电能力
(1)电解质导电的条件:电解质的导电条件是在水溶液中或高温熔融状态,共价化 合物只能在 中导电,离子化合物在 中均可导电。
(2)电解质溶液的导电能力:取决于溶液中自由移动离子的浓度和离子所带电荷 数,自由移动离子的浓度越 、离子所带电荷数越 ,导电能力越强。
水溶液
熔融状态和溶液
大
多
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥MgSO4固体
A. ①②③⑤ B. ③⑥
C. ③ D. ③④
C
①加大理石;②加少量浓醋酸;③加少量CH3COONa;④加少量浓盐酸;⑤加水;⑥ 加热
A. ①③⑥ B. ①③⑤⑥
C. ①②③⑥ D. ①②④⑥
B
3. 某化学小组在一定温度下,将冰醋酸加水稀释,溶液的导电能力I随加入水的体积 V变化的曲线如图所示。
O点冰醋酸中没有水,冰醋酸未电离,无离子
存在
增大
加水稀释,醋酸的电离平衡向右移动,n(H+)增大,但溶液体积增
大的程度没有n(H+)增大的程度大,因而c(H+)增大
减小
加水稀释,醋酸的电离平衡向右移动,n(H+)增大,但溶液体积增
大的程度更大,因而c(H+)减小
课堂强研习 合作学习 精研重难
课时作业(十五) 强电解质和弱电解质 弱电解质的电离平衡
[对点训练]
题组一 电解质及其分类和电离
A. Cu能导电,Cu为电解质
B. 强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
C. 电解质溶液之所以导电,是因为电流通过时,电解质发生了电离
D. 二氧化碳的水溶液能导电,但CO2属于非电解质
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:电解质应为化合物,故A错误;未指明酸的浓度的大小,无法确定溶液中氢离 子浓度大小,故B错误;电解质溶液之所以导电,是因为电解质溶于水后电离产生可 自由移动的离子,从而使溶液导电,故C错误;二氧化碳的水溶液能导电,是因为二 氧化碳与水反应生成弱电解质碳酸,碳酸电离产生氢离子、碳酸氢根离子等而使溶液 导电,并非二氧化碳本身电离,所以二氧化碳属于非电解质,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
C
1
2
3
4
5
6
7
8
9
10
11
12
选项 A B C D
强电解质 Ba(OH)2 BaSO4 HF HClO4
弱电解质 HI NH3·H2O Fe(OH)3 HClO
非电解质 SO2 乙醇 NH3 Cl2
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 自来水
B. 0.5 mol·L-1盐酸
C. 0.5 mol·L-1氨水
D. 0.5 mol·L-1硝酸钠溶液
B
1
2
3
4
5
6
7
8
9
10
11
12
A. ab段,溶液导电能力减弱是由于溶液中离子数目基本不变,溶 液体积增大,离子浓度减小
C. cd段,由于CH3COOH是弱酸,溶液中离子个数减少,故溶液导电能力下降
D. d点以后,随着CH3COOH溶液的滴加,溶液导电能力不可能增强
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组三 弱电解质的电离平衡及移动
A. 加水,平衡向右移动,溶液中氢离子浓度增大
B. 通入过量SO2气体,平衡向左移动,溶液pH增大
C. 滴加新制氯水,平衡向左移动,溶液pH减小
D. 加入少量硫酸铜固体(忽略溶液体积变化),溶液中所有离子浓度都减小
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. H3BO3为一元弱酸
B. 加水时,平衡正向移动,导电能力增强
C. 向硼酸溶液中加入少量冰醋酸,平衡逆向移动,溶液的酸性增强
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
B. 随着水的加入,溶液中的导电离子数目逐渐减小
C. 随着水的加入,溶液的pH逐渐减小
D. 向a点对应的体系中加入CH3COONa固体,醋酸的电离平衡逆向 移动,溶液的导电性减弱
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 原HCOOH溶液的浓度为0.001 mol·L-1
B. HCOOH的电离程度增大,溶液中所有离子的浓度均减小
C. 加水稀释至100 mL时,HCOOH溶液的pH<4
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. NaHCO3属于强电解质,H2CO3属于弱电解质
B. NaHCO3属于酸式盐,NaHCO3溶液呈酸性
C. 当体系中增加少量强酸时,平衡正向移动而消耗H+
D. 当体系中增加少量强碱时,平衡逆向移动而消耗OH-
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 适当升高温度 B. 加入NH4Cl固体
C. 通入NH3 D. 加入少量浓盐酸
BD
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(2)一定温度下,现有a.盐酸,b.硫酸,c.醋酸三种酸。
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的 量由大到小的顺序是 (用a、b、c表示,下同)。
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的 体积由大到小的顺序是 。
③当三者c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若 产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 。
b>a=c
c>a=b
a=b=c
1
2
3
4
5
6
7
8
9
10
11
12
解析:(2)①中和1 mol H2SO4消耗2 mol NaOH,中和1 mol盐酸或醋酸,均消耗1 mol NaOH,当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH 的物质的量由大到小的顺序是b>a=c;②硫酸和盐酸为强酸,完全电离,醋酸为弱 酸,只发生了部分的电离,当三者c(H+)相同且体积也相同时,说明醋酸的浓度远 远大于硫酸和盐酸,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序 是c>a=b;③当三者c(H+)相同、体积相同时,若产生相同体积的H2(相同状 况),由于开始时c(H+)相同,则开始时反应速率的大小关系为a=b=c。
1
2
3
4
5
6
7
8
9
10
11
12
(3)将0.1 mol/L的CH3COOH溶液加水稀释,下列有关稀释后CH3COOH溶液的说法 正确的是 (填字母)。
A. 电离程度增大
B. 溶液中离子总数增多
C. 溶液导电能力增强
D. 溶液中醋酸分子增多
AB
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
12. 在一定温度下,对冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积 V变化的曲线如图所示。
请回答下列问题:
(1)a、b、c三点对应的溶液中,c(H+)由小到大的顺序为 (用a、 b、c表示)。
(2)a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是 (填 “a”“b”或“c”)。
c<a<b
c
1
2
3
4
5
6
7
8
9
10
11
12
(3)若使c点对应的溶液中c(CH3COO-)增大,则下列措施中,可行的 是 (填字母,下同)。
A. 加热
B. 加入NaOH稀溶液
C. 加入K2CO3固体
D. 加水
E. 加入CH3COONa固体
F. 加入锌粒
ACEF
1
2
3
4
5
6
7
8
9
10
11
12
(4)在稀释过程中,随着醋酸浓度的减小,下列始终保持增大趋势的是 。
A. c(H+)
B. n(H+)
C. CH3COOH分子数
BD
1
2
3
4
5
6
7
8
9
10
11
12
